JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생쥐의 6개 뒷다리 근육의 효소 해리로 얻은 온전한 짧은, 중간 및 긴 골격근 섬유: Beyond Flexor Digitorum Brevis
요약
우리는 성인 마우스의 6개 근육에서 다양한 길이와 유형의 효소로 해리된 섬유를 얻기 위한 프로토콜을 설명합니다: 그 중 3개는 이미 설명되었고(flexor digitorum brevis, extensor digitorum longus, soleus) 그 중 3개는 처음으로 성공적으로 해리되었습니다(extensor hallucis longus, peroneus longus, peroneus digiti quarti).
초록
쥐 근육의 효소 해리에 의해 얻어진 골격근 섬유는 생리학적 실험에 유용한 모델이다. 그러나 대부분의 논문은 굴곡근 골곡근(FDB)의 단섬유를 다루고 있는데, 이는 섬유종을 다루는 결과의 범위를 제한하고, 이용 가능한 생물학적 물질의 양을 제한하며, 세포 생리학적 현상과 다른 근육에서 얻은 이전의 생화학적 및 역학적 지식 사이의 명확한 연결을 방해합니다.
이 논문은 서로 다른 섬유 유형 프로파일과 길이를 가진 6개의 근육에서 온전한 섬유를 얻는 방법을 설명합니다. C57BL/6 성체 마우스를 사용하여 근육 해부 및 섬유 분리 프로토콜을 보여주고 Ca2+ 과도 연구 및 형태학적 특성 분석에 대한 섬유의 적합성을 입증합니다. 근육의 섬유 유형 구성도 제시됩니다. 해리되면 모든 근육이 온전하게 되어 24시간 이상 활발하게 수축하는 살아있는 섬유가 됩니다. FDB는 짧은(<1mm), 비골 사중사(PDQA) 및 장비골(PL)은 중간(1-3mm)을 제공하는 반면, 장신근(EDL), 장신근(EHL) 및 가자미근은 긴(3-6mm) 섬유를 방출합니다.
고속 염료 Mag-Fluo-4로 기록했을 때 PDQA, PL 및 EHL 섬유의 Ca2+ 과도 현상은 IIX 및 IIB 섬유에 해당하는 것으로 알려진 형태 유형 II(MT-II)를 연상시키는 빠르고 좁은 동역학을 보여주었습니다. 이것은 이 근육이 FDB(~80%) 및 가자미(~65%)에 비해 90% 이상의 유형 II 섬유를 가지고 있다는 사실과 일치합니다. FDB를 넘어 우리는 처음으로 1mm에서 6mm 사이의 길이 범위에 걸쳐 있는 섬유를 렌더링하는 여러 근육의 해리를 시연합니다. 이러한 섬유는 생존 가능하며 빠른 Ca2+ 과도 현상을 제공하므로 MT-II는 근육 공급원에 관계없이 IIX 및 IIB 고속 섬유로 일반화될 수 있습니다. 이러한 결과는 성숙한 골격근 연구를 위한 모델의 가용성을 높입니다.
서문
포유류의 성숙한 골격근은 다기능 조직입니다. 그것은 신진 대사를 심하게 조절하고 열 생산의 주요 원천이며 동적 특성은 호흡, 신체 부분의 움직임 또는 한 지점에서 다른 지점으로의 변위에 중요한 역할을 부여합니다 1,2,3. 골격근은 또한 근육병증, 이영양증 또는 근감소증과 같은 유전 및 만성 질환뿐만 아니라 심장 대사 질환과 같은 많은 비근육 만성 질환을 포함한 많은 질병의 병태생리학과 관련이 있습니다 3,4,5,6,7,8.
건강과 질병의 맥락에서 성숙한 골격근의 구조적 및 기능적 특성에 대한 생체 외 연구는 주로 전체 근육과 분리 섬유의 두 가지 실험 모델을 통해 가능했습니다. 20세기에 연구자들은 다양한 작은 종의 온전한 장신근(EDL), 가자미근, 전경골 및 비복근 전체의 특성을 중추적인 모델로 활용하여 운동 단위, 섬유 유형, 수축 및 이완의 힘 및 운동과 같은 동적 특성에 대해 학습했습니다 9,10,11,12,13,14,15,16. 그러나 보다 정교한 세포 생물학 연구의 출현으로 이 분야는 단일 근육 섬유 연구로 이동했습니다. 선구적인 연구는 후속 특성 분석을 위한 효소 해리를 통해 쥐의 온전한 굴곡근 디지토룸 브레비스(FDB) 섬유를 분리할 수 있게 했습니다 17,18,19. FDB 섬유는 수동 해부에 의해서도 얻어질 수 있지만(20), 쥐 근육의 효소 해리의 용이성과 높은 처리량은 다양한 실험적 접근법에 대한 적합성 외에도 후자의 모델을 지난20년 동안 널리 사용하게 만들었다.
짧은 FDB 섬유는 전기 생리학 및 기타 생물 물리학 연구, 생화학, 대사 및 약리학 분석, 전자 및 형광 현미경 실험, 세포 생물학 접근법을 위한 형질 주입 또는 근육 형성 연구 5,21,22,23,24,25,26,27,28 에서 줄기 세포의 공급원으로 적합합니다. 29,30,31,32입니다. 그러나 근육 실험에서 FDB 섬유만 사용하면 섬유 유형을 다루는 연구 범위가 좁아지고 일부 방법론적 기술이나 한 동물로부터 더 많은 정보를 얻는 데 사용할 수 있는 생물학적 물질의 양이 제한됩니다. 이러한 한계는 세포 생리학적 현상과 다른 온전한 근육(예: EDL, 가자미, 페로네이)에서 수행된 이전의 생화학 및 역학 연구와의 명확한 상관관계를 방해합니다.
이러한 한계를 극복한 일부 그룹은 더 긴 EDL 및 가자미근 24,33,34,35,36,37,38,39,40을 해리하는 데 성공하여 다른 관련 근육으로 방법을 더욱 확장할 수 있는 문을 열었습니다. 그러나 EDL 및 가자미 섬유의 사용은 여전히 드물며, 이는 온전한 섬유로 얻기 위한 방법론적 세부 사항이 부족하기 때문일 수 있습니다. 여기에서는 6개의 근육에서 길이와 유형이 다른 섬유를 분리하는 방법을 자세히 설명합니다: 그 중 3개는 이미 설명한 근육(FDB, EDL 및 가자미)이고 그 중 3개는 처음으로 성공적으로 해리되었습니다(extensor hallucis longus [EHL], peroneus longus [PL] 및 peroneus digiti quarti [PDQA]). 본 연구의 결과는 효소로 해리된 섬유의 모델이 광범위한 연구 및 이전에 발표된 데이터와의 향후 상관 관계에 적합하다는 것을 확인시켜 성숙한 골격근 연구를 위한 모델의 가용성을 높입니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 절차는 콜롬비아 정부가 발행 한 1989 년 법률 84 및 1993 년 결의안 8430에 따라 안티오키아 대학교 (UdeA) (2016 년 6 월 21일 회의록 104 및 2021 년 4 월 15 일 005 분)의 동물 실험 윤리위원회의 승인을 받았으며 동물 연구에 따라 수행 및보고되었습니다. 생체 내 실험 보고(ARRIVE) 지침41. 여기에 제시된 모든 결과는 건강한 생후 7-13주, 20-26g, C57BL/6 수컷 마우스에서 얻은 것입니다. 그림 1은 이 연구의 일반적인 설계와 절차의 순서를 보여줍니다. 모든 시약, 재료 및 장비 세부 정보는 재료 표에 나열되어 있습니다.
1. 동물
- 온도 조절(21 ± 2°C) 및 빛:어둠(12:12 시간) 주기 조건에서 목재 유래 침구를 사용하여 아크릴, 투명, 직사각형 케이지당 최대 6마리의 마우스를 수용합니다.
- 동물들이 환경적 풍부함 없이 병원균이 없는 특정 동물 시설에서 먹이와 수돗물을 자유롭게 이용할 수 있도록 합니다.
2. 해부
- 용액, 재료 및 시약
- 다음 조성 (mM의 모든 농도)으로 작업 용액을 준비하고 여과 (0.22 μm)하십시오.
- 티로드 : 5.4 KCl, 1 MgCl2, 140 NaCl, 0.33 NaH2PO4, 2 CaCl2, 10 포도당, 10 HEPES, pH 7.3
- 해리 : 2.7 KCl, 1.2 KH2PO4 호, 0.5 MgCl2 호, 138 NaCl, 0.1 Na2HPO4 호, 1 CaCl2 호, pH 7.4
- 인산염 완충 식염수 (PBS) : 137 NaCl, 8.6 Na2HPO4 호, 2.8 KH2PO4 호, pH 7.34
- 두 개의 해부실을 준비하십시오. 입체경; 작동 가위; 가는 가위; 미세 집게; 깨끗하고 투명하며 원뿔형이 아닌 너비 1-1.5cm의 총 부피 3-4mL 유리 바이알(캡 포함). 해부실의 근육을 전기적으로 자극하는 시스템을 마련하십시오.
- 팁 너비가 다른 파이어 폴리싱 된 파스퇴르 유리 피펫 (5, 4, 3, 2 및 1mm)을 준비합니다.
- 수조를 37°C로 설정합니다. 콜라겐 분해 효소 유형 2 3mg의 부분 표본을 계량합니다.
- 다음 조성 (mM의 모든 농도)으로 작업 용액을 준비하고 여과 (0.22 μm)하십시오.
- 절차
- 지역 윤리 위원회에서 승인한 방법을 사용하여 쥐를 희생하십시오. 자궁 경부 탈구는 빠르고 스트레스가 적으며 근육 조직에 영향을 줄 수 있는 약물(예: CO2 또는 일부 마취제)에 대한 노출을 피하기 때문에 권장됩니다. 더 나은 결과를 얻으려면 즉시 해부를 시작하십시오.
- 폼 표면에 마우스를 놓고 앞다리를 테이프로 붙이거나 고정합니다. 수술용 가위로 무릎 위의 양쪽 뒷다리를 자르고 각각을 별도의 해부실로 옮기고 차갑게(10-20°C) Tyrode를 추가하여 조직을 덮습니다.
알림: 각 뒷다리는 FDB, 가자미, EDL, EHL, PL 및 PDQA의 순서로 6개의 다른 근육을 제공합니다. 힘줄에서 힘줄까지 온전한 6개의 근육을 해부하기 위한 상세한 해부학적 참고 문헌은 그림 2 와 다른 곳(42)에 나와 있다. - 다리의 뒤쪽 얼굴이 보이는 위치에서 첫 번째 뒷다리를 해부실에 고정합니다. 확대하여 피부를 제거하십시오. 그런 다음 FDB를 노출하고 제거합니다(그림 2). 1mL의 Tyrode 용액과 함께 라벨이 붙은 유리 바이알 하나에 보관하십시오.
알림: 근육 조직의 원치 않는 절단을 방지하기 위해 적절한 배율과 사전 훈련이 필요합니다. - 가자미를 노출시키고 제거한 후 1mL의 Tyrode가 들어 있는 별도의 바이알에 보관합니다. 그림 2와 같이 가는 가위를 사용하여 먼저 비복근을 분리한 다음 가자미를 제거합니다.
- 다리의 앞쪽을 노출하고 피부를 제거하고 경골 전방의 원위 힘줄과 발목의 EDL 근육을 식별합니다. 경골을 제거하고 버리십시오. 그런 다음 EDL의 원위 힘줄을 자릅니다(그림 2). EDL을 제거할 때까지 해부를 계속하고 1mL의 Tyrode가 들어 있는 별도의 유리 바이알에 넣습니다.
- EDL의 후방과 내측에 있는 EHL 근육을 제거합니다. 그림 2의 해당 패널에 표시된 대로 힘줄을 식별하여 1번째 자리까지 식별하여 해부를 시작합니다. 근육을 1mL의 티로드가 담긴 별도의 유리 바이알에 보관하십시오.
- 비골근의 가장 바깥쪽에 있는 힘줄을 확인하고 추적하여 절제하고 PL 근육을 제거합니다(그림 2). 근육을 1mL의 Tyrode가 들어 있는 별도의 유리 바이알에 넣습니다.
- 힘줄을 식별하고 4번째 자리까지 따라갑니다. 잘라내고 PDQA 근육을 제거합니다(그림 2). 1mL의 Tyrode가 들어 있는 별도의 유리 바이알에 넣습니다.
- 두 번째 뒷다리로 절차를 반복합니다.
- 동일한 유형의 두 근육을 하나의 라벨이 붙은 유리 유리병 또는 Tyrode 용액이 담긴 작은 페트리 접시에 모으십시오.
참고: 작업 세션 중에 두 쌍 이상의 근육을 해부할 계획인 경우 해부 절차를 위해 두 명의 연구원을 모집합니다.
3. 근섬유 분리 프로토콜
- 해부실에서 Tyrode 용액을 갱신하여 파편과 쥐 털을 제거합니다. FDB 근육을 하나의 해부 챔버에 붓고 무결성을 확인한 다음 1mL의 해리 용액이 있는 새 유리 바이알로 옮깁니다. EHL, PL 및 PDQA 근육으로 이 절차를 반복합니다.
알림: 근육이 과도하게 수축되거나 잘린 것처럼 보이거나 전기 자극에 반응하지 않는 경우 다음 프로토콜 단계를 계속하지 마십시오. 대신, 용액의 품질(pH, 오염, 삼투압)을 검증하고 더 많은 해부 기술을 습득하여 해부 프로토콜을 최적화하십시오(그림 1C 및 보충 비디오 S1). - 섬유의 방향에 따라 가자미근과 EDL 근육을 세로 또는 대각선으로 절단합니다(그림 2). 가자미의 경우 중앙 힘줄을 따라 길이의 ~ 80 %를 자릅니다. EDL의 경우 하나 또는 두 개의 힘줄을 따라 가자미와 거의 같은 길이로 자릅니다. 각 쌍의 근육을 1mL의 해리 용액이 담긴 유리 바이알에 넣습니다.
참고: 이 절차는 EDL과 가자미를 더 작게 만들고 콜라겐분해효소가 조직에 더 잘 들어갈 수 있도록 합니다. 충분한 배율(40-50배)과 미세한 가위와 집게는 필수입니다. 해리 프로토콜의 다음 단계를 계속하기 전에 항상 육안 검사와 전기 자극을 통해 샘플 무결성을 확인하십시오. - 콜라겐분해효소 유형 2 3mg(250-300U/mg의 활성)을 1mL의 해리 용액과 한 쌍의 근육이 들어 있는 각 바이알에 추가합니다. 사용된 효소 배치의 활성을 고려하여 콜라겐분해효소의 정확한 양을 표준화합니다.
- 36.8-37 °C에서 65-90분 동안 수조에서 근육 쌍을 부드럽게 흔들어 배양합니다.
알림: 온도 제어에 엄격하십시오. 손상을 방지하기 위해 근육이 콜라겐 분해 효소에 100분 이상 남아 있지 않도록 절차를 표준화합니다. - 배양5분 후 65분마다 입체경 배율로 바이알을 확인합니다. 근육이 약간 물결치고, 울퉁불퉁하고, 느슨해 보이면 바이알을 부드럽게 흔들어 일부 섬유가 쉽게 분리되기 시작하는지 확인합니다. 이 경우 실온에서 Tyrode로 근육을 씻어 콜라겐 분해 효소를 비활성화하고 제거하십시오.
알림: 세척은 피펫으로 근육을 만지지 않고 조심스럽게 수행해야 합니다. 먼저 0.8mL의 Tyrode를 추가한 다음 0.8mL의 용액을 제거합니다. 이 절차를 4-5번 반복하고 용액이 완전히 투명해지는지 확인합니다. - 파이어 폴리싱 처리된 파스퇴르 피펫 세트를 사용하여 Tyrode에서 매우 부드러운 분쇄로 근육의 대부분에서 더 많은 섬유를 분리하십시오. 가장 넓은 피펫(5mm 팁)으로 근육 주위의 용액을 교반하는 것으로 시작한 다음 근육을 피펫 안팎으로 부드럽게 3-4회 당겨 빼냅니다. 근육이 섬유를 방출하기 시작하고 얇아지면 다음 피펫(4mm 팁)으로 절차를 반복합니다.
참고: 이 절차를 통해 렌더링된 섬유는 보충 비디오 S2, 보충 비디오 S3, 보충 비디오 S4 및 보충 비디오 S5에서 PL, EDL, EHL 및 가자미스 섬유를 사용하여 예시된 바와 같이 24시간 이상 여기성 상태를 유지하고 활발하게 수축합니다.
4. 실험 절차
참고: 분리된 섬유는 근질 Ca2+ 농도 추정, 형태 측정 및 미오신 중쇄(MHC) 발현 연구에 사용되었습니다.
- 근질 Ca의 측정2+ 경련 중 집중력
- 실험용 욕실에 깨끗한 유리 슬라이드를 장착합니다. 슬라이드에 2-3μL의 라미닌을 입히고 30초 동안 건조시킨 후 ~400μL의 섬유 현탁액을 슬라이드에 붓습니다. 섬유가 실온에서 10-15분 동안 라미닌에 부착되도록 합니다.
- 실험 챔버를 에피형광을 위한 도립 현미경의 스테이지에 장착합니다(그림 3A).
- 실험 챔버의 양쪽을 따라 배치된 두 개의 백금 전극을 통해 직사각형 전류 펄스(0.8-1.2ms)를 적용하여 섬유의 생존 가능성을 확인하기 위해 단일 경련을 불러일으킵니다. 라미닌에 부착 된 경우에도 섬유의 수축은 주로 극단에서 여전히 볼 수 있습니다.
- 섬유에 3.5-4.5μM의 빠른 Ca2+ 염료 Mag-Fluo-4, AM을 Tyrode 용액에서 4-5분 동안 로드합니다. 이 시간이 지나면 Tyrode로 부드럽게 씻어 세포 외 염료를 제거합니다. 세포 내 염료가 어두운 조건에서 ~15-20분 동안 에스테르 화되지 않도록 합니다. 염료 구획화를 방지하기 위해 항상 온도를 22°C 미만으로 유지하십시오.
알림: 디메틸 설폭사이드(DMSO)에만 Mag-Fluo-4, AM 스톡을 준비하여 로딩 Tyrode 용액에서 DMSO의 최종 농도가 0.5% 미만이 되도록 합니다. - 백색 발광 다이오드(LED)와 여기/이색성/방출을 위한 파장 450-490/510/515nm의 필터 세트로 광섬유를 비춥니다(그림 3A).
참고: 대체 여기원에는 수은 및 크세논 형광 램프가 포함됩니다. 염료의 광표백과 세포 손상을 방지하기 위해 가능한 가장 낮은 강도와 크기의 여기 지점을 사용하십시오. - 20-22 °C에서 실험 챔버의 양쪽을 따라 배치 된 두 개의 백금 전극을 통해 직사각형 전류 펄스 (0.8-1.2ms)를 적용하여 섬유의 Ca2 + 응답 (근질 Ca2 + 과도 현상)을 불러 일으 킵니다.
- 형광에 적합한 오일 이멀젼 40x 장거리 대물렌즈와 디지타이저에 연결된 광전자 증배관(PMT)을 사용하여 광 신호를 수집하고 저장합니다(그림 3A 및 보충 비디오 S6). 수집 소프트웨어에서 0-200 임의 단위(AU)의 스케일을 보장하고 여기 스폿의 크기와 PMT의 게인을 조절하여 실험의 휴지 형광(Frest) 을 해당 스케일에서 10AU로 설정합니다. 절차가 표준화되면 한 실험에서 다른 실험으로 게인을 수정하지 않고 스폿 크기를 약간 조정하여 스케일을 설정합니다.
알림: 움직임 아티팩트가 발생하면 Tyrode 용액에 20-30μM N-벤질-p-톨루엔 설폰아미드(BTS)를 사용하십시오. - 다음과 같이 신호를 분석하고 보정합니다.
- 1kHz에서 전체 트레이스를 저역통과 필터링합니다.
- 트레이스의 1 s에서 Frest 를 계산하고, Frest 를 0으로 조정하고, 피크 근질 Ca2+ 과도 ' 진폭 (F피크)을 측정합니다. 진폭을 방정식 (1)과 같이 제시합니다.
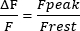 (1)
(1) - 방정식 (2)26 및 다음 매개변수를 사용하여 피크 Ca2+ 농도([Ca2+], μM)를 계산합니다: in situ 해리 상수(Kd) = 1.65 × 105 μM2, 최대 형광(Fmax) 150.9 AU, 최소 형광(Fmin) 0.14 AU, Mag-Fluo-4 농도 [D]T 229.1 μM26. F피크는 4.1.8.2 단계에서 이미 얻어졌습니다.
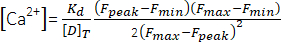 (2)
(2) - 진폭의 10%에서 90%까지의 상승 시간(RT, ms), 절반 최대에서의 지속 시간(HW, ms) 및 진폭의 90%에서 10%까지의 감쇠 시간(DT, ms)을 측정합니다. 그런 다음, 이지수 함수(방정식 3)를 사용한 피팅에 따라 감쇠 역학을 추정합니다.
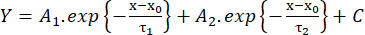 (3)
(3) - 감쇠 시간 상수 τ1 및 τ2 (ms)와 진폭 A1 및 A226의 값을 저장합니다.
- 형태 측정
- 실험용 욕실에 깨끗한 유리 슬라이드를 장착합니다. 슬라이드에 2-3μL의 라미닌을 입히고 30초 동안 건조시킨 후 ~400μL의 섬유 현탁액을 슬라이드에 붓습니다. 섬유가 실온에서 10-15분 동안 라미닌에 부착되도록 합니다.
- 실험 챔버의 양쪽을 따라 배치된 두 개의 백금 전극을 통해 직사각형 전류 펄스(0.8-1.2ms)를 적용하여 섬유의 생존 가능성을 확인하기 위해 단일 경련을 불러일으킵니다. 라미닌에 부착 된 경우에도 섬유의 수축은 주로 극단에서 여전히 볼 수 있습니다.
- 10x 및 20x 대물렌즈와 도립 형광 현미경에 장착된 최소 5메가픽셀의 카메라를 사용하여 살아 있는 섬유의 이미지를 획득합니다. 에 이미지를 저장합니다. 오프라인 분석을 위한 TIFF 형식입니다.
알림: 긴 광섬유를 완전히 캡처하려면 ~2-6개의 이미지 세트가 필요할 수 있습니다. - 현미경 마이크로미터 보정 눈금자를 동일한 배율로 이미지화합니다. 에 이미지를 저장합니다. 오프라인 분석을 위한 TIFF 형식입니다.
- 다음과 같이 이미지 분석을 위한 무료 소프트웨어의 보정 도구를 사용하여 섬유의 길이와 직경을 측정합니다.
- 보충 그림 S1에 표시된 대로 Analyze/Set scale 도구를 사용하여 현미경 마이크로미터 보정 눈금자를 사용하여 이미지에서 픽셀과 알려진 거리(μm) 사이의 관계를 설정합니다.
- 보충 그림 S1과 같이 섬유의 한 끝에서 다른 쪽 끝까지의 길이와 섬유를 따라 2-6개의 다른 위치에서 직경을 한 번 측정합니다(길이에 따라 이미지당 1-2회 측정).
- 길이 값(μm 또는 mm)과 섬유당 측정된 모든 직경의 평균(μm)을 보고합니다.
- Myosin 중쇄 발현 연구
참고: 전체 근육에서 면역형광43 및 소듐 도데실 설페이트-폴리아크릴아미드 겔 전기영동(SDS-PAGE)33,44,45,46에 의한 MHC 측정에 대한 자세한 내용은 보충 파일 1을 참조하십시오. FDB 분리 섬유의 현탁액에서 MHC의 면역형광 측정에 의한 섬유 타이핑을 위한 프로토콜은 다음과 같습니다.- 5 개의 깨끗한 유리 슬라이드 각각에 2-3 μL의 라미닌을 입히고 30 초 동안 건조시킨 후 각 슬라이드에 ~ 300 μL의 섬유 현탁액을 붓습니다. 섬유가 실온에서 4시간 동안 라미닌에 부착되도록 합니다.
- 냉동실에서 냉각된 아세톤으로 실온에서 30분 동안 준비물을 고정합니다.
- PBS로 부드럽게 3번 씻으십시오.
- 실온에서 15분 동안 0.7% Triton X-100이 보충된 PBS로 세포막을 투과시킵니다.
- 0.2% 소 혈청 알부민(BSA)과 0.04% Triton X-100이 보충된 PBS로 3배 부드럽게 씻은 다음 실온에서 30분 동안 2% BSA, 2% 염소 혈청 및 0.4% Triton X-100으로 PBS로 차단합니다.
- 0.2% BSA 및 0.04% Triton X-100이 보충된 PBS로 3배 부드럽게 세척하고 다음과 같이 1차 항체로 배양합니다.
- 각 항-MHC 1차 항체를 1% BSA 및 0.04% Triton X-100: anti-I(1:1,500), anti-II(1:600), anti-IIA(하이브리도마의 전체 조건 배지 사용) 및 anti-IIB(1:500)로 PBS의 별도 바이알에 희석합니다.
- 각 슬라이드를 하나의 항체로 배양하고 나머지 슬라이드를 대조군으로 PBS로 4°C에서 12-16시간 동안 배양합니다.
참고: 이 프로토콜에서 광섬유 유형 IIX는 모든 샘플에서 레이블이 지정되지 않은 상태로 유지되었습니다.
- PBS로 3배 부드럽게 세척하고 실온에서 1-2시간 동안 형광 녹색 분자에 결합된 2차 항체(1:800)로 모든 슬라이드를 배양합니다.
- 1 μg/mL Hoechst로 15분 동안 핵을 염색합니다.
- PBS로 부드럽게 3 번 세척하고 20-40 μL의 장착 매체를 조심스럽게 추가 한 다음 커버 슬립을 놓습니다.
알림: 부드러운 용액 교환 및 세척을 통해 수십 개의 섬유가 슬라이드에 부착된 상태로 유지되어 실험이 통계적으로 건전합니다. - 형광에 적합한 10x 대물렌즈와 여기/이색성/방출을 위한 파장 450-490/510/515nm의 필터 세트를 사용하여 각 슬라이드를 시각화하고 모든 양극 및 음극 섬유를 계산합니다. 또는 동일한 기술 조건과 도립 형광 현미경에 장착된 최소 5메가픽셀의 카메라를 사용하여 형광 이미지를 획득하고 에 저장합니다. 오프라인 분석을 위한 TIFF 형식입니다.
- 데이터베이스에 있는 각 슬라이드의 양극 및 음극 섬유를 기록하고 해당 슬라이드에 있는 총 섬유 수를 기준으로 양수 I, IIA, IIB 및 총 II 섬유의 백분율을 계산합니다. 전체 II 섬유의 백분율에서 IIA+IIB의 합을 빼서 IIX 섬유의 백분율을 계산합니다. 100% 값에서 I+II의 합을 빼서 하이브리드 I/IIA 파이버의 백분율을 추정합니다. 마지막으로, 순수한 유형 I 및 II 섬유를 갖기 위해 I 및 II의 합계에서 하이브리드 셀의 백분율을 뺍니다.
참고 : MHC 조성 연구에서 섬유 유형은 대문자로 지정되고 동형은 소문자46으로 지정됩니다.
- 헤마톡실린 및 에오신 염색
- 깨끗한 유리 슬라이드에 2-3μL의 라미닌을 입히고 30초 동안 건조시킨 후 ~300μL의 섬유 현탁액을 슬라이드에 붓습니다. 섬유가 실온에서 4시간 동안 라미닌에 부착되도록 합니다.
- Carnoy의 해결책 (60 % 절대 에탄올, 30 % 클로로포름, 10 % 아세트산)으로 실온에서 5 분 동안 준비물을 고정하십시오.
- 헤마톡실린으로 90초 동안 배양합니다.
- 수돗물로 3회 부드럽게 씻으십시오.
- 70 % 에탄올에서 제조 된 1 % eosin Y로 30 초 동안 배양합니다.
- 수돗물로 3회 부드럽게 씻으십시오.
- 절대 에탄올에 3x 담그십시오.
- 자일롤에서 60초 동안 배양합니다.
- 20-40 μL의 장착 매체를 추가하고 기존 현미경으로 시각화합니다. 최소 5메가픽셀의 컬러 카메라를 사용하여 원하는 배율로 이미지를 획득합니다.
5. 통계 분석 및 그래프 작성
참고: 실험 단위는 근육 섬유입니다.
- 결과를 평균 ± 표준 편차로 표현하고 일부 분석의 경우 신뢰 구간 95%(CI95%)를 계산합니다.
- 그룹 간 길이, 직경 및 Ca2+ 과도 역학을 비교하려면 Bonferroni의 보정을 사용하여 분산 분석(ANOVA) 및 사후 검정을 수행합니다.
- 각각 Shapiro-Wilk 검정과 Levene의 검정을 사용하여 정규성과 분산 동일성을 평가합니다.
- p가 0.05일 때 유의< 차이를 고려하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
경련 중 Sarcoplasmic Ca2+ 농도
해리된 섬유 세트에서 생리학적 실험의 타당성을 입증하고 여기-수축 결합(ECC) 및 섬유 유형에 대한 이전 결과를 확장하기 위해 모든 근육의 섬유에서 Ca2+ 과도 현상을 획득했습니다. 먼저, FDB(n=5) 및 EDL(n=7)은 형태형 II(MT-II)로 알려진Ca2+ 동역학을 나타냈다. 이들은 RT가 ~ 1ms 동안 지속되는 빠르고 뾰족한 신호입니다. 붕괴 단계는 ?...
Access restricted. Please log in or start a trial to view this content.
토론
성숙한 골격근 생물학을 연구하는 데 사용할 수 있는 모델을 보완하기 위해 여기서는 단섬유, 중섬유, 장섬유를 가진 다양한 쥐 근육의 성공적인 효소 해리를 보여줍니다. 이 섬유는 골격근에서 Ca2+ 과도 현상의 MT-II 동역학의 일반화 가능성을 입증할 수 있습니다. 또한, 온전한 전체 근육의 섬유 유형을 분류했습니다. FDB가 생리학적 실험에 가장 많이 사용되는 근육이라는 점을 감안할 때,...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
저자들은 동물과 사진에 도움을 준 UdeA의 Robinson Ramírez 교수와 기술 지원을 해준 Carolina Palacios에게 감사를 표합니다. Kaika의 Johan Pineda는 컬러 및 형광 카메라를 설치하는 데 도움을 주었습니다. 퀸즐랜드 대학교(University of Queensland)의 슈위안 응오(Shyuan Ngo)가 친절하게 원고를 교정해 주었습니다. 이 연구는 CODI-UdeA(2021년 2월 22일부터 2020-34909, 2022년 3월 31일부터 2021-40170, SIU) 및 콜롬비아 메데인에 있는 Planning Office-UdeA(E01708-K 및 ES03180101)의 자금 지원을 받았습니다. 자금 제공자는 데이터 수집 및 분석, 원고 작성 또는 제출에 참여하지 않았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
참고문헌
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260(2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14(2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939(2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898(2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976(2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118(2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199(2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807(2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074(2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961(2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669(2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796(2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654(2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126(2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075(2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유