È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Fibre muscolari scheletriche corte, intermedie e lunghe intatte ottenute dalla dissociazione enzimatica di sei muscoli degli arti posteriori di topi: oltre il flessore breve delle dita
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un protocollo per ottenere fibre enzimaticamente dissociate di diverse lunghezze e tipologie da sei muscoli di topi adulti: tre di essi già descritti (flessore breve delle dita, estensore lungo delle dita, soleo) e tre di essi dissociati con successo per la prima volta (estensore lungo dell'alluce, peroneo lungo, peroneo delle dita quarti).
Abstract
Le fibre muscolari scheletriche ottenute dalla dissociazione enzimatica dei muscoli del topo sono un modello utile per esperimenti fisiologici. Tuttavia, la maggior parte degli articoli si occupa delle fibre corte del flessore breve delle dita (FDB), il che limita la portata dei risultati relativi ai tipi di fibre, limita la quantità di materiale biologico disponibile e impedisce una chiara connessione tra i fenomeni fisiologici cellulari e le precedenti conoscenze biochimiche e dinamiche ottenute in altri muscoli.
Questo articolo descrive come ottenere fibre intatte da sei muscoli con diversi profili e lunghezze di tipo di fibra. Utilizzando topi adulti C57BL/6, mostriamo il protocollo di dissezione muscolare e isolamento delle fibre e dimostriamo l'idoneità delle fibre per studi transitori di Ca2+ e la loro caratterizzazione morfometrica. Viene anche presentata la composizione del tipo di fibra dei muscoli. Quando sono stati dissociati, tutti i muscoli sono diventati intatti, fibre vive che si contraggono rapidamente per più di 24 ore. FDB ha dato fibre corte (<1 mm), peroneo dita quarti (PDQA) e peroneo lungo (PL) intermedio (1-3 mm), mentre estensore lungo delle dita (EDL), estensore lungo dell'alluce (EHL) e muscolo soleo hanno rilasciato fibre lunghe (3-6 mm).
Quando sono stati registrati con il colorante veloce Mag-Fluo-4, i transienti di Ca2+ delle fibre PDQA, PL ed EHL hanno mostrato una cinetica veloce e stretta che ricorda la morfologia di tipo II (MT-II), nota per corrispondere alle fibre di tipo IIX e IIB. Ciò è coerente con il fatto che questi muscoli hanno oltre il 90% di fibre di tipo II rispetto a FDB (~80%) e soleo (~65%). Andando oltre l'FDB, dimostriamo per la prima volta la dissociazione di diversi muscoli, che rendono le fibre che coprono una gamma di lunghezze comprese tra 1 e 6 mm. Queste fibre sono vitali e danno transienti veloci di Ca2+ , indicando che l'MT-II può essere generalizzato alle fibre veloci IIX e IIB, indipendentemente dalla loro fonte muscolare. Questi risultati aumentano la disponibilità di modelli per gli studi sul muscolo scheletrico maturo.
Introduzione
Il muscolo scheletrico maturo dei mammiferi è un tessuto multifunzionale. Regola pesantemente il metabolismo, è la principale fonte di produzione di calore e le sue proprietà dinamiche gli conferiscono un ruolo chiave nella respirazione, nel movimento dei segmenti corporei o nello spostamento da un punto all'altro 1,2,3. Il muscolo scheletrico è anche rilevante per la fisiopatologia di molte malattie, comprese le condizioni ereditarie e croniche, come miopatie, distrofie o sarcopenia, nonché molte condizioni croniche non muscolari, come le malattie cardiometaboliche 3,4,5,6,7,8.
Lo studio ex vivo delle proprietà strutturali e funzionali del muscolo scheletrico maturo in un contesto di salute e malattia è stato possibile principalmente attraverso due modelli sperimentali: il muscolo intero e le fibre isolate. Nel 20° secolo, i ricercatori hanno sfruttato le proprietà dell'intero muscolo estensore lungo delle dita (EDL), del soleo, del tibiale anteriore e del gastrocnemio di diverse piccole specie come modelli cardine per conoscere le unità motorie, i tipi di fibre e le proprietà dinamiche come la forza e la cinetica di contrazione e rilassamento 9,10,11,12,13,14,15,16. Tuttavia, l'avvento di studi di biologia cellulare più raffinati ha spostato l'area verso lo studio delle singole fibre muscolari. Il lavoro pionieristico ha quindi permesso l'isolamento delle fibre flessori brevi delle dita intatte (FDB) dei ratti mediante dissociazione enzimatica per la successiva caratterizzazione 17,18,19. Sebbene le fibre FDB possano essere ottenute anche mediante dissezione manuale20, la facilità e l'elevata produttività della dissociazione enzimatica dei muscoli murini, oltre alla loro idoneità per una varietà di approcci sperimentali, hanno reso quest'ultimo modello ampiamente utilizzato negli ultimi due decenni.
Le fibre corte FDB sono adatte per studi elettrofisiologici e altri studi biofisici, analisi biochimiche, metaboliche e farmacologiche, esperimenti di microscopia elettronica e fluorescenza, trasfezione per approcci di biologia cellulare o come fonte di cellule staminali negli studi di miogenesi 5,21,22,23,24,25,26,27,28, 29,30,31,32. Tuttavia, l'utilizzo di sole fibre FDB negli esperimenti muscolari restringe l'ambito della ricerca che si occupa dei tipi di fibre e limita la quantità di materiale biologico disponibile per alcune tecniche metodologiche o per ottenere maggiori informazioni da un animale. Queste limitazioni ostacolano una chiara correlazione dei fenomeni fisiologici cellulari con precedenti studi biochimici e dinamici eseguiti in diversi muscoli interi, intatti (ad esempio, EDL, soleo, peronei).
Superando queste limitazioni, alcuni gruppi sono riusciti a dissociare i muscoli EDL e soleo più lunghi 24,33,34,35,36,37,38,39,40, aprendo la porta ad un'ulteriore estensione del metodo ad altri muscoli rilevanti. Tuttavia, l'uso di EDL e fibre soleo è ancora scarso, probabilmente a causa della mancanza di dettagli metodologici per ottenerle come fibre intatte. Qui descriviamo in dettaglio come isolare fibre di diverse lunghezze e tipi da sei muscoli: tre di essi già descritti (FDB, EDL e soleo) e tre di essi dissociati con successo per la prima volta (estensore lungo dell'alluce [EHL], peroneo lungo [PL] e peroneo delle dita quarti [PDQA]). I risultati del presente lavoro confermano che il modello di fibre enzimaticamente dissociate è adatto per un'ampia gamma di studi e future correlazioni con dati precedentemente pubblicati, aumentando così la disponibilità di modelli per studi sul muscolo scheletrico maturo.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure sono state approvate dal Comitato per l'Etica negli Esperimenti con gli animali dell'Università di Antioquia (UdeA) (verbali 104 del 21 giugno 2016 e 005 del 15 aprile 2021), secondo la Legge 84 del 1989 e la Risoluzione 8430 del 1993 emesse dal Governo Colombiano e sono state eseguite e riportate in conformità con la Ricerca Animale: Linee guida per la segnalazione degli esperimenti in vivo (ARRIVE)41. Tutti i risultati qui presentati provengono da topi maschi sani, di 7-13 settimane, di 20-26 g, C57BL/6. La figura 1 mostra il disegno generale di questo studio e l'ordine delle procedure. Tutti i reagenti, i materiali e i dettagli delle apparecchiature sono elencati nella Tabella dei materiali.
1. Animali
- Ospita un massimo di sei topi per gabbia rettangolare in acrilico, trasparente, con lettiera derivata dal legno, in condizioni di temperatura controllata (21 ± 2 °C) e cicli luce:buio (12:12 h).
- Dare agli animali libero accesso al cibo e all'acqua del rubinetto in strutture specifiche per animali prive di agenti patogeni senza alcun arricchimento ambientale.
2. Dissezione
- Soluzioni, materiali e reagenti
- Preparare e filtrare (0,22 μm) le soluzioni di lavoro con la seguente composizione (tutte le concentrazioni in mM):
- Tirodo: 5,4 KCl, 1 MgCl2, 140 NaCl, 0,33 NaH2PO4, 2 CaCl2, 10 glucosio, 10 HEPES, pH 7,3
- Dissociazione: 2,7 KCl, 1,2 KH2PO4, 0,5 MgCl2, 138 NaCl, 0,1 Na2HPO4, 1 CaCl2, pH 7,4
- Soluzione salina tamponata con fosfato (PBS): 137 NaCl, 8,6 Na2HPO4, 2,8 KH2PO4, pH 7,34
- Preparare due camere di dissezione; stereoscopio; forbici operatorie; forbici fini; pinze sottili; e flaconcini di vetro puliti, trasparenti, non conici, larghi 1-1,5 cm, di volume totale di 3-4 mL con tappi. Predisporre un sistema per stimolare elettricamente i muscoli nelle camere di dissezione.
- Preparare pipette in vetro Pasteur lucidate a fuoco con puntali di diversa larghezza: 5, 4, 3, 2 e 1 mm.
- Impostare il bagnomaria a 37 °C. Pesare aliquote di 3 mg di collagenasi di tipo 2.
- Preparare e filtrare (0,22 μm) le soluzioni di lavoro con la seguente composizione (tutte le concentrazioni in mM):
- Procedimento
- Sacrificare il topo utilizzando metodi approvati dal Comitato Etico locale. La lussazione cervicale è consigliata perché è rapida, meno stressante ed evita l'esposizione a farmaci, che possono influenzare il tessuto muscolare (come la CO2 o alcuni anestetici). Iniziare immediatamente la dissezione per ottenere risultati migliori.
- Posiziona il mouse su una superficie di schiuma e fissa o fissa con del nastro adesivo gli arti anteriori. Tagliare entrambi gli arti posteriori sopra le ginocchia con le forbici operatorie, trasferire ciascuno di essi in una camera di dissezione separata e aggiungere Tyrode freddo (10-20 °C) per coprire il tessuto.
NOTA: Ogni arto posteriore darà sei muscoli diversi nel seguente ordine: FDB, soleo, EDL, EHL, PL e PDQA. Riferimenti anatomici dettagliati per sezionare i sei muscoli intatti da tendine a tendine sono forniti nella Figura 2 e altrove42. - Appuntare il primo arto posteriore alla camera di dissezione in una posizione in cui sia visibile la faccia posteriore delle zampe. Rimuovere la pelle sotto ingrandimento; quindi esporre e rimuovere l'FDB (Figura 2). Conservare in un flaconcino di vetro etichettato con 1 mL di soluzione di Tyrode.
NOTA: Sono necessari un ingrandimento appropriato e un allenamento precedente per evitare tagli indesiderati nel tessuto muscolare. - Esponi, rimuovi e conservi il soleo in un flaconcino separato con 1 ml di Tyrode. Utilizzare forbici sottili per separare prima il gastrocnemio e poi per rimuovere il soleo, come indicato nella Figura 2.
- Esporre la faccia anteriore della gamba, rimuovere la pelle e identificare i tendini distali del tibiale anteriore e i muscoli EDL della caviglia. Rimuovere e scartare i tibiali; quindi tagliare i tendini distali dell'EDL (Figura 2). Continuare la dissezione fino a rimuovere l'EDL e metterlo in un flaconcino di vetro separato con 1 mL di Tyrode.
- Rimuovere il muscolo EHL, che si trova appena posteriormente e medialmente all'EDL. Iniziare la dissezione identificando e seguendo il tendine fino al 1° dito, come indicato nel pannello corrispondente della Figura 2. Conservare il muscolo in un flaconcino di vetro separato con 1 ml di Tyrode.
- Identificare e seguire il tendine più esterno dei peronei per tagliarlo e rimuovere il muscolo PL (Figura 2). Mettere il muscolo in una fiala di vetro separata con 1 ml di Tyrode.
- Identificare e seguire il tendine fino alla4a cifra; tagliarlo e rimuovere il muscolo PDQA (Figura 2). Metterlo in un flaconcino di vetro separato con 1 ml di Tyrode.
- Ripetere la procedura con il secondo arto posteriore.
- Riunire entrambi i muscoli dello stesso tipo in una fiala di vetro etichettata o in una piccola capsula di Petri con la soluzione di Tyrode.
NOTA: Se si prevede di sezionare più di due paia di muscoli durante una sessione di lavoro, reclutare due ricercatori per la procedura di dissezione.
3. Protocollo di isolamento delle fibre muscolari
- Rinnovare la soluzione di Tyrode nelle camere di dissezione per rimuovere i detriti e il pelo di topo. Versare i muscoli FDB in una camera di dissezione, verificarne l'integrità e trasferirli in una nuova fiala di vetro con 1 mL di soluzione di dissociazione. Ripeti questa procedura con i muscoli EHL, PL e PDQA.
NOTA: Se un muscolo sembra ipercontratto, tagliato o non risponde alla stimolazione elettrica, non continuare con la fase successiva del protocollo. Piuttosto, ottimizzare il protocollo di dissezione verificando la qualità delle soluzioni (pH, contaminazione, osmolarità) e acquisendo maggiori competenze di dissezione (Figura 1C e video supplementare S1). - Eseguire tagli longitudinali o diagonali ai muscoli soleo e EDL, seguendo l'orientamento delle fibre (Figura 2). Per il soleo, seguire il tendine centrale, tagliando ~80% della sua lunghezza. Per l'EDL, basta seguire uno o due tendini e tagliare all'incirca la stessa lunghezza del soleo. Mettere ogni paio di muscoli in fiale di vetro con 1 mL di soluzione di dissociazione.
NOTA: Questa procedura rende l'EDL e il soleo più piccoli e consente alla collagenasi di entrare meglio nel tessuto. Sono obbligatori un ingrandimento sufficiente (40-50x), oltre a forbici e pinze sottili. Controllare sempre l'integrità del campione mediante ispezione visiva e stimolazione elettrica prima di passare alla fase successiva del protocollo di dissociazione. - Aggiungere 3 mg di collagenasi di tipo 2 (con un'attività di 250-300 U/mg) a ciascun flaconcino contenente 1 mL di soluzione di dissociazione e un paio di muscoli. Standardizzare l'esatta quantità di collagenasi considerando l'attività del lotto enzimatico utilizzato.
- Incubare le coppie di muscoli a bagnomaria per 65-90 minuti a 36,8-37 °C, agitando delicatamente.
NOTA: Essere rigorosi con il controllo della temperatura. Standardizzare la procedura in modo che i muscoli non rimangano in collagenasi per più di 100 minuti per evitare danni. - Controllare i flaconcini sotto l'ingrandimento dello stereoscopio ogni 5 minuti dopo il 65° minuto di incubazione. Quando i muscoli appaiono leggermente increspati, sfilacciati e allentati, agitare delicatamente la fiala e verificare se alcune fibre iniziano a staccarsi rapidamente. In questo caso, lavare i muscoli con Tyrode a temperatura ambiente per inattivare e rimuovere la collagenasi.
NOTA: Il lavaggio deve essere eseguito con cura, senza toccare i muscoli con le pipette. Iniziare aggiungendo 0,8 mL di Tyrode e poi rimuovere 0,8 mL della soluzione. Ripetere questa procedura 4-5 volte e verificare che la soluzione diventi completamente trasparente. - Separa più fibre dalla maggior parte dei muscoli con una triturazione molto delicata in Tyrode con l'aiuto del set di pipette Pasteur lucidate a fuoco. Iniziare agitando la soluzione intorno al muscolo con la pipetta più larga (punta da 5 mm) e poi tirare delicatamente i muscoli dentro e fuori dalla pipetta 3-4 volte. Quando il muscolo inizia a rilasciare fibre e diventa più sottile, ripetere la procedura con la pipetta successiva (punta da 4 mm).
NOTA: le fibre renderizzate tramite questa procedura rimangono eccitabili e si contraggono rapidamente per più di 24 ore, come esemplificato utilizzando le fibre PL, EDL, EHL e soleo in Supplemental Video S2, Supplemental Video S3, Supplemental Video S4 e Supplemental Video S5.
4. Procedure sperimentali
NOTA: Le fibre isolate sono state utilizzate per le stime della concentrazione di Ca2+ sarcoplasmatica, le misurazioni morfometriche e gli studi di espressione della catena pesante della miosina (MHC).
- Misura del Ca sarcoplasmatico2+ Concentrazione durante una contrazione
- Montare un vetrino pulito sulla camera del bagno sperimentale. Rivestire il vetrino con 2-3 μL di laminina e lasciarlo asciugare per 30 secondi prima di versare ~400 μL di sospensione in fibra sul vetrino. Lasciare che le fibre aderiscano alla laminina per 10-15 minuti a temperatura ambiente.
- Montare la camera sperimentale sul tavolino di un microscopio invertito dotato di epifluorescenza (Figura 3A).
- Evocare singole contrazioni per verificare la vitalità delle fibre applicando impulsi di corrente rettangolari (0,8-1,2 ms) attraverso i due elettrodi di platino posti lungo entrambi i lati della camera sperimentale. Anche quando è attaccata alla laminina, la contrazione delle fibre è ancora visibile principalmente agli estremi.
- Caricare le fibre con 3,5-4,5 μM del colorante rapido Ca2+ Mag-Fluo-4, AM per 4-5 minuti in soluzione di Tyrode. Trascorso questo tempo, lavare delicatamente con Tyrode per rimuovere il colorante extracellulare. Lasciare che il colorante intracellulare sia deesterificato per ~15-20 minuti in condizioni di oscurità. Mantenere sempre la temperatura al di sotto dei 22 °C per evitare la compartimentazione del colorante.
NOTA: Preparare una scorta di Mag-Fluo-4, AM solo in dimetilsolfossido (DMSO), in modo che la concentrazione finale di DMSO nella soluzione di Tyrode di carico sia inferiore allo 0,5%. - Illuminare la fibra con un diodo a emissione di luce bianca (LED) e un set di filtri con le seguenti lunghezze d'onda per eccitazione/dicroica/emissione: 450-490/510/515 nm (Figura 3A).
NOTA: Fonti alternative di eccitazione includono lampade a fluorescenza al mercurio e allo xeno. Utilizzare l'intensità e la dimensione più basse possibili del punto di eccitazione per evitare il fotosbiancamento del colorante e danni alla cellula. - Evocare la risposta Ca2+ della fibra (transitori sarcoplasmatici Ca2+ ) applicando impulsi di corrente rettangolari (0,8-1,2 ms) attraverso i due elettrodi di platino posti lungo entrambi i lati della camera sperimentale a 20-22 °C.
- Raccogli e salva i segnali luminosi con un obiettivo a lunga distanza 40x a immersione in olio adatto alla fluorescenza e un tubo fotomoltiplicatore (PMT) collegato a un digitalizzatore (Figura 3A e video supplementare S6). Garantire una scala nel software di acquisizione di 0-200 unità arbitrarie (AU) e impostare la fluorescenza a riposo (riposo F) dell'esperimento a 10 UA su quella scala modulando la dimensione del punto di eccitazione e il guadagno del PMT. Una volta che la procedura è standardizzata, mantieni il guadagno invariato da un esperimento all'altro e imposta la scala solo attraverso piccoli aggiustamenti nella dimensione dello spot.
NOTA: In caso di artefatti da movimento, utilizzare 20-30 μM di N-benzil-p-toluene sulfonamide (BTS) nella soluzione di Tyrode. - Analizzare e calibrare i segnali come segue:
- Filtro passa-basso dell'intera traccia a 1 kHz.
- Calcolare il riposo F in 1 s della traccia, regolare il riposo F a 0 e misurare l'ampiezza dei transienti sarcoplasmatici Ca2+ (picco F). Presentare l'ampiezza come nell'equazione (1):
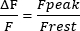 (1)
(1) - Calcolare la concentrazione di picco di Ca2+ ([Ca2+], μM) utilizzando l'equazione (2)26 e i seguenti parametri: costante di dissociazione in situ (Kd) = 1,65 × 105 μM2, fluorescenza massima (Fmax) di 150,9 UA, fluorescenza minima (Fmin) di 0,14 UA, concentrazione di Mag-Fluo-4 [D]T di 229,1 μM26. Ilpicco F è già stato ottenuto al punto 4.1.8.2.
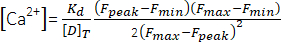 (2)
(2) - Misurare il tempo di salita dal 10% al 90% dell'ampiezza (RT, ms), la durata a metà massimo (HW, ms) e il tempo di decadimento dal 90% al 10% dell'ampiezza (DT, ms). Quindi, stimare la cinetica di decadimento secondo un fit con la funzione biesponenziale (equazione 3):
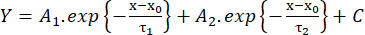 (3)
(3) - Salvare i valori delle costanti di tempo di decadimento τ1 e τ2 (ms) e delle ampiezze A1 e A226.
- Misure morfometriche
- Montare un vetrino pulito sulla camera del bagno sperimentale. Rivestire il vetrino con 2-3 μL di laminina e lasciarlo asciugare per 30 secondi prima di versare ~400 μL di sospensione in fibra sul vetrino. Lasciare che le fibre aderiscano alla laminina per 10-15 minuti a temperatura ambiente.
- Evocare singole contrazioni per verificare la vitalità delle fibre applicando impulsi di corrente rettangolari (0,8-1,2 ms) attraverso i due elettrodi di platino posti lungo entrambi i lati della camera sperimentale. Anche quando è attaccata alla laminina, la contrazione delle fibre è ancora visibile principalmente agli estremi.
- Acquisire immagini delle fibre vive utilizzando obiettivi 10x e 20x e una fotocamera di almeno 5 megapixel montata su un microscopio a fluorescenza invertita. Memorizzate le immagini in formato . Formato TIFF per le analisi offline.
NOTA: Potrebbe essere necessario un set di ~2-6 immagini per catturare completamente una fibra lunga. - Visualizzare l'immagine di un righello di calibrazione micrometrica del microscopio con lo stesso ingrandimento. Memorizzate le immagini in formato . Formato TIFF per le analisi offline.
- Misurare le lunghezze e i diametri delle fibre utilizzando lo strumento di calibrazione del software gratuito per l'analisi delle immagini come segue:
- Stabilire una relazione tra i pixel e la distanza nota (μm) nelle immagini con l'aiuto del righello di calibrazione del micrometro del microscopio utilizzando lo strumento Analizza/Imposta scala come mostrato nella Figura supplementare S1.
- Misurare una volta le lunghezze da una punta all'altra della fibra e i diametri in 2-6 punti diversi lungo la fibra (1-2 misurazioni per immagine, a seconda della sua lunghezza), come nella Figura supplementare S1.
- Riportare il valore della lunghezza (μm o mm) e la media di tutti i diametri (μm) misurati per fibra.
- Studi sull'espressione delle catene pesanti della miosina
NOTA: Per i dettagli sulla determinazione dell'MHC mediante immunofluorescenza43 ed elettroforesi su gel di sodio dodecil solfato-poliacrilammide (SDS-PAGE)33,44,45,46 nei muscoli interi, vedere il file supplementare 1. Il protocollo per la tipizzazione delle fibre mediante determinazione in immunofluorescenza dell'MHC nella sospensione di fibre isolate da FDB è il seguente:- Rivestire ciascuno dei cinque vetrini puliti con 2-3 μL di laminina e lasciarlo asciugare per 30 secondi prima di versare ~300 μL di sospensione in fibra su ciascun vetrino. Lasciare che le fibre aderiscano alla laminina per 4 ore a temperatura ambiente.
- Fissare le preparazioni con acetone raffreddato a congelatore per 30 minuti a temperatura ambiente.
- Lavare delicatamente 3 volte con PBS.
- Permeabilizzare le membrane cellulari con PBS integrato con Triton X-100 allo 0,7% per 15 minuti a temperatura ambiente.
- Lavare delicatamente 3 volte con PBS integrato con albumina sierica bovina (BSA) allo 0,2% e Triton X-100 allo 0,04%, quindi bloccare con PBS con BSA al 2%, siero di capra al 2% e Triton X-100 allo 0,4% per 30 minuti a temperatura ambiente.
- Lavare delicatamente 3 volte con PBS integrato con lo 0,2% di BSA e lo 0,04% di Triton X-100 e incubare con gli anticorpi primari come segue:
- Diluire ciascun anticorpo primario anti-MHC in un flaconcino separato in PBS con l'1% di BSA e lo 0,04% di Triton X-100: anti-I (1:1.500), anti-II (1:600), anti-IIA (utilizzare l'intero terreno condizionato dell'ibridoma) e anti-IIB (1:500).
- Incubare ogni vetrino con un anticorpo e il vetrino rimanente con PBS come controllo per 12-16 ore a 4 °C.
NOTA: In questo protocollo, le fibre di tipo IIX sono rimaste non marcate in tutti i campioni.
- Lavare delicatamente 3 volte con PBS e incubare tutti i vetrini con l'anticorpo secondario (1:800) accoppiato a una molecola verde fluorescente per 1-2 ore a temperatura ambiente.
- Colorare i nuclei con 1 μg/mL di Hoechst per 15 min.
- Lavare delicatamente 3 volte con PBS, aggiungere con cura 20-40 μL di mezzo di montaggio e posizionare un vetrino coprioggetti.
NOTA: Scambi di soluzione delicati e lavaggi assicurano che dozzine di fibre rimangano attaccate al vetrino, rendendo l'esperimento statisticamente valido. - Visualizzare ogni vetrino utilizzando un obiettivo 10x adatto alla fluorescenza e un set di filtri con le seguenti lunghezze d'onda per eccitazione/dicroica/emissione: 450-490/510/515 nm e contare tutte le fibre positive e negative. In alternativa, acquisire immagini a fluorescenza utilizzando le stesse condizioni tecniche e una fotocamera di almeno 5 megapixel montata su un microscopio a fluorescenza invertita e memorizzarle in . Formato TIFF per le analisi offline.
- Registrare le fibre positive e negative di ciascun vetrino in un database e calcolare le percentuali di fibre positive I, IIA, IIB e II totali in base al numero totale di fibre presenti nel vetrino corrispondente. Calcola la percentuale di fibre IIX sottraendo la somma di IIA+IIB dalla percentuale di fibre II totali. Stimare la percentuale di fibre ibride I/IIA sottraendo la somma di I+II da un valore del 100%. Infine, sottrai la percentuale di celle ibride dal totale di I e II per avere le fibre pure di tipo I e II.
NOTA: Negli studi di composizione MHC, i tipi di fibre sono designati da una lettera maiuscola mentre le isoforme sono designate da una lettera minuscola46.
- Colorazione con ematossilina ed eosina
- Rivestire un vetrino pulito con 2-3 μL di laminina e lasciarlo asciugare per 30 secondi prima di versare ~300 μL di sospensione in fibra sul vetrino. Lasciare che le fibre aderiscano alla laminina per 4 ore a temperatura ambiente.
- Fissare il preparato con la soluzione di Carnoy (60% etanolo assoluto, 30% cloroformio, 10% acido acetico) per 5 minuti a temperatura ambiente.
- Incubare con ematossilina per 90 s.
- Lavare delicatamente 3 volte con acqua di rubinetto.
- Incubare con l'1% di eosina Y preparata in etanolo al 70% per 30 s.
- Lavare delicatamente 3 volte con acqua di rubinetto.
- Immergere 3 volte nell'etanolo assoluto.
- Incubare nello xilolo per 60 s.
- Aggiungere 20-40 μL di mezzo di montaggio e visualizzare con un microscopio convenzionale. Acquisire immagini all'ingrandimento desiderato utilizzando una fotocamera a colori di almeno 5 megapixel.
5. Analisi statistiche e grafici
NOTA: L'unità sperimentale è una fibra muscolare.
- Esprimere i risultati come media ± deviazione standard e calcolare gli intervalli di confidenza al 95% (CI95%) per alcune analisi.
- Per confrontare la lunghezza, il diametro e la cinetica dei transienti Ca2+ tra i gruppi, eseguire l'analisi della varianza (ANOVA) e test post-hoc con la correzione di Bonferroni.
- Valutare la normalità e l'uguaglianza della varianza utilizzando rispettivamente i test di Shapiro-Wilk e Levene.
- Si considerino le differenze significative quando p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Risultati
Concentrazione sarcoplasmatica di Ca2+ durante una contrazione
Per dimostrare la fattibilità di esperimenti fisiologici nell'insieme delle fibre dissociate e per estendere i nostri precedenti risultati sull'accoppiamento eccitazione-contrazione (ECC) e sui tipi di fibre, i transitori di Ca2+ sono stati acquisiti nelle fibre di tutti i muscoli. In primo luogo, FDB (n = 5) e EDL (n = 7) hanno mostrato una cinetica di Ca2+ nota come morfologia di tipo II (MT-II). Si trat...
Access restricted. Please log in or start a trial to view this content.
Discussione
A complemento dei modelli disponibili per lo studio della biologia del muscolo scheletrico maturo, qui dimostriamo la dissociazione enzimatica di successo di una serie di muscoli di topo con fibre corte, intermedie e lunghe. Queste fibre permettono di dimostrare la generalizzabilità della cinetica MT-II dei transienti Ca2+ nel muscolo scheletrico. Inoltre, sono stati classificati i tipi di fibre nei muscoli intatti e interi. Dato che l'FDB è il muscolo più utilizzato per gli esperimenti fisiologici, sono st...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Gli autori esprimono la loro gratitudine al professor Robinson Ramírez di UdeA per l'aiuto con gli animali e alcune foto e a Carolina Palacios per il supporto tecnico. Johan Pineda di Kaika ci ha aiutato a configurare le telecamere a colori e a fluorescenza. Shyuan Ngo, dell'Università del Queensland, ha gentilmente corretto il manoscritto. Questo studio è stato finanziato dal CODI-UdeA (2020-34909 dal 22 febbraio 2021 e 2021-40170 dal 31 marzo 2022, SIU) e dall'Ufficio dipianificazione-UdeA (E01708-K e ES03180101), Medellín, Colombia, al JCC. I finanziatori non hanno partecipato alla raccolta e all'analisi dei dati, alla stesura o alla presentazione dei manoscritti.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
Riferimenti
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260(2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14(2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939(2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898(2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976(2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118(2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199(2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807(2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074(2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961(2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669(2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796(2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654(2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126(2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075(2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon