Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerin Altı Arka Bacak Kasının Enzimatik Ayrışmasıyla Elde Edilen Sağlam Kısa, Orta ve Uzun İskelet Kası Lifleri: Fleksör Digitorum Brevis'in Ötesinde
Bu Makalede
Özet
Yetişkin farelerin altı kasından farklı uzunluk ve tiplerde enzimatik olarak ayrışmış lifler elde etmek için bir protokol tarif ediyoruz: bunlardan üçü daha önce tarif edildi (fleksör digitorum brevis, ekstansör digitorum longus, soleus) ve üçü ilk kez başarılı bir şekilde ayrıştı (ekstansör hallusis longus, peroneus longus, peroneus digiti quarti).
Özet
Fare kaslarının enzimatik ayrışması ile elde edilen iskelet kası lifleri, fizyolojik deneyler için yararlı bir modeldir. Bununla birlikte, çoğu makale, lif türleri ile ilgili sonuçların kapsamını kısıtlayan, mevcut biyolojik materyal miktarını sınırlayan ve hücresel fizyolojik fenomenler ile diğer kaslarda elde edilen önceki biyokimyasal ve dinamik bilgiler arasında açık bir bağlantıyı engelleyen fleksör digitorum brevis'in (FDB) kısa lifleri ile ilgilidir.
Bu makale, farklı lif tipi profillere ve uzunluklara sahip altı kastan sağlam liflerin nasıl elde edileceğini açıklamaktadır. C57BL/6 yetişkin fareleri kullanarak, kas diseksiyonu ve lif izolasyon protokolünü gösteriyoruz ve liflerin Ca2+ geçici çalışmalar için uygunluğunu ve morfometrik karakterizasyonunu gösteriyoruz. Kasların lif tipi bileşimi de sunulmaktadır. Ayrıştığında, tüm kaslar sağlam, 24 saatten fazla hızlı bir şekilde kasılan canlı lifler haline gelir. FDB kısa (<1 mm), peroneus digiti quarti (PDQA) ve peroneus longus (PL) orta (1-3 mm) verirken, ekstansör digitorum longus (EDL), ekstansör hallusis longus (EHL) ve soleus kasları uzun (3-6 mm) lifleri serbest bıraktı.
Hızlı boya Mag-Fluo-4 ile kaydedildiğinde, PDQA, PL ve EHL liflerinin Ca2+ geçişleri, tip IIX ve IIB liflerine karşılık geldiği bilinen tip II (MT-II) morfolojisini anımsatan hızlı, dar kinetik gösterdi. Bu, bu kasların FDB (~% 80) ve soleus (~% 65) ile karşılaştırıldığında% 90'dan fazla tip II liflere sahip olduğu gerçeğiyle tutarlıdır. FDB'nin ötesine geçerek, ilk kez 1 ila 6 mm arasında değişen uzunluklarda lifler oluşturan birkaç kasın ayrışmasını gösteriyoruz. Bu lifler canlıdır ve hızlı Ca2+ geçişleri verir, bu da MT-II'nin kas kaynaklarından bağımsız olarak IIX ve IIB hızlı liflere genelleştirilebileceğini gösterir. Bu sonuçlar, olgun iskelet kası çalışmaları için modellerin kullanılabilirliğini arttırmaktadır.
Giriş
Memelilerin olgun iskelet kası çok işlevli bir dokudur. Metabolizmayı yoğun bir şekilde düzenler, ısı üretiminin ana kaynağıdır ve dinamik özellikleri ona solunumda, vücut bölümlerinin hareketinde veya bir noktadan diğerine yer değiştirmede önemli bir rol verir 1,2,3. İskelet kası, miyopatiler, distrofiler veya sarkopeni gibi kalıtsal ve kronik durumların yanı sıra kardiyometabolik hastalıklar 3,4,5,6,7,8 gibi birçok kas dışı kronik durum da dahil olmak üzere birçok hastalığın patofizyolojisi ile de ilgilidir.
Sağlık ve hastalık bağlamında olgun iskelet kasının yapısal ve fonksiyonel özelliklerinin ex vivo çalışması, esas olarak iki deneysel model aracılığıyla mümkün olmuştur: tüm kas ve izole lifler. 20. yüzyılda araştırmacılar, motor üniteler, lif tipleri ve kasılma ve gevşeme kuvveti ve kinetiği gibi dinamik özellikler hakkında bilgi edinmek için farklı küçük türlerin bütün, bozulmamış ekstansör digitorum longus (EDL), soleus, tibialis anterior ve gastroknemius kaslarının özelliklerini önemli modeller olarak kullandılar 9,10,11,12,13,14,15,16. Bununla birlikte, daha rafine hücre biyolojisi çalışmalarının ortaya çıkışı, alanı tek kas liflerinin incelenmesine doğru kaydırdı. Öncü çalışma daha sonra sıçanların bozulmamış fleksör digitorum brevis (FDB) liflerinin enzimatik ayrışma yoluyla daha sonraki karakterizasyon için izolasyonunu sağladı 17,18,19. FDB lifleri manuel diseksiyon20 ile de elde edilebilse de, çeşitli deneysel yaklaşımlara uygunluklarına ek olarak, murin kaslarının enzimatik ayrışmasının kolaylığı ve yüksek verimi, ikinci modelin son yirmi yılda yaygın olarak kullanılmasını sağlamıştır.
Kısa FDB lifleri, elektrofizyolojik ve diğer biyofiziksel çalışmalar, biyokimyasal, metabolik ve farmakolojik analizler, elektron ve floresan mikroskobu deneyleri, hücre biyolojisi yaklaşımları için transfeksiyon veya miyogenez çalışmalarında kök hücre kaynağı olarak uygundur 5,21,22,23,24,25,26,27,28, 29,30,31,32. Bununla birlikte, kas deneylerinde sadece FDB liflerinin kullanılması, lif türleriyle ilgili araştırmaların kapsamını daraltır ve bazı metodolojik teknikler veya bir hayvandan daha fazla bilgi edinmek için mevcut biyolojik materyal miktarını sınırlar. Bu sınırlamalar, hücresel fizyolojik fenomenlerin farklı bütün, sağlam kaslarda (örneğin, EDL, soleus, peronei) gerçekleştirilen önceki biyokimyasal ve dinamik çalışmalarla açık bir korelasyonunu engellemektedir.
Bu sınırlamaların üstesinden gelen bazı gruplar, daha uzun EDL ve soleus kaslarını 24,33,34,35,36,37,38,39,40 ayırmayı başardı ve yöntemi diğer ilgili kaslara daha da genişletmek için kapıyı açtı. Bununla birlikte, EDL ve soleus liflerinin kullanımı, muhtemelen onları bozulmamış lifler olarak elde etmek için metodolojik ayrıntıların bulunmamasından dolayı hala azdır. Burada, farklı uzunluk ve tipteki liflerin altı kastan nasıl izole edileceğini ayrıntılı olarak açıklıyoruz: bunlardan üçü daha önce tanımlanmış (FDB, EDL ve soleus) ve üçü ilk kez başarılı bir şekilde ayrıştı (ekstansör hallusis longus [EHL], peroneus longus [PL] ve peroneus digiti quarti [PDQA]). Bu çalışmanın sonuçları, enzimatik olarak ayrışmış liflerin modelinin çok çeşitli çalışmalar ve daha önce yayınlanmış verilerle gelecekteki korelasyonlar için uygun olduğunu ve böylece olgun iskelet kası çalışmaları için modellerin kullanılabilirliğini artırdığını doğrulamaktadır.
Protokol
Tüm prosedürler, Antioquia Üniversitesi (UdeA) Hayvanlarla Deneylerde Etik Komitesi tarafından (21 Haziran 2016 tarihli 104 ve 15 Nisan 2021 tarihli 005 sayılı tutanaklar), Kolombiya Hükümeti tarafından yayınlanan 84 tarihli 84 sayılı Kanun ve 1993 tarihli 8430 sayılı Karara göre onaylandı ve Hayvan Araştırmalarına uygun olarak gerçekleştirildi ve raporlandı: In Vivo Deneylerin Raporlanması (ARRIVE) kılavuzları41. Burada sunulan tüm sonuçlar sağlıklı, 7-13 haftalık, 20-26 g, C57BL/6 erkek farelerden gelmektedir. Şekil 1, bu çalışmanın genel tasarımını ve prosedürlerin sırasını göstermektedir. Tüm reaktifler, malzemeler ve ekipman ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Hayvanlar
- Kontrollü sıcaklık (21 ± 2 °C) ve ışık: karanlık (12:12 saat) döngüleri koşulları altında, ahşap türevli yataklı, akrilik, şeffaf, dikdörtgen kafes başına en fazla altı fare barındırın.
- Hayvanlara, çevresel zenginleştirme olmaksızın belirli patojen içermeyen hayvan tesislerinde yiyecek ve musluk suyuna ücretsiz erişim sağlayın.
2. Diseksiyon
- Çözeltiler, malzemeler ve reaktifler
- Çalışma çözeltilerini aşağıdaki bileşimle hazırlayın ve filtreleyin (0.22 μm) (tüm konsantrasyonlar mM cinsinden):
- Tirol: 5.4 KCl, 1 MgCl2, 140 NaCl, 0.33 NaH2PO4, 2 CaCl2, 10 glikoz, 10 HEPES, pH 7.3
- Ayrışma: 2.7 KCl, 1.2 KH2PO4, 0.5 MgCl2, 138 NaCl, 0.1 Na2HPO4, 1 CaCl2, pH 7.4
- Fosfat tamponlu salin (PBS): 137 NaCl, 8.6Na2HPO4, 2.8 KH2PO4, pH 7.34
- İki diseksiyon odası hazırlayın; stereoskop; ameliyat makası; ince makas; ince forseps; ve temiz, şeffaf, konik olmayan, 1-1.5 cm genişliğinde, kapaklı toplam hacmi 3-4 mL olan cam şişeler. Diseksiyon odalarındaki kasları elektriksel olarak uyarmak için bir sistem düzenleyin.
- Farklı genişlikte uçlara sahip ateşle parlatılmış Pasteur cam pipetler hazırlayın: 5, 4, 3, 2 ve 1 mm.
- Su banyosunu 37 °C'ye ayarlayın. 3 mg kollajenaz tip 2'nin alikotlarını tartın.
- Çalışma çözeltilerini aşağıdaki bileşimle hazırlayın ve filtreleyin (0.22 μm) (tüm konsantrasyonlar mM cinsinden):
- Prosedür
- Yerel Etik Kurul tarafından onaylanan yöntemleri kullanarak fareyi kurban edin. Servikal çıkık, hızlı, daha az stresli olduğu ve kas dokusunu etkileyebilecek ilaçlara (CO2 veya bazı anestezikler gibi) maruz kalmayı önlediği için önerilir. Daha iyi sonuçlar elde etmek için hemen diseksiyona başlayın.
- Fareyi köpük bir yüzeye yerleştirin ve ön ayakları bantlayın veya sabitleyin. Her iki arka ayağı da ameliyat makası ile dizlerin üzerinden kesin, her birini ayrı bir diseksiyon odasına aktarın ve dokuyu kaplamak için soğuk (10-20 °C) Tyrode ekleyin.
NOT: Her arka bacak aşağıdaki sırayla altı farklı kas verecektir: FDB, soleus, EDL, EHL, PL ve PDQA. Tendondan tendona sağlam altı kası incelemek için ayrıntılı anatomik referanslar Şekil 2'de ve başkayerlerde verilmiştir 42. - İlk arka ayağı, bacakların arka yüzünün görülebileceği bir pozisyonda diseksiyon odasına sabitleyin. Cildi büyütme altında çıkarın; ardından FDB'yi açığa çıkarın ve çıkarın (Şekil 2). 1 mL Tyrode çözeltisi ile etiketli bir cam şişede saklayın.
NOT: Kas dokusunda istenmeyen herhangi bir kesiyi önlemek için uygun büyütme ve önceden eğitim gereklidir. - Soleus'u açığa çıkarın, çıkarın ve 1 mL Tyrode ile ayrı bir şişede saklayın. Şekil 2'de gösterildiği gibi, önce gastroknemius'u ayırmak ve ardından soleus'u çıkarmak için ince makas kullanın.
- Bacağın ön yüzünü ortaya çıkarın, cildi çıkarın ve tibialis anteriorunun distal tendonlarını ve ayak bileğindeki EDL kaslarını tanımlayın. Tibialis'i çıkarın ve atın; daha sonra EDL'nin distal tendonlarını kesin (Şekil 2). EDL'yi çıkarana kadar diseksiyona devam edin ve 1 mL Tyrode ile ayrı bir cam şişeye koyun.
- EDL'nin hemen arkasında ve medialinde yer alan EHL kasını çıkarın. Şekil 2'nin ilgili panelinde gösterildiği gibi, tendonu 1. basamağa kadar tanımlayarak ve takip ederek diseksiyona başlayın. Kasları 1 mL Tyrode ile ayrı bir cam şişede saklayın.
- Kesmek ve PL kasını çıkarmak için peronei'nin en dış tendonunu tanımlayın ve takip edin (Şekil 2). Kası 1 mL Tyrode ile ayrı bir cam şişeye yerleştirin.
- Tendonu tanımlayın ve 4. basamağa kadar takip edin; kesin ve PDQA kasını çıkarın (Şekil 2). 1 mL Tyrode ile ayrı bir cam şişeye koyun.
- İşlemi ikinci arka bacak ile tekrarlayın.
- Aynı tipteki her iki kası da etiketli bir cam şişede veya Tyrode solüsyonu içeren küçük bir Petri kabında toplayın.
NOT: Bir çalışma seansı sırasında ikiden fazla kas çiftinin diseke edilmesi planlanıyorsa, diseksiyon prosedürü için iki araştırmacı görevlendirin.
3. Kas lifi izolasyon protokolü
- Kalıntıları ve fare kürkünü temizlemek için diseksiyon odalarındaki Tyrode solüsyonunu yenileyin. FDB kaslarını bir diseksiyon odasına dökün, bütünlüklerini doğrulayın ve 1 mL ayrışma solüsyonu ile yeni bir cam şişeye aktarın. Bu prosedürü EHL, PL ve PDQA kasları ile tekrarlayın.
NOT: Bir kas aşırı kasılmış, kesilmiş görünüyorsa veya elektriksel stimülasyona yanıt vermiyorsa, bir sonraki protokol adımına devam etmeyin. Bunun yerine, solüsyonların kalitesini (pH, kontaminasyon, ozmolarite) doğrulayarak ve daha fazla diseksiyon becerisi kazanarak diseksiyon protokolünü optimize edin (Şekil 1C ve Ek Video S1). - Liflerin oryantasyonunu takip ederek soleus ve EDL kaslarına uzunlamasına veya çapraz kesimler yapın (Şekil 2). Soleus için, uzunluğunun ~% 80'ini keserek merkezi tendonu takip edin. EDL için, sadece bir veya iki tendonu takip edin ve soleus ile aynı uzunlukta kesin. Her bir kas çiftini 1 mL ayrışma solüsyonu ile cam şişelere koyun.
NOT: Bu prosedür EDL ve soleusu küçültür ve kollajenazın dokuya daha iyi girmesini sağlar. Yeterli büyütme (40-50x), ince makas ve forseps zorunludur. Ayrışma protokolünün bir sonraki adımına geçmeden önce her zaman görsel inceleme ve elektriksel stimülasyon ile numune bütünlüğünü kontrol edin. - 1 mL ayrışma çözeltisi ve bir çift kas içeren her şişeye 3 mg kollajenaz tip 2 (250-300 U / mg aktivite ile) ekleyin. Kullanılan enzim partisinin aktivitesini göz önünde bulundurarak tam kollajenaz miktarını standartlaştırın.
- Kas çiftlerini su banyosunda 36.8-37 ° C'de 65-90 dakika hafifçe çalkalayarak inkübe edin.
NOT: Sıcaklık kontrolü konusunda titiz olun. Hasarı önlemek için kasların 100 dakikadan fazla kollajenaz içinde kalmaması için prosedürü standartlaştırın. - İnkübasyonun 65. dakikasından sonra her 5 dakikada bir stereoskop büyütme altındaki şişeleri kontrol edin. Kaslar hafifçe dalgalı, düzensiz ve gevşek göründüğünde, şişeyi hafifçe sallayın ve bazı liflerin kolayca ayrılmaya başlayıp başlamadığını kontrol edin. Bu durumda, kollajenazı etkisiz hale getirmek ve çıkarmak için kasları oda sıcaklığında Tyrode ile yıkayın.
NOT: Yıkama işlemi, pipetlerle kaslara dokunmadan dikkatlice yapılmalıdır. 0.8 mL Tyrode ekleyerek başlayın ve ardından çözeltinin 0.8 mL'sini çıkarın. Bu prosedürü 4-5 kez tekrarlayın ve çözümün tamamen şeffaf hale geldiğini doğrulayın. - Ateşle parlatılmış Pasteur pipet setinin yardımıyla Tyrode'da çok nazik bir öğütme ile kasların büyük kısmından daha fazla lif ayırın. Solüsyonu en geniş pipetle (5 mm uç) kasın etrafında çalkalayarak başlayın ve ardından kasları pipetin 3-4 kez içine ve dışına yavaşça çekin. Kas lifleri serbest bırakmaya başladığında ve inceldiğinde, işlemi bir sonraki pipetle (4 mm uç) tekrarlayın.
NOT: Bu prosedürle işlenen lifler, Ek Video S2, Ek Video S3, Ek Video S4 ve Ek Video S5'te PL, EDL, EHL ve soleus lifleri kullanılarak örneklendiği gibi, 24 saatten fazla bir süre boyunca uyarılabilir ve hızlı bir şekilde büzülür.
4. Deneysel prosedürler
NOT: İzole edilmiş lifler sarkoplazmik Ca2+ konsantrasyon tahminleri, morfometrik ölçümler ve miyozin ağır zincir (MHC) ekspresyon çalışmaları için kullanılmıştır.
- Sarkoplazmik Ca ölçümü2+ seğirme sırasında konsantrasyon
- Deneysel banyo odasına temiz, cam bir slayt monte edin. Slaytı 2-3 μL laminin ile kaplayın ve ~400 μL fiber süspansiyonu slaytın üzerine dökmeden önce 30 saniye kurumasını bekleyin. Liflerin oda sıcaklığında 10-15 dakika laminine yapışmasına izin verin.
- Deney odasını, epifloresan için donatılmış ters çevrilmiş bir mikroskobun sahnesine monte edin (Şekil 3A).
- Deney odasının her iki tarafına yerleştirilmiş iki platin elektrot boyunca dikdörtgen akım darbeleri (0.8-1.2 ms) uygulayarak liflerin canlılığını doğrulamak için tek seğirmeleri uyandırın. Laminine bağlandığında bile, liflerin büzülmesi esas olarak uç noktalarda hala görülebilir.
- Lifleri 3.5-4.5 μM hızlı Ca2+ boya Mag-Fluo-4, ile 4-5 dakika Tyrode çözeltisi içinde yükleyin. Bu sürenin sonunda, hücre dışı boyayı çıkarmak için Tyrode ile hafifçe yıkayın. Hücre içi boyanın karanlık koşullar altında ~ 15-20 dakika boyunca esterden arındırılmasına izin verin. Boya bölümlendirmesini önlemek için sıcaklığı her zaman 22 °C'nin altında tutun.
NOT: Yükleme Tyrode çözeltisindeki nihai DMSO konsantrasyonu %0,5'ten az olacak şekilde, yalnızca dimetil sülfoksit (DMSO) içinde bir Mag-Fluo-4, stoğu hazırlayın. - Fiberi beyaz ışık yayan diyot (LED) ve uyarma/dikroik/emisyon için aşağıdaki dalga boylarına sahip bir filtre seti ile aydınlatın: 450-490/510/515 nm (Şekil 3A).
NOT: Alternatif uyarma kaynakları arasında cıva ve ksenon floresan lambalar bulunur. Boyanın foto ağartılmasını ve hücreye zarar vermesini önlemek için uyarma noktasının mümkün olan en düşük yoğunluğunu ve boyutunu kullanın. - 20-22 ° C'de deney odasının her iki tarafına yerleştirilmiş iki platin elektrot aracılığıyla dikdörtgen akım darbeleri (0.8-1.2 ms) uygulayarak fiberin Ca 2+ tepkisini (sarkoplazmik Ca 2+ geçici maddeler) uyandırın.
- Floresan için uygun yağa daldırma 40x uzun mesafeli objektif ve bir sayısallaştırıcıya bağlı bir fotoçoğaltıcı tüp (PMT) ile ışık sinyallerini toplayın ve kaydedin (Şekil 3A ve Ek Video S6). Edinme yazılımında 0-200 rastgele birimlik (AU) bir ölçek sağlayın ve uyarma noktasının boyutunu ve PMT'nin kazancını modüle ederek deneyin dinlenme floresansını (Fdinlenme) bu ölçekte 10 AU'ya ayarlayın. Prosedür standartlaştırıldıktan sonra, kazancı bir deneyden diğerine değiştirmeden tutun ve ölçeği yalnızca nokta boyutunda küçük ayarlamalar yaparak ayarlayın.
NOT: Hareket artefaktları ortaya çıkarsa, Tyrode çözeltisinde 20-30 μM N-benzil-p-toluen sülfonamid (BTS) kullanın. - Sinyalleri aşağıdaki gibi analiz edin ve kalibre edin:
- Alçak geçiren tüm izi 1 kHz'de filtreler.
- İzin 1 saniyesinde Frestini hesaplayın, Frestini 0'a ayarlayın ve tepe sarkoplazmik Ca2+ geçici genliklerinin genliğini (Ftepe noktası) ölçün. Genliği denklem (1)'deki gibi sunun:
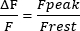 (1)
(1) - Denklem (2)26 ve aşağıdaki parametreleri kullanarak tepe Ca2+ konsantrasyonunu ([Ca2+], μM) hesaplayın: in situ ayrışma sabiti (Kd) = 1,65 × 105 μM2, maksimum floresan (Fmaks) 150,9 AU, minimum floresan (Fmin) 0,14 AU, Mag-Fluo-4 konsantrasyonu [D]T 229,1 μM26. Fzirvesi 4.1.8.2 adımında zaten elde edilmiştir.
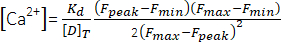 (2)
(2) - Genliğin %10'undan %90'ına (RT, ms) yükselme süresini, maksimumun yarısındaki süreyi (HW, ms) ve genliğin %90'ından %10'una (DT, ms) bozunma süresini ölçün. Ardından, bozunma kinetiğini biüstel fonksiyona uymaya göre tahmin edin (denklem 3):
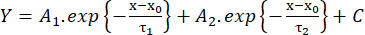 (3)
(3) - Bozunma τ1 ve τ2 (ms) zaman sabitlerinin ve A1 ve A226 genliklerinin değerlerini kaydedin.
- Morfometrik ölçümler
- Deneysel banyo odasına temiz, cam bir slayt monte edin. Slaytı 2-3 μL laminin ile kaplayın ve ~400 μL fiber süspansiyonu slaytın üzerine dökmeden önce 30 saniye kurumasını bekleyin. Liflerin oda sıcaklığında 10-15 dakika laminine yapışmasına izin verin.
- Deney odasının her iki tarafına yerleştirilmiş iki platin elektrot boyunca dikdörtgen akım darbeleri (0.8-1.2 ms) uygulayarak liflerin canlılığını doğrulamak için tek seğirmeleri uyandırın. Laminine bağlandığında bile, liflerin büzülmesi esas olarak uç noktalarda hala görülebilir.
- 10x ve 20x objektifler ve ters çevrilmiş bir floresan mikroskobuna monte edilmiş en az 5 megapiksellik bir kamera kullanarak canlı liflerin görüntülerini elde edin. Görüntüleri 'de saklayın. Çevrimdışı analizler için TIFF formatı.
NOT: Uzun bir fiberi tamamen yakalamak için ~2-6 görüntüden oluşan bir set gerekebilir. - Aynı büyütme altında bir mikroskop mikrometre kalibrasyon cetvelini görüntüleyin. Görüntüleri 'de saklayın. Çevrimdışı analizler için TIFF formatı.
- Görüntü analizleri için ücretsiz yazılımın kalibrasyon aracını kullanarak liflerin uzunluklarını ve çaplarını aşağıdaki gibi ölçün:
- Ek Şekil S1'de gösterildiği gibi Analiz Et/Ayarla ölçek aracını kullanarak mikroskop mikrometre kalibrasyon cetveli yardımıyla görüntülerdeki pikseller ile bilinen mesafe (μm) arasında bir ilişki kurun.
- Ek Şekil S1'de olduğu gibi, lifin bir ucundan diğerine uzunluklarını ve lif boyunca 2-6 farklı yerdeki çapları ölçün (uzunluğuna bağlı olarak görüntü başına 1-2 ölçüm).
- Uzunluk değerini (μm veya mm) ve lif başına ölçülen tüm çapların (μm) ortalamasını bildirin.
- Miyozin ağır zincir ekspresyon çalışmaları
NOT: MHC'nin tüm kaslarda immünofloresan43 ve sodyum dodesil sülfat-poliakrilamid jel elektroforezi (SDS-PAGE)33,44,45,46 ile belirlenmesiyle ilgili ayrıntılar için lütfen Ek Dosya 1'e bakın. FDB ile izole edilmiş liflerin süspansiyonunda MHC'nin immünofloresan tayini ile lif tiplemesi için protokol aşağıdaki gibidir:- Beş temiz cam slaytın her birini 2-3 μL laminin ile kaplayın ve her bir slaytın üzerine ~300 μL fiber süspansiyon dökmeden önce 30 saniye kurumasını bekleyin. Liflerin oda sıcaklığında 4 saat boyunca laminine yapışmasına izin verin.
- Müstahzarları oda sıcaklığında 30 dakika boyunca dondurucuda soğutulmuş asetonla sabitleyin.
- PBS ile 3 kez nazikçe yıkayın.
- Oda sıcaklığında 15 dakika boyunca% 0.7 Triton X-100 ile desteklenmiş PBS ile hücre zarlarını geçirgenleştirin.
- % 0.2 sığır serum albümini (BSA) ve% 0.04 Triton X-100 ile desteklenmiş PBS ile 3 kez nazikçe yıkayın ve ardından% 2 BSA,% 2 keçi serumu ve% 0.4 Triton X-100 ile oda sıcaklığında 30 dakika boyunca PBS ile bloke edin.
- % 0.2 BSA ve% 0.04 Triton X-100 ile desteklenmiş PBS ile 3 kez nazikçe yıkayın ve birincil antikorlarla aşağıdaki gibi inkübe edin:
- Her bir anti-MHC primer antikorunu PBS'de ayrı bir şişede% 1 BSA ve% 0.04 Triton X-100 ile seyreltin: anti-I (1: 1.500), anti-II (1: 600), anti-IIA (hibridomdan tüm şartlandırılmış ortamı kullanın) ve anti-IIB (1: 500).
- Her slaytı bir antikor ile ve kalan slaytı 4 ° C'de 12-16 saat boyunca kontrol olarak PBS ile inkübe edin.
NOT: Bu protokolde, IIX tipi lifler tüm numunelerde etiketsiz kalmıştır.
- PBS ile 3 kez nazikçe yıkayın ve tüm slaytları oda sıcaklığında 1-2 saat boyunca floresan yeşil bir moleküle bağlı ikincil antikor (1:800) ile inkübe edin.
- Çekirdekleri 1 μg/mL Hoechst ile 15 dakika boyayın.
- PBS ile 3 kez nazikçe yıkayın, dikkatlice 20-40 μL montaj ortamı ekleyin ve bir lamel yerleştirin.
NOT: Nazik çözelti değişimleri ve yıkama, düzinelerce elyafın slayta bağlı kalmasını sağlayarak deneyi istatistiksel olarak sağlam hale getirir. - Floresan için uygun 10x objektif ve uyarma/dikroik/emisyon için aşağıdaki dalga boylarına sahip bir filtre seti kullanarak her slaydı görselleştirin: 450-490/510/515 nm ve tüm pozitif ve negatif lifleri sayın. Alternatif olarak, aynı teknik koşulları ve ters çevrilmiş bir floresan mikroskobuna monte edilmiş en az 5 megapiksellik bir kamerayı kullanarak floresan görüntüler elde edin ve bunları . Çevrimdışı analizler için TIFF formatı.
- Her slaytın pozitif ve negatif liflerini bir veritabanına kaydedin ve ilgili slaytta bulunan toplam lif sayısına göre pozitif I, IIA, IIB ve toplam II liflerinin yüzdelerini hesaplayın. IIA+IIB'nin toplamını toplam II liflerinin yüzdesinden çıkararak IIX liflerinin yüzdesini hesaplayın. I+II'nin toplamını %100'lük bir değerden çıkararak hibrit I/IIA fiberlerin yüzdesini tahmin edin. Son olarak, saf tip I ve II liflere sahip olmak için hibrit hücrelerin yüzdesini I ve II'nin toplamından çıkarın.
NOT: MHC kompozisyon çalışmalarında, lif tipleri büyük harfle, izoformlar ise küçük harf46 ile gösterilir.
- Hematoksilen ve eozin boyama
- Temiz, cam bir lamı 2-3 μL laminin ile kaplayın ve ~300 μL fiber süspansiyonu kızak üzerine dökmeden önce 30 saniye kurumasını bekleyin. Liflerin oda sıcaklığında 4 saat boyunca laminine yapışmasına izin verin.
- Preparatı Carnoy çözeltisi (% 60 mutlak etanol,% 30 kloroform,% 10 asetik asit) ile oda sıcaklığında 5 dakika sabitleyin.
- Hematoksilen ile 90 saniye inkübe edin.
- Musluk suyuyla 3 kez nazikçe yıkayın.
- % 70 etanol içinde hazırlanan% 1 eozin Y ile 30 saniye inkübe edin.
- Musluk suyuyla 3 kez nazikçe yıkayın.
- 3x'i mutlak etanole daldırın.
- Ksilol içinde 60 saniye inkübe edin.
- 20-40 μL montaj ortamı ekleyin ve geleneksel bir mikroskopla görselleştirin. En az 5 megapiksellik bir renkli kamera kullanarak istenen büyütmede görüntüler elde edin.
5. İstatistiksel analizler ve grafik oluşturma
NOT: Deney birimi bir kas lifidir.
- Sonuçları ortalama ± standart sapma olarak ifade edin ve bazı analizler için %95 (%CI95) güven aralıklarını hesaplayın.
- Gruplar arasında uzunluk, çap ve Ca2+ geçici olayların kinetiğini karşılaştırmak için, Bonferroni'nin düzeltilmesi ile varyans analizi (ANOVA) ve post-hoc testleri yapın.
- Sırasıyla Shapiro-Wilk ve Levene'nin testlerini kullanarak normalliği ve varyans eşitliğini değerlendirin.
- p < 0.05 olduğunda farkları önemli olarak düşünün.
Sonuçlar
Sarkoplazmik Ca2+ seğirme sırasında konsantrasyon
Ayrışmış lifler kümesinde fizyolojik deneylerin uygulanabilirliğini göstermek ve uyarma-kasılma eşleşmesi (ECC) ve lif tipleri hakkındaki önceki bulgularımızı genişletmek için, tüm kaslardan liflerde Ca2+ geçişleri elde edildi. İlk olarak, FDB (n = 5) ve EDL (n = 7), morfoloji tip II (MT-II) olarak bilinen Ca2+ kinetik gösterdi. Bunlar, RT'si ~1 ms süren hızlı, dikenli sinyallerdir; bozunma f...
Tartışmalar
Olgun iskelet kası biyolojisini incelemek için mevcut modelleri tamamlamak için, burada kısa, orta ve uzun liflere sahip bir dizi fare kasının başarılı bir şekilde enzimatik ayrışmasını gösteriyoruz. Bu lifler, iskelet kasındakiCa2+ geçici akımlarının MT-II kinetiğinin genelleştirilebilirliğinin gösterilmesine izin verir. Ayrıca, sağlam, bütün kaslardaki lif tipleri sınıflandırıldı. FDB'nin fizyolojik deneyler için en çok kullanılan kas olduğu göz önüne alındığında, ...
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, UdeA'dan Profesör Robinson Ramírez'e hayvanlar ve bazı fotoğraflar konusundaki yardımları için ve teknik destek için Carolina Palacios'a şükranlarını sunarlar. Kaika'dan Johan Pineda, renkli ve floresan kameraları kurmamıza yardımcı oldu. Queensland Üniversitesi'nden Shyuan Ngo, el yazmasını nazikçe düzeltti. Bu çalışma CODI-UdeA (22 Şubat 2021'den itibaren 2020-34909 ve 31 Mart 2022'den itibaren 2021-40170, SIU) ve Planlama Ofisi-UdeA (E01708-K ve ES03180101), Medellín, Kolombiya tarafından JCC'ye finanse edilmiştir. Fon sağlayıcılar veri toplama ve analizine, makale yazımına veya gönderimine katılmamıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
Referanslar
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260 (2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14 (2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939 (2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898 (2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976 (2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118 (2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -. P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199 (2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807 (2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074 (2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961 (2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669 (2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796 (2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654 (2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126 (2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -. Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075 (2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır