Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Fibres musculaires squelettiques courtes, intermédiaires et longues intactes obtenues par dissociation enzymatique de six muscles des membres postérieurs de souris : au-delà du fléchisseur digitorum brevis
Dans cet article
Résumé
Nous décrivons un protocole pour obtenir des fibres dissociées enzymatiquement de différentes longueurs et types à partir de six muscles de souris adultes : trois d’entre eux déjà décrits (fléchisseur des doigts court, extenseur des doigts long, soléaire) et trois d’entre eux dissociés avec succès pour la première fois (extenseur de l’hallucis long, péronier long, péronier des doigts quarti).
Résumé
Les fibres musculaires squelettiques obtenues par dissociation enzymatique des muscles de souris sont un modèle utile pour les expériences physiologiques. Cependant, la plupart des articles traitent des fibres courtes du fléchisseur des doigts (FDB), ce qui limite la portée des résultats traitant des types de fibres, limite la quantité de matériel biologique disponible et empêche un lien clair entre les phénomènes physiologiques cellulaires et les connaissances biochimiques et dynamiques antérieures obtenues dans d’autres muscles.
Cet article décrit comment obtenir des fibres intactes à partir de six muscles avec différents profils et longueurs de types de fibres. En utilisant des souris adultes C57BL/6, nous montrons le protocole de dissection musculaire et d’isolement des fibres et démontrons l’adéquation des fibres pour les études transitoires Ca2+ et leur caractérisation morphométrique. La composition en fibres des muscles est également présentée. Lorsqu’ils sont dissociés, tous les muscles sont rendus intacts, des fibres vivantes qui se contractent rapidement pendant plus de 24 h. FDB a donné des fibres courtes (<1 mm), le péronier carré quarti (PDQA) et le péronier long (PL) ont donné des fibres intermédiaires (1-3 mm), tandis que les muscles extenseurs digitoles longs (EDL), extenseurs hallucis longs (EHL) et soléaires ont libéré des fibres longues (3-6 mm).
Lorsqu’ils ont été enregistrés avec le colorant rapide Mag-Fluo-4, les transitoires Ca2+ des fibres PDQA, PL et EHL ont montré la cinétique rapide et étroite rappelant la morphologie de type II (MT-II), connue pour correspondre aux fibres de type IIX et IIB. Cela est cohérent avec le fait que ces muscles ont plus de 90% de fibres de type II par rapport au FDB (~80%) et au soléaire (~65%). Au-delà du FDB, nous démontrons pour la première fois la dissociation de plusieurs muscles, ce qui donne des fibres couvrant une gamme de longueurs comprises entre 1 et 6 mm. Ces fibres sont viables et donnent des transitoires rapides Ca2+ , indiquant que le MT-II peut être généralisé aux fibres rapides IIX et IIB, quelle que soit leur source musculaire. Ces résultats augmentent la disponibilité de modèles pour les études des muscles squelettiques matures.
Introduction
Le muscle squelettique mature des mammifères est un tissu multifonctionnel. Il régule fortement le métabolisme, est la principale source de production de chaleur et ses propriétés dynamiques lui confèrent un rôle clé dans la respiration, le mouvement des segments du corps ou le déplacement d’un point à un autre 1,2,3. Le muscle squelettique est également pertinent pour la physiopathologie de nombreuses maladies, y compris les maladies héréditaires et chroniques, telles que les myopathies, les dystrophies ou la sarcopénie, ainsi que de nombreuses maladies chroniques non musculaires, telles que les maladies cardiométaboliques 3,4,5,6,7,8.
L’étude ex vivo des propriétés structurelles et fonctionnelles du muscle squelettique mature dans le contexte de la santé et de la maladie a été possible principalement grâce à deux modèles expérimentaux : le muscle entier et les fibres isolées. Au 20esiècle, les chercheurs ont exploité les propriétés de l’ensemble des muscles extenseurs digitorum longus (EDL), du soléaire, du tibial antérieur et du gastrocnémien intacts de différentes petites espèces comme modèles pivots pour en savoir plus sur les unités motrices, les types de fibres et les propriétés dynamiques telles que la force et la cinétique de contraction et de relaxation 9,10,11,12,13,14,15,16. Cependant, l’avènement d’études de biologie cellulaire plus raffinées a orienté le domaine vers l’étude des fibres musculaires uniques. Des travaux pionniers ont ensuite permis d’isoler des fibres intactes de fléchisseurs des doigts (FDB) de rats par dissociation enzymatique pour une caractérisation ultérieure 17,18,19. Bien que les fibres FDB puissent également être obtenues par dissection manuelle20, la facilité et le débit élevé de dissociation enzymatique des muscles murins, en plus de leur adéquation à une variété d’approches expérimentales, ont rendu ce dernier modèle largement utilisé au cours des deux dernières décennies.
Les fibres FDB courtes conviennent aux études électrophysiologiques et autres études biophysiques, aux analyses biochimiques, métaboliques et pharmacologiques, aux expériences de microscopie électronique et à fluorescence, à la transfection pour les approches de biologie cellulaire ou comme source de cellules souches dans les études de myogenèse 5,21,22,23,24,25,26,27,28, 29,30,31,32. Cependant, l’utilisation uniquement de fibres FDB dans les expériences musculaires réduit la portée de la recherche portant sur les types de fibres et limite la quantité de matériel biologique disponible pour certaines techniques méthodologiques ou pour obtenir plus d’informations d’un animal. Ces limitations empêchent une corrélation claire des phénomènes physiologiques cellulaires avec des études biochimiques et dynamiques antérieures réalisées dans différents muscles entiers et intacts (par exemple, EDL, soléaire, péronier).
Surmontant ces limitations, certains groupes ont réussi à dissocier les muscles EDL et soléaire plus longs 24,33,34,35,36,37,38,39,40, ouvrant la porte à l’extension de la méthode à d’autres muscles pertinents. Cependant, l’utilisation de fibres EDL et soléaires est encore rare, probablement en raison du manque de détails méthodologiques pour les obtenir en tant que fibres intactes. Ici, nous décrivons en détail comment isoler des fibres de différentes longueurs et types à partir de six muscles : trois d’entre eux déjà décrits (FDB, EDL et soléaire) et trois d’entre eux se sont dissociés avec succès pour la première fois (extenseur hallucis longus [EHL], péronier long [PL] et péronier digiti quarti [PDQA]). Les résultats du présent travail confirment que le modèle de fibres dissociées enzymatiquement est apte pour un large éventail d’études et de corrélations futures avec les données publiées précédemment, augmentant ainsi la disponibilité de modèles pour les études des muscles squelettiques matures.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les procédures ont été approuvées par le Comité d’éthique des expériences sur les animaux de l’Université d’Antioquia (UdeA) (procès-verbaux 104 du 21 juin 2016 et 005 du 15 avril 2021), conformément à la loi 84 de 1989 et à la résolution 8430 de 1993 émises par le gouvernement colombien et ont été effectuées et rapportées conformément à la loi sur la recherche animale : Lignes directrices sur le rapport des expériences in vivo (ARRIVE)41. Tous les résultats présentés ici proviennent de souris mâles C57BL/6 en bonne santé, âgées de 7 à 13 semaines, âgées de 20 à 26 g. La figure 1 montre la conception générale de cette étude et l’ordre des procédures. Tous les réactifs, matériaux et détails de l’équipement sont répertoriés dans le tableau des matériaux.
1. Animaux
- Hébergez un maximum de six souris par cage rectangulaire transparente en acrylique, avec litière dérivée du bois, dans des conditions de température contrôlée (21 ± 2 °C) et de cycles lumière/obscurité (12 :12 h).
- Donner aux animaux un accès gratuit à la nourriture et à l’eau du robinet dans des installations spécifiques exemptes d’agents pathogènes et sans enrichissement de l’environnement.
2. Dissection
- Solutions, matériaux et réactifs
- Préparer et filtrer (0,22 μm) les solutions de travail ayant la composition suivante (toutes les concentrations en mM) :
- Tyrode : 5,4 KCl, 1 MgCl2, 140 NaCl, 0,33 NaH2PO4, 2 CaCl2, 10 glucose, 10 HEPES, pH 7,3
- Dissociation : 2,7 KCl, 1,2 KH2PO4, 0,5 MgCl2, 138 NaCl, 0,1 Na2HPO4, 1 CaCl2, pH 7,4
- Solution saline tamponnée au phosphate (PBS) : 137 NaCl, 8,6 Na,2HPO4, 2,8 KH,2PO4, pH 7,34
- Préparez deux chambres de dissection ; stéréoscope; utiliser des ciseaux ; des ciseaux fins ; pinces fines ; et des flacons en verre propres, transparents, non coniques, de 1 à 1,5 cm de large, d’un volume total de 3 à 4 mL avec bouchons. Disposez un système de stimulation électrique des muscles dans les chambres de dissection.
- Préparez des pipettes en verre Pasteur polies au feu de différentes largeurs d’embouts : 5, 4, 3, 2 et 1 mm.
- Réglez le bain-marie à 37 °C. Peser des aliquotes de 3 mg de collagénase de type 2.
- Préparer et filtrer (0,22 μm) les solutions de travail ayant la composition suivante (toutes les concentrations en mM) :
- Procédure
- Sacrifiez la souris en utilisant des méthodes approuvées par le comité d’éthique local. La luxation cervicale est recommandée car elle est rapide, moins stressante et évite l’exposition aux médicaments, qui peuvent affecter le tissu musculaire (comme le CO2 ou certains anesthésiques). Commencez immédiatement la dissection pour obtenir de meilleurs résultats.
- Placez la souris sur une surface en mousse et collez ou épinglez les membres antérieurs. Coupez les deux membres postérieurs sur les genoux avec les ciseaux opératoires, transférez chacun d’eux dans une chambre de dissection séparée et ajoutez du Tyrode froid (10-20 °C) pour couvrir le tissu.
REMARQUE : Chaque membre postérieur donnera six muscles différents dans l’ordre suivant : FDB, soléaire, EDL, EHL, PL et PDQA. Des références anatomiques détaillées pour disséquer les six muscles intacts d’un tendon à l’autre sont données dans la figure 2 et ailleurs42. - Épinglez le premier membre postérieur à la chambre de dissection dans une position où la face postérieure des pattes est visible. Retirez la peau sous grossissement ; puis exposer et retirer le FDB (Figure 2). Conservez-le dans un flacon en verre étiqueté avec 1 mL de solution Tyrode.
REMARQUE : Un grossissement approprié et un entraînement préalable sont nécessaires pour éviter toute coupure indésirable dans le tissu musculaire. - Exposez, retirez et conservez le soléaire dans un flacon séparé avec 1 ml de Tyrode. Utilisez des ciseaux fins pour séparer d’abord le gastrocnémien, puis pour retirer le soléaire, comme indiqué sur la figure 2.
- Exposez la face antérieure de la jambe, retirez la peau et identifiez les tendons distaux du tibial antérieur et les muscles EDL de la cheville. Retirer et jeter le tibial ; puis coupez les tendons distaux de l’EDL (Figure 2). Poursuivre la dissection jusqu’à ce que l’EDL soit retiré et le placer dans un flacon en verre séparé avec 1 mL de Tyrode.
- Retirez le muscle EHL, qui se trouve juste derrière et médialement à l’EDL. Commencez la dissection en identifiant et en suivant le tendon jusqu’au1er chiffre, comme indiqué dans le panneau correspondant de la figure 2. Conservez le muscle dans un flacon en verre séparé avec 1 ml de Tyrode.
- Identifiez et suivez le tendon le plus externe du péronier pour le couper et retirer le muscle PL (Figure 2). Placer le muscle dans un flacon en verre séparé avec 1 mL de Tyrode.
- Identifiez et suivez le tendon jusqu’au4ème chiffre ; coupez-le et retirez le muscle PDQA (Figure 2). Placez-le dans un flacon en verre séparé avec 1 mL de Tyrode.
- Répétez la procédure avec la deuxième patte arrière.
- Rassemblez les deux muscles du même type dans un flacon en verre étiqueté ou une petite boîte de Pétri avec une solution de Tyrode.
REMARQUE : Si plus de deux paires de muscles doivent être disséquées au cours d’une séance de travail, recrutez deux chercheurs pour la procédure de dissection.
3. Protocole d’isolement des fibres musculaires
- Renouveler la solution Tyrode dans les chambres de dissection pour éliminer les débris et la fourrure de souris. Versez les muscles FDB dans une chambre de dissection, vérifiez leur intégrité et transférez-les dans un nouveau flacon en verre avec 1 mL de solution de dissociation. Répétez cette procédure avec les muscles EHL, PL et PDQA.
REMARQUE : Si un muscle semble hypercontracté, coupé ou ne répond pas à la stimulation électrique, ne passez pas à l’étape suivante du protocole. Au lieu de cela, optimisez le protocole de dissection en vérifiant la qualité des solutions (pH, contamination, osmolarité) et en acquérant plus de compétences en dissection (Figure 1C et vidéo supplémentaire S1). - Effectuez des coupes longitudinales ou diagonales des muscles soléaire et EDL, en suivant l’orientation des fibres (Figure 2). Pour le soléaire, suivez le tendon central en coupant ~80% de sa longueur. Pour l’EDL, il suffit de suivre un ou deux tendons et de couper à peu près la même longueur que pour le soléaire. Mettre chaque paire de muscles dans des flacons en verre avec 1 mL de solution de dissociation.
REMARQUE : Cette procédure réduit la taille de l’EDL et du soléaire et permet à la collagénase de mieux pénétrer dans les tissus. Un grossissement suffisant (40-50x), ainsi que des ciseaux fins et des pinces, sont obligatoires. Vérifiez toujours l’intégrité de l’échantillon par inspection visuelle et stimulation électrique avant de passer à l’étape suivante du protocole de dissociation. - Ajouter 3 mg de collagénase de type 2 (avec une activité de 250-300 U/mg) dans chaque flacon contenant 1 mL de solution de dissociation et une paire de muscles. Standardisez la quantité exacte de collagénase en tenant compte de l’activité du lot d’enzymes utilisé.
- Incuber les paires de muscles dans le bain-marie pendant 65 à 90 minutes à 36,8-37 °C, en secouant doucement.
REMARQUE : Soyez rigoureux avec le contrôle de la température. Standardisez la procédure afin que les muscles ne restent pas en collagénase pendant plus de 100 minutes pour éviter les dommages. - Vérifier les flacons sous grossissement stéréoscopique toutes les 5 min après la 65ème minute d’incubation. Lorsque les muscles semblent légèrement ondulés, déchiquetés et lâches, secouez doucement le flacon et vérifiez si certaines fibres commencent à se détacher facilement. Si c’est le cas, lavez les muscles avec du Tyrode à température ambiante pour inactiver et éliminer la collagénase.
REMARQUE : Le lavage doit être effectué avec soin, sans toucher les muscles avec les pipettes. Commencez par ajouter 0,8 mL de Tyrode, puis retirez 0,8 mL de solution. Répétez cette procédure 4 à 5 fois et vérifiez que la solution devient totalement transparente. - Séparez plus de fibres de la masse des muscles avec une trituration très douce dans Tyrode à l’aide de l’ensemble de pipettes Pasteur polies au feu. Commencez par agiter la solution autour du muscle avec la pipette la plus large (pointe de 5 mm), puis tirez doucement les muscles vers le haut et hors de la pipette 3-4x. Lorsque le muscle commence à libérer des fibres et devient plus fin, répétez la procédure avec la pipette suivante (pointe de 4 mm).
REMARQUE : Les fibres rendues par cette procédure restent excitables et se contractent rapidement pendant plus de 24 heures, comme illustré en utilisant les fibres PL, EDL, EHL et soléaires dans la vidéo supplémentaire S2, la vidéo supplémentaire S3, la vidéo supplémentaire S4 et la vidéo supplémentaire S5.
4. Procédures expérimentales
REMARQUE : Des fibres isolées ont été utilisées pour les estimations de la concentration de Ca2+ sarcoplasmique, les mesures morphométriques et les études d’expression de la chaîne lourde de myosine (CMH).
- Mesure du Ca sarcoplasmique2+ Concentration pendant une contraction
- Montez une lame de verre propre sur la chambre de bain expérimentale. Enduire la lame de 2-3 μL de laminine et la laisser sécher pendant 30 s avant de verser ~400 μL de la suspension de fibres sur la lame. Laissez les fibres adhérer à la laminine pendant 10 à 15 minutes à température ambiante.
- Monter la chambre expérimentale sur la platine d’un microscope inversé équipé pour l’épifluorescence (Figure 3A).
- Évoquer des secousses simples pour vérifier la viabilité des fibres en appliquant des impulsions de courant rectangulaires (0,8-1,2 ms) à travers les deux électrodes de platine placées de chaque côté de la chambre expérimentale. Même lorsqu’elles sont attachées à la laminine, la contraction des fibres est toujours visible principalement aux extrémités.
- Chargez les fibres avec 3,5-4,5 μM du colorant rapide Ca2+ Mag-Fluo-4, AM pendant 4-5 min dans une solution Tyrode. Après ce temps, lavez délicatement avec du Tyrode pour éliminer le colorant extracellulaire. Laissez le colorant intracellulaire être désestérifié pendant ~15-20 min dans des conditions sombres. Maintenez toujours la température en dessous de 22 °C pour éviter la compartimentation de la teinture.
REMARQUE : Préparer un stock de Mag-Fluo-4, AM dans du diméthylsulfoxyde (DMSO) uniquement, de sorte que la concentration finale de DMSO dans la solution de chargement de Tyrode soit inférieure à 0,5 %. - Éclairez la fibre avec une diode électroluminescente blanche (LED) et un ensemble de filtres avec les longueurs d’onde suivantes pour l’excitation/dichroïque/émission : 450-490/510/515 nm (Figure 3A).
REMARQUE : Les autres sources d’excitation comprennent les lampes à fluorescence au mercure et au xénon. Utilisez l’intensité et la taille les plus faibles possibles du point d’excitation pour éviter le photoblanchiment du colorant et les dommages à la cellule. - Évoquer la réponse Ca2+ de la fibre (transitoires sarcoplasmiques Ca2+ ) en appliquant des impulsions de courant rectangulaires (0,8-1,2 ms) à travers les deux électrodes de platine placées de part et d’autre de la chambre expérimentale à 20-22 °C.
- Collectez et enregistrez les signaux lumineux à l’aide d’un objectif longue distance 40x à immersion dans l’huile adapté à la fluorescence et d’un tube photomultiplicateur (PMT) connecté à un numériseur (Figure 3A et vidéo supplémentaire S6). Assurez-vous d’une échelle dans le logiciel d’acquisition de 0 à 200 unités arbitraires (UA) et réglez la fluorescence au repos (Frest) de l’expérience à 10 UA sur cette échelle en modulant la taille du point d’excitation et le gain du PMT. Une fois la procédure normalisée, gardez le gain inchangé d’une expérience à l’autre et réglez l’échelle uniquement par des ajustements mineurs de la taille du spot.
REMARQUE : En cas d’apparition d’artefacts de mouvement, utiliser 20 à 30 μM de N-benzyl-p-toluène sulfamide (BTS) dans la solution de Tyrode. - Analysez et calibrez les signaux comme suit :
- Filtre passe-bas sur toute la piste à 1 kHz.
- Calculez le repos F en 1 s de la trace, ajustez le repos F à 0 et mesurez l’amplitude des transitoires sarcoplasmiques Ca2+ (pic F). Présentez l’amplitude comme dans l’équation (1) :
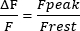 (1)
(1) - Calculer la concentration maximale de Ca2+ ([Ca2+], μM) à l’aide de l’équation (2)26 et des paramètres suivants : constante de dissociation in situ (Kd) = 1,65 ×10 5 μM2, fluorescence maximale (Fmax) de 150,9 UA, fluorescence minimale (Fmin) de 0,14 UA, concentration de Mag-Fluo-4 [D]T de 229,1 μM26. Lepic F a déjà été obtenu à l’étape 4.1.8.2.
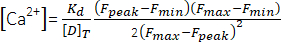 (2)
(2) - Mesurez le temps de montée de 10% à 90% de l’amplitude (RT, ms), la durée à mi-maximum (HW, ms) et le temps de décroissance de 90% à 10% de l’amplitude (DT, ms). Ensuite, estimez la cinétique de décroissance en fonction d’un ajustement avec la fonction biexponentielle (équation 3) :
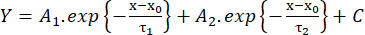 (3)
(3) - Enregistrez les valeurs des constantes de temps de décroissance τ1 et τ2 (ms) et des amplitudes A1 et A226.
- Mesures morphométriques
- Montez une lame de verre propre sur la chambre de bain expérimentale. Enduire la lame de 2-3 μL de laminine et la laisser sécher pendant 30 s avant de verser ~400 μL de la suspension de fibres sur la lame. Laissez les fibres adhérer à la laminine pendant 10 à 15 minutes à température ambiante.
- Évoquer des secousses simples pour vérifier la viabilité des fibres en appliquant des impulsions de courant rectangulaires (0,8-1,2 ms) à travers les deux électrodes de platine placées de chaque côté de la chambre expérimentale. Même lorsqu’elles sont attachées à la laminine, la contraction des fibres est toujours visible principalement aux extrémités.
- Acquérir des images des fibres vivantes à l’aide d’objectifs 10x et 20x et d’une caméra d’au moins 5 mégapixels montée sur un microscope à fluorescence inversée. Stockez les images dans . Format TIFF pour les analyses hors ligne.
REMARQUE : Un ensemble de ~2 à 6 images peut être nécessaire pour capturer complètement une longue fibre. - Imagez une règle d’étalonnage micrométrique de microscope sous le même grossissement. Stockez les images dans . Format TIFF pour les analyses hors ligne.
- Mesurez les longueurs et les diamètres des fibres à l’aide de l’outil de calibrage d’un logiciel libre pour les analyses d’images comme suit :
- Établissez une relation entre les pixels et la distance connue (μm) dans les images à l’aide de la règle d’étalonnage micrométrique du microscope à l’aide de l’outil Analyser/Définir l’échelle comme indiqué dans la figure supplémentaire S1.
- Mesurez les longueurs une fois d’une pointe à l’autre de la fibre et les diamètres à 2 à 6 endroits différents le long de la fibre (1 à 2 mesures par image, selon sa longueur), comme dans la figure supplémentaire S1.
- Indiquez la valeur de la longueur (μm ou mm) et la moyenne de tous les diamètres (μm) mesurés par fibre.
- Études d’expression de la chaîne lourde de la myosine
REMARQUE : Pour plus de détails sur la détermination du CMH par immunofluorescence43 et électrophorèse sur gel de dodécylsulfate-polyacrylamide de sodium (SDS-PAGE)33,44,45,46 dans les muscles entiers, veuillez consulter le fichier supplémentaire 1. Le protocole de typage des fibres par immunofluorescence du CMH dans la suspension de fibres isolées par FDB est le suivant :- Enduire chacune des cinq lames de verre propres avec 2-3 μL de laminine et laisser sécher pendant 30 s avant de verser ~300 μL de suspension de fibre sur chaque lame. Laisser les fibres adhérer à la laminine pendant 4 h à température ambiante.
- Fixez les préparations avec de l’acétone refroidie au congélateur pendant 30 min à température ambiante.
- Laver délicatement 3x avec PBS.
- Perméabiliser les membranes cellulaires avec du PBS complété par 0,7% de Triton X-100 pendant 15 min à température ambiante.
- Laver délicatement 3 fois avec du PBS complété par 0,2 % d’albumine sérique bovine (BSA) et 0,04 % de Triton X-100, puis bloquer avec du PBS avec 2 % de BSA, 2 % de sérum de chèvre et 0,4 % de Triton X-100 pendant 30 min à température ambiante.
- Laver doucement 3 fois avec du PBS complété par 0,2 % de BSA et 0,04 % de Triton X-100 et incuber avec les anticorps primaires comme suit :
- Diluer chaque anticorps primaire anti-CMH dans un flacon séparé dans du PBS avec 1 % de BSA et 0,04 % de Triton X-100 : anti-I (1 :1 500), anti-II (1 :600), anti-IIA (utiliser des milieux conditionnés entiers de l’hybridome) et anti-IIB (1 :500).
- Incuber chaque lame avec un anticorps et la lame restante avec du PBS comme témoin pendant 12 à 16 h à 4 °C.
REMARQUE : Dans ce protocole, les fibres de type IIX n’ont pas été marquées dans tous les échantillons.
- Laver délicatement 3 fois avec du PBS et incuber toutes les lames avec l’anticorps secondaire (1 :800) couplé à une molécule verte fluorescente pendant 1 à 2 h à température ambiante.
- Colorer les noyaux avec 1 μg/mL de Hoechst pendant 15 min.
- Laver délicatement 3 fois avec du PBS, ajouter soigneusement 20 à 40 μL de support de montage et placer une lamelle.
REMARQUE : Des échanges de solution et un lavage doux garantissent que des dizaines de fibres restent attachées à la lame, ce qui rend l’expérience statistiquement solide. - Visualisez chaque lame à l’aide d’un objectif 10x adapté à la fluorescence et d’un ensemble de filtres avec les longueurs d’onde suivantes pour l’excitation/dichroïque/émission : 450-490/510/515 nm et comptez toutes les fibres positives et négatives. Vous pouvez également acquérir des images de fluorescence dans les mêmes conditions techniques et avec une caméra d’au moins 5 mégapixels montée sur un microscope à fluorescence inversée et les stocker dans . Format TIFF pour les analyses hors ligne.
- Enregistrez les fibres positives et négatives de chaque lame dans une base de données et calculez les pourcentages de fibres positives I, IIA, IIB et totales II en fonction du nombre total de fibres présentes dans la lame correspondante. Calculez le pourcentage de fibres IIX en soustrayant la somme de IIA+IIB du pourcentage de fibres II totales. Estimez le pourcentage de fibres hybrides I/IIA en soustrayant la somme de I+II d’une valeur de 100 %. Enfin, soustrayez le pourcentage de cellules hybrides du total de I et II pour avoir les fibres pures de type I et II.
REMARQUE : Dans les études de composition du CMH, les types de fibres sont désignés par une lettre majuscule tandis que les isoformes sont désignées par une lettre minuscule46.
- Coloration à l’hématoxyline et à l’éosine
- Enduire une lame de verre propre de 2 à 3 μL de laminine et la laisser sécher pendant 30 s avant de verser ~300 μL de suspension de fibre sur la lame. Laisser les fibres adhérer à la laminine pendant 4 h à température ambiante.
- Fixer la préparation avec la solution de Carnoy (60% d’éthanol absolu, 30% de chloroforme, 10% d’acide acétique) pendant 5 min à température ambiante.
- Incuber avec de l’hématoxyline pendant 90 s.
- Laver délicatement 3x à l’eau du robinet.
- Incuber avec 1% d’éosine Y préparée dans de l’éthanol à 70% pendant 30 s.
- Laver délicatement 3x à l’eau du robinet.
- Plongez 3x dans de l’éthanol absolu.
- Incuber dans du xylol pendant 60 s.
- Ajouter 20 à 40 μL de milieu de montage et visualiser avec un microscope conventionnel. Acquérez des images au grossissement souhaité à l’aide d’une caméra couleur d’au moins 5 mégapixels.
5. Analyses statistiques et graphiques
NOTE : L’unité expérimentale est une fibre musculaire.
- Exprimer les résultats sous forme de moyenne ±écart-type et calculer des intervalles de confiance de 95 % (IC95 %) pour certaines analyses.
- Pour comparer la longueur, le diamètre et la cinétique des transitoires Ca2+ entre les groupes, effectuez une analyse de variance (ANOVA) et des tests post-hoc avec la correction de Bonferroni.
- Évaluez la normalité et l’égalité de variance à l’aide des tests de Shapiro-Wilk et de Levene, respectivement.
- Considérez les différences significatives lorsque p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Résultats
Concentration de Ca2+ sarcoplasmique lors d’une contraction
Pour démontrer la faisabilité d’expériences physiologiques dans l’ensemble des fibres dissociées et pour étendre nos résultats antérieurs sur le couplage excitation-contraction (ECC) et les types de fibres, des transitoires Ca2+ ont été acquis dans les fibres de tous les muscles. Tout d’abord, FDB (n = 5) et EDL (n = 7) ont montré une cinétique Ca2+ connue sous le nom de morphologie de type ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Pour compléter les modèles disponibles pour étudier la biologie des muscles squelettiques matures, nous démontrons ici la dissociation enzymatique réussie d’une gamme de muscles de souris avec des fibres courtes, intermédiaires et longues. Ces fibres permettent de démontrer la généralisabilité de la cinétique MT-II des transitoires Ca2+ dans le muscle squelettique. De plus, les types de fibres dans les muscles entiers intacts ont été classés. Étant donné que le FDB est le muscle le plus utili...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts.
Remerciements
Les auteurs expriment leur gratitude au professeur Robinson Ramírez de l’UdeA pour son aide avec les animaux et quelques photos et à Carolina Palacios pour son soutien technique. Johan Pineda de Kaika nous a aidés à mettre en place les caméras couleur et fluorescence. Shyuan Ngo, de l’Université du Queensland, a aimablement relu le manuscrit. Cette étude a été financée par le CODI-UdeA (2020-34909 du 22 février 2021 et 2021-40170 du 31 mars 2022, SIU) et le Bureau de planification-UdeA (E01708-K et ES03180101), Medellín, Colombie, au JCC. Les bailleurs de fonds n’ont pas participé à la collecte et à l’analyse des données, à la rédaction ou à la soumission des manuscrits.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
Références
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260(2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14(2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939(2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898(2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976(2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118(2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199(2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807(2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074(2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961(2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669(2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796(2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654(2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126(2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075(2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon