Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Интактные короткие, промежуточные и длинные скелетные мышечные волокна, полученные ферментативной диссоциацией шести мышц задних конечностей мышей: за пределами сгибателя пальцев (Beyond Flexor Digitorum Brevis)
В этой статье
Резюме
Описан протокол получения ферментативно диссоциированных волокон разной длины и типа из шести мышц взрослых мышей: трех из них уже описанных (flexor digitorum brevis, extensor digitorum longus, soleus) и трех из них успешно диссоциированных впервые (extensor hallucis longus, peroneus longus, peroneus digiti quarti).
Аннотация
Скелетные мышечные волокна, полученные путем ферментативной диссоциации мышц мышей, являются полезной моделью для физиологических экспериментов. Тем не менее, большинство работ имеют дело с короткими волокнами короткого сгибателя пальцев (FDB), что ограничивает область результатов, связанных с типами волокон, ограничивает количество доступного биологического материала и препятствует четкой связи между клеточными физиологическими явлениями и предыдущими биохимическими и динамическими знаниями, полученными в других мышцах.
В данной работе описывается, как получить неповрежденные волокна из шести мышц с различными профилями и длинами волокон. Используя взрослых мышей C57BL/6, мы показали протокол рассечения мышц и изоляции волокон, а также продемонстрировали пригодность волокон для транзиентных исследований Ca2+ и их морфометрической характеристики. Также представлен волокнистый состав мышц. При диссоциации все мышцы становились неповрежденными, живые волокна, которые быстро сокращались более 24 ч. FDB давали короткие (<1 мм), peroneus digiti quarti (PDQA) и peroneus longus (PL) давали промежуточные (1-3 мм), в то время как разгибатели пальцев (EDL), разгибатели галлюциса (EHL) и камбаловидные мышцы высвобождали длинные (3-6 мм) волокна.
При регистрации с помощью быстрого красителя Mag-Fluo-4 переходные процессы Ca2+ волокон PDQA, PL и EHL показали быструю, узкую кинетику, напоминающую морфологию типа II (MT-II), которая, как известно, соответствует волокнам типа IIX и IIB. Это согласуется с тем фактом, что эти мышцы имеют более 90% волокон II типа по сравнению с FDB (~80%) и камбаловидной мышцей (~65%). Выйдя за рамки FDB, мы впервые продемонстрировали диссоциацию нескольких мышц, которые выделяют волокна длиной от 1 до 6 мм. Эти волокна жизнеспособны и дают быстрые транзиентыCa2+ , что указывает на то, что MT-II может быть обобщен на быстрые волокна IIX и IIB, независимо от их мышечного источника. Эти результаты повышают доступность моделей для исследований зрелых скелетных мышц.
Введение
Зрелая скелетная мускулатура млекопитающих является многофункциональной тканью. Он в значительной степени регулирует обмен веществ, является основным источником теплообразования, а его динамические свойства наделяют его ключевой ролью в дыхании, движении сегментов тела или перемещении из одной точкив другую1,2,3. Скелетные мышцы также важны для патофизиологии многих заболеваний, включая наследственные и хронические состояния, такие как миопатии, дистрофии или саркопения, а также многие немышечные хронические состояния, такие как кардиометаболические заболевания 3,4,5,6,7,8.
Исследование ex vivo структурных и функциональных свойств зрелых скелетных мышц в контексте здоровья и болезни стало возможным в основном с помощью двух экспериментальных моделей: цельных мышц и изолированных волокон. В20-м веке исследователи использовали свойства целых, неповрежденных мышц-разгибателей пальцев (EDL), камбаловидной, передней большеберцовой и икроножной мышц различных мелких видов в качестве основных моделей для изучения двигательных единиц, типов волокон и динамических свойств, таких как сила и кинетика сокращения и расслабления 9,10,11,12,13,14,15.16. Однако появление более совершенных исследований клеточной биологии сдвинуло эту область в сторону изучения отдельных мышечных волокон. Новаторская работа позволила выделить интактные волокна сгибателя пальцев (FDB) крыс путем ферментативной диссоциации для последующей характеристики 17,18,19. Несмотря на то, что волокна FDB также могут быть получены путем ручной диссекции20, легкость и высокая пропускная способность ферментативной диссоциации мышц мышей, в дополнение к их пригодности для различных экспериментальных подходов, сделали последнюю модель широко используемой в течение последних двух десятилетий.
Короткие волокна FDB подходят для электрофизиологических и других биофизических исследований, биохимических, метаболических и фармакологических анализов, экспериментов по электронной и флуоресцентной микроскопии, трансфекции для клеточной биологии или в качестве источника стволовых клеток в исследованиях миогенеза 5,21,22,23,24,25,26,27,28, 29,30,31,32. Однако использование только волокон FDB в мышечных экспериментах сужает рамки исследований, связанных с типами волокон, и ограничивает количество биологического материала, доступного для некоторых методологических методов или для получения дополнительной информации от одного животного. Эти ограничения препятствуют четкой корреляции клеточных физиологических явлений с предыдущими биохимическими и динамическими исследованиями, выполненными в различных целых, интактных мышцах (например, ЖНВП, камбаловидной мышце, перонеи).
Преодолев эти ограничения, некоторым группам удалось диссоциировать более длинные EDL и камбаловидные мышцы 24,33,34,35,36,37,38,39,40, открыв дверь для дальнейшего распространения метода на другие соответствующие мышцы. Тем не менее, использование EDL и камбаловидных волокон по-прежнему ограничено, вероятно, из-за отсутствия методологических подробностей для получения их в виде неповрежденных волокон. Здесь мы подробно опишем, как выделить волокна разной длины и типа из шести мышц: три из них уже описаны (FDB, EDL и камбаловидная мышца) и три из них успешно диссоциированы впервые (extensor hallucis longus [EHL], peroneus longus [PL] и peroneus digiti quarti [PDQA]). Результаты настоящей работы подтверждают, что модель ферментативно диссоциированных волокон пригодна для широкого круга исследований и будущих корреляций с ранее опубликованными данными, что повышает доступность моделей для исследований зрелых скелетных мышц.
Access restricted. Please log in or start a trial to view this content.
протокол
Все процедуры были одобрены Комитетом по этике в экспериментах на животных Университета Антьокии (UdeA) (протоколы 104 от 21 июня 2016 г. и 005 от 15 апреля 2021 г.), в соответствии с Законом 84 от 1989 г. и Резолюцией 8430 от 1993 г., изданной правительством Колумбии, и были выполнены и представлены в соответствии с Исследованиями на животных: Рекомендации по отчетности об экспериментах in vivo (ARRIVE)41. Все результаты, представленные здесь, получены от здоровых самцов мышей C57BL/6 в возрасте 7-13 недель, весом 20-26 г. На рисунке 1 показан общий план этого исследования и порядок процедур. Все реактивы, материалы и детали оборудования перечислены в Таблице материалов.
1. Животные
- Содержать не более шести мышей в акриловой прозрачной прямоугольной клетке с древесной подстилкой в условиях контролируемой температуры (21 ± 2 °C) и циклов свет:темнота (12:12 ч).
- Обеспечьте животным свободный доступ к пище и водопроводной воде в специальных животноводческих помещениях, свободных от патогенов, без обогащения окружающей среды.
2. Вскрытие
- Растворы, материалы и реагенты
- Готовят и фильтруют (0,22 мкм) рабочие растворы со следующим составом (все концентрации в мМ):
- Тирод: 5,4 KCl, 1 MgCl2, 140 NaCl, 0,332PO4, 2 CaCl2, глюкоза 10, HEPES 10, pH 7,3
- Диссоциация: 2,7 KCl, 1,2 KH2PO4, 0,5 MgCl2, 138 NaCl, 0,1Na2HPO4, 1 CaCl2, pH 7,4
- Фосфатно-солевой буфер (PBS): 137 NaCl, 8,6Na2HPO4, 2,8 KH2PO4, pH 7,34
- Подготовьте две камеры для вскрытия; стереоскоп; операционные ножницы; тонкие ножницы; тонкие щипцы; чистые, прозрачные, неконические, шириной 1-1,5 см, стеклянные флаконы общим объемом 3-4 мл с крышками. Организуйте систему электростимуляции мышц в камерах препарирования.
- Подготовьте полированные огнем стеклянные пипетки Пастера с наконечниками разной ширины: 5, 4, 3, 2 и 1 мм.
- Установите водяную баню на 37 °C. Взвесьте аликвоты 3 мг коллагеназы 2-го типа.
- Готовят и фильтруют (0,22 мкм) рабочие растворы со следующим составом (все концентрации в мМ):
- Процедура
- Пожертвуйте мышью, используя методы, одобренные местным Комитетом по этике. Вывих шейного отдела рекомендуется потому, что он быстрый, менее стрессовый и позволяет избежать воздействия лекарств, которые могут повлиять на мышечную ткань (например, CO2 или некоторые анестетики). Немедленно приступайте к препарированию для получения лучших результатов.
- Поместите мышь на поролоновую поверхность и заклейте передние конечности скотчем или булавкой. Операционными ножницами разрежьте обе задние конечности над коленями, перенесите каждую из них в отдельную камеру для препарирования и добавьте холодный (10-20 °С) тирод, чтобы покрыть ткань.
ПРИМЕЧАНИЕ: Каждая задняя конечность дает шесть различных мышц в следующем порядке: FDB, камбаловидная мышца, EDL, EHL, PL и PDQA. Подробные анатомические справки по рассечению шести неповрежденных мышц от сухожилия до сухожилия приведены на рисунке 2 и в других местах42. - Прижмите первую заднюю конечность к камере препарирования в положении, при котором видна задняя грань ног. Снимаем кожицу под увеличением; затем выставьте и удалите FDB (рисунок 2). Храните его в одном пробирном стеклянном флаконе с 1 мл раствора Tyrode.
ПРИМЕЧАНИЕ: Требуется соответствующее увеличение и предварительная тренировка, чтобы избежать нежелательных порезов мышечной ткани. - Обнажите, извлеките и храните камбаловидную камбалу в отдельном флаконе с 1 мл Tyrode. Используйте тонкие ножницы, чтобы сначала отделить икроножную мышцу, а затем удалить камбаловидную мышцу, как показано на рисунке 2.
- Обнажите переднюю поверхность ноги, снимите кожу и определите дистальные сухожилия передней большеберцовой кости и мышцы EDL в голеностопном суставе. Удалите и выбросьте большеберцовые кости; затем разрезают дистальные сухожилия ЖНВЛП (рис. 2). Продолжайте вскрытие до тех пор, пока не снимите EDL и поместите его в отдельный стеклянный флакон с 1 мл Tyrode.
- Удалите мышцу EHL, которая лежит чуть позади и медиально от EDL. Начните рассечение с определения и следования сухожилия до1-го пальца, как указано на соответствующей панели рисунка 2. Держите мышцу в отдельном стеклянном флаконе с 1 мл Тироде.
- Определите и проследите за самым внешним сухожилием малоберцовой кости, чтобы разрезать его и удалить PL-мышцу (Рисунок 2). Поместите мышцу в отдельный стеклянный флакон с 1 мл Tyrode.
- Определите и проследите сухожилие до4-го пальца; разрежьте его и удалите мышцу PDQA (рис. 2). Поместите его в отдельный стеклянный флакон с 1 мл Tyrode.
- Повторите процедуру со второй задней конечностью.
- Соберите обе мышцы одного типа в один стеклянный флакон с этикеткой или небольшую чашку Петри с раствором Тироде.
ПРИМЕЧАНИЕ: Если во время рабочего сеанса планируется рассечение более двух пар мышц, наймите двух исследователей для процедуры препарирования.
3. Протокол изоляции мышечных волокон
- Обновите раствор Tyrode в камерах препарирования, чтобы удалить мусор и шерсть мышей. Поместите мышцы FDB в одну камеру диссекции, проверьте их целостность и переложите в новый стеклянный флакон с 1 мл раствора диссоциации. Повторите эту процедуру с мышцами EHL, PL и PDQA.
ПРИМЕЧАНИЕ: Если мышца выглядит гиперсокращенной, порезанной или не реагирует на электрическую стимуляцию, не переходите к следующему шагу протокола. Вместо этого оптимизируйте протокол вскрытия, проверив качество растворов (pH, загрязнение, осмолярность) и приобретя дополнительные навыки препарирования (рис. 1C и дополнительное видео S1). - Выполняйте продольные или диагональные надрезы камбаловидной мышцы и мышцы МНПВ, соблюдая ориентацию волокон (рисунок 2). Для камбаловидной мышцы следуйте центральному сухожилию, обрезая ~80% его длины. Для ЖНВЛП достаточно одного или двух сухожилий и обрезать примерно такую же длину, как и для камбаловидной мышцы. Поместите каждую пару мышц в стеклянные флаконы с 1 мл раствора диссоциации.
ПРИМЕЧАНИЕ: Эта процедура уменьшает ЖНВП и камбаловидную мышцу и позволяет коллагеназе лучше проникать в ткани. Достаточное увеличение (40-50х), а также тонкие ножницы и щипцы обязательны. Всегда проверяйте целостность образца путем визуального осмотра и электростимуляции, прежде чем переходить к следующему этапу протокола диссоциации. - Добавьте 3 мг коллагеназы 2-го типа (с активностью 250-300 Ед/мг) в каждый флакон, содержащий 1 мл раствора диссоциации и пару мышц. Стандартизируйте точное количество коллагеназы, учитывая активность используемой партии фермента.
- Инкубируйте пары мышц на водяной бане в течение 65-90 мин при температуре 36,8-37 °С, при легком встряхивании.
ПРИМЕЧАНИЕ: Будьте строги с контролем температуры. Стандартизируйте процедуру так, чтобы мышцы не оставались в коллагеназе более 100 минут, чтобы избежать повреждений. - Проверяют флаконы под увеличением стереоскопа каждые 5 мин после65-й мин инкубации. Когда мышцы выглядят слегка волнистыми, рваными и рыхлыми, осторожно встряхните флакон и проверьте, не начинают ли некоторые волокна легко отделяться. В этом случае промойте мышцы препаратом Tyrode комнатной температуры, чтобы инактивировать и удалить коллагеназу.
ПРИМЕЧАНИЕ: Мытье должно производиться осторожно, не касаясь пипетками мышц. Начните с добавления 0,8 мл Tyrode, а затем удалите 0,8 мл раствора. Повторите эту процедуру 4-5 раз и убедитесь, что раствор стал полностью прозрачным. - Отделите больше волокон от основной массы мышц с очень щадящим растиранием в Тироде с помощью набора отполированных огнем пипеток Пастера. Начните с перемешивания раствора вокруг мышцы самой широкой пипеткой (наконечник 5 мм), а затем осторожно вытяните мышцы вверх и из пипетки 3-4 раза. Когда мышца начнет освобождать волокна и станет тоньше, повторите процедуру со следующей пипеткой (наконечник 4 мм).
ПРИМЕЧАНИЕ: Волокна, полученные с помощью этой процедуры, остаются возбудимыми и быстро сокращаются в течение более 24 часов, как показано на примере волокон PL, EDL, EHL и камбаловидных волокон в Supplemental Video S2, Supplemental Video S3, Supplemental Video S4 и Supplemental Video S5.
4. Экспериментальные процедуры
ПРИМЕЧАНИЕ: Изолированные волокна использовались для оценки концентрации саркоплазматического Ca2+ , морфометрических измерений и исследований экспрессии тяжелой цепи миозина (MHC).
- Измерение саркоплазматического Ca2+ Концентрация во время подергивания
- Установите чистую стеклянную горку на экспериментальную камеру ванны. Покройте предметное стекло 2-3 мкл ламинина и дайте ему высохнуть в течение 30 с, прежде чем вылить ~400 мкл суспензии волокна на предметное стекло. Дайте волокнам прилипнуть к ламинину в течение 10-15 минут при комнатной температуре.
- Установите экспериментальную камеру на столик инвертированного микроскопа, оборудованного для эпифлуоресценции (рис. 3А).
- Вызывайте одиночные подергивания для проверки жизнеспособности волокон, применяя прямоугольные импульсы тока (0,8-1,2 мс) через два платиновых электрода, расположенных по обе стороны экспериментальной камеры. Даже при присоединении к ламинину сокращение волокон все равно видно в основном на крайних точках.
- Нагружают волокна 3,5-4,5 мкМ быстрого красителяCa2+ Mag-Fluo-4, AM в течение 4-5 мин в растворе Tyrode. По истечении этого времени аккуратно промойте Tyrode, чтобы удалить внеклеточный краситель. Дайте внутриклеточному красителю деэтерифицироваться в течение ~15-20 мин в темных условиях. Всегда поддерживайте температуру ниже 22 °C, чтобы избежать разделения красителя.
ПРИМЕЧАНИЕ: Приготовьте запас Mag-Fluo-4, AM только в диметилсульфоксиде (ДМСО) так, чтобы конечная концентрация ДМСО в загружающем растворе Tyrode была менее 0,5%. - Осветите волокно белым светодиодом (LED) и комплектом фильтров со следующими длинами волн возбуждения/дихроичности/излучения: 450-490/510/515 нм (рис. 3А).
ПРИМЕЧАНИЕ: Альтернативными источниками возбуждения являются ртутные и ксеноновые люминесцентные лампы. Используйте минимально возможную интенсивность и размер пятна возбуждения, чтобы избежать фотообесцвечивания красителя и повреждения клетки. - Вызвать отклик волокна Ca2+ (саркоплазматические переходные процессы Ca2+ ) путем подачи прямоугольных импульсов тока (0,8-1,2 мс) через два платиновых электрода, расположенных по обе стороны экспериментальной камеры при температуре 20-22 °C.
- Собирайте и сохраняйте световые сигналы с помощью 40-кратного объектива для флуоресценции с погружением в масло, подходящего для флуоресценции, и фотоумножителя (ФЭУ), подключенного к дигитайзеру (рис. 3A и дополнительное видео S6). Обеспечьте масштаб в программном обеспечении регистрации 0-200 условных единиц (АЕ) и установите флуоресценцию покоя (Frest) эксперимента на 10 а.е. по этой шкале, модулируя размер пятна возбуждения и усиление ФЭУ. После того, как процедура стандартизирована, сохраняйте коэффициент усиления неизменным от одного эксперимента к другому и устанавливайте масштаб только путем незначительных корректировок размера пятна.
ПРИМЕЧАНИЕ: Если возникают артефакты движения, используйте 20-30 мкМ N-бензил--толуолсульфаниламид (BTS) в растворе Tyrode. - Анализируйте и калибруйте сигналы следующим образом:
- Фильтр низких частот на частоте 1 кГц.
- Вычислите остаток F за 1 с трассы, установите опору F на 0 и измерьте амплитуду пиковых саркоплазматических переходных процессов Ca2+ (пик F). Представим амплитуду, как в уравнении (1):
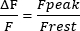 (1)
(1) - Рассчитайте пиковую концентрациюCa2+ ([Ca2+], мкМ), используя уравнение (2)26 и следующие параметры: константа диссоциации in situ (Kd) = 1,65 × 10,5 мкМ2 , максимальная флуоресценция (Fmax) 150,9 AU, минимальная флуоресценция (Fmin) 0,14 AU, концентрация Mag-Fluo-4 [D]T 229,1 мкМ26. Пик F уже был получен на шаге 4.1.8.2.
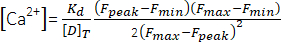 (2) См.
(2) См. - Измерьте время нарастания от 10% до 90% амплитуды (RT, мс), длительность при полумаксимуме (HW, мс) и время затухания от 90% до 10% амплитуды (DT, мс). Затем оценим кинетику распада в соответствии с биэкспоненциальной функцией (уравнение 3):
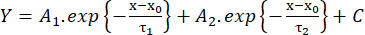 (3) См.
(3) См. - Сохраните значения временных констант распадаτ1 иτ2 (мс) и амплитудА1 иА226.
- Морфометрические измерения
- Установите чистую стеклянную горку на экспериментальную камеру ванны. Покройте предметное стекло 2-3 мкл ламинина и дайте ему высохнуть в течение 30 с, прежде чем вылить ~400 мкл суспензии волокна на предметное стекло. Дайте волокнам прилипнуть к ламинину в течение 10-15 минут при комнатной температуре.
- Вызывайте одиночные подергивания для проверки жизнеспособности волокон, применяя прямоугольные импульсы тока (0,8-1,2 мс) через два платиновых электрода, расположенных по обе стороны экспериментальной камеры. Даже при присоединении к ламинину сокращение волокон все равно видно в основном на крайних точках.
- Получение изображений живых волокон с помощью 10- и 20-кратных объективов и камеры не менее 5 мегапикселей, установленной на инвертированном флуоресцентном микроскопе. Сохраните изображения в папке . Формат TIFF для анализа в автономном режиме.
ПРИМЕЧАНИЕ: Для полного захвата длинного волокна может потребоваться набор из ~2-6 изображений. - Изображение микроскопа микрометрической калибровочной линейкой под тем же увеличением. Сохраните изображения в папке . Формат TIFF для анализа в автономном режиме.
- Измерьте длину и диаметр волокон с помощью калибровочного инструмента бесплатного программного обеспечения для анализа изображений следующим образом:
- Установите связь между пикселями и известным расстоянием (мкм) на изображениях с помощью калибровочной линейки микрометра микроскопа с помощью инструмента Анализ/Установка масштаба, как показано на дополнительном рисунке S1.
- Измерьте длину волокна один раз от одного кончика до другого и диаметры в 2-6 различных местах вдоль волокна (1-2 измерения на изображение, в зависимости от его длины), как показано на дополнительном рисунке S1.
- Сообщите значение длины (мкм или мм) и среднее значение всех диаметров (мкм), измеренных для каждого волокна.
- Исследования экспрессии тяжелых цепей миозина
ПРИМЕЧАНИЕ: Для получения подробной информации об определении MHC методом иммунофлуоресценции43 и электрофореза в додецилсульфате-полиакриламидном геле натрия (SDS-PAGE)33,44,45,46 в целых мышцах, см. Дополнительный файл 1. Протокол типирования волокон методом иммунофлуоресцентного определения MHC в суспензии FDB-изолированных волокон выглядит следующим образом:- Покройте каждое из пяти чистых стеклянных предметных стекол 2-3 мкл ламинина и дайте ему высохнуть в течение 30 с, прежде чем вылить ~300 мкл суспензии волокна на каждое предметное стекло. Дайте волокнам прилипнуть к ламинину в течение 4 часов при комнатной температуре.
- Закрепите заготовки охлажденным в морозильной камере ацетоном на 30 мин при комнатной температуре.
- Аккуратно вымойте 3 раза с помощью PBS.
- Пермеабилизацию клеточных мембран с помощью PBS с добавлением 0,7% Triton X-100 в течение 15 мин при комнатной температуре.
- Осторожно промойте 3 раза PBS с добавлением 0,2% бычьего сывороточного альбумина (BSA) и 0,04% Triton X-100, а затем заблокируйте PBS с 2% BSA, 2% козьей сыворотки и 0,4% Triton X-100 в течение 30 минут при комнатной температуре.
- Осторожно промойте 3 раза PBS с добавлением 0,2% BSA и 0,04% Triton X-100 и инкубируйте с первичными антителами следующим образом:
- Разведите каждое первичное антитело против MHC в отдельном флаконе в PBS с 1% BSA и 0,04% Triton X-100: анти-I (1:1,500), anti-II (1:600), anti-IIA (используйте цельную кондиционированную среду из гибридомы) и anti-IIB (1:500).
- Инкубируют каждое предметное стекло с одним антителом, а оставшееся предметное стекло с PBS в качестве контроля в течение 12-16 ч при 4 °C.
ПРИМЕЧАНИЕ: В этом протоколе волокна типа IIX остались немаркированными во всех образцах.
- Осторожно промойте 3 раза PBS и инкубируйте все предметные стекла со вторичным антителом (1:800), связанным с флуоресцентной зеленой молекулой, в течение 1-2 ч при комнатной температуре.
- Окрасьте ядра препаратом Hoechst в дозе 1 мкг/мл в течение 15 мин.
- Аккуратно промойте 3 раза PBS, осторожно добавьте 20-40 мкл монтажной среды и поместите покровный листок.
ПРИМЕЧАНИЕ: Щадящая замена раствора и промывка гарантируют, что десятки волокон остаются прикрепленными к предметному стеклу, что делает эксперимент статистически обоснованным. - Визуализируйте каждый слайд с помощью 10-кратного объектива, подходящего для флуоресценции, и набора фильтров со следующими длинами волн для возбуждения/дихроизма/излучения: 450-490/510/515 нм и подсчитайте все положительные и отрицательные волокна. В качестве альтернативы можно получить флуоресцентные изображения, используя те же технические условия и камеру не менее 5 мегапикселей, установленную на инвертированном флуоресцентном микроскопе, и хранить их в . Формат TIFF для анализа в автономном режиме.
- Запишите положительные и отрицательные волокна каждого слайда в базу данных и рассчитайте процентное соотношение положительных волокон I, IIA, IIB и общего количества волокон II на основе общего количества волокон, присутствующих в соответствующем слайде. Рассчитайте процентное содержание волокон IIX, вычитая сумму IIA+IIB из общего количества волокон II. Оцените процентное соотношение гибридных волокон I/IIA путем вычитания суммы I+II из значения 100%. Наконец, вычтите процент гибридных клеток из общего количества I и II, чтобы получить чистые волокна I и II типов.
ПРИМЕЧАНИЕ: В исследованиях состава MHC типы волокон обозначаются заглавной буквой, в то время как изоформы обозначаются строчной буквой46.
- Окрашивание гематоксилином и эозином
- Покройте чистое стекло 2-3 мкл ламинина и дайте ему высохнуть в течение 30 с, прежде чем вылить ~300 мкл суспензии волокна на предметное стекло. Дайте волокнам прилипнуть к ламинину в течение 4 часов при комнатной температуре.
- Закрепить препарат раствором Карнуа (60% абсолютный этанол, 30% хлороформ, 10% уксусная кислота) в течение 5 мин при комнатной температуре.
- Инкубируют с гематоксилином в течение 90 с.
- Аккуратно промойте 3 раза водой из-под крана.
- Инкубируют с 1%-ным эозином Y, приготовленным в 70%-ном этаноле, в течение 30 с.
- Аккуратно промойте 3 раза водой из-под крана.
- Погрузите 3 раза в абсолютный этанол.
- Инкубируют в ксилоле в течение 60 с.
- Добавьте 20-40 мкл монтажной среды и визуализируйте с помощью обычного микроскопа. Получайте изображения с нужным увеличением с помощью цветной камеры не менее 5 мегапикселей.
5. Статистический анализ и построение графиков
ПРИМЕЧАНИЕ: Экспериментальной единицей является мышечное волокно.
- Выражайте результаты в виде среднего ± стандартного отклонения и вычисляйте доверительные интервалы 95% (CI95%) для некоторых анализов.
- Для сравнения длины, диаметра и кинетики переходных процессов Ca2+ между группами проводят дисперсионный анализ (ANOVA) и post-hoc тесты с коррекцией Бонферрони.
- Оценивают нормальность и дисперсионное равенство с помощью критериев Шапиро-Уилка и Левена соответственно.
- Считайте различия значимыми, когда р < 0,05.
Access restricted. Please log in or start a trial to view this content.
Результаты
Саркоплазматическая концентрация Ca2+ во время подергивания
Чтобы продемонстрировать возможность проведения физиологических экспериментов с набором диссоциированных волокон и расширить наши предыдущие выводы о связях возбуждения-сокращения (ECC) и типах волокон, в во?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В дополнение к моделям, доступным для изучения биологии зрелых скелетных мышц, мы демонстрируем успешную ферментативную диссоциацию ряда мышц мышей с короткими, промежуточными и длинными волокнами. Эти волокна позволяют продемонстрировать обобщаемость кинетики MT-II переходных процес...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Авторы выражают благодарность профессору Робинсону Рамиресу из UdeA за помощь с животными и фотографиями, а также Каролине Паласиос за техническую поддержку. Йохан Пинеда из Kaika помог нам настроить цветные и флуоресцентные камеры. Шуань Нго из Университета Квинсленда любезно вычитал рукопись. Это исследование было профинансировано CODI-UdeA (2020-34909 от 22 февраля 2021года и 2021-40170 от 31 марта 2022года, SIU) и Planning Office-UdeA (E01708-K и ES03180101), Медельин, Колумбия, для JCC. Спонсоры не участвовали в сборе и анализе данных, написании или представлении рукописей.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Absolute ethanol | Sigma Aldrich | 32221 | |
| Acetone | Merck | 179124 | |
| Acrylamide | Gibco BRL | 15512-015 | |
| Ammonium persulfate | Panreac | 141138.1610 | |
| Anti myosin I antibody | Sigma Aldrich | M4276 | Primary antibody |
| Anti myosin II antibody | Sigma Aldrich | M8421 | Primary antibody |
| Anti myosin IIA antibody | American Type Culture Collection | SC-71 | Primary antibody. Derived from HB-277 hybridoma |
| Anti myosin IIB antibody | Developmental Studies Hybridoma Bank | BF-F3-c | Primary antibody |
| Bis-acrylamide | AMRESCO | 0172 | |
| Bovine serum albumin | Thermo Scientific | B14 | |
| Bradford reagent | Merck | 1.10306.0500 | |
| Bromophenol blue | Carlo Erba | 428658 | |
| Calcium carbonate | Merck | 102066 | |
| Calcium dichloride (CaCl2) | Merck | 2389 | |
| Chloroform | Sigma Aldrich | 319988 | |
| Collagenase type 2 | Worthington | CLS-2/LS004176 | |
| Consul-Mount | Thermo Scientific | 9990440 | |
| Coomassie Brilliant blue R 250 | Merck | 112553 | |
| Dimethyl sulfoxide (DMSO) | Sigma Aldrich | D2650 | |
| Dithiothreitol (DTT) | AMRESCO | 0281 | |
| Edetic acid (EDTA | AMRESCO | 0322 | |
| Eosin Y | Sigma Aldrich | E4009 | |
| Glycerol | Panreac | 1423291211 | |
| Glycine | Panreac | 151340.1067 | |
| Goat serum | Sigma Aldrich | G9023 | |
| Hematoxylin | Thermo Scientific | 6765015 | |
| HEPES | AMRESCO | 0511 | |
| Hoechst 33258 | Sigma Aldrich | 861405 | |
| Imidazole | AMRESCO | M136 | |
| Isopentane | Sigma Aldrich | M32631 | |
| Laminin | Sigma Aldrich | L2020 | |
| Mag-Fluo-4, AM | Invitrogen | M14206 | Prepared only in DMSO. Pluronic acid is not required and should not be used to avoid fiber deterioration. |
| Mercaptoethanol | Applichem | A11080100 | |
| Methanol | Protokimica | MP10043 | |
| Mice | Several | Several | For this manuscript, we only used C57BL/6 mice. However, some preliminary results have shown that the protocol works well for Swiss Webster mice of the same age and weight. |
| Mowiol 4-88 | Sigma Aldrich | 81381 | |
| N,N,N',N'-tetramethylethane-1,2-diamine (TEMED) | Promega | V3161 | |
| N-benzyl-p-toluene sulphonamide (BTS) | Tocris | 1870 | |
| Optimal cutting compound (OCT) | Thermo Scientific | 6769006 | |
| Secondary antibody | Thermo Scientific | A-11001 | Goat anti-mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 488 |
| Sodium dodecil sulfate | Panreac | 1323631209 | |
| TRIS 0.5 M, pH 6.8 | AMRESCO | J832 | |
| Tris(Hydroxymethyl)aminomethane | AMRESCO | M151 | |
| Triton X-100 | AMRESCO | M143 | |
| Materials | |||
| Dissection chamber | Custom-made | ||
| Charged slides | Erie Scientific | 5951PLUS | |
| Experimental bath chamber | Warner Instruments | RC-27NE2 | Narrow Bath Chamber with Field Stimulation, ensembled on a heated platform PH-6 |
| Fine forceps | World Precision Instruments | 500338, 500230 | |
| Fine scissors | World Precision Instruments | Vannas Scissors 501778 | |
| Glass Pasteur pipettes | Several | Fire-polished tips | |
| Glass vials with cap | Several | 2-3 mL volumen | |
| Operating scissors | World Precision Instruments | 501223-G | |
| Equipment | |||
| Centrifuge | Thermo Scientific | SL 8R | |
| Confocal microscope | Olympus | FV1000 | |
| Cryostat | Leica | CM1850 | |
| Digital camera | Zeiss | Erc 5s and Axio 305 | Axio 305, coupled to the Stemi 508 stereoscope, was used to take pictures during dissection; while Erc 5s or Axio 208, coupled to the Axio Observer A1 microscope, were used to take images of the isolated fibers and the immunofluorescence assays |
| Digitizer | Molecular Devices | 1550A Digidata | |
| Electrophoresis chamber | Bio Rad | Mini-Protean IV | |
| Inverted microscope coupled to fluorescence | Zeiss | Axio Observer A1 | Coupled to an appropriate light source, filters and objectives for fluorescence |
| Photomultiplier | Horiba | R928 tube, Hamamatsu, in a D104 photometer, Horiba | Coupled to the lateral port of the fluorescence microscope |
| Stereoscope | Zeiss | Stemi 508 | |
| Stimulator | Grass Instruments | S6 | |
| Water bath | Memmert | WNE-22 | |
| Xilol | Sigma Aldrich | 808691 | |
| Software | |||
| Free software for electrophoreses analyses | University of Kentucky | GelBandFitter v1.7 | http://www.gelbandfitter.org |
| Free software for image analysis and morphometry | National Institutes of Health | ImageJ v1.54 | https://imagej.nih.gov/ij/index.html |
| Licensed software for Ca2+ signals acquisition and analyses | Molecular Devices | pCLAMP v10.05 | https://www.moleculardevices.com |
| Licensed software for statistical analyses and graphing | OriginLab | OriginPro 2019 | https://www.originlab.com/ |
Ссылки
- Frontera, W. R., Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int. 96 (3), 183-195 (2015).
- Barclay, C., Launikonis, B. Components of activation heat in skeletal muscle. J Muscle Res Cell Motil. 42 (1), 1-16 (2021).
- Gallo-Villegas, J. A., Calderón, J. C. Epidemiological, mechanistic, and practical bases for assessment of cardiorespiratory fitness and muscle status in adults in healthcare settings. Eur J Appl Physiol. 123 (5), 945-964 (2023).
- Cardamone, M., Darras, B. T., Ryan, M. M. Inherited myopathies and muscular dystrophies. Semin Neurol. 28 (2), 250-259 (2008).
- Sánchez-Aguilera, P., et al. Role of ABCA1 on membrane cholesterol content, insulin-dependent Akt phosphorylation and glucose uptake in adult skeletal muscle fibers from mice. Biochim Biophys Acta. 1863 (12), 1469-1477 (2018).
- Cruz-Jentoft, A. J., et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 48 (1), 16-31 (2019).
- Narvaez-Sanchez, R., Calderón, J. C., Vega, G., Trillos, M. C., Ospina, S. Skeletal muscle as a protagonist in the pregnancy metabolic syndrome. Med Hypotheses. 126, 26-37 (2019).
- Gallo-Villegas, J., et al. Efficacy of high-intensity interval- or continuous aerobic-training on insulin resistance and muscle function in adults with metabolic syndrome: a clinical trial. Eur J Appl Physiol. 122 (2), 331-344 (2022).
- Close, R. Properties of motor units in fast and slow skeletal muscles of the rat. J Physiol. 193 (1), 45-55 (1967).
- Barnard, R. J., Edgerton, V. R., Furukawa, T., Peter, J. B. Histochemical, biochemical, and contractile properties of red, white, and intermediate fibers. Am J Physiol. 220, 410-414 (1971).
- Bär, A., Pette, D. Three fast myosin heavy chains in adult rat skeletal muscle. FEBS letters. 235 (1-2), 153-155 (1988).
- Schiaffino, S., et al. Myosin heavy chain isoforms and velocity of shortening of type 2 skeletal muscle fibres. Acta Physiol Scand. 134 (4), 575-576 (1988).
- Schiaffino, S., et al. Three myosin heavy chain isoforms in type 2 skeletal muscle fibres. J Muscle Res Cell Motil. 10 (3), 197-205 (1989).
- Ranatunga, K., Thomas, P. Correlation between shortening velocity, force-velocity relation and histochemical fibre-type composition in rat muscles. J Muscle Res Cell Motil. 11 (3), 240-250 (1990).
- Hämäläinen, N., Pette, D. The histochemical profiles of fast fiber types IIB, IID, and IIA in skeletal muscles of mouse, rat, and rabbit. J Histochem Cytochem. 41 (5), 733-743 (1993).
- Agbulut, O., Li, Z., Mouly, V., Butler-Browne, G. S. Analysis of skeletal and cardiac muscle from desmin knock-out and normal mice by high resolution separation of myosin heavy-chain isoforms. Biol Cell. 88 (3), 131-135 (1996).
- Bekoff, A., Betz, W. Properties of isolated adult rat muscle fibres maintained in tissue culture. J Physiol. 271 (2), 537-547 (1977).
- Bekoff, A., Betz, W. Physiological properties of dissociated muscle fibres obtained from innervated and denervated adult rat muscle. J Physiol. 271 (1), 25-40 (1977).
- Schuetze, S. M. The acetylcholine channel open time in chick muscle is not decreased following innervation. J Physiol. 303, 111-124 (1980).
- Youhanna, S., Bruton, J., Jardemark, K., Westerblad, H., Lauschke, V. M. Calcium measurements in enzymatically dissociated or mechanically microdissected mouse primary skeletal muscle fibers. STAR Protoc. 4 (2), 102260(2023).
- Wozniak, A. C., Anderson, J. E. Single-fiber isolation and maintenance of satellite cell quiescence. Biochem Cell Biol. 83 (5), 674-676 (2005).
- Anderson, J. E., Wozniak, A. C., Mizunoya, W. Single muscle-fiber isolation and culture for cellular, molecular, pharmacological, and evolutionary studies. Methods Mol Biol. 798, 85-102 (2012).
- Bolaños, P., Guillen, A., Gámez, A., Caputo, C. Quantifying SOCE fluorescence measurements in mammalian muscle fibres. The effects of ryanodine and osmotic shocks. J Muscle Res Cell Motil. 34 (5-6), 379-393 (2013).
- Lopez, R., et al. Raptor ablation in skeletal muscle decreases Cav1.1 expression and affects the function of the excitation-contraction coupling supramolecular complex. Biochem J. 466 (1), 123-135 (2015).
- Tarpey, M. D., et al. Characterization and utilization of the flexor digitorum brevis for assessing skeletal muscle function. Skelet Muscle. 8 (1), 14(2018).
- Milán, A. F., et al. Calibration of mammalian skeletal muscle Ca2+ transients recorded with the fast Ca2+ dye Mag-Fluo-4. Biochim Biophys Acta. 1865 (9), 129939(2021).
- Park, K. H., et al. Assessment of calcium sparks in intact skeletal muscle fibers. J Vis Exp. (84), e50898(2014).
- Wei-LaPierre, L., Groom, L., Dirksen, R. T. Acute exposure to extracellular BTP2 does not inhibit Ca2+ release during EC coupling in intact skeletal muscle fibers. J Gen Physiol. 154 (9), 202112976(2022).
- Banks, Q., et al. Voltage sensor movements of Ca(V)1.1 during an action potential in skeletal muscle fibers. Proc Natl Acad Sci U S A. 118 (40), 2026116118(2021).
- Jaque-Fernandez, F., et al. Preserved Ca2+ handling and excitation-contraction coupling in muscle fibres from diet-induced obese mice. Diabetologia. 63 (11), 2471-2481 (2020).
- Ravenscroft, G., et al. Dissociated flexor digitorum brevis myofiber culture system--a more mature muscle culture system. Cell Motil Cytoskeleton. 64 (10), 727-738 (2007).
- Leduc-Gaudet, J. -P., et al. MYTHO is a novel regulator of skeletal muscle autophagy and integrity. Nat Commun. 14 (1), 1199(2023).
- Calderón, J. C., Bolaños, P., Caputo, C. Myosin heavy chain isoform composition and Ca2+ transients in fibres from enzymatically dissociated murine soleus and extensor digitorum longus muscles. J Physiol. 588 (1), 267-279 (2010).
- Calderón, J. C., Bolaños, P., Caputo, C. Kinetic changes in tetanic Ca2+ transients in enzymatically dissociated muscle fibres under repetitive stimulation. J Physiol. 589 (21), 5269-5283 (2011).
- Calderón, J. C., Bolaños, P., Caputo, C. Tetanic Ca2+ transient differences between slow- and fast-twitch mouse skeletal muscle fibres: a comprehensive experimental approach. J Muscle Res Cell Motil. 35 (5-6), 279-293 (2014).
- Li, R., et al. Development of a high-throughput method for real-time assessment of cellular metabolism in intact long skeletal muscle fibre bundles. J Physiol. 594 (24), 7197-7213 (2016).
- Chemello, F., et al. Microgenomic analysis in skeletal muscle: expression signatures of individual fast and slow myofibers. PloS One. 6 (2), 16807(2011).
- Williams, D. A., Head, S. I., Bakker, A. J., Stephenson, D. G. Resting calcium concentrations in isolated skeletal muscle fibres of dystrophic mice. J Physiol. 428 (1), 243-256 (1990).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. J Vis Exp. (73), e50074(2013).
- Brun, C. E., et al. GLI3 regulates muscle stem cell entry into G(Alert) and self-renewal. Nat Commun. 13 (1), 3961(2022).
- Percie du Sert, N., et al. The ARRIVE guidelines 2.0: updated guidelines for reporting animal research. J Physiol. 598 (18), 3793-3801 (2020).
- Charles, J. P., Cappellari, O., Spence, A. J., Hutchinson, J. R., Wells, D. J. Musculoskeletal geometry, muscle architecture and functional specialisations of the mouse hindlimb. PLoS One. 11 (4), 0147669(2016).
- Enríquez, V., Granados, S., Arias, M. P., Calderón, J. C. Muscle fiber types of gluteus medius in the Colombian creole horse. J Equine Vet Sci. 35 (6), 524-530 (2015).
- Sartorius, C. A., et al. Myosin heavy chains IIa and IId are functionally distinct in the mouse. J Cell Biol. 141 (4), 943-953 (1998).
- Talmadge, R. J., Roy, R. R. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms. J Appl Physiol. 75 (5), 2337-2340 (1993).
- Hämäläinen, N., Pette, D. Patterns of myosin isoforms in mammalian skeletal muscle fibres. Microsc Res Tech. 30 (5), 381-389 (1995).
- Bolaños, P., Calderón, J. C. Excitation-contraction coupling in mammalian skeletal muscle: Blending old and last-decade research. Front Physiol. 13, 989796(2022).
- Gineste, C., et al. Enzymatically dissociated muscle fibers display rapid dedifferentiation and impaired mitochondrial calcium control. iScience. 25 (12), 105654(2022).
- Calderón, J. C., Bolaños, P., Caputo, C. The excitation-contraction coupling mechanism in skeletal muscle. Biophys Rev. 6 (1), 133-160 (2014).
- Lainé, J., Skoglund, G., Fournier, E., Tabti, N. Development of the excitation-contraction coupling machinery and its relation to myofibrillogenesis in human iPSC-derived skeletal myocytes. Skelet Muscle. 8 (1), (2018).
- Rao, L., Qian, Y., Khodabukus, A., Ribar, T., Bursac, N. Engineering human pluripotent stem cells into a functional skeletal muscle tissue. Nat Commun. 9 (1), 126(2018).
- Cea, L. A., et al. The absence of dysferlin induces the expression of functional connexin-based hemichannels in human myotubes. BMC Cell Biology. 17 (15), 127-136 (2016).
- Nakada, T., et al. Physical interaction of junctophilin and the Ca(V)1.1 C terminus is crucial for skeletal muscle contraction. Proc Natl Acad Sci U S A. 115 (17), 4507-4512 (2018).
- Cully, T. R., Edwards, J. N., Murphy, R. M., Launikonis, B. S. A quantitative description of tubular system Ca2+ handling in fast- and slow-twitch muscle fibres. J Physiol. 594 (11), 2795-2810 (2016).
- Lim, J. -Y., Frontera, W. R. Single skeletal muscle fiber mechanical properties: a muscle quality biomarker of human aging. Eur J Appl Physiol. 122 (6), 1383-1395 (2022).
- Gonzalez, E., Messi, M. L., Zheng, Z., Delbono, O. Insulin-like growth factor-1 prevents age-related decrease in specific force and intracellular Ca2+ in single intact muscle fibres from transgenic mice. J Physiol. 552, 833-844 (2003).
- Luedeke, J. D., McCall, R. D., Dillaman, R. M., Kinsey, S. T. Properties of slow- and fast-twitch skeletal muscle from mice with an inherited capacity for hypoxic exercise. Comp Biochem Physiol A Mol Integr Physiol. 138 (3), 373-382 (2004).
- Asmussen, G., Schmalbruch, I., Soukup, T., Pette, D. Contractile properties, fiber types, and myosin isoforms in fast and slow muscles of hyperactive Japanese waltzing mice. Exp Neurol. 184 (2), 758-766 (2003).
- Augusto, V., Padovani, C. R., Campos, G. E. R. Skeletal muscle fiber types in C57BL6J mice. Braz J Morphol Sci. 21 (2), 89-94 (2004).
- Wang, L. C., Kernell, D. Fibre type regionalisation in lower hindlimb muscles of rabbit, rat and mouse: a comparative study. J Anat. 199, 631-643 (2001).
- Abbassi-Daloii, T., et al. Quantitative analysis of myofiber type composition in human and mouse skeletal muscles. STAR Protoc. 4 (1), 102075(2023).
- Tulloch, L. K., Perkins, J. D., Piercy, R. J. Multiple immunofluorescence labelling enables simultaneous identification of all mature fibre types in a single equine skeletal muscle cryosection. Equine Vet J. 43 (4), 500-503 (2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены