Method Article
用于肺通气和灌注 (V/Q) 评估的相位分辨功能性肺 MRI
摘要
在这里,我们描述了相位分辨功能性肺 MRI 作为一种不含造影剂的质子 MR 技术来评估肺通气和灌注动力学。它在不同领域优势和年龄组得到验证和适用,可以通过帮助疾病量化和治疗监测来增强未来的临床决策。
摘要
傅里叶分解是一种不含造影剂的 1H MRI 方法,用于肺灌注 (Q) 和通气 (V) 评估。图像配准后,根据心脏和呼吸频率分量分析每个体素的时间序列。
使用时间分辨率为 ~300 ms 的标准 2D 变质梯度回波序列,开发了一种图像排序算法,以产生具有更高时间分辨率的相位分辨功能肺成像 (PREFUL)。因此,评估潮气量呼吸过程中的区域流容环 (FVL) 并描述心动周期期间脉搏波的传播是可行的。该方法可以使用标准 MR 硬件在 1.5T 或 3T 下应用,而无需进行序列编程,因为在大多数系统上可以使用默认的 SPGRE 序列实现所描述的协议。
PREFUL 通气 MRI 已使用 129Xe 和 19F 气体成像进行了验证,具有良好的区域一致性。灌注加权 PREFUL MRI 已使用 SPECT 和动态对比增强 (DCE) MRI 进行了验证。PREFUL 已在双中心双供应商环境中进行了测试,目前正在多项正在进行的多中心试验中得到应用。此外,它在一系列场强 (0.55T-3T) 和不同年龄组(包括新生儿)中是可行的。
定量 V/Q PREFUL MRI 已用于囊性纤维化、慢性阻塞性肺病、慢性血栓栓塞性肺动脉高压和 2019 冠状病毒病患者,以量化疾病并监测治疗后的治疗变化。此外,PREFUL V/Q 成像已被证明可以预测肺移植后患者因慢性肺同种异体移植物功能障碍而导致的移植丢失。总之,PREFUL MRI 是一种经过验证的定量通气和肺脉搏波/灌注成像技术,用于区域肺部疾病检测、量化和治疗监测,对当前临床常规具有潜在的附加值。
引言
呼吸系统具有复杂的机制,容易受到各种疾病的影响。突出的是,慢性呼吸系统疾病,如慢性阻塞性肺病 (COPD)、囊性纤维化 (CF) 和慢性血栓栓塞性肺动脉高压 (CTEPH) 会大大缩短预期寿命1。因此,早期诊断、监测和治疗反应评估变得至关重要。
肺功能测试 (PFT) 可以得出整体肺功能参数,例如 Tiffeneau-Pinelli 指数,该指数定义为一秒用力呼气容积 (FEV1) 和用力肺活量 (FVC) 的比率 (FVC)2。这些参数在临床常规中已经明确确立,但缺乏区域信息,需要高水平的患者依从性。在这方面,成像可以为更敏感的参数提供额外的见解和可能性。计算机断层扫描 (CT) 提供实质形态的高分辨率成像,参数反应映射等最新技术也可以检索功能信息3。尽管如此,单光子发射计算机断层扫描 (SPECT) 仍然是当前描述肺通气和灌注 (V/Q) 的金标准4。众所周知,上述成像方式需要暴露于电离辐射,这在监测和弱势群体的情况下需要特别考虑。因此,人们正在努力将 MRI 作为一种替代方式进行推广。
从本质上讲,肺是一个具有挑战性的 MRI 器官,因为它的质子密度低且信号衰减快5。在众多方法中,最广泛的解决方案包括使用超极化气体(例如 129Xe MRI)进行通气6 和静脉注射基于钆的造影剂应用进行灌注描述7。这些方法提供高信噪比 (SNR),是 MR 界广泛认为的金标准方法。一种较新的方法避免了任何造影剂的应用,并且在自由呼吸中与传统质子 MR 一起是可行的,总采集时间为 ~1 分钟/切片。因此,避免了造影剂的潜在不良事件和最近争论的长期影响,并且更容易传播,而无需额外的超极化和多核硬件。此外,自由呼吸采集避免了寻找适当的充气状态的问题,这可能会影响得出的通风缺陷值8 (ventilation defect values)。
这种基于间接 MR 信号的方法最早由 Zapke 等人提出,他们利用质子加权信号 S 和肺体积 V:S~1/V.9 的倒数关系,它基于将自由呼吸中获得的图像转换为一种常见的充气状态(通常处于呼气结束和吸气结束之间的中间位置)的过程,从而补偿运动并允许分析每个体素中的信号时间序列。此后,可以使用 Klimeš 等人的公式 (1) 从这些所谓的配准图像中得出通风测量值10:
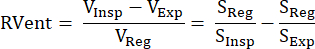 (1)
(1)
交易量/信号处于灵感 (Insp)、到期 (Exp) 和注册状态 (Reg) 中。此后,通过引入傅里叶分解来扩展该方法,以区分与呼吸频率(通气)和脉搏频率(灌注)相关的信号调制,因此,从一次采集中得出空间上完美匹配的 V/Q 图11。这是通过呼吸频率和心率之间的典型间隙实现的,因此在时域中彼此重叠的两个分量在频域中通过傅里叶分析有效区分。在从低场 (0.35T) 过渡到具有优化平衡稳态自由进动序列 (bSSFP) 的 1.5T 后12,这种方法开始受到更多关注,进行了几项后续研究 13,14,15。
由于呼吸和脉搏会发生变化,并且市售的 1.5T bSSFP(梯度补偿)成像会导致大量的条带伪影(清晰的信号空线),因此提出了一种相关方法,将破坏梯度回波序列 (SPGRE) 与宽低通和高通滤波相结合16,17.这捕获了更复杂的真实呼吸和脉搏相关调制频谱。以下时域中幅度的计算避免了选择一个特定频率峰值的必要性。通过将针对一个参考状态的典型一步配准拆分为两个单独的步骤,实现了进一步的优化。因此,在自由呼吸期间,在吸气末和呼气末之间获得了一系列不同的呼吸阶段,并且需要向固定状态变形不同程度。选择多个组并确定单个图像的组后,执行以下程序:1) 在相应的呼吸状态组内注册,2) 从一个相邻组到下一个相邻组(例如,1->2、2->3,...)的逐步组间注册代表参考组。通过对每个图像进行相位估计,这种方法进一步扩展,以建立更高的表观时间分辨率,以促进通气和灌注动力学的分析,从而产生相位分辨功能肺 (PREFUL) MR 术语,以区分该分支与其他相关技术18。随访研究利用了完整呼吸和心动周期提供的额外信息,并表明这些参数的敏感性可能增加 19,20,21。
使用金标准 SPECT 的验证显示,缺损区域22 的 dice 系数为 ≥67%,使用 129Xe 进行的更直接通气测量显示通气缺损百分比相关性 ≥ 在混合 COPD/CF/健康队列23 中为 62%,在 CF 多中心、多供应商队列24 中为 84%,这也显示出与 PREFUL 和 129Xe 的肺清除指数相似的相关性(r = 0.82 和 r = 0.91)。同一研究的灌注分析表明,在评估中心之间与 DCE 的空间重叠没有显着差异25。一项包括 9 个中心的前瞻性子研究还报告了与 DCE 的一致性和中心之间 PREFUL 结果的一致性26。对 COPD 患者的可重复性分析导致所有参数的变异系数低于 15%27。目前的研究表明,与仅考虑吸气末和呼气末阶段的"静态"通气参数相比,FVL 参数具有更高的预测能力和检测治疗变化的敏感性。在 COPD28 中,用茚达特罗-格隆溴铵 (IND/GLY) 吸入器治疗后,证明了对区域流量-体积环 (FVL) 测量治疗的反应性。一致,FVL 参数可预测双肺移植患者的移植物损失,而肺活量测定法则不能 (P = .02 vs. P = 0.33)29。首次可行性研究表明,使用标准临床 MRI 硬件可以在自由呼吸的婴儿和新生儿中实现 PREFUL 的功能性肺部成像30,31。Glandorf 等人比较了 1.5T 和 3T(SPGRE 序列)的 PREFUL 参数,发现大多数参数没有显著差异,尽管场强存在差异,但这些参数具有高度可重复性32。这可能是一个重要的优势,因为并非每个站点都可以使用 1.5T 或更低场强的扫查器。最近,通过使用 PREFUL33 评估 bSSFP 数据,证明了在 0.55T 时 COVID-19 感染后持续症状的可行性和检测。
总之,尽管 PREFUL 是一种相对较新的技术,但它已被广泛研究。评估了重要标准,例如使用更直接和既定的测量进行验证、可重复性、对病理学的敏感性以及对治疗和进展变化的反应性。尽管如此,尽管技术要求较低,但仍然只有少数专业中心在使用这种技术。因此,这项工作的目的是以书面和视觉形式总结 PREFUL MR 的最新方法。这些信息可用于在更多中心建立这项技术,因此,从长远来看,会导致更成熟的技术。
研究方案
这项研究获得了汉诺威医学院伦理委员会的批准,确保其在整个研究过程中遵守严格的伦理标准。调查严格遵循《赫尔辛基宣言》中概述的指导方针,强调医学研究的道德行为。此外,在参与 MRI 检查之前,所有研究参与者(或其父母或法定监护人)都认真获得了知情同意。有关核心方案步骤的简化概述,请参见 图 1 ,包括采集、注册、过滤和排序,最后是心脏和呼吸周期合成。在以下部分中,将详细介绍所有相关步骤。
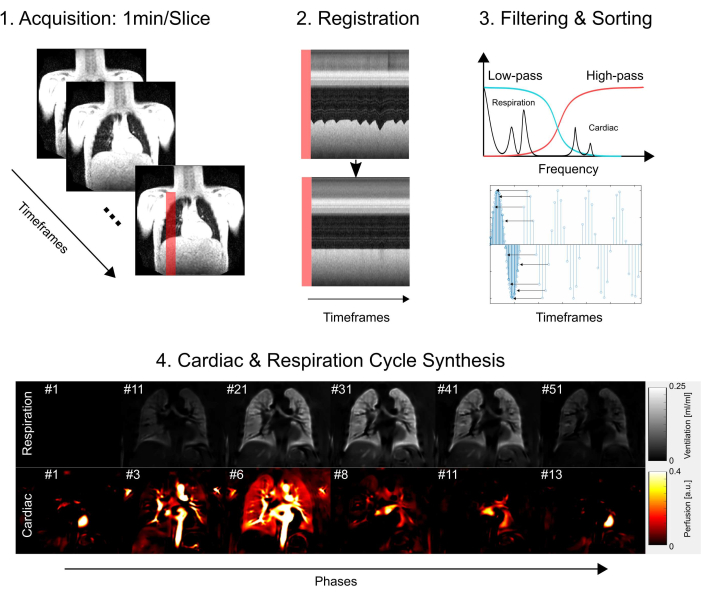
图 1:PREFUL 核心组件的示意图概述。 1) 自由呼吸采集,这需要 2) 通过配准进行运动补偿,如剖面图所示,并能够对傅里叶分量进行逐体素分析,如步骤 3) 过滤和排序所示。在低通(通气)和高通(灌注)滤波后,4) 估计相位用于将图像排序为更高的表观时间分辨率,并合成一个完整的心脏和呼吸周期。请注意,这是一个简化的大纲,手稿中描述了完整的细节。此图中省略的进一步步骤包括参数量化和报告生成。缩写:PREFUL = 相位分辨功能性肺。 请单击此处查看此图的较大版本。
1. 招聘
- 根据患者和健康对照者根据肺活量测定检查和/或既往影像学检查(例如 X 射线或 CT 扫描)诊断为肺部疾病,在 PREFUL MRI 试验中招募 成年患者或未成年人;给予知情同意的能力;能够在 MRI 扫描期间平躺并保持静止;并且没有已知的 MRI 禁忌症(例如,金属植入物、幽闭恐惧症)。
- 如果患者 怀孕、在过去 6 个月内接受过肺部手术史、有严重的呼吸窘迫或需要持续补充氧气,或者如果除了 PREFUL 之外使用造影剂,则之前对基于钆的造影剂有过不良反应。
- 如果根据临床检查和自我报告没有已知的肺部疾病史;肺功能检查正常;他们能够给予知情同意;他们能够在 MRI 扫描期间平躺并保持静止;并且没有已知的 MRI 禁忌症。
- 根据当前或过去的吸烟史、已知肺部毒素或职业危害暴露史、遗传性肺病家族史、任何可能影响肺功能的已知慢性疾病和怀孕,将个体排除在健康对照之外。
- 获取 同意书。如果从参与者那里获得书面知情同意书,其中包含研究的目的和程序、任何潜在风险和益处、保密保证、研究持续时间以及退出的权利,则继续执行协议 而不会产生任何后果。
- 当招募包括未成年人时,请应用以下附加步骤。
- 除了未成年人的同意外,还应获得至少一位父母或监护人的书面知情同意。
- 以未成年人可以理解的适合年龄的方式呈现整个过程。
- 对于年龄较小的未成年人,请使用视觉辅助工具、故事书或简化说明。
- 确保研究与年龄组相关,并且不会不必要地包括未成年人。
- 在所有与试验相关的程序中,允许未成年人由值得信赖的成年人(例如父母、监护人)陪同,除非这会影响试验的完整性。
注意:所述步骤假设试验已由伦理委员会审查和批准。
- 当招募包括未成年人时,请应用以下附加步骤。
2. 收购
- 执行预扫描安全程序。
- 在进行 MRI 之前,对患者进行详细的预筛查,以确定潜在的禁忌症,例如以前的手术、植入的装置、纹身或接触金属碎片。
- 到达后,教育患者有关手术的磁性和风险。
- 指导患者取下所有个人金属物品,包括珠宝、手表和某些衣物,并在必要时为他们提供长袍。
- 让训练有素的专业人员目视检查患者是否有被忽视的金属物体。
- 检查所有医疗设备或植入物的 MRI 兼容性。
- 确保为工作人员和患者安全制定应急协议。
- 定位参与者和扫描
- 将患者头部先定向,并将他们仰卧在 0.55T、1.5T 或 3T 系统上。
- 提供听力保护、紧急铃铛、衬垫和毯子,以确保安全和舒适。
- 将多通道柔性线圈放置在下巴正下方,以确保所有肺部区域的最佳线圈灵敏度。
- 固定线圈的位置以保持稳定性,而不会妨碍患者的呼吸。
- 指导患者闭上眼睛,然后使用 MR 激光标记肺的中心。
- 将肺中心对准等中心,让患者再次睁开眼睛。
- 扫描初始定位器以建立大致方向,然后进行横向形态学扫描以识别气管分叉。
- 将第一个冠状切片锚定在气管分叉处作为一致的标志,以提高可重复性。
- 根据扫描协议,捕获三个切片,切片到切片的距离(从边缘到边缘测量)为 100%(切片厚度),或者采集跨越整个肺的多个切片,距离为 20% 或 33%。
- 完全 单独 获取每个切片,而不是交错获取。
- 将重建后的图片上传到图片归档与通信系统 (PACS) 进行后续访问和分析。或者,为了遵守隐私和数据保护标准,请手动将图像导出到指定的网络驱动器或类似的存储解决方案。
注:有关序列协议和参数的详细信息,请参阅 表 1 和 表 2。有关 slice 定位的可视化表示,请参见 图 2。
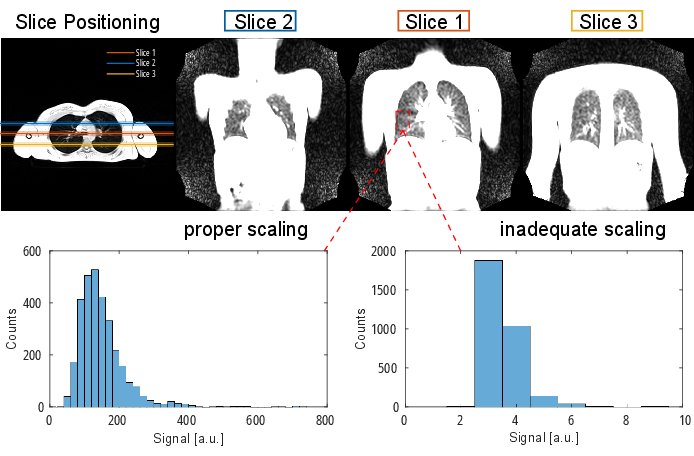
图 2:PREFUL 实验的典型切片定位,通过横向的 3D 梯度回波进行可视化。 请注意,第一个切片位于气管分叉处作为可重复的标志。第 2 个和第 3 个 切片在前后方向上以 100% 的切片间隙定位。示例直方图显示具有适当和不充分(低)缩放的值分布。后者会导致动态范围低和精度损失。还应避免导致剪辑(此处未显示)的高缩放不足。缩写:PREFUL = 相位分辨功能性肺。 请单击此处查看此图的较大版本。
表 1:PREFUL 协议的典型概述。 定位器后,在横向获得肺的 3D 体积。该采集用于规划以下 PREFUL 采集(序列设置另见 表 2 和切片定位图 2 )。可以根据研究添加其他序列。缩写:PREFUL = 相位分辨功能性肺。 请点击此处下载此表格。
表 2:梯度回波序列变质的 PREFUL 采集的序列参数摘要。缩写: PREFUL = 相位分辨功能性肺;SPGRE = 变质的梯度回波序列。请单击此处下载此表格。
3. 后处理
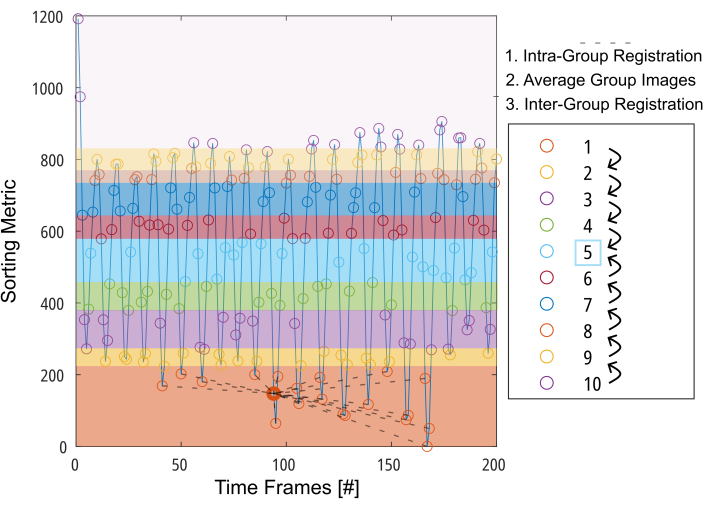
图 3:面向群的套准示意图,以最大限度地减少运动补偿所需的变形。 根据排序指标(例如,分割的肺区域)将图像(由圆圈表示)分成 10 组后,图像在每个组内注册到中间位置(由第 1 组的虚线表示)。然后,对注册的图像进行平均,并逐步用于组间注册的最后一步,以逐步向中间组进行。缩写: GOREG = 面向组的注册。 请单击此处查看此图的较大版本。
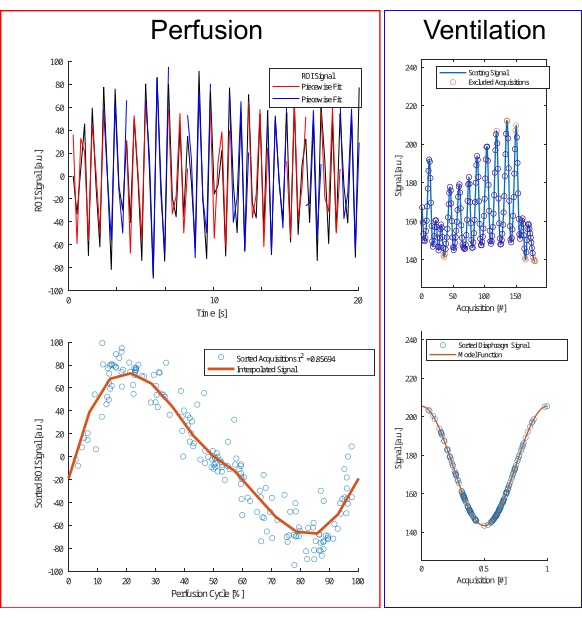
图 4:灌注和通气的分选算法图示。 对于灌注(左),执行分段拟合(上行)以估计相位并调整采集(下行)。对于通气(右),排除异常值(上行),并根据余弦模型(下行)根据振幅和振幅差异进行排序,以区分呼气期和吸气期。 请单击此处查看此图的较大版本。
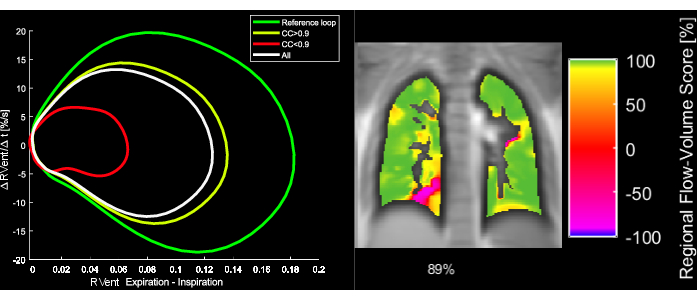
图 5:一名 43 岁女性 COPD 患者的示例性流量-体积环和相应的 FVL 相关指标。 请注意,随着 FVL 的变化,FVL-CM 会降低。缩写: FVL = 流量-体积环;FVL-CM = FVL 相关度量;COPD = 慢性阻塞性肺疾病。 请单击此处查看此图的较大版本。
表 3:阈值对参数图和缺陷图组合的应用。请点击此处下载此表格。
- 注册
注:在下一节中,描述了使用面向群体 (GOREG) 方案补偿呼吸和心脏运动的非刚性配准到参考体积(最好是中间呼吸水平)的程序。- 检索图像。
- 最初,使用经过训练的 U-Net 对所有未注册的图像进行肺分割,并应用截止值为 0.7 Hz 的低通滤波器以获得呼吸期的估计值。
注意:这将启动全自动处理管道,该管道将在后台执行后续步骤。演示和描述的处理步骤不限于特定的应用程序或语言,因此可以在具有多种编程语言的自定义应用程序中实现。 - 将大量分段体素分类为 inspiration,将少量分类为 expiration。
- 通过将图像划分为第 10 个百分位数来对图像进行分组,确保生成的 10 个组中的每一组都包含相同数量的图像。
- 选择 ANTs34(具有互相关度量的 BSplineSyN)或 Forsberg35,36(具有弹性和流体正则化的多项式展开)作为配准算法。
- 对每组进行内部配准,朝向相应组的中间肺位置。
- 对组结果进行平均,以获得每个组的一张图像。
- 从每个组图像沿第 5 组 方向向下一个邻居进行 Inter-registration。
- 根据需要将变形链应用于原始图像,以达到第 5 组中平均图像所代表的呼吸位置。例如,对于属于第 3 组的图像 36,应用了以下 变形字段 : 36->图像 57(~第 3 组中的中间肺位置)-> 步骤 3->4 ->步骤 4->5。
注意:有关 GOREG 程序的详细说明,请参阅 图 3。使用并行计算执行注册以减少处理时间。执行 GOREG 配准是为了最大限度地减少每个配准步骤所需的变形量,从而确保算法的稳定收敛。尽管如此,也可以只向中间肺位置移动一个变形步骤来进行配准。虽然所有已发表的 2D PREFUL 研究都使用 ANT,但 Forsberg 产生结果的速度提高了 6 倍,结果质量与 3D PREFUL 研究报告的质量相当37。本报告中的示例结果是通过 Forsberg 注册生成的。请参阅 图 1 以查看对振膜运动的配准效应图。
- 常规筛选
- 使用图像引导过滤38 对配准图像进行降噪,采用时间平均配准图像作为引导图像。应用以下设置: NeighborhoodSize = [10, 10],DegreeOfSmoothing = 1。
- 对于通气和灌注分析,使用 截止 值为 0.7 Hz 的低通或高通滤波器来抑制相应的其他组分。从所有进一步的处理步骤中排除前 20 张图像,量化灌注计算除外,以确保包含的时间序列中的稳定状态。
注意:如果受试者的呼吸频率高于 ~40 次呼吸/分钟,则可能需要更改截止值。
- 分割
注意:最终分割是使用中间肺位置的注册图像在两步程序中进行的,如下所述。- 使用经过训练的 U-Net 或手动对时间平均的注册图像进行肺边界(肺 ROI)分割。
- 然后,排除大型中央血管以细化肺边界分割并获得肺实质的感兴趣区域或 ROI。
- 灌注
注意:需要以下步骤来精确估计采集系列中每张图像的心脏相位,这些图像以相对较低的频率(~3-5 张图像/秒)采样,尤其是与心率(通常为 40-90 bpm)相比。根据确定的心脏相位重新排列数据用于获得具有增强时间分辨率的完整心动周期,超过了数据采集的采样率18 (有关排序过程的说明,请参阅 图 4 )。对于相位估计,需要具有强灌注加权信号的搜索 ROI。采用如下迭代搜索算法22.- 连接肺边界 ROI 以将纵隔包含在搜索 ROI 中。
- 通过计算整个图像序列的标准差来生成简单的灌注加权图。
- 在搜索 ROI 中确定与此地图的第 98 个百分位数对应的区域,作为后续步骤的种子 ROI。
- 执行分段拟合,只要拟合性能提高,就可以增加种子点的大小。
- 根据扩展的种子 ROI 的拟合性能对扩展的种子 ROI 进行排名。
- 以迭代方式将最佳扩展的种子 ROI 与次优、第三好的种子 ROI 等组合在一起,直到组合没有改善指标或考虑所有种子 ROI。将最终的 ROI 视为用于心脏相位估计的血管 ROI。
- 在优化的相位估计内对信号进行空间平均,以生成一个用于相位估计的信号时间序列。
- 通过使用信号的局部最大值将信号分割成更小的部分,然后考虑幅度、相位偏移和频率等参数进行分段正弦拟合,执行分段估计(图 4)。
- 对图像进行相位排序以表示一个心动周期。
- 使用高斯核 (sigma = 0.1) 的 Nadaraya-Watson 核回归将 15 个相位插值到包含单个心动周期的均匀间隔时间网格上。
注意:请参阅 图 1 了解健康志愿者的示例合成完整心动周期的子集,从舒张期开始,过渡到收缩期,然后返回舒张期。
- 通风
注:对于灌注分析,请注意心脏频率保持相对稳定,振幅变化可以忽略不计。相比之下,通气往往在潮气量和频率方面发生更多变化,导致不同的呼吸状态,相同的呼吸相位并不总是具有相同的振幅。受 Fischer 等人的自门控方法的启发,根据信号振幅对通气进行分类至关重要。- 使用经验规则排除极端异常值(低于第 5 个百分位数或高于第 97 个百分位数的数据)。
- 从为配准分组创建的信号时间序列中导出幅度范围 R 和偏移量 C。
- 定义一个模型函数 A(t),其频率为任意选择频率 f呼吸 (此处为 0.3 Hz):
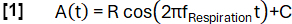
- 根据斜率将数据分类为 inspiration 和 expiration 状态。
- 根据模型功能实现更精细的相位确定:
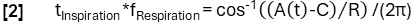
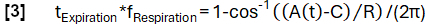
- 随后,根据样本的阶段对齐样本,并应用 Nadaraya-Watson 核回归来计算呼吸周期中均匀间隔的通气。
- 与方程 1 类似,计算每个阶段的区域通风 (RVent),用相应的阶段代入吸气阶段。
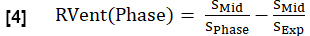
注意:请参阅 图 1 以查看健康志愿者的示例合成完整呼吸周期的子集,从呼气开始,过渡到吸气,然后返回到呼气。有关排序算法的图示,请参阅 图 4。
- 参数计算
注意:使用合成的完整呼吸和心动周期,可以推导出进一步的参数。下面介绍了一些最重要的参数。 - 区域通风 (RVent)
- 使用吸气期根据以下公式导出 RVent:
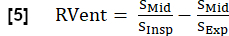
- 使用吸气期根据以下公式导出 RVent:
- 流量-体积-环相关指标 (FVL-CM)
注意:为了评估所有呼吸阶段,执行一系列步骤以生成相当于 FVL 分析的 MRI,类似于肺功能测试。- 使用 RVent 的第一次导数计算区域通风斜率 (RVent) 作为流量的代理项。采用步长为 h 的对称差分商:
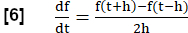
- (可选)将区域或平均 RVent 坡度显示为相应 RVent 的函数,从而生成与 FVL 分析等效的 PREFUL。
- 通过确定肺实质 ROI 中 RVent 值在第 80 到第 90 个百分位范围内的最大连接区域来确定参考 ROI。
- 对确定的参考 ROI 内的流量-体积循环进行平均。
- 为了确定每个肺 FVC 与参考的相似性,将肺实质 ROI 中的每个 FVC 与参考交叉相关,零滞后:
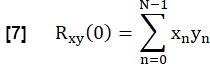
- 根据以下内容对其进行归一化:
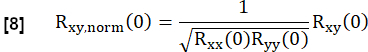
此处,x 和 y 表示参考和相应的 RVent 流曲线。
注意:请注意,采用零滞后,因此延迟通气会导致较低的相关性。
注:请参阅 图 5 了解 FVL 计算和派生的 FVL-CM 指标的图示。
- 使用 RVent 的第一次导数计算区域通风斜率 (RVent) 作为流量的代理项。采用步长为 h 的对称差分商:
- 定量灌注
注:根据 Glandorf 等人使用在瞬态36 期间采集的第一张图像进行定量。- 使用步骤 3.1.2 中计算的肺体素量 A 将前四个注册图像标准化到中间吸气水平。由质子密度变化引起的调制减少表示为:
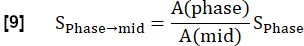
- 使用以下模型执行指数拟合以估计与最大磁化强度相关的信号:
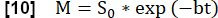
- 使用心动周期期确定与实质灌注相关的图 Q,该阶段显示肺实质 ROI 中的最大信号。
- 对于区域血液分数 (BF) 的估计,通过对搜索 ROI(全血体素)中第 99.99 个百分位数以上的值进行平均,对 S0 值进行归一化:
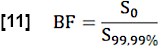
- 通过考虑稳态 (SS) 和初始状态之间的最大中值信号差(由 S0 确定)与流量相关信号差 Q 的比率,估计心动周期期间的交换分数 (EF):
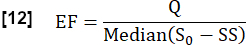
- 使用傅里叶分析(频率对应于最大峰值)从血管 ROI 确定心脏频率 f心脏 1/s。
- 以 mL·min-1∙100 mL-1 为单位计算最终定量灌注 (QQ),如下所示:
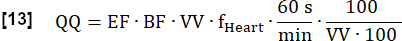
注:此处,体素体积 (VV) 被取消 [mL/mL],转换因子 60 s/min 和常规因子 100/100 用于在 [mL∙min-1∙100 mL-1] 中显示最终结果。EF 和 BF 是无量纲比率。
- 使用步骤 3.1.2 中计算的肺体素量 A 将前四个注册图像标准化到中间吸气水平。由质子密度变化引起的调制减少表示为:
- 阈值和统计信息
- 用平均值(所有值/中间切片值)和标准偏差(所有值/仅中间切片值)统计描述中间切片和所有切片的上述参数。
- 此外,将标准差归一化为变异系数,以获得离差的相对解释。选择平均值和变异系数作为最终统计输出。
- 将阈值应用于参数映射,以生成缺陷图并导出缺陷百分比值(参见 表 3)。
- 将低于阈值的值分类为通气或灌注缺陷 (VD/QD)。进一步组合这些映射以量化缺陷和正常区域(V/Q 类别)的重叠,包括 表 3 中四折表所示的以下组合:
- 计算通气缺陷 (VD)、灌注缺陷 (QD) 和通气/灌注 (V/Q) 类别的缺陷百分比,作为与总肺实质体素相关的相应类别的体素数量:
缺陷百分比 = #DefectVoxels/#LungParenchyma - 计算每个切片和复合冠状切片的缺陷百分比。对于这项研究,选择组合方法,其中通气缺损由 OR 操作确定:VD = VD(RVent) 或 VD(FVL-CM)。
注:所述分析是使用 Forsberg 配准工具箱通过商业软件应用程序(参见 材料表)进行的。
| 参数 | 门槛 | 评论 |
| RVent | 第 90个 百分位数 * 0.4 | 自适应阈值 |
| FVL-CM 系列 | 90% | 固定阈值 |
| Q | 第 90个 百分位数 * 0.15 | 自适应阈值 |
| V/Q | 无 QD | QD |
| 无 VD | 正常 | VQ 失配(仅 QD) |
| VD (垂直) | VQ 失配 (Exclusive VD) | VQ 缺陷匹配 |
结果
图 2 的下半部分说明了适当和不适当的缩放的后果,以及对动态范围的相应影响。图 6 显示了不均匀的信号分布,这代表了没有线圈归一化和有线圈归一化的扫描。建议避免使用低动态范围和没有线圈归一化的图像。
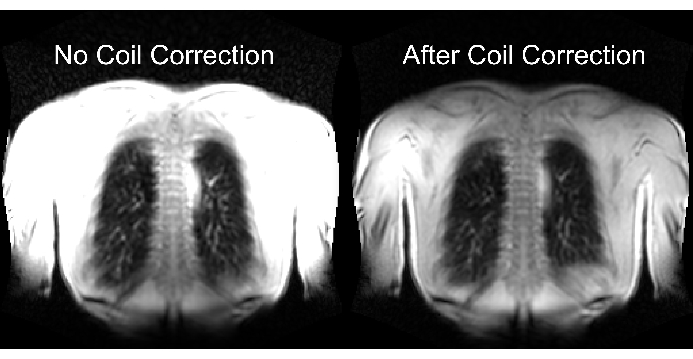
图 6:采集后未进行线圈校正(不正确)和有线圈校正(正确)的示例图像。 请注意线圈元件附近体边界处的人工信号增强。 请单击此处查看此图的较大版本。
图 7 说明了成功和失败的自动分段。请注意,失败的分割不包括所有肺体素,这将使进一步的分析和统计证伪。对于有渗透的情况需要特别小心,因为这样的体素可能会被 AI 模型误类为血管,因为它们的信号很高,或者根本没有被分割。
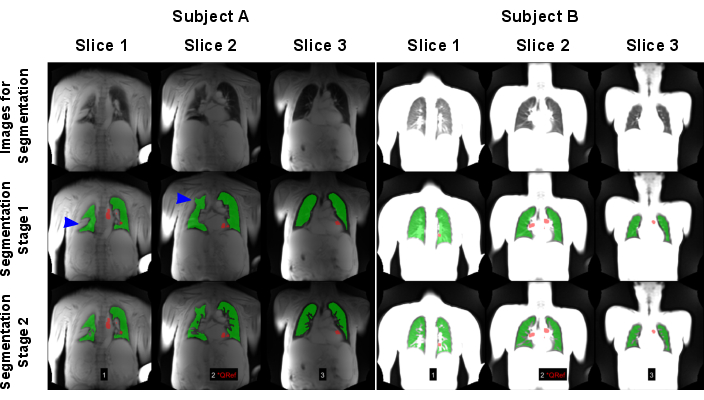
图 7:自动分割导致失败(受试者 A:83 岁男性患有 COPD)和成功结果(受试者 B:30 岁女性健康对照)的示例。 第一行显示用作 AI 模型输入的图像。第二行显示了第一个分割阶段的结果,包括寻找肺边界。第三行显示排除容器后的最终结果。如蓝色箭头所示,该算法受到高信号肺方差导致错误肺边界检测的挑战。请注意,图像是通过最大信号进行归一化的,由于对受试者 A 执行的扫描缺少线圈归一化,这导致了不同的结果。红色区域显示了 ROI,这些 ROI 被自动检测到以进行灌注阶段排序。缩写: COPD = 慢性阻塞性肺疾病;ROIs = 感兴趣的区域。 请单击此处查看此图的较大版本。
图 8 和 图 9 显示了健康对照 (30 岁,女性) 和 COPD 患者 (60 岁,男性) 的代表性参数图。请注意,正常对照显示出更均匀的通气和灌注,因此缺陷体素更少。 表 4 和 表 5 中提供了 ROI 统计数据的相应报告。
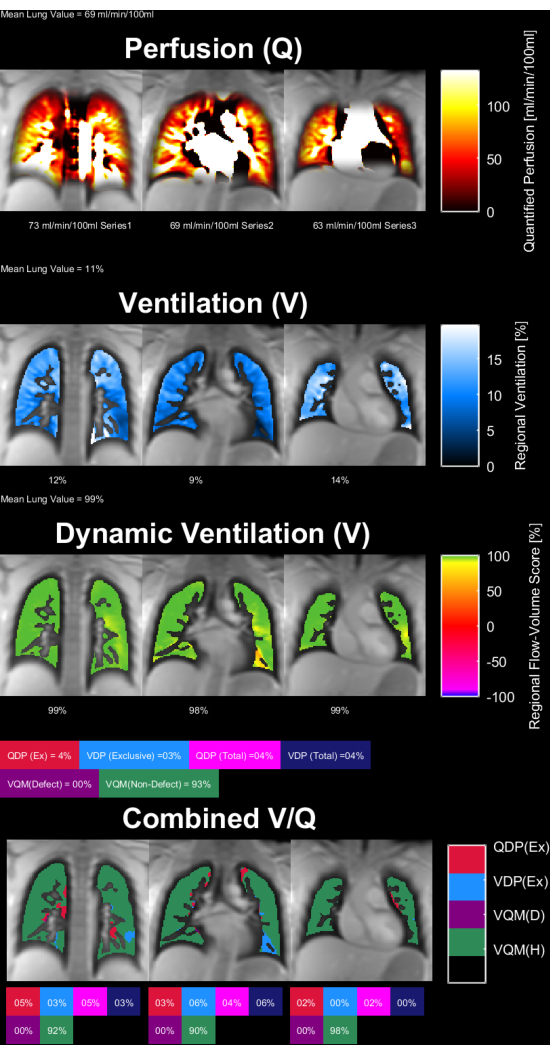
图 8:30 岁女性健康对照的 PREFUL 参数图。 灌注(第 1 行)、区域通气(第 2 行)、流量-体积环相关指标(第 3 行)和阈值 V/Q 图(第 4 行)。注意实质值的均匀分布和低缺陷百分比。缩写: PREFUL = 相位分辨功能性肺;V = 通风;Q = 灌注。 请单击此处查看此图的较大版本。
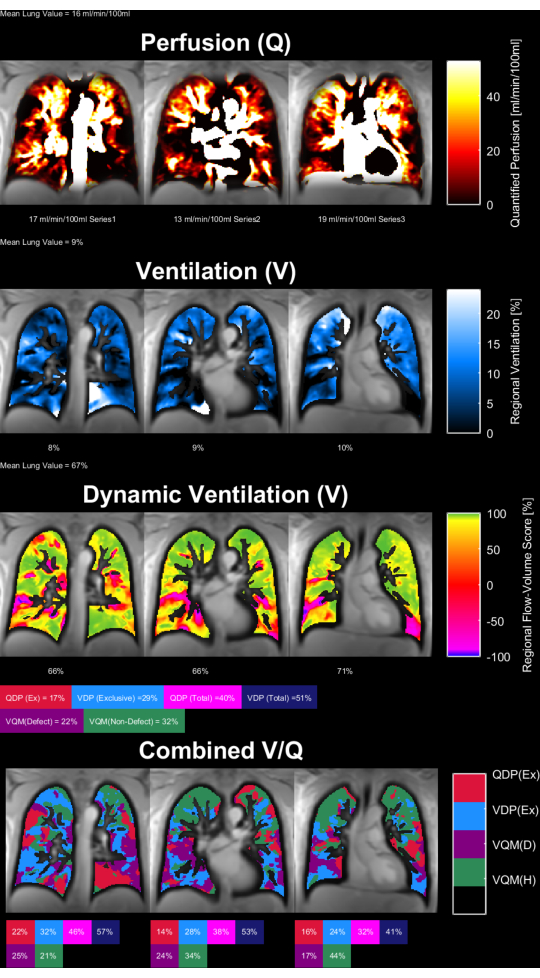
图 9:一名 60 岁男性 COPD 患者的 PREFUL 参数图。 灌注(第 1 行)、区域通气(第 2 行)、流量-体积环相关指标(第 3 行)和阈值 V/Q 图(第 4 行)。注意实质值的异质分布和高缺陷百分比。缩写: COPD = 慢性阻塞性肺疾病;PREFUL = 相位分辨功能性肺;V = 通风;Q = 灌注。 请单击此处查看此图的较大版本。
表 4:为健康对照(30 岁女性)获得的 PREFUL 参数的示例报告。 请注意低变异系数和缺陷值,它们与 图 8 中针对同一主题提供的参数图一致。另请参阅 表 5 和 图 9。缩写:PREFUL = 相位分辨功能性肺。 请点击此处下载此表格。
表 5:COPD 患者 (60 岁男性) 获得的 PREFUL 参数的示例报告。 请注意,高变异系数和缺陷值与 图 9 中针对同一主题提供的参数图一致。另请参见 表 4 和 图 8。 请点击此处下载此表格。
补充材料: PREFUL 算法的动画解释。请点击此处下载此文件。
讨论
关键步骤
采集过程中最常见的陷阱之一是信号缩放不充分,这会导致数字数据表示精度降低,从而导致 DICOM 转换过程中的信息丢失。因此,这可能会导致后处理阶段出现问题。另一个更关键的陷阱是以交错方式获取多个切片。因此,单个切片的有效时间分辨率会大大降低。此外,根据切片的距离,这可能会对灌注对比度和定量产生影响,因为流入依赖于没有磁化历史的新鲜自旋。在方案设置过程中需要特别小心,尤其是在梯度强度、不对称回波、带宽和并行成像方面。即使只是这些参数中的一个与建议设置的偏差也可能导致 TE 和时间分辨率不足。
后处理由多个步骤组成,应按所述顺序执行。例如,低通滤波后的注册没有意义。因此,一个步骤的失败会导致后续步骤的崩溃。这使得注册阶段尤为重要。由于没有单一的注册算法,因此根据各自的实现,必须根据经验设置参数。如果不对这些参数进行微调,错误注册将阻止生成任何有意义的结果。后处理过程中另一个可能耗时且关键的步骤是分割。错误的分割会导致最终报告中的参数计算完全错误(例如,包括非肺区域)。这种错误分割更可能发生在深度学习算法中,深度学习算法习惯于某些图像外观,并应用于来自其他供应商/机器的图像,但外观略有不同。因此,必须对分割精度进行视觉质量检查,并可能进行手动校正。
故障 排除
典型的故障排除过程是逐个执行所有步骤,并检查中间结果的合理性。主要步骤的步骤如下:检查图像是否以正确的顺序和设置在自由呼吸中采集。接下来,检查信号的动态范围是否合适(肺实质中为 ~50 AU)。如果原始数据仍然可用,请使用适当的缩放因子重复图像的重建,而无需重新采集数据。检查是否执行了配准,没有主要伪影和剩余运动。接下来,检查小的 ROI 是否显示具有预期通气和灌注相关调节的时间序列。然后,检查应用的滤波器是否以预期的方式更改图像(例如,低通滤波数据中没有高频调制)。检查合成的呼吸和心动周期是否是生理性的,并且没有显示突然跳跃。检查分割精度。请注意,一旦确定了出现问题的主要步骤,就可能需要在更精细的分辨率级别上进行搜索。
局限性
尽管已知所提出的协议会产生可重复和敏感的结果,但在采集和后处理过程中涉及的步骤和参数的数量允许几乎无穷无尽的优化并且交织在一起。因此,应采用自下而上的方法,首先解决序列协议的优化问题(例如,关于 SNR 和功能对比度噪声比)。对于以下后处理优化,数字肺模型形式的预定义真值可能有用40。如前所述,该模型模拟了自由呼吸采集,并包括几个类来模拟通气/灌注缺陷。包括已知的移动引起的变形,也可以直接测试配准算法。尽管有这些优势,但每个模型本身都受到将复杂现实映射到有限和简化模型的准确性的限制。
通过实证分析发现,该方案中提出的阈值对健康志愿者和不同患者队列显示了合理的结果。然而,如前所述,可能需要根据序列、场强和队列进行调整。
PREFUL 的一个普遍限制是广泛的后处理,尽管 Siemens Healthineers 和 BioVisioneers 的第一批正在进行的版本可用于科学合作/商业环境中的科学目的,但目前还不能作为医疗产品获得。计算通常涉及并行处理,这对 CPU 和 RAM 的要求特别高,并且可能需要现代工作站或服务器解决方案来有效地处理大量数据。此外,耗时的后处理步骤目前阻碍了结果的即时呈现,这对于临床工作流程来说是可取的。
与其他方法的比较
有许多类似的方法,如 PREFUL,包括前身傅里叶分解及其其他衍生方法,如矩阵铅笔分解41 和略有不同的方法自门控非造影剂增强功能性肺 MRI (SENCEFUL MRI)42。虽然傅里叶分解和类似方法在频域中运行,但 PREFUL 使用不太严格的傅里叶滤波和随后在时域中计算幅度。因此,不需要选择与通气/灌注相对应的特定峰。这可能导致对呼吸变异性的敏感性降低,已知呼吸变异性发生在人类受试者中。
PREFUL 执行图像排序,而 SENCEFUL 使用 k 空间行排序,从而带来更大的灵活性。尽管如此,SENCEFUL 需要具有自设门功能的序列,而 PREFUL 可以使用传统的变质梯度回波序列来执行。同样,基于傅里叶分解的方法中常用的 bSSFP 以更好的 SNR 和血流对比度而闻名,但通常需要对肺采集进行更多优化,尤其是在 3T43 时。尽管如此,除此之外,没有理由不将 PREFUL 与 bSSFP 收购44 合并。
所有这些基于信号的方法都假设某些不需要的信号影响,包括 T1、T2/T2*、扩散、通过平面运动和非正交灌注体素,可以忽略不计。虽然 PREFUL 的进展验证间接表明这种影响确实并不重要,但 Triphan 等人表明存在对有效 T1 和 TE 的依赖性,这可以通过取决于 TE45 的血液和实质成分的不同权重来解释。有鉴于此,与 SPGRE 更简单的造影剂机制相比,bSSFP 在 T2/T1 造影剂造影剂中可视化血液的初始优势可能会带来额外的挑战,即建立准确的定量。尽管如此,直接解决各种 MR 变量影响的进一步研究是可取的,例如,Glandorf 等人对造影剂46,47 进行的研究,因为它们可以直接量化对 PREFUL 的影响。
重要性
作为一种自由呼吸、无造影剂介质的方法,PREFUL 与前面提到的相关方法具有许多优点:1) 无需电离辐射和造影剂应用,2) 不需要额外的硬件或人员,3) 采集,这仅取决于最低的患者依从性。这些优势使 PREFUL 成为一种方便的监测工具,特别是对于患有慢性肺病的儿童等弱势群体。尽管 SPGRE 序列的 SNR 较低,但可用性和对额外序列编程/共享的缺乏要求进一步促进了这种方法的传播。
正如引言部分所讨论的,显示良好验证、可重复性、灵敏度结果和监测能力的研究数量表明,该技术和相应的动态参数的重要性正在上升,并将得到广泛传播的进一步支持。
披露声明
Filip Klimeš、Andreas Voskrebenzev 和 Jens Vogel-Claussen 是 BioVisioneers GmbH 的股东,该公司对肺磁共振成像方法感兴趣。
致谢
这项工作由德国肺研究中心 (DZL) 资助。作者要对所有为 PREFUL 的进一步发展做出贡献和支持的人表示深深的感谢,特别是:Marcel Gutberlet、Till F. Kaireit、Lea Behrendt、Julian Glandorf、Sonja Lüdiger、Tawfik Moher Alsady、Katharina Bünemann、Marius Wernz、Robin Müller、Maximilian Zubke、Gesa Pöhler、Agilo Kern、Cristian Crisosto、Milan Speth、Arnd Obert、Julienne Scheller、 吉姆·怀尔德、埃德温·范·贝克、海伦·马歇尔、延斯·戈特利布、玛莎·多纳、黛安·伦茨、安娜-玛丽亚·迪特里希、托比亚斯·韦尔特、延斯·霍尔菲尔德、帕特里克·扎尔多、贾尔斯·桑特、弗朗茨·沃尔夫冈·赫希、罗伯特·格林、巴斯蒂安·比尔、巴塞姆·伊斯梅尔、安德烈·费舍尔、贝特霍尔德·基弗、格雷戈尔·托尔默和丽贝卡·兰布。此外,作者还要感谢放射技师和研究参与者。我们特别感谢放射学系(汉诺威医学院)的 Frank Schröder 和 Sven Thiele 在进行 MRI 检查方面提供的出色技术帮助。
材料
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
参考文献
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。