Method Article
Phasenaufgelöste funktionelle Lungen-MRT zur Beurteilung der Lungenbeatmung und -perfusion (V/Q)
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird die Implementierung der phasenaufgelösten funktionellen Lungen-MRT als kontrastmittelfreie Protonen-MRT-Technik zur Beurteilung der Lungenventilations- und Perfusionsdynamik beschrieben. Validiert und anwendbar in verschiedenen Fachgebieten und Altersgruppen, könnte es die klinische Entscheidungsfindung in Zukunft verbessern, indem es bei der Quantifizierung von Krankheiten und der Therapieüberwachung hilft.
Zusammenfassung
Die Fourier-Zerlegung ist eine kontrastmittelfreie 1H-MRT-Methode zur Beurteilung der Lungenperfusion (Q) und der Beatmung (V). Nach der Bildregistrierung wird die Zeitreihe jedes Voxels hinsichtlich der Herz- und Atemfrequenzkomponente analysiert.
Unter Verwendung einer standardmäßigen 2D-verwöhnten Gradienten-Echo-Sequenz mit einer zeitlichen Auflösung von ~300 ms wurde ein Bildsortierungsalgorithmus entwickelt, um eine phasenaufgelöste funktionelle Lungenbildgebung (PREFUL) mit erhöhter zeitlicher Auflösung zu erstellen. So ist es möglich, regionale Strömungsvolumenschleifen (FVL) während der Tidalvolumenatmung auszuwerten und die Ausbreitung der Pulswelle während des Herzzyklus abzubilden. Diese Methode kann bei 1,5 T oder 3 T mit Standard-MR-Hardware angewendet werden, ohne dass eine Sequenzprogrammierung erforderlich ist, da das beschriebene Protokoll auf den meisten Systemen mit der Standard-SPGRE-Sequenz implementiert werden kann.
Die Beatmungs-MRT von PREFUL wurde mit 129Xe und 19F Gasbildgebung mit guter regionaler Übereinstimmung validiert. Die perfusionsgewichtete PREFUL-MRT wurde sowohl mit SPECT als auch mit dynamischer kontrastverstärkter (DCE) MRT validiert. PREFUL wurde in einer Dual-Center-Dual-Vendor-Umgebung getestet und wird derzeit in mehreren laufenden multizentrischen Studien eingesetzt. Darüber hinaus ist es über eine Reihe von Feldstärken (0,55 T-3 T) und verschiedene Altersgruppen, einschließlich Neugeborener, durchführbar.
Die quantitative V/Q PREFUL MRT wurde bei Patienten mit Mukoviszidose, chronisch obstruktiver Lungenerkrankung, chronischer thromboembolischer pulmonaler Hypertonie und Corona-Virus-Krankheit-2019 eingesetzt, um die Krankheit zu quantifizieren und die Behandlungsänderung nach der Therapie zu überwachen. Darüber hinaus wurde gezeigt, dass die PREFUL V/Q-Bildgebung bei Patienten nach einer Lungentransplantation einen Transplantatverlust aufgrund einer chronischen Lungenallotransplantat-Dysfunktion vorhersagen kann. Zusammenfassend lässt sich sagen, dass PREFUL MRT eine validierte Technik für die quantitative Beatmung und die pulmonale Pulswellen-/Perfusionsbildgebung für die regionale Erkennung, Quantifizierung und Behandlungsüberwachung von Lungenerkrankungen mit potenziellem Mehrwert für die aktuelle klinische Routine ist.
Einleitung
Das Atmungssystem mit seinen komplizierten Mechanismen ist anfällig für verschiedene Krankheiten. Vor allem chronische Atemwegserkrankungen wie chronisch obstruktive Lungenerkrankung (COPD), Mukoviszidose (CF) und chronische thromboembolische pulmonale Hypertonie (CTEPH) reduzieren die Lebenserwartung erheblich1. Infolgedessen sind eine frühzeitige Diagnose, Überwachung und Bewertung des therapeutischen Ansprechens von größter Bedeutung geworden.
Lungenfunktionstests (PFTs) können globale Lungenfunktionsparameter wie den Tiffeneau-Pinelli-Index ableiten, der als Verhältnis des forcierten exspiratorischen Volumens in einer Sekunde (FEV1) und der forcierten Vitalkapazität (FVC) definiert ist2. Solche Parameter sind in der klinischen Routine gut etabliert, aber es fehlen regionale Informationen und sie erfordern ein hohes Maß an Compliance der Patienten. In dieser Hinsicht kann die Bildgebung zusätzliche Erkenntnisse und Möglichkeiten für empfindlichere Parameter bieten. Die Computertomographie (CT) bietet eine hochauflösende Bildgebung der parenchymalen Morphologie, und neuere Techniken wie das parametrische Response-Mapping liefern ebenfalls funktionelle Informationen3. Dennoch bleibt die Einzelphotonen-Emissions-Computertomographie (SPECT) der aktuelle Goldstandard für die Darstellung von Ventilation und Perfusion (V/Q) in der Lunge4. Die für alle genannten bildgebenden Verfahren ist allen gemeinsam, dass sie einer Exposition gegenüber ionisierender Strahlung ausgesetzt sind, was bei der Überwachung und bei gefährdeten Gruppen besonders zu berücksichtigen ist. Daher gibt es anhaltende Bemühungen, die MRT als alternative Modalität zu fördern.
Von Natur aus ist die Lunge aufgrund ihrer geringen Protonendichte und ihres schnellen Signalzerfalls ein schwieriges Organ für die MRT5. Zu den am weitesten verbreiteten Lösungen gehören unter der Vielzahl von Ansätzen die Verwendung von hyperpolarisiertem Gas (z. B. 129Xe MRT) für die Beatmung6 und die intravenöse Gadolinium-basierte Kontrastmittelapplikation für die Perfusionsdarstellung7. Diese Methoden bieten ein hohes Signal-Rausch-Verhältnis (SNR) und gelten in der MRT-Gemeinschaft weithin als Goldstandardmethoden. Ein neuerer Ansatz vermeidet den Einsatz von Kontrastmittel und ist mit konventioneller Protonen-MR in freier Atmung mit einer Gesamtaufnahmezeit von ~1 min/Scheibe durchführbar. Auf diese Weise werden potenzielle unerwünschte Ereignisse und kürzlich diskutierte Langzeitwirkungen von Kontrastmitteln vermieden und eine einfachere Verbreitung ohne zusätzliche Hyperpolarisation und multinukleare Hardware ermöglicht. Zusätzlich wird das Problem der Suche nach einem adäquaten Aufblaszustand, der die abgeleiteten Beatmungsdefektwerte8 beeinflussen kann, durch die freiatmende Erfassung vermieden.
Dieser indirekte MR-Signal-basierte Ansatz wurde erstmals von Zapke et al. eingeführt, die die reziproke Beziehung zwischen protonengewichtetem Signal S und Lungenvolumen V nutzten: S~1/V.9 Er basiert auf dem Prozess der Umwandlung von Bildern, die bei freier Atmung aufgenommen wurden, in einen gemeinsamen Aufblaszustand (typischerweise in einer Zwischenposition zwischen Endausatmung und Endinspiration), wodurch die Bewegung kompensiert und die Signalzeitreihen in jedem Voxel analysiert werden können. Danach kann aus diesen sogenannten registrierten Bildern mit Hilfe von Gleichung (1) von Klimeš et al.10 eine Lüftungsmessung abgeleitet werden:
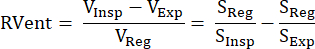 (1)
(1)
Mit den Volumina/Signalen in Inspiration (Insp), Ablauf (Exp) und registriertem Zustand (Reg). Danach wurde das Verfahren durch die Einführung der Fourier-Zerlegung erweitert, um zwischen Signalmodulationen, die mit der Atemfrequenz (Ventilation) und der Pulsfrequenz (Perfusion) assoziiert sind, zu differenzieren und somit eine perfekt räumlich abgestimmte V/Q-Karte aus einer Erfassungabzuleiten 11. Möglich wird dies durch die typische Lücke zwischen Atem- und Herzfrequenz, so dass beide Komponenten, die im Zeitbereich übereinander liegen, im Frequenzbereich durch die Fourier-Analyse effektiv unterschieden werden. Nach dem Übergang vom Tieffeld (0,35 T) zu 1,5 T mit einer optimierten balancierten Steady-State-freien Präzessionssequenz (bSSFP)12 gewann diese Methode mit mehreren Folgestudien zunehmend an Aufmerksamkeit 13,14,15.
Da Atmung und Puls einer Variabilität unterliegen und die kommerziell erhältliche bSSFP-Bildgebung (gradientenkompensiert) bei 1,5 T zu erheblichen Banding-Artefakten (klare Linien der Signalleere) führen kann, wurde eine verwandte Methode mit Spoiled Gradient Echo Sequence (SPGRE) in Kombination mit breiter Tiefpass- und Hochpassfilterung vorgeschlagen16,17. Damit wird das komplexere Spektrum realer atem- und pulsbezogener Modulationen erfasst. Die folgende Berechnung der Amplitude im Zeitbereich vermeidet die Notwendigkeit, eine bestimmte Frequenzspitze auszuwählen. Eine weitere Optimierung wurde durch die Aufteilung der typischen einstufigen Registrierung in Richtung eines Referenzzustands in zwei separate Schritte erreicht. Dabei wird die Tatsache ausgenutzt, dass während der freien Atmung eine Reihe unterschiedlicher Atmungsphasen zwischen Endinspiration und Endexspiration mit unterschiedlichen Graden der erforderlichen Verformung hin zu einem festen Zustand erworben werden. Nach der Auswahl mehrerer Gruppen und der Identifizierung der Gruppe der einzelnen Bilder wird folgendes Verfahren durchgeführt: 1) Registrierung innerhalb der jeweiligen Atmungszustandsgruppe, 2) Schritt-für-Schritt-Registrierung zwischen den Gruppen von einer benachbarten Gruppe zur nächsten (z.B. 1->2, 2->3,...) zu der Gruppe, die die Referenzgruppe repräsentiert. Dieser Ansatz wurde durch eine Phasenschätzung für jedes Bild weiter erweitert, um eine höhere scheinbare zeitliche Auflösung zu erreichen, um die Analyse der Beatmungs- und Perfusionsdynamik zu erleichtern, was zu der Terminologie der phasenaufgelösten funktionellen Lunge (PREFUL) führte, um diesen Zweig von anderen verwandten Techniken zu unterscheiden18. Follow-up-Studien nutzten die zusätzlichen Informationen, die durch den vollständigen Atmungs- und Herzzyklus geliefert wurden, und zeigten eine potenziell erhöhte Sensitivität dieser Parameter 19,20,21.
Die Validierung mit dem Goldstandard SPECT ergab einen DICE-Koeffizienten von ≥67 % für die Defektregionen22, und eine direktere Beatmungsmessung mit 129Xe zeigte eine prozentuale Korrelation der Beatmungsdefekte ≥62 % in einer gemischten COPD/CF/gesunden Kohorte23 und 84 % in einer multizentrischen CF-Kohorte24, die auch eine ähnliche Korrelation mit dem Lungenclearance-Index von PREFUL und 129Xe aufwies (r = 0,82 und r = 0,91). Die Perfusionsanalyse derselben Studie zeigte, dass es keine signifikanten Unterschiede in der räumlichen Überlappung mit der DCE zwischen den evaluierten Zentren gab25. Die Übereinstimmung mit DCE und die Übereinstimmung der PREFUL-Ergebnisse zwischen den Zentren wurde auch für eine prospektive Teilstudie mit neun Zentren berichtet26. Eine Reproduzierbarkeitsanalyse bei COPD-Patienten ergab für alle Parameter einen Variationskoeffizienten von unter 15 %27. Aktuelle Studien deuten darauf hin, dass der FVL-Parameter eine höhere Vorhersagekraft und Sensitivität zur Erkennung von Therapieänderungen aufweist als der "statische" Beatmungsparameter, der nur die endinspiratorische und die endexspiratorische Phase berücksichtigt. Das Ansprechen auf die Behandlung mit Messungen des regionalen Flow-Volume-Loops (FVL) wurde nach inhalativer Behandlung mit Indacaterol-Glycopyrronium (IND/GLY) bei COPD28 nachgewiesen. In Übereinstimmung sagte der FVL-Parameter den Transplantatverlust bei Patienten mit Doppellungentransplantation voraus, während dies bei der Spirometrie nicht möglich war (P = 0,02 vs. P = 0,33)29. Erste Machbarkeitsstudien zeigen, dass eine funktionelle Lungenbildgebung mit PREFUL bei frei atmenden Säuglingen und Neugeborenen mit klinischer Standard-MRT-Hardware realisiert werden kann30,31. Glandorf et al. verglichen PREFUL-Parameter bei 1,5T und 3T (SPGRE-Sequenz) und fanden bei den meisten Parametern, die trotz des Unterschieds in der Feldstärke sehr gut reproduzierbar waren, keine signifikanten Unterschiede32. Dies kann ein wichtiger Vorteil sein, da nicht jeder Standort Zugang zu Scannern mit 1,5 T oder niedrigerer Feldstärke hat. Kürzlich wurde die Machbarkeit und der Nachweis persistierender Symptome nach einer COVID-19-Infektion bei 0,55 T durch die Auswertung von bSSFP-Daten mit PREFUL33 demonstriert.
Zusammenfassend lässt sich sagen, dass PREFUL, obwohl es sich um eine relativ neuartige Technik handelt, ausgiebig untersucht wurde. Wichtige Kriterien wie die Validierung mit direkteren und etablierteren Messungen, die Reproduzierbarkeit, die Sensitivität für die Pathologie und das Ansprechen auf Behandlungs- und Progressionsänderungen wurden bewertet. Dennoch nutzen trotz der geringen technologischen Anforderungen immer noch nur wenige spezialisierte Zentren diese Technik. Daher ist es das Ziel dieser Arbeit, die neueste Methodik von PREFUL MR in schriftlicher und visueller Form zusammenzufassen. Diese Informationen können genutzt werden, um diese Technik in mehr Zentren zu etablieren und so langfristig zu einer reiferen Technik zu führen.
Protokoll
Diese Studie wurde von der Ethikkommission der Medizinischen Hochschule Hannover genehmigt und stellte sicher, dass sie während des gesamten Forschungsprozesses strenge ethische Standards einhält. Die Untersuchung folgte strikt den in der Deklaration von Helsinki dargelegten Richtlinien, die die ethische Durchführung medizinischer Forschung betonen. Zusätzlich wurde von allen Studienteilnehmern (bzw. deren Eltern oder Erziehungsberechtigten) vor der Teilnahme an der MRT-Untersuchung sorgfältig eine Einverständniserklärung eingeholt. Abbildung 1 zeigt einen vereinfachten Überblick über die wichtigsten Protokollschritte, bestehend aus Erfassung, Registrierung, Filterung und Sortierung und schließlich der Synthese des Herz- und Atemzyklus. In den folgenden Abschnitten werden alle beteiligten Schritte ausführlich beschrieben.
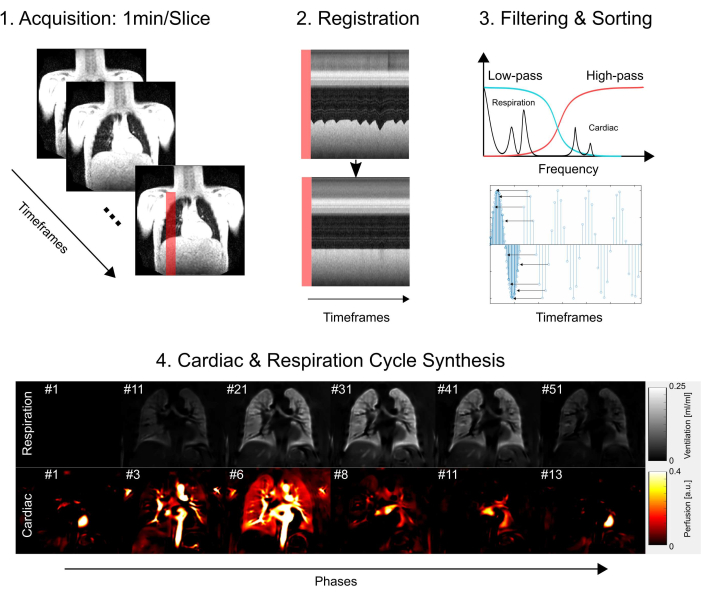
Abbildung 1: Schematische Übersicht über die Kernkomponenten von PREFUL. 1) Erfassung in freier Atmung, die 2) eine Bewegungskompensation durch Registrierung erfordert, wie mit den Profilplots gezeigt, und eine Voxel-für-Voxel-Analyse der Fourier-Komponenten ermöglicht, wie in Schritt 3) Filtern und Sortieren dargestellt. Nach der Tiefpass- (Beatmung) und Hochpassfilterung (Perfusion) 4) wird die geschätzte Phase verwendet, um die Bilder mit einer höheren scheinbaren zeitlichen Auflösung zu sortieren und einen vollständigen Herz- und Atmungszyklus zu synthetisieren. Beachten Sie, dass es sich hierbei um eine vereinfachte Gliederung handelt und alle Details im Manuskript beschrieben sind. Weitere Schritte, die in dieser Abbildung nicht enthalten sind, sind die Parameterquantifizierung und die Berichterstellung. Abkürzung: PREFUL = phasenaufgelöste funktionelle Lunge. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
1. Rekrutierung
- Rekrutierung von erwachsenen Patienten oder Minderjährigenin einer PREFUL-MRT-Studie für Patienten und gesunde Kontrollpersonen auf der Grundlage ihrer Diagnose einer Lungenerkrankung auf der Grundlage einer spirometrischen Untersuchung und/oder früherer Bildgebung (z. B. Röntgen- oder CT-Scan); die Fähigkeit, eine Einwilligung nach Aufklärung zu erteilen; Fähigkeit, für die Dauer der MRT-Untersuchung flach zu liegen und still zu bleiben; und keine bekannten Kontraindikationen für die MRT (z. B. metallische Implantate, Klaustrophobie).
- Patientinnen sind auszuschließen , wenn sie schwanger sind, sich innerhalb der letzten 6 Monate einer Lungenoperation unterzogen haben, schwere Atemnot haben oder eine kontinuierliche Sauerstoffergänzung benötigen oder in der Vergangenheit Nebenwirkungen auf gadoliniumbasierte Kontrastmittel hatten, wenn zusätzlich zu PREFUL eine kontrastmittelverstärkte MRT verwendet wird.
- Rekrutieren Sie gesunde Kontrollpersonen , wenn aufgrundder klinischen Untersuchung und des Selbstberichts keine Lungenerkrankung in der Vorgeschichte bekannt ist, die Lungenfunktionstests normal sind, sie in der Lage sind, eine Einverständniserklärung zu geben, wenn sie in der Lage sind, für die Dauer der MRT-Untersuchung flach zu liegen und still zu bleiben, und wenn keine Kontraindikationen für die MRT bekannt sind.
- Schließen Sie Personen aufgrund der aktuellen oder früheren Vorgeschichte des Rauchens, der Exposition gegenüber bekannten Lungentoxinen oder Berufsrisiken, der familiären Vorgeschichte von erblichen Lungenerkrankungen, aller bekannten chronischen Krankheiten, die die Lungenfunktion beeinflussen könnten, und der Schwangerschaft als gesunde Kontrollpersonen aus.
- Einholung von Einverständniserklärungen. Fahren Sie mit dem Protokoll fort, wenn der Teilnehmer eine schriftliche Einverständniserklärung einholt, die den Zweck und die Verfahren der Forschung, mögliche Risiken und Vorteile, Vertraulichkeitszusicherungen, die Dauer der Studie und das Recht auf Rücktritt ohne Konsequenzen enthält.
- Wenden Sie die folgenden zusätzlichen Schritte an, wenn die Rekrutierung Minderjährige umfasst.
- Holen Sie zusätzlich zur Zustimmung des Minderjährigen die schriftliche Einverständniserklärung von mindestens einem Elternteil oder Erziehungsberechtigten ein.
- Präsentieren Sie den gesamten Prozess in einer altersgerechten Weise, die für den Minderjährigen verständlich ist.
- Verwenden Sie für jüngere Minderjährige visuelle Hilfsmittel, Märchenbücher oder vereinfachte Erklärungen.
- Stellen Sie sicher, dass die Studie für die Altersgruppe relevant ist und dass Minderjährige nicht unnötig einbezogen werden.
- Erlauben Sie Minderjährigen, während aller verfahrensbezogenen Verfahren von einem vertrauenswürdigen Erwachsenen (z. B. Elternteil, Erziehungsberechtigter) begleitet zu werden, es sei denn, dies beeinträchtigt die Integrität der Prüfung.
HINWEIS: Bei den beschriebenen Schritten wird davon ausgegangen, dass die Studie von der Ethikkommission geprüft und genehmigt wurde.
- Wenden Sie die folgenden zusätzlichen Schritte an, wenn die Rekrutierung Minderjährige umfasst.
2. Akquisition
- Führen Sie das Sicherheitsverfahren vor dem Scan durch.
- Führen Sie vor einer MRT ein detailliertes Vorscreening der Patienten durch, um mögliche Kontraindikationen wie frühere Operationen, implantierte Geräte, Tätowierungen oder den Kontakt mit Metallfragmenten zu identifizieren.
- Klären Sie die Patienten bei Ihrer Ankunft über die magnetischen Eigenschaften und Risiken des Verfahrens auf.
- Weisen Sie die Patienten an, alle persönlichen metallischen Gegenstände, einschließlich Schmuck, Uhren und bestimmte Kleidungsbestandteile, abzulegen und ihnen bei Bedarf einen Kittel zur Verfügung zu stellen.
- Lassen Sie einen geschulten Fachmann die Patienten visuell auf übersehene metallische Gegenstände untersuchen.
- Überprüfen Sie alle medizinischen Geräte oder Implantate auf MRT-Kompatibilität.
- Stellen Sie sicher, dass Notfallprotokolle für die Sicherheit von Personal und Patienten vorhanden sind.
- Teilnehmer positionieren und scannen
- Richten Sie den Patienten mit dem Kopf voran aus und legen Sie ihn in Rückenlage auf ein 0,55-T-, 1,5-T- oder 3-T-System.
- Stellen Sie einen Gehörschutz, eine Notfallklingel, eine Polsterung und eine Decke für Sicherheit und Komfort bereit.
- Positionieren Sie eine Mehrkanal-Flexspule direkt unter dem Kinn, um eine optimale Empfindlichkeit der Spule in allen Lungenbereichen zu gewährleisten.
- Sichern Sie die Position der Spirale, um die Stabilität zu erhalten, ohne die Atmung des Patienten zu behindern.
- Weisen Sie den Patienten an, die Augen zu schließen und dann die Mitte der Lunge mit dem MRT-Laser zu markieren.
- Richten Sie das Lungenzentrum auf das Isozentrum aus und lassen Sie den Patienten die Augen wieder öffnen.
- Scannen Sie die ersten Lokalisatoren, um eine allgemeine Orientierung zu bestimmen, gefolgt von einem transversalen morphologischen Scan, um die Trachealbifurkation zu identifizieren.
- Verankern Sie den ersten koronalen Schnitt an der Trachealbifurkation als konsistenten Orientierungspunkt, um die Reproduzierbarkeit zu verbessern.
- Je nach Scanprotokoll werden entweder drei Schichten mit einem Abstand von Schicht zu Schicht (gemessen von Rand zu Kante) von 100 % (der Schichtdicke) oder mehrere Schichten erfasst, die sich über die gesamte Lunge erstrecken, mit einem Abstand von 20 % oder 33 %.
- Erwerben Sie jede Scheibe vollständig separat und nicht verschachtelt.
- Laden Sie die rekonstruierten Bilder in das Bildarchivierungs- und Kommunikationssystem (PACS) hoch, um sie anschließend abzurufen und zu analysieren. Alternativ können Sie zur Einhaltung von Datenschutzstandards Bilder manuell auf ein bestimmtes Netzlaufwerk oder eine ähnliche Speicherlösung exportieren.
HINWEIS: Detaillierte Informationen zum Sequenzprotokoll und zu den Parametern finden Sie in Tabelle 1 und Tabelle 2. Eine visuelle Darstellung der Schichtpositionierung finden Sie in Abbildung 2.
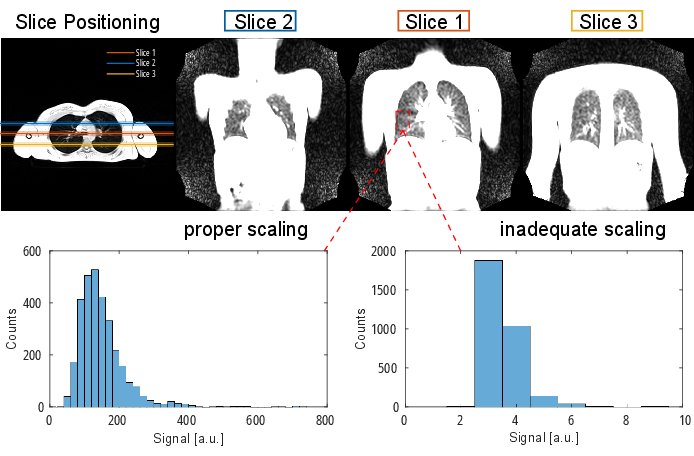
Abbildung 2: Eine typische Schichtpositionierung für ein PREFUL-Experiment, visualisiert mit einem 3D-Gradientenecho in transversaler Ausrichtung. Beachten Sie, dass die erste Scheibe an der Trachealbifurkation als reproduzierbarer Orientierungspunkt positioniert ist. Die 2. und 3. Scheibe werden mit einem 100%igen Scheibenabstand in anteriorer und hinterer Richtung positioniert. Beispielhafte Histogramme zeigen Werteverteilungen mit korrekter und unzureichender (niedriger) Skalierung. Letzteres führt zu einem geringen Dynamikbereich und einem Verlust an Genauigkeit. Eine unzureichend hohe Skalierung, die zu Clipping führt (hier nicht gezeigt), sollte ebenfalls vermieden werden. Abkürzung: PREFUL = phasenaufgelöste funktionelle Lunge. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Ein typischer Abriss eines PREFUL-Protokolls. Nach einem Localizer wird ein 3D-Volumen der Lunge in transversaler Orientierung aufgenommen. Diese Erfassung wird verwendet, um die folgenden PREFUL-Erfassungen zu planen (siehe auch Tabelle 2 für die Sequenzeinstellungen und Abbildung 2 für die Schichtpositionierung). Je nach Studie können weitere Sequenzen hinzugefügt werden. Abkürzung: PREFUL = phasenaufgelöste funktionelle Lunge. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Zusammenfassung der Sequenzparameter für die PREFUL-Erfassung mit verdorbener Gradientenechosequenz. Abkürzungen: PREFUL = phasenaufgelöste funktionelle Lunge; SPGRE = verdorbene Gradienten-Echo-Sequenz. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
3. Nachbearbeitung
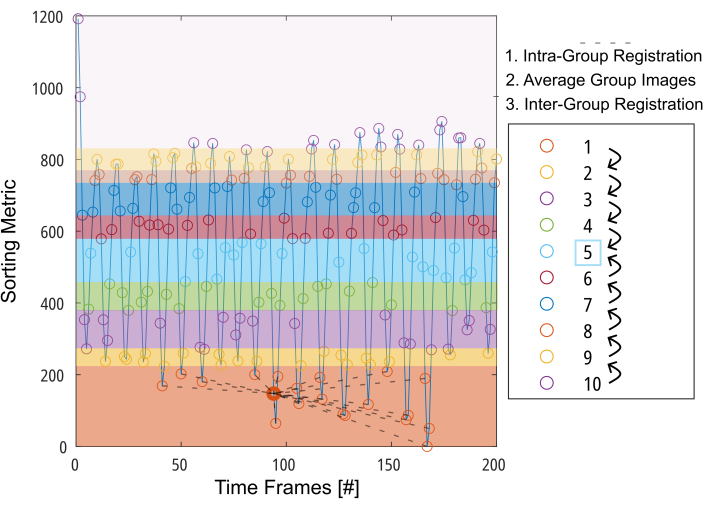
Abbildung 3: Schematische Darstellung der gruppenorientierten Registrierung zur Minimierung der erforderlichen Verformung für die Bewegungskompensation . Nach der Unterteilung der Bilder (dargestellt durch Kreise) in 10 Gruppen basierend auf einer Sortiermetrik (z. B. segmentierter Lungenbereich) werden die Bilder in jeder Gruppe an einer Zwischenposition registriert (dargestellt durch gestrichelte Linien für Gruppe 1). Anschließend werden die registrierten Bilder gemittelt und für den letzten Schritt der gruppenübergreifenden Registrierung Schritt für Schritt in Richtung Zwischengruppe verwendet. Abkürzung: GOREG = gruppenorientierte Registrierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
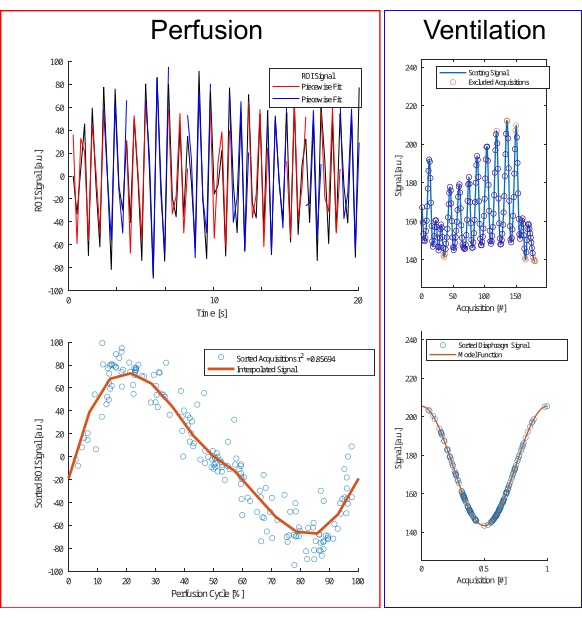
Abbildung 4: Illustration des Sortieralgorithmus für Perfusion und Beatmung. Für die Perfusion (links) wird eine stückweise Anpassung (obere Reihe) durchgeführt, um die Phase abzuschätzen und die Aufnahmen neu zu sortieren (untere Reihe). Für die Ventilation (rechts) werden Ausreißer ausgeschlossen (obere Reihe) und nach einem Kosinusmodell (untere Reihe) sortiert, das auf Amplitude und Amplitudendifferenz basiert, um zwischen Exspirations- und Inspirationsphase zu unterscheiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
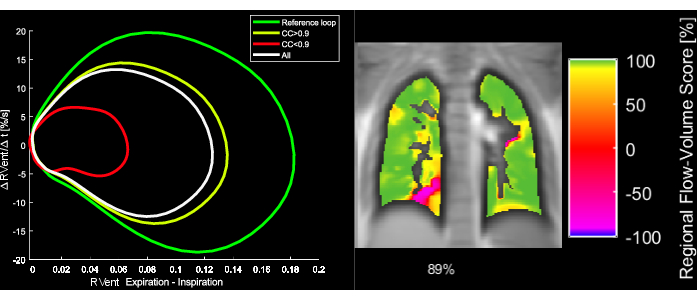
Abbildung 5: Beispielhafte Fluss-Volumen-Schleifen und die entsprechende FVL-Korrelationsmetrik einer 43-jährigen Patientin mit COPD. Beachten Sie, dass mit der Änderung des FVL der FVL-CM abnimmt. Abkürzungen: FVL = Fluss-Volumen-Schleife; FVL-CM = FVL-Korrelationsmetrik; COPD = chronisch obstruktive Lungenerkrankung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 3: Anwendung von Schwellenwerten auf die Parameterkarten und Kombination von Fehlerkarten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
- Registrierung
HINWEIS: Im folgenden Abschnitt wird das Verfahren für die nicht starre Registrierung auf ein Referenzvolumen (vorzugsweise das mittlere Atmungsniveau) unter Verwendung eines gruppenorientierten (GOREG) Schemas zur Kompensation der Atmung und der Herzbewegung beschrieben.- Rufen Sie die Bilder ab.
- Führen Sie zunächst eine Lungensegmentierung für alle nicht registrierten Bilder mit einem trainierten U-Net durch und wenden Sie einen Tiefpassfilter mit einem Cut-off von 0,7 Hz an, um eine Schätzung für die Atmungsphasen zu erhalten.
HINWEIS: Dadurch wird die vollautomatische Verarbeitungspipeline initiiert, die die nachfolgenden Schritte im Hintergrund ausführt. Die demonstrierten und beschriebenen Verarbeitungsschritte sind nicht auf eine bestimmte App oder Sprache beschränkt und können daher in einer benutzerdefinierten App mit vielen Programmiersprachen implementiert werden. - Klassifizieren Sie eine hohe Anzahl segmentierter Voxel als Inspiration und eine geringe Anzahl als Ablauf.
- Gruppieren Sie die Bilder, indem Sie sie in 10. Perzentile unterteilen, und stellen Sie sicher, dass jede der resultierenden 10 Gruppen die gleiche Anzahl von Bildern enthält.
- Wählen Sie ANTs34 (BSplineSyN mit Kreuzkorrelationsmetrik) oder Forsberg35,36 (polynomiale Expansion mit elastischer und fluider Regularisierung) als Registrierungsalgorithmus.
- Führen Sie für jede Gruppe eine Intra-Registrierung in Richtung der intermediären Lungenposition der jeweiligen Gruppe durch.
- Mittelwerten Sie die Gruppenergebnisse, um ein Bild für jede Gruppe zu erhalten.
- Führen Sie die Interregistrierung durch, indem Sie von jedem Gruppenbild zum nächsten Nachbarn in Richtung der 5. Gruppe gehen.
- Wenden Sie die Verformungskette auf die Originalbilder an, wenn dies erforderlich ist, um die Atemposition zu erreichen, die durch das gemittelte Bild in Gruppe 5 dargestellt wird. Für Bild 36, das zur Gruppe 3 gehört, werden beispielsweise die folgenden Verformungsfelder angewendet: 36->Bild 57 (~Zwischenlungenposition in Gruppe 3) -> Schritt 3->4 -> Schritt 4->5.
HINWEIS: Eine detaillierte Beschreibung des GOREG-Verfahrens finden Sie in Abbildung 3. Führen Sie die Registrierung mit parallelem Computing durch, um die Verarbeitungszeit zu reduzieren. Die GOREG-Registrierung wird durchgeführt, um die für jeden Registrierungsschritt erforderliche Verformungsmenge zu minimieren und somit eine stabile Algorithmuskonvergenz zu gewährleisten. Die Registrierung kann aber auch mit nur einem Verformungsschritt in Richtung der Zwischenlungenposition erfolgen. Während alle veröffentlichten 2D-PREFUL-Studien ANTs verwendeten, liefert Forsberg bis zu 6x schnellere Ergebnisse mit Ergebnissen von vergleichbarer Qualität, wie in einer 3D-PREFUL-Studieberichtet 37. Beispielhafte Ergebnisse in diesem Bericht wurden mit Forsberg-Registrierung generiert. In Abbildung 1 sehen Sie eine Abbildung des Registrierungseffekts auf die Membranbewegung.
- Allgemeine Filterung
- Entrauschen der registrierten Bilder unter Verwendung einer bildgeführten Filterung38, wobei das zeitlich gemittelte registrierte Bild als Leitbild verwendet wird. Wenden Sie die folgenden Einstellungen an: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- Für die Beatmungs- und Perfusionsanalyse verwenden Sie einen Tiefpass- oder Hochpassfilter mit einer Abschaltung bei 0,7 Hz , um die jeweils andere Komponente zu unterdrücken. Schließen Sie die ersten 20 Bilder von allen weiteren Verarbeitungsschritten aus, mit Ausnahme der quantifizierten Perfusionsberechnung, um einen stationären Zustand in der eingeschlossenen Zeitreihe zu gewährleisten.
HINWEIS: Eine Änderung des Cut-offs kann erforderlich sein, wenn die Probanden eine Atemfrequenz von über ~40 Atemzügen/min haben.
- Segmentierung
HINWEIS: Die abschließende Segmentierung erfolgt unter Verwendung der registrierten Bilder in Zwischenlungenposition in einem zweistufigen Verfahren, wie im Folgenden beschrieben.- Führen Sie eine Segmentierung der Lungengrenze (Lungen-ROI) auf den zeitlich gemittelten registrierten Bildern mit einem trainierten U-Net oder manuell durch.
- Schließen Sie dann große zentrale Gefäße aus, um die Segmentierung der Lungengrenzen zu verfeinern und eine Region of Interest oder einen ROI für das Lungenparenchym zu erhalten.
- Perfusion
HINWEIS: Die folgenden Schritte sind erforderlich, um die Herzphase für jedes Bild in der aufgenommenen Serie genau abzuschätzen, die mit einer relativ niedrigen Frequenz (~3-5 Bilder/s) abgetastet wird, insbesondere im Vergleich zur Herzfrequenz (typischerweise 40-90 Schläge pro Minute). Die Umlagerung der Daten nach den ermittelten Herzphasen wird verwendet, um den vollständigen Herzzyklus mit erhöhter zeitlicher Auflösung zu erhalten, der die Abtastrate18 der Datenerfassung übertrifft (siehe Abbildung 4 für eine Darstellung des Sortierverfahrens). Für die Phasenschätzung ist ein Such-ROI mit einem starken perfusionsgewichteten Signal erforderlich. Verwenden Sie einen iterativen Suchalgorithmus wie folgt22.- Verbinden Sie den ROI der Lungengrenze, um das Mediastinum in den ROI der Suche einzubeziehen.
- Generieren Sie ein einfaches perfusionsgewichtetes Map, indem Sie die Standardabweichung über die Bildsequenz berechnen.
- Identifizieren Sie Regionen, die dem 98. Perzentil dieser Karte innerhalb des Such-ROI entsprechen, als Seed-ROIs für nachfolgende Schritte.
- Führen Sie die stückweise Anpassung durch und vergrößern Sie die Größe der Kernpunkte, solange sich die Anpassungsleistung verbessert.
- Ordnen Sie die erweiterten Seed-ROIs nach ihrer passenden Leistung.
- Kombinieren Sie iterativ die am besten erweiterten Seed-ROIs mit den zweitbesten, drittbesten usw., bis entweder die Kombination die Metrik nicht verbessert oder alle Seed-ROIs berücksichtigt werden. Betrachten Sie den endgültigen ROI als den ROI des Gefäßes, der für die Schätzung der Herzphase verwendet wird.
- Bilden Sie den räumlichen Mittelwert des Signals innerhalb der optimierten Phasenschätzung, um eine Signalzeitreihe für die Phasenschätzung zu erzeugen.
- Führen Sie die stückweise Schätzung durch, indem Sie das Signal anhand der lokalen Maxima des Signals in kleinere Teile segmentieren, gefolgt von einer stückweisen sinusförmigen Anpassung unter Berücksichtigung von Parametern wie Amplitude, Phasenversatz und Frequenz (Abbildung 4).
- Sortieren Sie die Bilder phasenweise, um einen Herzzyklus darzustellen.
- Verwenden Sie die Nadaraya-Watson-Kernel-Regression mit einem Gaußschen Kernel (Sigma = 0,1), um 15 Phasen auf ein gleichmäßig verteiltes Zeitraster zu interpolieren, das einen einzelnen Herzzyklus umfasst.
HINWEIS: In Abbildung 1 finden Sie eine Teilmenge eines beispielhaft synthetisierten vollständigen Herzzyklus eines gesunden Freiwilligen, beginnend bei der Diastole, über den Übergang zur Systole bis hin zur Diastole.
- Beatmung
HINWEIS: Bei der Perfusionsanalyse ist zu beachten, dass die Herzfrequenz mit vernachlässigbaren Amplitudenschwankungen relativ stabil bleibt. Im Gegensatz dazu neigt die Ventilation dazu, mehr Schwankungen des Atemzugvolumens und der Häufigkeit zu erfahren, was zu unterschiedlichen Atmungszuständen mit identischen Atemphasen führt, die nicht immer die gleiche Amplitude haben. Inspiriert durch den Self-Gating-Ansatz von Fischer et al. ist es wichtig, die Belüftung anhand der Signalamplitude zu kategorisieren.- Schließen Sie extreme Ausreißer mithilfe empirischer Regeln aus (Daten unterhalb des 5. oder über dem 97. Perzentil).
- Leiten Sie den Amplitudenbereich R und den Offset C aus den Signal-Zeitreihen ab, die für die Registergruppierung erstellt wurden.
- Definieren Sie eine Modellfunktion A(t) mit einer beliebig gewählten Frequenz fAtmung (hier 0,3 Hz):
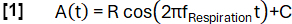
- Klassifizieren Sie die Daten basierend auf der Steigung in Inspirations- und Ablaufzustände.
- Erreichen Sie eine verfeinerte Phasenbestimmung entsprechend der Modellfunktion:
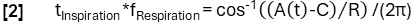
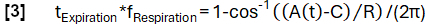
- Richten Sie anschließend die Proben basierend auf ihrer Phase aus und wenden Sie die Nadaraya-Watson-Kernel-Regression an, um die Beatmung in gleichmäßig verteilten Intervallen während des Atemzyklus zu berechnen.
- Berechnen Sie die regionale Lüftung (RVent) für jede Phase in Analogie zu Gleichung 1 und ersetzen Sie die Inspirationsphase durch die jeweilige Phase.
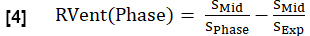
HINWEIS: In Abbildung 1 sehen Sie eine Teilmenge eines beispielhaft synthetisierten vollständigen Atemzyklus eines gesunden Freiwilligen, der bei der Exspiration beginnt, zur Inspiration übergeht und dann zur Exspiration zurückkehrt. Eine Abbildung des Sortieralgorithmus finden Sie in Abbildung 4.
- Berechnung der Parameter
HINWEIS: Anhand der synthetisierten Vollatmungs- und Herzzyklen kann man weitere Parameter ableiten. Eine Auswahl der wichtigsten Parameter wird im Folgenden beschrieben. - Regionale Lüftung (RVent)
- Unter Verwendung der inspiratorischen Phase leiten Sie RVent ab nach:
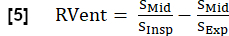
- Unter Verwendung der inspiratorischen Phase leiten Sie RVent ab nach:
- Durchfluss-Volumen-Kreislauf-Korrelationsmetrik (FVL-CM)
HINWEIS: Um alle Atmungsphasen zu beurteilen, wird eine Reihe von Schritten durchgeführt, um eine MRT zu erstellen, die der FVL-Analyse in Analogie zur Lungenfunktionsprüfung entspricht.- Berechnen Sie die Steigung der regionalen Lüftung (RVent) als Surrogat für die Strömung unter Verwendung der erstmaligen Ableitung von RVent. Verwenden Sie einen symmetrischen Differenzenquotienten mit der Schrittlänge h:
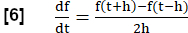
- Optional können regionale oder gemittelte RVent-Steigungen in Abhängigkeit vom jeweiligen RVent angezeigt werden, wodurch ein PREFUL-Äquivalent zur FVL-Analyse generiert wird.
- Bestimmen Sie einen Referenz-ROI, indem Sie die größte verbundene Region mit RVent-Werten im Bereich des 80. bis 90. Perzentils im Lungenparenchym-ROI identifizieren.
- Berechnen Sie den Durchschnitt der Durchfluss-Volumen-Schleifen innerhalb des ermittelten Referenz-ROI.
- Um die Ähnlichkeit jeder Lungen-FVC mit der Referenz zu bestimmen, kreuzkorrelieren Sie jede FVC im Lungenparenchym-ROI mit der Referenz ohne Verzögerung:
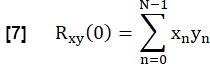
- Normalisieren Sie es nach:
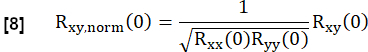
Dabei stellen x und y die Referenz und die jeweilige RVent-Strömungskurve dar.
HINWEIS: Beachten Sie, dass die verzögerungsfreie Beatmung verwendet wird, so dass eine verzögerte Beatmung zu einer geringeren Korrelation führt.
HINWEIS: In Abbildung 5 finden Sie eine Abbildung der FVL-Berechnung und der abgeleiteten FVL-CM-Metrik.
- Berechnen Sie die Steigung der regionalen Lüftung (RVent) als Surrogat für die Strömung unter Verwendung der erstmaligen Ableitung von RVent. Verwenden Sie einen symmetrischen Differenzenquotienten mit der Schrittlänge h:
- Quantifizierte Perfusion
HINWEIS: Die Quantifizierung erfolgt nach Glandorf et al. unter Verwendung der ersten Bilder, die während des transienten Zustands36 aufgenommen wurden.- Normalisieren Sie die ersten vier registrierten Bilder auf das mittlere Inspirationsniveau mit der Lungenvoxelmenge A, wie in Schritt 3.1.2 berechnet. Diese Verringerung der Modulation, die durch unterschiedliche Protonendichte verursacht wird, wird wie folgt ausgedrückt:
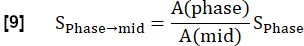
- Führen Sie eine exponentielle Anpassung durch, um das Signal zu schätzen, das mit der maximalen Magnetisierung verbunden ist, indem Sie das Modell verwenden:
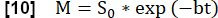
- Bestimmen Sie eine Map Q in Bezug auf die parenchymale Perfusion unter Verwendung der kardialen Zyklusphase, die die maximalsten Signale im Lungenparenchym-ROI zeigt.
- Für die Schätzung der regionalen Blutfraktion (BF) normalisieren Sie den S0-Wert , indem Sie die Werte über dem 99,99. Perzentil in der Such-ROI (Vollblutvoxel) mitteln:
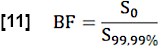
- Schätzen Sie die Austauschfraktion (EF) während eines Herzzyklus unter Berücksichtigung des Verhältnisses der maximalen medianen Signaldifferenz zwischen stationärem Zustand (SS) und Anfangszustand, bestimmt durch S0 , und der flussbezogenen Signaldifferenz Q:
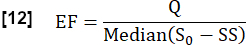
- Bestimmen Sie die Herzfrequenz fHeart in 1/s vom ROI des Gefäßes mit Hilfe der Fourier-Analyse (Frequenz, die dem größten Peak entspricht).
- Berechnen Sie die endgültige quantifizierte Perfusion (QQ) in mL∙min-1∙100 mL-1 wie folgt:
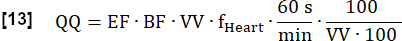
HINWEIS: Hier wird das Voxelvolumen (VV) ausgelöscht [mL/mL], und der Umrechnungsfaktor 60 s/min und der Konventionsfaktor 100/100 werden verwendet, um das Endergebnis in [mL∙min-1∙100 mL-1] anzuzeigen. EF und BF sind dimensionslose Verhältnisse.
- Normalisieren Sie die ersten vier registrierten Bilder auf das mittlere Inspirationsniveau mit der Lungenvoxelmenge A, wie in Schritt 3.1.2 berechnet. Diese Verringerung der Modulation, die durch unterschiedliche Protonendichte verursacht wird, wird wie folgt ausgedrückt:
- Schwellenwerte und Statistiken
- Beschreiben Sie die oben genannten Parameter für die mittlere Schicht und alle Schichten statistisch mit Mittelwert (alle Werte/mittlere Schnittwerte) und Standardabweichung (alle Werte / nur mittlere Schnittwerte).
- Normalisieren Sie außerdem die Standardabweichung auf den Variationskoeffizienten, um eine relative Streuungsrechnung zu erhalten. Wählen Sie den Mittelwert und den Variationskoeffizienten als endgültige statistische Ergebnisse aus.
- Wenden Sie Schwellenwerte auf die Parameterzuordnungen an, um Fehlerkarten zu generieren und Fehlerprozentsätze abzuleiten (siehe Tabelle 3).
- Werte unterhalb der Schwellenwerte als Beatmungs- oder Perfusionsdefekt (VD/QD) klassifizieren. Kombinieren Sie diese Karten weiter, um die Überlappung von Defekten und Normalbereichen (V/Q-Klassen) zu quantifizieren, einschließlich der folgenden Kombinationen, wie in der Vierfachtabelle in Tabelle 3 dargestellt:
- Berechnen Sie den Defektprozentsatz der Klassen Ventilationsdefekt (VD), Perfusionsdefekt (QD) und Ventilation/Perfusion (V/Q) als Anzahl der Voxel mit der entsprechenden Klasse im Verhältnis zu den gesamten Lungenparenchym-Voxeln:
Prozentsatz des Fehlers = #DefectVoxels/#LungParenchyma - Berechnen Sie diesen Defektprozentsatz für jede Scheibe und die zusammengesetzten koronalen Scheiben. Für diese Studie wird der kombinierte Ansatz gewählt, bei dem ein Beatmungsdefekt durch eine OP-Operation festgestellt wird: VD = VD(RVent) ODER VD(FVL-CM).
HINWEIS: Die beschriebene Analyse wurde mit einer kommerziellen Software-App (siehe Materialtabelle) unter Verwendung der Forsberg-Registrierungs-Toolbox durchgeführt.
| Parameter | Schwelle | Kommentar |
| Wohnmobil | 90. Perzentil * 0,4 | Adaptiver Schwellenwert |
| FVL-CM | 90% | Fester Schwellenwert |
| Q | 90. Perzentil * 0,15 | Adaptiver Schwellenwert |
| V/Q | KEINE QD | QD |
| KEIN VD | Normal | VQ-Mismatch (exklusive QD) |
| VD | VQ-Diskrepanz (Exklusiv VD) | VQ Fehler-Übereinstimmung |
Ergebnisse
Der untere Teil von Abbildung 2 veranschaulicht die Folgen einer ordnungsgemäßen und unzureichenden Skalierung mit einem entsprechenden Effekt auf den Dynamikbereich. Abbildung 6 zeigt die inhomogene Signalverteilung, die repräsentativ für Scans ohne und mit Spulennormalisierung ist. Es wird empfohlen, einen niedrigen Dynamikbereich und Bilder ohne Spulennormalisierung zu vermeiden.
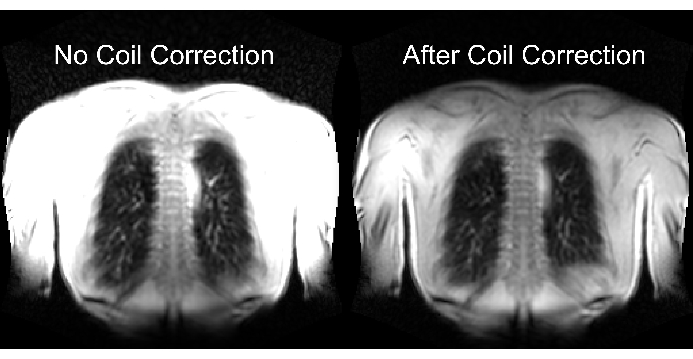
Abbildung 6: Beispielhafte Bilder nach der Aufnahme ohne Spulenkorrektur (falsch) und mit Spulenkorrektur (korrekt). Beachten Sie die künstliche Signalverstärkung an den Körpergrenzen in der Nähe der Spulenelemente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 7 zeigt die erfolgreiche und fehlgeschlagene automatische Segmentierung. Beachten Sie, dass die fehlgeschlagene Segmentierung nicht alle Lungenvoxel umfasst, was weitere Analysen und Statistiken verfälschen wird. Besondere Vorsicht ist bei Fällen mit Infiltraten geboten, da solche Voxel aufgrund ihres hohen Signals von KI-Modellen fälschlicherweise als Gefäße klassifiziert oder gar nicht segmentiert werden können.
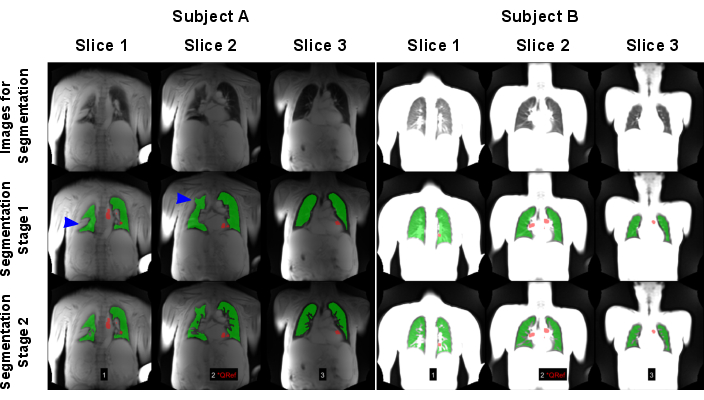
Abbildung 7: Ein Beispiel für eine automatisierte Segmentierung, die zu einem fehlgeschlagenen (Proband A: 83-jähriger Mann mit COPD) und einem erfolgreichen Ergebnis (Proband B: 30-jähriger weiblicher gesunder Kontrolle) führte. Die erste Zeile zeigt die Bilder, die als Input für die KI-Modelle verwendet wurden. Die zweite Zeile zeigt die Ergebnisse der ersten Segmentierungsphase, die darin besteht, die Lungengrenze zu finden. Die dritte Zeile zeigt das Endergebnis nach Ausschluss der Schiffe. Wie die blauen Pfeile zeigen, wurde der Algorithmus durch die Lungenvarianzen mit hohem Signal herausgefordert, die zu einer falschen Erkennung der Lungengrenze führten. Es ist zu beachten, dass die Bilder nach maximalem Signal normalisiert wurden, was zu unterschiedlichen Ergebnissen führte, da die Spulennormalisierung des an Subjekt A durchgeführten Scans fehlte. Rote Bereiche zeigen die ROIs, die für die Perfusionsphasensortierung automatisch erkannt wurden. Abkürzungen: COPD = chronisch obstruktive Lungenerkrankung; ROIs = interessante Regionen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 8 und Abbildung 9 zeigen repräsentative Parameterkarten für einen gesunden Kontrollpatienten (30 Jahre, weiblich) und einen COPD-Patienten (60 Jahre, männlich). Zu beachten ist, dass die gesunde Kontrolle eine homogenere Ventilation und Perfusion und damit weniger Defektvoxel zeigt. Die entsprechenden Berichte der ROI-Statistik finden Sie in Tabelle 4 und Tabelle 5.
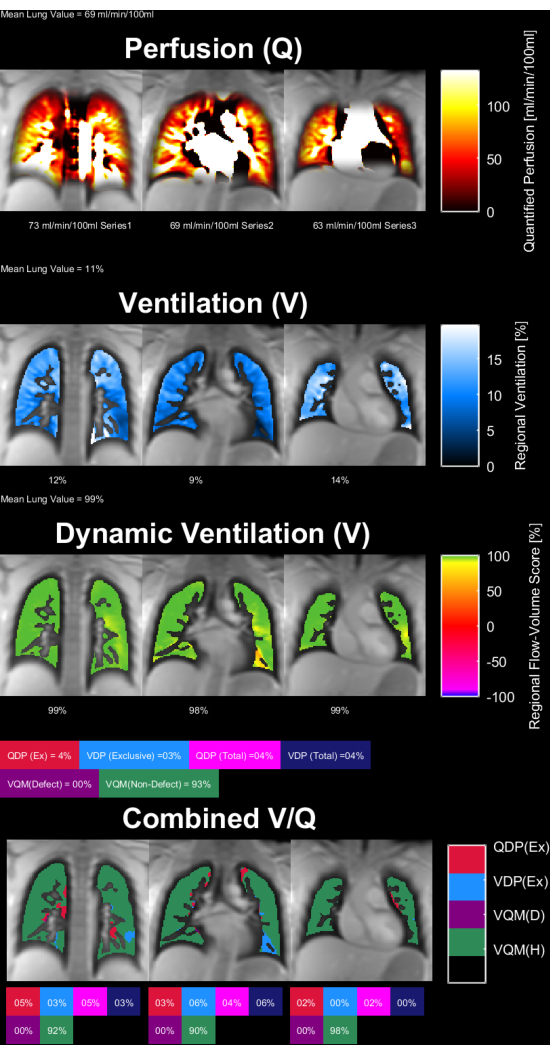
Abbildung 8: PREFUL-Parameterkarten einer 30-jährigen weiblichen gesunden Kontrolle. Die Perfusion (1. Reihe ), die regionale Ventilation (2. Reihe), die Korrelationsmetrik der Durchfluss-Volumen-Schleife (3. Reihe ) und die V/Q-Schwellenkarten (4. Reihe ). Zu beachten sind die homogene Verteilung der Parenchymwerte und die geringen Defektanteile. Abkürzungen: PREFUL = phasenaufgelöste funktionelle Lunge; V = Belüftung; Q = Durchblutung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
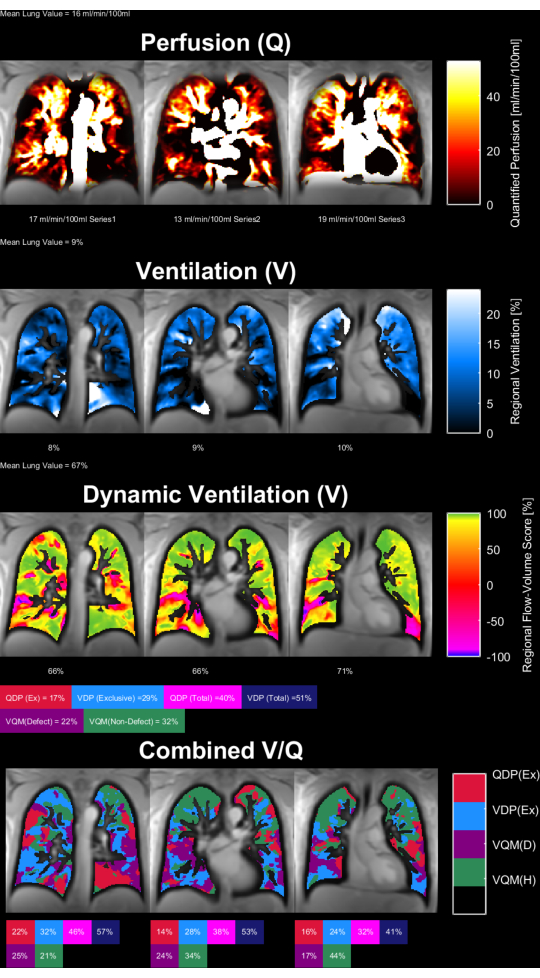
Abbildung 9: PREFUL-Parameterkarten eines 60-jährigen männlichen COPD-Patienten. Die Perfusion (1. Reihe ), die regionale Ventilation (2. Reihe), die Korrelationsmetrik der Durchfluss-Volumen-Schleife (3. Reihe ) und die V/Q-Schwellenkarten (4. Reihe ). Zu beachten sind die heterogene Verteilung der Parenchymwerte und die hohen Defektanteile. Abkürzungen: COPD = chronisch obstruktive Lungenerkrankung; PREFUL = phasenaufgelöste funktionelle Lunge; V = Belüftung; Q = Durchblutung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 4: Beispielhafter Bericht über PREFUL-Parameter, die für eine gesunde Kontrollgruppe (30-jährige Frau) erhalten wurden. Beachten Sie die niedrigen Werte für den Variationskoeffizienten und den Defekt, die mit den in Abbildung 8 dargestellten Parameterkarten für dasselbe Subjekt übereinstimmen. Siehe auch Tabelle 5 und Abbildung 9. Abkürzung: PREFUL = phasenaufgelöste funktionelle Lunge. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 5: Beispielhafter Bericht über PREFUL-Parameter für einen COPD-Patienten (60-jähriger Mann). Beachten Sie die hohen Werte für den Variationskoeffizienten und die Fehler, die mit den in Abbildung 9 dargestellten Parameterkarten für dasselbe Subjekt übereinstimmen. Siehe auch Tabelle 4 und Abbildung 8. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzendes Material: Animierte Erklärung des PREFUL-Algorithmus. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Kritische Schritte
Eine der häufigsten Fallstricke bei der Erfassung ist die unzureichende Signalskalierung, die bei der DICOM-Umwandlung durch eine verminderte Präzision der digitalen Datendarstellung zu einem Informationsverlust führt. Dies kann in der Folge zu Problemen in der Nachbearbeitung führen. Eine weitere, noch kritischere Falle ist die Erfassung mehrerer Slices in einer verschachtelten Weise. Dadurch wird die effektive zeitliche Auflösung der einzelnen Slices entscheidend reduziert. Darüber hinaus kann dies je nach Abstand der Schichten einen Einfluss auf den Perfusionskontrast und die Quantifizierung haben, da der Zufluss auf frischen Spins ohne Magnetisierungsgeschichte beruht. Besondere Sorgfalt ist bei der Einrichtung des Protokolls erforderlich, insbesondere in Bezug auf Gradientenstärke, asymmetrisches Echo, Bandbreite und parallele Bildgebung. Abweichungen von den vorgeschlagenen Einstellungen auch nur für einen dieser Parameter können zu einer unzureichenden TE und zeitlichen Auflösung führen.
Die Nachbearbeitung besteht aus mehreren Schritten, die in der beschriebenen Reihenfolge befolgt werden sollten. So ist z.B. eine Registrierung nach der Tiefpassfilterung nicht sinnvoll. Folglich führt das Scheitern in einem Schritt zu einem Zusammenbruch in den nächsten Schritten. Daher ist die Registrierungsphase besonders wichtig. Da es keinen einheitlichen Registrierungsalgorithmus gibt, müssen abhängig von der jeweiligen Implementierung Parameter empirisch gesetzt werden. Ohne Feinabstimmung dieser Parameter verhindert eine falsche Registrierung die Generierung eines aussagekräftigen Ergebnisses. Ein weiterer, möglicherweise zeitaufwändiger und kritischer Schritt bei der Nachbearbeitung ist die Segmentierung. Falsche Segmentierungen können zu völlig falschen Parameterberechnungen (z.B. durch Einbeziehung von Nicht-Lungenregionen) im Abschlussbericht führen. Solche Fehlsegmentierungen treten eher bei Deep-Learning-Algorithmen auf, die an bestimmte Bilddarstellungen gewöhnt sind und auf Bilder eines anderen Anbieters/einer anderen Maschine mit einem etwas anderen Erscheinungsbild angewendet werden. Eine visuelle Qualitätsprüfung der Segmentierungsgenauigkeit mit möglicher manueller Korrektur ist daher zwingend erforderlich.
Fehlerbehebung
Die typische Vorgehensweise bei der Fehlerbehebung besteht darin, alle Schritte nacheinander zu durchlaufen und die Zwischenergebnisse auf ihre Plausibilität zu prüfen. Die Vorgehensweise für die Hauptschritte ist wie folgt: Überprüfen Sie, ob die Bilder in freier Atmung mit der richtigen Reihenfolge und den richtigen Einstellungen aufgenommen wurden. Überprüfen Sie anschließend, ob der Dynamikbereich der Signale angemessen ist (~50 AE im Lungenparenchym). Wenn noch Rohdaten verfügbar sind, wiederholen Sie die Rekonstruktion der Bilder mit einem entsprechenden Skalierungsfaktor, um eine erneute Datenerfassung zu vermeiden. Stellen Sie sicher, dass die Registrierung ohne größere Artefakte und verbleibende Bewegung durchgeführt wurde. Überprüfen Sie als nächstes, ob kleine ROIs eine Zeitreihe mit erwarteten ventilations- und perfusionsbezogenen Modulationen zeigen. Überprüfen Sie dann, ob die angewendeten Filter die Bilder in der erwarteten Weise verändern (z. B. keine hochfrequenten Modulationen in tiefpassgefilterten Daten). Überprüfen Sie, ob die synthetisierten Atem- und Herzzyklen physiologisch sind und keine plötzlichen Sprünge zeigen. Überprüfen Sie die Genauigkeit der Segmentierung. Beachten Sie, dass eine Suche auf einer feineren Auflösungsstufe erforderlich sein kann, sobald der Hauptschritt, bei dem das Problem auftritt, identifiziert wurde.
Begrenzungen
Obwohl das vorgestellte Protokoll dafür bekannt ist, reproduzierbare und empfindliche Ergebnisse zu liefern, ermöglicht die Anzahl der beteiligten Schritte und Parameter während der Erfassung und Nachbearbeitung eine nahezu endlose Optimierung und ist miteinander verflochten. Daher sollte ein Bottom-up-Ansatz verfolgt werden, indem zunächst Optimierungen des Sequenzprotokolls (z.B. hinsichtlich des SNR und des funktionalen Kontrast-Rausch-Verhältnisses) angegangen werden. Für die folgenden Nachbearbeitungsoptimierungen könnte eine vordefinierte Ground Truth in Form eines digitalen Lungenmodells nützlich sein40. Wie vorgestellt, ahmt dieses Modell eine Erfassung der freien Atmung nach und umfasst mehrere Klassen zur Simulation von Beatmungs-/Perfusionsdefekten. Unter Berücksichtigung einer bekannten Verformung durch Bewegung können auch Registrierungsalgorithmen direkt getestet werden. Trotz dieser Vorteile ist jedes Modell von Natur aus durch die Genauigkeit der Abbildung komplexer Realitäten auf ein endliches und vereinfachtes Modell begrenzt.
Die in diesem Protokoll vorgestellten Schwellenwerte zeigten durch empirische Analysen akzeptable Ergebnisse für gesunde Probanden und über verschiedene Patientenkohorten hinweg. Nichtsdestotrotz ist, wie bereits beschrieben, wahrscheinlich eine Anpassung in Abhängigkeit von der Sequenz, der Feldstärke und der Kohorte erforderlich.
Eine generelle Einschränkung von PREFUL ist die umfangreiche Nachbearbeitung, die als Medizinprodukt noch nicht ohne weiteres verfügbar ist, obwohl erste Work-in-Progress-Versionen von Siemens Healthineers und BioVisioneers für wissenschaftliche Zwecke in einem wissenschaftlichen Kollaborations-/kommerziellen Umfeld verfügbar sind. Die Berechnungen erfolgen in der Regel über eine parallele Verarbeitung, die besonders hohe Anforderungen an CPU und RAM stellt und moderne Workstations oder Serverlösungen erfordern kann, um große Datenmengen effektiv zu verarbeiten. Darüber hinaus erschweren die zeitaufwändigen Nachbearbeitungsschritte derzeit eine sofortige Präsentation der Ergebnisse, die für den klinischen Workflow wünschenswert wäre.
Vergleich mit anderen Methoden
Es gibt eine Vielzahl ähnlicher Ansätze wie PREFUL, einschließlich des Vorgängers Fourier Decomposition und seiner anderen Derivate wie Matrix Pencil Decomposition41 und des etwas anderen Ansatzes Self-gated Non-Contrast-enhanced Functional Lung MRT (Senceful MRT)42. Während die Fourier-Zerlegung und ähnliche Verfahren im Frequenzbereich arbeiten, verwendet PREFUL eine weniger strenge Fourier-Filterung und die anschließende Berechnung der Amplituden im Zeitbereich. Daher ist es nicht erforderlich, spezifische Peaks auszuwählen, die der Beatmung/Perfusion entsprechen. Dies kann zu einer geringeren Anfälligkeit für Atemvariabilität führen, von der bekannt ist, dass sie bei menschlichen Probanden auftritt.
Während PREFUL die Bildsortierung übernimmt, verwendet SENCEFUL die Sortierung von k-Space-Zeilen, was zu mehr Flexibilität führt. Nichtsdestotrotz erfordert SENCEFUL Sequenzen mit Self-Gating-Fähigkeit, während PREFUL mit einer herkömmlichen verdorbenen Gradienten-Echo-Sequenz durchgeführt werden kann. In ähnlicher Weise ist bSSFP, das häufig in auf Fourier-Zerlegung basierenden Ansätzen verwendet wird, für ein besseres SNR und einen besseren Blutflusskontrast bekannt, erfordert jedoch in der Regel eine stärkere Optimierung für die Lungenerfassung, insbesondere bei 3T43. Abgesehen davon gibt es jedoch keinen Grund, PREFUL nicht mit der bSSFP-Akquisition44 zu kombinieren.
Alle diese signalbasierten Ansätze gehen davon aus, dass bestimmte unerwünschte Signaleinflüsse, einschließlich T1, T2/T2*, Diffusion, Bewegung durch die Ebene und nicht-orthogonal durchblutete Voxele, vernachlässigbar sind. Während die fortschreitende Validierung von PREFUL indirekt darauf hindeutet, dass solche Einflüsse tatsächlich nicht kritisch sind, zeigten Triphan et al., dass eine Abhängigkeit von den effektiven T1 und TE besteht, was durch die unterschiedliche Gewichtung der Blut- und Parenchymkomponenten in Abhängigkeit von der TE45 erklärt wird. Vor diesem Hintergrund könnte der anfängliche Vorteil der bSSFP zur Visualisierung von Blut aufgrund des T2/T1-Kontrasts eine zusätzliche Herausforderung darstellen, um eine genaue Quantifizierung im Vergleich zu den einfacheren Kontrastmechanismen einer SPGRE zu etablieren. Nichtsdestotrotz sind weitere Studien, die sich direkt mit dem Einfluss verschiedener MR-Variablen befassen, wie z.B. Glandorf et al. für Kontrastmittel46,47, wünschenswert, da sie die Wirkung auf PREFUL direkt quantifizieren können.
Wichtigkeit
Als frei atmende, kontrastmittelfreie Methode teilt PREFUL viele Vorteile mit den zuvor genannten verwandten Methoden: 1) Keine Anwendung von ionisierender Strahlung und Kontrastmittel, 2) Keine zusätzliche Hardware oder zusätzliches Personal erforderlich, 3) Erfassung, die nur von einer minimalen Compliance des Patienten abhängt. Diese Vorteile machen PREFUL zu einem komfortablen Überwachungsinstrument, insbesondere für gefährdete Gruppen wie Kinder mit chronischen Lungenerkrankungen. Obwohl das SNR bei SPGRE-Sequenzen niedrig ist, fördern die Verfügbarkeit und der fehlende Bedarf an zusätzlicher Sequenzprogrammierung/-freigabe die Verbreitung dieses Ansatzes weiter.
Wie im Einführungsteil erörtert, zeigt die Anzahl der Studien, die eine gute Validierung, Reproduzierbarkeit, Sensitivitätsergebnisse und Überwachungsmöglichkeiten zeigen, dass die Bedeutung dieser Technik und der entsprechenden dynamischen Parameter auf einem steigenden Kurs ist und durch eine weite Verbreitung weiter unterstützt wird.
Offenlegungen
Filip Klimeš, Andreas Voskrebenzev und Jens Vogel-Claussen sind Gesellschafter der BioVisioneers GmbH, einem Unternehmen, das sich mit pulmonalen Magnetresonanztomographie-Verfahren beschäftigt.
Danksagungen
Diese Arbeit wurde vom Deutschen Zentrum für Lungenforschung (DZL) gefördert. Die Autoren bedanken sich herzlich bei allen, die zur Weiterentwicklung von PREFUL beigetragen und diese unterstützt haben, insbesondere: Marcel Gutberlet, Till F. Kaireit, Lea Behrendt, Julian Glandorf, Sonja Lüdiger, Tawfik Moher Alsady, Katharina Bünemann, Marius Wernz, Robin Müller, Maximilian Zubke, Gesa Pöhler, Agilo Kern, Cristian Crisosto, Milan Speth, Arnd Obert, Julienne Scheller, Jim Wild, Edwin van Beek, Helen Marshall, Jens Gottlieb, Martha Dohna, Diane Renz, Anna-Maria Dittrich, Tobias Welte, Jens Hohlfeld, Patrick Zardo, Giles Santyr, Franz Wolfgang Hirsch, Robert Grimm, Bastian Bier, Bassem Ismail, André Fischer, Berthold Kiefer, Gregor Thoermer und Rebecca Ramb. Darüber hinaus bedanken sich die Autoren auch bei den Radiologietechnologen und Studienteilnehmern. Wir danken insbesondere Frank Schröder und Sven Thiele von der Klinik für Radiologie (Medizinische Hochschule Hannover) für die hervorragende technische Unterstützung bei der Durchführung der MRT-Untersuchungen.
Materialien
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
Referenzen
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten