Method Article
폐 환기 및 관류(V/Q) 평가를 위한 단계 분해 기능적 폐 MRI
요약
여기에서는 폐 환기 및 관류 역학 평가를 위한 조영제가 없는 양성자 MR 기법으로서 위상 분해 기능성 폐 MRI의 구현에 대해 설명합니다. 다양한 분야의 강점과 연령대에 걸쳐 검증되고 적용 가능한 이 제품은 질병 정량화 및 치료 모니터링을 지원함으로써 향후 임상 의사 결정을 향상시킬 수 있습니다.
초록
푸리에 분해는 폐 관류(Q) 및 환기(V) 평가를 위한 조영제가 없는 1H MRI 방법입니다. 이미지 정합 후, 각 복셀의 시계열은 심장 및 호흡 빈도 구성 요소와 관련하여 분석됩니다.
시간적 해상도가 ~300ms인 표준 2D 스포일드 그래디언트 에코 시퀀스를 사용하여 이미지 정렬 알고리즘을 개발하여 시간적 해상도가 향상된 위상 분해 기능적 폐 영상(PREFUL)을 생성했습니다. 따라서, 일회 호흡 중 FVL(regional flow volume loops)을 평가하고 심장 주기 동안 맥파의 전파를 묘사하는 것이 가능합니다. 이 방법은 설명된 프로토콜이 대부분의 시스템에서 기본 SPGRE 시퀀스로 구현될 수 있기 때문에 시퀀스 프로그래밍이 필요 없이 표준 MR 하드웨어를 사용하여 1.5T 또는 3T에서 적용할 수 있습니다.
PREFUL 인공호흡 MRI는 129Xe 및 19F 가스 이미징을 사용하여 양호한 지역 합의하에 검증되었습니다. 관류 가중 PREFUL MRI는 SPECT와 DCE(Dynamic Contrast Enhanced) MRI를 사용하여 검증되었습니다. PREFUL은 이중 센터 이중 공급업체 환경에서 테스트되었으며 현재 진행 중인 여러 다기관 시험에 적용되고 있습니다. 또한 다양한 필드 강도(0.55T-3T)와 신생아를 포함한 다양한 연령대에서 실현 가능합니다.
정량적 V/Q PREFUL MRI는 낭포성 섬유증, 만성 폐쇄성 폐질환, 만성 혈전색전성 폐고혈압 및 코로나 바이러스 질환-2019 환자를 대상으로 질병을 정량화하고 치료 후 치료 변화를 모니터링하는 데 사용되었습니다. 또한, PREFUL V/Q 영상은 폐 이식 후 환자에서 만성 폐 동종이식 기능 장애로 인한 이식 손실을 예측하는 것으로 나타났습니다. 요약하면, PREFUL MRI는 국소 폐 질환 감지, 정량화 및 치료 모니터링을 위한 정량적 환기 및 폐 맥파/관류 이미징을 위한 검증된 기술로, 현재 임상 루틴에 잠재적인 부가가치를 제공합니다.
서문
호흡기는 복잡한 메커니즘을 가지고 있어 다양한 질병에 취약합니다. 두드러진 경우, 만성 폐쇄성 폐질환(COPD), 낭포성 섬유증(CF), 만성 혈전색전성 폐고혈압(CTEPH)과 같은 만성 호흡기 질환은 기대 수명을 상당히 단축시킵니다1. 그 결과, 조기 진단, 모니터링 및 치료 반응 평가가 가장 중요해졌습니다.
폐 기능 검사(PFT)는 1초 내 강제 호기량(FEV1)과 강제 폐활량(FVC)2의 비율로 정의되는 Tiffeneau-Pinelli 지수와 같은 전반적인 폐 기능 매개변수를 도출할 수 있습니다. 이러한 매개변수는 임상 루틴에서 잘 확립되어 있지만 지역별 정보가 부족하고 높은 수준의 환자 순응도가 필요합니다. 이와 관련하여 이미징은 더 민감한 매개변수에 대한 추가적인 통찰력과 가능성을 제공할 수 있습니다. 컴퓨터 단층 촬영(CT)은 실질 형태의 고해상도 이미징을 제공하며, 파라메트릭-응답 매핑(parametric-response mapping)과 같은 최신 기술도 기능 정보를 검색한다3. 그럼에도 불구하고, 단일 광자 방출 컴퓨터 단층 촬영(single photon emission computed tomography, SPECT)은 폐의 환기 및 관류(V/Q)를 묘사하기 위한 현재의 황금 표준으로 남아 있다4. 모두에게 공통적으로 언급된 이미징 방식은 전리 방사선에 노출되어야 하며, 이는 모니터링 및 취약 그룹의 경우 특별한 고려가 필요합니다. 결과적으로, MRI를 대체 양식으로 홍보하기 위한 지속적인 노력이 있습니다.
본질적으로 폐는 양성자 밀도가 낮고 신호 감소가 빠르기 때문에 MRI를 촬영하기 어려운 장기이다5. 다양한 접근법 중에서 가장 널리 퍼진 해결책은 환기를 위한 과분극 가스( 예: 129Xe MRI)의사용6과 관류 묘사를 위한 가돌리늄 기반 조영제 정맥 주사 적용7을 포함한다. 이러한 방법은 높은 신호 대 잡음비(SNR)를 제공하며 MR 커뮤니티에서 널리 표준 방법으로 간주됩니다. 보다 최근의 접근 방식은 조영제의 적용을 피하고 총 획득 시간이 ~1분/slice인 자유 호흡에서 기존 양성자 MR로 실현 가능합니다. 따라서, 잠재적인 부작용과 최근에 논란이 되고 있는 조영제의 장기적인 효과를 피할 수 있으며, 추가적인 과분극 및 다중 핵 하드웨어가 필요 없이 더 쉽게 보급될 수 있습니다. 또한, 유도된 환기 결함 값(8 )에 영향을 줄 수 있는 적절한 팽창 상태를 찾는 문제는 자유 호흡 획득에 의해 방지됩니다.
이 간접 MR 신호 기반 접근법은 양성자 가중 신호 S와 폐 부피 V : S ~ 1 / V의 상호 관계를 활용한 Zapke et al.에 의해 처음 소개되었습니다.9 이는 자유 호흡에서 획득 한 이미지를 하나의 공통 인플레이션 상태 (일반적으로 종료 호기와 종료 영감 사이의 중간 위치)로 변환하는 과정을 기반으로하며, 따라서 움직임을 보상하고 각 복셀의 신호 시계열을 분석 할 수 있습니다. 그 후, 환기 측정은 Klimeš et al.10의 방정식 (1)을 사용하여 이러한 소위 등록된 이미지로부터 유도될 수 있습니다.
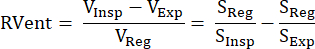 (1)
(1)
볼륨/신호의 경우 영감(Insp), 만료(Exp) 및 등록 상태(Reg)가 있습니다. 그 후, 호흡 주파수(환기) 및 펄스 주파수(관류)와 관련된 신호 변조를 구별하기 위해 푸리에 분해를 도입함으로써 이 방법을 확장했으며, 따라서 하나의 획득으로부터 공간적으로 완벽하게 일치하는 V/Q 맵을 도출했습니다(11). 이는 호흡 주파수와 심장 주파수 사이의 일반적인 갭에 의해 가능하며, 시간 영역에서 서로 위에 있는 두 구성 요소는 푸리에 분석에 의해 주파수 영역에서 효과적으로 구별됩니다. 최적화된 bSSFP(Balanced Steady-State Free Precession sequence)12를 사용하여 저자기장(0.35T)에서 1.5T로 전환한 후, 이 방법은 여러 후속 연구에서 더 많은 관심을 받기 시작했습니다 13,14,15.
호흡 및 맥박은 변동성의 영향을 받고 1.5T에서 상업적으로 이용 가능한 bSSFP(기울기 보정) 이미징은 상당한 밴딩 아티팩트(명확한 신호 보이드 라인)를 초래할 수 있기 때문에 넓은 저역 통과 및 고역 통과 필터링과 함께 SPGRE(spoiled gradient echo sequence)를 사용하는 관련 방법이 제안되었습니다16,17. 이것은 실제 호흡 및 맥박 관련 변조의 더 복잡한 스펙트럼을 포착합니다. 시간 영역에서의 진폭에 대한 다음 계산은 하나의 특정 주파수 피크를 선택할 필요를 없애줍니다. 추가 최적화는 하나의 참조 상태에 대한 일반적인 1단계 등록을 두 개의 개별 단계로 분할하여 달성되었습니다. 따라서 자유 호흡 중에는 최종 영감과 종료 호기 사이에 다양한 다양한 호흡 단계가 획득되며 고정 상태를 향한 다양한 정도의 변형이 필요하다는 사실이 활용됩니다. 여러 그룹을 선택하고 개별 이미지의 그룹을 식별한 후 다음 절차를 수행합니다: 1) 각 호흡 상태 그룹 내 등록, 2) 한 인접 그룹에서 다음 그룹으로의 단계별 그룹 간 등록(예: 1->2, 2->3,...)을 나타냅니다. 이 접근법은 환기 및 관류 역학의 분석을 용이하게 하기 위해 더 높은 겉보기 시간 해상도를 설정하기 위해 각 이미지에 대한 위상 추정에 의해 더욱 확장되었으며, 이 분야를 다른 관련 기술과 구별하기 위한 위상 분해 기능적 폐(PREFUL) MR 용어로 이어졌습니다18. 후속 연구에서는 전체 호흡 및 심장 주기에 의해 제공되는 추가 정보를 사용하였으며 이러한 매개변수 19,20,21의 민감도가 잠재적으로 증가했음을 보여주었습니다.
골드 스탠다드 SPECT를 사용한 검증은 결점 영역22에 대해 ≥67%의 주사위 계수를 나타냈으며, 129Xe를 사용한 보다 직접적인 환기 측정은 환기 결점 비율 상관 관계가 COPD/CF/건강한 혼합 코호트23에서 ≥62%, CF 다기관, 다중 공급업체 코호트24에서 84%를 보여주었으며, 이는 PREFUL 및 129Xe의 폐 청소 지수와 유사한 상관 관계를 보여주었습니다(r = 0.82 및 r = 0.91). 동일한 연구의 관류 분석은 평가 대상 센터25 간에 DCE와의 공간적 중복에 유의한 차이가 없음을 보여주었다. DCE와의 일치 및 센터 간 PREFUL 결과의 일치는 9개 센터를 포함한 전향적 하위 연구에 대해서도 보고되었다26. COPD 환자를 대상으로 한 재현성 분석 결과, 모든 매개변수에 대해 변동 계수가 15% 미만이었다27. 현재 연구에 따르면 FVL 매개변수는 흡기말 및 호기말 단계만 고려하는 "정적" 환기 매개변수에 비해 치료 변화를 감지하는 예측력과 민감도가 더 높습니다. COPD28에서 indacaterol-glycopyrronium(IND/GLY)을 사용한 흡입기 처리 후 FVL(Regional flow-volume loop) 측정을 통한 치료에 대한 반응이 입증되었습니다. 이와 관련하여, FVL 매개변수는 이중 폐 이식 환자의 이식편 손실을 예측한 반면, 폐활량 측정은 예측하지 못했습니다(P = .02 vs. P = 0.33)29. 첫 번째 타당성 조사에 따르면 PREFUL을 사용한 기능적 폐 영상은 표준 임상 MRI 하드웨어를 사용하여 자유 호흡 영아 및 신생아에서 실현될 수 있습니다30,31. Glandorf et al.은 1.5T 및 3T(SPGRE 서열)에서 PREFUL 파라미터를 비교한 결과, 전계 강도(field strength)의 차이에도 불구하고 재현성이 높은 대부분의 파라미터에 대해 유의한 차이가 없음을 발견했다(32). 이는 모든 현장이 1.5T 이하의 자기계 강도 스캐너에 액세스할 수 있는 것은 아니기 때문에 중요한 이점이 될 수 있습니다. 최근에는 PREFUL33으로 bSSFP 데이터를 평가하여 0.55T에서 COVID-19 감염 후 지속적인 증상의 타당성 및 감지가 입증되었습니다.
요약하면, PREFUL은 비교적 새로운 기술임에도 불구하고 광범위하게 연구되었습니다. 보다 직접적이고 확립된 측정을 통한 검증, 재현성, 병리학에 대한 민감도, 치료 및 진행 변화에 대한 반응성과 같은 중요한 기준을 평가했습니다. 그럼에도 불구하고 낮은 기술 요구 사항에도 불구하고 여전히 소수의 전문 센터만이 이 기술을 사용하고 있습니다. 따라서 본 연구의 목적은 PREFUL MR의 최신 방법론을 서면 및 시각 형식으로 요약하는 것입니다. 이 정보는 더 많은 센터에서 이 기술을 확립하는 데 사용할 수 있으므로 장기적으로 더 성숙한 기술로 이어질 수 있습니다.
프로토콜
이 연구는 하노버 의과대학 윤리위원회의 승인을 받았으며, 연구 과정 전반에 걸쳐 엄격한 윤리 기준을 준수했음을 확인했습니다. 이 조사는 의학 연구의 윤리적 행위를 강조하는 헬싱키 선언에 명시된 지침을 엄격히 따랐습니다. 또한 MRI 검사에 참여하기 전에 모든 연구 참가자(또는 부모 또는 법적 보호자)로부터 정보에 입각한 동의를 부지런히 얻었습니다. 그림 1 을 참조하면 수집, 등록, 필터링 및 분류로 구성된 핵심 프로토콜 단계와 마지막으로 심장 및 호흡 주기 합성으로 구성되는 간단한 개요를 확인할 수 있습니다. 다음 섹션에서는 관련된 모든 단계에 대해 자세히 설명합니다.
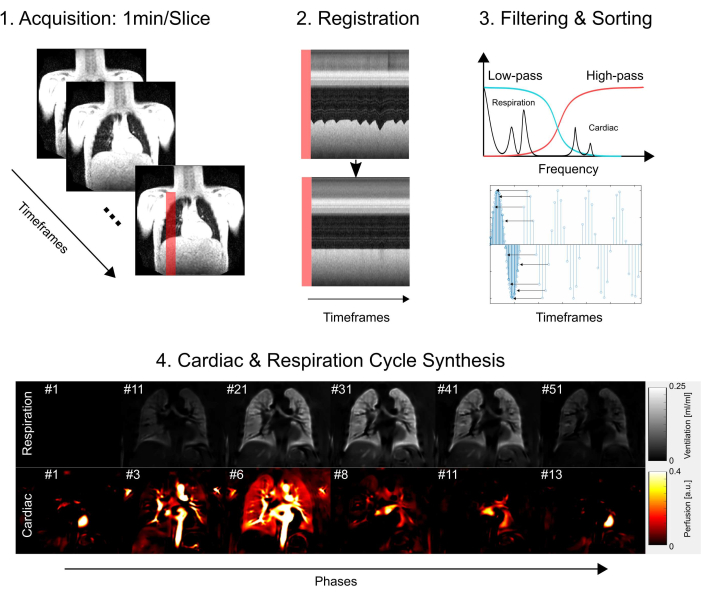
그림 1: PREFUL의 핵심 구성 요소에 대한 개략도. 1) 2) 프로파일 플롯에서 입증된 대로 정합을 통한 모션 보정이 필요한 자유 호흡에서의 획득은 3) 필터링 및 정렬과 같이 푸리에 성분의 복셀별 분석을 가능하게 합니다. 저역 통과(환기) 및 고역 통과(관류) 필터링 후 4) 추정된 위상은 이미지를 더 높은 겉보기 시간 해상도로 정렬하고 하나의 전체 심장 및 호흡 주기를 합성하는 데 사용됩니다. 이것은 단순화된 개요이며 전체 세부 사항은 원고에 설명되어 있습니다. 이 그림에서 생략된 추가 단계에는 파라미터 정량화 및 보고서 생성이 포함됩니다. 약어: PREFUL = phase-resolved functional lung. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 채용
- 폐활량 측정 검사 및/또는 이전 영상(예: X선 또는 CT 스캔)을 기반으로 한 폐 질환 진단을 기반으로 환자 및 건강한 대조군을 위한 PREFUL MRI 시험에서 성인 환자 또는 미성년자를 모집합니다. 정보에 입각한 동의를 제공할 수 있는 능력; MRI 스캔 기간 동안 평평하게 누워 가만히 있을 수 있는 능력; MRI에 대한 알려진 금기 사항이 없습니다(예: 금속 임플란트, 폐소 공포증).
- 임신 중이거나, 지난 6개월 이내에 이전에 폐 수술을 받은 적이 있거나, 심한 호흡 곤란이 있거나 지속적인 산소 보충이 필요하거나, PREFUL 외에 조영제 강화 MRI를 사용하는 경우 이전에 가돌리늄 기반 조영제에 대한 부작용이 있는 환자는 제외됩니다.
- 임상적 검사와 자가 보고에 근거한 폐 질환의 알려진 병력이 없는 경우, 폐 기능 검사가 정상이고, 정보에 입각한 동의를 할 수 있으며, MRI 스캔 기간 동안 납작하게 누워서 가만히 있을 수 있고, MRI에 대한 알려진 금기 사항이 없는 경우 건강한 대조군을 모집합니다.
- 현재 또는 과거의 흡연 병력, 알려진 폐 독소 또는 직업적 위험에 대한 노출, 유전성 폐 질환의 가족력, 폐 기능에 영향을 미칠 수 있는 알려진 만성 질환 및 임신에 따라 개인을 건강한 대조군으로 제외합니다.
- 동의서를 획득합니다 . 참가자로부터 연구의 목적과 절차, 잠재적인 위험 및 이점, 기밀 보장, 연구 기간 및 결과 없이 철회할 수 있는 권리가 포함된 서면 동의서를 받은 경우 프로토콜을 계속하십시오.
- 모집에 미성년자가 포함된 경우 다음 추가 단계를 적용하십시오.
- 미성년자의 동의 외에 최소 한 명의 부모 또는 보호자로부터 서면 동의를 받아야 합니다.
- 미성년자가 이해할 수 있는 연령에 적합한 방식으로 전체 과정을 제시하십시오.
- 미성년자가 어린 경우, 시각 자료, 동화책 또는 간단한 설명을 사용하십시오.
- 연구가 해당 연령 그룹과 관련이 있고 미성년자가 불필요하게 포함되지 않도록 합니다.
- 미성년자가 임상시험의 무결성을 방해하지 않는 한 모든 임상시험 관련 절차에서 신뢰할 수 있는 성인(예: 부모, 보호자)과 동행할 수 있도록 허용합니다.
참고: 설명된 단계는 임상시험이 윤리 위원회의 검토 및 승인을 받았다고 가정합니다.
- 모집에 미성년자가 포함된 경우 다음 추가 단계를 적용하십시오.
2. 인수
- 프리스캔 안전 절차를 수행합니다.
- MRI를 찍기 전에 이전 수술, 이식된 장치, 문신 또는 금속 조각에 대한 노출과 같은 잠재적인 금기 사항을 식별하기 위해 환자에 대한 자세한 사전 검사를 수행합니다.
- 도착하자마자 환자에게 시술의 자기 특성과 위험에 대해 교육합니다.
- 환자에게 보석, 시계 및 특정 의복 부품을 포함한 모든 개인 금속 품목을 제거하고 필요한 경우 가운을 제공하도록 지시합니다.
- 훈련된 전문가가 환자에게 간과된 금속 물체가 있는지 육안으로 검사하도록 하십시오.
- MRI 호환성을 위해 모든 의료 기기 또는 임플란트를 검사합니다.
- 직원과 환자 모두의 안전을 위해 비상 프로토콜이 마련되어 있는지 확인합니다.
- 참가자 위치 지정 및 스캔
- 환자를 머리 먼저 향하게 하고 0.55T, 1.5T 또는 3T 시스템에서 누운 자세로 눕힙니다.
- 안전과 편안함을 위해 청력 보호구, 비상 벨, 패딩 및 담요를 제공하십시오.
- 턱 바로 아래에 다중 채널 플렉스 코일을 배치하여 모든 폐 영역에서 최적의 코일 감도를 보장합니다.
- 환자의 호흡을 방해하지 않고 안정성을 유지하기 위해 코일의 위치를 고정합니다.
- 환자에게 눈을 감으라고 지시한 다음 MR 레이저를 사용하여 폐의 중심을 표시합니다.
- 폐 중심을 등중심에 맞추고 환자가 다시 눈을 뜰 수 있도록 합니다.
- 초기 localizer를 스캔하여 일반적인 방향을 설정한 다음 transversal morphological scan을 스캔하여 기관 분기를 식별합니다.
- 첫 번째 coronal slice를 기관 분기점에 고정하여 재현성을 향상시키기 위해 일관된 랜드마크로 지정합니다.
- 스캔 프로토콜에 따라 100%(슬라이스 두께)의 슬라이스 간 거리(가장자리에서 가장자리까지 측정)로 간격을 둔 3개의 슬라이스를 캡처하거나 20% 또는 33%의 거리로 폐 전체에 걸쳐 여러 슬라이스를 획득합니다.
- 각 슬라이스를 완전히 개별적으로 가져오고 인터리브하지 않습니다.
- 재구성된 이미지를 PACS(Picture Archiving and Communication System)에 업로드하여 후속 액세스 및 분석을 수행할 수 있습니다. 또는 개인 정보 보호 및 데이터 보호 표준을 준수하기 위해 이미지를 지정된 네트워크 드라이브 또는 유사한 스토리지 솔루션으로 수동으로 내보냅니다.
참고: 시퀀스 프로토콜 및 매개변수에 대한 자세한 내용은 표 1 및 표 2를 참조하십시오. 슬라이스 위치 지정의 시각적 표현은 그림 2를 참조하십시오.
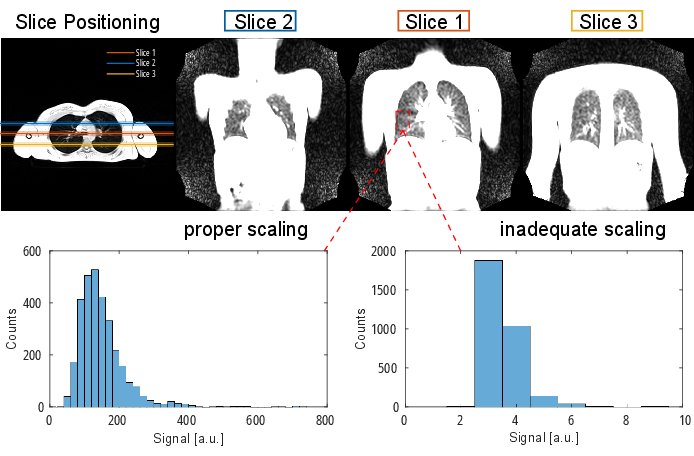
그림 2: 횡단 방향에서 3D 그래디언트 에코로 시각화된 PREFUL 실험의 일반적인 슬라이스 위치. 첫 번째 슬라이스는 재현 가능한 랜드마크로 기관 분기점에 위치합니다. 2번째 및 3번째 슬라이스는 전방 및 후방 방향으로 100% 슬라이스 간격으로 배치됩니다. 예시적인 히스토그램은 적절하고 부적절한(낮은) 척도법을 가진 값 분포를 보여줍니다. 후자는 낮은 다이내믹 레인지와 정확도 손실로 이어집니다. 클리핑(여기에 표시되지 않음)으로 이어지는 부적절한 높은 크기 조정도 피해야 합니다. 약어: PREFUL = phase-resolved functional lung. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: PREFUL 프로토콜의 일반적인 개요. localizer 후, 폐의 3D 부피가 횡단 방향으로 획득됩니다. 이 수집은 다음과 같은 PREFUL 수집을 계획하는 데 사용됩니다(시퀀스 설정은 표 2 , 슬라이스 포지셔닝은 그림 2 참조). 스터디에 따라 다른 시퀀스를 추가할 수 있습니다. 약어: PREFUL = phase-resolved functional lung. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 스포일드 그래디언트 에코 시퀀스를 사용한 PREFUL 수집에 대한 시퀀스 파라미터 요약. 약어: PREFUL = 위상 분해 기능성 폐; SPGRE = 손상된 그래디언트 에코 시퀀스. 이 표를 다운로드하려면 여기를 클릭하십시오.
3. 후처리
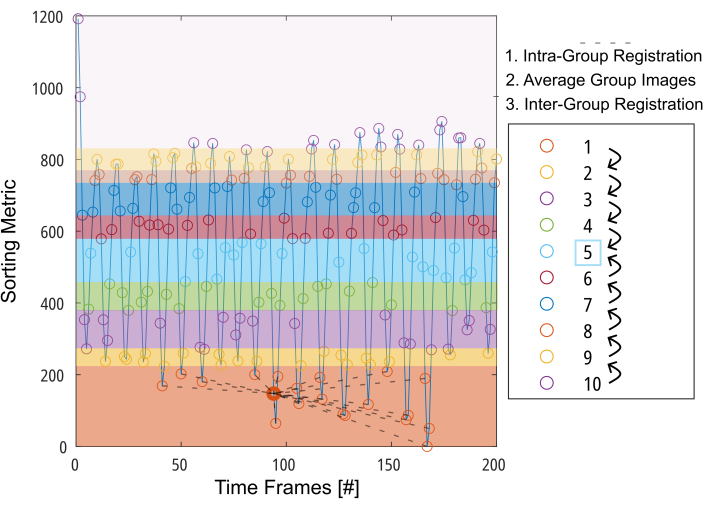
그림 3: 모션 보정에 필요한 변형을 최소화하기 위한 그룹 지향 정합(group-oriented registration)의 개략도. 정렬 메트릭(예: 분할된 폐 면적)에 따라 이미지(원으로 표시)를 10개 그룹으로 나눈 후 이미지는 각 그룹 내부의 중간 위치(그룹 1의 경우 점선으로 표시)에 등록됩니다. 그런 다음, 등록된 이미지를 평균화하여 중간 그룹을 향해 단계적으로 그룹 간 등록의 최종 단계에 사용합니다. 약어: GOREG = group-oriented registration. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
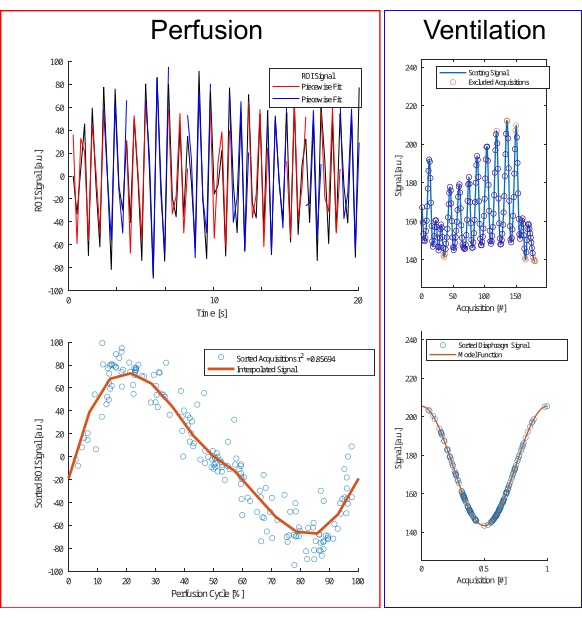
그림 4: 관류 및 환기를 위한 분류 알고리즘의 그림. 관류(왼쪽)의 경우 조각별 피팅(위쪽 줄)을 수행하여 위상을 추정하고 획득을 재정렬합니다(아래쪽 줄). 환기(오른쪽)의 경우 이상치를 제외하고(위쪽 행) 진폭 및 진폭 차이를 기반으로 코사인 모델(아래쪽 행)에 따라 정렬하여 만료 단계와 흡기 단계를 구분합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
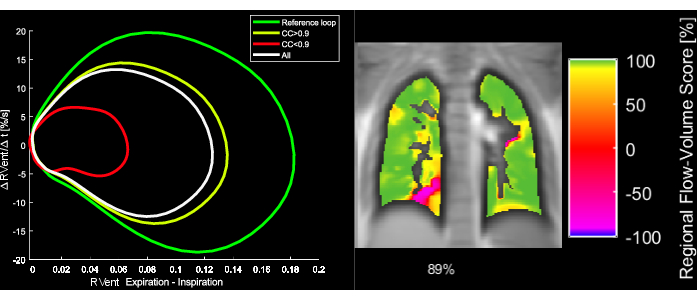
그림 5: COPD를 앓고 있는 43세 여성 환자의 예시적인 유량 루프 및 해당 FVL-상관 메트릭. FVL을 변경하면 FVL-CM이 감소합니다. 약어: FVL = 유량 루프; FVL-CM = FVL-상관 관계 메트릭; COPD = 만성 폐쇄성 폐질환. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 3: 파라미터 맵에 대한 임계값 적용 및 결함 맵의 조합. 이 표를 다운로드하려면 여기를 클릭하십시오.
- 등록
참고: 다음 섹션에서는 호흡 및 심장 운동 보상을 위한 그룹 지향(GOREG) 체계를 사용하여 기준 볼륨(바람직하게는 중간 수준 호흡 수준)에 비경직성 등록하는 절차에 대해 설명합니다.- 이미지를 검색합니다.
- 처음에는 훈련된 U-Net을 사용하여 등록되지 않은 모든 이미지에 대해 폐 분할을 수행하고 컷오프가 0.7Hz인 저역 통과 필터를 적용하여 호흡 단계에 대한 추정치를 얻습니다.
참고: 이렇게 하면 완전히 자동화된 처리 파이프라인이 시작되어 백그라운드에서 후속 단계를 수행합니다. 시연 및 설명된 처리 단계는 특정 앱 또는 언어로 제한되지 않으므로 많은 프로그래밍 언어가 있는 사용자 지정 앱에서 구현할 수 있습니다. - 많은 양의 분할된 복셀을 영감으로 분류하고 적은 양을 만료로 분류합니다.
- 이미지를 10번째 백분위수로 나누어 그룹화하여 결과 10개 그룹의 각 그룹에 동일한 수의 이미지가 포함되도록 합니다.
- 정합 알고리즘으로 ANTs34(BSplineSyN with cross-correlation metric) 또는 Forsberg35,36 (polynomial expansion with elastic and fluid regularization)을 선택합니다.
- 각 그룹의 중간 폐 위치를 향해 각 그룹에 대한 Intra-registration을 수행합니다.
- 각 그룹에 대해 하나의 이미지를 얻기 위해 그룹 결과의 평균을 구합니다.
- 각 그룹 이미지에서 5번째 그룹 방향으로 다음 이웃으로 이동하는 Inter-registration을 수행합니다.
- 그룹 5의 평균 이미지로 표시되는 호흡 위치에 도달하기 위해 필요한 경우 원본 이미지에 변형 체인을 적용합니다. 예를 들어, 그룹 3에 속하는 이미지 36의 경우 다음 변형 필드 가 적용됩니다: 36->이미지 57 (~그룹 3의 중간 폐 위치) -> 단계 3->4 -> 단계 4->5.
참고: GOREG 절차에 대한 자세한 설명은 그림 3을 참조하십시오. 병렬 컴퓨팅으로 등록을 수행하여 처리 시간을 줄입니다. GOREG 정합은 각 정합 단계에 필요한 변형량을 최소화하여 안정적인 알고리즘 수렴을 보장하기 위해 수행됩니다. 그럼에도 불구하고, 등록은 중간 폐 위치를 향한 단 한 번의 변형 단계로 수행될 수도 있습니다. 발표된 모든 2D PREFUL 연구는 ANT를 사용했지만, Forsberg는 3D PREFUL 연구에서 보고된 것과 유사한 품질로 최대 6배 더 빠른 결과를 제공합니다37. 이 보고서의 예시적인 결과는 Forsberg 등록으로 생성되었습니다. 그림 1 을 참조하여 다이어프램 움직임에 대한 등록 효과에 대한 그림을 보십시오.
- 일반 필터링
- 이미지-유도 필터링(image-guided filtering)(38)을 사용하여 등록된 이미지의 노이즈를 제거하고, 시간적으로 평균화된 등록된 이미지를 안내 이미지로 사용한다. NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1 설정을 적용합니다.
- 환기 및 관류 분석의 경우 0.7Hz에서 차단이 있는 저역 통과 또는 고역 통과 필터를 사용하여 각각의 다른 구성 요소를 억제합니다. 포함된 시계열에서 정상 상태를 보장하기 위해 정량화된 관류 계산을 제외한 모든 추가 처리 단계에서 처음 20개의 이미지를 제외합니다.
알림: 피험자의 호흡수가 ~40회/분 이상인 경우 컷오프 변경이 필요할 수 있습니다.
- 세분화
참고: 최종 분할은 다음의 개요와 같이 2단계 절차로 중간 폐 위치에 등록된 이미지를 사용하여 수행됩니다.- 훈련된 U-Net을 사용하거나 수동으로 시간적으로 평균화된 등록 이미지에 대해 폐 경계(폐 ROI) 분할을 수행합니다.
- 그런 다음 큰 중앙 혈관을 제외하여 폐 경계 분할을 구체화하고 폐 실질에 대한 관심 영역 또는 ROI를 얻습니다.
- 관류
참고: 획득한 시리즈의 각 이미지에 대한 심장 위상을 정확하게 추정하려면 다음 단계가 필요하며, 이는 특히 심박수(일반적으로 40-90bpm)와 비교하여 상대적으로 낮은 주파수(~3-5 images/s)로 샘플링됩니다. 결정된 심장 위상에 따른 데이터의 재배치는 데이터 수집의 샘플링 레이트(18 )를 능가하는 향상된 시간적 해상도로 완전한 심장 주기를 얻는 데 사용된다(분류 절차의 예시는 도 4 참조). 위상 추정을 위해서는 강한 관류 가중 신호를 갖는 탐색 ROI가 필요합니다. 다음과 같이 반복적인 검색 알고리즘을 사용한다22.- 폐 경계 ROI를 연결하여 검색 ROI에 종격동을 포함합니다.
- 이미지 시퀀스에서 표준 편차를 계산하여 간단한 관류 가중 맵을 생성합니다.
- 검색 ROI 내에서 이 맵의 98번째 백분위수에 해당하는 영역을 후속 단계에 대한 시드 ROI로 식별합니다.
- 조각별 피팅을 수행하여 피팅 성능이 향상되는 한 시드 점의 크기를 늘립니다.
- 피팅 성능에 따라 확장된 시드 ROI의 순위를 매깁니다.
- 최상의 확장 시드 ROI를 두 번째로 좋은 경우, 세 번째로 좋은 점 등과 반복적으로 결합하여 조합으로 지표가 개선되지 않거나 모든 시드 ROI가 고려됩니다. 최종 ROI는 심장 위상 추정에 사용되는 vessel ROI로 간주합니다.
- 최적화된 위상 추정 내에서 신호를 공간적으로 평균화하여 위상 추정을 위한 하나의 신호-시계열을 생성합니다.
- 신호의 국소 최대값을 사용하여 신호를 더 작은 부분으로 분할한 다음 진폭, 위상 오프셋 및 주파수와 같은 파라미터를 고려한 조각별 정현파 피팅을 수행하여 조각별 추정을 수행합니다(그림 4).
- 하나의 심장 주기를 나타내기 위해 이미지를 위상 정렬합니다.
- 가우스 커널(sigma = 0.1)과 함께 Nadaraya-Watson 커널 회귀를 사용하여 단일 심장 주기를 포함하는 균일한 간격의 시간 그리드에 15개의 위상을 보간합니다.
참고: 건강한 지원자의 예시적인 합성된 전체 심장 주기의 하위 집합에 대해서는 그림 1 을 참조하십시오. 이완기에서 시작하여 수축기로 전환하고 다시 이완기로 돌아갑니다.
- 환기
알림: 관류 분석의 경우 심장 주파수가 무시할 수 있는 진폭 변화로 비교적 안정적으로 유지된다는 점에 유의하십시오. 대조적으로, 환기는 일회 호흡량과 빈도에서 더 많은 변화를 경험하는 경향이 있으며, 이로 인해 동일한 호흡 단계가 항상 동일한 진폭을 갖지 않는 다른 호흡 상태가 발생합니다. Fischer et al.의 셀프 게이팅 접근 방식에서 영감을 받아 신호 진폭을 기준으로 환기를 분류하는 것이 중요합니다.- 경험적 규칙을 사용하여 극단적인 이상치를 제외합니다(5번째 백분위수 미만 또는 97번째 백분위수 위의 데이터).
- 정합 그룹화를 위해 생성된 신호-시계열에서 진폭 범위 R과 오프셋 C를 도출합니다.
- 임의로 선택된 주파수 f 호흡(여기서는 0.3Hz)을 사용하여 모델 함수 A(t)를 정의합니다.
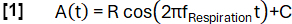
- 기울기를 기준으로 데이터를 영감 상태와 만료 상태로 분류합니다.
- 모델 기능에 따라 보다 정교한 위상 결정을 달성합니다.
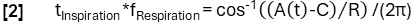
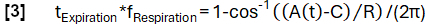
- 그런 다음, 위상에 따라 샘플을 정렬하고 Nadaraya-Watson 커널 회귀를 적용하여 호흡 주기 동안 균일한 간격으로 환기를 계산합니다.
- 방정식 1과 유사하게 각 단계에 대한 지역 환기(RVent)를 계산하고 흡기 단계를 해당 단계로 대체합니다.
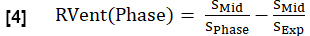
참고: 그림 1 을 참조하여 건강한 지원자의 예시적인 합성된 전체 호흡 주기의 하위 집합을 확인하십시오., 만료에서 시작하여 영감으로 전환한 다음 만료로 돌아갑니다. 정렬 알고리즘에 대한 설명은 그림 4를 참조하십시오.
- 파라미터 계산
참고: 합성된 전체 호흡 및 심장 주기를 사용하여 추가 매개변수를 도출할 수 있습니다. 가장 중요한 매개 변수의 선택은 다음에 설명되어 있습니다. - 지역 환기(RVent)
- 흡기 단계를 사용하여 다음에 따라 RVent를 도출합니다.
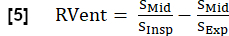
- 흡기 단계를 사용하여 다음에 따라 RVent를 도출합니다.
- 유량-부피-루프 상관 관계 메트릭(FVL-CM)
알림: 모든 호흡 단계를 평가하기 위해 폐 기능 검사와 유사하게 FVL 분석과 동일한 MRI를 생성하기 위해 일련의 단계를 수행합니다.- RVent의 1차 도함수를 사용하여 흐름에 대한 대리로 RVent(Slope of Regional Ventilation)를 계산합니다. 스텝 길이 h인 대칭 차분 지수를 사용합니다.
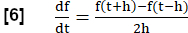
- 선택적으로, 지역 또는 평균 RVent 경사를 각 RVent의 함수로 표시하여 FVL 분석과 동일한 PREFUL을 생성합니다.
- 폐 실질 ROI에서 80번째에서 90번째 백분위수 범위의 RVent 값으로 가장 큰 연결 영역을 식별하여 참조 ROI를 결정합니다.
- 결정된 기준 ROI 내에서 유량 루프의 평균을 구합니다.
- 각 폐 FVC와 기준의 유사성을 확인하려면 폐 실질 ROI의 각 FVC를 지연 없이 기준과 상호 연관시키십시오.
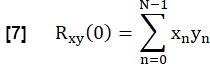
- 다음과 같이 정규화합니다.
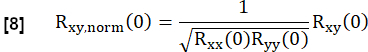
여기서 x와 y는 참조 및 각각의 RVent 흐름 곡선을 나타냅니다.
알림: 제로 래그는 지연된 환기로 인해 상관 관계가 낮아지도록 사용됩니다.
참고: FVL 계산 및 파생된 FVL-CM 메트릭에 대한 그림은 그림 5 를 참조하십시오.
- RVent의 1차 도함수를 사용하여 흐름에 대한 대리로 RVent(Slope of Regional Ventilation)를 계산합니다. 스텝 길이 h인 대칭 차분 지수를 사용합니다.
- 정량화된 관류
참고: Glandorf et al.에 따르면 정량화는 과도 상태(36) 동안 획득된 첫 번째 이미지를 사용하여 수행됩니다.- 3.1.2단계에서 계산된 대로 폐 복셀 양 A를 사용하여 처음 4개의 등록된 이미지를 중간 영감 수준으로 정규화합니다. 다양한 양성자 밀도로 인한 이러한 변조 감소는 다음과 같이 표현됩니다.
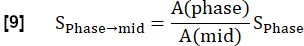
- 모델을 사용하여 최대 자화와 관련된 신호를 추정하기 위해 지수 피팅을 수행합니다.
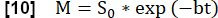
- 폐 실질 ROI에서 가장 큰 신호를 보여주는 심장 주기 단계를 사용하여 실질 관류와 관련된 맵 Q를 결정합니다.
- 지역 혈구 분율(BF)을 추정하려면 검색 ROI(전체 혈액 복셀)에서 99.99번째 백분위수 위의 값을 평균화하여 S0 값을 정규화합니다.
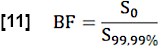
- S0 및 흐름 관련 신호 차이 Q에 의해 결정된 정상 상태(SS)와 초기 상태 간의 최대 중앙 신호 차이의 비율을 고려하여 심장 주기 동안 교환 분율(EF)을 추정합니다.
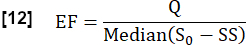
- 푸리에 분석(가장 큰 피크에 해당하는 주파수)을 사용하여 혈관 ROI에서 1/s의 심장 주파수를 결정합니다.
- 다음과 같이 최종 정량화된 관류(QQ)를 mL∙min-1∙100mL-1로 계산합니다.
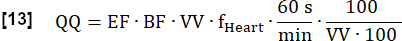
참고: 여기서 복셀 부피(VV)는 [mL/mL]로 취소되고 변환 계수 60 s/min 및 컨벤션 계수 100/100을 사용하여 최종 결과를 [mL∙min-1∙100 mL-1]로 표시합니다. EF와 BF는 무차원 비율입니다.
- 3.1.2단계에서 계산된 대로 폐 복셀 양 A를 사용하여 처음 4개의 등록된 이미지를 중간 영감 수준으로 정규화합니다. 다양한 양성자 밀도로 인한 이러한 변조 감소는 다음과 같이 표현됩니다.
- 임계값 설정 및 통계
- 중간 슬라이스와 평균값(모든 값/중간 슬라이스 값) 및 표준 편차(모든 값/중간 슬라이스 값만)가 있는 모든 슬라이스에 대해 앞서 언급한 매개변수를 통계적으로 설명합니다.
- 또한, 표준 편차를 변동 계수로 정규화하여 분산에 대한 상대적 설명을 얻을 수 있습니다. 평균값과 변동 계수를 최종 통계 출력으로 선택합니다.
- 매개변수 맵에 임계값을 적용하여 결함 맵을 생성하고 결함 백분율 값을 도출합니다( 표 3 참조).
- 임계값 미만의 값을 환기 또는 관류 결함(VD/QD)으로 분류합니다. 이러한 맵을 추가로 결합하여 결함과 정상 영역(V/Q 등급)의 중복을 정량화하며, 표 3의 4겹 표와 같이 다음 조합을 포함합니다.
- 환기 결함(VD), 관류 결함(QD) 및 환기/관류(V/Q) 등급의 결점 백분율을 총 폐 실질 복셀과 관련하여 각 등급의 복셀 수로 계산합니다.
결점 비율 = #DefectVoxels/#LungParenchyma - 각 슬라이스와 화합물 코로나 슬라이스에 대해 이 결점 백분율을 계산합니다. 이 연구에서는 환기 결함이 OR 연산에 의해 결정되는 결합 접근 방식(VD = VD(RVent) 또는 VD(FVL-CM)을 선택합니다.
참고: 설명된 분석은 Forsberg 등록 도구 상자를 사용하여 상용 소프트웨어 앱( 자료 표 참조)으로 수행되었습니다.
| 매개 변수 | 문지방 | 주석 |
| RVent | 90번째 백분위수 * 0.4 | 적응형 임계값 |
| FVL-CM | 90% | 고정 임계값 |
| Q | 90번째 백분위수 * 0.15 | 적응형 임계값 |
| 브이/큐 | QD 없음 | 증권 시세 표시기 |
| 성병 없음 | 보통 | VQ 미스매치 (전용 QD) |
| 브이디 | VQ 불일치(전용 VD) | VQ 결함 정합 |
결과
그림 2의 하단은 동적 범위에 대한 해당 효과와 함께 적절하고 부적절한 스케일링의 결과를 보여줍니다. 그림 6은 불균일한 신호 분포를 보여주며, 이는 코일 정규화가 없는 스캔과 코일 정규화가 있는 스캔을 나타냅니다. 낮은 다이나믹 레인지와 코일 정규화가 없는 이미지는 피하는 것이 좋습니다.
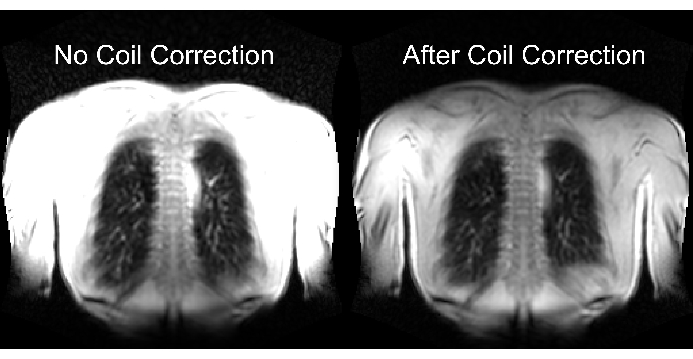
그림 6: 코일 보정을 하지 않은 후(잘못된 것) 및 코일 보정을 한 후(올바름) 촬영 후의 예시적인 이미지. 코일 요소 근처의 본체 경계에서 인공 신호 향상에 유의하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 7 은 자동 세그멘테이션의 성공과 실패를 보여줍니다. 실패한 세분화에는 모든 폐 복셀이 포함되지 않으며, 이는 추가 분석 및 통계를 위조할 수 있습니다. 복셀과 같은 침투가 있는 경우 AI 모델에 의해 높은 신호로 인해 용기로 잘못 분류되거나 전혀 분할되지 않을 수 있으므로 특별한 주의가 필요합니다.
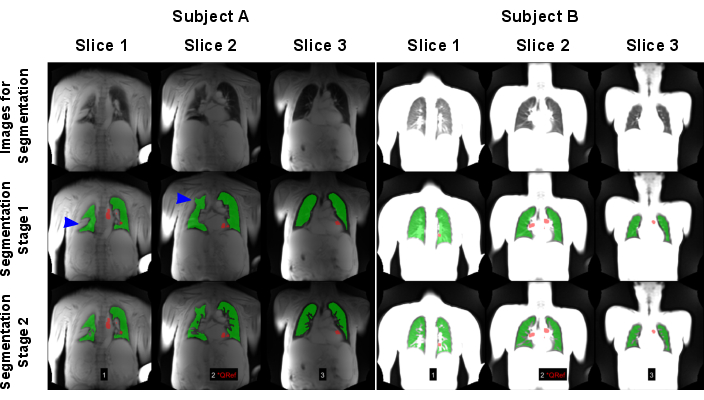
그림 7: 실패한 결과(피험자 A: COPD가 있는 83세 남성)와 성공적인 결과(피험자 B: 30세 여성 건강한 대조군)를 초래하는 자동화된 세분화의 예. 첫 번째 행에는 AI 모델의 입력으로 사용된 이미지가 표시됩니다. 두 번째 행은 폐 경계를 찾는 것으로 구성된 첫 번째 분할 단계의 결과를 보여줍니다. 세 번째 행은 선박을 제외한 후의 최종 결과를 보여줍니다. 파란색 화살표에서 볼 수 있듯이 알고리즘은 잘못된 폐 경계 감지를 유발하는 고신호 폐 분산으로 인해 어려움을 겪었습니다. 이미지는 최대 신호에 의해 정규화되었으며, 이는 피사체 A에 대해 수행된 스캔의 코일 정규화가 누락되어 다른 결과를 낳았습니다. 빨간색 영역은 관류 위상 정렬을 위해 자동으로 감지된 ROI를 나타냅니다. 약어: COPD = 만성 폐쇄성 폐질환; ROI = 관심 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 8 과 그림 9 는 건강한 대조군(30세, 여성)과 COPD 환자(60세, 남성)에 대한 대표적인 파라미터 맵을 보여줍니다. 건강한 대조군은 더 균질한 환기 및 관류를 보여주므로 결함 복셀이 더 적습니다. ROI 통계의 해당 보고서는 표 4 및 표 5에서 찾을 수 있습니다.
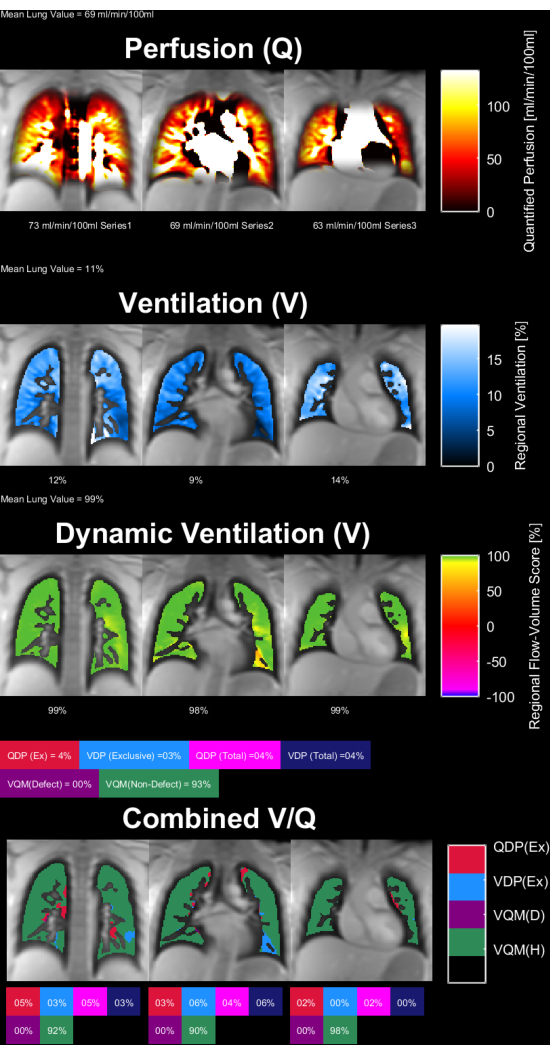
그림 8: 30세 여성의 건강한 대조군의 PREFUL 파라미터 맵. 관류(1번째 행 ), 국소 환기(2번째 행), 유량-부피 루프 상관 관계 메트릭(3번째 행) 및 임계값 V/Q 맵(4번째 행). parenchymal 값의 균질한 분포와 낮은 결점 백분율에 주목하십시오. 약어: PREFUL = 위상 분해 기능성 폐; V = 환기; Q = 관류. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
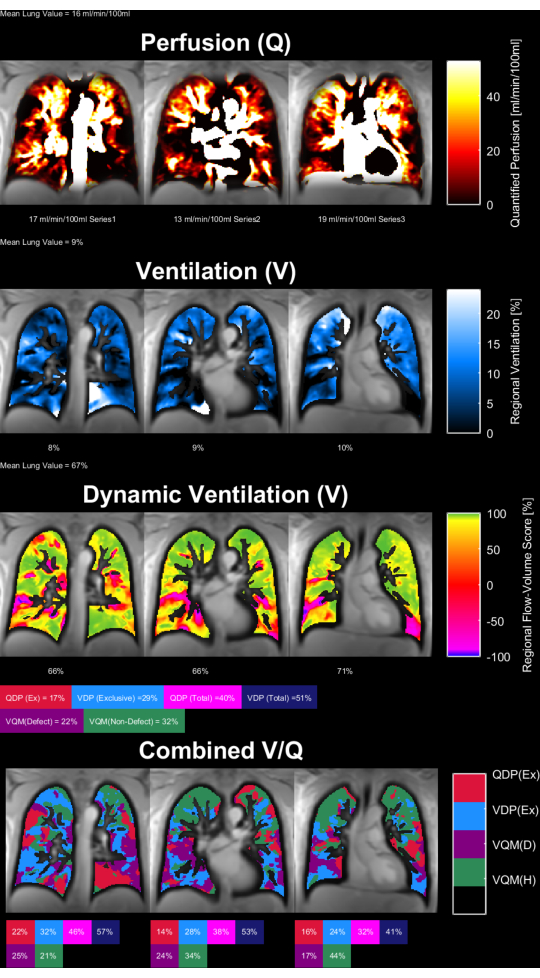
그림 9: 60세 남성 COPD 환자의 PREFUL 파라미터 맵. 관류(1번째 행 ), 국소 환기(2번째 행), 유량-부피 루프 상관 관계 메트릭(3번째 행) 및 임계값 V/Q 맵(4번째 행). 실질 값의 이질적인 분포와 높은 결점 비율에 주목하십시오. 약어: COPD = 만성 폐쇄성 폐질환; PREFUL = 위상 분해 기능성 폐; V = 환기; Q = 관류. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 4: 건강한 대조군(30세 여성)을 위해 얻은 PREFUL 매개변수의 예시적인 보고서. 낮은 변동 계수(coefficient-of-variation)와 결점 값(defect values)은 동일한 주제에 대해 그림 8 에 제시된 파라미터 맵과 일치합니다. 표 5 및 그림 9도 참조하십시오. 약어: PREFUL = phase-resolved functional lung. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 5: COPD 환자(60세 남성)에 대해 얻은 PREFUL 매개변수의 예시적인 보고서. 높은 변동 계수 및 결함 값에 주목하십시오.이 값은 동일한 주제에 대해 그림 9 에 제시된 매개 변수 맵과 일치합니다. 표 4 및 그림 8도 참조하십시오. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 자료: PREFUL 알고리즘에 대한 애니메이션 설명. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
중요 단계
수집 중 가장 흔한 함정 중 하나는 부적절한 신호 스케일링으로, 디지털 데이터 표현의 정밀도가 감소하여 DICOM 변환 중에 정보가 손실됩니다. 결과적으로 후처리 단계에서 문제가 발생할 수 있습니다. 또 다른 훨씬 더 중요한 함정은 인터리브 방식으로 여러 슬라이스를 획득하는 것입니다. 따라서 개별 슬라이스의 효과적인 시간적 해상도가 크게 감소합니다. 또한 slices의 거리에 따라 유입이 자화 이력 없이 새로운 스핀에 의존하기 때문에 관류 대비 및 정량화에 영향을 미칠 수 있습니다. 프로토콜 설정 중에는 특히 그래디언트 강도, 비대칭 에코, 대역폭 및 병렬 이미징과 관련하여 특별한 주의가 필요합니다. 이러한 파라미터 중 하나라도 제안된 설정에서 벗어나면 부적절한 TE 및 시간 분해능이 발생할 수 있습니다.
후처리는 여러 단계로 구성되며 설명된 순서대로 수행해야 합니다. 예를 들어, 저역 통과 필터링 후의 등록은 의미가 없습니다. 결과적으로 한 단계에서 실패하면 다음 단계에서 고장이 발생합니다. 따라서 등록 단계가 특히 중요합니다. 단일 등록 알고리즘이 없기 때문에 각 구현에 따라 매개 변수를 경험적으로 설정해야 합니다. 이러한 매개 변수를 미세 조정하지 않으면 잘못된 등록으로 인해 의미 있는 결과가 생성되지 않습니다. 후처리 중 시간이 많이 걸리고 중요할 수 있는 또 다른 단계는 세분화입니다. 잘못된 세분화는 최종 보고서에서 완전히 잘못된 매개변수 계산(예: 비폐 영역 포함)으로 이어질 수 있습니다. 이러한 잘못된 분할은 딥 러닝 알고리즘에서 발생할 가능성이 더 높은데, 이 알고리즘은 특정 이미지 모양에 익숙하고 약간 다른 모양으로 다른 공급업체/기계의 이미지에 적용됩니다. 따라서 잠재적인 수동 수정과 함께 세분화 정확도에 대한 시각적 품질 검사는 필수입니다.
문제 해결
일반적인 문제 해결 절차는 모든 단계를 하나씩 수행하고 중간 결과의 타당성을 확인하는 것입니다. 주요 단계에 대한 절차는 다음과 같습니다. 이미지가 올바른 순서와 설정으로 자유로운 호흡으로 획득되었는지 확인하십시오. 다음으로, 신호의 동적 범위가 적절한지 확인합니다(폐 실질에서 ~50AU). 원시 데이터를 계속 사용할 수 있는 경우 적절한 배율 인수를 사용하여 이미지 재구성을 반복하여 데이터를 새로 수집할 필요가 없습니다. 주요 아티팩트 및 남은 모션 없이 정합이 수행되었는지 확인합니다. 다음으로, 작은 ROI가 예상되는 환기 및 관류 관련 변조가 있는 시계열을 보여주는지 확인합니다. 그런 다음 적용된 필터가 예상한 방식으로 이미지를 변경하는지 확인합니다(예: 저역 통과 필터링된 데이터에 고주파 변조가 없음). 합성된 호흡 및 심장 주기가 생리학적이고 갑작스러운 점프를 보이지 않는지 확인하십시오. 분할 정확도를 확인합니다. 더 세밀한 해상도 수준에 대한 검색은 문제가 발생하는 기본 단계가 식별되는 즉시 필요할 수 있습니다.
제한
제시된 프로토콜은 재현 가능하고 민감한 결과를 생성하는 것으로 알려져 있지만, 수집 및 후처리 중에 관련된 단계 및 파라미터의 수는 거의 무한한 최적화를 허용하고 서로 얽혀 있습니다. 따라서 상향식 접근 방식을 따르기 위해서는 먼저 시퀀스 프로토콜의 최적화를 해결해야 합니다(예: SNR 및 기능적 대비 대 잡음비에 관한). 다음의 후처리 최적화를 위해, 디지털 폐 모델(digital lung model)의 형태로 사전 정의된 실측 자료(ground truth)가 유용할 수 있다(40). 제시된 바와 같이 이 모델은 자유 호흡 획득을 모방하며 환기/관류 결함을 시뮬레이션하기 위한 여러 클래스를 포함합니다. 움직임으로 인한 알려진 변형을 포함하여 정합 알고리즘을 직접 테스트할 수도 있습니다. 이러한 장점에도 불구하고 각 모델은 복잡한 현실을 유한하고 단순화된 모델에 매핑하는 정확도에 의해 본질적으로 제한됩니다.
이 프로토콜에 제시된 임계값은 경험적 분석을 통해 건강한 지원자와 다양한 환자 코호트에 걸쳐 합리적인 결과를 보여주는 것으로 나타났습니다. 그럼에도 불구하고, 앞서 설명한 바와 같이, 순서, 전계 강도 및 코호트에 따라 조정이 필요할 수 있습니다.
PREFUL의 일반적인 한계는 광범위한 후처리 과정으로, 아직 의료 제품으로 쉽게 사용할 수 없지만, Siemens Healthineers 및 BioVisioneers의 첫 번째 작업 진행 버전은 과학적 협업/상업 환경에서 과학적 목적으로 사용할 수 있습니다. 계산에는 일반적으로 병렬 처리가 포함되며, 이는 특히 CPU 및 RAM에 대한 요구 사항이 높으며 많은 양의 데이터를 효과적으로 처리하기 위해 최신 워크스테이션 또는 서버 솔루션이 필요할 수 있습니다. 또한, 시간이 많이 소요되는 후처리 단계는 현재 결과를 즉각적으로 제시하는 데 방해가 되며, 이는 임상 워크플로우에 바람직합니다.
다른 방법과의 비교
PREFUL과 같은 유사한 접근법이 많이 있으며, 그 중에는 이전의 푸리에 분해법(Fourier Decomposition)과 매트릭스 연필 분해법(Matrix Pencil Decomposition41 ) 및 약간 다른 접근법인 Self-gated Non-Contrast-enhanced Functional Lung MRI (SENCEFUL MRI)42와 같은 다른 접근법이 있습니다. 푸리에 분해 및 이와 유사한 방법이 주파수 영역에서 작동하는 반면, PREFUL은 덜 엄격한 푸리에 필터링과 시간 영역의 진폭 계산을 사용합니다. 따라서 환기/관류에 해당하는 특정 피크를 선택할 필요가 없습니다. 이로 인해 인간 피험자에서 발생하는 것으로 알려진 호흡 변동성에 대한 민감성이 줄어들 수 있습니다.
PREFUL은 이미지 정렬을 수행하는 반면 SENCEFUL은 k-space 라인의 정렬을 사용하여 유연성을 높입니다. 그럼에도 불구하고 SENCEFUL은 자체 게이팅 기능이 있는 시퀀스를 필요로 하는 반면 PREFUL은 기존의 버릇없는 그래디언트 에코 시퀀스로 수행할 수 있습니다. 유사하게, 푸리에 분해 기반 접근법에서 일반적으로 사용되는 bSSFP는 더 나은 SNR 및 혈류 대비로 알려져 있지만, 전형적으로 특히 3T(43)에서 폐 획득을 위해 더 많은 최적화를 필요로 한다. 그럼에도 불구하고, 그 외에는 PREFUL을 bSSFP 획득(44)과 결합하지 않을 이유가 없다.
이러한 모든 신호 기반 접근 방식은 T1, T2/T2*, 확산, 평면 통과 운동 및 비직교 관류 복셀을 포함한 원치 않는 특정 신호 영향이 무시할 수 있다고 가정합니다. PREFUL의 진행된 검증은 실제로 그러한 영향이 중요하지 않다는 것을 간접적으로 시사하지만, Triphan et al.은 효과적인 T1 및 TE에 대한 의존성이 있음을 보여주었으며, 이는 TE45에 따라 혈액 및 실질 구성 요소의 가중치가 다르기 때문에 설명됩니다. 이러한 관점에서, T2/T1 콘트라스트로 인한 혈액을 시각화하는 bSSFP의 초기 이점은 SPGRE의 단순한 콘트라스트 역학과 비교하여 정확한 정량화를 설정하는 데 추가적인 도전을 제기할 수 있습니다. 그럼에도 불구하고, 예를 들어, Glandorf et al.이 조영제46,47에 대해 수행한 바와 같이 다양한 MR-변수의 영향을 직접 다루는 추가 연구는 PREFUL에 대한 효과를 직접 정량화할 수 있기 때문에 바람직합니다.
중요성
PREFUL은 자유롭게 숨을 쉬고 조영제가 없는 방법이기 때문에 앞서 언급한 관련 방법과 많은 장점을 공유합니다: 1) 전리 방사선 및 조영제 도포 없음, 2) 추가 하드웨어 또는 인력 필요 없음, 3) 최소한의 환자 순응도에만 의존하는 획득. 이러한 장점으로 인해 PREFUL은 특히 만성 폐 질환을 앓고 있는 어린이와 같은 취약 계층에게 편리한 모니터링 도구입니다. SPGRE 시퀀스에서는 SNR이 낮지만 가용성과 추가 시퀀스 프로그래밍/공유에 대한 요구 사항이 부족하여 이 접근 방식의 보급을 더욱 촉진합니다.
소개 섹션에서 논의한 바와 같이, 우수한 검증성, 재현성, 민감도 결과 및 모니터링 기능을 보여주는 연구의 수는 이 기술과 해당 동적 매개변수의 중요성이 증가하고 있으며 광범위한 보급에 의해 더욱 뒷받침될 것임을 보여줍니다.
공개
Filip Klimeš, Andreas Voskrebenzev 및 Jens Vogel-Claussen은 폐 자기 공명 영상 방법에 관심이 있는 회사인 BioVisioneers GmbH의 주주입니다.
감사의 말
이 연구는 독일 폐 연구 센터(DZL)의 자금 지원을 받았습니다. 저자는 특히 Marcel Gutberlet, Till F. Kaireit, Lea Behrendt, Julian Glandorf, Sonja Lüdiger, Tawfik Moher Alsady, Katharina Bünemann, Marius Wernz, Robin Müller, Maximilian Zubke, Gesa Pöhler, Agilo Kern, Cristian Crisosto, Milan Speth, Arnd Obert, Julienne Scheller, 짐 와일드, 에드윈 반 베이크, 헬렌 마셜, 옌스 고틀리브, 마르타 도나, 다이앤 렌츠, 안나 마리아 디트리히, 토비아스 벨테, 옌스 홀펠트, 패트릭 자르도, 자일스 산티르, 프란츠 볼프강 히르쉬, 로베르트 그림, 바스티안 비어, 바셈 이스마일, 안드레 피셔, 베르톨트 키퍼, 그레고르 토르머, 레베카 람브. 또한 저자들은 방사선 기사와 연구 참가자에게도 감사를 표하고 싶습니다. 특히, MRI 검사 수행에 탁월한 기술적 도움을 준 방사선과(하노버 의과대학)의 Frank Schröder와 Sven Thiele에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
참고문헌
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유