Method Article
肺換気および灌流 (V/Q) 評価のための位相分解機能肺 MRI
要約
ここでは、肺換気と灌流動態を評価するための造影剤不要の陽子線MR技術としての位相分解機能肺MRIの実装について説明します。さまざまな分野の強みや年齢層で検証され、適用可能なこの手法は、疾患の定量化と治療モニタリングを支援することで、将来的に臨床上の意思決定を強化する可能性があります。
要約
フーリエ分解は、肺灌流(Q)および換気(V)評価のための造影剤不要の1H MRI法です。画像レジストレーション後、各ボクセルの時系列を心拍成分と呼吸周波数成分に関して分析します。
~300 msの時間分解能を持つ標準的な2Dスポイルドグラディエントエコーシーケンスを使用して、画像ソートアルゴリズムを開発し、時間分解能を高めた位相分解機能的肺イメージング(PREFUL)を生成しました。したがって、潮汐量呼吸中の地域流量ループ(FVL)を評価し、心周期中の脈波の伝播を描写することは可能です。この方法は、ほとんどのシステムでデフォルトのSPGREシーケンスを使用して実装できるため、シーケンスプログラミングを必要とせずに、標準のMRハードウェアを使用して1.5Tまたは3Tで適用できます。
PREFUL換気MRIは、 129Xeおよび 19Fガスイメージングを使用して検証されており、地域ごとに良好な合意が得られています。灌流強調 PREFUL MRI は、SPECT および Dynamic Contrast Enhanced (DCE) MRI を使用して検証されています。PREFULは、デュアルセンター、デュアルベンダーの設定でテストされており、現在進行中のいくつかのマルチセンター試験で適用されています。さらに、さまざまな磁場強度(0.55T-3T)と、新生児を含むさまざまな年齢層で実現可能です。
定量的V/Q PREFUL MRIは、嚢胞性線維症、慢性閉塞性肺疾患、慢性血栓塞栓性肺高血圧症、およびコロナウイルス病-2019の患者において、疾患の定量化と治療後の治療変化のモニタリングに使用されています。さらに、PREFUL V/Q イメージングは、肺移植後の患者における慢性肺同種移植片機能障害による移植損失を予測することが示されています。要約すると、PREFUL MRIは、局所的な肺疾患の検出、定量化、および治療モニタリングのための定量的換気および肺脈波/灌流イメージングのための検証済みの技術であり、現在の臨床ルーチンに潜在的な付加価値をもたらします。
概要
呼吸器系は、その複雑なメカニズムにより、さまざまな病気に対して脆弱です。特に、慢性閉塞性肺疾患(COPD)、嚢胞性線維症(CF)、慢性血栓塞栓性肺高血圧症(CTEPH)などの慢性呼吸器疾患は、平均余命を大幅に短縮します1。その結果、早期診断、モニタリング、治療反応評価が最も重要になっています。
肺機能検査 (PFT) は、1 秒間の強制呼気量 (FEV1) と強制肺活量 (FVC) の比率として定義される Tiffeneau-Pinelli 指数などの全体的な肺機能パラメーターを導き出すことができます2。このようなパラメータは、臨床ルーチンでは十分に確立されていますが、地域情報が不足しており、高いレベルの患者コンプライアンスが必要です。この点で、イメージングは、より感度の高いパラメーターについて、さらなる洞察と可能性を提供することができます。コンピュータ断層撮影(CT)は、実質形態の高解像度イメージングを提供し、パラメトリック応答マッピングなどの最近の技術も機能情報を取得します3。それにもかかわらず、単一光子放出型コンピュータ断層撮影法(SPECT)は、肺の換気と灌流(V/Q)を描写するための現在のゴールドスタンダードであり続けています4。すべてに共通して、前述のイメージングモダリティは電離放射線への曝露を必要とし、モニタリングや脆弱なグループの場合には特別な考慮が必要です。そのため、MRIを代替法として推進する取り組みが進められています。
本質的に、肺は陽子密度が低く、信号の減衰が速いため、MRIにとって困難な臓器です5。数あるアプローチの中で、最も普及している解決策には、換気のための過分極ガス( 129Xe MRIなど)の使用6や、 灌流描写のためのガドリニウムベースの造影剤の静脈内投与7などがあります。これらの方法は、高い信号対雑音比(SNR)を提供し、MRコミュニティで広くゴールドスタンダードの方法と見なされています。より最近のアプローチでは、造影剤の適用を回避し、従来の陽子MRを自由呼吸で使用し、合計取得時間を~1分/スライスで実現可能としています。したがって、造影剤の潜在的な有害事象や最近議論されている長期的な影響が回避され、追加の過分極や多核ハードウェアを必要とせずに、より簡単に普及することができます。さらに、導出された換気欠陥値8 に影響を与える可能性のある適切な膨張状態を見つける問題は、自由呼吸の取得によって回避される。
この間接的なMR信号ベースのアプローチは、プロトン強調信号Sと肺容量V:S~1/V.9の相互関係を利用したZapkeらによって最初に導入されました.9 これは、自由呼吸で取得された画像を1つの共通の膨張状態(通常は終了呼気と終了吸気の中間位置)に変換するプロセスに基づいており、それによって動きを補償し、各ボクセルの信号時系列を分析することを可能にします。その後、Klimeš et al.10 の式 (1) を使用して、これらのいわゆるレジストレーション画像から換気測定値を導き出すことができます。
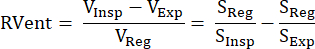 (1)
(1)
吸気(Insp)、有効期限(Exp)、および登録状態(Reg)のボリューム/シグナル。その後、フーリエ分解を導入して、呼吸周波数(換気)とパルス周波数(灌流)に関連する信号変調を区別し、したがって、1つの取得から完全に空間的に一致したV / Qマップを導出することにより、方法が拡張されました11。これは、呼吸と心の周波数の間の典型的なギャップによって可能になり、時間領域で互いに重なり合っている両方の成分がフーリエ解析によって周波数領域で効果的に識別されます。最適化された平衡定常状態自由歳差運動シーケンス(bSSFP)12による低磁場(0.35T)から1.5Tへの移行後、この方法はいくつかの追跡研究13,14,15でより注目を集め始めました。
呼吸とパルスは変動性の影響を受けやすく、1.5Tでの市販のbSSFP(グラジエント補償)イメージングは、かなりのバンディングアーチファクト(信号の空隙の明確な線)をもたらす可能性があるため、スポイルドグラジエントエコーシーケンス(SPGRE)と広範なローパスおよびハイパスフィルタリングを組み合わせた関連方法が提案された16,17.これにより、実際の呼吸および脈拍に関連する変調のより複雑なスペクトルがキャプチャされます。時間領域での振幅の次の計算により、特定の周波数ピークを1つ選択する必要がなくなります。1つの参照状態に対する一般的な1ステップ登録を2つの別々のステップに分割することで、さらなる最適化が達成されました。これにより、自由呼吸中に、エンドインスピレーションとエンド呼気の間にさまざまな異なる呼吸フェーズが獲得され、固定状態に向けて必要な変形の程度が異なるという事実が利用されます。いくつかのグループを選択し、個々の画像のグループを特定した後、次の手順が実行されます:1)それぞれの呼吸状態グループ内での登録、2)1つの隣接するグループから次のグループへの段階的なグループ間登録(たとえば、1->2、2->3,...)参照グループを表すグループへの登録。このアプローチは、換気および灌流ダイナミクスの分析を容易にするために、より高い見かけの時間分解能を確立するために、各画像の位相推定によってさらに拡張され、このブランチを他の関連技術と区別するための位相分解機能肺(PREFUL)MR用語につながった18。追跡研究では、全呼吸および心周期によって提供される追加情報を利用し、そのようなパラメータ19,20,21の感度が潜在的に増加したことを示しました。
ゴールドスタンダードのSPECTによる検証では、欠陥領域22のサイコロ係数が≥67%であることが明らかになり、129Xeを使用したより直接的な換気測定では、COPD/CF/健康な混合コホート23で換気欠陥率の相関≥62%、CFマルチセンター、マルチベンダーコホート24で84%が示され、PREFULおよび129Xeの肺クリアランス指数(r = 0.82およびr = 0.91)と同様の相関が示されました。同じ研究の灌流分析では、評価されたセンター間でDCEとの空間的重複に有意差がないことが示されました25。DCEとの一致およびセンター間のPREFUL結果の一致も、9つのセンターを含む前向きサブスタディについて報告されました26。COPD患者における再現性分析の結果、すべてのパラメータで変動係数が15%未満であった27。現在の研究では、FVLパラメータは、吸気終末期と呼気終末期のみを考慮に入れた「静的」換気パラメータと比較して、治療変化を検出するための予測力と感度が高いことが示唆されています。COPD28 では、インダカテロール-グリコピロニウム (IND/GLY) による吸入器治療後に、領域流量ループ (FVL) 測定による治療に対する応答性が示されました。これと一致して、FVLパラメータは両肺移植患者の移植片損失を予測しましたが、スパイロメトリーは予測できませんでした(P = 0.02対P = 0.33)29。まず、実現可能性調査では、PREFULによる機能的な肺イメージングが、標準的な臨床MRIハードウェア30,31を使用して、自由呼吸の乳児および新生児で実現できることが示されています。Glandorfらは、1.5Tと3T(SPGRE配列)でPREFULパラメータを比較し、ほとんどのパラメータに有意差はなく、電界強度の違いにもかかわらず再現性が高い32ことを確認しました。これは、すべてのサイトが1.5T以下の電界強度スキャナーにアクセスできるわけではないため、重要な利点になる可能性があります。最近、PREFUL33 で bSSFP データを評価することにより、0.55T での COVID-19 感染後の持続的な症状の実現可能性と検出が実証されました。
要約すると、PREFULは比較的新しい技術であるにもかかわらず、広く研究されてきました。より直接的で確立された測定値による検証、再現性、病理学に対する感度、治療や進行の変化に対する反応性などの重要な基準が評価されました。それにもかかわらず、技術的要件が低いにもかかわらず、この技術を使用している専門センターはごくわずかです。したがって、この作業の目的は、PREFUL MRの最新の方法論を書面および視覚的な形式で要約することです。この情報は、この手法をより多くのセンターで確立するために使用できるため、長期的には、より成熟した手法につながります。
プロトコル
この研究は、ハノーバー医科大学の倫理委員会から承認を受け、研究プロセス全体を通じて厳格な倫理基準を遵守していることが保証されました。調査は、ヘルシンキ宣言に概説されたガイドラインに厳密に従い、医学研究の倫理的実施を強調しました。さらに、MRI検査に参加する前に、すべての研究参加者(またはその親または法定後見人)からインフォームドコンセントが熱心に得られました。 図1 では、取得、レジストレーション、フィルタリング、ソーティング、そして最後に心筋および呼吸周期の合成からなる主要なプロトコールステップの概要を簡略化しています。次のセクションでは、関連するすべての手順について詳しく説明します。
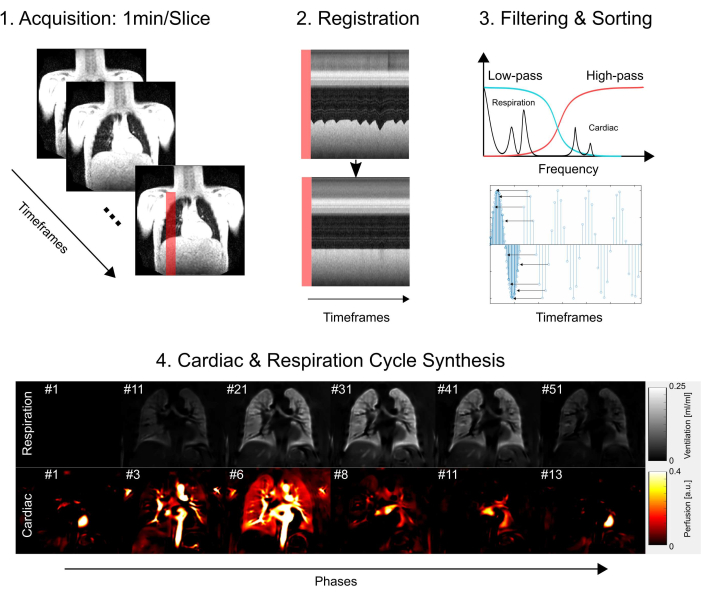
図1:PREFULのコアコンポーネントの概略図 1)自由呼吸での取得(これには2)プロファイルプロットで示されているようにレジストレーションによる運動補償が必要であり、ステップ3)フィルタリングとソートで示されているように、フーリエ成分のボクセルごとの分析が可能になります。ローパス(換気)およびハイパス(灌流)フィルタリングの後、4)推定された位相を使用して、画像をより高い見かけの時間分解能に分類し、1つの完全な心臓および呼吸サイクルを合成します。これは簡略化されたアウトラインであり、完全な詳細は原稿に記載されていることに注意してください。この図では省略されているその他の手順には、パラメーターの定量化とレポート生成が含まれます。略語:PREFUL =位相分解機能肺。 この図の拡大版を表示するには、ここをクリックしてください。
1. 採用
- スパイロメトリー検査および/または以前の画像診断に基づく肺障害の診断に基づいて、患者および健康なコントロール向けの PREFUL MRI 試験で 成人患者または未成年者を募集します (例: X 線または CT スキャン)。インフォームドコンセントを与える能力;-MRIスキャンの期間中、平らに横たわってじっとしている能力;MRIに対する既知の禁忌はありません(例:金属インプラント、閉所恐怖症)。
- 妊娠中、過去 6 か月以内に以前に肺手術を受けたことのある患者、重度の呼吸困難または継続的な酸素補給の必要性がある場合、または PREFUL に加えて造影 MRI を使用する場合は、ガドリニウムベースの造影剤に対する以前に副作用があった患者は除外します。
- 臨床検査と自己報告に基づいて肺疾患の既往歴がない場合、肺機能検査が正常であること、インフォームドコンセントを与えることができること、MRIスキャンの間、横たわってじっとしていること、MRIに対する禁忌が知られていない場合、健康なコントロールを募集します。
- 現在または過去の喫煙歴、既知の肺毒素または職業上の危険への曝露、遺伝性肺疾患の家族歴、肺機能に影響を与える可能性のある既知の慢性疾患、および妊娠に従って、個人を健康なコントロールとして除外します。
- 同意書を取得する。研究の目的と手順、潜在的なリスクと利益、機密性の保証、研究の期間、および結果なしに撤回する権利を含む書面によるインフォームドコンセントフォームが参加者から取得された場合は、プロトコルを続行します。
- 募集に未成年者が含まれる場合は、次の追加手順を適用してください。
- 未成年者の同意に加えて、少なくとも1人の親または保護者から書面によるインフォームドコンセントを取得します。
- 未成年者が理解できる年齢に適した方法で、プロセス全体を提示します。
- 年少の未成年者の場合は、視覚補助、絵本、または簡単な説明を使用してください。
- 研究が年齢層に関連していること、および未成年者が不必要に含まれていないことを確認してください。
- 未成年者は、試験の完全性を妨げる場合を除き、すべての試験関連の手続きにおいて、信頼できる大人(親、保護者など)の同伴を許可します。
注:説明されている手順は、試験が倫理委員会によってレビューおよび承認されたことを前提としています。
- 募集に未成年者が含まれる場合は、次の追加手順を適用してください。
2. 買収
- プレスキャンの安全手順を実施します。
- MRIの前に、患者の詳細な事前スクリーニングを実施して、以前の手術、埋め込み型デバイス、入れ墨、金属片への曝露などの潜在的な禁忌を特定します。
- 到着したら、手術の磁気特性とリスクについて患者を教育します。
- ジュエリー、時計、特定の衣服部品など、すべての個人的な金属アイテムを取り外し、必要に応じてガウンを提供するように患者に指示します。
- 訓練を受けた専門家に、見落とされた金属物体がないか患者を目視検査してもらいます。
- すべての医療機器またはインプラントをMRI適合性のために調査します。
- スタッフと患者の両方の安全のために、緊急時のプロトコルが実施されていることを確認してください。
- 参加者の位置とスキャン
- 患者を頭から向き、0.55T、1.5T、または3Tシステムで仰臥位に寝かせます。
- 安全性と快適さのために、聴覚保護具、緊急用ベル、パッド、毛布を用意してください。
- マルチチャンネルフレックスコイルをあごのすぐ下に配置して、すべての肺領域で最適なコイル感度を確保します。
- 患者の呼吸を妨げることなく安定性を維持するために、コイルの配置を固定してください。
- 患者に目を閉じてから、MRレーザーを使用して肺の中心をマークするように指示します。
- 肺の中心をアイソセンターに合わせ、患者が再び目を開けられるようにします。
- 最初のローカライザーをスキャンして一般的な配向を確立し、続いて横方向の形態学的スキャンを行って気管分岐部を特定します。
- 最初の冠状スライスを気管分岐部に固定し、再現性を高めるための一貫したランドマークとして使用します。
- スキャンプロトコルに応じて、スライス間の距離(端から端まで測定)が100%(スライスの厚さ)の間隔で3つのスライスをキャプチャするか、20%または33%の距離で肺全体にまたがる複数のスライスを取得します。
- 各スライスを完全に 個別に 取得し、インターリーブしません。
- 再構築された画像を画像アーカイブ通信システム(PACS)にアップロードして、後でアクセスして分析します。または、プライバシーとデータ保護の基準を遵守するために、指定されたネットワークドライブまたは同様のストレージソリューションに画像を手動でエクスポートします。
メモ:シーケンスプロトコルとパラメータの詳細については、 表1 および 表2を参照してください。スライスの位置決めを視覚的に表現するには、 図 2 を参照してください。
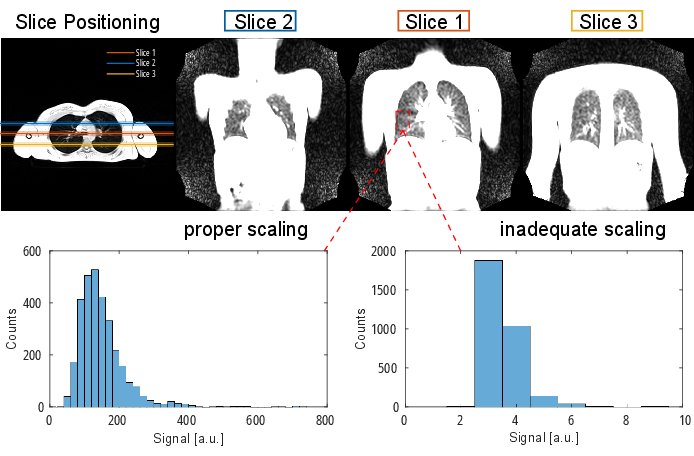
図2:横方向の3Dグラジエントエコーで視覚化されたPREFUL実験の典型的なスライスポジショニング。 最初のスライスは、再現可能なランドマークとして気管分岐部に配置されていることに注意してください。2番目 と3番目の スライスは、前後方向に100%のスライスギャップで配置されています。例示的なヒストグラムは、適切なスケーリングと不適切な(低い)スケーリングで値の分布を示します。後者は、ダイナミックレンジが狭くなり、精度が低下します。クリッピング (ここには示されていません) につながる不適切な高スケーリングも避ける必要があります。略語:PREFUL =位相分解機能肺。 この図の拡大版を表示するには、ここをクリックしてください。
表1:PREFULプロトコルの典型的な概要。 ローカライザーの後、肺の3Dボリュームが横方向に取得されます。この取得は、以下のPREFUL取得を計画するために使用されます(シーケンス設定については 表2 、スライスの位置決めについては 図2 も参照してください)。他の配列は、研究に応じて追加できます。略語:PREFUL =位相分解機能肺。 この表をダウンロードするには、ここをクリックしてください。
表2:スポイルドグラジエントエコーシーケンスを使用したPREFUL取得のシーケンスパラメータの概要。略語:PREFUL =位相分解機能肺;SPGRE = 損なわれたグラディエントエコーシーケンス。この表をダウンロードするには、ここをクリックしてください。
3. ポストプロセッシング
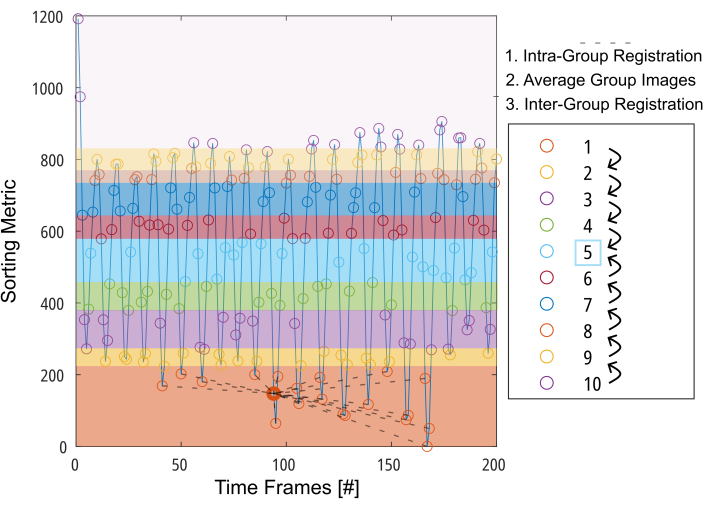
図3:モーション補償に必要な変形を最小限に抑えるためのグループ指向レジストレーションの概略図。 画像(円で表される画像)をソートメトリックに基づいて10のグループ(例:セグメント化された肺領域)に分割した後、画像は各グループ内の中間位置(グループ1は破線で示されています)に登録されます。そして、登録された画像を平均化し、中間グループに向かって段階的にグループ間登録の最終ステップに利用します。略称:GOREG=グループ指向の登録。 この図の拡大版を表示するには、ここをクリックしてください。
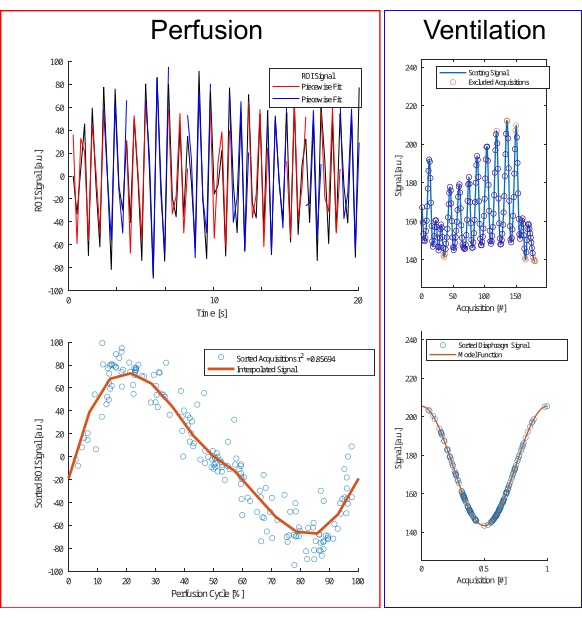
図4:灌流と換気の選別アルゴリズムの図。 灌流(左)の場合、区分的フィッティング(上段)を実行して位相を推定し、取得を並べ替えます(下段)。換気(右)の場合、外れ値は除外され(上段)、振幅と振幅差に基づく余弦モデル(下段)に従ってソートされ、呼気フェーズと吸気フェーズが区別されます。 この図の拡大版を表示するには、ここをクリックしてください。
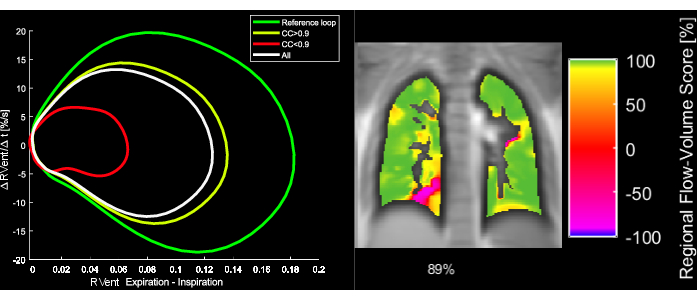
図5:COPDの43歳の女性患者の例示的な流量-体積ループと対応するFVL-相関メトリック。 FVL を変更すると、FVL-CM が減少することに注意してください。略語:FVL =流量ループ;FVL-CM = FVL-相関メトリック;COPD = 慢性閉塞性肺疾患。 この図の拡大版を表示するには、ここをクリックしてください。
表 3: パラメータ マップへのしきい値の適用と欠陥マップの組み合わせ。この表をダウンロードするには、ここをクリックしてください。
- 登録
注:次のセクションでは、呼吸と心臓の動きを補正するためのグループ指向(GOREG)スキームを使用して、参照ボリューム(できれば中レベルの呼吸レベル)への非硬性レジストレーションの手順について説明します。- 画像を取得します。
- 最初に、トレーニング済みの U-Net を使用して、すべての未登録画像に対して肺セグメンテーションを実行し、カットオフが 0.7 Hz のローパス フィルターを適用して、呼吸フェーズの推定値を取得します。
注: これにより、完全に自動化された処理パイプラインが開始され、後続の手順がバックグラウンドで実行されます。示され、説明されている処理手順は、特定のアプリや言語に限定されないため、多くのプログラミング言語を使用してカスタム アプリに実装できます。 - セグメント化されたボクセルの量が多いものを吸気として分類し、少量のボクセルを呼気として分類します。
- 画像を 10 パーセンタイルに分割してグループ化し、結果の 10 グループの各グループに同じ数の画像が含まれるようにします。
- 登録アルゴリズムとして、ANTs 34 (相互相関メトリックを持つ BSplineSyN) または Forsberg35,36 (弾性正則化と流体正則化を伴う多項式展開) を選択します。
- 各グループの中間肺位置に向けて、各グループに対して登録内を実施します。
- グループ結果を平均化して、グループごとに 1 つの画像を取得します。
- 各グループ画像から5番目の グループの方向に次の隣人に向かってインターレジストレーションを実施します。
- 必要に応じて、グループ5の平均化された画像で表される呼吸位置に到達するために、変形のチェーンを元の画像に適用します。たとえば、グループ 3 に属するイメージ 36 の場合、次の 変形フィールド が適用されます: 36->イメージ 57 (~グループ 3 の中間肺位置) -> ステップ 3->4 -> ステップ 4->5。
注: GOREG 手順の詳細については、 図 3 を参照してください。並列計算によるレジストレーションを行い、処理時間を短縮します。GOREGレジストレーションは、各レジストレーションステップに必要な変形量を最小限に抑え、アルゴリズムの収束を安定させるために実行されます。それにもかかわらず、レジストレーションは、中間肺位置に向かって1つの変形ステップで実行することもできます。発表されたすべての 2D PREFUL 研究は ANT を使用していましたが、Forsberg は最大 6 倍速い結果をもたらし、結果は 3D PREFUL 研究で報告されているのと同等の品質でした37。このレポートの例示的な結果は、Forsberg の登録によって作成されました。 図1 を参照して、ダイヤフラムの動きに対するレジストレーション効果の図を確認してください。
- 一般的なフィルタリング
- 画像誘導フィルタリング38を使用して登録画像のノイズを除去し、時間的に平均化された登録画像を誘導画像として採用する。次の設定を適用します: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- 換気および灌流分析では、0.7 Hzのカットオフを持つローパスフィルターまたはハイパスフィルターを使用して、それぞれの他の成分を抑制します。最初の 20 枚の画像を、定量化された灌流計算を除くすべての以降の処理ステップから除外して、含まれる時系列で定常状態を確保します。
注: 被験者の呼吸数が ~40 呼吸/分を超える場合は、カットオフの変更が必要になる場合があります。
- セグメンテーション
注:最終的なセグメンテーションは、次のアウトラインのように、中間肺位置にある登録済みの画像を使用して、2段階の手順で実行されます。- 時間的に平均化された登録画像に対して、トレーニング済みの U-Net または手動で肺境界 (肺 ROI) セグメンテーションを実行します。
- 次に、大きな中央血管を除外して肺境界セグメンテーションを改良し、肺実質の関心領域または ROI を取得します。
- 灌 流
注:取得されたシリーズの各画像の心相を正確に推定するには、次の手順が必要です。これは、特に心拍数(通常は40〜90 bpm)と比較して、比較的低い周波数(~3〜5画像/秒)でサンプリングされます。決定された心相に従ってデータを再配置することで、データ取得のサンプリングレート18 を上回る、時間分解能が向上した完全な心周期を得るために使用される(ソーティング手順の図解については 図4 を参照のこと)。位相推定には、強力な灌流強調シグナルを持つ探索 ROI が必要です。次のように反復検索アルゴリズムを採用します22.- 肺境界 ROI を接続して、検索 ROI に縦隔を含めます。
- 画像シーケンス全体の標準偏差を計算することにより、単純な灌流重み付けマップを生成します。
- 検索 ROI 内でこのマップの 98 パーセンタイルに対応する領域を、後続のステップのシード ROI として特定します。
- ピース単位のフィッティングを実行し、フィッティングのパフォーマンスが向上する限り、シードポイントのサイズを増やします。
- 拡張シード ROI をフィッティング性能に従ってランク付けします。
- 最も拡大したシード ROI を 2 番目に優れた ROI、3 番目に優れた ROI などと繰り返し組み合わせて、組み合わせによってメトリックが改善されないか、すべてのシード ROI が考慮されるまで繰り返し組み合わせます。最終的なROIは、心臓の位相推定に使用される血管ROIであると考えてください。
- 最適化された位相推定内の信号を空間的に平均化して、位相推定用の信号時系列を 1 つ生成します。
- 信号の局所的な最大値を使用して信号を小さな部分に分割し、その後、振幅、位相オフセット、周波数などのパラメータを考慮した区分的正弦波近似を行うことで、区分的推定を実行します(図4)。
- 画像を位相ソートして、1 つの心周期を表します。
- ガウス カーネル (sigma = 0.1) を使用した Nadaraya-Watson カーネル回帰を使用して、1 つの心周期を含む等間隔の時間グリッドに 15 のフェーズを補間します。
注:拡張期から始まり、収縮期に移行し、拡張期に戻る健康なボランティアの例示的な合成全心周期のサブセットについては、 図1 を参照してください。
- 換気
注:灌流分析では、心拍数は比較的安定しており、振幅の変動は無視できることに注意してください。対照的に、換気は潮汐量と潮汐周波数の変動が大きくなる傾向があり、同じ呼吸相が常に同じ振幅を持つとは限らない、異なる呼吸状態につながります。Fischerらのセルフゲーティングアプローチに触発されて、信号の振幅に基づいて換気を分類することが不可欠です。- 経験的ルール(5パーセンタイルより下または97パーセンタイルより上のデータ)を使用して極端な外れ値を除外します。
- 振幅範囲 R とオフセット C を、レジストレーション グルーピング用に作成された信号時系列から導き出します。
- モデル関数 A(t) を任意に選択した周波数 fRespiration (ここでは 0.3 Hz) で定義します。
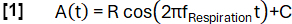
- 傾きに基づいて、データを吸気状態と有効期限状態に分類します。
- モデル関数に従って、より洗練された位相決定を実現します。
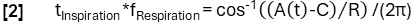
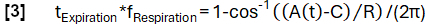
- その後、サンプルを位相に基づいて位置合わせし、Nadaraya-Watsonカーネル回帰を適用して、呼吸サイクル中の等間隔での換気を計算します。
- 式 1 と同様に、各フェーズの局所換気 (RVent) を計算し、吸気フェーズをそれぞれのフェーズに代入します。
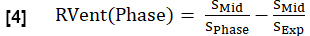
注: 図1 を参照して、健康なボランティアの例示的に合成された完全な呼吸サイクルの一部(呼気から始まり、吸気に移行し、その後呼気に戻る)を確認してください。並べ替えアルゴリズムの図については、 図 4 を参照してください。
- パラメータ計算
注:合成された全呼吸と心周期を使用して、さらにパラメータを導き出すことができます。最も重要なパラメータの選択については、以下で説明します。 - 地域換気(RVent)
- 吸気相を使用して、次のようにRVentを導き出します。
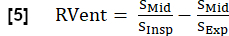
- 吸気相を使用して、次のようにRVentを導き出します。
- フロー・ボリューム・ループ相関メトリック (FVL-CM)
注: すべての呼吸段階を評価するために、一連の手順を実行して、肺機能検査と同様に FVL 分析と同等の MRI を生成します。- RVent の 1 次時間微分を使用して、流れの代理として局所換気 (RVent) の傾きを計算します。ステップ長 h の対称差分商を採用します。
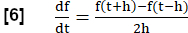
- 必要に応じて、地域別または平均化された RVent 勾配をそれぞれの RVent の関数として表示し、FVL 解析と同等の PREFUL を生成します。
- 肺実質 ROI の 80 パーセンタイルから 90 パーセンタイルの範囲にある RVent 値を持つ最大の接続領域を特定することにより、参照 ROI を決定します。
- 決定された参照 ROI 内の流量ループを平均化します。
- 各肺 FVC と参照の類似性を判断するには、肺実質 ROI の各 FVC を参照とラグをゼロで相互相関させます。
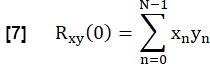
- 次のように正規化します。
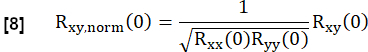
ここで、x と y は参照とそれぞれの RVent 流れ曲線を表します。
注:ゼロラグが採用されているため、換気の遅延による相関関係が低くなります。
注:FVL計算と派生したFVL-CMメトリックの図については、 図5 を参照してください。
- RVent の 1 次時間微分を使用して、流れの代理として局所換気 (RVent) の傾きを計算します。ステップ長 h の対称差分商を採用します。
- 定量灌流
注:定量化は、過渡状態36の間に取得された最初の画像を使用して、Glandorfらに従って行われる。- ステップ 3.1.2 で計算した肺ボクセル量 A を使用して、最初の 4 つの登録済みイメージを中吸気レベルに正規化します。このプロトン密度の変化による変調の減少は、次のように表されます。
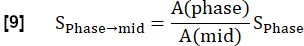
- 指数関数的近似を実行し、モデルを使用して最大磁化に関連する信号を推定します。
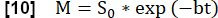
- 肺実質ROIで最も最大のシグナルを示す心周期期を使用して、実質灌流に関連するマップQを決定します。
- 領域血分率 (BF) の推定では、検索 ROI (全血ボクセル) で 99.99 パーセンタイルを超える値を平均化して S0 値を正規化します。
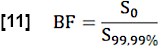
- S0 によって決定される定常状態 (SS) と初期状態の間の最大中央信号差と、流れに関連する信号差 Q の比を考慮して、心周期中の交換率 (EF) を推定します。
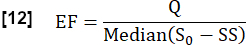
- フーリエ解析を使用して、血管のROIから1/sで心拍周波数 fHeart を決定します(最大のピークに対応する周波数)。
- 最終定量灌流(QQ)をmL・min-1・100mL-1で次のように計算します。
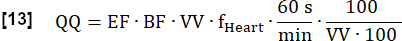
注:ここでは、ボクセル容量(VV)を[mL/mL]キャンセルし、変換係数60 s/minとconvention factor100/100を使用して最終結果を[mL・min-1・100 mL-1]で表示します。EFとBFは無次元比です。
- ステップ 3.1.2 で計算した肺ボクセル量 A を使用して、最初の 4 つの登録済みイメージを中吸気レベルに正規化します。このプロトン密度の変化による変調の減少は、次のように表されます。
- しきい値処理と統計
- 中央のスライスと、平均値 (すべての値/中央のスライス値) と標準偏差 (すべての値/中央のスライス値のみ) を持つすべてのスライスの前述のパラメーターを統計的に記述します。
- さらに、標準偏差を変動係数に正規化して、分散の相対的な説明を求めます。平均値と変動係数を最終的な統計出力として選択します。
- パラメータ・マップにしきい値を適用して、ディフェクト・マップを生成し、ディフェクト・パーセンテージ値を導き出します ( 表 3 を参照)。
- しきい値を下回る値を換気または灌流欠陥(VD/QD)として分類します。これらのマップをさらに組み合わせて、欠陥と正常領域(V/Qクラス)のオーバーラップを定量化します。これには、 表3の4つの表に示すように、次の組み合わせが含まれます。
- 換気欠陥 (VD)、灌流欠陥 (QD)、および換気/灌流 (V/Q) クラスの欠陥パーセンテージを、肺実質ボクセル全体に対するそれぞれのクラスのボクセルの数として計算します。
不良率 = #DefectVoxels/#LungParenchyma - この欠陥率は、各スライスとコンパウンドコロナールスライスについて計算します。この研究では、換気欠陥が OR 演算によって決定される複合アプローチ (VD = VD(RVent) または VD(FVL-CM) を選択します。
注:説明されている分析は、Forsbergレジストレーションツールボックスを使用して、商用ソフトウェアアプリ( 材料の表を参照)で実行しました。
| パラメーター | 閾 | コメント |
| RVentの | 90パー センタイル* 0.4 | 適応しきい値 |
| FVL-CMの | 90% | 固定しきい値 |
| Q | 90パー センタイル * 0.15 | 適応しきい値 |
| V/Q | QDなし | QDの |
| VDなし | 正常 | VQ ミスマッチ (専用 QD) |
| VDの | VQミスマッチ(エクスクルーシブVD) | VQ ディフェクトマッチ |
結果
図2の下部は、適切なスケーリングと不適切なスケーリングの結果と、ダイナミックレンジに対応する影響を示しています。図6は、コイルの正規化を使用しないスキャンとコイル正規化を使用したスキャンを代表する不均一な信号分布を示しています。低ダイナミックレンジやコイル正規化のない画像は避けることをお勧めします。
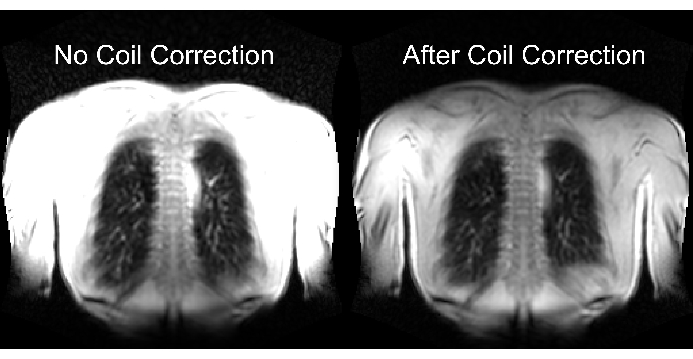
図6:コイル補正なし(不正解)およびコイル補正あり(正解)で取得した後の例示的な画像。 コイル素子の近くのボディ境界での人工的な信号の増強に注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
図 7 は、自動セグメンテーションの成功と失敗を示しています。失敗したセグメンテーションにはすべての肺ボクセルが含まれているわけではないため、今後の分析と統計が改ざんされることに注意してください。浸潤がある場合は、AIモデルによる信号が高いため、ボクセルが血管として誤って分類されたり、まったくセグメント化されなかったりする可能性があるため、特別な注意が必要です。
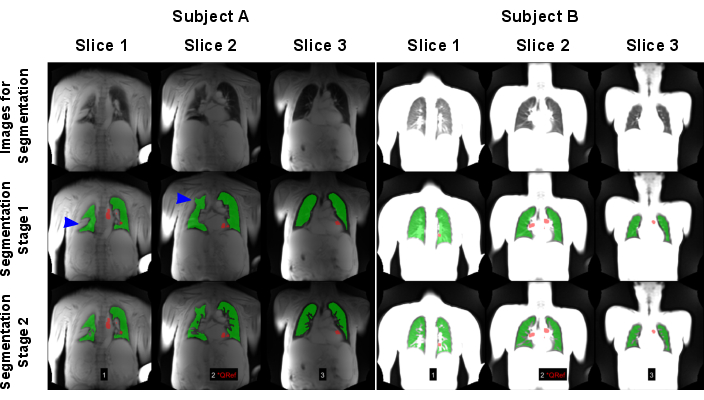
図7:自動セグメンテーションの例で、失敗(被験者A:COPDの83歳男性)と成功した結果(被験者B:30歳女性、健康な対照 )が得られました。最初の行には、AI モデルの入力として使用された画像が表示されます。2 行目は、肺の境界を見つける最初のセグメンテーション段階の結果を示しています。3行目は、船舶を除外した後の最終結果を示しています。青い矢印で示されているように、アルゴリズムは、誤った肺境界検出を引き起こす高信号の肺分散によって課題に直面しました。画像は最大信号によって正規化されたため、被験者Aに対して実行されたスキャンのコイル正規化が欠落しているため、異なる結果が生じたことに注意してください。略語:COPD =慢性閉塞性肺疾患;ROI = 関心領域。 この図の拡大版を表示するには、ここをクリックしてください。
図 8 と 図 9 は、健康なコントロール(30 歳、女性)と COPD 患者(60 歳、男性)の代表的なパラメータ マップを示しています。健康なコントロールでは、より均質な換気と灌流が示され、したがって欠陥ボクセルが少ないことに注意してください。ROI統計の対応するレポートは、 表4 および 表5にあります。
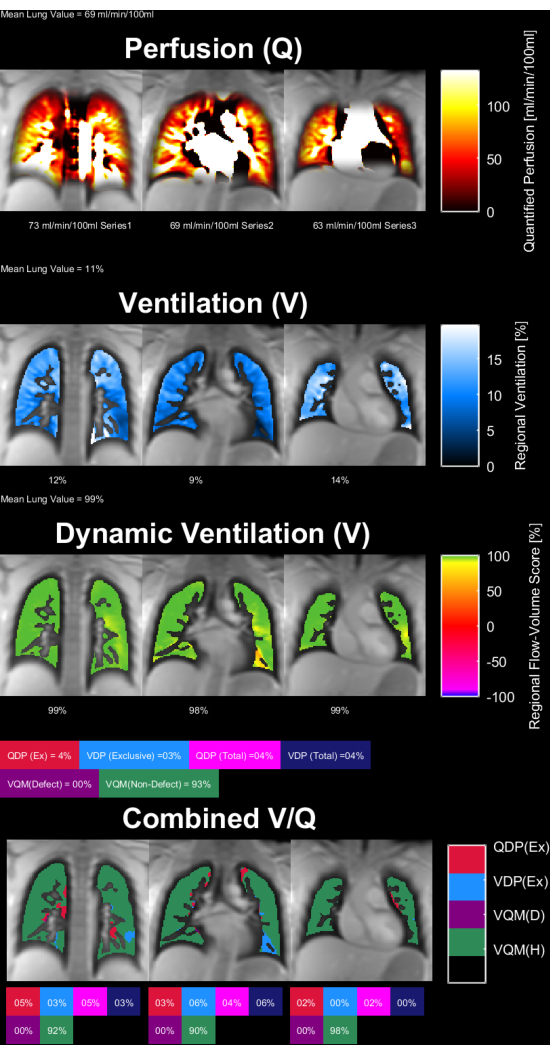
図8:30歳の女性の健康なコントロールのPREFFULパラメータマップ。灌流(1行目)、局所換気(2行目)、流量ループ相関メトリック(3行目)、およびしきい値化されたV / Qマップ(4行目)。実質値の均質な分布と低い欠陥率に注目してください。略語:PREFUL =位相分解機能肺;V =換気;Q = 灌流。この図の拡大版を表示するには、ここをクリックしてください。
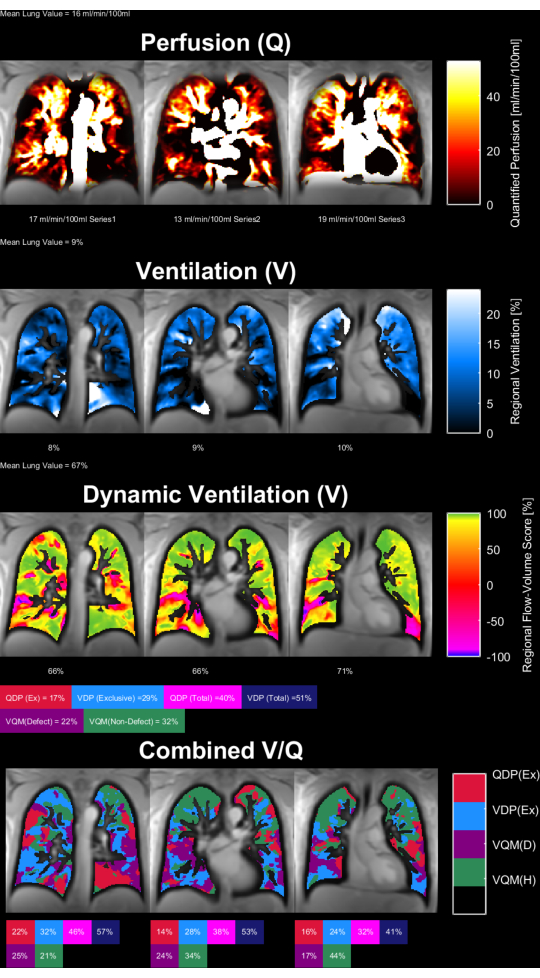
図9:60歳の男性COPD患者のPREFULパラメータマップ。灌流(1行目)、局所換気(2行目)、流量ループ相関メトリック(3行目)、およびしきい値化されたV / Qマップ(4行目)。実質値の不均一な分布と高い欠陥率に注意してください。略語:COPD =慢性閉塞性肺疾患;PREFUL = 位相分解機能肺;V =換気;Q = 灌流。この図の拡大版を表示するには、ここをクリックしてください。
表4:健康な対照(30歳の女性)について得られたPREFULパラメータの例示的な報告。 変動係数と欠陥値が低く、同じ被験者の 図8 に示されているパラメータマップと一致していることに注意してください。 表 5 と 図 9 も参照してください。略語:PREFUL =位相分解機能肺。 この表をダウンロードするには、ここをクリックしてください。
表5:COPD患者(60歳男性)について得られたPREFULパラメータの例示的な報告。 高い変動係数と欠陥の値は、同じ被験者の 図 9 に示されているパラメータ マップと一致していることに注意してください。 表 4 と 図 8 も参照してください。 この表をダウンロードするには、ここをクリックしてください。
補足資料: PREFULアルゴリズムのアニメーション説明。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
重要なステップ
集録時の最も一般的な落とし穴の1つは、信号のスケーリングが不十分であることです。これにより、デジタルデータ表現の精度が低下するため、DICOM変換中に情報が失われます。その結果、後処理段階で問題が発生する可能性があります。さらに重大な落とし穴は、インターリーブ方式で複数のスライスを取得することです。これにより、個々のスライスの有効な時間分解能が大幅に低下します。さらに、スライスの距離によっては、流入が磁化履歴のない新鮮なスピンに依存するため、灌流のコントラストと定量化に影響を与える可能性があります。プロトコールのセットアップ時には、特にグラジエント強度、非対称エコー、帯域幅、およびパラレルイメージングに関して特別な注意が必要です。これらのパラメーターの 1 つだけで推奨設定から逸脱すると、TE と時間分解能が不十分になる可能性があります。
ポストプロセッシングは複数のステップで構成されており、説明されている順序で実行する必要があります。たとえば、ローパス フィルタリング後の登録は意味がありません。その結果、1つのステップで失敗すると、次のステップで故障します。そのため、登録段階は特に重要になります。単一の登録アルゴリズムは存在しないため、それぞれの実装に応じて、パラメーターを経験的に設定する必要があります。これらのパラメータを微調整しないと、誤った登録によって意味のある結果が生成されなくなります。後処理中に時間がかかり、重要なステップとなるもう1つのステップは、セグメンテーションです。誤ったセグメンテーションは、最終レポートに完全に誤ったパラメータ計算(肺以外の領域を含めるなど)につながる可能性があります。このようなミスセグメンテーションは、特定の画像の外観に慣れており、外観がわずかに異なる別のベンダー/マシンの画像に適用されるディープラーニングアルゴリズムで発生する可能性が高くなります。したがって、セグメンテーションの精度を目視で品質チェックし、手動で修正する可能性も必要になります。
トラブルシューティング
一般的なトラブルシューティング手順は、すべての手順を 1 つずつ実行し、中間結果の妥当性を確認することです。主な手順の手順は次のとおりです:画像が正しい順序と設定で自由呼吸で取得されていることを確認してください。次に、信号のダイナミックレンジが適切であることを確認します(肺実質では~50AU)。生データがまだ利用可能な場合は、適切なスケーリング係数で画像の再構築を繰り返し、新しいデータ取得の必要性を回避します。登録が大きなアーティファクトや残りのモーションなしで実行されたことを確認します。次に、小さなROIが、予想される換気および灌流関連の変調を伴う時系列を示しているかどうかを確認します。次に、適用されたフィルターが期待どおりに画像を変更するかどうかを確認します (たとえば、ローパス フィルター データに高周波変調がないなど)。合成された呼吸周期と心周期が生理学的であり、突然のジャンプを示さないかどうかを確認します。セグメンテーションの精度を確認します。より細かい解像度レベルでの検索は、問題が発生するメインステップが特定されるとすぐに必要になる場合があることに注意してください。
制限
提示されたプロトコルは、再現性のある高感度な結果を生成することが知られていますが、取得および後処理中に関与するステップとパラメータの数により、ほぼ無限の最適化が可能になり、絡み合っています。したがって、ボトムアップアプローチの後には、まずシーケンスプロトコルの最適化(例:SNRおよび機能的コントラスト対雑音比)に対処する必要があります。次のポストプロセッシングの最適化では、デジタル肺モデルの形式で事前定義されたグラウンドトゥルースが役立つ場合があります40。示されているように、このモデルは自由呼吸の取得を模倣し、換気/灌流の欠陥をシミュレートするためのいくつかのクラスが含まれています。動きによる既知の変形を含め、レジストレーションアルゴリズムを直接テストすることもできます。これらの利点にもかかわらず、各モデルは、複雑な現実を有限で単純化されたモデルにマッピングする精度によって本質的に制限されます。
このプロトコルで提示された閾値は、経験的分析により、健康なボランティアおよびさまざまな患者コホート間で合理的な結果を示すことがわかりました。それにもかかわらず、前に概説したように、配列、電界強度、およびコホートによっては調整が必要になる可能性があります。
PREFULの一般的な制限は、広範な後処理であり、これはまだ医療製品として容易に入手できませんが、Siemens HealthineersおよびBioVisioneersの最初の進行中のバージョンは、科学的なコラボレーション/商業的な環境で科学的な目的のために利用可能です。通常、計算には並列処理が含まれるため、CPU と RAM に対する要求が特に高く、大量のデータを効果的に処理するには、最新のワークステーションやサーバー ソリューションが必要になる場合があります。さらに、時間のかかる後処理ステップは、現在、結果を即座に提示することを妨げており、これは臨床ワークフローにとって望ましいことです。
他の方法との比較
PREFULには、その前身であるフーリエ分解や、マトリックスペンシル分解41 などの派生物、わずかに異なるアプローチであるセルフゲート非造影機能肺MRI(SENCEFUL MRI)42など、類似のアプローチが多数あります。フーリエ分解や同様の方法は周波数領域で動作しますが、PREFULはそれほど厳密ではないフーリエフィルタリングを使用し、その後の時間領域での振幅の計算を行います。したがって、換気/灌流に対応する特定のピークを選択する必要はありません。これにより、人間の被験者に発生することが知られている呼吸の変動性に対する感受性が低下する可能性があります。
PREFULが画像のソートを行うのに対し、SENCEFULはk空間のラインのソートを使用するため、より柔軟性が高くなります。しかし、SENCEFULにはセルフゲーティング機能を持つシーケンスが必要ですが、PREFULは従来の甘やかされたグラディエントエコーシーケンスで実行できます。同様に、フーリエ分解ベースのアプローチで一般的に使用されるbSSFPは、SNRと血流のコントラストが優れていることが知られていますが、通常、特に3T43での肺の獲得にはより多くの最適化が必要です。それにもかかわらず、それ以外に、PREFULをbSSFP取得44と組み合わせない理由はありません。
これらのシグナルベースのアプローチはすべて、T1、T2/T2*、拡散、平面貫通運動、非直交灌流ボクセルなど、特定の不要な信号の影響が無視できることを前提としています。PREFULの継続的な検証は、間接的にそのような影響が重要ではないことを示唆していますが、Triphanらは、有効なT1とTEに依存していることを示しました。これは、TE45に依存する血液成分と実質成分の重み付けが異なることで説明されます。この観点から、T2/T1 コントラストによる血液の可視化に対する bSSFP の最初の利点は、SPGRE の単純なコントラストメカニズムと比較して、正確な定量を確立するための追加の課題を提起する可能性があります。それにもかかわらず、例えばGlandorfらが造影剤46,47に対して行ったように、さまざまなMR変数の影響に直接対処するさらなる研究が望まれます。これは、PREFULへの影響を直接定量化できるためです。
重要性
PREFULは、自由呼吸法で造影剤を使用しない方法であるため、前述の関連方法と多くの利点を共有しています:1)電離放射線や造影剤の塗布が不要、2)追加のハードウェアや人員が不要、3)取得は最小限の患者コンプライアンスのみに依存します。これらの利点により、PREFULは、特に慢性肺疾患を持つ子供などの脆弱なグループにとって便利なモニタリングツールとなっています。SPGRE配列ではSNRは低いですが、可用性が高く、追加の配列プログラミング/共有の必要性がないことから、このアプローチの普及がさらに促進されます。
導入セクションで説明したように、良好な検証、再現性、感度結果、およびモニタリング機能を示す多くの研究は、この手法と対応する動的パラメータの重要性が上昇軌道に乗っており、広範な普及によってさらに支持されることを示しています。
開示事項
Filip Klimeš氏、Andreas Voskrebenzev氏、Jens Vogel-Claussen氏は、肺磁気共鳴画像法に関心を持つBioVisioneers GmbHの株主です。
謝辞
この研究は、ドイツ肺研究センター(DZL)によって資金提供されました。著者は、PREFULのさらなる発展に貢献し、支援してくださったすべての方々、特にMarcel Gutberlet氏、Till F. Kaireit氏、Lea Behrendt氏、Julian Glandorf氏、Sonja Lüdiger氏、Tawfik Moher Alsady氏、Katharina Bünemann氏、Marius Wernz氏、Robin Müller氏、Maximilian Zubke氏、Gesa Pöhler氏、Agilo Kern氏、Cristian Crisosto氏、Milan Speth氏、Arnd Obert氏、Julienne Scheller氏に深い感謝の意を表します。 ジム・ワイルド、エドウィン・ファン・ベーク、ヘレン・マーシャル、イェンス・ゴットリーブ、マーサ・ドーナ、ダイアン・レンツ、アンナ・マリア・ディートリッヒ、トビアス・ヴェルテ、イェンス・ホールフェルト、パトリック・ザルド、ジャイルズ・サンティール、フランツ・ヴォルフガング・ヒルシュ、ロバート・グリム、バスティアン・ビア、バッセム・イスマイル、アンドレ・フィッシャー、ベルトルト・キーファー、グレゴール・ソーマー、レベッカ・ラムブ。さらに、著者らは、放射線技師と研究参加者にも感謝したいと思います。特に、MRI検査の実施に際し、優れた技術支援を提供してくださった放射線科(ハノーバー医科大学)のFrank Schröder氏とSven Thiele氏に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
参考文献
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved