Method Article
Risonanza magnetica polmonare funzionale risolta in fase per la valutazione della ventilazione e della perfusione polmonare (V/Q)
In questo articolo
Riepilogo
Qui, descriviamo l'implementazione della risonanza magnetica polmonare funzionale risolta in fase come tecnica di risonanza magnetica protonica priva di mezzo di contrasto per la valutazione della ventilazione polmonare e della dinamica della perfusione. Convalidato e applicabile a diversi punti di forza sul campo e gruppi di età, potrebbe migliorare il processo decisionale clinico in futuro aiutando nella quantificazione della malattia e nel monitoraggio della terapia.
Abstract
La decomposizione di Fourier è un metodo di risonanza magnetica 1H senza mezzo di contrasto per la valutazione della perfusione polmonare (Q) e della ventilazione (V). Dopo la registrazione dell'immagine, la serie temporale di ciascun voxel viene analizzata per quanto riguarda le componenti cardiache e di frequenza respiratoria.
Utilizzando una sequenza standard 2D di gradiente-eco viziato con una risoluzione temporale di ~300 ms, è stato sviluppato un algoritmo di ordinamento delle immagini per produrre imaging polmonare funzionale a risoluzione di fase (PREFUL) con una risoluzione temporale aumentata. Pertanto, è possibile valutare i loop regionali di flusso-volume (FVL) durante la respirazione del volume corrente e rappresentare la propagazione dell'onda del polso durante il ciclo cardiaco. Questo metodo può essere applicato a 1,5T o 3T con hardware MR standard senza la necessità di programmazione di sequenze, poiché il protocollo descritto può essere implementato con la sequenza SPGRE predefinita sulla maggior parte dei sistemi.
La risonanza magnetica con ventilazione PREFUL è stata convalidata utilizzando la rilevazione di gas 129Xe e 19F con un buon accordo regionale. La risonanza magnetica PREFUL pesata per perfusione è stata convalidata utilizzando la SPECT e la risonanza magnetica con mezzo di contrasto dinamico (DCE). PREFUL è stato testato in un contesto dual center dual vendor ed è attualmente applicato in diversi studi multicentrici in corso. Inoltre, è fattibile in una gamma di intensità di campo (0,55T-3T) e in diverse fasce d'età, compresi i neonati.
La risonanza magnetica quantitativa V/Q PREFUL è stata utilizzata in pazienti con fibrosi cistica, broncopneumopatia cronica ostruttiva, ipertensione polmonare tromboembolica cronica e malattia da corona virus-2019 per quantificare la malattia e monitorare il cambiamento del trattamento dopo la terapia. Inoltre, è stato dimostrato che l'imaging PREFUL V/Q predice la perdita del trapianto dovuta a disfunzione cronica dell'allotrapianto polmonare nei pazienti dopo il trapianto di polmone. In sintesi, la risonanza magnetica PREFUL è una tecnica convalidata per la ventilazione quantitativa e l'imaging a onde di polso polmonare/perfusione per il rilevamento, la quantificazione e il monitoraggio del trattamento della malattia polmonare regionale con un potenziale valore aggiunto all'attuale routine clinica.
Introduzione
L'apparato respiratorio, con i suoi intricati meccanismi, è vulnerabile a varie malattie. In particolare, le condizioni respiratorie croniche come la broncopneumopatia cronica ostruttiva (BPCO), la fibrosi cistica (FC) e l'ipertensione polmonare tromboembolica cronica (CTEPH) riducono notevolmente l'aspettativa di vita1. Di conseguenza, la diagnosi precoce, il monitoraggio e la valutazione della risposta terapeutica sono diventati fondamentali.
I test di funzionalità polmonare (PFT) possono derivare parametri di funzionalità polmonare globale come l'indice di Tiffeneau-Pinelli, definito come il rapporto tra il volume espiratorio forzato in un secondo (FEV1) e la capacità vitale forzata (FVC)2. Tali parametri sono ben consolidati nella routine clinica, ma mancano di informazioni regionali e richiedono un alto livello di compliance del paziente. A questo proposito, l'imaging può offrire ulteriori informazioni e possibilità per parametri più sensibili. La tomografia computerizzata (TC) offre immagini ad alta risoluzione della morfologia parenchimale e anche tecniche recenti come la mappatura della risposta parametrica recuperano informazioni funzionali3. Ciononostante, la tomografia computerizzata a emissione di fotoni singoli (SPECT) rimane l'attuale gold standard per la rappresentazione della ventilazione e della perfusione (V/Q) nel polmone4. Le modalità di imaging citate richiedono l'esposizione a radiazioni ionizzanti, che richiede un'attenzione particolare nei casi di monitoraggio e nei gruppi vulnerabili. Di conseguenza, è in corso uno sforzo per promuovere la risonanza magnetica come modalità alternativa.
Intrinsecamente, il polmone è un organo impegnativo per la risonanza magnetica a causa della sua bassa densità protonica e del rapido decadimento del segnale5. Tra la moltitudine di approcci, le soluzioni più diffuse includono l'uso di gas iperpolarizzato (ad esempio, 129Xe MRI) per la ventilazione6 e l'applicazione di un mezzo di contrasto a base di gadolinio per via endovenosa per la rappresentazione della perfusione7. Questi metodi offrono un elevato rapporto segnale/rumore (SNR) e sono ampiamente considerati metodi gold standard nella comunità RM. Un approccio più recente evita l'applicazione di qualsiasi mezzo di contrasto ed è fattibile con la risonanza magnetica protonica convenzionale in respirazione libera con un tempo di acquisizione totale di ~1 min/fetta. In questo modo, si evitano potenziali eventi avversi e gli effetti a lungo termine degli agenti di contrasto recentemente dibattuti e si facilita la diffusione senza la necessità di ulteriore iperpolarizzazione e hardware multinucleare. Inoltre, il problema di trovare uno stato di gonfiaggio adeguato, che può influenzare i valori di difetto di ventilazione derivati8 , viene evitato dall'acquisizione della respirazione libera.
Questo approccio basato sul segnale RM indiretto è stato introdotto per la prima volta da Zapke et al. che hanno utilizzato la relazione reciproca tra il segnale pesato in protoni S e il volume polmonare V: S~1/V.9 Si basa sul processo di trasformazione delle immagini acquisite in respirazione libera in uno stato di inflazione comune (tipicamente in una posizione intermedia tra la fine dell'espirazione e la fine dell'inspirazione), compensando così il movimento e consentendo di analizzare le serie temporali del segnale in ciascun voxel. Successivamente, una misurazione della ventilazione può essere derivata da queste cosiddette immagini registrate utilizzando l'equazione (1) di Klimeš et al.10:
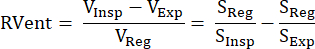 (1)
(1)
Con i volumi/segnali in inspirazione (Insp), scadenza (Exp) e stato registrato (Reg). Successivamente, il metodo è stato ampliato introducendo la decomposizione di Fourier per differenziare tra le modulazioni del segnale associate alla frequenza respiratoria (ventilazione) e alla frequenza del polso (perfusione) e, quindi, derivare una mappa V/Q perfettamente abbinata spazialmente da un'acquisizione11. Ciò è reso possibile dal tipico divario tra la respirazione e le frequenze cardiache, in modo che entrambe le componenti che si trovano una sopra l'altra nel dominio del tempo siano efficacemente discriminate nel dominio della frequenza mediante analisi di Fourier. Dopo il passaggio da un campo basso (0,35 T) a 1,5 T con una sequenza di precessione libera bilanciata allo stato stazionario ottimizzata (bSSFP)12, questo metodo ha iniziato a guadagnare maggiore attenzione con diversi studi di follow-up 13,14,15.
Poiché la respirazione e il polso sono soggetti a variabilità e l'imaging bSSFP (gradient compensated) disponibile in commercio a 1,5T può provocare sostanziali artefatti di banding (chiare linee di vuoto del segnale), è stato proposto un metodo correlato con la sequenza SPGRE (spoiled gradient echo sequence) in combinazione con un ampio filtraggio passa-basso e passa-alto16,17. Questo cattura lo spettro più complesso delle modulazioni reali relative alla respirazione e al polso. Il seguente calcolo dell'ampiezza nel dominio del tempo evita la necessità di selezionare un picco di frequenza specifico. Un'ulteriore ottimizzazione è stata ottenuta suddividendo la tipica registrazione in un solo passaggio verso uno stato di riferimento in due fasi separate. In questo modo si utilizza il fatto che durante la respirazione libera viene acquisita una serie di diverse fasi di respirazione tra la fine dell'inspirazione e la fine dell'espirazione, con vari gradi di deformazione richiesta verso uno stato fisso. Dopo aver scelto diversi gruppi e identificato il gruppo delle singole immagini, viene eseguita la seguente procedura: 1) Registrazione all'interno del rispettivo gruppo di stato respiratorio, 2) Registrazione inter-gruppo Step-by-Step da un gruppo adiacente all'altro (es. 1->2, 2->3,...) al gruppo che rappresenta il gruppo di riferimento. Questo approccio è stato ulteriormente ampliato dalla stima di fase per ciascuna immagine per stabilire una risoluzione temporale apparente più elevata per facilitare l'analisi della ventilazione e della dinamica di perfusione, portando alla terminologia RM polmonare funzionale risolta in fase (PREFUL) per differenziare questo ramo da altre tecniche correlate18. Gli studi di follow-up si sono avvalsi delle informazioni aggiuntive fornite dai cicli respiratori e cardiaci completi e hanno mostrato un potenziale aumento della sensibilità di tali parametri 19,20,21.
La convalida con il gold standard SPECT ha rivelato un coefficiente di dado del ≥67% per le regioni difettose22 e una misurazione più diretta della ventilazione con 129Xe ha mostrato una correlazione delle percentuali di difetti di ventilazione ≥62% in una coorte mista BPCO/CF/sana23 e 84% in una coorte multicentrica e multi-vendorFC 24, che ha anche dimostrato una correlazione simile con l'indice di clearance polmonare di PREFUL e 129Xe (r = 0,82 e r = 0,91). L'analisi di perfusione dello stesso studio ha mostrato che non c'erano differenze significative nella sovrapposizione spaziale con DCE tra i centri valutati25. La concordanza con il DCE e l'accordo dei risultati PREFUL tra i centri sono stati riportati anche per un sottostudio prospettico che comprendeva nove centri26. Un'analisi di riproducibilità nei pazienti con BPCO ha portato a un coefficiente di variazione inferiore al 15% per tutti i parametri27. Gli studi attuali suggeriscono che il parametro FVL ha un potere predittivo e una sensibilità più elevati per rilevare i cambiamenti del trattamento rispetto al parametro di ventilazione "statica", che tiene conto solo delle fasi di fine inspirazione e fine espirazione. La risposta al trattamento con misurazioni dell'ansa flusso-volume regionale (FVL) è stata dimostrata dopo il trattamento con inalatore con indacaterolo-glicopirronio (IND/GLY) nella BPCO28. In concordanza, il parametro FVL prediceva la perdita del trapianto nei pazienti sottoposti a doppio trapianto di polmone, mentre la spirometria non poteva (P = 0,02 vs. P = 0,33)29. I primi studi di fattibilità mostrano che l'imaging polmonare funzionale con PREFUL può essere realizzato in neonati e neonati a respirazione libera con hardware MRI clinico standard30,31. Glandorf et al. hanno confrontato i parametri PREFUL a 1,5T e 3T (sequenza SPGRE) e non hanno trovato differenze significative per la maggior parte dei parametri, che erano altamente riproducibili nonostante la differenza nell'intensità di campo32. Questo potrebbe essere un vantaggio importante, poiché non tutti i siti hanno accesso a scanner con intensità di campo da 1,5 T o inferiori. Recentemente, la fattibilità e l'individuazione di sintomi persistenti dopo l'infezione da COVID-19 a 0,55T è stata dimostrata valutando i dati bSSFP con PREFUL33.
In sintesi, nonostante sia una tecnica relativamente nuova, la PREFUL è stata ampiamente studiata. Sono stati valutati criteri importanti come la convalida con misurazioni più dirette e consolidate, la riproducibilità, la sensibilità per la patologia e la reattività per i cambiamenti del trattamento e della progressione. Tuttavia, solo pochi centri specializzati utilizzano questa tecnica nonostante i bassi requisiti tecnologici. Pertanto, lo scopo di questo lavoro è quello di riassumere la più recente metodologia di PREFUL MR in forma scritta e visiva. Queste informazioni possono essere utilizzate per stabilire questa tecnica in più centri e quindi, a lungo termine, portare a una tecnica più matura.
Protocollo
Questo studio ha ricevuto l'approvazione dal comitato etico della Hannover Medical School, che ha garantito che abbia aderito a rigorosi standard etici durante tutto il processo di ricerca. L'indagine ha seguito rigorosamente le linee guida delineate nella Dichiarazione di Helsinki, sottolineando la condotta etica della ricerca medica. Inoltre, il consenso informato è stato diligentemente ottenuto da tutti i partecipanti allo studio (o dai loro genitori o tutori legali) prima della loro partecipazione all'esame MRI. Vedere la Figura 1 per una panoramica semplificata delle fasi principali del protocollo, che consistono nell'acquisizione, registrazione, filtraggio e smistamento e, infine, nella sintesi del ciclo cardiaco e respiratorio. Nelle sezioni seguenti, tutti i passaggi coinvolti sono descritti in modo dettagliato.
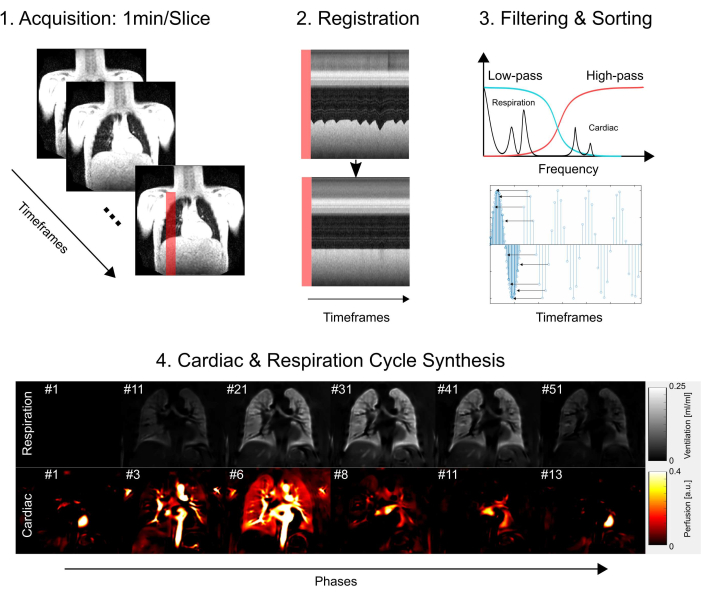
Figura 1: Panoramica schematica dei componenti principali di PREFUL. 1) Acquisizione in respirazione libera, che richiede 2) compensazione del movimento tramite registrazione come dimostrato con i grafici del profilo e consente un'analisi voxel per voxel dei componenti di Fourier come illustrato nel passaggio 3) filtraggio e ordinamento. Dopo il filtraggio passa-basso (ventilazione) e passa-alto (perfusione), 4) la fase stimata viene utilizzata per ordinare le immagini a una risoluzione temporale apparente più elevata e sintetizzare un ciclo cardiaco e respiratorio completo. Si noti che si tratta di uno schema semplificato e tutti i dettagli sono descritti nel manoscritto. I passaggi successivi, che vengono omessi da questa figura, includono la quantificazione dei parametri e la generazione di report. Abbreviazione: PREFUL = polmone funzionale risolto in fase. Clicca qui per visualizzare una versione più grande di questa figura.
1. Reclutamento
- Reclutare pazienti adulti o minoriin uno studio di risonanza magnetica PREFUL per pazienti e controlli sani in base alla loro diagnosi di una malattia polmonare basata su esame spirometrico e/o imaging precedente (ad es. raggi X o TAC); capacità di dare il consenso informato; capacità di sdraiarsi e rimanere fermi per tutta la durata della risonanza magnetica; e nessuna controindicazione nota alla risonanza magnetica (ad esempio, protesi metalliche, claustrofobia).
- Escludere le pazienti in gravidanza, che hanno subito un precedente intervento chirurgico ai polmoni negli ultimi 6 mesi, che hanno grave distress respiratorio o che necessitano di un'integrazione continua di ossigeno, o che hanno avuto precedenti reazioni avverse agli agenti di contrasto a base di gadolinio se la risonanza magnetica con mezzo di contrasto viene utilizzata in aggiunta a PREFUL.
- Reclutare controlli sani se non c'è unastoria nota di malattia polmonare sulla base dell'esame clinico e dell'autovalutazione; i test di funzionalità polmonare sono normali; sono in grado di dare il consenso informato; sono in grado di sdraiarsi e rimanere fermi per tutta la durata della risonanza magnetica; e non hanno controindicazioni note alla risonanza magnetica.
- Escludere gli individui come controlli sani in base alla storia attuale o passata di fumo, esposizione a tossine polmonari note o rischi professionali, storia familiare di malattie polmonari ereditarie, qualsiasi malattia cronica nota che potrebbe influenzare la funzione polmonare e gravidanza.
- Acquisisci i moduli di consenso. Continuare con il protocollo se si ottiene un modulo di consenso informato scritto dal partecipante contenente lo scopo e le procedure della ricerca, eventuali rischi e benefici potenziali, garanzie di riservatezza, durata dello studio e il diritto di ritirarsi senza conseguenze.
- Applicare i seguenti passaggi aggiuntivi quando l'assunzione include minori.
- Ottenere il consenso informato scritto di almeno un genitore o tutore oltre all'assenso del minore.
- Presentare l'intero processo in modo appropriato all'età e comprensibile per il minore.
- Per i minori più piccoli, utilizzare ausili visivi, libri di fiabe o spiegazioni semplificate.
- Assicurarsi che lo studio sia pertinente alla fascia di età e che i minori non vengano inclusi inutilmente.
- Consentire ai minori di essere accompagnati da un adulto di fiducia (ad esempio, genitore, tutore) durante tutte le procedure relative al processo, a meno che ciò non interferisca con l'integrità del processo.
NOTA: Le fasi descritte presuppongono che lo studio sia stato esaminato e approvato dal Comitato Etico.
- Applicare i seguenti passaggi aggiuntivi quando l'assunzione include minori.
2. Acquisizione
- Eseguire la procedura di sicurezza prescan.
- Prima di una risonanza magnetica, condurre uno screening preliminare dettagliato dei pazienti per identificare potenziali controindicazioni come precedenti interventi chirurgici, dispositivi impiantati, tatuaggi o esposizione a frammenti metallici.
- All'arrivo, educare i pazienti sulle proprietà magnetiche e sui rischi della procedura.
- Istruire i pazienti a rimuovere tutti gli oggetti metallici personali, inclusi gioielli, orologi e alcuni componenti dell'abbigliamento, e fornire loro un camice se necessario.
- Chiedi a un professionista qualificato di ispezionare visivamente i pazienti alla ricerca di oggetti metallici trascurati.
- Esamina tutti i dispositivi medici o gli impianti per verificarne la compatibilità con la risonanza magnetica.
- Assicurarsi che siano in atto protocolli di emergenza sia per il personale che per la sicurezza dei pazienti.
- Posizionare il partecipante e scansionare
- Orientare il paziente con la testa in avanti e adagiarlo in posizione supina su un sistema da 0,55 T, 1,5 T o 3 T.
- Fornisci protezioni per l'udito, un campanello di emergenza, un'imbottitura e una coperta per sicurezza e comfort.
- Posiziona una bobina flessibile multicanale appena sotto il mento per garantire una sensibilità ottimale della bobina in tutte le aree polmonari.
- Fissare il posizionamento della bobina per mantenere la stabilità senza ostacolare la respirazione del paziente.
- Istruire il paziente a chiudere gli occhi, quindi segnare il centro del polmone utilizzando il laser RM.
- Allineare il centro polmonare all'isocentro e consentire al paziente di riaprire gli occhi.
- Scansione dei localizzatori iniziali per stabilire un orientamento generale, seguita da una scansione morfologica trasversale per identificare la biforcazione tracheale.
- Ancorare la prima fetta coronale alla biforcazione tracheale come punto di riferimento coerente per migliorare la riproducibilità.
- A seconda del protocollo di scansione, è possibile acquisire tre fette distanziate con una distanza da fetta a fetta (misurata da un bordo all'altro) del 100% (dello spessore della fetta) o acquisire più fette che coprono l'intero polmone con una distanza del 20% o del 33%.
- Acquisisci ogni sezione completamente separatamente e non interlacciata.
- Caricare le immagini ricostruite sul sistema di archiviazione e comunicazione delle immagini (PACS) per il successivo accesso e analisi. In alternativa, per rispettare gli standard di privacy e protezione dei dati, esportare manualmente le immagini su un'unità di rete designata o su una soluzione di archiviazione simile.
NOTA: Per informazioni dettagliate sul protocollo di sequenza e sui parametri, fare riferimento alla Tabella 1 e alla Tabella 2. Per una rappresentazione visiva del posizionamento delle sezioni, vedere la Figura 2.
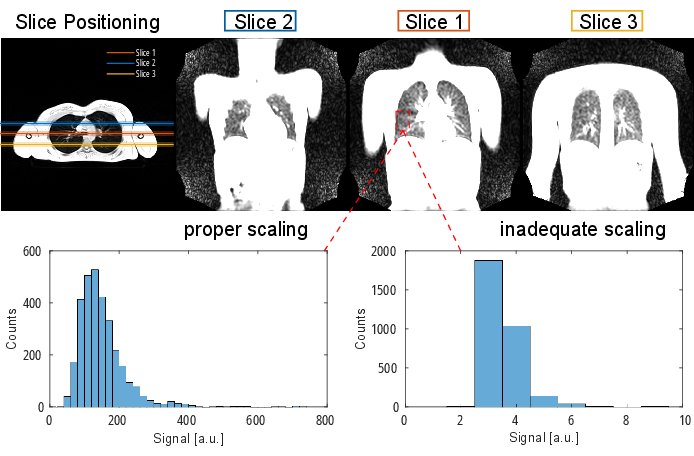
Figura 2: Un tipico posizionamento della fetta per un esperimento PREFUL visualizzato con un'eco a gradiente 3D in orientamento trasversale. Si noti che la prima fetta è posizionata in corrispondenza della biforcazione tracheale come punto di riferimento riproducibile. La 2ae la 3a fetta sono posizionate con una fessura del 100% nelle direzioni anteriore e posteriore. Istogrammi esemplari mostrano distribuzioni di valori con una scala corretta e inadeguata (bassa). Quest'ultimo porta a una bassa gamma dinamica e a una perdita di precisione. Anche un ridimensionamento elevato inadeguato, che porta al clipping (non mostrato qui), dovrebbe essere evitato. Abbreviazione: PREFUL = polmone funzionale risolto in fase. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Uno schema tipico di un protocollo PREFUL. Dopo un localizzatore, viene acquisito un volume 3D del polmone in orientamento trasversale. Questa acquisizione viene utilizzata per pianificare le seguenti acquisizioni PREFUL (vedere anche la Tabella 2 per le impostazioni della sequenza e la Figura 2 per il posizionamento della fetta). Altre sequenze possono essere aggiunte a seconda dello studio. Abbreviazione: PREFUL = polmone funzionale risolto in fase. Clicca qui per scaricare questa tabella.
Tabella 2: Il riepilogo dei parametri di sequenza per l'acquisizione PREFUL con sequenza di eco a gradiente rovinato. Abbreviazioni: PREFUL = polmone funzionale a risoluzione di fase; SPGRE = sequenza di eco a gradiente rovinato. Clicca qui per scaricare questa tabella.
3. Post-elaborazione
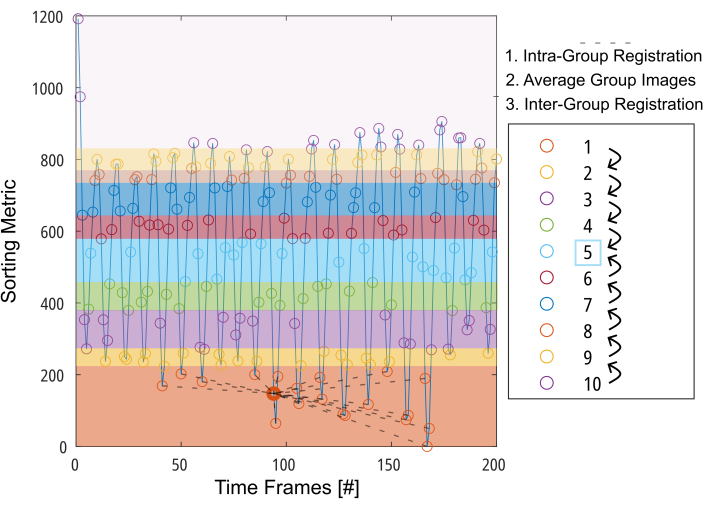
Figura 3: Presentazione schematica della registrazione orientata al gruppo per minimizzare la deformazione richiesta per la compensazione del movimento. Dopo aver diviso le immagini (rappresentate da cerchi) in 10 gruppi in base a una metrica di ordinamento (ad esempio, area polmonare segmentata), le immagini vengono registrate all'interno di ciascun gruppo in una posizione intermedia (illustrata da linee tratteggiate per il gruppo 1). Quindi, le immagini registrate vengono mediate e utilizzate per la fase finale della registrazione inter-gruppo in modo graduale verso il gruppo intermedio. Abbreviazione: GOREG = registrazione orientata al gruppo. Clicca qui per visualizzare una versione più grande di questa figura.
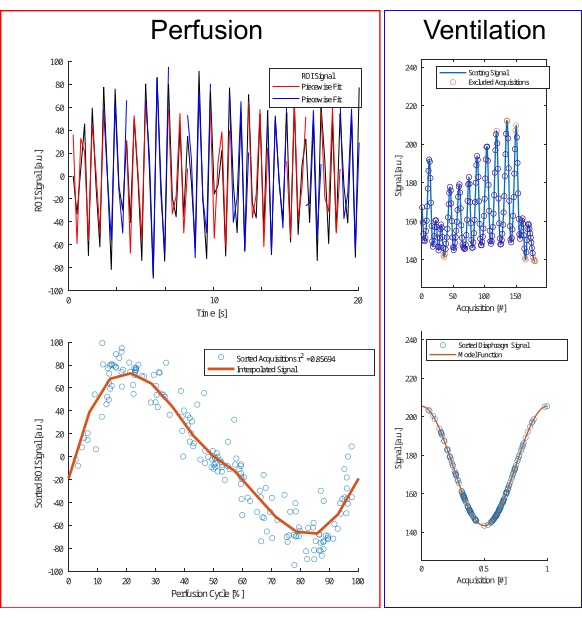
Figura 4: Illustrazione dell'algoritmo di smistamento per la perfusione e la ventilazione. Per la perfusione (a sinistra), viene eseguito un adattamento a tratti (riga superiore) per stimare la fase e ricorrere alle acquisizioni (riga inferiore). Per la ventilazione (a destra), i valori anomali vengono esclusi (riga superiore) e ordinati in base a un modello a coseno (riga inferiore) in base all'ampiezza e al differenziale di ampiezza per distinguere tra le fasi di espirazione e inspirazione. Clicca qui per visualizzare una versione più grande di questa figura.
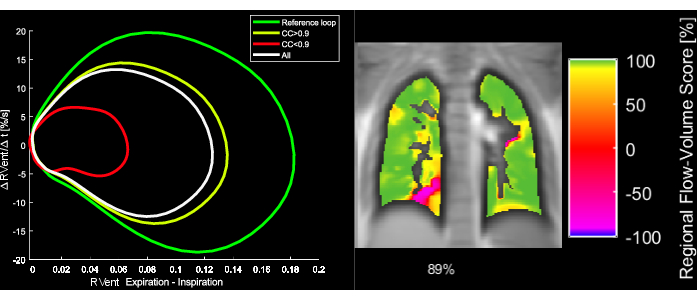
Figura 5: Loop flusso-volume esemplari e la corrispondente metrica di correlazione FVL di una paziente di 43 anni con BPCO. Si noti che con la modifica del FVL, il FVL-CM diminuisce. Abbreviazioni: FVL = loop flusso-volume; FVL-CM = metrica di correlazione FVL; BPCO = broncopneumopatia cronica ostruttiva. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 3: Applicazione delle soglie alle mappe dei parametri e combinazione delle mappe dei difetti. Clicca qui per scaricare questa tabella.
- Registrazione
NOTA: Nella sezione seguente, viene descritta la procedura per la registrazione non rigida a un volume di riferimento (preferibilmente il livello di respirazione medio) utilizzando uno schema orientato al gruppo (GOREG) per la compensazione della respirazione e del movimento cardiaco.- Recupera le immagini.
- Inizialmente, eseguire la segmentazione polmonare su tutte le immagini non registrate, con un U-Net addestrato e applicare un filtro passa-basso con un cut-off di 0,7 Hz per ottenere una stima delle fasi di respirazione.
NOTA: verrà avviata la pipeline di elaborazione completamente automatizzata, che eseguirà i passaggi successivi in background. I passaggi di elaborazione dimostrati e descritti non sono limitati a un'app o a un linguaggio specifico e pertanto possono essere implementati in un'app personalizzata con molti linguaggi di programmazione. - Classifica un'elevata quantità di voxel segmentati come ispirazione e una quantità bassa come scadenza.
- Raggruppa le immagini dividendole in decimi percentili, assicurandoti che ogni gruppo dei 10 gruppi risultanti contenga un numero uguale di immagini.
- Selezionare ANTs34 (BSplineSyN con metrica di correlazione incrociata) o Forsberg35,36 (espansione polinomiale con regolarizzazione elastica e fluida) come algoritmo di registrazione.
- Effettuare l'Intra-registrazione per ciascun gruppo verso la posizione polmonare intermedia del rispettivo gruppo.
- Calcola la media dei risultati del gruppo per ottenere un'immagine per ogni gruppo.
- Effettuare l'inter-registrazione andando da ogni immagine di gruppo verso il vicino successivo in direzione del 5° gruppo.
- Applicare la catena di deformazioni alle immagini originali, se necessario per raggiungere la posizione respiratoria rappresentata dall'immagine media del gruppo 5. Ad esempio, per l'immagine 36, che appartiene al gruppo 3, vengono applicati i seguenti campi di deformazione : 36->Immagine 57 (~Posizione polmonare intermedia nel gruppo 3) -> Passaggio 3->4 -> Passaggio 4->5.
NOTA: Per una descrizione dettagliata della procedura GOREG, fare riferimento alla Figura 3. Eseguire la registrazione con il calcolo parallelo per ridurre i tempi di elaborazione. La registrazione GOREG viene eseguita per ridurre al minimo la quantità di deformazione richiesta per ogni fase di registrazione e quindi garantire una convergenza stabile dell'algoritmo. Tuttavia, la registrazione può essere eseguita anche con un solo passo di deformazione verso la posizione polmonare intermedia. Mentre tutti gli studi 2D PREFUL pubblicati hanno utilizzato le ANT, Forsberg produce risultati fino a 6 volte più veloci con risultati di qualità comparabile a quelli riportati da uno studio 3D PREFUL37. I risultati esemplari di questo rapporto sono stati generati con la registrazione Forsberg. Fare riferimento alla Figura 1 per vedere un'illustrazione dell'effetto di registrazione sul movimento del diaframma.
- Filtraggio generale
- Riduzione del rumore delle immagini registrate utilizzando il filtro guidato dalle immagini38, utilizzando l'immagine registrata con media temporale come immagine guida. Applicare le impostazioni seguenti: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- Per l'analisi della ventilazione e della perfusione, utilizzare un filtro passa-basso o passa-alto con un cut-off a 0,7 Hz per sopprimere il rispettivo altro componente. Escludere le prime 20 immagini da tutte le ulteriori fasi di elaborazione, ad eccezione del calcolo della perfusione quantificata, per garantire lo stato stazionario nelle serie temporali incluse.
NOTA: Potrebbe essere necessaria una modifica del cut-off se i soggetti hanno una frequenza respiratoria superiore a ~40 respiri/min.
- Segmentazione
NOTA: La segmentazione finale viene eseguita utilizzando le immagini registrate in posizione polmonare intermedia in una procedura in due fasi, come descritto di seguito.- Esegui la segmentazione del limite polmonare (ROI polmonare) sulle immagini registrate con media temporale con una U-Net addestrata o manualmente.
- Quindi, escludere i grandi vasi centrali per affinare la segmentazione del confine polmonare e ottenere una regione di interesse o ROI per il parenchima polmonare.
- Perfusione
NOTA: I seguenti passaggi sono necessari per stimare con precisione la fase cardiaca per ciascuna immagine della serie acquisita, che viene campionata a una frequenza relativamente bassa (~3-5 immagini/s), soprattutto rispetto alla frequenza cardiaca (tipicamente 40-90 bpm). La riorganizzazione dei dati in base alle fasi cardiache determinate viene utilizzata per ottenere il ciclo cardiaco completo con una maggiore risoluzione temporale, superando la frequenza di campionamento dell'acquisizione dei dati18 (fare riferimento alla Figura 4 per un'illustrazione della procedura di ordinamento). Per la stima della fase, è necessario un ROI di ricerca con un forte segnale ponderato in perfusione. Utilizzare un algoritmo di ricerca iterativo come segue22.- Collegare la ROI del limite polmonare per includere il mediastino nella ROI della ricerca.
- Genera una semplice mappa ponderata in perfusione calcolando la deviazione standard nella sequenza di immagini.
- Identifica le regioni corrispondenti al 98° percentile di questa mappa all'interno del ROI di ricerca come ROI iniziali per i passaggi successivi.
- Eseguire l'adattamento pezzo per pezzo, aumentando le dimensioni dei punti di semina purché le prestazioni di montaggio migliorino.
- Classifica i ROI dei seed ampliati in base alle loro prestazioni di adattamento.
- Combina iterativamente i ROI dei seed più espansi con il secondo, il terzo migliore, ecc., fino a quando la combinazione non migliora la metrica o non vengono considerati tutti i ROI dei seed. Si consideri che il ROI finale è il ROI del vaso utilizzato per la stima della fase cardiaca.
- Calcolare la media spaziale del segnale all'interno della stima di fase ottimizzata per produrre una serie tempo-segnale per la stima di fase.
- Eseguire la stima a tratti segmentando il segnale in porzioni più piccole utilizzando i massimi locali del segnale, seguiti da un adattamento sinusoidale a tratti considerando parametri come ampiezza, offset di fase e frequenza (Figura 4).
- Ordina le immagini in fase per rappresentare un ciclo cardiaco.
- Impiegare la regressione del kernel di Nadaraya-Watson con un kernel gaussiano (sigma = 0,1) per interpolare 15 fasi su una griglia temporale uniformemente distanziata che comprende un singolo ciclo cardiaco.
NOTA: Fare riferimento alla Figura 1 per un sottoinsieme di un ciclo cardiaco completo sintetizzato esemplare di un volontario sano, a partire dalla diastole, passando alla sistole e tornando alla diastole.
- Ventilazione
NOTA: Per l'analisi della perfusione, si noti che la frequenza cardiaca rimane relativamente stabile con variazioni di ampiezza trascurabili. Al contrario, la ventilazione tende a subire maggiori variazioni nel volume e nella frequenza corrente, portando a diversi stati respiratori con fasi respiratorie identiche che non sempre hanno la stessa ampiezza. Ispirati dall'approccio self-gating di Fischer et al., è essenziale classificare la ventilazione in base all'ampiezza del segnale.- Escludi i valori anomali estremi utilizzando regole empiriche (dati inferiori al 5° o superiori al 97° percentile).
- Ricavare l'intervallo di ampiezza R e l'offset C dalla serie segnale-tempo creata per il raggruppamento delle registrazioni.
- Definisci una funzione del modello A(t) con una frequenza fRespirazione selezionata arbitrariamente (qui 0,3 Hz):
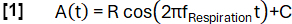
- Classificare i dati in stati di inspirazione ed espirazione in base alla pendenza.
- Ottenere una determinazione di fase più precisa in base alla funzione del modello:
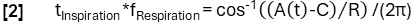
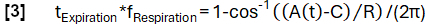
- Successivamente, allineare i campioni in base alla loro fase e applicare la regressione del kernel Nadaraya-Watson per calcolare la ventilazione a intervalli uniformemente distanziati durante il ciclo respiratorio.
- Calcolare la ventilazione regionale (RVent) per ciascuna fase in analogia con l'equazione 1, sostituendo la fase di inspirazione con la rispettiva fase.
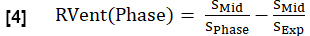
NOTA: Fare riferimento alla Figura 1 per vedere un sottoinsieme di un ciclo respiratorio completo sintetizzato esemplare di un volontario sano, che inizia all'espirazione, passa all'inspirazione e poi ritorna all'espirazione. Per un'illustrazione dell'algoritmo di ordinamento, vedere la Figura 4.
- Calcolo dei parametri
NOTA: Utilizzando la respirazione completa sintetizzata e i cicli cardiaci, è possibile derivare ulteriori parametri. Di seguito viene descritta una selezione dei parametri più importanti. - Ventilazione regionale (RVent)
- Utilizzando la fase inspiratoria derivare RVent secondo:
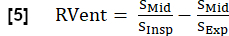
- Utilizzando la fase inspiratoria derivare RVent secondo:
- Metrica di correlazione flusso-volume-loop (FVL-CM)
NOTA: Per valutare tutte le fasi della respirazione, viene eseguita una serie di passaggi per generare una risonanza magnetica equivalente all'analisi FVL in analogia al test di funzionalità polmonare.- Calcolare la pendenza della ventilazione regionale (RVent) come surrogato del flusso utilizzando la derivata temporale prima di RVent. Impiegare un quoziente di differenza simmetrica con la lunghezza del passo h:
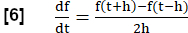
- Facoltativamente, visualizzare le pendenze RVent regionali o medie in funzione del rispettivo RVent, generando così un equivalente PREFUL dell'analisi FVL.
- Determinare un ROI di riferimento identificando la regione connessa più grande con valori RVent nell'intervallo tra l'80° e il 90° percentile nel ROI del parenchima polmonare.
- Fare la media dei loop flusso-volume all'interno del ROI di riferimento determinato.
- Per determinare la somiglianza di ciascuna FVC polmonare con il riferimento, correlare in modo incrociato ciascuna FVC nel ROI del parenchima polmonare al riferimento con ritardo zero:
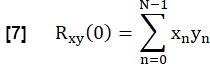
- Normalizzarlo in base a:
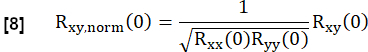
In questo caso, x e y rappresentano il riferimento e la rispettiva curva di flusso RVent.
NOTA: Si noti che viene impiegato lo zero-lag in modo che la ventilazione ritardata risulti in una correlazione inferiore.
NOTA: Fare riferimento alla Figura 5 per un'illustrazione del calcolo FVL e della metrica FVL-CM derivata.
- Calcolare la pendenza della ventilazione regionale (RVent) come surrogato del flusso utilizzando la derivata temporale prima di RVent. Impiegare un quoziente di differenza simmetrica con la lunghezza del passo h:
- Perfusione quantificata
NOTA: La quantificazione viene eseguita secondo Glandorf et al. utilizzando le prime immagini acquisite durante lo stato transitorio36.- Normalizza le prime quattro immagini registrate al livello medio di inspirazione utilizzando la quantità di voxel polmonare A calcolata nel passaggio 3.1.2. Questa riduzione della modulazione causata dalla variazione della densità protonica è espressa come:
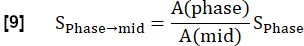
- Eseguire un adattamento esponenziale per stimare il segnale associato alla magnetizzazione massima utilizzando il modello:
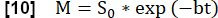
- Determinare una mappa Q correlata alla perfusione parenchimale utilizzando la fase del ciclo cardiaco che mostra i segnali più massimi nel ROI del parenchima polmonare.
- Per la stima della frazione ematica regionale (BF), normalizzare il valore S0 calcolando la media dei valori superiori al 99,99° percentile nel ROI di ricerca (voxel del sangue intero):
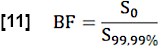
- Stimare la frazione di scambio (EF) durante un ciclo cardiaco considerando il rapporto tra la differenza mediana massima del segnale tra lo stato stazionario (SS) e lo stato iniziale determinato da S0 e la differenza del segnale correlata al flusso Q:
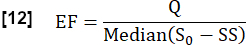
- Determinare la frequenza cardiaca fCuore in 1/s dal ROI del vaso utilizzando l'analisi di Fourier (frequenza corrispondente al picco maggiore).
- Calcolare la perfusione quantitativa finale (QQ) in mL∙min-1∙100 mL-1 come segue:
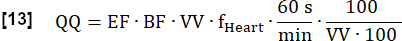
NOTA: In questo caso, il volume dei voxel (VV) viene annullato [mL/mL] e il fattore di conversione 60 s/min e il fattore di convenzione 100/100 vengono utilizzati per visualizzare il risultato finale in [mL∙min-1∙100 mL-1]. EF e BF sono rapporti adimensionali.
- Normalizza le prime quattro immagini registrate al livello medio di inspirazione utilizzando la quantità di voxel polmonare A calcolata nel passaggio 3.1.2. Questa riduzione della modulazione causata dalla variazione della densità protonica è espressa come:
- Soglie e statistiche
- Descrivi statisticamente i parametri di cui sopra per la fetta centrale e tutte le fette con il valore medio (tutti i valori/valori della fetta centrale) e la deviazione standard (tutti i valori / solo i valori della fetta centrale).
- Inoltre, normalizzare la deviazione standard del coefficiente di variazione per ottenere un conto relativo della dispersione. Selezionare il valore medio e il coefficiente di variazione come output statistici finali.
- Applicare soglie alle mappe dei parametri per generare mappe dei difetti e derivare i valori percentuali dei difetti (vedere la Tabella 3).
- Classificare i valori al di sotto delle soglie come difetto di ventilazione o di perfusione (VD/QD). Combinare ulteriormente queste mappe per quantificare la sovrapposizione di difetti e regioni normali (classi V/Q), comprese le seguenti combinazioni, come mostrato nella tabella quadrupla della Tabella 3:
- Calcolare la percentuale di difetto delle classi Difetto di Ventilazione (VD), Difetto di Perfusione (QD) e Ventilazione/Perfusione (V/Q) come il numero di voxel con la rispettiva classe in relazione ai voxel totali del parenchima polmonare:
Percentuale di difetti = #DefectVoxels/#LungParenchyma - Calcola questa percentuale di difetti per ogni fetta e le fette coronali composte. Per questo studio, scegliere l'approccio combinato, in cui un difetto di ventilazione è determinato da un'operazione OR: VD = VD(RVent) O VD(FVL-CM).
NOTA: L'analisi descritta è stata eseguita con un'app software commerciale (vedere la Tabella dei materiali) utilizzando il toolbox di registrazione Forsberg.
| Parametro | Soglia | Commento |
| RVent | 90° percentile * 0,4 | Soglia adattiva |
| FVL-CM | 90% | Soglia fissa |
| Q | 90° percentile * 0,15 | Soglia adattiva |
| V/Q | SENZA QD | QD |
| NO VD | Normale | Mancata corrispondenza VQ (QD esclusivo) |
| VD | Mancata corrispondenza VQ (VD esclusivo) | VQ Defect-Match |
Risultati
La parte inferiore della Figura 2 illustra le conseguenze di un ridimensionamento corretto e inadeguato con un corrispondente effetto sulla gamma dinamica. La Figura 6 mostra la distribuzione disomogenea del segnale, che è rappresentativa delle scansioni senza e con normalizzazione della bobina. Si consiglia di evitare una gamma dinamica bassa e immagini senza normalizzazione della bobina.
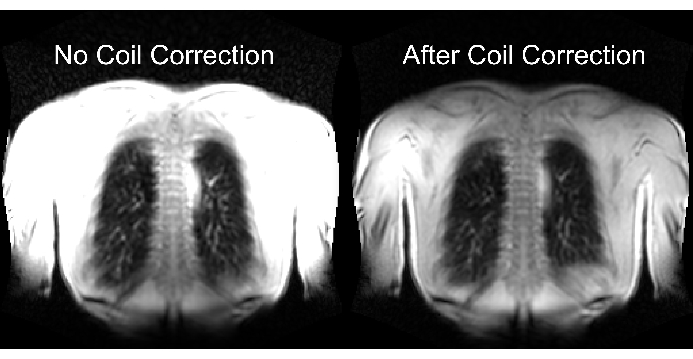
Figura 6: Immagini esemplificative dopo l'acquisizione senza correzione della bobina (errata) e con correzione della bobina (corretta). Si noti l'aumento artificiale del segnale ai bordi del corpo vicino agli elementi della bobina. Clicca qui per visualizzare una versione più grande di questa figura.
La Figura 7 illustra la segmentazione automatica riuscita e non riuscita. Si noti che la segmentazione fallita non include tutti i voxel polmonari, il che falsificherà ulteriori analisi e statistiche. È necessaria un'attenzione particolare per i casi con infiltrati, in quanto tali voxel possono essere erroneamente classificati come vasi a causa del loro segnale elevato dai modelli di intelligenza artificiale o non segmentati affatto.
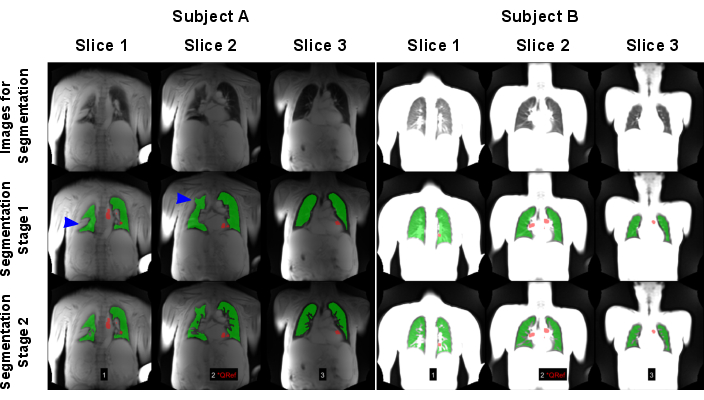
Figura 7: Un esempio di segmentazione automatizzata che ha portato a un risultato fallito (Soggetto A: maschio di 83 anni con BPCO) e positivo (Soggetto B: controllo sano femmina di 30 anni). La prima riga mostra le immagini che sono state utilizzate come input per i modelli di intelligenza artificiale. La seconda riga mostra i risultati della prima fase di segmentazione che consiste nel trovare il confine polmonare. La terza riga mostra il risultato finale dopo l'esclusione delle navi. Come mostrato dalle frecce blu, l'algoritmo è stato messo alla prova dalle variazioni polmonari ad alto segnale che causavano un rilevamento errato dei confini polmonari. Si noti che le immagini sono state normalizzate dal segnale massimale, il che ha portato a risultati diversi a causa della mancata normalizzazione della bobina della scansione eseguita sul soggetto A. Le regioni rosse mostrano le ROI, che sono state rilevate automaticamente per l'ordinamento della fase di perfusione. Abbreviazioni: BPCO = broncopneumopatia cronica ostruttiva; ROI = regioni di interesse. Clicca qui per visualizzare una versione più grande di questa figura.
La Figura 8 e la Figura 9 mostrano mappe di parametri rappresentative per un controllo sano (30 anni, femmina) e un paziente con BPCO (60 anni, maschio). Si noti che il controllo sano mostra una ventilazione e una perfusione più omogenee e quindi un minor numero di voxel difettosi. I rapporti corrispondenti delle statistiche sul ROI sono disponibili nella Tabella 4 e nella Tabella 5.
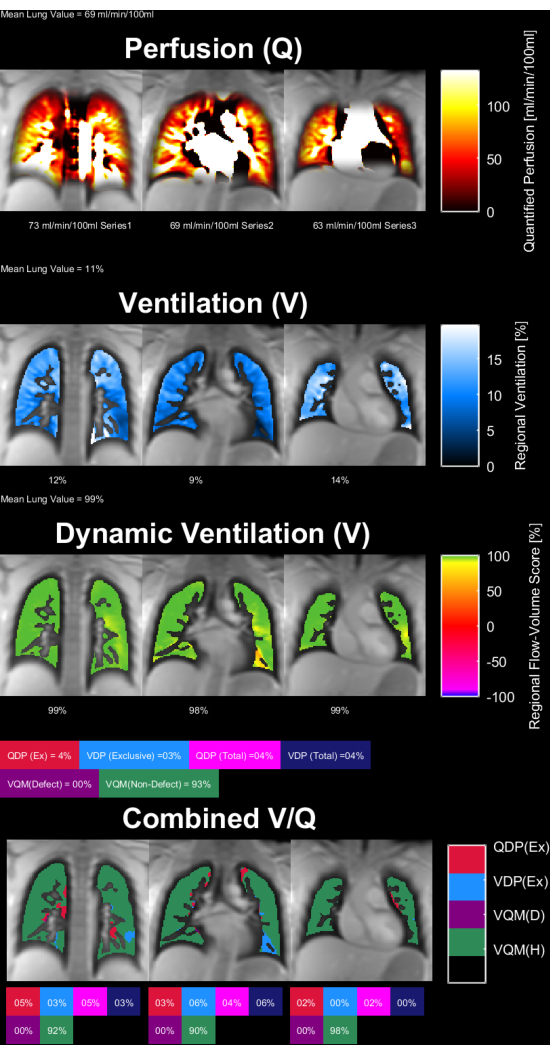
Figura 8: Mappe dei parametri PREFUL di una femmina di 30 anni di controllo sano. La perfusione (1a fila), la ventilazione regionale (2afila), la metrica di correlazione flusso-volume (3afila) e le mappe V/Q a soglia (4afila). Si noti la distribuzione omogenea dei valori parenchimali e le basse percentuali di difetto. Abbreviazioni: PREFUL = polmone funzionale a risoluzione di fase; V = ventilazione; Q = perfusione. Clicca qui per visualizzare una versione più grande di questa figura.
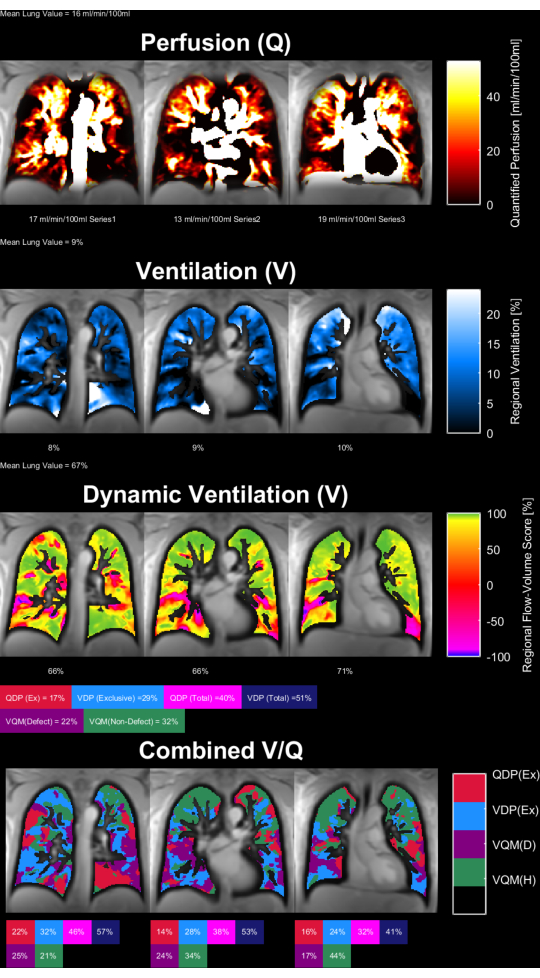
Figura 9: Mappe dei parametri PREFUL di un paziente maschio con BPCO di 60 anni. La perfusione (1a fila), la ventilazione regionale (2afila), la metrica di correlazione flusso-volume (3afila) e le mappe V/Q a soglia (4afila). Si noti la distribuzione eterogenea dei valori parenchimali e le alte percentuali di difetto. Abbreviazioni: BPCO = broncopneumopatia cronica ostruttiva; PREFUL = polmone funzionale risolto in fase; V = ventilazione; Q = perfusione. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 4: Report esemplificativo dei parametri PREFUL ottenuti per un controllo sano (femmina di 30 anni). Si notino i bassi valori del coefficiente di variazione e del difetto, che sono in linea con le mappe dei parametri presentate nella Figura 8 per lo stesso argomento. Vedere anche la Tabella 5 e la Figura 9. Abbreviazione: PREFUL = polmone funzionale risolto in fase. Clicca qui per scaricare questa tabella.
Tabella 5: Rapporto esemplare dei parametri PREFUL ottenuti per un paziente con BPCO (maschio di 60 anni). Si notino gli alti valori del coefficiente di variazione e del difetto, che sono in linea con le mappe dei parametri presentate nella Figura 9 per lo stesso soggetto. Vedere anche la Tabella 4 e la Figura 8. Clicca qui per scaricare questa tabella.
Materiale supplementare: Spiegazione animata dell'algoritmo PREFUL. Clicca qui per scaricare questo file.
Discussione
Passaggi critici
Una delle insidie più comuni durante l'acquisizione è l'inadeguata scala del segnale, che causa una perdita di informazioni durante la conversione DICOM a causa della ridotta precisione della rappresentazione dei dati digitali. Di conseguenza, ciò può portare a problemi durante la fase di post-elaborazione. Un'altra insidia ancora più critica è l'acquisizione di più sezioni in modo interlacciato. In questo modo, la risoluzione temporale effettiva delle singole sezioni viene ridotta in modo critico. Inoltre, a seconda della distanza delle fette, questo può avere un impatto sul contrasto e sulla quantificazione della perfusione poiché l'afflusso si basa su spin freschi senza storia di magnetizzazione. È necessaria un'attenzione particolare durante l'impostazione del protocollo, in particolare per quanto riguarda l'intensità del gradiente, l'eco asimmetrica, la larghezza di banda e l'imaging parallelo. Deviazioni dalle impostazioni suggerite anche per uno solo di questi parametri possono portare a una risoluzione TE e temporale inadeguata.
La post-elaborazione consiste in più passaggi, che devono essere seguiti nell'ordine descritto. Ad esempio, una registrazione dopo il filtro passa-basso non è significativa. Di conseguenza, il fallimento in una fase porta a un guasto durante le fasi successive. Ciò rende la fase di registrazione particolarmente importante. Poiché non esiste un unico algoritmo di registrazione, a seconda della rispettiva implementazione, i parametri devono essere impostati empiricamente. Senza la messa a punto di questi parametri, una falsa registrazione impedirà la generazione di qualsiasi risultato significativo. Un altro passaggio critico e dispendioso in termini di tempo durante la post-elaborazione è la segmentazione. Segmentazioni errate possono portare a calcoli dei parametri completamente errati (ad esempio, includendo regioni non polmonari) nel rapporto finale. È più probabile che tali segmentazioni errate si verifichino con gli algoritmi di deep learning, che sono abituati a determinati aspetti delle immagini e vengono applicati a immagini di un altro fornitore/macchina con un aspetto leggermente diverso. È quindi obbligatorio un controllo visivo della qualità dell'accuratezza della segmentazione, con eventuale correzione manuale.
Risoluzione dei problemi
La procedura tipica di risoluzione dei problemi consiste nel seguire tutti i passaggi uno per uno e verificare la plausibilità dei risultati intermedi. La procedura per i passaggi principali è la seguente: Verificare che le immagini siano acquisite in respirazione libera con la sequenza e le impostazioni corrette. Successivamente, verificare che la gamma dinamica dei segnali sia appropriata (~50 UA nel parenchima polmonare). Se i dati grezzi sono ancora disponibili, ripetere la ricostruzione delle immagini con un fattore di scala appropriato evitando la necessità di una nuova acquisizione di dati. Verificare che la registrazione sia stata eseguita senza artefatti importanti e movimento residuo. Successivamente, controlla se piccoli ROI mostrano una serie temporale con modulazioni attese relative alla ventilazione e alla perfusione. Quindi, controlla se i filtri applicati alterano le immagini nel modo previsto (ad esempio, nessuna modulazione ad alta frequenza nei dati filtrati passa-basso). Controlla se i cicli respiratori e cardiaci sintetizzati sono fisiologici e non mostrano salti improvvisi. Verificare l'accuratezza della segmentazione. Si noti che una ricerca a un livello di risoluzione più fine potrebbe essere necessaria non appena è stato identificato il passaggio principale, durante il quale si verifica il problema.
Limitazioni
Sebbene il protocollo presentato sia noto per produrre risultati riproducibili e sensibili, il numero di passaggi e parametri coinvolti durante l'acquisizione e la post-elaborazione consente un'ottimizzazione quasi infinita e sono intrecciati. Pertanto, un approccio bottom-up dovrebbe essere seguito da ottimizzazioni di primo indirizzamento del protocollo di sequenza (ad esempio, per quanto riguarda l'SNR e il rapporto contrasto/rumore funzionale). Per le seguenti ottimizzazioni di post-elaborazione, potrebbe essere utile una verità di base predefinita sotto forma di un modello polmonare digitale40. Come presentato, questo modello imita un'acquisizione a respirazione libera e include diverse classi per simulare i difetti di ventilazione/perfusione. Includendo una deformazione nota dovuta al movimento, gli algoritmi di registrazione possono anche essere testati direttamente. Nonostante questi vantaggi, ogni modello è intrinsecamente limitato dall'accuratezza della mappatura della realtà complessa in un modello finito e semplificato.
Le soglie presentate in questo protocollo sono risultate mostrare risultati ragionevoli per i volontari sani e in diverse coorti di pazienti mediante analisi empirica. Tuttavia, come accennato in precedenza, è probabile che sia necessario un aggiustamento a seconda della sequenza, dell'intensità del campo e della coorte.
Una limitazione generale di PREFUL è l'ampia post-elaborazione, che non è ancora prontamente disponibile come prodotto medico, sebbene le prime versioni work-in-progress di Siemens Healthineers e BioVisioneers siano disponibili per scopi scientifici in un contesto di collaborazione scientifica/commerciale. I calcoli in genere comportano l'elaborazione parallela, che pone requisiti particolarmente elevati su CPU e RAM e potrebbe richiedere workstation moderne o soluzioni server per elaborare in modo efficace grandi quantità di dati. Inoltre, le lunghe fasi di post-elaborazione attualmente impediscono una presentazione istantanea dei risultati, che sarebbe auspicabile per il flusso di lavoro clinico.
Confronto con altri metodi
Esistono una moltitudine di approcci simili come PREFUL, tra cui il predecessore Fourier Decomposition e i suoi altri derivati come Matrix Pencil Decomposition41 e l'approccio leggermente diverso Self-gated Non-Contrast-enhanced Functional Lung MRI (senceful mri)42. Mentre la decomposizione di Fourier e metodi simili operano nel dominio della frequenza, PREFUL utilizza un filtraggio di Fourier meno rigoroso e il successivo calcolo delle ampiezze nel dominio del tempo. Pertanto, non è necessario selezionare picchi specifici corrispondenti alla ventilazione/perfusione. Ciò può comportare una minore suscettibilità alla variabilità respiratoria, che è nota per verificarsi nei soggetti umani.
Mentre PREFUL esegue l'ordinamento delle immagini, SENCEFUL utilizza l'ordinamento delle linee dello spazio k, portando a una maggiore flessibilità. Tuttavia, SENCEFUL richiede sequenze con capacità di auto-gating, mentre PREFUL può essere eseguito con una sequenza convenzionale di eco a gradiente viziato. Allo stesso modo, il bSSFP comunemente utilizzato negli approcci basati sulla decomposizione di Fourier è noto per un migliore SNR e contrasto del flusso sanguigno, ma in genere richiede una maggiore ottimizzazione per l'acquisizione polmonare, specialmente a 3T43. Tuttavia, a parte questo, non c'è motivo per non combinare PREFUL con l'acquisizione44 di bSSFP.
Tutti questi approcci basati sui segnali presuppongono che alcune influenze indesiderate del segnale, tra cui T1, T2/T2*, diffusione, movimento attraverso il piano e voxel non perfusi ortogonalmente, siano trascurabili. Mentre la convalida progredita di PREFUL suggerisce indirettamente che tali influenze non sono critiche, Triphan et al. hanno dimostrato che esiste una dipendenza dai T1 e dai TE efficaci, che si spiega con il diverso peso dei componenti del sangue e del parenchima a seconda del TE45. Alla luce di ciò, il vantaggio iniziale del bSSFP di visualizzare il sangue grazie al contrasto T2/T1 potrebbe rappresentare un'ulteriore sfida per stabilire una quantificazione accurata rispetto alla più semplice meccanica di contrasto di uno SPGRE. Tuttavia, ulteriori studi che affrontano direttamente l'influenza di varie variabili RM, ad esempio, come eseguito da Glandorf et al. per i mezzi di contrasto 46,47, sono auspicabili in quanto possono quantificare direttamente l'effetto su PREFUL.
Importanza
Essendo un metodo a respirazione libera e privo di mezzi di contrasto, PREFUL condivide molti vantaggi con i metodi correlati precedentemente menzionati: 1) nessuna applicazione di radiazioni ionizzanti e agenti di contrasto, 2) nessuna necessità di hardware o personale aggiuntivo, 3) acquisizione, che dipende solo dalla minima compliance del paziente. Questi vantaggi rendono PREFUL uno strumento di monitoraggio conveniente, soprattutto per i gruppi vulnerabili come i bambini con broncopneumopatia cronica. Sebbene l'SNR sia basso con la sequenza SPGRE, la disponibilità e la mancanza di requisiti per la programmazione/condivisione di sequenze aggiuntive promuovono ulteriormente la diffusione di questo approccio.
Come discusso nella sezione introduttiva, il numero di studi che mostrano una buona convalida, riproducibilità, risultati di sensibilità e capacità di monitoraggio mostra che l'importanza di questa tecnica e dei corrispondenti parametri dinamici è su una traiettoria ascendente e sarà ulteriormente supportata da un'ampia diffusione.
Divulgazioni
Filip Klimeš, Andreas Voskrebenzev e Jens Vogel-Claussen sono azionisti di BioVisioneers GmbH, una società che ha un interesse nei metodi di risonanza magnetica polmonare.
Riconoscimenti
Questo lavoro è stato finanziato dal Centro tedesco per la ricerca polmonare (DZL). Gli autori desiderano esprimere una profonda gratitudine nei confronti di tutti coloro che hanno contribuito e sostenuto l'ulteriore sviluppo di PREFUL, in particolare: Marcel Gutberlet, Till F. Kaireit, Lea Behrendt, Julian Glandorf, Sonja Lüdiger, Tawfik Moher Alsady, Katharina Bünemann, Marius Wernz, Robin Müller, Maximilian Zubke, Gesa Pöhler, Agilo Kern, Cristian Crisosto, Milan Speth, Arnd Obert, Julienne Scheller, Jim Wild, Edwin van Beek, Helen Marshall, Jens Gottlieb, Martha Dohna, Diane Renz, Anna-Maria Dittrich, Tobias Welte, Jens Hohlfeld, Patrick Zardo, Giles Santyr, Franz Wolfgang Hirsch, Robert Grimm, Bastian Bier, Bassem Ismail, André Fischer, Berthold Kiefer, Gregor Thoermer e Rebecca Ramb. Inoltre, gli autori desiderano ringraziare i radiografi e i partecipanti allo studio. In particolare, ringraziamo Frank Schröder e Sven Thiele del Dipartimento di Radiologia (Hannover Medical School) per l'eccezionale assistenza tecnica nell'esecuzione degli esami di risonanza magnetica.
Materiali
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
Riferimenti
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon