Method Article
Функциональная МРТ легких с фазовым разрешением для легочной вентиляции и оценки перфузии (V/Q)
В этой статье
Резюме
В данной работе мы описываем применение функциональной МРТ легких с фазовым разрешением в качестве метода протонной МРТ без контрастных веществ для оценки легочной вентиляции и динамики перфузии. Проверенный и применимый в различных областях и возрастных группах, он может улучшить процесс принятия клинических решений в будущем, помогая в количественной оценке заболевания и мониторинге терапии.
Аннотация
Разложение Фурье — это метод МРТ без контрастного вещества 1H для оценки перфузии легких (Q) и вентиляции легких (V). После регистрации изображения временной ряд каждого воксела анализируется с учетом сердечной составляющей и частоты дыхания.
С использованием стандартной 2D-последовательности испорченного градиентного эха с временным разрешением ~300 мс был разработан алгоритм сортировки изображений для получения функциональной визуализации легких с фазовым разрешением (PREFUL) с увеличенным временным разрешением. Таким образом, можно оценить региональные объемные петли потока (FVL) во время дыхания в дыхательном объеме и изобразить распространение пульсовой волны в течение сердечного цикла. Этот метод может быть применен при 1,5 Тл или 3 Тл со стандартным оборудованием для МРТ без необходимости программирования последовательности, так как описанный протокол может быть реализован с последовательностью SPGRE по умолчанию на большинстве систем.
МРТ с вентиляцией PREFUL была валидирована с использованием газовой визуализации 129Xe и 19F с хорошим региональным согласованием. Перфузионно-взвешенная PREFUL MRI была валидирована с использованием ОФЭКТ, а также МРТ с динамическим контрастированием (DCE). PREFUL был протестирован в условиях двойного центра и в настоящее время применяется в нескольких текущих многоцентровых испытаниях. Кроме того, это возможно для диапазона напряженности поля (0,55Тл-3Тл) и различных возрастных групп, включая новорожденных.
Количественная V/Q PREFUL MRI использовалась у пациентов с муковисцидозом, хронической обструктивной болезнью легких, хронической тромбоэмболической легочной гипертензией и коронавирусной болезнью-2019 для количественной оценки заболевания и мониторинга изменений в лечении после терапии. Кроме того, было показано, что визуализация PREFUL V/Q предсказывает потерю трансплантата из-за хронической дисфункции аллотрансплантата легких у пациентов после трансплантации легких. Таким образом, PREFUL MRI является валидированным методом количественной вентиляции легких и визуализации пульсовой волны/перфузии легких для регионального выявления, количественной оценки и мониторинга лечения легочных заболеваний с потенциальной добавленной стоимостью в текущей клинической рутине.
Введение
Дыхательная система со своими сложными механизмами уязвима для различных заболеваний. Очевидно, что хронические респираторные заболевания, такие как хроническая обструктивная болезнь легких (ХОБЛ), муковисцидоз (МВ) и хроническая тромбоэмболическая легочная гипертензия (ХТЭЛГ), значительно сокращают ожидаемую продолжительность жизни1. В результате ранняя диагностика, мониторинг и оценка терапевтического ответа приобрели первостепенное значение.
Тесты функции легких (ПФТ) могут выводить глобальные параметры функции легких, такие как индекс Тиффино-Пинелли, определяемый как отношение объема форсированного выдоха за одну секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ)2. Такие параметры хорошо зарекомендовали себя в клинической практике, но не имеют региональной информации и требуют высокого уровня комплаентности пациента. В этом отношении визуализация может дать дополнительные сведения и возможности для получения более чувствительных параметров. Компьютерная томография (КТ) обеспечивает визуализацию морфологии паренхимы с высоким разрешением, а современные методы, такие как параметрическое картирование ответа, также позволяют получать функциональнуюинформацию. Тем не менее, однофотонная эмиссионная компьютерная томография (ОФЭКТ) остается в настоящее время золотым стандартом для отображения вентиляции и перфузии (V/Q) в легких4. Общие для всех упомянутые методы визуализации требуют воздействия ионизирующего излучения, что требует особого внимания в случаях мониторинга и уязвимых групп. В связи с этим в настоящее время предпринимаются усилия по продвижению МРТ в качестве альтернативного метода.
По своей сути легкое является сложным органом для МРТ из-за его низкой плотности протонов и быстрого затухания сигнала. Среди множества подходов наиболее распространенными решениями являются использование гиперполяризованного газа (например, МРТ 129Xe) длявентиляции легких 6 и внутривенное применение контрастного вещества на основе гадолиния для визуализации перфузии7. Эти методы обеспечивают высокое отношение сигнал/шум (SNR) и считаются золотым стандартом в сообществе МРТ. Более поздний подход позволяет избежать применения какого-либо контрастного вещества и возможен при обычной протонной МРТ при свободном дыхании с общим временем регистрации ~1 мин/срез. Таким образом, можно избежать потенциальных нежелательных явлений и недавно обсуждавшихся долгосрочных эффектов контрастных веществ, а также облегчить распространение без необходимости дополнительной гиперполяризации и использования многоядерного оборудования. Кроме того, проблема нахождения адекватного состояния надувания, которое может повлиять на полученные значения дефекта вентиляции8 , избегается за счет регистрации свободного дыхания.
Этот подход, основанный на непрямом МР-сигнале, был впервые представлен Zapke et al., которые использовали обратную связь между протонно-взвешенным сигналом S и объемом легких V: S~1/V.9 Он основан на процессе преобразования изображений, полученных при свободном дыхании, в одно общее состояние надувания (обычно в промежуточном положении между концом выдоха и концом вдоха), тем самым компенсируя движение и позволяя анализировать сигнальный временной ряд в каждом вокселе. После этого измерение вентиляции может быть получено из этих так называемых зарегистрированных изображений с помощью уравнения (1) Klimeš et al.10:
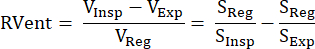 (1)
(1)
С объемами/сигналами во вдохе (Insp), экспирации (Exp) и зарегистрированном состоянии (Reg). Впоследствии метод был расширен за счет введения разложения Фурье для дифференциации модуляций сигнала, связанных с частотой дыхания (вентиляция) и частотой пульса (перфузия), и, следовательно, для получения идеально пространственно согласованной карты V/Q из одного сбораданных. Это стало возможным благодаря типичному разрыву между частотами дыхания и сердца, так что обе компоненты, расположенные друг над другом во временной области, эффективно различаются в частотной области с помощью анализа Фурье. После перехода от низкопольной (0,35 Тл) к 1,5 Тл с оптимизированной сбалансированной стационарной последовательностью свободной прецессии (bSSFP)12, этот метод начал привлекать больше внимания в нескольких последующих исследованиях 13,14,15.
Поскольку дыхание и пульс подвержены вариабельности, а коммерчески доступная визуализация bSSFP (gradient compensated) при 1,5 Тл может привести к существенным артефактам полос (четким линиям пустоты сигнала), был предложен родственный метод с испорченной градиентной эхо-последовательностью (SPGRE) в сочетании с широкой фильтрацией нижних и верхних частот16,17. Это охватывает более сложный спектр реальных дыхательных и пульсовых модуляций. Последующий расчет амплитуды во временной области позволяет избежать необходимости выбора одного конкретного пика частоты. Дальнейшая оптимизация была достигнута за счет разбиения типичной одношаговой регистрации на одно опорное состояние на два отдельных шага. Таким образом, используется тот факт, что во время свободного дыхания между окончанием вдоха и концом выдоха приобретается ряд различных фаз дыхания с различной степенью требуемой деформации в сторону фиксированного состояния. После выбора нескольких групп и идентификации группы отдельных изображений выполняется следующая процедура: 1) Регистрация внутри соответствующей группы состояния дыхания, 2) Пошаговая межгрупповая регистрация из одной соседней группы в другую (например, 1->2, 2->3,...) в группу, представляющую референтную группу. Этот подход был дополнительно расширен за счет оценки фазы для каждого изображения для установления более высокого видимого временного разрешения, что облегчает анализ динамики вентиляции и перфузии, что привело к терминологии МРТ функционального легкого с фазовым разрешением (PREFUL) для дифференциации этой ветви от других родственных методов18. В последующих исследованиях использовалась дополнительная информация, полученная по полному дыханию и сердечным циклам, и они показали потенциально повышенную чувствительность таких параметров 19,20,21.
Валидация с помощью золотого стандарта ОФЭКТ показала коэффициент dice ≥67% для дефектных областей22, а более прямое измерение вентиляции с помощью 129Xe показало корреляцию процентов дефектов вентиляции ≥62% в смешанной когорте ХОБЛ/КФ/здоровых23 и 84% в многоцентровой когорте24 с КФ с несколькими поставщиками, которая также продемонстрировала аналогичную корреляцию с индексом клиренса легких PREFUL и 129Xe (r = 0,82 и r = 0,91). Перфузионный анализ того же исследования показал, что не было существенных различий в пространственном перекрытии с DCE среди оцениваемых центров25. Также сообщалось о согласовании с DCE и согласовании результатов PREFUL между центрами для проспективного подисследования, включающего девятьцентров26. Анализ воспроизводимости у пациентов с ХОБЛ показал коэффициент вариации ниже 15% по всем параметрам27. Текущие исследования показывают, что параметр FVL обладает более высокой прогностической силой и чувствительностью для обнаружения изменений в лечении по сравнению со «статическим» параметром вентиляции, который учитывает только фазы конца вдоха и конца выдоха. Реакция на лечение с помощью измерений региональной петли потока-объема (FVL) была продемонстрирована после ингаляционной обработки индакатерол-гликопирронием (IND/GLY) при ХОБЛ28. В соответствии с этим параметр FVL предсказывал потерю трансплантата у пациентов с трансплантацией двух легких, в то время как спирометрия не могла (P = 0,02 против P = 0,33)29. Первые технико-экономические обоснования показывают, что функциональная визуализация легких с помощью PREFUL может быть реализована у свободно дышащих младенцев и новорожденных с помощью стандартного клинического аппаратного обеспечения МРТ30,31. Glandorf et al. сравнили параметры PREFUL при 1,5 Тл и 3 Тл (последовательность SPGRE) и не обнаружили существенных различий по большинству параметров, которые были высоко воспроизводимы, несмотря на разницу в напряженности поля32. Это может быть важным преимуществом, так как не на каждом объекте есть доступ к сканерам напряженности поля 1,5 Тл или ниже. Недавно была продемонстрирована целесообразность и выявление стойких симптомов после инфекции COVID-19 при дозе 0,55 Тл, оценивая данные bSSFP с помощью PREFUL33.
Подводя итог, можно сказать, что, несмотря на то, что PREFUL является относительно новым методом, он был широко изучен. Оценивались такие важные критерии, как валидация с более прямыми и установленными измерениями, воспроизводимость, чувствительность к патологии и реакция на лечение и прогрессирующие изменения. Тем не менее, несмотря на низкие технологические требования, лишь несколько специализированных центров используют эту методику. Таким образом, целью данной работы является обобщение новейшей методологии PREFUL MR в письменной и визуальной форме. Эта информация может быть использована для внедрения этой техники в большем количестве центров и, таким образом, в долгосрочной перспективе приведет к более зрелой технике.
протокол
Это исследование получило одобрение комитета по этике Ганноверской медицинской школы, что гарантировало соблюдение строгих этических стандартов на протяжении всего исследовательского процесса. Расследование строго следовало руководящим принципам, изложенным в Хельсинкской декларации, подчеркивая этичность проведения медицинских исследований. Кроме того, информированное согласие было тщательно получено от всех участников исследования (или их родителей или законных опекунов) до их участия в обследовании МРТ. На рисунке 1 представлен упрощенный обзор основных этапов протокола, состоящих из сбора, регистрации, фильтрации и сортировки и, наконец, синтеза сердечного и дыхательного циклов. В следующих разделах подробно описаны все связанные с этим шаги.
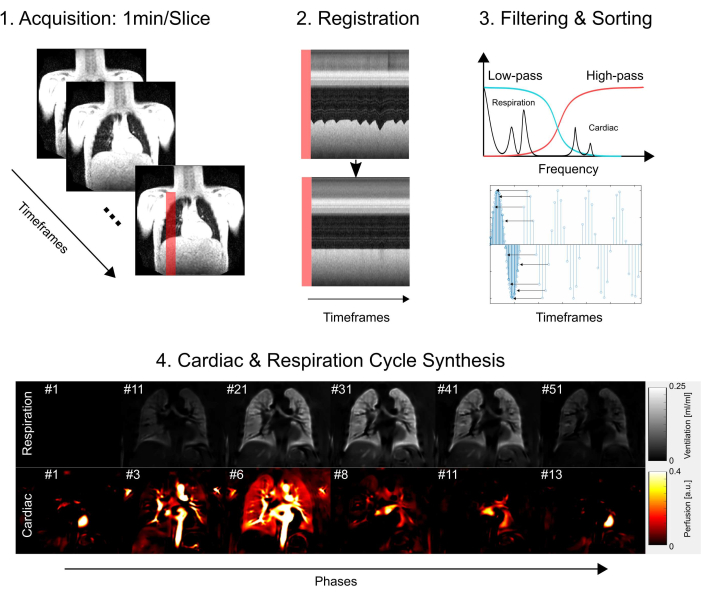
Рисунок 1: Схематический обзор основных компонентов PREFUL. 1) Получение данных в режиме свободного дыхания, что требует 2) компенсации движения посредством регистрации, как показано на профильных графиках, и позволяет проводить воксельный анализ компонентов Фурье, как показано на шаге 3) фильтрация и сортировка. После низкочастотной (вентиляция) и высокочастотной (перфузионной) фильтрации, 4) расчетная фаза используется для сортировки изображений с более высоким видимым временным разрешением и синтеза одного полного сердечного и дыхательного цикла. Обратите внимание, что это упрощенный план и все детали описаны в рукописи. Дальнейшие шаги, которые не показаны на этом рисунке, включают количественную оценку параметров и создание отчета. Сокращение: PREFUL = функциональное легкое с фазовым разрешением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Подбор персонала
- Набор взрослых пациентов или несовершеннолетних дляучастия в исследовании PREFUL MRI для пациентов и здоровых людей из контрольной группы на основе их диагноза легочного заболевания на основании спирометрического исследования и/или предыдущей визуализации (например, рентгена или компьютерной томографии); способность давать информированное согласие; способность лежать ровно и оставаться неподвижным на протяжении всего МРТ-сканирования; и отсутствие известных противопоказаний к проведению МРТ (например, металлические имплантаты, клаустрофобия).
- Исключите пациенток , если они беременны, ранее перенесли операцию на легких в течение последних 6 месяцев, имеют тяжелый респираторный дистресс или потребность в непрерывном приеме кислорода, или ранее имели побочные реакции на контрастные вещества на основе гадолиния, если в дополнение к PREFUL используется МРТ с контрастированием.
- Набирайте здоровых людей из контрольной группы , если ванамнезе нет известных заболеваний легких, основанных на клиническом обследовании и самоотчетах; тесты функции легких в норме; они могут дать информированное согласие; они могут лежать и оставаться неподвижными в течение всего времени МРТ; и не имеют известных противопоказаний к МРТ.
- Исключите лиц из контрольной группы здорового образа жизни в соответствии с текущим или прошлым анамнезом курения, воздействием известных легочных токсинов или профессиональных рисков, семейным анамнезом наследственных заболеваний легких, любыми известными хроническими заболеваниями, которые могут повлиять на функцию легких, и беременностью.
- Получение форм согласия. Продолжайте работу с протоколом, если от участника получена письменная форма информированного согласия, содержащая цель и процедуры исследования, любые потенциальные риски и преимущества, гарантии конфиденциальности, продолжительность исследования и право на отказ без каких-либо последствий.
- Примените следующие дополнительные шаги, если при наборе несовершеннолетних есть несовершеннолетние.
- Получите письменное информированное согласие хотя бы от одного родителя или опекуна в дополнение к согласию несовершеннолетнего.
- Представьте весь процесс в соответствующей возрасту форме, понятной несовершеннолетнему.
- Для детей младшего возраста используйте наглядные пособия, сборники рассказов или упрощенные объяснения.
- Убедитесь, что исследование соответствует возрастной группе и что несовершеннолетние не включаются без необходимости.
- Разрешайте несовершеннолетним сопровождать доверенного взрослого (например, родителя, опекуна) во время всех процедур, связанных с исследованием, если это не нарушает целостность исследования.
ПРИМЕЧАНИЕ: Описанные шаги предполагают, что исследование было рассмотрено и одобрено Комитетом по этике.
- Примените следующие дополнительные шаги, если при наборе несовершеннолетних есть несовершеннолетние.
2. Приобретение
- Проведите процедуру безопасности перед сканированием.
- Перед проведением МРТ проведите подробный предварительный скрининг пациентов, чтобы выявить потенциальные противопоказания, такие как предыдущие операции, имплантированные устройства, татуировки или воздействие металлических фрагментов.
- По прибытии расскажите пациентам о магнитных свойствах процедуры и рисках.
- Проинструктируйте пациентов снять все личные металлические предметы, включая украшения, часы и некоторые элементы одежды, и при необходимости предоставить им халат.
- Попросите обученного специалиста визуально осмотреть пациентов на предмет незамеченных металлических предметов.
- Проверьте все медицинские устройства или имплантаты на совместимость с МРТ.
- Обеспечьте соблюдение протоколов экстренной помощи для обеспечения безопасности персонала и пациентов.
- Позиционирование участника и сканирование
- Ориентируйте пациента головой вперед и уложите его в лежачее положение на систему 0,55 Тл, 1,5 Т или 3 Тл.
- Обеспечьте защиту органов слуха, аварийный звонок, набивку и одеяло для безопасности и комфорта.
- Расположите многоканальную гибкую катушку чуть ниже подбородка, чтобы обеспечить оптимальную чувствительность катушки во всех областях легких.
- Закрепите положение катушки для поддержания устойчивости, не затрудняя дыхание пациента.
- Попросите пациента закрыть глаза, затем отметьте центр легкого с помощью МР-лазера.
- Выровняйте центр легких в изоцентре и дайте пациенту снова открыть глаза.
- Отсканируйте первоначальные локализаторы для установления общей ориентации, а затем проведите поперечное морфологическое сканирование для выявления бифуркации трахеи.
- Закрепите первый корональный срез на бифуркации трахеи в качестве последовательного ориентира для улучшения воспроизводимости.
- В зависимости от протокола сканирования необходимо либо захватить три среза с расстоянием от среза до среза (измеренным от края до края) 100% (от толщины среза), либо получить несколько срезов, охватывающих все легкое, с расстоянием 20% или 33%.
- Приобретайте каждый ломтик полностью отдельно и не чередуйте.
- Загрузите восстановленные изображения в систему архивации и передачи изображений (PACS) для последующего доступа и анализа. В качестве альтернативы, чтобы соответствовать стандартам конфиденциальности и защиты данных, вручную экспортируйте изображения на указанный сетевой диск или аналогичное решение для хранения.
ПРИМЕЧАНИЕ: Для получения подробной информации о протоколе и параметрах секвенирования обратитесь к Таблице 1 и Таблице 2. Визуальное представление позиционирования среза приведено на рисунке 2.
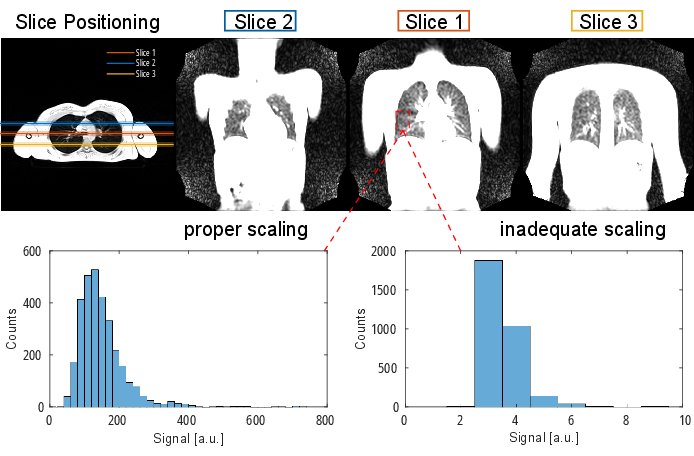
Рисунок 2: Типичное позиционирование среза для эксперимента PREFUL, визуализированное с помощью 3D градиентного эха в поперечной ориентации. Обратите внимание, что первый срез расположен в месте бифуркации трахеи в качестве воспроизводимого ориентира. 2-й и3-й срезы располагаются со 100% промежутком между срезами в переднем и заднем направлениях. Примерные гистограммы показывают распределения значений с правильным и неадекватным (низким) масштабированием. Последнее приводит к низкому динамическому диапазону и потере точности. Также следует избегать неадекватного высокого масштабирования, которое приводит к клиппингу (здесь не показано). Сокращение: PREFUL = функциональное легкое с фазовым разрешением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 1: Типичная схема протокола PREFUL. После локализатора приобретается 3D-объем легкого в поперечной ориентации. Этот сбор данных используется для планирования следующих сборов данных PREFUL (см. также Таблицу 2 для настроек последовательности и Рисунок 2 для позиционирования срезов). В зависимости от исследования могут быть добавлены и другие последовательности. Сокращение: PREFUL = функциональное легкое с фазовым разрешением. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Сводка параметров последовательности для сбора данных PREFUL с испорченной градиентной эхо-последовательностью. Сокращения: PREFUL = функциональное легкое с фазовым разрешением; SPGRE = испорченная градиентная эхо-последовательность. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
3. Постобработка
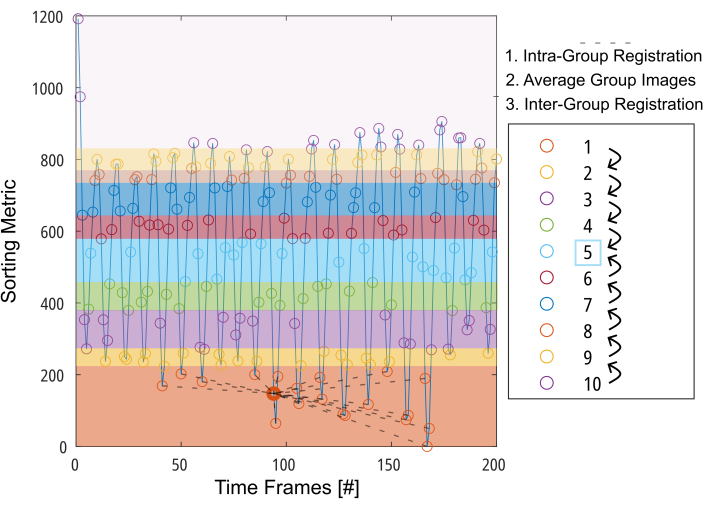
Рисунок 3: Схематическое представление групповой регистрации для минимизации требуемой деформации для компенсации движения. После деления изображений (представленных кружками) на 10 групп на основе метрики сортировки (например, сегментированной площади легких) изображения регистрируются внутри каждой группы в промежуточной позиции (показано пунктирными линиями для группы 1). Затем зарегистрированные изображения усредняются и используются на заключительном этапе межгрупповой регистрации шаг за шагом к промежуточной группе. Сокращение: GOREG = групповая регистрация. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
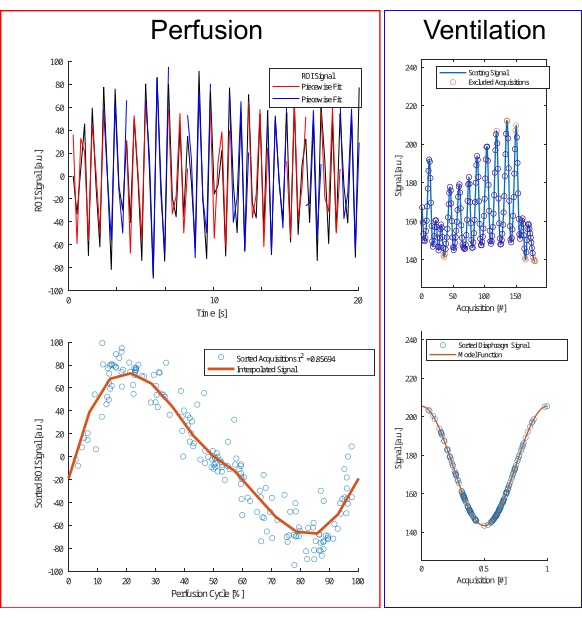
Рисунок 4: Иллюстрация алгоритма сортировки по перфузии и вентиляции. Для перфузии (слева) выполняется поштучная подгонка (верхний ряд) для оценки фазы и использования приобретений (нижний ряд). Для вентиляции (справа) выбросы исключаются (верхний ряд) и сортируются в соответствии с моделью косинуса (нижний ряд) на основе амплитуды и разницы амплитуд, чтобы различать фазы выдоха и вдоха. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
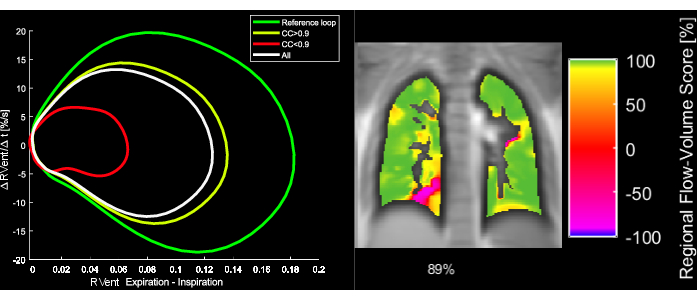
Рисунок 5: Примерные контуры потока-объема и соответствующая метрика FVL-корреляции 43-летней пациентки с ХОБЛ. Обратите внимание, что при изменении FVL FVL-CM уменьшается. Сокращения: FVL = контур потока-объема; FVL-CM = метрика FVL-корреляции; ХОБЛ = хроническая обструктивная болезнь легких. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 3: Применение пороговых значений к картам параметров и комбинациям карт дефектов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
- Регистрация
ПРИМЕЧАНИЕ: В следующем разделе описана процедура нежесткой регистрации до референтного объема (предпочтительно среднего уровня дыхания) с использованием групп-ориентированной схемы (GOREG) для компенсации дыхания и сердечной деятельности.- Получите изображения.
- Первоначально выполните сегментацию легких на всех незарегистрированных изображениях с помощью обученного U-Net и примените фильтр нижних частот с отсечкой 0,7 Гц, чтобы получить оценку фаз дыхания.
ПРИМЕЧАНИЕ: Это запустит полностью автоматизированный конвейер обработки, который будет выполнять последующие шаги в фоновом режиме. Продемонстрированные и описанные шаги обработки не ограничены конкретным приложением или языком и, следовательно, могут быть реализованы в пользовательском приложении со многими языками программирования. - Классифицируйте большое количество сегментированных вокселей как вдохновение, а малое количество — как истечение срока действия.
- Сгруппируйте изображения, разделив их на 10-й процентиль, гарантируя, что каждая группа из полученных 10 групп содержит равное количество изображений.
- В качестве алгоритма регистрации выберите ANTs34 (BSplineSyN с метрикой взаимной корреляции) или Forsberg35,36 (разложение полинома с упругой и жидкостной регуляризацией).
- Проведите интра-регистрацию для каждой группы в направлении промежуточного положения легких соответствующей группы.
- Усредните результаты группы, чтобы получить по одному изображению для каждой группы.
- Проведите межрегистрацию, двигаясь от изображения каждой группы к следующему соседу в направлении5-й группы.
- Нанесите цепочку деформаций на исходные изображения, по мере необходимости, чтобы достичь дыхательного положения, представленного усредненным изображением в группе 5. Например, для Изображения 36, относящегося к группе 3, применяются следующие поля деформации : 36->Изображение 57 (~Промежуточное положение легких в группе 3) -> Шаг 3->4 -> Шаг 4->5.
ПРИМЕЧАНИЕ: Подробное описание процедуры GOREG приведено на рисунке 3. Выполняйте регистрацию с помощью параллельных вычислений для сокращения времени обработки. Регистрация GOREG выполняется для минимизации величины деформации, необходимой для каждого шага регистрации, и, следовательно, для обеспечения стабильной сходимости алгоритма. Тем не менее, регистрация также может быть выполнена с помощью всего одного шага деформации в направлении промежуточного положения легкого. В то время как во всех опубликованных исследованиях 2D PREFUL использовались ANTs, Forsberg дает результаты до 6 раз быстрее, а качество результатов сопоставимос тем, что сообщается в исследовании 3D PREFUL. Примерные результаты в этом отчете были получены при регистрации компании Forsberg. На рисунке 1 показана иллюстрация эффекта регистрации при движении диафрагмы.
- Общая фильтрация
- Шумоподавление зарегистрированных изображений с помощью фильтрации38 на основе изображения, используя усредненное по времени зарегистрированное изображение в качестве направляющего изображения. Примените следующие настройки: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- Для анализа вентиляции и перфузии используйте фильтр нижних или верхних частот с отсечкой на 0,7 Гц для подавления соответствующего другого компонента. Исключите первые 20 изображений из всех дальнейших этапов обработки, за исключением количественного расчета перфузии, чтобы обеспечить устойчивое состояние во включенном временном ряду.
ПРИМЕЧАНИЕ: Изменение порогового значения может быть необходимым, если у испытуемых частота дыхания выше ~40 вдохов/мин.
- Сегментация
ПРИМЕЧАНИЕ: Окончательная сегментация выполняется с использованием зарегистрированных изображений в промежуточном положении легких в рамках двухэтапной процедуры, как показано ниже.- Выполняйте сегментацию границы легких (ROI легких) на усредненных по времени зарегистрированных изображениях с помощью обученного U-Net или вручную.
- Затем исключите крупные центральные сосуды, чтобы уточнить сегментацию границ легких и получить область интереса или ROI для паренхимы легких.
- Перфузия
ПРИМЕЧАНИЕ: Следующие шаги необходимы для точной оценки сердечной фазы для каждого изображения в полученной серии, которые дискретизируются с относительно низкой частотой (~3-5 изображений/с), особенно по сравнению с частотой сердечных сокращений (обычно 40-90 уд/мин). Перегруппировка данных в соответствии с определенными сердечными фазами используется для получения полного сердечного цикла с повышенным временным разрешением, превышающим частоту дискретизации18 при сборе данных (см. рисунок 4 для иллюстрации процедуры сортировки). Для оценки фазы требуется поиск ROI с сильным перфузионно-взвешенным сигналом. Используйте алгоритм итерационного поиска следующим образом22.- Соедините ROI границы легких, чтобы включить средостение в ROI поиска.
- Создайте простую перфузионно-взвешенную карту, вычислив стандартное отклонение по всей последовательности изображений.
- Определите регионы, соответствующие 98-му процентилю этой карты, в ROI поиска в качестве исходных ROI для последующих шагов.
- Выполните поштучную подгонку, увеличивая размер точек высева по мере улучшения характеристик подгонки.
- Ранжируйте расширенные ROI семян в соответствии с их подходящими характеристиками.
- Итеративно комбинируйте лучшие расширенные начальные ROI со вторыми, третьими лучшими и т. д., пока комбинация не улучшит метрику или не будут учтены все начальные ROI. Считайте, что итоговый ROI — это ROI сосуда, используемый для оценки фазы сердца.
- Пространственное усреднение сигнала внутри оптимизированной оценки фазы для создания одного сигнально-временного ряда для оценки фазы.
- Выполните кусочную оценку, сегментировав сигнал на более мелкие части с использованием локальных максимумов сигнала, а затем кусочно-синусоидальную аппроксимацию с учетом таких параметров, как амплитуда, смещение фазы и частота (рис. 4).
- Отсортируйте изображения по фазе, чтобы представить один сердечный цикл.
- Используйте регрессию ядра Надараи-Уотсона с ядром Гаусса (сигма = 0,1) для интерполяции 15 фаз на равномерно распределенную временную сетку, охватывающую один сердечный цикл.
Примечание: На рисунке 1 приведена подгруппа примерного синтезированного полного сердечного цикла здорового добровольца, начиная с диастолы, переходя в систолу и возвращаясь к диастоле.
- Вентиляция
ПРИМЕЧАНИЕ: При анализе перфузии обратите внимание, что частота сердечных сокращений остается относительно стабильной с незначительными вариациями амплитуды. Напротив, вентиляция имеет тенденцию испытывать больше вариаций дыхательного объема и частоты, что приводит к различным респираторным состояниям с идентичными дыхательными фазами, не всегда имеющими одинаковую амплитуду. Вдохновленный подходом Fischer et al. к самостробированию, важно классифицировать вентиляцию на основе амплитуды сигнала.- Исключите экстремальные выбросы с помощью эмпирических правил (данные ниже 5-го или выше 97-го процентиля).
- Выведите диапазон амплитуды R и смещение C из сигнально-временного ряда, созданного для группировки регистраций.
- Определим функцию модели A(t) с произвольно выбранной частотой fДыхание (в данном случае 0,3 Гц):
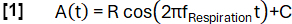
- Классифицируйте данные по состояниям вдоха и истечения срока действия в зависимости от наклона.
- Более точное определение фазы в соответствии с модельной функцией:
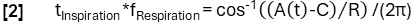
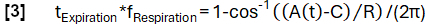
- Затем выровняйте выборки в зависимости от их фазы и примените регрессию ядра Надараи-Уотсона для вычисления вентиляции через равномерно распределенные интервалы в течение дыхательного цикла.
- Рассчитайте региональную вентиляцию (RVent) для каждой фазы по аналогии с уравнением 1, заменив фазу вдоха на соответствующую фазу.
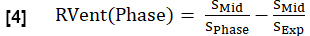
Примечание: На рисунке 1 приведена подгруппа примера синтезированного полного дыхательного цикла здорового добровольца, начинающегося с выдоха, переходящего во вдох и возвращающегося к выдоху. Иллюстрация алгоритма сортировки приведена на рисунке 4.
- Расчет параметров
ПРИМЕЧАНИЕ: Используя синтезированные полные дыхательные и сердечные циклы, можно получить дополнительные параметры. Выбор наиболее важных параметров описан ниже. - Региональная вентиляция (RVent)
- Используя фазу вдоха, получают RVent в соответствии с:
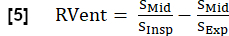
- Используя фазу вдоха, получают RVent в соответствии с:
- Метрика корреляции поток-объем-петля (FVL-CM)
ПРИМЕЧАНИЕ: Для оценки всех фаз дыхания выполняется ряд шагов для создания МРТ, эквивалентного анализу FVL, по аналогии с тестированием функции легких.- Рассчитайте наклон региональной вентиляции (РВент) в качестве суррогата потока с использованием первой производной по времени РВента. Используйте симметричное разностное частное с длиной шага h:
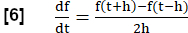
- При необходимости можно отобразить региональные или усредненные уклоны RVent как функцию соответствующего RVent, тем самым генерируя PREFUL, эквивалентный анализу FVL.
- Определите референсный ROI, определив самую большую связанную область со значениями RVent в диапазоне от 80-го до 90-го процентиля ROI легочной паренхимы.
- Усреднить контуры потока-объема в пределах определенного эталонного ROI.
- Чтобы определить сходство каждой ФЖЕЛ легкого с эталоном, соотнесите каждую ФЖЕЛ в ROI легочной паренхимы с эталоном с нулевым запаздыванием:
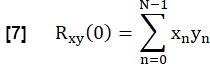
- Нормализуйте его в соответствии с:
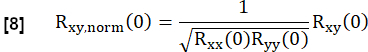
Здесь x и y представляют опорную и соответствующую кривую потока RVent.
ПРИМЕЧАНИЕ: Обратите внимание, что нулевое запаздывание используется для того, чтобы задержка вентиляции приводила к более низкой корреляции.
ПРИМЕЧАНИЕ: На рисунке 5 приведена иллюстрация расчета FVL и производной метрики FVL-CM.
- Рассчитайте наклон региональной вентиляции (РВент) в качестве суррогата потока с использованием первой производной по времени РВента. Используйте симметричное разностное частное с длиной шага h:
- Количественная перфузия
ПРИМЕЧАНИЕ: Количественная оценка выполнена по Glandorf et al. с использованием первых изображений, полученных в переходном состоянии36.- Нормализуйте первые четыре зарегистрированных изображения до среднего уровня вдоха, используя количество вокселя в легких, рассчитанное на шаге 3.1.2. Это уменьшение модуляции, вызванное изменением плотности протонов, выражается как:
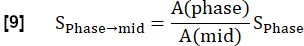
- Выполните экспоненциальную подгонку, чтобы оценить сигнал, связанный с максимальной намагниченностью, с помощью модели:
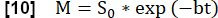
- Определите карту Q, связанную с паренхиматозной перфузией, используя фазу сердечного цикла, которая показывает наиболее максимальные сигналы в ROI паренхимы легких.
- Для оценки регионарной фракции крови (БР) нормализуйте значение S0 , усреднив значения выше 99,99-го процентиля в поисковом ROI (полном вокселе крови):
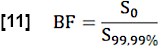
- Оцените обменную фракцию (ФВ) в течение сердечного цикла, рассмотрев отношение максимальной медианной разницы сигналов между устойчивым состоянием (SS) и начальным состоянием, определяемым S0 , и разности сигналов, связанной с потоком Q:
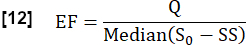
- Определите частоту сердечных сокращений fСердце в 1/с от ROI сосуда с помощью анализа Фурье (частота, соответствующая наибольшему пику).
- Рассчитайте окончательную количественную перфузию (QQ) в мл∙мин-1∙100 мл-1 следующим образом:
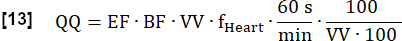
ПРИМЕЧАНИЕ: Здесь объем вокселя (VV) отменяется [мл/мл], а коэффициент преобразования 60 с/мин и коэффициент соглашения 100/100 используются для отображения конечного результата в [мл∙мин-1∙100 мл-1]. EF и BF являются безразмерными соотношениями.
- Нормализуйте первые четыре зарегистрированных изображения до среднего уровня вдоха, используя количество вокселя в легких, рассчитанное на шаге 3.1.2. Это уменьшение модуляции, вызванное изменением плотности протонов, выражается как:
- Пороговые значения и статистика
- Статистически опишите вышеупомянутые параметры для среднего среза и всех срезов со средним значением (все значения/значения среднего среза) и стандартным отклонением (все значения / только значения среднего среза).
- Кроме того, нормализуйте стандартное отклонение до коэффициента вариации, чтобы получить относительный учет дисперсии. Выберите среднее значение и коэффициент вариации в качестве окончательных статистических выходов.
- Применение пороговых значений к картам параметров для создания карт дефектов и получения значений процента дефектов (см. таблицу 3).
- Классифицируйте значения ниже пороговых значений как дефект вентиляции или перфузии (VD/QD). Объедините эти карты для количественной оценки перекрытия дефектов и нормальных областей (классов V/Q), включая следующие комбинации, как показано в четырехкратной таблице в таблице 3:
- Рассчитайте процент дефектов классов «Дефект вентиляции» (VD), «Дефект перфузии (QD)» и «Дефект вентиляции/перфузии (V/Q)» как количество вокселей с соответствующим классом по отношению к общему количеству вокселей паренхимы легких:
Процент брака = #DefectVoxels/#LungParenchyma - Рассчитайте этот процент дефектов для каждого среза и составных корональных срезов. Для данного исследования следует выбрать комбинированный подход, при котором дефект вентиляции определяется операцией OR: VD = VD(RVent) ИЛИ VD(FVL-CM).
ПРИМЕЧАНИЕ: Описанный анализ был выполнен с помощью коммерческого программного приложения (см. Таблицу материалов) с использованием набора инструментов для регистрации Форсберга.
| Параметр | Порог | Комментарий |
| Вент | 90-й процентиль * 0,4 | Адаптивный порог |
| ФВЛ-СМ | 90% | Фиксированный порог |
| Q | 90-й процентиль * 0,15 | Адаптивный порог |
| В/Q | БЕЗ QD | QD |
| БЕЗ ВД | Нормальный | Несоответствие VQ (эксклюзивный QD) |
| ВД | Несоответствие VQ (эксклюзивный VD) | VQ Дефект-Матч |
Результаты
В нижней части рисунка 2 показано следствие правильного и неадекватного масштабирования с соответствующим влиянием на динамический диапазон. На рисунке 6 показано неоднородное распределение сигнала, которое является репрезентативным для сканов без и с нормализацией катушки. Рекомендуется избегать низкого динамического диапазона и изображений без нормализации катушки.
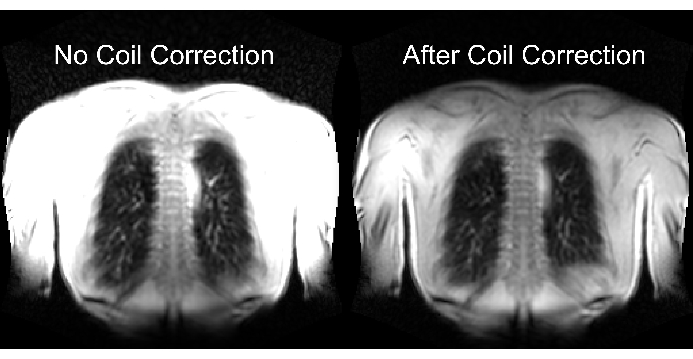
Рисунок 6: Примеры изображений после получения без коррекции катушки (неверно) и с коррекцией катушки (правильно). Обратите внимание на искусственное усиление сигнала на границах корпуса вблизи элементов катушки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
На рисунке 7 показана успешная и неудачная автоматическая сегментация. Обратите внимание, что неудачная сегментация включает в себя не все легкие воксели, что приведет к фальсификации дальнейшего анализа и статистики. Особая осторожность требуется в случаях с инфильтратами, так как такие воксели могут быть ошибочно классифицированы как сосуды из-за их высокого сигнала моделями ИИ или вообще не сегментированы.
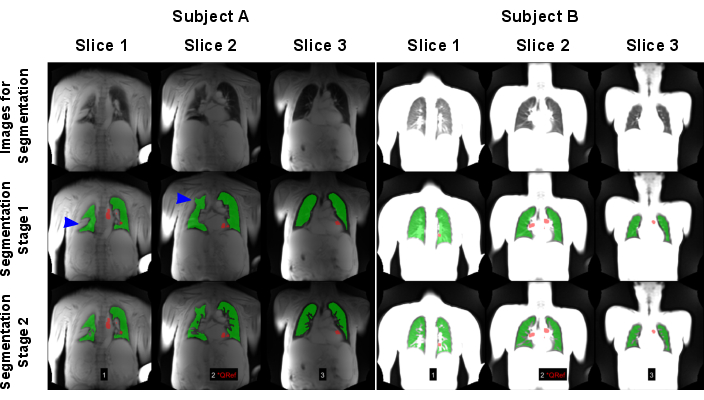
Рисунок 7: Пример автоматизированной сегментации, приведшей к неудачному (субъект А: 83-летний мужчина с ХОБЛ) и успешному результату (субъект Б: 30-летняя женщина здорового контрольного периода). В первой строке показаны изображения, которые использовались в качестве входных данных для моделей ИИ. Во второй строке показаны результаты первого этапа сегментации, заключающегося в нахождении границы легкого. В третьем ряду показан итоговый результат после исключения сосудов. Как показано синими стрелками, алгоритм столкнулся с проблемой из-за высокосигнальных вариаций легких, вызывающих неправильное определение границ легких. Обратите внимание, что изображения были нормализованы по максимальному сигналу, что привело к различным результатам из-за отсутствующей катушки нормализации сканирования, выполненного на объекте А. Красными областями показаны ROI, которые были автоматически обнаружены для сортировки по перфузионной фазе. Сокращения: ХОБЛ = хроническая обструктивная болезнь легких; ROI = области интересов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
На рисунках 8 и 9 показаны репрезентативные карты параметров для здоровых людей из контрольной группы (возраст 30 лет, женщина) и пациента с ХОБЛ (возраст 60 лет, мужчина). Обратите внимание, что здоровый контроль показывает более однородную вентиляцию и перфузию и, следовательно, меньшее количество дефектных вокселей. С соответствующими отчетами статистики ROI можно ознакомиться в таблицах 4 и 5.
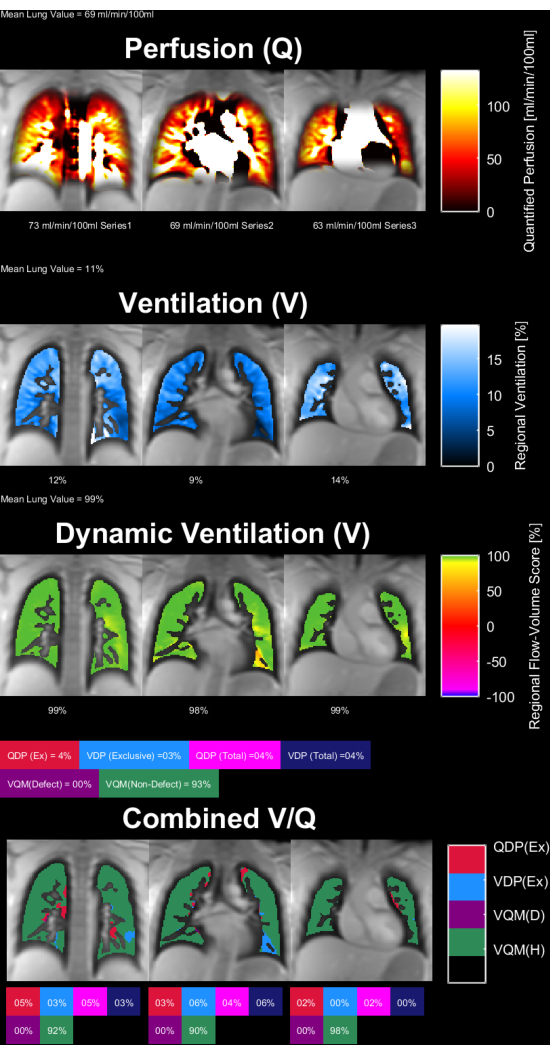
Рисунок 8: Карты параметров PREFUL у 30-летней женщины здорового контрольного периода. Перфузия (1-я строка), регионарная вентиляция (2-я строка), метрика корреляции поток-объемная петля (3-я строка) и пороговые карты V/Q (4-я строка). Обратите внимание на однородное распределение паренхиматозных значений и низкий процент дефектов. Сокращения: PREFUL = функциональное легкое с фазовым разрешением; V = вентиляция; Q = перфузия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
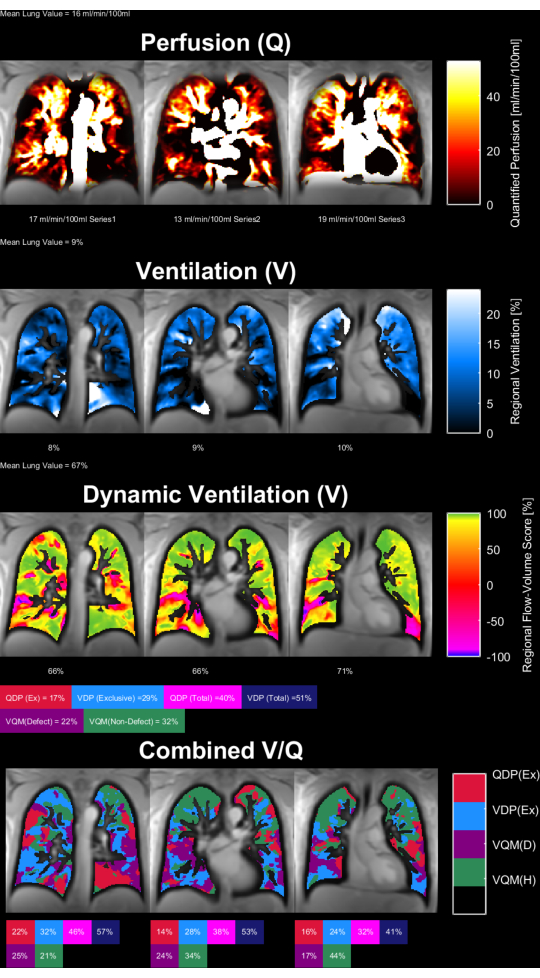
Рисунок 9: Карты параметров PREFUL у 60-летнего мужчины с ХОБЛ. Перфузия (1-я строка), регионарная вентиляция (2-я строка), метрика корреляции поток-объемная петля (3-я строка) и пороговые карты V/Q (4-я строка). Обратите внимание на неоднородное распределение паренхиматозных значений и высокий процент дефектов. Сокращения: ХОБЛ = хроническая обструктивная болезнь легких; PREFUL = функциональное легкое с фазовым разрешением; V = вентиляция; Q = перфузия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Таблица 4: Примерный отчет о параметрах PREFUL, полученных для здоровой контрольной группы (30-летняя женщина). Обратите внимание на низкие значения коэффициента вариации и дефектов, которые соответствуют картам параметров, представленным на рисунке 8 для того же объекта. Смотрите также таблицу 5 и рисунок 9. Сокращение: PREFUL = функциональное легкое с фазовым разрешением. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 5: Примерный отчет о параметрах PREFUL, полученный у пациента с ХОБЛ (мужчина 60 лет). Обратите внимание на высокие значения коэффициента вариации и дефектов, которые соответствуют картам параметров, представленным на рисунке 9 для того же объекта. Смотрите также таблицу 4 и рисунок 8. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительные материалы: Анимированное объяснение алгоритма PREFUL. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Критические шаги
Одним из наиболее распространенных подводных камней при сборе данных является недостаточное масштабирование сигнала, что приводит к потере информации при преобразовании DICOM из-за снижения точности представления цифровых данных. Следовательно, это может привести к проблемам на этапе постобработки. Другой, еще более важной ловушкой является получение нескольких срезов с чередованием. Таким образом, эффективное временное разрешение отдельных срезов критически снижается. Кроме того, в зависимости от расстояния между срезами, это может повлиять на контраст перфузии и количественную оценку, поскольку приток зависит от свежих спинов без истории намагниченности. При настройке протокола требуется особая осторожность, особенно в отношении силы градиента, асимметричного эха, полосы пропускания и параллельной визуализации. Отклонения от предложенных настроек даже для одного из этих параметров могут привести к неадекватному TE и временному разрешению.
Постобработка состоит из нескольких этапов, которые должны выполняться в описанном порядке. Например, регистрация после фильтрации нижних частот не имеет смысла. Следовательно, неудача на одном этапе приводит к поломке на следующих этапах. Это делает этап регистрации особенно важным. Поскольку единого алгоритма регистрации не существует, в зависимости от соответствующей реализации, параметры необходимо задавать опытным путем. Без тонкой настройки этих параметров ложная регистрация помешает получению какого-либо значимого результата. Еще одним возможным трудоемким и важным этапом постобработки является сегментация. Ложная сегментация может привести к совершенно неправильным расчетам параметров (например, при включении областей, не относящихся к легким) в итоговый отчет. Такая неправильная сегментация чаще возникает при использовании алгоритмов глубокого обучения, которые привыкли к определенному внешнему виду изображений и применяются к изображениям другого поставщика/машины с немного другим внешним видом. Поэтому визуальная проверка точности сегментации с возможной ручной коррекцией является обязательной.
Устранение неполадок
Типичная процедура устранения неполадок заключается в том, чтобы следовать всем шагам один за другим и проверять достоверность промежуточных результатов. Порядок выполнения основных действий следующий: Убедитесь, что снимки получены в режиме свободного дыхания с правильной последовательностью и настройками. Затем убедитесь, что динамический диапазон сигналов соответствует (~50 а.е. в паренхиме легкого). Если исходные данные все еще доступны, повторите реконструкцию изображений с соответствующим коэффициентом масштабирования, избегая необходимости в новом сборе данных. Убедитесь, что регистрация была выполнена без существенных артефактов и остаточного движения. Затем проверьте, показывают ли малые ROI временные ряды с ожидаемыми модуляциями, связанными с вентиляцией и перфузией. Затем проверьте, изменяют ли примененные фильтры изображения ожидаемым образом (например, отсутствие высокочастотных модуляций в данных низких частот). Проверьте, являются ли синтезированные дыхательные и сердечные циклы физиологическими и не показывают ли резких скачков. Проверьте точность сегментации. Обратите внимание, что поиск с более высоким уровнем разрешения может понадобиться, как только будет определен основной этап, на котором возникает проблема.
Ограничения
Несмотря на то, что представленный протокол известен тем, что дает воспроизводимые и чувствительные результаты, количество задействованных шагов и параметров во время сбора данных и постобработки позволяет проводить практически бесконечную оптимизацию и взаимосвязано. Таким образом, восходящий подход должен следовать первому рассмотрению оптимизаций протокола последовательности (например, в отношении отношения сигнал/шум и функционального контраста/шума). Для последующих оптимизаций постобработки может быть полезна предопределенная наземная истина в виде цифровой модели легких40. В представленном виде эта модель имитирует получение данных при свободном дыхании и включает в себя несколько классов для моделирования дефектов вентиляции/перфузии. В том числе известную деформацию из-за движения, алгоритмы регистрации также могут быть проверены напрямую. Несмотря на эти преимущества, каждая модель по своей сути ограничена точностью отображения сложной реальности в конечную и упрощенную модель.
Было установлено, что пороговые значения, представленные в этом протоколе, показывают приемлемые результаты для здоровых добровольцев и в различных когортах пациентов с помощью эмпирического анализа. Тем не менее, как указывалось ранее, вероятно, потребуется корректировка в зависимости от последовательности, напряженности поля и когорты.
Общим ограничением PREFUL является обширная постобработка, которая еще не всегда доступна в качестве медицинского продукта, хотя первые версии от Siemens Healthineers и BioVisioneers доступны для научных целей в научном сотрудничестве/коммерческой среде. Вычисления обычно включают параллельную обработку, что предъявляет особенно высокие требования к процессору и оперативной памяти и может потребовать современных рабочих станций или серверных решений для эффективной обработки больших объемов данных. Кроме того, трудоемкие этапы постобработки в настоящее время препятствуют мгновенному представлению результатов, что было бы желательно для клинического рабочего процесса.
Сравнение с другими методами
Существует множество подобных подходов, таких как PREFUL, включая предшественник Фурье-декомпозиции и другие его производные, такие как Matrix Pencil Decomposition41 и несколько иной подход: Self-gated Non-Contrast-enhanced Functional Lung MRI (SENCEFUL MRI)42. В то время как разложение Фурье и подобные методы работают в частотной области, PREFUL использует менее строгую фильтрацию Фурье и последующий расчет амплитуд во временной области. Таким образом, нет необходимости выбирать конкретные пики, соответствующие вентиляции/перфузии. Это может привести к снижению восприимчивости к вариабельности дыхания, которая, как известно, имеет место у людей.
В то время как PREFUL выполняет сортировку изображений, SENCEFUL использует сортировку линий k-space, что приводит к большей гибкости. Тем не менее, SENCEFUL требует последовательностей с возможностями самостробирования, в то время как PREFUL может быть выполнен с обычной последовательностью испорченного градиентного эха. Аналогичным образом, bSSFP, обычно используемый в подходах, основанных на разложении Фурье, известен лучшим SNR и контрастом кровотока, но, как правило, требует большей оптимизации для приобретения легких, особенно при 3T43. Тем не менее, кроме этого, нет никаких причин не объединять PREFUL с приобретением bSSFP44.
Все эти подходы, основанные на сигналах, предполагают, что определенными нежелательными воздействиями сигналов, включая T1, T2/T2*, диффузию, движение в сквозной плоскости и неортогонально перфузированные воксели, можно пренебречь. В то время как прогрессирующая валидация PREFUL косвенно предполагает, что такие влияния действительно не являются критическими, Triphan et al. показали, что существует зависимость от эффективных T1 и TE, что объясняется различным весом компонентов крови и паренхимы в зависимости от TE45. В этом свете первоначальное преимущество bSSFP для визуализации крови из-за контраста T2/T1 может создать дополнительную проблему для установления точной количественной оценки по сравнению с более простой механикой контрастирования SPGRE. Тем не менее, дальнейшие исследования, непосредственно посвященные влиянию различных MR-переменных, например, проведенные Glandorf et al. для контрастных средств46,47, являются желательными, поскольку они могут непосредственно количественно оценить влияние на PREFUL.
Важность
Будучи методом со свободным дыханием и контрастными веществами, PREFUL имеет много преимуществ с ранее упомянутыми родственными методами: 1) Отсутствие применения ионизирующего излучения и контрастного вещества, 2) Отсутствие необходимости в дополнительном оборудовании или персонале, 3) приобретение, которое зависит только от минимального соблюдения пациентом режима лечения. Эти преимущества делают PREFUL удобным инструментом мониторинга, особенно для уязвимых групп, таких как дети с хроническими заболеваниями легких. Несмотря на то, что отношение сигнал/шум при использовании последовательности SPGRE является низким, доступность и отсутствие потребности в дополнительном программировании/совместном использовании последовательностей еще больше способствуют распространению этого подхода.
Как обсуждалось во введении, количество исследований, демонстрирующих хорошую валидацию, воспроизводимость, результаты чувствительности и возможности мониторинга, показывает, что важность этого метода и соответствующих динамических параметров находится на восходящей траектории и будет в дальнейшем поддерживаться широким распространением.
Раскрытие информации
Филип Климеш, Андреас Воскресензев и Йенс Фогель-Клауссен являются акционерами компании BioVisioneers GmbH, которая проявляет интерес к методам магнитно-резонансной томографии легких.
Благодарности
Эта работа была профинансирована Немецким центром исследований легких (DZL). Авторы выражают глубокую благодарность всем, кто внес свой вклад и поддержал дальнейшее развитие PREFUL, в частности: Марселю Гутберлету, Тиллю Ф. Кайрайту, Леа Берендт, Юлиану Гландорфу, Соне Людигер, Тауфику Мохеру Алсади, Катарине Бюнеманн, Мариусу Вернцу, Робину Мюллеру, Максимилиану Зубке, Гезе Пёлер, Агило Керну, Кристиану Кризосто, Милану Шпету, Арнду Оберту, Жюльену Шеллеру, Джим Уайлд, Эдвин ван Бик, Хелен Маршалл, Йенс Готлиб, Марта Дона, Диана Ренц, Анна-Мария Дитрих, Тобиас Велте, Йенс Хольфельд, Патрик Зардо, Джайлс Сантир, Франц Вольфганг Хирш, Роберт Гримм, Бастиан Бир, Бассем Исмаил, Андре Фишер, Бертольд Кифер, Грегор Тормер и Ребекка Рамб. Кроме того, авторы также хотели бы поблагодарить рентгенологов и участников исследования. В частности, мы благодарим Франка Шредера и Свена Тиле из отделения радиологии Высшей медицинской школы Ганновера за выдающуюся техническую помощь в проведении МРТ-исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
Ссылки
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены