Method Article
IRM pulmonaire fonctionnelle résolue en phase pour l’évaluation de la ventilation et de la perfusion pulmonaires (V/Q)
Dans cet article
Résumé
Ici, nous décrivons la mise en œuvre de l’IRM pulmonaire fonctionnelle résolue en phase en tant que technique d’IRM de protons sans agent de contraste pour l’évaluation de la ventilation pulmonaire et de la dynamique de perfusion. Validé et applicable à différentes intensités de champ et groupes d’âge, il pourrait améliorer la prise de décision clinique à l’avenir en aidant à la quantification de la maladie et au suivi du traitement.
Résumé
La décomposition de Fourier est une méthode d’IRM 1H sans produit de contraste pour l’évaluation de la perfusion pulmonaire (Q) et de la ventilation (V). Après l’enregistrement des images, la série temporelle de chaque voxel est analysée en ce qui concerne les composantes de fréquence cardiaque et respiratoire.
À l’aide d’une séquence standard d’écho dégradé gâché 2D avec une résolution temporelle de ~300 ms, un algorithme de tri d’images a été développé pour produire une imagerie pulmonaire fonctionnelle résolue en phase (PREFUL) avec une résolution temporelle accrue. Ainsi, il est possible d’évaluer les boucles volumiques régionales (FVL) pendant la respiration du volume courant et de décrire la propagation de l’onde de pouls pendant le cycle cardiaque. Cette méthode peut être appliquée à 1,5T ou 3T avec du matériel MR standard sans qu’il soit nécessaire de programmer des séquences, car le protocole décrit peut être mis en œuvre avec la séquence SPGRE par défaut sur la plupart des systèmes.
L’IRM de ventilation PREFUL a été validée à l’aide de l’imagerie des gaz 129Xe et 19F avec un bon accord régional. L’IRM PREFUL pondérée en fonction de la perfusion a été validée à l’aide de la SPECT ainsi que de l’IRM à contraste dynamique (DCE). PREFUL a été testé dans un cadre double centre et deux fournisseurs et est actuellement appliqué dans plusieurs essais multicentriques en cours. De plus, il est réalisable dans une gamme d’intensités de champ (0,55T-3T) et dans différents groupes d’âge, y compris les nouveau-nés.
L’IRM quantitative V/Q PREFUL a été utilisée chez des patients atteints de mucoviscidose, de bronchopneumopathie chronique obstructive, d’hypertension pulmonaire thromboembolique chronique et de maladie à virus corona-2019 pour quantifier la maladie et surveiller l’évolution du traitement après le traitement. De plus, il a été démontré que l’imagerie PREFUL V/Q permet de prédire la perte de greffe due à un dysfonctionnement chronique de l’allogreffe pulmonaire chez les patients après une transplantation pulmonaire. En résumé, l’IRM PREFUL est une technique validée pour la ventilation quantitative et l’imagerie des ondes de pouls/perfusion pulmonaires pour la détection, la quantification et le suivi du traitement des maladies pulmonaires régionales, avec une valeur ajoutée potentielle à la routine clinique actuelle.
Introduction
Le système respiratoire, avec ses mécanismes complexes, est vulnérable à diverses maladies. De manière proéminente, les affections respiratoires chroniques telles que la bronchopneumopathie chronique obstructive (BPCO), la fibrose kystique (FK) et l’hypertension pulmonaire thromboembolique chronique (HPTEC) réduisent considérablement l’espérance de vie1. Par conséquent, le diagnostic précoce, le suivi et l’évaluation de la réponse thérapeutique sont devenus primordiaux.
Les tests de la fonction respiratoire (PFT) peuvent dériver des paramètres globaux de la fonction pulmonaire tels que l’indice de Tiffeneau-Pinelli, défini comme le rapport entre le volume expiratoire maximal en une seconde (VEMS1) et la capacité vitale forcée (CVF)2. Ces paramètres sont bien établis dans la routine clinique, mais manquent d’informations régionales et nécessitent un niveau élevé d’observance du patient. À cet égard, l’imagerie peut offrir des informations supplémentaires et des possibilités pour des paramètres plus sensibles. La tomodensitométrie (TDM) offre une imagerie à haute résolution de la morphologie parenchymateuse, et des techniques récentes telles que la cartographie de la réponse paramétrique récupèrent également des informations fonctionnelles3. Néanmoins, la tomographie par émission de photons uniques (SPECT) reste la référence actuelle pour représenter la ventilation et la perfusion (V/Q) dans le poumon4. Communes à tous, les modalités d’imagerie mentionnées nécessitent une exposition aux rayonnements ionisants, ce qui nécessite une attention particulière dans les cas de surveillance et de groupes vulnérables. Par conséquent, un effort continu est en cours pour promouvoir l’IRM en tant que modalité alternative.
De manière inhérente, le poumon est un organe difficile pour l’IRM en raison de sa faible densité de protons et de sa décroissance rapide du signal5. Parmi la multitude d’approches, les solutions les plus répandues comprennent l’utilisation de gaz hyperpolarisés (par exemple, l’IRM 129Xe) pour la ventilation6 et l’application intraveineuse d’un agent de contraste à base de gadolinium pour la représentation de la perfusion7. Ces méthodes offrent un rapport signal/bruit (SNR) élevé et sont largement considérées comme des méthodes de référence dans la communauté MR. Une approche plus récente évite l’application de tout agent de contraste et est réalisable avec la RM conventionnelle des protons en respiration libre avec un temps d’acquisition total de ~1 min/tranche. Ainsi, les effets indésirables potentiels et les effets à long terme récemment débattus des agents de contraste sont évités et une diffusion plus facile sans qu’il soit nécessaire de recourir à une hyperpolarisation supplémentaire et à du matériel multinucléaire est permise. De plus, le problème de trouver un état de gonflage adéquat, qui peut affecter les valeurs de défaut de ventilation dérivées8 , est évité par l’acquisition en respiration libre.
Cette approche basée sur le signal IRM indirect a été introduite pour la première fois par Zapke et al. qui ont utilisé la relation réciproque du signal pondéré en protons S et du volume pulmonaire V : S~1/V.9 Elle est basée sur le processus de transformation des images acquises en respiration libre en un état d’inflation commun (généralement dans une position intermédiaire entre l’expiration finale et l’inspiration finale), compensant ainsi le mouvement et permettant d’analyser la série temporelle du signal dans chaque voxel. Par la suite, une mesure de la ventilation peut être dérivée de ces images dites enregistrées à l’aide de l’équation (1) de Klimeš et al.10 :
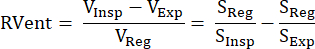 (1)
(1)
Avec les volumes/signaux en inspiration (Insp), en expiration (Exp) et en état enregistré (Reg). Par la suite, la méthode a été élargie par l’introduction de la décomposition de Fourier pour différencier les modulations du signal associées à la fréquence respiratoire (ventilation) et à la fréquence du pouls (perfusion) et donc, dériver une carte V/Q parfaitement appariée spatialement à partir d’une acquisition11. Ceci est rendu possible par l’écart typique entre les fréquences respiratoires et cardiaques, de sorte que les deux composantes qui sont superposées dans le domaine temporel sont efficacement discriminées dans le domaine fréquentiel par l’analyse de Fourier. Après le passage d’un champ faible (0,35T) à 1,5T avec une séquence de précession libre en régime stationnaire équilibrée optimisée (bSSFP)12, cette méthode a commencé à attirer davantage l’attention avec plusieurs études de suivi 13,14,15.
Étant donné que la respiration et le pouls sont sujets à la variabilité et que l’imagerie bSSFP (gradient compensé) disponible dans le commerce à 1,5T peut entraîner des artefacts de bande substantiels (lignes claires de signal vide), une méthode similaire a été proposée avec une séquence d’écho de gradient gâchée (SPGRE) en combinaison avec un filtrage passe-bas et passe-haut large16,17. Cela permet de capturer le spectre plus complexe des modulations réelles liées à la respiration et au pouls. Le calcul suivant de l’amplitude dans le domaine temporel évite d’avoir à sélectionner un pic de fréquence spécifique. Une optimisation supplémentaire a été obtenue en divisant l’enregistrement typique en une étape vers un état de référence en deux étapes distinctes. Ainsi, le fait que pendant la respiration libre, une gamme de phases de respiration différentes est acquise entre l’inspiration finale et l’expiration finale, avec divers degrés de déformation requis vers un état fixe, est utilisé. Après avoir choisi plusieurs groupes et identifié le groupe d’images individuelles, la procédure suivante est effectuée : 1) Enregistrement à l’intérieur du groupe d’état respiratoire respectif, 2) Enregistrement intergroupe étape par étape d’un groupe adjacent à l’autre (par exemple, 1->2, 2->3,...) au groupe représentant le groupe de référence. Cette approche a été élargie par l’estimation de phase pour chaque image afin d’établir une résolution temporelle apparente plus élevée pour faciliter l’analyse de la dynamique de la ventilation et de la perfusion, ce qui a conduit à la terminologie IRM du poumon fonctionnel résolu en phase (PREFUL) pour différencier cette branche des autres techniques connexes18. Les études de suivi ont utilisé les informations supplémentaires fournies par la respiration complète et les cycles cardiaques et ont montré une sensibilité potentiellement accrue de ces paramètres 19,20,21.
La validation avec la SPECT de référence a révélé un coefficient de dés de ≥67 % pour les régions de défauts22, et une mesure plus directe de la ventilation avec 129Xe a montré une corrélation des pourcentages de défauts de ventilation ≥62 % dans une cohorte mixte BPCO/FK/sain23 et 84 % dans une cohorte multicentrique et multi-fournisseurs de FK24, qui a également démontré une corrélation similaire avec l’indice de clairance pulmonaire de PREFUL et 129Xe (r = 0,82 et r = 0,91). L’analyse de perfusion de la même étude a montré qu’il n’y avait pas de différences significatives dans le chevauchement spatial avec l’ECD entre les centres évalués25. La concordance avec l’EDC et l’accord des résultats de PREFUL entre les centres ont également été signalés pour une sous-étude prospective incluant neuf centres26. Une analyse de reproductibilité chez les patients atteints de BPCO a abouti à un coefficient de variation inférieur à 15 % pour tous les paramètres27. Les études actuelles suggèrent que le paramètre FVL a un pouvoir prédictif et une sensibilité plus élevés pour détecter les changements de traitement par rapport au paramètre de ventilation « statique », qui ne prend en compte que les phases de fin d’inspiration et de fin d’expiration. La réactivité au traitement par des mesures de boucle débit-volume régionale (FVL) a été démontrée après un traitement par inhalation avec de l’indacatérol-glycopyrronium (IND/GLY) dans la BPCO28. En concordance, le paramètre FVL prédisait la perte de greffe chez les patients transplantés de deux poumons, alors que la spirométrie ne le pouvait pas (P = 0,02 vs P = 0,33)29. Les premières études de faisabilité montrent que l’imagerie pulmonaire fonctionnelle avec PREFUL peut être réalisée chez les nourrissons et les nouveau-nés en respiration libre avec du matériel d’IRM clinique standard30,31. Glandorf et al. ont comparé les paramètres PREFUL à 1,5T et 3T (séquence SPGRE) et n’ont trouvé aucune différence significative pour la plupart des paramètres, qui étaient hautement reproductibles malgré la différence d’intensité de champ32. Cela peut être un avantage important, car tous les sites n’ont pas accès à des scanners de champ 1,5T ou inférieur. Récemment, la faisabilité et la détection de symptômes persistants après une infection par la COVID-19 à 0,55T ont été démontrées en évaluant les données bSSFP avec PREFUL33.
En résumé, bien qu’il s’agisse d’une technique relativement nouvelle, PREFUL a été largement étudiée. Des critères importants tels que la validation avec des mesures plus directes et établies, la reproductibilité, la sensibilité pour la pathologie et la réactivité au traitement et aux changements de progression ont été évalués. Néanmoins, seuls quelques centres spécialisés utilisent cette technique malgré les faibles exigences technologiques. Par conséquent, l’objectif de ce travail est de résumer la dernière méthodologie de PREFUL MR sous forme écrite et visuelle. Cette information peut être utilisée pour établir cette technique dans plus de centres et ainsi, à long terme, conduire à une technique plus mature.
Protocole
Cette étude a reçu l’approbation du comité d’éthique de la faculté de médecine de Hanovre, ce qui garantit qu’elle a respecté des normes éthiques rigoureuses tout au long du processus de recherche. L’enquête a strictement suivi les lignes directrices énoncées dans la Déclaration d’Helsinki, qui met l’accent sur la conduite éthique de la recherche médicale. De plus, le consentement éclairé a été obtenu avec diligence de tous les participants à l’étude (ou de leurs parents ou tuteurs légaux) avant leur participation à l’examen IRM. Voir la figure 1 pour une vue d’ensemble simplifiée des étapes de base du protocole, à savoir l’acquisition, l’enregistrement, le filtrage et le tri, et enfin, la synthèse des cycles cardiaques et respiratoires. Dans les sections suivantes, toutes les étapes impliquées sont décrites en détail.
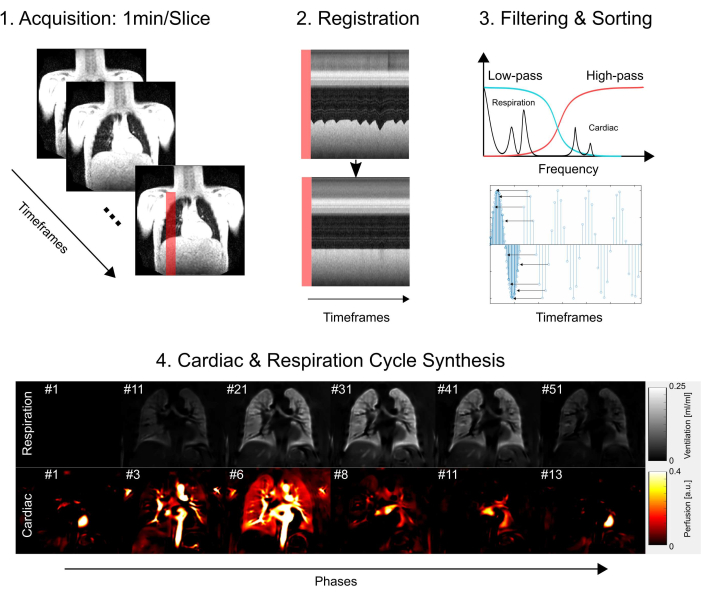
Figure 1 : Vue d’ensemble schématique des composants de base de PREFUL. 1) Acquisition en respiration libre, ce qui nécessite 2) la compensation de mouvement par recalage comme démontré avec les tracés de profil et permet une analyse voxel par voxel des composantes de Fourier comme illustré à l’étape 3) le filtrage et le tri. Après filtrage passe-bas (ventilation) et passe-haut (perfusion), 4) la phase estimée est utilisée pour trier les images à une résolution temporelle apparente plus élevée et synthétiser un cycle cardiaque et respiratoire complet. Notez qu’il s’agit d’un plan simplifié et que tous les détails sont décrits dans le manuscrit. D’autres étapes, qui sont omises dans cette figure, incluent la quantification des paramètres et la génération de rapports. Abréviation : PREFUL = poumon fonctionnel résolu en phase. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Recrutement
- Recruter des patients adultes ou mineursdans un essai d’IRM PREFUL pour des patients et des témoins sains sur la base de leur diagnostic d’un trouble pulmonaire basé sur un examen de spirométrie et/ou une imagerie antérieure (par exemple, radiographie ou tomodensitométrie) ; la capacité de donner un consentement éclairé ; capacité de s’allonger à plat et de rester immobile pendant toute la durée de l’IRM ; et aucune contre-indication connue à l’IRM (p. ex., implants métalliques, claustrophobie).
- Exclure les patientes qui sont enceintes, qui ont déjà subi une chirurgie pulmonaire au cours des 6 derniers mois, qui présentent une détresse respiratoire sévère ou qui ont besoin d’une supplémentation continue en oxygène, ou qui ont déjà eu des effets indésirables à des agents de contraste à base de gadolinium si l’IRM avec produit de contraste est utilisée en plus de PREFUL.
- Recrutez des témoins sains s’il n’y a pas d’antécédents connus de maladie pulmonaire sur la base de l’examen clinique et de l’auto-évaluation ; les tests de la fonction pulmonaire sont normaux ; ils sont capables de donner un consentement éclairé ; ils sont capables de rester allongés et immobiles pendant toute la durée de l’IRM ; et n’ont pas de contre-indications connues à l’IRM.
- Exclure les individus en tant que témoins sains en fonction des antécédents actuels ou passés de tabagisme, de l’exposition à des toxines pulmonaires connues ou à des risques professionnels, des antécédents familiaux de maladies pulmonaires héréditaires, de toute maladie chronique connue qui pourrait influencer la fonction pulmonaire et de la grossesse.
- Procurez-vous des formulaires de consentement. Poursuivre le protocole si le participant obtient un formulaire écrit de consentement éclairé contenant l’objet et les procédures de la recherche, les risques et les avantages potentiels, les garanties de confidentialité, la durée de l’étude et le droit de se retirer sans conséquence.
- Appliquez les étapes supplémentaires suivantes lorsque le recrutement comprend des mineurs.
- Obtenir le consentement éclairé écrit d’au moins un parent ou tuteur en plus de l’assentiment du mineur.
- Présentez l’ensemble du processus d’une manière adaptée à l’âge et compréhensible pour le mineur.
- Pour les jeunes mineurs, utilisez des aides visuelles, des livres d’histoires ou des explications simplifiées.
- Assurez-vous que l’étude est pertinente pour le groupe d’âge et que les mineurs ne sont pas inclus inutilement.
- Permettre aux mineurs d’être accompagnés d’un adulte de confiance (par exemple, un parent, un tuteur) pendant toutes les procédures liées au procès, à moins que cela n’interfère avec l’intégrité du procès.
REMARQUE : Les étapes décrites supposent que l’essai a été examiné et approuvé par le Comité d’éthique.
- Appliquez les étapes supplémentaires suivantes lorsque le recrutement comprend des mineurs.
2. Acquisition
- Effectuez la procédure de sécurité du prébalayage.
- Avant une IRM, effectuez un prédépistage détaillé des patients afin d’identifier les contre-indications potentielles telles que des interventions chirurgicales antérieures, des dispositifs implantés, des tatouages ou une exposition à des fragments métalliques.
- À votre arrivée, informez les patients des propriétés magnétiques et des risques de la procédure.
- Demandez aux patients d’enlever tous les objets métalliques personnels, y compris les bijoux, les montres et certains composants vestimentaires, et de leur fournir une blouse si nécessaire.
- Demandez à un professionnel qualifié d’inspecter visuellement les patients à la recherche d’objets métalliques négligés.
- Examinez tous les dispositifs médicaux ou implants pour vérifier leur compatibilité avec l’IRM.
- S’assurer que des protocoles d’urgence sont en place pour assurer la sécurité du personnel et des patients.
- Position du participant et balayage
- Orientez le patient la tête la première et allongez-le en position couchée sur un système 0,55T, 1,5T ou 3T.
- Fournissez une protection auditive, une sonnette d’urgence, un rembourrage et une couverture pour plus de sécurité et de confort.
- Positionnez une bobine flexible multicanaux juste sous le menton pour assurer une sensibilité optimale de la bobine dans toutes les zones pulmonaires.
- Sécurisez le placement de la bobine pour maintenir la stabilité sans entraver la respiration du patient.
- Demandez au patient de fermer les yeux, puis marquez le centre du poumon à l’aide du laser IRM.
- Alignez le centre pulmonaire sur l’isocentre et laissez le patient rouvrir les yeux.
- Balayage des localisateurs initiaux pour établir une orientation générale, suivi d’un balayage morphologique transversal pour identifier la bifurcation trachéale.
- Ancrez la première coupe coronale au niveau de la bifurcation trachéale comme point de repère cohérent pour améliorer la reproductibilité.
- Selon le protocole de balayage, capturez trois tranches espacées d’une tranche à l’autre à une distance (mesurée d’un bord à l’autre) de 100 % (de l’épaisseur de la tranche) ou acquérez plusieurs tranches couvrant l’ensemble du poumon avec une distance de 20 % ou 33 %.
- Acquérez chaque tranche complètement séparément et non entrelacée.
- Téléchargez les images reconstruites dans le système d’archivage et de communication d’images (PACS) pour un accès et une analyse ultérieurs. Par ailleurs, pour respecter les normes de confidentialité et de protection des données, exportez manuellement les images vers un lecteur réseau désigné ou une solution de stockage similaire.
REMARQUE : Pour des informations détaillées sur le protocole et les paramètres de séquence, reportez-vous au Tableau 1 et au Tableau 2. Pour une représentation visuelle du positionnement des tranches, reportez-vous à la figure 2.
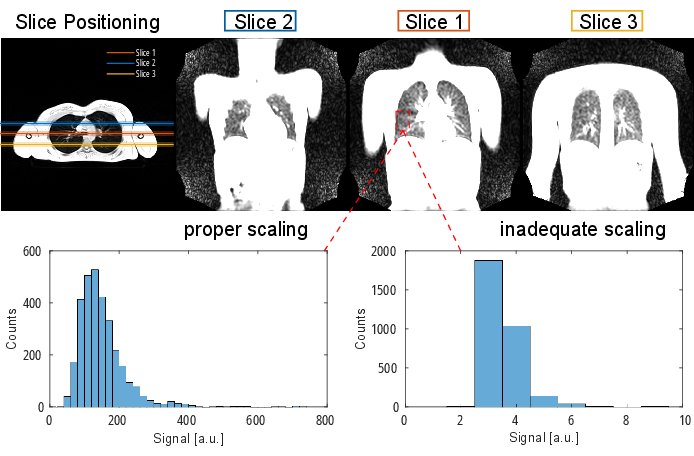
Figure 2 : Positionnement typique d’une tranche pour une expérience PREFUL visualisé avec un écho de gradient 3D en orientation transversale. Notez que la première tranche est positionnée au niveau de la bifurcation trachéale comme un point de repère reproductible. Les 2eet 3etranches sont positionnées avec un espace de tranche de 100% dans les directions antérieure et postérieure. Des histogrammes exemplaires montrent des distributions de valeurs avec une mise à l’échelle correcte et inadéquate (faible). Ce dernier conduit à une faible plage dynamique et à une perte de précision. Une mise à l’échelle élevée inadéquate, qui conduit à un écrêtage (non illustré ici), doit également être évitée. Abréviation : PREFUL = poumon fonctionnel résolu en phase. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Aperçu typique d’un protocole PREFUL. Après un localisateur, un volume 3D du poumon est acquis en orientation transversale. Cette acquisition est utilisée pour planifier les acquisitions PREFUL suivantes (voir également le Tableau 2 pour les paramètres de séquence et la Figure 2 pour le positionnement des tranches). D’autres séquences peuvent être ajoutées en fonction de l’étude. Abréviation : PREFUL = poumon fonctionnel résolu en phase. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Résumé des paramètres de séquence pour l’acquisition de PREFUL avec une séquence d’écho de gradient gâtée. Abréviations : PREFUL = poumon fonctionnel résolu en phase ; SPGRE = séquence d’écho de gradient gâtée. Veuillez cliquer ici pour télécharger ce tableau.
3. Post-traitement
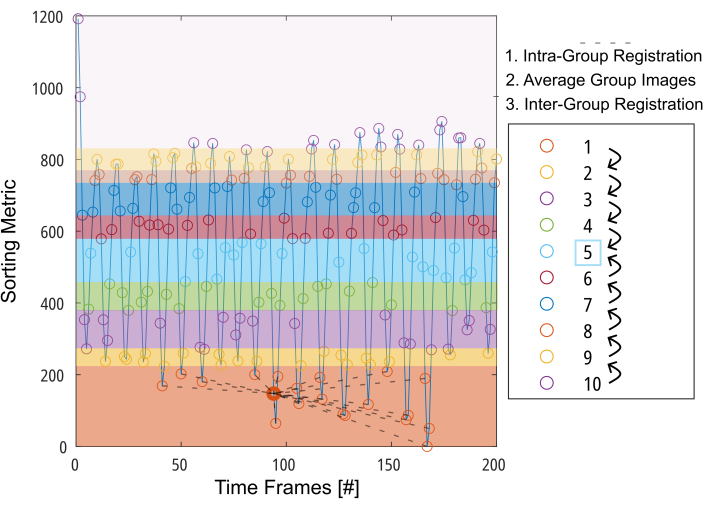
Figure 3 : Présentation schématique de l’alignement orienté groupe afin de minimiser la déformation requise pour la compensation de mouvement. Après avoir divisé les images (représentées par des cercles) en 10 groupes sur la base d’une métrique de tri (par exemple, la zone pulmonaire segmentée), les images sont enregistrées à l’intérieur de chaque groupe jusqu’à une position intermédiaire (illustrée par des lignes pointillées pour le groupe 1). Ensuite, la moyenne des images enregistrées est calculée et utilisée pour l’étape finale du recalage intergroupe, étape par étape, vers le groupe intermédiaire. Abréviation : GOREG = inscription orientée groupe. Veuillez cliquer ici pour voir une version agrandie de cette figure.
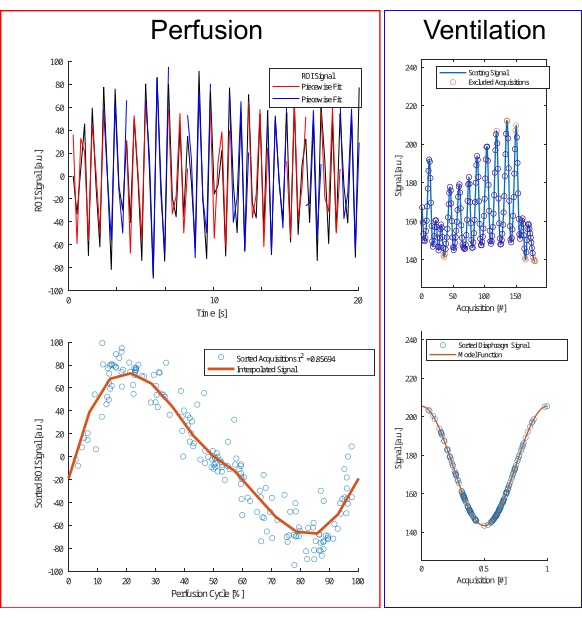
Figure 4 : Illustration de l’algorithme de tri pour la perfusion et la ventilation. Pour la perfusion (à gauche), un ajustement par pièce (rangée supérieure) est effectué pour estimer la phase et le recours des acquisitions (rangée inférieure). Pour la ventilation (à droite), les valeurs aberrantes sont exclues (rangée supérieure) et triées selon un modèle de cosinus (rangée inférieure) basé sur l’amplitude et le différentiel d’amplitude pour distinguer les phases d’expiration et d’inspiration. Veuillez cliquer ici pour voir une version agrandie de cette figure.
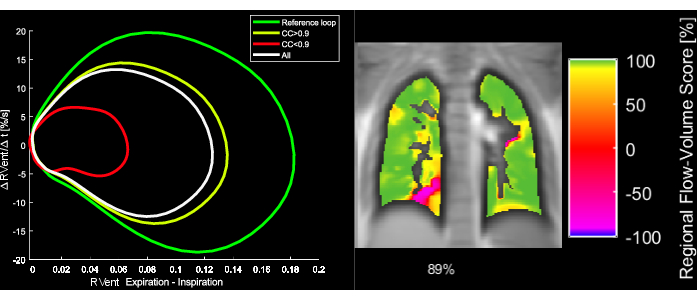
Figure 5 : Boucles débit-volume exemplaires et mesure de corrélation FVL correspondante d’une patiente de 43 ans atteinte de BPCO. Notez qu’avec le changement de FVL, le FVL-CM diminue. Abréviations : FVL = boucle débit-volume ; FVL-CM = métrique de corrélation FVL ; BPCO = bronchopneumopathie chronique obstructive. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 3 : Application de seuils aux cartes de paramètres et combinaison de cartes de défauts. Veuillez cliquer ici pour télécharger ce tableau.
- Inscription
REMARQUE : Dans la section suivante, la procédure d’enregistrement non rigide à un volume de référence (de préférence le niveau respiratoire de niveau moyen) à l’aide d’un schéma orienté groupe (GOREG) pour la compensation de la respiration et du mouvement cardiaque est décrite.- Récupérez les images.
- Dans un premier temps, effectuez une segmentation pulmonaire sur toutes les images non enregistrées, avec un U-Net entraîné et appliquez un filtre passe-bas avec une coupure de 0,7 Hz pour obtenir une estimation des phases de respiration.
REMARQUE : Cela lancera le pipeline de traitement entièrement automatisé, qui effectuera les étapes suivantes en arrière-plan. Les étapes de traitement démontrées et décrites ne sont pas limitées à une application ou à un langage spécifique et peuvent donc être implémentées dans une application personnalisée avec de nombreux langages de programmation. - Classez une grande quantité de voxels segmentés comme inspiration et une faible quantité comme expiration.
- Regroupez les images en les divisant en 10e centiles, en vous assurant que chaque groupe des 10 groupes résultants contient un nombre égal d’images.
- Sélectionnez ANTs34 (BSplineSyN avec métrique de corrélation croisée) ou Forsberg35,36 (expansion polynomiale avec régularisation élastique et fluide) comme algorithme de recalage.
- Effectuer l’intra-inscription pour chaque groupe vers la position pulmonaire intermédiaire du groupe respectif.
- Faites la moyenne des résultats du groupe pour obtenir une image pour chaque groupe.
- Effectuez l’inter-enregistrement en allant de chaque image de groupe vers le voisin suivant en direction du 5èmegroupe.
- Appliquer la chaîne de déformations aux images d’origine, si nécessaire pour atteindre la position respiratoire représentée par l’image moyennée dans le groupe 5. Par exemple, pour l’image 36, qui appartient au groupe 3, les champs de déformation suivants sont appliqués : 36->Image 57 (~Position pulmonaire intermédiaire dans le groupe 3) -> Étape 3->4 -> Étape 4->5.
REMARQUE : Pour une description détaillée de la procédure GOREG, reportez-vous à la figure 3. Effectuez l’enregistrement avec le calcul parallèle pour réduire le temps de traitement. Le repérage GOREG est effectué pour minimiser la quantité de déformation requise pour chaque étape de repérage et ainsi assurer une convergence stable des algorithmes. Néanmoins, l’enregistrement peut également être effectué avec un seul pas de déformation vers la position pulmonaire intermédiaire. Alors que toutes les études 2D PREFUL publiées ont utilisé des ANT, Forsberg donne des résultats jusqu’à 6 fois plus rapides avec des résultats de qualité comparable à celle rapportée par une étude 3D PREFUL37. Des résultats exemplaires dans ce rapport ont été obtenus avec l’enregistrement Forsberg. Reportez-vous à la figure 1 pour voir une illustration de l’effet de repérage sur le mouvement du diaphragme.
- Filtrage général
- Débruitez les images enregistrées à l’aide du filtrage guidé par l’image38, en utilisant l’image enregistrée moyennée dans le temps comme image guide. Appliquez les paramètres suivants : NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- Pour l’analyse de la ventilation et de la perfusion, utilisez un filtre passe-bas ou passe-haut avec une coupure à 0,7 Hz pour supprimer l’autre composant respectif. Excluez les 20 premières images de toutes les étapes de traitement ultérieures, à l’exception du calcul de perfusion quantifié, afin de garantir un état stable dans la série chronologique incluse.
REMARQUE : Un changement de la coupure peut être nécessaire si les sujets ont une fréquence respiratoire supérieure à ~40 respirations / min.
- Segmentation
REMARQUE : La segmentation finale est effectuée à l’aide des images enregistrées en position pulmonaire intermédiaire dans une procédure en deux étapes comme indiqué ci-dessous.- Effectuez une segmentation de la limite pulmonaire (retour sur investissement pulmonaire) sur les images enregistrées moyennées temporellement avec un U-Net entraîné ou manuellement.
- Ensuite, excluez les gros vaisseaux centraux pour affiner la segmentation des limites pulmonaires et obtenir une région d’intérêt ou un retour sur investissement pour le parenchyme pulmonaire.
- Perfusion
REMARQUE : Les étapes suivantes sont nécessaires pour estimer avec précision la phase cardiaque pour chaque image de la série acquise, qui est échantillonnée à une fréquence relativement faible (~3-5 images/s), en particulier par rapport à la fréquence cardiaque (généralement 40-90 bpm). La réorganisation des données en fonction des phases cardiaques déterminées permet d’obtenir le cycle cardiaque complet avec une résolution temporelle améliorée, dépassant le taux d’échantillonnage de l’acquisition des données18 (voir la figure 4 pour une illustration de la procédure de tri). Pour l’estimation de phase, un retour sur investissement de recherche avec un signal pondéré par perfusion fort est nécessaire. Utiliser un algorithme de recherche itératif comme suit22.- Connectez le retour d’intérêt de la limite pulmonaire pour inclure le médiastin dans le retour sur investissement de recherche.
- Générez une carte simple pondérée par la perfusion en calculant l’écart-type sur l’ensemble de la séquence d’images.
- Identifiez les régions correspondant au 98e centile de cette carte dans le retour sur investissement de recherche en tant que retours sur investissement de départ pour les étapes suivantes.
- Effectuez le montage par morceaux, en augmentant la taille des points de graine tant que les performances de montage s’améliorent.
- Classez les retours sur investissement des semences élargies en fonction de leur performance d’ajustement.
- Combinez de manière itérative les meilleurs retours sur investissement des graines avec les deuxième, troisième meilleurs, etc., jusqu’à ce que la combinaison n’améliore pas la métrique ou que tous les retours sur investissement des graines soient pris en compte. Considérez que le retour sur investissement final est le retour sur investissement du navire utilisé pour l’estimation de la phase cardiaque.
- Faites la moyenne spatiale du signal à l’intérieur de l’estimation de phase optimisée pour produire une série signal-temps pour l’estimation de phase.
- Effectuez l’estimation par morceau en segmentant le signal en portions plus petites à l’aide des maxima locaux du signal, suivis d’un ajustement sinusoïdal par morceau en tenant compte de paramètres tels que l’amplitude, le décalage de phase et la fréquence (Figure 4).
- Triez les images par phases pour représenter un cycle cardiaque.
- Utilisez la régression du noyau de Nadaraya-Watson avec un noyau gaussien (sigma = 0,1) pour interpoler 15 phases sur une grille temporelle uniformément espacée englobant un seul cycle cardiaque.
REMARQUE : Reportez-vous à la figure 1 pour un sous-ensemble d’un cycle cardiaque complet synthétisé exemplaire d’un volontaire sain, commençant à la diastole, passant à la systole et revenant à la diastole.
- Ventilation
REMARQUE : Pour l’analyse de perfusion, notez que la fréquence cardiaque reste relativement stable avec des variations d’amplitude négligeables. En revanche, la ventilation a tendance à connaître plus de variations de volume courant et de fréquence, ce qui conduit à des états respiratoires différents avec des phases respiratoires identiques n’ayant pas toujours la même amplitude. Inspiré par l’approche d’auto-déclenchement de Fischer et al., il est essentiel de catégoriser la ventilation en fonction de l’amplitude du signal.- Exclure les valeurs aberrantes extrêmes à l’aide de règles empiriques (données inférieures au 5e centile ou supérieures au 97e centile).
- Dérivez la plage d’amplitude R et le décalage C à partir de la série signal-temps créée pour le regroupement de recalage.
- Définissez une fonction modèle A(t) avec une fréquence choisie arbitrairement fRespiration (ici 0,3 Hz) :
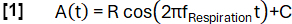
- Classez les données en états d’inspiration et d’expiration en fonction de la pente.
- Obtenir une détermination de phase plus précise en fonction de la fonction du modèle :
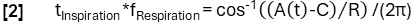
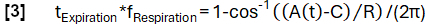
- Par la suite, alignez les échantillons en fonction de leur phase et appliquez la régression du noyau de Nadaraya-Watson pour calculer la ventilation à des intervalles uniformément espacés pendant le cycle respiratoire.
- Calculez la ventilation régionale (RVent) pour chaque phase par analogie avec l’équation 1, en remplaçant la phase d’inspiration par la phase respective.
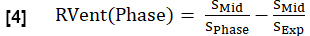
REMARQUE : Reportez-vous à la figure 1 pour voir un sous-ensemble d’un cycle respiratoire complet synthétisé exemplaire d’un volontaire sain, commençant à l’expiration, passant à l’inspiration, puis revenant à l’expiration. Pour une illustration de l’algorithme de tri, voir la figure 4.
- Calcul des paramètres
REMARQUE : En utilisant la respiration complète synthétisée et les cycles cardiaques, on peut dériver d’autres paramètres. Une sélection des paramètres les plus importants est décrite ci-dessous. - Ventilation régionale (RVent)
- À l’aide de la phase inspiratoire, dérivez RVent en fonction de :
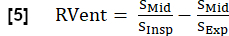
- À l’aide de la phase inspiratoire, dérivez RVent en fonction de :
- Métrique de corrélation flux-volume-boucle (FVL-CM)
REMARQUE : Pour évaluer toutes les phases de la respiration, une série d’étapes est effectuée pour générer une IRM équivalente à l’analyse FVL par analogie avec le test de la fonction respiratoire.- Calculez la pente de la ventilation régionale (RVent) comme substitut de l’écoulement à l’aide de la dérivée première temps de RVent. Employez un quotient de différence symétrique avec une longueur de pas h :
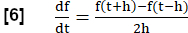
- Si vous le souhaitez, affichez les pentes RVent régionales ou moyennes en fonction du RVent respectif, générant ainsi un équivalent PREFUL de l’analyse FVL.
- Déterminez un retour sur investissement de référence en identifiant la plus grande région connectée avec des valeurs RVent comprises entre le 80e et le 90e centile du retour sur investissement du parenchyme pulmonaire.
- Faites la moyenne des boucles débit-volume à l’intérieur du retour sur investissement de référence déterminé.
- Pour déterminer la similitude de chaque CVF pulmonaire avec la référence, corrélez chaque CVF dans la ROI du parenchyme pulmonaire avec la référence avec un décalage nul :
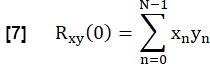
- Normalisez-le en fonction de :
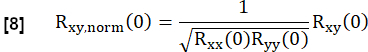
Ici, x et y représentent la référence et la courbe d’écoulement RVent respective.
REMARQUE : Notez que le décalage zéro est utilisé de sorte que la ventilation retardée entraîne une corrélation plus faible.
REMARQUE : Reportez-vous à la figure 5 pour une illustration du calcul de la FVL et de la métrique FVL-CM dérivée.
- Calculez la pente de la ventilation régionale (RVent) comme substitut de l’écoulement à l’aide de la dérivée première temps de RVent. Employez un quotient de différence symétrique avec une longueur de pas h :
- Perfusion quantifiée
NOTE : La quantification est effectuée selon Glandorf et al. à l’aide des premières images acquises lors de l’état transitoire36.- Normalisez les quatre premières images enregistrées au niveau d’inspiration moyen en utilisant la quantité de voxel pulmonaire A calculée à l’étape 3.1.2. Cette réduction de la modulation causée par la variation de la densité de protons s’exprime comme suit :
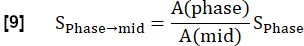
- Effectuez un ajustement exponentiel pour estimer le signal associé à l’aimantation maximale à l’aide du modèle :
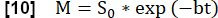
- Déterminez une carte Q liée à la perfusion parenchymateuse à l’aide de la phase du cycle cardiaque qui montre les signaux les plus maximaux dans le ROI du parenchyme pulmonaire.
- Pour l’estimation de la fraction sanguine régionale (BF), normalisez la valeur S0 en faisant la moyenne des valeurs supérieures au 99,99e centile dans le ROI de recherche (voxel sanguin complet) :
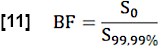
- Estimez la fraction d’échange (FE) au cours d’un cycle cardiaque en considérant le rapport entre la différence de signal médiane maximale entre l’état d’équilibre (SS) et l’état initial, déterminée par S0 , et la différence de signal liée au débit Q :
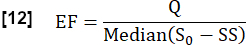
- Déterminez la fréquence cardiaque fHeart en 1/s à partir du ROI du vaisseau à l’aide de l’analyse de Fourier (fréquence correspondant au pic le plus important).
- Calculez la perfusion finale quantifiée (QQ) en mL∙min-1∙100 mL-1 comme suit :
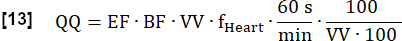
REMARQUE : Ici, le volume de voxel (VV) est annulé [mL/mL], et le facteur de conversion 60 s/min et le facteur de convention 100/100 sont utilisés pour afficher le résultat final en [mL∙min-1∙100 mL-1]. EF et BF sont des rapports sans dimension.
- Normalisez les quatre premières images enregistrées au niveau d’inspiration moyen en utilisant la quantité de voxel pulmonaire A calculée à l’étape 3.1.2. Cette réduction de la modulation causée par la variation de la densité de protons s’exprime comme suit :
- Seuillage et statistiques
- Décrivez statistiquement les paramètres susmentionnés pour la tranche centrale et toutes les tranches avec la valeur moyenne (toutes les valeurs/valeurs de la tranche centrale) et l’écart-type (toutes les valeurs / uniquement les valeurs de la tranche centrale).
- De plus, normalisez l’écart-type en fonction du coefficient de variation pour obtenir un compte relatif de la dispersion. Sélectionnez la valeur moyenne et le coefficient de variation comme sorties statistiques finales.
- Appliquez des seuils aux mappages de paramètres pour générer des mappages de défauts et dériver des valeurs de pourcentage de défauts (voir le Tableau 3).
- Classer les valeurs inférieures aux seuils comme défaut de ventilation ou de perfusion (VD/QD). Combinez davantage ces cartes pour quantifier le chevauchement des défauts et des régions normales (classes V/Q), y compris les combinaisons suivantes, comme le montre le tableau en quatre volets du tableau 3 :
- Calculez le pourcentage de défauts des classes Défaut de ventilation (VD), Défaut de perfusion (QD) et Ventilation/Perfusion (V/Q) en tant que nombre de voxels avec la classe respective par rapport aux voxels totaux du parenchyme pulmonaire :
Pourcentage de défauts = #DefectVoxels/#LungParenchyma - Calculez ce pourcentage de défaut pour chaque tranche et les tranches coronales composées. Pour cette étude, choisissez l’approche combinée, où un défaut de ventilation est déterminé par une opération OR : VD = VD(RVent) OU VD(FVL-CM).
REMARQUE : L’analyse décrite a été effectuée à l’aide d’un logiciel commercial (voir la Table des matériaux) à l’aide de la boîte à outils d’enregistrement Forsberg.
| Paramètre | Seuil | Commentaire |
| RVent | 90e centile * 0,4 | Seuil adaptatif |
| FVL-CM | 90% | Seuil fixe |
| Q | 90e centile * 0,15 | Seuil adaptatif |
| V/Q | PAS de QD | QD |
| PAS de VD | Normal | VQ Mismatch (QD exclusif) |
| VD | VQ Mismatch (VD exclusif) | VQ Defect-Match |
Résultats
La partie inférieure de la figure 2 illustre les conséquences d’une mise à l’échelle correcte et inadéquate, avec un effet correspondant sur la plage dynamique. La figure 6 montre la distribution inhomogène du signal, qui est représentative des balayages sans et avec normalisation de la bobine. Il est recommandé d’éviter une plage dynamique faible et des images sans normalisation de la bobine.
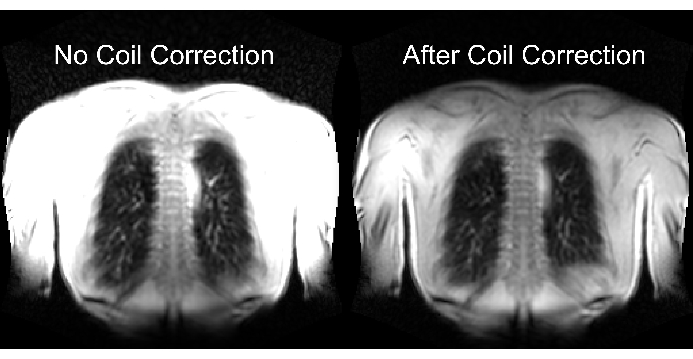
Figure 6 : Exemples d’images après acquisition sans correction de bobine (incorrecte) et avec correction de bobine (correcte). Notez l’amélioration artificielle du signal aux limites du corps près des éléments de la bobine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La figure 7 illustre la réussite et l’échec de la segmentation automatique. Notez que la segmentation échouée n’inclut pas tous les voxels pulmonaires, ce qui faussera l’analyse et les statistiques ultérieures. Une attention particulière est requise pour les cas d’infiltrats, car ces voxels peuvent être classés à tort comme des récipients en raison de leur signal élevé par les modèles d’IA ou ne pas être segmentés du tout.
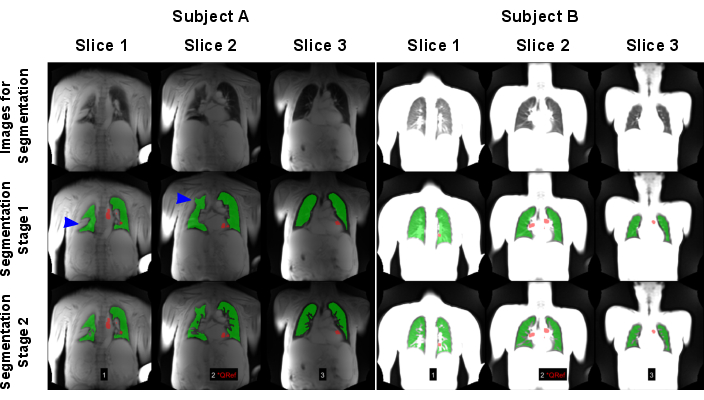
Figure 7 : Un exemple de segmentation automatisée aboutissant à un échec (Sujet A : homme de 83 ans atteint de BPCO) et à un résultat positif (Sujet B : femme de 30 ans témoin sain). La première rangée montre les images, qui ont été utilisées comme entrée pour les modèles d’IA. La deuxième rangée montre les résultats de la première étape de segmentation consistant à trouver la limite pulmonaire. La troisième rangée montre le résultat final après l’exclusion des navires. Comme le montrent les flèches bleues, l’algorithme a été mis à l’épreuve par les variances pulmonaires à signal élevé provoquant une mauvaise détection des limites pulmonaires. Notez que les images ont été normalisées par le signal maximal, ce qui a conduit à des résultats différents en raison de l’absence de normalisation de la bobine du balayage effectuée sur le sujet A. Les régions rouges montrent les ROI, qui ont été automatiquement détectés pour le tri en phase de perfusion. Abréviations : MPOC = maladie pulmonaire obstructive chronique ; ROI = régions d’intérêt. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les figures 8 et 9 montrent des cartes de paramètres représentatives pour un témoin sain (30 ans, femme) et un patient BPCO (60 ans, homme). Notez que le contrôle sain présente une ventilation et une perfusion plus homogènes et donc, moins de voxels défectueux. Les rapports correspondants des statistiques sur le retour sur investissement se trouvent dans les tableaux 4 et 5.
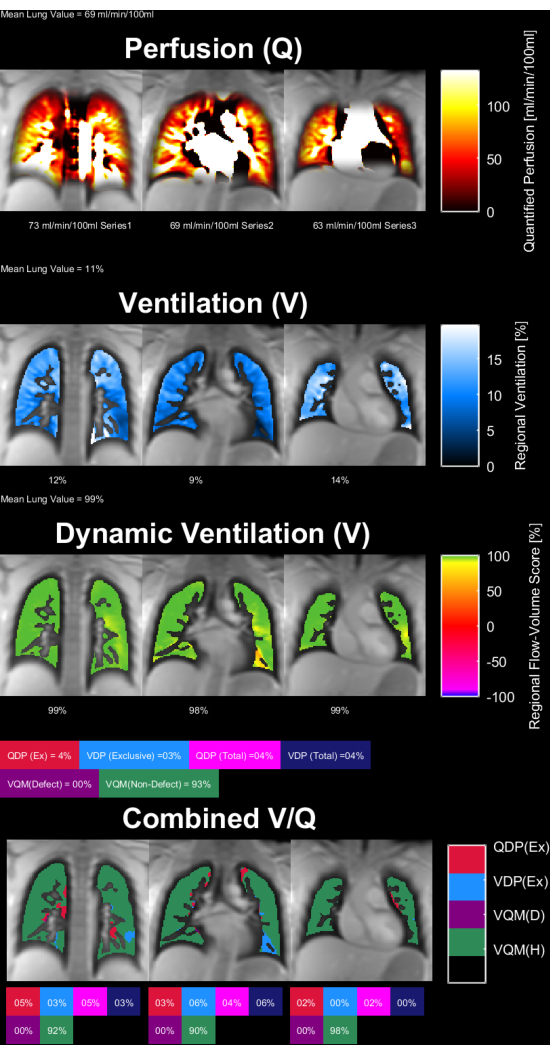
Figure 8 : Cartes des paramètres PREFUL d’une femelle de 30 ans témoin en bonne santé. La perfusion (1èrerangée), la ventilation régionale (2èmerangée), la métrique de corrélation de boucle débit-volume (3èmerangée) et les cartes V/Q seuillées (4èmerangée). Notez la distribution homogène des valeurs parenchymateuses et les faibles pourcentages de défauts. Abréviations : PREFUL = poumon fonctionnel résolu en phase ; V = ventilation ; Q = perfusion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
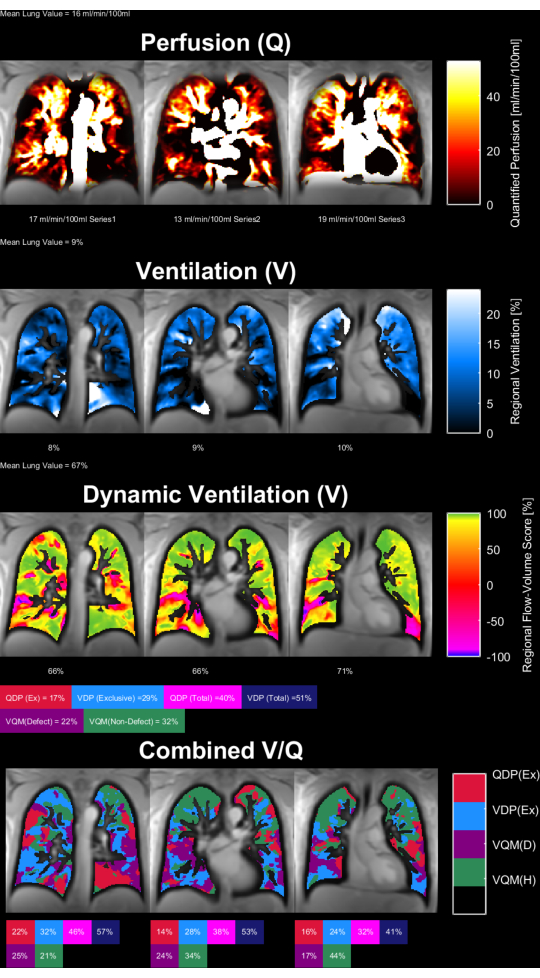
Figure 9 : Cartes des paramètres PREFUL d’un patient de 60 ans atteint de BPCO. La perfusion (1èrerangée), la ventilation régionale (2èmerangée), la métrique de corrélation de boucle débit-volume (3èmerangée) et les cartes V/Q seuillées (4èmerangée). Notez la distribution hétérogène des valeurs parenchymateuses et les pourcentages élevés de défauts. Abréviations : MPOC = maladie pulmonaire obstructive chronique ; PREFUL = poumon fonctionnel résolu en phase ; V = ventilation ; Q = perfusion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 4 : Rapport exemplaire des paramètres PREFUL obtenus pour un contrôle sain (femelle de 30 ans). Notez les faibles valeurs de coefficient de variation et de défaut, qui sont conformes aux cartes de paramètres présentées à la figure 8 pour le même sujet. Voir aussi le tableau 5 et la figure 9. Abréviation : PREFUL = poumon fonctionnel résolu en phase. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 5 : Rapport exemplaire des paramètres PREFUL obtenus pour un patient BPCO (homme de 60 ans). Notez les valeurs élevées de coefficient de variation et de défaut, qui sont conformes aux cartes de paramètres présentées à la figure 9 pour le même sujet. Voir aussi le tableau 4 et la figure 8. Veuillez cliquer ici pour télécharger ce tableau.
Matériel supplémentaire : Explication animée de l’algorithme PREFUL. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Étapes critiques
L’un des pièges les plus courants lors de l’acquisition est une mise à l’échelle inadéquate du signal, qui entraîne une perte d’informations lors de la conversion DICOM en raison d’une précision réduite de la représentation des données numériques. Par conséquent, cela peut entraîner des problèmes lors de la phase de post-traitement. Un autre piège encore plus critique est l’acquisition de plusieurs tranches de manière entrelacée. Ainsi, la résolution temporelle effective des coupes individuelles est considérablement réduite. De plus, en fonction de la distance des tranches, cela peut avoir un impact sur le contraste de perfusion et la quantification, car l’afflux repose sur des spins frais sans historique de magnétisation. Une attention particulière est requise lors de la configuration du protocole, en particulier en ce qui concerne l’intensité du gradient, l’écho asymétrique, la bande passante et l’imagerie parallèle. Des écarts par rapport aux paramètres suggérés, même pour un seul de ces paramètres, peuvent entraîner une résolution TE et temporelle inadéquate.
Le post-traitement se compose de plusieurs étapes, qui doivent être suivies dans l’ordre décrit. Par exemple, un enregistrement après un filtrage passe-bas n’est pas significatif. Par conséquent, l’échec d’une étape entraîne une panne lors des étapes suivantes. D’où l’importance de l’étape d’inscription. Comme il n’existe pas d’algorithme de recalage unique, les paramètres doivent être définis empiriquement en fonction de l’implémentation respective. Sans réglage fin de ces paramètres, un faux enregistrement empêchera la génération de tout résultat significatif. La segmentation est une autre étape potentiellement chronophage et critique lors du post-traitement. Des segmentations erronées peuvent conduire à des calculs de paramètres complètement erronés (par exemple, en incluant des régions non pulmonaires) dans le rapport final. De telles erreurs de segmentation sont plus susceptibles de se produire avec des algorithmes d’apprentissage profond, qui sont habitués à certaines apparences d’image et sont appliqués à des images d’un autre fournisseur/machine avec une apparence légèrement différente. Un contrôle visuel de la qualité de la précision de la segmentation, avec une éventuelle correction manuelle, est donc obligatoire.
Dépannage
La procédure de dépannage typique consiste à suivre toutes les étapes une par une et à vérifier la plausibilité des résultats intermédiaires. La procédure pour les étapes principales est la suivante : Vérifiez que les images sont acquises en respiration libre avec la séquence et les paramètres corrects. Ensuite, vérifiez que la plage dynamique des signaux est appropriée (~50 UA dans le parenchyme pulmonaire). Si des données brutes sont encore disponibles, répétez la reconstruction des images avec un facteur d’échelle approprié en évitant d’avoir à acquérir de nouvelles données. Vérifiez que l’enregistrement a été effectué sans artefacts majeurs ni mouvement restant. Ensuite, vérifiez si les petits retours sur investissement présentent une série chronologique avec les modulations attendues liées à la ventilation et à la perfusion. Vérifiez ensuite si les filtres appliqués modifient les images de la manière attendue (par exemple, pas de modulations à haute fréquence dans les données filtrées passe-bas). Vérifiez si les cycles respiratoires et cardiaques synthétisés sont physiologiques et ne montrent pas de sauts soudains. Vérifiez la précision de la segmentation. Notez qu’une recherche à un niveau de résolution plus fin peut être nécessaire dès que l’étape principale, au cours de laquelle le problème survient, a été identifiée.
Limitations
Bien que le protocole présenté soit connu pour produire des résultats reproductibles et sensibles, le nombre d’étapes et de paramètres impliqués lors de l’acquisition et du post-traitement permet une optimisation presque infinie et sont entrelacés. Par conséquent, une approche ascendante doit être suivie en abordant d’abord les optimisations du protocole de séquence (par exemple, en ce qui concerne le SNR et le rapport contraste/bruit fonctionnel). Pour les optimisations de post-traitement suivantes, une vérité terrain prédéfinie sous la forme d’un modèle pulmonaire numérique peut être utile40. Tel que présenté, ce modèle imite une acquisition en respiration libre et comprend plusieurs classes pour simuler des défauts de ventilation/perfusion. En incluant une déformation connue due au mouvement, les algorithmes de repérage peuvent également être testés directement. Malgré ces avantages, chaque modèle est intrinsèquement limité par la précision de la cartographie de la réalité complexe à un modèle fini et simplifié.
L’analyse empirique a montré que les seuils présentés dans ce protocole donnaient des résultats raisonnables chez des volontaires en bonne santé et dans différentes cohortes de patients. Néanmoins, comme nous l’avons déjà mentionné, il est probable qu’un ajustement soit nécessaire en fonction de la séquence, de l’intensité du champ et de la cohorte.
Une limitation générale de PREFUL est le post-traitement étendu, qui n’est pas encore facilement disponible en tant que produit médical, bien que les premières versions en cours de développement de Siemens Healthineers et BioVisioneers soient disponibles à des fins scientifiques dans un cadre de collaboration scientifique/commerciale. Les calculs impliquent généralement un traitement parallèle, ce qui pose des exigences particulièrement élevées en matière de processeur et de RAM et peut nécessiter des postes de travail modernes ou des solutions de serveur pour traiter efficacement de grandes quantités de données. De plus, les étapes de post-traitement chronophages empêchent actuellement une présentation instantanée des résultats, ce qui serait souhaitable pour le flux de travail clinique.
Comparaison avec d’autres méthodes
Il existe une multitude d’approches similaires comme PREFUL, y compris le prédécesseur de la décomposition de Fourier et ses autres dérivés tels que la décomposition au crayon matriciel41 et l’approche légèrement différente Self-gated Non-Contrast-enhanced Functional Lung IRM (senceful mri)42. Alors que la décomposition de Fourier et des méthodes similaires fonctionnent dans le domaine fréquentiel, PREFUL utilise un filtrage de Fourier moins strict et un calcul ultérieur des amplitudes dans le domaine temporel. Par conséquent, il n’est pas nécessaire de sélectionner des pics spécifiques correspondant à la ventilation/perfusion. Cela peut entraîner une moindre sensibilité à la variabilité de la respiration, ce qui est connu chez les sujets humains.
Alors que PREFUL effectue le tri des images, SENCEFUL utilise le tri des lignes de l’espace k, ce qui permet une plus grande flexibilité. Néanmoins, SENCEFUL nécessite des séquences avec des capacités d’auto-gating, tandis que PREFUL peut être réalisé avec une séquence d’écho à gradient gâché conventionnelle. De même, la bSSFP couramment utilisée dans les approches basées sur la décomposition de Fourier est connue pour un meilleur SNR et un meilleur contraste de flux sanguin, mais nécessite généralement plus d’optimisation pour l’acquisition pulmonaire, en particulier à 3T43. Néanmoins, à part cela, il n’y a aucune raison de ne pas combiner PREFUL avec l’acquisition de bSSFP44.
Toutes ces approches basées sur le signal supposent que certaines influences de signaux indésirables, notamment T1, T2/T2*, la diffusion, le mouvement à travers le plan et les voxels non irréguliers orthogonalement, sont négligeables. Alors que la validation avancée de PREFUL suggère indirectement que de telles influences ne sont effectivement pas critiques, Triphan et al. ont montré qu’il existe une dépendance vis-à-vis de la T1 et de l’ET efficaces, ce qui s’explique par la pondération différente des composants sanguins et parenchymateux en fonction de l’ET45. Dans cette optique, l’avantage initial de la bSSFP pour visualiser le sang en raison du contraste T2/T1 pourrait poser un défi supplémentaire pour établir une quantification précise par rapport à la mécanique de contraste plus simple d’un SPGRE. Néanmoins, d’autres études portant directement sur l’influence de diverses variables MR, par exemple, comme celles réalisées par Glandorf et al. pour les produits de contraste46,47, sont souhaitables car elles peuvent quantifier directement l’effet sur PREFUL.
Importance
En tant que méthode à respiration libre et sans produit de contraste, PREFUL partage de nombreux avantages avec les méthodes connexes mentionnées précédemment : 1) Pas d’application de rayonnements ionisants et d’agents de contraste, 2) Pas besoin de matériel ou de personnel supplémentaire, 3) Acquisition, qui ne dépend que de l’observance minimale du patient. Ces avantages font de PREFUL un outil de surveillance pratique, en particulier pour les groupes vulnérables tels que les enfants atteints de maladies pulmonaires chroniques. Bien que le SNR soit faible avec la séquence SPGRE, la disponibilité et l’absence de besoin de programmation ou de partage de séquences supplémentaires favorisent davantage la diffusion de cette approche.
Comme nous l’avons vu dans la section d’introduction, le nombre d’études montrant de bons résultats de validation, de reproductibilité, de sensibilité et de capacités de surveillance montre que l’importance de cette technique et des paramètres dynamiques correspondants est sur une trajectoire croissante et sera soutenue par une large diffusion.
Déclarations de divulgation
Filip Klimeš, Andreas Voskrebenzev et Jens Vogel-Claussen sont actionnaires de BioVisioneers GmbH, une société qui s’intéresse aux méthodes d’imagerie par résonance magnétique pulmonaire.
Remerciements
Ces travaux ont été financés par le Centre allemand de recherche pulmonaire (DZL). Les auteurs tiennent à exprimer leur profonde gratitude à tous ceux qui ont contribué et soutenu le développement ultérieur de PREFUL, en particulier : Marcel Gutberlet, Till F. Kaireit, Lea Behrendt, Julian Glandorf, Sonja Lüdiger, Tawfik Moher Alsady, Katharina Bünemann, Marius Wernz, Robin Müller, Maximilian Zubke, Gesa Pöhler, Agilo Kern, Cristian Crisosto, Milan Speth, Arnd Obert, Julienne Scheller, Jim Wild, Edwin van Beek, Helen Marshall, Jens Gottlieb, Martha Dohna, Diane Renz, Anna-Maria Dittrich, Tobias Welte, Jens Hohlfeld, Patrick Zardo, Giles Santyr, Franz Wolfgang Hirsch, Robert Grimm, Bastian Bier, Bassem Ismail, André Fischer, Berthold Kiefer, Gregor Thoermer et Rebecca Ramb. De plus, les auteurs tiennent également à remercier les radiographes et les participants à l’étude. Nous remercions tout particulièrement Frank Schröder et Sven Thiele du département de radiologie (Faculté de médecine de Hanovre) pour leur assistance technique exceptionnelle dans la réalisation des examens IRM.
matériels
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
Références
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon