Method Article
MRI ריאתי תפקודי בשלב לאוורור ריאתי והערכת זילוח (V/Q)
In This Article
Summary
במאמר זה אנו מתארים את היישום של MRI ריאה תפקודי מפוענח בפאזה כטכניקת MRI פרוטון ללא חומר ניגוד להערכת אוורור ריאתי ודינמיקת זילוח. הוא תקף ויושם על פני חוזקות שדה שונות וקבוצות גיל שונות, והוא יכול לשפר את קבלת ההחלטות הקליניות בעתיד על ידי סיוע בכימות מחלות וניטור טיפול.
Abstract
פירוק פורייה הוא שיטת MRI 1H ללא חומר ניגוד להערכת זילוח ריאות (Q) ואוורור (V). לאחר רישום התמונה, סדרת הזמן של כל ווקסל מנותחת ביחס למרכיבי תדירות הלב והנשימה.
באמצעות רצף סטנדרטי של הד הדרגתי מקולקל דו-ממדי ברזולוציה טמפורלית של ~300 אלפיות השנייה, פותח אלגוריתם מיון תמונות כדי לייצר דימות ריאות תפקודי מפוענח פאזה (PREFUL) עם רזולוציה טמפורלית מוגברת. לפיכך, ניתן להעריך לולאות נפח זרימה אזוריות (FVL) במהלך נשימת נפח הגאות ולתאר את התפשטות גל הדופק במהלך מחזור הלב. שיטה זו יכולה להיות מיושמת ב 1.5T או 3T עם חומרת MR סטנדרטית ללא צורך בתכנות רצף, שכן ניתן ליישם את הפרוטוקול המתואר עם רצף SPGRE ברירת המחדל ברוב המערכות.
MRI אוורור PREFUL אומת באמצעות הדמיית גז 129Xe ו- 19F עם הסכם אזורי טוב. MRI PREFUL משוקלל זילוח אומת באמצעות SPECT וכן MRI משופר ניגודיות דינמית (DCE). PREFUL נבדקה בסביבה של ספק כפול מרכזי והיא מיושמת כעת במספר ניסויים רב-מרכזיים מתמשכים. יתר על כן, זה אפשרי על פני מגוון של עוצמות שדה (0.55T-3T) וקבוצות גיל שונות, כולל יילודים.
V/Q PREFUL MRI כמותי שימש בחולים עם סיסטיק פיברוזיס, מחלת ריאות חסימתית כרונית, יתר לחץ דם ריאתי טרומבואמבולי כרוני ומחלת נגיף הקורונה-2019 כדי לכמת מחלה ולעקוב אחר שינוי הטיפול לאחר הטיפול. יתר על כן, הדמיית V/Q PREFUL הוכחה כמנבאת אובדן השתלה עקב תפקוד לקוי כרוני של אלוגרפט ריאות בחולים לאחר השתלת ריאות. לסיכום, PREFUL MRI היא טכניקה מתוקפת להנשמה כמותית והדמיית גלי דופק ריאתיים/זילוח לגילוי, כימות וניטור טיפול במחלות ריאה אזוריות עם ערך מוסף פוטנציאלי לשגרה הקלינית הנוכחית.
Introduction
מערכת הנשימה, על מנגנוניה המורכבים, פגיעה למחלות שונות. באופן בולט, מצבים נשימתיים כרוניים כגון מחלת ריאות חסימתית כרונית (COPD), סיסטיק פיברוזיס (CF) ויתר לחץ דם ריאתי טרומבואמבולי כרוני (CTEPH) מפחיתים במידה ניכרת את תוחלת החיים1. כתוצאה מכך, אבחון מוקדם, ניטור והערכת תגובה טיפולית הפכו להיות בעלי חשיבות עליונה.
בדיקות תפקודי ריאות (PFTs) יכולות לגזור פרמטרים גלובליים של תפקודי ריאות כמו מדד טיפנאו-פינלי, המוגדר כיחס בין נפח התפוגה הכפויה בשנייה אחת (FEV1) לבין קיבולת חיונית מאולצת (FVC)2. פרמטרים אלה מבוססים היטב בשגרה הקלינית אך חסרים מידע אזורי ודורשים רמה גבוהה של היענות למטופלים. בהקשר זה, הדמיה יכולה להציע תובנות נוספות ואפשרויות לפרמטרים רגישים יותר. טומוגרפיה ממוחשבת (CT) מציעה הדמיה ברזולוציה גבוהה של מורפולוגיה פרנכימלית, וטכניקות עדכניות כמו מיפוי תגובה פרמטרית מאחזרות גם מידע פונקציונלי3. אף על פי כן, טומוגרפיה ממוחשבת של פליטת פוטון בודד (SPECT) נותרה תקן הזהב הנוכחי לתיאור אוורור וזילוח (V/Q) בריאה4. המשותף לכולם, שיטות ההדמיה שהוזכרו מחייבות חשיפה לקרינה מייננת, הדורשת התייחסות מיוחדת במקרים של ניטור וקבוצות פגיעות. כתוצאה מכך, קיים מאמץ מתמשך לקדם MRI כשיטה חלופית.
באופן אינהרנטי, הריאה היא איבר מאתגר עבור MRI בשל צפיפות הפרוטונים הנמוכה שלה ודעיכת אות מהירה5. מבין שלל הגישות, הפתרונות הנפוצים ביותר כוללים שימוש בגז היפרפולרי (למשל, 129Xe MRI) לאוורור6 ושימוש בחומר ניגוד מבוסס גדוליניום תוך ורידי לתיאור זילוח7. שיטות אלה מציעות יחס אות לרעש גבוה (SNR) ונחשבות לשיטות תקן זהב בקהילת ה- MR. גישה עדכנית יותר מונעת את היישום של כל חומר ניגוד והיא אפשרית עם MR פרוטון קונבנציונאלי בנשימה חופשית עם זמן רכישה כולל של ~ 1 דקה / פרוסה. לפיכך, נמנעים תופעות לוואי פוטנציאליות והשפעות ארוכות טווח שנויות במחלוקת לאחרונה של חומרי ניגוד והפצה קלה יותר ללא צורך בהיפרפולריזציה נוספת וחומרה רב-גרעינית. בנוסף, הבעיה של מציאת מצב ניפוח נאות, אשר יכול להשפיע על ערכי פגם אוורור נגזר8 נמנעת על ידי רכישת נשימה חופשית.
גישה עקיפה זו המבוססת על אותות MR הוצגה לראשונה על ידי Zapke et al. שהשתמשו בקשר ההדדי של אות S משוקלל פרוטונים ונפח ריאות V: S~1/V.9 היא מבוססת על תהליך של הפיכת תמונות שנרכשו בנשימה חופשית למצב אינפלציה משותף אחד (בדרך כלל במצב ביניים בין פקיעת הסיום להשראה הסופית), ובכך לפצות על התנועה ולאפשר לנתח את סדרת זמן האות בכל ווקסל. לאחר מכן, ניתן לגזור מדידת אוורור ממה שמכונה תמונות רשומות אלה באמצעות משוואה (1) על ידי Klimeš et al.10:
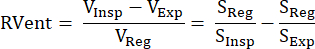 (1)
(1)
כאשר אמצעי האחסון/האותות נמצאים בהשראה (Insp), תפוגה (Exp) ומצב רשום (Reg). לאחר מכן, השיטה הורחבה על ידי החדרת פירוק פורייה כדי להבדיל בין אפנון אותות הקשורים לתדר נשימה (אוורור) ותדר דופק (זילוח) ולכן, לגזור מפת V/Q מותאמת מרחבית מושלמת מרכישה אחת11. הדבר מתאפשר הודות לפער האופייני בין תדרי הנשימה לתדרי הלב, כך ששני המרכיבים הנמצאים זה על גבי זה בתחום הזמן מופלים למעשה בתחום התדרים על ידי ניתוח פורייה. לאחר המעבר משדה נמוך (0.35T) ל-1.5T עם רצף נקיפה חופשי מאוזן ומאוזן (bSSFP)12, שיטה זו החלה לקבל תשומת לב רבה יותר עם מספר מחקרי מעקב 13,14,15.
מכיוון שהנשימה והדופק כפופים לשונות והדמיית bSSFP (שיפוע מפוצה) זמינה מסחרית ב- 1.5T יכולה לגרום לפסי פסים משמעותיים (קווים ברורים של ריק אות), הוצעה שיטה דומה עם רצף הד שיפוע מקולקל (SPGRE) בשילוב עם סינון רחב במעבר נמוך ומעבר גבוה16,17. זה לוכד את הספקטרום המורכב יותר של אפנון אמיתי הקשור לנשימה ולדופק. החישוב הבא של המשרעת בתחום הזמן מונע את הצורך לבחור שיא תדר ספציפי אחד. אופטימיזציה נוספת הושגה על ידי פיצול הרישום הטיפוסי בן שלב אחד למצב התייחסות אחד לשני שלבים נפרדים. בכך מנוצלת העובדה שבמהלך הנשימה החופשית נרכשים מגוון שלבי נשימה שונים בין ההשראה הסופית לפקיעת הסיום בדרגות שונות של עיוות נדרש לקראת מצב קבוע. לאחר בחירת מספר קבוצות וזיהוי קבוצת התמונות הבודדות מתבצע ההליך הבא: 1) רישום בתוך קבוצת מצב הנשימה המתאימה, 2) רישום שלב אחר שלב בין קבוצות מקבוצה סמוכה אחת לאחרת (למשל, 1->2, 2->3,...) לקבוצה המייצגת את קבוצת הייחוס. גישה זו הורחבה עוד יותר על ידי הערכת פאזה עבור כל תמונה כדי לבסס רזולוציה טמפורלית גבוהה יותר לכאורה כדי להקל על ניתוח דינמיקת אוורור וזילוח, מה שהוביל לטרמינולוגיה MR תפקודית של פתרון פאזה (PREFUL) כדי להבדיל ענף זה מטכניקות קשורות אחרות18. מחקרי המשך עשו שימוש במידע הנוסף שסופק על ידי מחזור הנשימה המלאה ומחזור הלב והראו רגישות מוגברת פוטנציאלית של פרמטרים אלה 19,20,21.
תיקוף עם תקן הזהב SPECT גילה מקדם קוביות של ≥67% עבור אזורי פגמים22, ומדידת אוורור ישיר יותר עם 129Xe הראתה מתאם באחוזי פגם אוורור ≥62% בקבוצה מעורבת COPD/CF/בריאה23 ו-84% בקבוצת CF רב-מרכזית, מרובת ספקים24, שגם הראתה מתאם דומה למדד פינוי הריאות של PREFUL ו-129Xe (r = 0.82 ו-r = 0.91). ניתוח הזלוף של אותו מחקר הראה כי לא היו הבדלים משמעותיים בחפיפה המרחבית עם DCE בקרב המרכזים שנבדקו25. קונקורדנציה עם DCE והסכמה של תוצאות PREFUL בין מרכזים דווחו גם עבור תת-מחקר פרוספקטיבי הכולל תשעה מרכזים26. ניתוח שחזור בחולי COPD הביא למקדם שונות מתחת ל -15% עבור כל הפרמטרים27. מחקרים עדכניים מצביעים על כך שלפרמטר FVL יש כוח ניבוי ורגישות גבוהים יותר לזיהוי שינויים בטיפול בהשוואה לפרמטר האוורור "הסטטי", אשר לוקח בחשבון רק את שלבי ההשראה הסופיים ותפוגת הסיום. היענות לטיפול במדידות אזוריות של לולאת נפח זרימה (FVL) הודגמה לאחר טיפול במשאף עם אינדקטרול-גליקופירוניום (IND/GLY) ב-COPD28. בקונקורדנציה, פרמטר FVL ניבא אובדן שתל בחולים מושתלי ריאות כפולות, בעוד שספירומטריה לא יכלה (P = 0.02 לעומת P = 0.33)29. ראשית, מחקרי היתכנות מראים כי הדמיית ריאות תפקודית עם PREFUL יכולה להתממש בתינוקות נושמים חופשי ויילודים עם חומרת MRI קלינית סטנדרטית30,31. גלנדורף ועמיתיו השוו פרמטרים של PREFUL ב-1.5T וב-3T (רצף SPGRE) ולא מצאו הבדלים משמעותיים ברוב הפרמטרים, שהיו ניתנים לשחזור למרות ההבדל בחוזק השדה32. זה עשוי להיות יתרון חשוב, מכיוון שלא לכל אתר יש גישה לסורקי חוזק שדה של 1.5T או פחות. לאחרונה, ההיתכנות והזיהוי של תסמינים מתמשכים לאחר הידבקות ב- COVID-19 ב- 0.55T הודגמו על ידי הערכת נתוני bSSFP עם PREFUL33.
לסיכום, למרות היותה טכניקה חדשנית יחסית, PREFUL נחקרה בהרחבה. נבדקו קריטריונים חשובים כגון תיקוף עם מדידות ישירות ומבוססות יותר, יכולת שחזור, רגישות לפתולוגיה והיענות לטיפול ולשינויים מתקדמים. עם זאת, עדיין, רק כמה מרכזים מיוחדים משתמשים בטכניקה זו למרות הדרישות הטכנולוגיות הנמוכות. לכן, מטרת עבודה זו היא לסכם את המתודולוגיה העדכנית ביותר של PREFUL MR בצורה כתובה וחזותית. מידע זה יכול לשמש כדי לבסס טכניקה זו במרכזים נוספים ובכך, בטווח הארוך, להוביל טכניקה בוגרת יותר.
Protocol
מחקר זה קיבל את אישור ועדת האתיקה של בית הספר לרפואה של האנובר, והבטיח כי הוא עומד בסטנדרטים אתיים מחמירים לאורך כל תהליך המחקר. החקירה פעלה בקפדנות בהתאם להנחיות המפורטות בהצהרת הלסינקי, תוך שימת דגש על ההתנהגות האתית של המחקר הרפואי. בנוסף, הסכמה מדעת התקבלה בחריצות מכל משתתפי המחקר (או הוריהם או האפוטרופוס החוקי שלהם) לפני השתתפותם בבדיקת MRI. ראו איור 1 לסקירה מפושטת של שלבי פרוטוקול הליבה, הכוללים רכישה, רישום, סינון ומיון, ולבסוף, סינתזת מחזור הלב והנשימה. בסעיפים הבאים, כל השלבים המעורבים מתוארים בפירוט מלא.
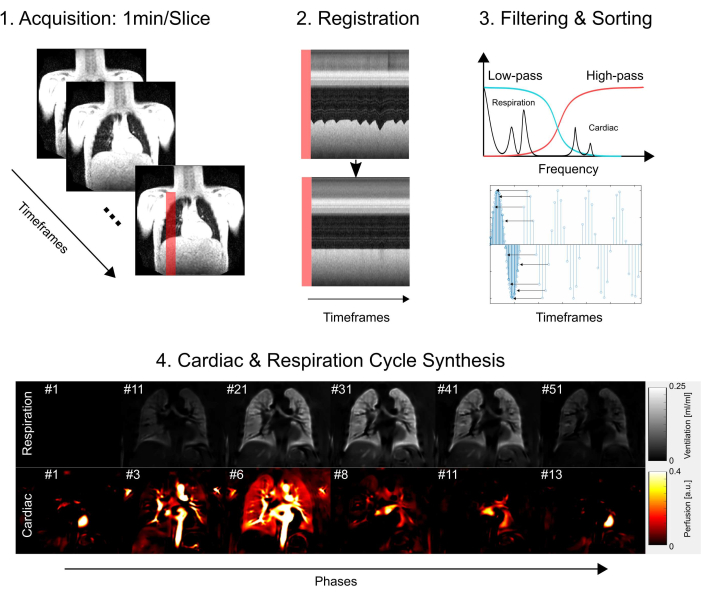
איור 1: סקירה סכמטית של מרכיבי הליבה של PREFUL. 1) רכישה בנשימה חופשית, המחייבת 2) פיצוי תנועה באמצעות רישום כפי שהודגם בתרשימי הפרופיל ומאפשרת ניתוח ווקסל אחר ווקסל של רכיבי פורייה כפי שמודגם בשלב 3) סינון ומיון. לאחר סינון במעבר נמוך (אוורור) וסינון מעבר גבוה (זילוח), 4) השלב המשוער משמש למיון התמונות לרזולוציה טמפורלית גבוהה יותר לכאורה ולסינתזה של מחזור לב ונשימה מלא אחד. שימו לב שמדובר במתווה פשוט והפרטים המלאים מתוארים בכתב היד. צעדים נוספים, שהושמטו מנתון זה, כוללים כימות פרמטרים והפקת דוחות. קיצור: PREFUL = ריאה תפקודית עם פתרון פאזה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. גיוס
- לגייס מטופלים בוגרים או קטיניםלניסוי PREFUL MRI לחולים ובקרות בריאות על סמך אבחנתם להפרעה ריאתית על סמך בדיקת ספירומטריה ו/או הדמיה קודמת (למשל, צילום רנטגן או סריקת CT); היכולת לתת הסכמה מדעת; היכולת לשכב שטוח ולהישאר ללא תזוזה למשך סריקת MRI; ואין התוויות נגד ידועות ל- MRI (למשל, שתלים מתכתיים, קלסטרופוביה).
- אין לכלול מטופלים אם הם בהריון, עברו ניתוח ריאות קודם במהלך 6 החודשים האחרונים, סובלים ממצוקה נשימתית חמורה או זקוקים לתוספת חמצן מתמשכת, או שהיו להם תגובות שליליות קודמות לחומרי ניגוד מבוססי גדוליניום אם נעשה שימוש ב- MRI משופר בניגודיות בנוסף ל- PREFUL.
- לגייס בקרות בריאות אם איןהיסטוריה ידועה של מחלת ריאות המבוססת על בדיקה קלינית ודיווח עצמי; בדיקות תפקודי ריאות הן נורמליות; הם מסוגלים לתת הסכמה מדעת; הם מסוגלים לשכב שטוח ולהישאר ללא תזוזה למשך סריקת MRI; ואין להם התוויות נגד ידועות ל- MRI.
- אין לכלול אנשים כבקרות בריאות על פי היסטוריה נוכחית או קודמת של עישון, חשיפה לרעלני ריאות ידועים או סיכונים תעסוקתיים, היסטוריה משפחתית של מחלות ריאה תורשתיות, כל מחלה כרונית ידועה שעלולה להשפיע על תפקוד הריאות והריון.
- רכוש טופסי הסכמה. המשך עם הפרוטוקול אם מתקבל טופס הסכמה מדעת בכתב מהמשתתף המכיל את מטרת המחקר ונהליו, סיכונים ויתרונות פוטנציאליים, הבטחות לסודיות, משך המחקר והזכות לסגת ללא תוצאות.
- החל את השלבים הנוספים הבאים כאשר הגיוס כולל קטינים.
- לקבל הסכמה מדעת בכתב מהורה או אפוטרופוס אחד לפחות, בנוסף להסכמת הקטין.
- להציג את התהליך כולו בצורה מותאמת גיל המובנת לקטין.
- עבור קטינים צעירים יותר, השתמש בעזרים חזותיים, ספרי סיפורים או הסברים פשוטים.
- לוודא כי המחקר רלוונטי לקבוצת הגיל וכי קטינים אינם נכללים שלא לצורך.
- אפשר לקטינים להיות מלווים על ידי מבוגר מהימן (למשל, הורה, אפוטרופוס) במהלך כל ההליכים הקשורים למשפט, אלא אם כן הדבר מפריע לשלמות המשפט.
הערה: השלבים המתוארים מבוססים על ההנחה שהמשפט נבדק ואושר על-ידי ועדת האתיקה.
- החל את השלבים הנוספים הבאים כאשר הגיוס כולל קטינים.
2. רכישה
- בצע את נוהל הבטיחות prescan.
- לפני MRI, בצע סינון מקדים מפורט של חולים כדי לזהות התוויות נגד פוטנציאליות כגון ניתוחים קודמים, מכשירים מושתלים, קעקועים או חשיפה לרסיסי מתכת.
- עם ההגעה, לחנך את המטופלים על התכונות המגנטיות של ההליך ואת הסיכונים.
- להנחות את המטופלים להסיר את כל פריטי המתכת האישיים, כולל תכשיטים, שעונים ורכיבי לבוש מסוימים, ולספק להם חלוק במידת הצורך.
- בקש מאיש מקצוע מיומן לבדוק חזותית את המטופלים עבור אובייקטים מתכתיים שהתעלמו מהם.
- בדוק את כל המכשירים הרפואיים או השתלים לצורך תאימות MRI.
- ודא שקיימים פרוטוקולי חירום הן לבטיחות הצוות והן לבטיחות המטופל.
- מיקום משתתף וסריקה
- כוונו את המטופל בראש הראשון והשכיבו אותו במצב שכיבה על מערכת 0.55T, 1.5T או 3T.
- ספקו הגנה על השמיעה, פעמון חירום, ריפוד ושמיכה לבטיחות ונוחות.
- מקם סליל גמיש רב-ערוצי ממש מתחת לסנטר כדי להבטיח רגישות סליל אופטימלית בכל אזורי הריאות.
- אבטח את מיקום הסליל כדי לשמור על יציבות מבלי להפריע לנשימתו של המטופל.
- יש להנחות את המטופל לעצום את עיניו, ולאחר מכן לסמן את מרכז הריאה באמצעות לייזר MR.
- יישרו את מרכז הריאה באיזוסנטר ואפשרו למטופל לפקוח שוב את עיניו.
- סרוק את הלוקליזרים הראשוניים כדי לקבוע כיוון כללי, ולאחר מכן סריקה מורפולוגית רוחבית כדי לזהות את התפצלות קנה הנשימה.
- עגנו את פרוסת העטרה הראשונה בהתפצלות קנה הנשימה כנקודת ציון עקבית לשיפור יכולת השחזור.
- בהתאם לפרוטוקול הסריקה, לכדו שלוש פרוסות ברווח של 100% (מעובי הפרוסה) או רכשו פרוסות מרובות המשתרעות על פני הריאה כולה במרחק של 20% או 33%.
- לרכוש כל פרוסה בנפרד לחלוטין ולא interleaveed.
- העלה את התמונות המשוחזרות למערכת ארכיון התמונות והתקשורת (PACS) לצורך גישה וניתוח לאחר מכן. לחלופין, כדי לעמוד בתקני פרטיות והגנה על נתונים, יצא תמונות באופן ידני לכונן רשת ייעודי או לפתרון אחסון דומה.
הערה: לקבלת מידע מפורט על פרוטוקול רצף ופרמטרים, עיין בטבלה 1 ובטבלה 2. לייצוג חזותי של מיקום פרוסות, ראו איור 2.
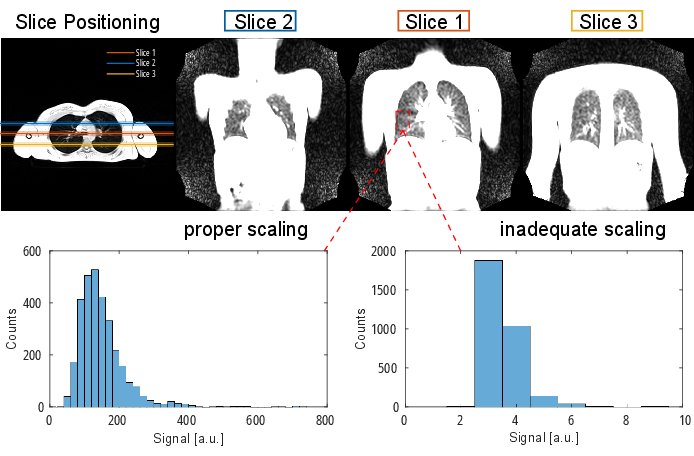
איור 2: מיקום פרוסה טיפוסי עבור ניסוי PREFUL שהודגם עם הד הדרגתי תלת-ממדי בכיוון רוחבי. שימו לב שהפרוסה הראשונה ממוקמת בהתפצלות קנה הנשימה כנקודת ציון הניתנת לשחזור. הפרוסותהשנייה והשלישית ממוקמות עם מרווח פרוסה של 100% בכיוון הקדמי והאחורי. היסטוגרמות לדוגמה מציגות התפלגות ערכים עם קנה מידה נכון ולא מספק (נמוך). האחרון מוביל לטווח דינמי נמוך ואובדן דיוק. יש להימנע גם משינוי קנה מידה גבוה שאינו מספק, המוביל לגזירה (לא מוצג כאן). קיצור: PREFUL = ריאה תפקודית עם פתרון פאזה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: מתאר טיפוסי של פרוטוקול PREFUL. לאחר לוקלייזר, נפח 3D של הריאה נרכש בכיוון רוחבי. רכישה זו משמשת לתכנון רכישות PREFUL הבאות (ראו גם טבלה 2 להגדרות רצף ואיור 2 למיקום פרוסות). ניתן להוסיף רצפים אחרים בהתאם למחקר. קיצור: PREFUL = ריאה תפקודית עם פתרון פאזה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: סיכום פרמטרי הרצף עבור רכישת PREFUL עם רצף הד הדרגתי מקולקל. קיצורים: PREFUL = ריאה תפקודית נפתרת פאזה; SPGRE = רצף הד הדרגתי מקולקל. אנא לחץ כאן כדי להוריד טבלה זו.
3. עיבוד לאחר מכן
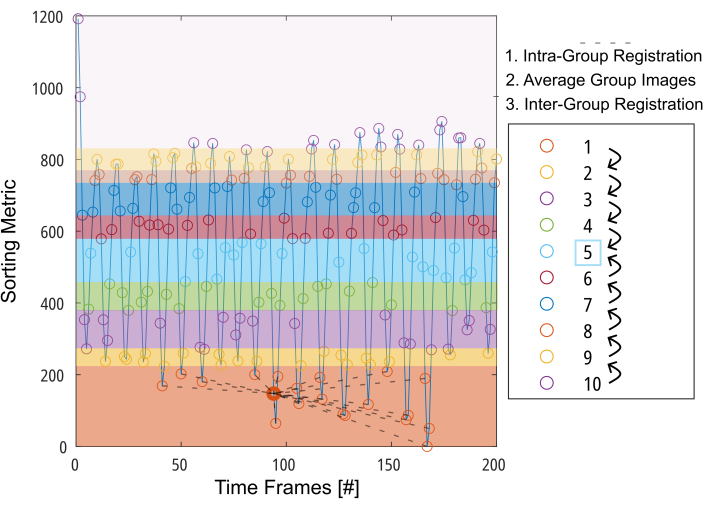
איור 3: הצגה סכמטית של הרישום הקבוצתי כדי למזער את העיוות הנדרש לפיצוי תנועה. לאחר חלוקת התמונות (המיוצגות על ידי עיגולים) ל-10 קבוצות בהתבסס על מדד מיון (למשל, אזור ריאה מקוטע), התמונות נרשמות בתוך כל קבוצה למיקום ביניים (מאויר בקווים מקווקווים עבור קבוצה 1). לאחר מכן, התמונות הרשומות ממוצעות ומשמשות לשלב הסופי של הרישום הבין-קבוצתי באופן שלב אחר שלב לעבר קבוצת הביניים. קיצור: GOREG = רישום מונחה קבוצה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
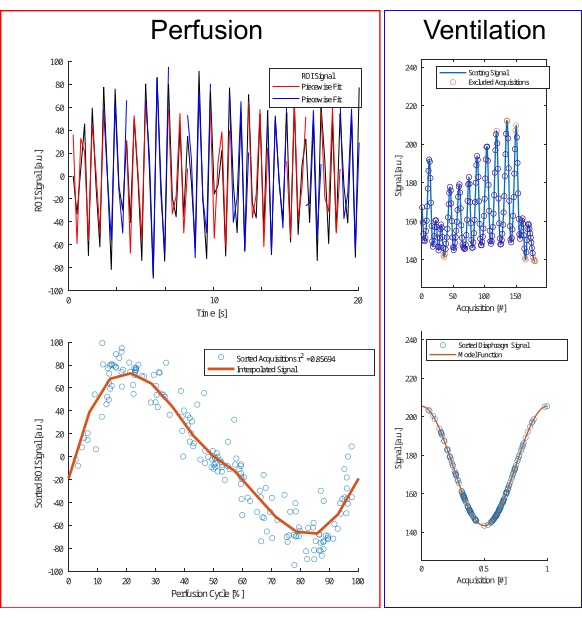
איור 4: איור של אלגוריתם המיון לזילוח ואוורור. עבור זילוח (משמאל), התאמה חתיכה (שורה עליונה) מבוצעת כדי להעריך את השלב ולהשתמש ברכישות (שורה תחתונה). עבור אוורור (מימין), חריגים אינם נכללים (שורה עליונה) וממוינים לפי מודל קוסינוס (שורה תחתונה) המבוסס על הפרש משרעת ומשרעת כדי להבחין בין שלבי פקיעה והשראה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
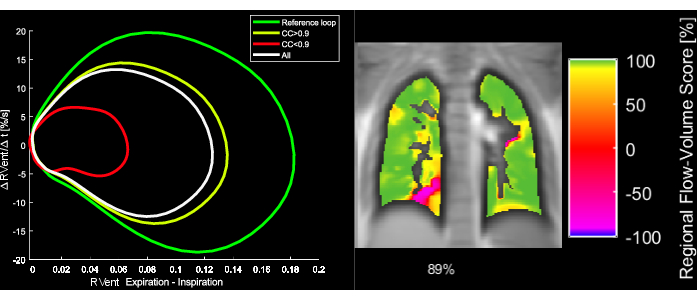
איור 5: לולאות מופתיות של נפח זרימה ומדד מתאם FVL המתאים של מטופלת בת 43 עם COPD. שים לב שעם שינוי FVL, ה- FVL-CM פוחת. קיצורים: FVL = לולאת נפח זרימה; FVL-CM = מדד מתאם FVL; COPD = מחלת ריאות חסימתית כרונית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 3: יישום ערכי סף על מפות הפרמטרים ושילוב מפות פגמים. אנא לחץ כאן כדי להוריד טבלה זו.
- הרשמה
הערה: בסעיף הבא מתואר ההליך לרישום לא קשיח לנפח ייחוס (רצוי רמת הנשימה האמצעית) באמצעות סכמה מונחית קבוצה (GOREG) לפיצוי נשימה ותנועת לב.- אחזר את התמונות.
- בתחילה, בצע פילוח ריאות על כל התמונות הלא רשומות, עם U-Net מאומן ולהחיל מסנן מעבר נמוך עם חתך של 0.7 הרץ כדי לקבל הערכה לשלבי הנשימה.
הערה: פעולה זו תיזום את צינור העיבוד האוטומטי במלואו, אשר יבצע את השלבים הבאים ברקע. שלבי העיבוד המודגמים והמתוארים אינם מוגבלים לאפליקציה או שפה ספציפית ולכן ניתן ליישם אותם ביישום מותאם אישית עם שפות תיכנות רבות. - לסווג כמות גבוהה של ווקסלים מפולחים כהשראה וכמות נמוכה כתפוגה.
- קבץ את התמונות על-ידי חלוקתן לאחוזונים 10, וודא שכל קבוצה מתוך 10 הקבוצות המתקבלות מכילה מספר שווה של תמונות.
- בחר ANTs34 (BSplineSyN עם מטריקה של מתאם צולב) או Forsberg35,36 (התפשטות פולינומית עם רגולציה אלסטית וזורמת) כאלגוריתם הרישום.
- ביצוע רישום פנימי עבור כל קבוצה לקראת תנוחת הריאה הבינונית של הקבוצה המתאימה.
- ממוצע תוצאות הקבוצה כדי לקבל תמונה אחת לכל קבוצה.
- ביצוע רישום הדדי העובר מכל תמונה קבוצתית לעבר השכן הבא לכיוון הקבוצההחמישית .
- החל את שרשרת העיוותים על התמונות המקוריות, לפי הצורך כדי להגיע למצב הנשימה המיוצג על ידי התמונה הממוצעת בקבוצה 5. לדוגמה, עבור תמונה 36, השייכת לקבוצה 3, מוחלים שדות העיוות הבאים: 36->תמונה 57 (~מיקום ריאה בינוני בקבוצה 3) -> שלב 3->4 -> שלב 4->5.
הערה: לתיאור מפורט של הליך GOREG, עיין באיור 3. בצע רישום עם מחשוב מקבילי כדי לקצר את זמן העיבוד. רישום GOREG מבוצע כדי למזער את כמות העיוות הנדרשת לכל שלב רישום ובכך להבטיח התכנסות אלגוריתם יציבה. עם זאת, הרישום יכול להתבצע גם עם צעד עיוות אחד בלבד לכיוון תנוחת הריאה הבינונית. בעוד שכל מחקרי 2D PREFUL שפורסמו השתמשו ב- ANTs, פורסברג מניב תוצאות עד פי 6 מהר יותר עם תוצאות באיכות דומה כפי שדווח על ידי מחקר3D PREFUL 37. תוצאות מופתיות בדו"ח זה נוצרו עם רישום פורסברג. עיין באיור 1 כדי לראות המחשה של השפעת הרישום על תנועת הסרעפת.
- סינון כללי
- נטרלו את התמונות הרשומות באמצעות סינון מונחה תמונה38, תוך שימוש בתמונה הרשומה הממוצעת הזמנית כתמונה המנחה. החל את ההגדרות הבאות: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- לניתוח אוורור וזילוח, השתמש במסנן במעבר נמוך או גבוה עם חיתוך של 0.7 הרץ כדי לדכא את הרכיב האחר המתאים. אל תכלול את 20 התמונות הראשונות בכל שלבי העיבוד הנוספים, למעט חישוב זילוח מכומת, כדי להבטיח מצב יציב בסדרת הזמן הכלולה.
הערה: שינוי החתך עשוי להיות נחוץ אם לנבדקים יש קצב נשימה מעל ~ 40 נשימות / דקה.
- פילוח
הערה: סגמנטציה סופית מבוצעת באמצעות התמונות הרשומות במצב ריאה בינוני בהליך דו-שלבי כמפורט להלן.- בצע פילוח גבול ריאות (החזר השקעה על הריאות) בתמונות שנרשמו בממוצע זמני עם U-Net מאומן או באופן ידני.
- לאחר מכן, לא לכלול כלי דם מרכזיים גדולים כדי לחדד את פילוח גבולות הריאה ולקבל אזור עניין או ROI עבור פרנכימה ריאות.
- זילוח
הערה: השלבים הבאים נדרשים כדי להעריך במדויק את השלב הלבבי עבור כל תמונה בסדרה שנרכשה, אשר נדגמים בתדירות נמוכה יחסית (~ 3-5 תמונות לשנייה), במיוחד בהשוואה לקצב הלב (בדרך כלל 40-90 פעימות לדקה). סידור מחדש של הנתונים לפי השלבים הלבביים שנקבעו משמש לקבלת מחזור הלב המלא ברזולוציה זמנית משופרת, העולה על קצב הדגימה של איסוף הנתונים18 (עיין באיור 4 להמחשה של הליך המיון). לצורך הערכת פאזה, נדרש החזר השקעה על חיפוש עם אות משוקלל זילוח חזק. השתמש באלגוריתם חיפוש איטרטיבי כדלקמן22.- חבר את החזר ההשקעה על גבול הריאה כדי לכלול את המדיאסטינום בהחזר ההשקעה של החיפוש.
- צור מפה פשוטה משוקללת זילוח באמצעות חישוב סטיית התקן לאורך רצף התמונות.
- זהה אזורים המתאימים לאחוזון 98 של מפה זו בתוך החזר ההשקעה של החיפוש כהחזר השקעה על זרעים עבור השלבים הבאים.
- בצע את ההתאמה מבחינת היצירה, והגדל את גודל נקודות הזרע כל עוד ביצועי ההתאמה משתפרים.
- דרג את החזר ההשקעה המורחב על זרעים בהתאם לביצועים המתאימים להם.
- שלב באופן איטרטיבי את החזר ההשקעה המורחב ביותר על זרעים עם השני הטוב ביותר, השלישי הטוב ביותר וכו ', עד שהשילוב אינו משפר את המדד או עד שכל החזר ההשקעה על זרעים נלקח בחשבון. שקול את החזר ההשקעה הסופי כהחזר ההשקעה של כלי הדם המשמש להערכת שלב הלב.
- ממוצע מרחבי של האות בתוך אומדן הפאזה הממוטב כדי להפיק סדרת זמן אות אחת להערכת פאזה.
- בצע את האומדן מבחינת חתיכת על-ידי פילוח האות לחלקים קטנים יותר באמצעות המקסימום המקומי של האות, ולאחר מכן התאמה סינוסואידלית חתיכתית בהתחשב בפרמטרים כמו משרעת, היסט פאזה ותדירות (איור 4).
- מיין את התמונות בשלב כך שייצגו מחזור לב אחד.
- השתמש ברגרסיה של ליבת Nadaraya-Watson עם גרעין גאוס (סיגמה = 0.1) כדי לבצע אינטרפולציה של 15 שלבים לרשת זמן במרווח אחיד המקיפה מחזור לב יחיד.
הערה: עיינו באיור 1 לקבלת תת-קבוצה של מחזור לב מלא מסונתז לדוגמה של מתנדב בריא, החל מדיאסטולה, מעבר לסיסטולה וחזרה לדיאסטולה.
- איוורור
הערה: לניתוח זילוח, שים לב שתדירות הלב נשארת יציבה יחסית עם שינויים זניחים באמפליטודה. לעומת זאת, אוורור נוטה לחוות שינויים רבים יותר בנפח ובתדירות הגאות, מה שמוביל למצבי נשימה שונים עם שלבי נשימה זהים שלא תמיד יש את אותה משרעת. בהשראת הגישה העצמית של פישר ואחרים, חיוני לסווג אוורור על בסיס משרעת אותות.- אל תכלול חריגים קיצוניים באמצעות כללים אמפיריים (נתונים מתחת לאחוזון 5 או מעל אחוזון 97).
- גזור את תחום המשרעת R ואת היסט C מסדרת זמן האות שנוצרה עבור קיבוץ רישום.
- הגדר פונקציית מודל A(t) עם תדרf נשימה שנבחר באופן שרירותי (כאן 0.3 הרץ):
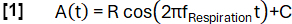
- סווג את הנתונים למצבי השראה ותפוגה בהתבסס על המדרון.
- השג קביעת פאזה מעודנת יותר בהתאם לפונקציית המודל:
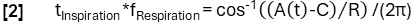
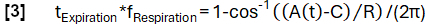
- לאחר מכן, יישרו דגימות בהתבסס על הפאזה שלהן והחילו את רגרסיית הליבה Nadaraya-Watson כדי לחשב אוורור במרווחי זמן אחידים במהלך מחזור הנשימה.
- חשב את האוורור האזורי (RVent) עבור כל שלב באנלוגיה למשוואה 1, והחליף את שלב ההשראה בפאזה המתאימה.
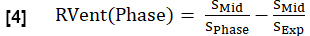
הערה: עיינו באיור 1 כדי לראות תת-קבוצה של מחזור נשימה מלא מסונתז למופת של מתנדב בריא, שמתחיל בפגיעה, עובר להשראה ואז חוזר לתפוגה. להמחשה של אלגוריתם המיון, ראו איור 4.
- חישוב פרמטרים
הערה: באמצעות מחזורי הנשימה המלאה והלב המסונתזים, ניתן לגזור פרמטרים נוספים. מבחר של הפרמטרים החשובים ביותר מתואר להלן. - אוורור אזורי (RVent)
- באמצעות השלב ההשראתי להפיק RVent לפי:
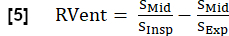
- באמצעות השלב ההשראתי להפיק RVent לפי:
- מטריקת מתאם זרימה-נפח-לולאת (FVL-CM)
הערה: כדי להעריך את כל שלבי הנשימה, מבוצעת סדרה של צעדים ליצירת MRI שווה ערך לניתוח FVL באנלוגיה לבדיקת תפקודי ריאות.- חשב את שיפוע האוורור האזורי (RVent) כתחליף לזרימה באמצעות נגזרת הזמן הראשונה של RVent. השתמש במניין הפרש סימטרי עם אורך צעד h:
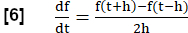
- לחלופין, הצג שיפועי RVent אזוריים או ממוצעים כפונקציה של RVent בהתאמה, ובכך ליצור מקבילה PREFUL לניתוח FVL.
- קבע החזר השקעה ייחוס על ידי זיהוי האזור המחובר הגדול ביותר עם ערכי RVent בטווח אחוזונים 80 עד 90 בהחזר ההשקעה על פרנכימה של הריאות.
- ממוצע של לולאות נפח הזרימה בתוך החזר ההשקעה על הייחוס שנקבע.
- כדי לקבוע את הדמיון של כל FVC ריאתי לייחוס, הצליבו כל FVC בפרנכימת הריאה ROI לייחוס עם אפס השהיה:
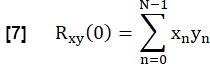
- לנרמל את זה לפי:
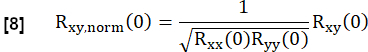
כאן, x ו- y מייצגים את הייחוס ואת עקומת זרימת RVent בהתאמה.
הערה: שים לב שמשתמשים בפיגור אפס כך שאוורור מושהה גורם למתאם נמוך יותר.
הערה: עיין באיור 5 להמחשה של חישוב FVL ומדד FVL-CM הנגזר.
- חשב את שיפוע האוורור האזורי (RVent) כתחליף לזרימה באמצעות נגזרת הזמן הראשונה של RVent. השתמש במניין הפרש סימטרי עם אורך צעד h:
- זילוח מכומת
הערה: הכימות מתבצע על פי Glandorf et al. באמצעות התמונות הראשונות שנרכשו במהלך המצב הארעי36.- נרמל את ארבע התמונות הרשומות הראשונות לרמת ההשראה האמצעית באמצעות כמות ווקסל הריאה A כפי שחושב בשלב 3.1.2. הפחתה זו של אפנון הנגרמת על ידי צפיפות פרוטונים משתנה מתבטאת כך:
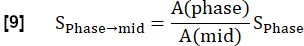
- בצע התאמה מעריכית כדי להעריך את האות המשויך למגנטיזציה מקסימלית באמצעות המודל:
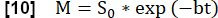
- קבע מפה Q הקשורה לזילוח פרנכימלי באמצעות שלב מחזור הלב המציג את האותות המקסימליים ביותר בהחזר ההשקעה על פרנכימה ריאתית.
- להערכת מקטע דם אזורי (BF), נרמל את ערך S0 על ידי ממוצע הערכים מעל אחוזון 99.99 בהחזר ההשקעה של החיפוש (ווקסל דם מלא):
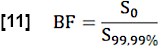
- הערך את מקטע החליפין (EF) במהלך מחזור לב על ידי התחשבות ביחס בין הפרש האות החציוני המרבי בין מצב יציב (SS) למצב התחלתי כפי שנקבע על ידי S0 והפרש האות הקשור לזרימה Q:
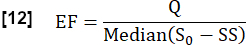
- קבע את תדירות הלב fלב ב 1/s מהחזר ההשקעה של כלי הדם באמצעות ניתוח פורייה (תדירות המתאימה לשיא הגדול ביותר).
- חשב את הזילוח המכומת הסופי (QQ) ב- mL∙min-1∙100 mL-1 באופן הבא:
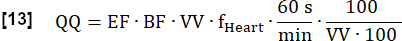
הערה: כאן, נפח הווקסל (VV) מבוטל [mL/mL], ומקדם ההמרה 60 s/min וגורם מוסכמה 100/100 משמשים להצגת התוצאה הסופית ב- [mL∙min-1∙100 mL-1]. EF ו- BF הם יחסים חסרי ממד.
- נרמל את ארבע התמונות הרשומות הראשונות לרמת ההשראה האמצעית באמצעות כמות ווקסל הריאה A כפי שחושב בשלב 3.1.2. הפחתה זו של אפנון הנגרמת על ידי צפיפות פרוטונים משתנה מתבטאת כך:
- סף וסטטיסטיקה
- תאר סטטיסטית את הפרמטרים הנ"ל לפרוסה האמצעית ולכל הפרוסות עם ערך ממוצע (כל הערכים/ערכי הפרוסה האמצעית) וסטיית תקן (כל הערכים / ערכי הפרוסה האמצעית בלבד).
- בנוסף, לנרמל את סטיית התקן למקדם השונות כדי לקבל חשבון יחסי של פיזור. בחר את הערך הממוצע ואת מקדם השונות כפלט סטטיסטי סופי.
- החל ערכי סף על מפות הפרמטרים כדי ליצור מפות פגמים ולגזור ערכי אחוזי פגמים (ראה טבלה 3).
- סווג ערכים מתחת לערכי הסף כפגם אוורור או זילוח (VD/QD). שלב מפות אלה עוד יותר כדי לכמת את החפיפה בין פגמים ואזורים נורמליים (מחלקות V/Q), כולל הצירופים הבאים כפי שמוצג בטבלה מרובעת בטבלה 3:
- חשב את אחוז הפגם של מחלקות פגם אוורור (VD), פגם זילוח (QD) ואוורור/זילוח (V/Q) כמספר הווקסלים עם המחלקה המתאימה ביחס לווקסלים הכוללים של פרנכימה ריאתית:
אחוז פגם = #DefectVoxels/#LungParenchyma - חשב אחוז פגם זה עבור כל פרוסה ופרוסות העטרה המורכבות. במחקר זה, בחר בגישה המשולבת, שבה פגם אוורור נקבע על ידי פעולת OR: VD = VD(RVent) או VD(FVL-CM).
הערה: הניתוח המתואר בוצע באמצעות אפליקציית תוכנה מסחרית (ראה טבלת חומרים) באמצעות ארגז הכלים לרישום של Forsberg.
| פרמטר | סף | תגובה |
| RVent | אחוזון 90 * 0.4 | סף אדפטיבי |
| FVL-CM | 90% | סף קבוע |
| Q | אחוזון 90 * 0.15 | סף אדפטיבי |
| V/Q | אין QD | QD |
| ללא VD | רגיל | חוסר התאמה של VQ (QD בלעדי) |
| VD | חוסר התאמה של VQ (בלעדי ל-VD) | VQ Defect-Match |
תוצאות
החלק התחתון של איור 2 ממחיש את התוצאה של קנה מידה נכון ולא מספק עם השפעה מקבילה על הטווח הדינמי. איור 6 מראה את התפלגות האותות הלא הומוגנית, המייצגת סריקות ללא ועם נורמליזציה של סליל. מומלץ להימנע מטווח דינמי נמוך ומתמונות ללא נורמליזציה של סליל.
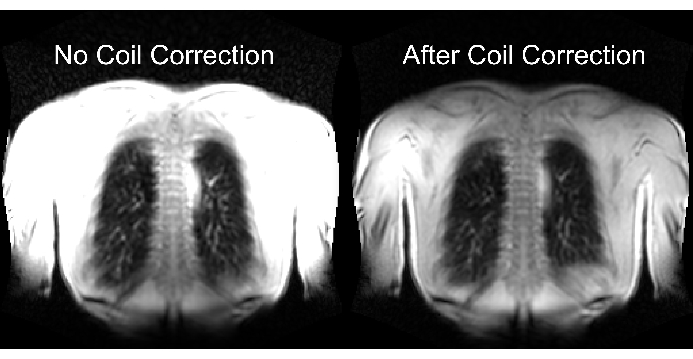
איור 6: תמונות מופתיות לאחר רכישה ללא תיקון סליל (שגוי) ועם תיקון סליל (נכון). שימו לב לשיפור האות המלאכותי בגבולות הגוף ליד רכיבי הסליל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 7 ממחיש סגמנטציה אוטומטית מוצלחת וכושלת. שימו לב שהפילוח הכושל אינו כולל את כל ווקסלי הריאות, מה שיזייף ניתוחים וסטטיסטיקות נוספות. טיפול מיוחד נדרש במקרים עם מסתננים כמו ווקסלים כאלה יכולים להיות מסווגים בטעות ככלי בשל האות הגבוה שלהם על ידי מודלים AI או לא מפולח בכלל.
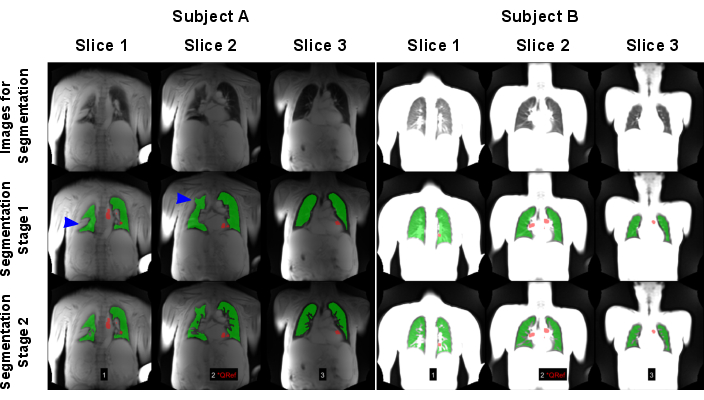
תרשים 7: דוגמה לפילוח אוטומטי שהביא לכישלון (נושא א': גבר בן 83 עם COPD) ולתוצאה מוצלחת (נושא ב': שליטה בריאה של נקבה בת 30). השורה הראשונה מציגה את התמונות, ששימשו כקלט עבור מודלי הבינה המלאכותית. השורה השנייה מציגה את תוצאות שלב הפילוח הראשון המורכב ממציאת גבול הריאה. השורה השלישית מציגה את התוצאה הסופית לאחר אי הכללת כלי שיט. כפי שמוצג על ידי החיצים הכחולים, האלגוריתם אותגר על ידי סטיות ריאה בעלות אות גבוה שגרמו לזיהוי שגוי של גבולות הריאה. שים לב שהתמונות נורמלו על ידי אות מקסימלי, מה שהוביל לתוצאות שונות עקב נורמליזציה סלילית חסרה של הסריקה שבוצעה בנושא A. אזורים אדומים מציגים את ה- ROIs, שזוהו אוטומטית למיון בשלב הזילוח. קיצורים: COPD = מחלת ריאות חסימתית כרונית; ROI = אזורי עניין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור 8 ואיור 9 מציגים מפות פרמטרים מייצגות עבור קבוצת ביקורת בריאה (גיל 30, נקבה) וחולה COPD (גיל 60, זכר). שימו לב שהבקרה הבריאה מראה אוורור וזילוח הומוגניים יותר ולכן פחות ווקסלים פגומים. את הדוחות המקבילים של נתוני החזר ההשקעה ניתן למצוא בטבלה 4 ובטבלה 5.
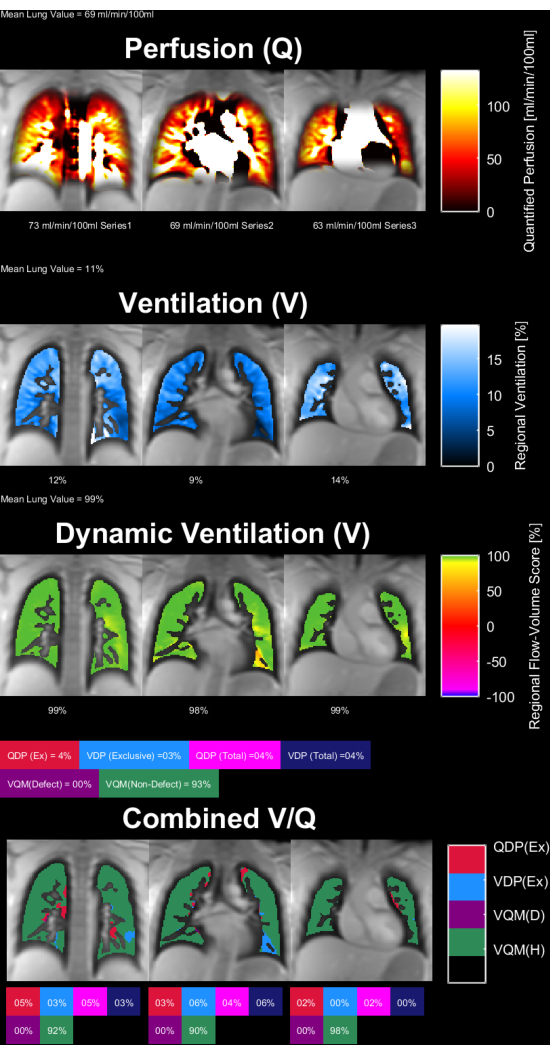
איור 8: מפות פרמטרים PREFUL של קבוצת ביקורת בריאה של אישה בת 30. הזלוף (שורה 1), אוורור אזורי(שורה 2 ), מדד מתאם לולאת נפח זרימה(שורה 3 ) ומפות V/Q סף(שורה 4 ). שים לב להתפלגות הומוגנית של ערכים parenchymal ואחוזי פגם נמוכים. קיצורים: PREFUL = ריאה תפקודית נפתרת פאזה; V = אוורור; Q = זילוח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
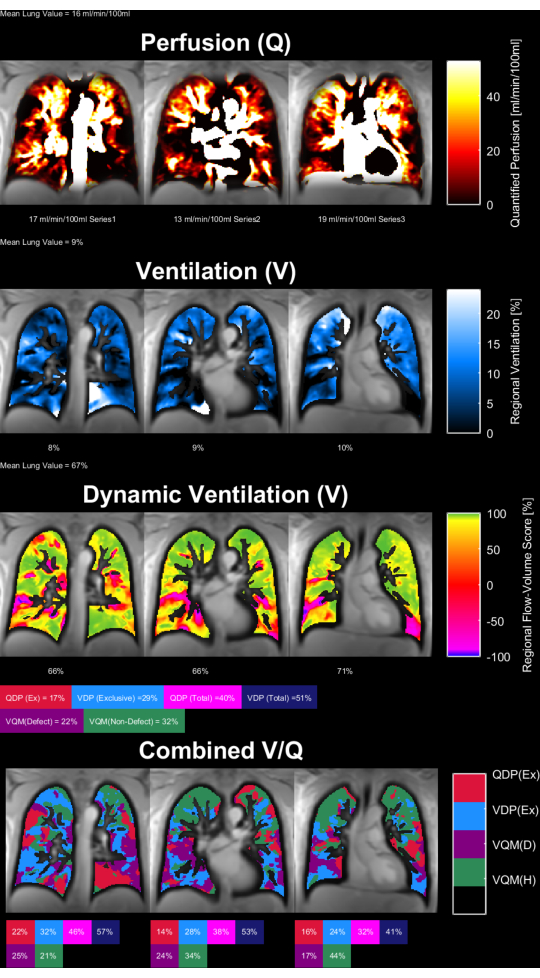
איור 9: מפות פרמטרים PREFUL של חולה COPD גבר בן 60. הזלוף (שורה 1), אוורור אזורי(שורה 2 ), מדד מתאם לולאת נפח זרימה(שורה 3 ) ומפות V/Q סף(שורה 4 ). שים לב להתפלגות הטרוגנית של הערכים parenchymal ואחוזי פגם גבוהים. קיצורים: COPD = מחלת ריאות חסימתית כרונית; PREFUL = ריאה תפקודית שנפתרה בשלבה; V = אוורור; Q = זילוח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 4: דו"ח לדוגמה של פרמטרים PREFUL שהתקבלו עבור קבוצת ביקורת בריאה (אישה בת 30). שימו לב לערכי מקדם השונות והפגמים הנמוכים, התואמים את מפות הפרמטרים המוצגות באיור 8 עבור אותו נושא. ראו גם טבלה 5 ותרשים 9. קיצור: PREFUL = ריאה תפקודית עם פתרון פאזה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: דו"ח לדוגמה של פרמטרים PREFUL שהתקבלו עבור חולה COPD (גבר בן 60). שימו לב לערכי מקדם השונות והליקויים הגבוהים, התואמים את מפות הפרמטרים המוצגות באיור 9 לאותו נושא. ראו גם טבלה 4 ותרשים 8. אנא לחץ כאן כדי להוריד טבלה זו.
חומר משלים: הסבר מונפש של אלגוריתם PREFUL. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
שלבים קריטיים
אחת המלכודות הנפוצות ביותר במהלך הרכישה היא קנה מידה לקוי של אותות, הגורם לאובדן מידע במהלך המרת DICOM על ידי דיוק מופחת של ייצוג נתונים דיגיטליים. כתוצאה מכך, זה יכול להוביל לבעיות בשלב שלאחר העיבוד. מלכודת קריטית עוד יותר היא רכישת פרוסות מרובות באופן משולב. בכך, הרזולוציה הזמנית היעילה של הפרוסות הבודדות מצטמצמת באופן קריטי. בנוסף, בהתאם למרחק הפרוסות, זה יכול להשפיע על ניגודיות הזלוף ועל הכימות מכיוון שהזרימה מסתמכת על ספינים טריים ללא היסטוריית מגנטיזציה. טיפול מיוחד נדרש במהלך הגדרת הפרוטוקול, במיוחד בכל הנוגע לחוזק שיפוע, הד אסימטרי, רוחב פס והדמיה מקבילית. סטיות מההגדרות המוצעות אפילו רק עבור אחד מהפרמטרים הללו עלולות להוביל לפתרון TE וזמני לא מספק.
העיבוד מורכב ממספר שלבים, אשר יש לעקוב אחריהם בסדר המתואר. לדוגמה, רישום לאחר סינון מעבר נמוך אינו משמעותי. כתוצאה מכך, כישלון בשלב אחד מוביל להתמוטטות במהלך השלבים הבאים. זה הופך את שלב הרישום לחשוב במיוחד. מכיוון שאין אלגוריתם רישום יחיד, בהתאם ליישום המתאים, יש להגדיר פרמטרים באופן אמפירי. ללא כוונון עדין של פרמטרים אלה, רישום כוזב ימנע יצירת כל תוצאה משמעותית. שלב נוסף שעשוי לגזול זמן רב וקריטי במהלך עיבוד פוסט הוא סגמנטציה. פילוחים שגויים יכולים להוביל לחישובי פרמטרים שגויים לחלוטין (למשל, על ידי הכללת אזורים שאינם ריאה) בדו"ח הסופי. סגמנטציות שגויות כאלה נוטות יותר להתרחש עם אלגוריתמים של למידה עמוקה, אשר רגילים למראה תמונה מסוים ומוחלים על תמונות מספק/מכונה אחר עם מראה מעט שונה. לכן חובה לבצע בדיקת איכות ויזואלית של דיוק הסגמנטציה, עם אפשרות לתיקון ידני.
פתרון בעיות
הליך פתרון הבעיות הטיפוסי הוא לבצע את כל השלבים בזה אחר זה ולבדוק את סבירות תוצאות הביניים. ההליך עבור השלבים העיקריים הוא כדלקמן: בדוק כי התמונות נרכשות נשימה חופשית עם רצף והגדרות נכונים. לאחר מכן, בדוק כי הטווח הדינמי של האותות מתאים (~ 50 AU בפרנכימת הריאות). אם נתונים גולמיים עדיין זמינים, חזרו על הבנייה מחדש של התמונות עם גורם שינוי קנה מידה מתאים, ובכך הימנעו מהצורך ברכישה חדשה של נתונים. בדוק כי הרישום בוצע ללא ממצאים עיקריים ותנועה שנותרה. לאחר מכן, בדוק אם החזר השקעה קטן מציג סדרת זמן עם אפנון צפוי הקשור לאוורור וזילוח. לאחר מכן, בדקו אם המסננים שהוחלו משנים את התמונות באופן הצפוי (לדוגמה, ללא אפנון בתדירות גבוהה בנתונים מסוננים במעבר נמוך). בדוק אם מחזורי הנשימה והלב המסונתזים הם פיזיולוגיים ואינם מראים קפיצות פתאומיות. בדוק את דיוק הסגמנטציה. שים לב שייתכן שיהיה צורך בחיפוש ברמת רזולוציה עדינה יותר ברגע שזוהה השלב הראשי, שבמהלכו מתרחשת הבעיה.
מגבלות
למרות שהפרוטוקול המוצג ידוע כמניב תוצאות ניתנות לשחזור ורגישות, מספר השלבים והפרמטרים המעורבים במהלך הרכישה ואחרי העיבוד מאפשרים אופטימיזציה כמעט אינסופית ושזורים זה בזה. לכן, יש לנקוט בגישה מלמטה למעלה על ידי התייחסות תחילה לאופטימיזציות של פרוטוקול הרצף (למשל, לגבי SNR ויחס ניגודיות לרעש פונקציונלי). עבור האופטימיזציות הבאות לאחר עיבוד, אמת קרקעית מוגדרת מראש בצורה של מודל ריאות דיגיטלי עשויה להיות שימושית40. כפי שהוצג, מודל זה מחקה רכישת נשימה חופשית וכולל מספר מחלקות להדמיית פגמים באוורור/זילוח. כולל עיוות ידוע עקב תנועה, אלגוריתמי רישום יכולים גם להיבדק ישירות. למרות יתרונות אלה, כל מודל מוגבל מטבעו על ידי הדיוק של מיפוי מציאות מורכבת למודל סופי ופשוט.
ערכי הסף המוצגים בפרוטוקול זה נמצאו כמראים תוצאות סבירות עבור מתנדבים בריאים ועל פני קבוצות חולים שונות על ידי ניתוח אמפירי. עם זאת, כפי שתואר קודם, סביר להניח שתידרש התאמה בהתאם לרצף, חוזק השדה והקבוצה.
מגבלה כללית של PREFUL היא העיבוד הנרחב שלאחר העיבוד, שעדיין אינו זמין כמוצר רפואי, אם כי גרסאות ראשונות של Siemens Healthineers ו- BioVisioneers זמינות למטרות מדעיות במסגרת שיתוף פעולה מדעי / מסחרי. חישובים בדרך כלל כוללים עיבוד מקבילי, אשר מציב דרישות גבוהות במיוחד על CPU ו- RAM ועשוי לדרוש תחנות עבודה מודרניות או פתרונות שרת כדי לעבד ביעילות כמויות גדולות של נתונים. יתר על כן, שלבי העיבוד הגוזלים זמן רב מעכבים כיום הצגה מיידית של התוצאות, אשר תהיה רצויה עבור זרימת העבודה הקלינית.
השוואה לשיטות אחרות
ישנן מספר רב של גישות דומות כמו PREFUL, כולל קודמו פירוק פורייה ונגזרותיו האחרות כגון פירוק עיפרון מטריקס41 והגישה השונה במקצת עצמית ללא ניגודיות משופרת ריאות MRI ריאתי תפקודי (MRI senceful)42. בעוד פירוק פורייה ושיטות דומות פועלות בתחום התדרים, PREFUL משתמש בסינון פורייה פחות קפדני ובחישוב עוקב של אמפליטודות בתחום הזמן. לכן, אין דרישה לבחור פסגות ספציפיות המתאימות לאוורור/זילוח. זה יכול לגרום לפחות רגישות לשונות הנשימה, אשר ידוע להתרחש אצל נבדקים אנושיים.
בעוד PREFUL מבצעת מיון תמונות, SENCEFUL משתמשת במיון של קווי k-space, מה שמוביל לגמישות רבה יותר. עם זאת, SENCEFUL דורש רצפים עם יכולות gating עצמי, בעוד PREFUL יכול להתבצע עם רצף הד הדרגתי מפונק קונבנציונאלי. באופן דומה, bSSFP הנפוץ בגישות מבוססות פירוק פורייה ידוע בניגודיות SNR וזרימת דם טובה יותר, אך בדרך כלל דורש אופטימיזציה רבה יותר לרכישת ריאות, במיוחד ב- 3T43. עם זאת, מלבד זאת אין סיבה לא לשלב את PREFUL עם רכישת bSSFP44.
כל הגישות מבוססות האותות הללו מניחות שהשפעות אותות לא רצויות מסוימות, כולל T1, T2/T2*, דיפוזיה, תנועה דרך מישור ווקסלים לא מחוררים אורתוגונלית, הן זניחות. בעוד התיקוף המתקדם של PREFUL מצביע בעקיפין על כך שאכן השפעות כאלה אינן קריטיות, Triphan et al. הראו כי קיימת תלות ב- T1 ו- TE היעילים, אשר מוסברת על ידי שקלול שונה של הדם ומרכיבים parenchymal בהתאם TE45. לאור זאת, היתרון הראשוני של bSSFP להמחשת דם עקב ניגודיות T2/T1 עשוי להוות אתגר נוסף לביסוס כימות מדויק בהשוואה למכניקת הניגודיות הפשוטה יותר של SPGRE. עם זאת, מחקרים נוספים המתייחסים ישירות להשפעתם של משתני MR שונים, למשל, כפי שבוצעו על ידי Glandorf et al. עבור מדיה ניגודית46,47, רצויים מכיוון שהם יכולים לכמת ישירות את ההשפעה על PREFUL.
חשיבות
בהיותה שיטה חופשית לנשימה, ללא מדיה ניגודית, PREFUL חולקת יתרונות רבים עם השיטות הקשורות שהוזכרו לעיל: 1) אין יישום קרינה מייננת וחומר ניגוד, 2) אין דרישה לחומרה או כוח אדם נוספים, 3) רכישה, התלויה רק בהיענות מינימלית של המטופל. יתרונות אלה הופכים את PREFUL לכלי ניטור נוח, במיוחד עבור קבוצות פגיעות כגון ילדים עם מחלת ריאות כרונית. למרות ש- SNR נמוך עם רצף SPGRE, הזמינות, וחוסר הדרישה לתכנות/שיתוף רצפים נוספים מקדמים עוד יותר את הפצת גישה זו.
כפי שנדון בחלק המבוא, מספר המחקרים המראים תיקוף טוב, יכולת שחזור, תוצאות רגישות ויכולות ניטור מראים כי חשיבותה של טכניקה זו והפרמטרים הדינמיים המתאימים נמצאת במסלול עולה ותיתמך עוד יותר על ידי הפצה רחבה.
Disclosures
פיליפ קלימש, אנדריאס ווסקרבנצב וינס ווגל-קלאוסן הם בעלי המניות של BioVisioneers GmbH, חברה, שיש לה עניין בשיטות הדמיה של תהודה מגנטית ריאתית.
Acknowledgements
עבודה זו מומנה על ידי המרכז הגרמני לחקר ריאות (DZL). המחברים רוצים להביע הכרת תודה עמוקה לכולם, שתרמו ותמכו בהמשך הפיתוח של PREFUL, בפרט: מרסל גוטברלט, טיל פ. קאירייט, לאה בהרנדט, יוליאן גלנדורף, סוניה לודיגר, תאופיק מוהר אלסדי, קתרינה בונמן, מריוס ורנץ, רובין מולר, מקסימיליאן זובקה, גסה פוהלר, אגילו קרן, כריסטיאן קריסטו, מילאן ספת', ארנד אוברט, ג'וליאן שלר, ג'ים ויילד, אדווין ואן ביק, הלן מרשל, ינס גוטליב, מרתה דוהנה, דיאן רנץ, אנה-מריה דיטריך, טוביאס וולטה, ינס הולפלד, פטריק זארדו, ג'יילס סנטיר, פרנץ וולפגנג הירש, רוברט גרים, בסטיאן בייר, באסם איסמעיל, אנדרה פישר, ברטולד קיפר, גרגור ת'ורמר ורבקה ראמב. יתר על כן, המחברים רוצים גם להודות לרדיוגרפים ולמשתתפי המחקר. בפרט, אנו מודים לפרנק שרדר וסוון תיל מהמחלקה לרדיולוגיה (בית הספר לרפואה של האנובר) על סיוע טכני יוצא דופן בביצוע בדיקות MRI.
Materials
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
References
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved