Method Article
Ressonância magnética pulmonar funcional resolvida em fase para avaliação de ventilação e perfusão pulmonar (V/Q)
Neste Artigo
Resumo
Aqui, descrevemos a implementação da RM pulmonar funcional resolvida em fase como uma técnica de RM de prótons sem contraste para a avaliação da ventilação pulmonar e da dinâmica de perfusão. Validado e aplicável em diferentes pontos fortes de campo e faixas etárias, pode melhorar a tomada de decisões clínicas no futuro, auxiliando na quantificação de doenças e no monitoramento da terapia.
Resumo
A decomposição de Fourier é um método de ressonância magnética 1H sem agente de contraste para avaliação da perfusão pulmonar (Q) e ventilação (V). Após o registro das imagens, a série temporal de cada voxel é analisada em relação aos componentes de frequência cardíaca e respiratória.
Usando uma sequência gradiente-eco 2D padrão com uma resolução temporal de ~ 300 ms, um algoritmo de classificação de imagens foi desenvolvido para produzir imagens pulmonares funcionais resolvidas por fase (PREFUL) com uma resolução temporal aumentada. Assim, é viável avaliar as alças de fluxo-volume regionais (FVL) durante a respiração do volume corrente e descrever a propagação da onda de pulso durante o ciclo cardíaco. Este método pode ser aplicado em 1,5T ou 3T com hardware MR padrão sem a necessidade de programação de sequência, pois o protocolo descrito pode ser implementado com a sequência SPGRE padrão na maioria dos sistemas.
A ressonância magnética de ventilação PREFUL foi validada usando imagens de gás 129Xe e 19F com boa concordância regional. A ressonância magnética PREFUL ponderada por perfusão foi validada usando SPECT, bem como ressonância magnética com contraste dinâmico (DCE). O PREFUL foi testado em um ambiente de dois centros e fornecedores duplos e atualmente é aplicado em vários ensaios multicêntricos em andamento. Além disso, é viável em uma variedade de intensidades de campo (0,55T-3T) e diferentes faixas etárias, incluindo recém-nascidos.
A ressonância magnética quantitativa V/Q PREFUL tem sido usada em pacientes com fibrose cística, doença pulmonar obstrutiva crônica, hipertensão pulmonar tromboembólica crônica e doença do vírus corona-2019 para quantificar a doença e monitorar a mudança do tratamento após a terapia. Além disso, a imagem PREFUL V/Q demonstrou prever a perda do transplante devido à disfunção crônica do enxerto pulmonar em pacientes após o transplante pulmonar. Em resumo, a ressonância magnética PREFUL é uma técnica validada para ventilação quantitativa e imagem de onda de pulso/perfusão pulmonar para detecção, quantificação e monitoramento do tratamento de doenças pulmonares regionais com potencial valor agregado à rotina clínica atual.
Introdução
O sistema respiratório, com seus intrincados mecanismos, é vulnerável a várias doenças. Destacam-se as condições respiratórias crônicas, como doença pulmonar obstrutiva crônica (DPOC), fibrose cística (FC) e hipertensão pulmonar tromboembólica crônica (HPTEC), reduzindo consideravelmente a expectativa de vida1. Como resultado, o diagnóstico precoce, o monitoramento e a avaliação da resposta terapêutica tornaram-se primordiais.
Os testes de função pulmonar (TFPs) podem derivar parâmetros globais da função pulmonar, como o índice de Tiffeneau-Pinelli, definido como a razão entre o volume expiratório forçado no primeiro segundo (VEF1) e a capacidade vital forçada (CVF)2. Tais parâmetros estão bem estabelecidos na rotina clínica, mas carecem de informações regionais e exigem um alto nível de adesão do paciente. Nesse sentido, a imagem pode oferecer insights adicionais e possibilidades para parâmetros mais sensíveis. A tomografia computadorizada (TC) oferece imagens de alta resolução da morfologia do parênquima, e técnicas recentes, como o mapeamento de resposta paramétrica, também recuperam informações funcionais3. No entanto, a tomografia computadorizada por emissão de fóton único (SPECT) continua sendo o padrão-ouro atual para descrever a ventilação e a perfusão (V/Q) no pulmão4. Comum a todos, as modalidades de imagem mencionadas requerem exposição à radiação ionizante, o que requer consideração especial em casos de monitoramento e grupos vulneráveis. Consequentemente, há um esforço contínuo para promover a RM como uma modalidade alternativa.
Inerentemente, o pulmão é um órgão desafiador para a ressonância magnética devido à sua baixa densidade de prótons e rápido decaimento do sinal5. Entre as múltiplas abordagens, as soluções mais difundidas incluem o uso de gás hiperpolarizado (por exemplo, ressonância magnética 129Xe) para ventilação6 e aplicação de agente de contraste intravenoso à base de gadolínio para representação de perfusão7. Esses métodos oferecem uma alta relação sinal-ruído (SNR) e são amplamente considerados métodos padrão-ouro na comunidade de RM. Uma abordagem mais recente evita a aplicação de qualquer agente de contraste e é viável com RM de prótons convencional em respiração livre com um tempo total de aquisição de ~ 1 min/fatia. Assim, eventos adversos potenciais e efeitos de longo prazo recentemente debatidos dos agentes de contraste são evitados e a disseminação mais fácil sem a necessidade de hiperpolarização adicional e hardware multinuclear é habilitada. Além disso, o problema de encontrar um estado de insuflação adequado, que pode afetaros valores derivados do defeito ventilatório8, é evitado pela aquisição de respiração livre.
Essa abordagem indireta baseada em sinal de RM foi introduzida pela primeira vez por Zapke et al., que utilizaram a relação recíproca do sinal ponderado em prótons S e volume pulmonar V: S ~ 1 / V.9 Baseia-se no processo de transformação de imagens adquiridas na respiração livre em um estado de inflação comum (normalmente em uma posição intermediária entre a expiração final e a inspiração final), compensando assim o movimento e permitindo analisar a série temporal do sinal em cada voxel. A partir daí, uma medida de ventilação pode ser derivada dessas chamadas imagens registradas usando a equação (1) de Klimeš et al.10:
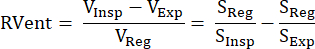 Características (1)
Características (1)
Com os volumes/sinais em inspiração (Insp), expiração (Exp) e estado registrado (Reg). Posteriormente, o método foi expandido com a introdução da Decomposição de Fourier para diferenciar entre modulações de sinal associadas à frequência respiratória (ventilação) e frequência de pulso (perfusão) e, portanto, derivar um mapa V / Q perfeitamente compatível espacialmente a partir de uma aquisição11. Isso é possível graças à lacuna típica entre as frequências respiratória e cardíaca, de modo que ambos os componentes que estão um sobre o outro no domínio do tempo são efetivamente discriminados no domínio da frequência pela análise de Fourier. Após a transição de baixo campo (0,35T) para 1,5T com uma sequência de precessão livre em estado estacionário balanceada otimizada (bSSFP)12, esse método começou a ganhar mais atenção com vários estudos de acompanhamento 13,14,15.
Uma vez que a respiração e o pulso estão sujeitos à variabilidade e a imagem bSSFP (gradiente compensado) disponível comercialmente a 1,5T pode resultar em artefatos de bandas substanciais (linhas claras de vazio de sinal), um método relacionado foi proposto com sequência de eco gradiente estragada (SPGRE) em combinação com ampla filtragem passa-baixa e passa-alta16,17. Isso captura o espectro mais complexo de modulações reais relacionadas à respiração e ao pulso. O cálculo a seguir da amplitude no domínio do tempo evita a necessidade de selecionar um pico de frequência específico. Uma otimização adicional foi alcançada dividindo o registro típico de uma etapa em direção a um estado de referência em duas etapas separadas. Assim, é utilizado o fato de que, durante a respiração livre, uma variedade de diferentes fases respiratórias são adquiridas entre a inspiração final e a expiração final, com vários graus de deformação necessária em direção a um estado fixo. Após a escolha de vários grupos e a identificação do grupo de imagens individuais, é realizado o seguinte procedimento: 1) Registro dentro do respectivo grupo de estado de respiração, 2) Registro intergrupo passo a passo de um grupo adjacente para o próximo (por exemplo, 1->2, 2->3,...) para o grupo que representa o grupo de referência. Essa abordagem foi expandida ainda mais pela estimativa de fase para cada imagem para estabelecer uma resolução temporal aparente mais alta para facilitar a análise da dinâmica de ventilação e perfusão, levando à terminologia de RM do pulmão funcional resolvido em fase (PREFUL) para diferenciar esse ramo de outras técnicas relacionadas18. Estudos de acompanhamento utilizaram as informações adicionais fornecidas pelos ciclos respiratório completo e cardíaco e mostraram sensibilidade potencialmente aumentada desses parâmetros 19,20,21.
A validação com o SPECT padrão-ouro revelou um coeficiente de dados de ≥67% para regiões de defeito22, e a medição mais direta da ventilação com 129Xe mostrou correlação percentual de defeito ventilatório ≥62% em uma coorte mista de DPOC/FC/saudável23 e 84% em uma coorte multicêntrica e multifornecedorde FC 24, que também demonstrou uma correlação semelhante ao índice de depuração pulmonar de PREFUL e 129Xe (r = 0,82 e r = 0,91). A análise de perfusão do mesmo estudo mostrou que não houve diferenças significativas na sobreposição espacial com o DCE entre os centros avaliados25. A concordância com o DCE e a concordância dos resultados do PREFUL entre os centros também foram relatadas para um subestudo prospectivo incluindo nove centros26. A análise da reprodutibilidade em pacientes com DPOC resultou em um coeficiente de variação abaixo de 15% para todos os parâmetros27. Estudos atuais sugerem que o parâmetro FVL tem maior poder preditivo e sensibilidade para detectar alterações no tratamento em comparação com o parâmetro ventilatório "estático", que leva em consideração apenas as fases inspiratória final e expiratória final. A capacidade de resposta ao tratamento com medidas regionais de alça fluxo-volume (FVL) foi demonstrada após o tratamento inalatório com indacaterol-glicopirrônio (IND/GLY) na DPOC28. Em concordância, o parâmetro FVL previu a perda do enxerto em pacientes com transplante duplo pulmonar, enquanto a espirometria não (P = 0,02 vs. P = 0,33)29. Os primeiros estudos de viabilidade mostram que a imagem pulmonar funcional com PREFUL pode ser realizada em bebês e neonatos respiradores livres com hardware de ressonância magnética clínica padrão30,31. Glandorf et al. compararam os parâmetros PREFUL em 1,5T e 3T (sequência SPGRE) e não encontraram diferenças significativas para a maioria dos parâmetros, que foram altamente reprodutíveis, apesar da diferença na intensidade do campo32. Isso pode ser uma vantagem importante, pois nem todos os locais têm acesso a scanners de intensidade de campo de 1,5 T ou inferior. Recentemente, a viabilidade e detecção de sintomas persistentes após a infecção por COVID-19 a 0,55T foi demonstrada avaliando os dados do bSSFP com o PREFUL33.
Em resumo, apesar de ser uma técnica relativamente nova, o PREFUL tem sido extensivamente estudado. Critérios importantes como validação com medidas mais diretas e estabelecidas, reprodutibilidade, sensibilidade para patologia e responsividade para alterações de tratamento e progressão foram avaliados. No entanto, ainda assim, apenas alguns centros especializados estão utilizando essa técnica, apesar da baixa exigência tecnológica. Portanto, o objetivo deste trabalho é resumir a mais recente metodologia de RM PREFUL na forma escrita e visual. Essas informações podem ser usadas para estabelecer essa técnica em mais centros e, assim, a longo prazo, levar a uma técnica mais madura.
Protocolo
Este estudo recebeu aprovação do comitê de ética da Hannover Medical School, garantindo que aderiu a rigorosos padrões éticos durante todo o processo de pesquisa. A investigação seguiu rigorosamente as diretrizes descritas na Declaração de Helsinque, enfatizando a conduta ética da pesquisa médica. Além disso, o consentimento informado foi diligentemente obtido de todos os participantes do estudo (ou de seus pais ou responsáveis legais) antes de sua participação no exame de ressonância magnética. Consulte a Figura 1 para obter uma visão geral simplificada das principais etapas do protocolo, que consistem em aquisição, registro, filtragem e classificação e, finalmente, síntese do ciclo cardíaco e respiratório. Nas seções a seguir, todas as etapas envolvidas são descritas em detalhes.
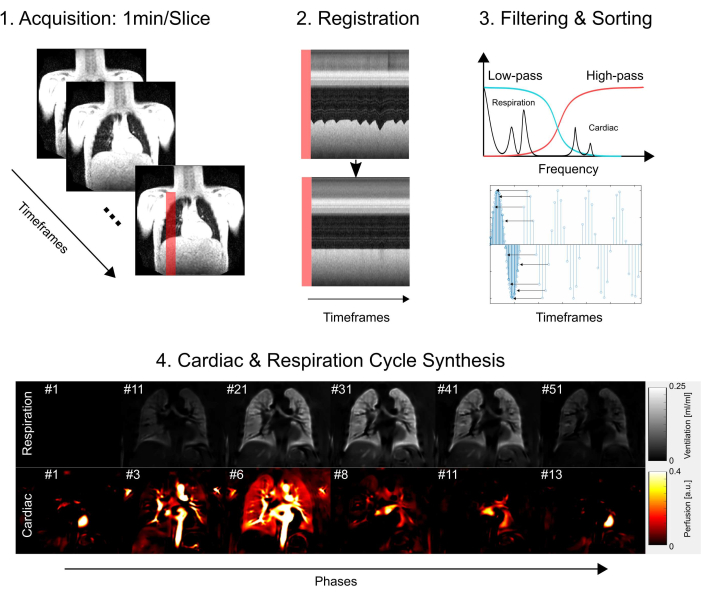
Figura 1: Visão geral esquemática dos componentes principais do PREFUL. 1) Aquisição em respiração livre, que requer 2) compensação de movimento por meio de registro, conforme demonstrado com os gráficos de perfil e permite uma análise voxel por voxel dos componentes de Fourier, conforme ilustrado na etapa 3) filtragem e classificação. Após a filtragem passa-baixa (ventilação) e passa-alta (perfusão), 4) a fase estimada é usada para classificar as imagens para uma resolução temporal aparente mais alta e sintetizar um ciclo cardíaco e respiratório completo. Observe que este é um esboço simplificado e todos os detalhes são descritos no manuscrito. Outras etapas, que são omitidas desta figura, incluem quantificação de parâmetros e geração de relatórios. Abreviatura: PREFUL = pulmão funcional resolvido em fase. Clique aqui para ver uma versão maior desta figura.
1. Recrutamento
- Recrutar pacientes adultos ou menoresem um estudo de ressonância magnética PREFUL para pacientes e controles saudáveis com base em seu diagnóstico de um distúrbio pulmonar com base no exame de espirometria e/ou imagem anterior (por exemplo, raio-X ou tomografia computadorizada); capacidade de dar consentimento informado; capacidade de ficar deitado e permanecer imóvel durante a ressonância magnética; e nenhuma contraindicação conhecida para ressonância nuclear magnética (RNM) (por exemplo, implantes metálicos, claustrofobia).
- Exclua pacientes se estiverem grávidas, tiverem feito cirurgia pulmonar prévia nos últimos 6 meses, tiverem dificuldade respiratória grave ou necessidade de suplementação contínua de oxigênio ou tiverem tido reações adversas anteriores a agentes de contraste à base de gadolínio se a ressonância magnética com contraste for usada além de PREFUL.
- Recrutar controles saudáveis se não houverhistórico conhecido de doença pulmonar com base no exame clínico e autorrelato; os testes de função pulmonar são normais; eles são capazes de dar consentimento informado; eles são capazes de ficar deitados e permanecer imóveis durante a ressonância magnética; e não têm contra-indicações conhecidas para ressonância magnética.
- Exclua indivíduos como controles saudáveis de acordo com a história atual ou passada de tabagismo, exposição a toxinas pulmonares conhecidas ou riscos ocupacionais, história familiar de doenças pulmonares hereditárias, qualquer doença crônica conhecida que possa influenciar a função pulmonar e gravidez.
- Adquira formulários de consentimento. Continue com o protocolo se um formulário de consentimento informado por escrito for obtido do participante contendo o objetivo e os procedimentos da pesquisa, quaisquer riscos e benefícios potenciais, garantias de confidencialidade, duração do estudo e o direito de desistir sem consequências.
- Aplique as seguintes etapas adicionais quando o recrutamento incluir menores.
- Obtenha o consentimento informado por escrito de pelo menos um dos pais ou responsável, além do consentimento do menor.
- Apresente todo o processo de maneira apropriada à idade e compreensível para o menor.
- Para menores de idade, use recursos visuais, livros de histórias ou explicações simplificadas.
- Certifique-se de que o estudo seja relevante para a faixa etária e que os menores não sejam incluídos desnecessariamente.
- Permita que menores sejam acompanhados por um adulto de confiança (por exemplo, pai, responsável) durante todos os procedimentos relacionados ao estudo, a menos que isso interfira na integridade do estudo.
NOTA: As etapas descritas pressupõem que o estudo foi revisado e aprovado pelo Comitê de Ética.
- Aplique as seguintes etapas adicionais quando o recrutamento incluir menores.
2. Aquisição
- Realize o procedimento de segurança de pré-digitalização.
- Antes de uma ressonância magnética, realize uma pré-triagem detalhada dos pacientes para identificar possíveis contra-indicações, como cirurgias anteriores, dispositivos implantados, tatuagens ou exposição a fragmentos de metal.
- Ao chegar, eduque os pacientes sobre as propriedades e riscos magnéticos do procedimento.
- Instrua os pacientes a remover todos os itens metálicos pessoais, incluindo joias, relógios e certos componentes de roupas, e forneça-lhes um avental, se necessário.
- Peça a um profissional treinado que inspecione visualmente os pacientes em busca de objetos metálicos esquecidos.
- Examine todos os dispositivos médicos ou implantes para compatibilidade com ressonância magnética.
- Certifique-se de que os protocolos de emergência estejam em vigor para a segurança da equipe e do paciente.
- Posicionar participante e escanear
- Oriente o paciente de cabeça para baixo e coloque-o em decúbito dorsal em um sistema de 0,55T, 1,5T ou 3T.
- Forneça proteção auditiva, uma campainha de emergência, acolchoamento e um cobertor para segurança e conforto.
- Posicione uma bobina flexível multicanal logo abaixo do queixo para garantir a sensibilidade ideal da bobina em todas as áreas pulmonares.
- Fixe a colocação da bobina para manter a estabilidade sem prejudicar a respiração do paciente.
- Instrua o paciente a fechar os olhos e, em seguida, marque o centro do pulmão usando o laser de ressonância magnética.
- Alinhe o centro pulmonar no isocentro e permita que o paciente abra os olhos novamente.
- Escanear os localizadores iniciais para estabelecer uma orientação geral, seguido de um escaneamento morfológico transversal para identificar a bifurcação traqueal.
- Ancore o primeiro corte coronal na bifurcação traqueal como um ponto de referência consistente para aumentar a reprodutibilidade.
- Dependendo do protocolo de varredura, capture três fatias espaçadas com uma distância fatia a fatia (medida de ponta a ponta) de 100% (da espessura da fatia) ou adquira várias fatias abrangendo todo o pulmão com uma distância de 20% ou 33%.
- Adquira cada fatia completamente separada e não intercalada.
- Carregue as imagens reconstruídas no sistema de arquivamento e comunicação de imagens (PACS) para acesso e análise subsequentes. Como alternativa, para adesão aos padrões de privacidade e proteção de dados, exporte manualmente as imagens para uma unidade de rede designada ou uma solução de armazenamento semelhante.
NOTA: Para obter informações detalhadas sobre o protocolo e os parâmetros de sequência, consulte a Tabela 1 e a Tabela 2. Para obter uma representação visual do posicionamento da fatia, consulte a Figura 2.
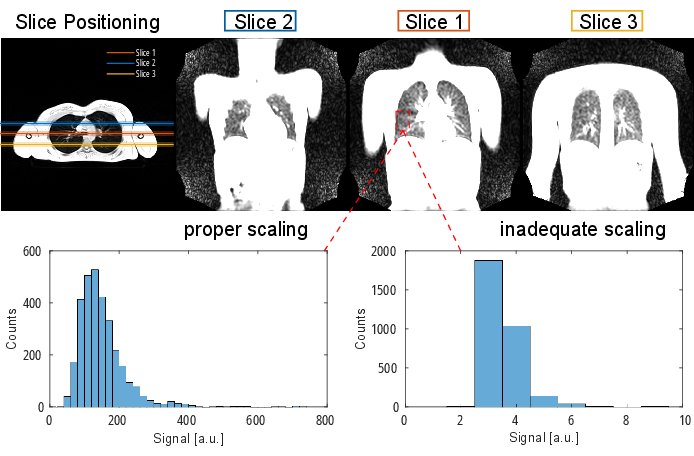
Figura 2: Um posicionamento típico de fatia para um experimento PREFUL visualizado com um eco gradiente 3D na orientação transversal. Observe que o primeiro corte é posicionado na bifurcação traqueal como um ponto de referência reprodutível. O2º e o3º cortes são posicionados com um intervalo de corte de 100% nas direções anterior e posterior. Histogramas exemplares mostram distribuições de valor com escala adequada e inadequada (baixa). Este último leva a uma baixa faixa dinâmica e perda de precisão. Uma escala alta inadequada, que leva ao recorte (não mostrado aqui), também deve ser evitada. Abreviatura: PREFUL = pulmão funcional resolvido em fase. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Um esboço típico de um protocolo PREFUL. Após um localizador, um volume 3D do pulmão é adquirido em orientação transversal. Essa aquisição é usada para planejar as seguintes aquisições PREFUL (consulte também a Tabela 2 para configurações de sequência e a Figura 2 para posicionamento de fatia). Outras sequências podem ser adicionadas dependendo do estudo. Abreviatura: PREFUL = pulmão funcional resolvido em fase. Clique aqui para baixar esta tabela.
Tabela 2: Resumo dos parâmetros de sequência para aquisição de PREFUL com sequência de gradiente eco estragado. Abreviaturas: PREFUL = pulmão funcional resolvido em fase; SPGRE = sequência de eco gradiente estragada. Clique aqui para baixar esta tabela.
3. Pós-processamento
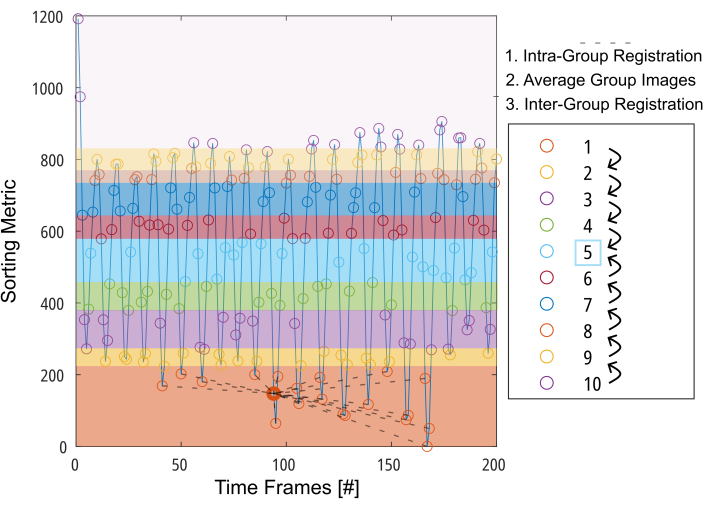
Figura 3: Apresentação esquemática do registro orientado ao grupo para minimizar a deformação necessária para compensação de movimento. Depois de dividir as imagens (representadas por círculos) em 10 grupos com base em uma métrica de classificação (por exemplo, área pulmonar segmentada), as imagens são registradas dentro de cada grupo em uma posição intermediária (ilustrada por linhas tracejadas para o grupo 1). Em seguida, as imagens registradas são calculadas e usadas para a etapa final do registro entre grupos passo a passo em direção ao grupo intermediário. Abreviatura: GOREG = registro orientado a grupo. Clique aqui para ver uma versão maior desta figura.
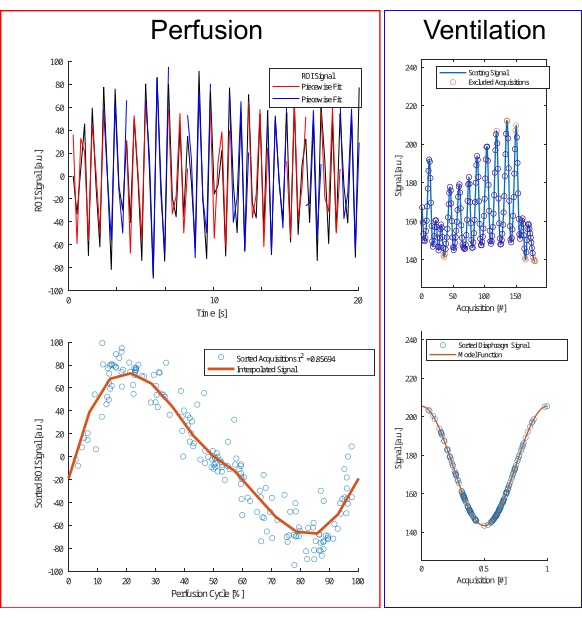
Figura 4: Ilustração do algoritmo de classificação para perfusão e ventilação. Para a perfusão (esquerda), é realizado um ajuste por partes (linha superior) para estimar a fase e recorrer às aquisições (linha inferior). Para ventilação (direita), os outliers são excluídos (linha superior) e classificados de acordo com um modelo de cosseno (linha inferior) com base na amplitude e no diferencial de amplitude para distinguir entre as fases de expiração e inspiração. Clique aqui para ver uma versão maior desta figura.
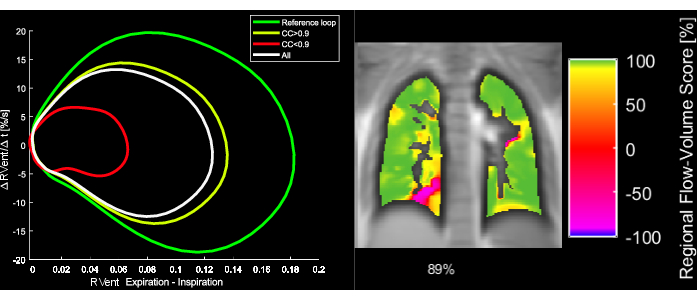
Figura 5: Loops fluxo-volume exemplares e a correspondente Métrica de Correlação FVL de uma paciente de 43 anos com DPOC. Observe que, com a mudança de FVL, o FVL-CM diminui. Abreviaturas: FVL = loop fluxo-volume; FVL-CM = FVL-métrica de correlação; DPOC = doença pulmonar obstrutiva crônica. Clique aqui para ver uma versão maior desta figura.
Tabela 3: Aplicação de limiares aos mapas de parâmetros e combinação de mapas de defeitos. Clique aqui para baixar esta tabela.
- Inscrição
NOTA: Na seção a seguir, é descrito o procedimento para registro não rígido em um volume de referência (preferencialmente o nível respiratório de nível médio) usando um esquema orientado a grupo (GOREG) para compensação da respiração e do movimento cardíaco.- Recupere as imagens.
- Inicialmente, realizar a segmentação pulmonar em todas as imagens não registradas, com U-Net treinado e aplicar um filtro passa-baixa com corte de 0,7 Hz para obter uma estimativa das fases respiratórias.
NOTA: Isso iniciará o pipeline de processamento totalmente automatizado, que executará as etapas subsequentes em segundo plano. As etapas de processamento demonstradas e descritas não se limitam a um aplicativo ou linguagem específica e, portanto, podem ser implementadas em um aplicativo personalizado com muitas linguagens de programação. - Classifique alta quantidade de voxels segmentados como inspiração e baixa quantidade como expiração.
- Agrupe as imagens dividindo-as em percentis 10, garantindo que cada grupo dos 10 grupos resultantes contenha um número igual de imagens.
- Selecione ANTs34 (BSplineSyN com métrica de correlação cruzada) ou Forsberg35,36 (expansão polinomial com regularização elástica e fluida) como o algoritmo de registro.
- Realize o Intra-registro para cada grupo em direção à posição pulmonar intermediária do respectivo grupo.
- Faça a média dos resultados do grupo para obter uma imagem para cada grupo.
- Realizar o Inter-registro indo de cada imagem do grupo para o próximo vizinho na direção do5º grupo.
- Aplicar a cadeia de deformações nas imagens originais, conforme necessário para atingir a posição respiratória representada pela média da imagem no grupo 5. Por exemplo, para a Imagem 36, que pertence ao grupo 3, os seguintes campos de deformação são aplicados: 36->Imagem 57 (~Posição Pulmonar Intermediária no grupo 3) -> Etapa 3->4 -> Etapa 4->5.
NOTA: Para obter uma descrição detalhada do procedimento GOREG, consulte a Figura 3. Realize o registro com computação paralela para reduzir o tempo de processamento. O registro GOREG é realizado para minimizar a quantidade de deformação necessária para cada etapa de registro e, portanto, garantir a convergência estável do algoritmo. No entanto, o registro também pode ser realizado com apenas uma etapa de deformação em direção à posição pulmonar intermediária. Embora todos os estudos 2D PREFUL publicados tenham usado ANTs, Forsberg produz resultados até 6x mais rápidos, com resultados de qualidade comparável, conforme relatado por um estudo 3D PREFUL37. Resultados exemplares neste relatório foram gerados com o registro de Forsberg. Consulte a Figura 1 para ver uma ilustração do efeito de registro no movimento do diafragma.
- Filtragem geral
- Reduza o ruído das imagens registradas usando filtragem guiada por imagem38, empregando a imagem registrada com média temporal como imagem guia. Aplique as seguintes configurações: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- Para análise de ventilação e perfusão, use um filtro passa-baixa ou passa-alta com um corte em 0.7 Hz para suprimir o respectivo outro componente. Exclua as primeiras 20 imagens de todas as etapas de processamento adicionais, exceto para o cálculo de perfusão quantificada, para garantir o estado estacionário nas séries temporais incluídas.
NOTA: Uma mudança do corte pode ser necessária se os indivíduos tiverem uma frequência respiratória acima de ~ 40 respirações / min.
- Segmentação
NOTA: A segmentação final é realizada usando as imagens registradas na posição pulmonar intermediária em um procedimento de duas etapas, conforme descrito a seguir.- Execute a segmentação do limite pulmonar (ROI pulmonar) nas imagens registradas com média temporal com uma U-Net treinada ou manualmente.
- Em seguida, exclua grandes vasos centrais para refinar a segmentação do limite pulmonar e obter uma região de interesse ou ROI para o parênquima pulmonar.
- Perfusão
NOTA: As etapas a seguir são necessárias para estimar com precisão a fase cardíaca para cada imagem na série adquirida, que são amostradas em uma frequência relativamente baixa (~ 3-5 imagens / s), especialmente em comparação com a frequência cardíaca (normalmente 40-90 bpm). O rearranjo dos dados de acordo com as fases cardíacas determinadas é usado para obter o ciclo cardíaco completo com resolução temporal aprimorada, superando a taxa de amostragem da aquisição de dados18 (consulte a Figura 4 para uma ilustração do procedimento de classificação). Para estimativa de fase, é necessário um ROI de pesquisa com um forte sinal ponderado por perfusão. Empregue um algoritmo de pesquisa iterativo da seguinte forma22.- Conecte a ROI do limite do pulmão para incluir o mediastino na ROI da pesquisa.
- Gere um mapa simples ponderado por perfusão calculando o desvio padrão ao longo da sequência de imagens.
- Identifique as regiões correspondentes ao 98º percentil deste mapa no ROI de pesquisa como ROIs iniciais para as etapas subsequentes.
- Execute o ajuste por peça, aumentando o tamanho das pontas iniciais enquanto o desempenho do ajuste melhora.
- Classifique os ROIs iniciais expandidos de acordo com seu desempenho adequado.
- Combine iterativamente os ROIs iniciais mais bem expandidos com o segundo, terceiro melhor, etc., até que a combinação não melhore a métrica ou todos os ROIs iniciais sejam considerados. Considere a ROI final como a ROI do vaso usada para estimativa da fase cardíaca.
- Calcule a média espacial do sinal dentro da estimativa de fase otimizada para produzir uma série temporal de sinal para estimativa de fase.
- Realize a estimativa por partes segmentando o sinal em porções menores usando os máximos locais do sinal, seguidos por um ajuste senoidal por partes considerando parâmetros como amplitude, deslocamento de fase e frequência (Figura 4).
- Classifique as imagens por fase para representar um ciclo cardíaco.
- Empregue a regressão do kernel de Nadaraya-Watson com um kernel gaussiano (sigma = 0,1) para interpolar 15 fases em uma grade de tempo uniformemente espaçada, abrangendo um único ciclo cardíaco.
NOTA: Consulte a Figura 1 para obter um subconjunto de um ciclo cardíaco completo sintetizado exemplar de um voluntário saudável, começando na diástole, fazendo a transição para a sístole e retornando à diástole.
- Ventilação
NOTA: Para análise de perfusão, observe que a frequência cardíaca permanece relativamente estável com variações de amplitude insignificantes. Em contraste, a ventilação tende a experimentar mais variações no volume corrente e na frequência, levando a diferentes estados respiratórios com fases respiratórias idênticas nem sempre com a mesma amplitude. Inspirado na abordagem de auto-gating de Fischer et al., é essencial categorizar a ventilação com base na amplitude do sinal.- Exclua outliers extremos usando regras empíricas (dados abaixo do 5º ou acima do percentil 97).
- Derive a faixa de amplitude R e o deslocamento C da série sinal-tempo criada para o agrupamento de registro.
- Defina uma função modelo A(t) com uma frequência arbitrariamente selecionada fRespiração (aqui 0,3 Hz):
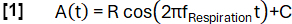
- Classifique os dados em estados de inspiração e expiração com base na inclinação.
- Obtenha uma determinação de fase mais refinada de acordo com a função do modelo:
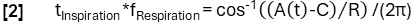
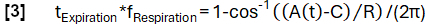
- Posteriormente, alinhe as amostras com base em sua fase e aplique a regressão de kernel de Nadaraya-Watson para calcular a ventilação em intervalos uniformemente espaçados durante o ciclo respiratório.
- Calcule a ventilação regional (VDent) para cada fase em analogia à equação 1, substituindo a fase de inspiração pela respectiva fase.
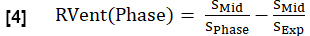
NOTA: Consulte a Figura 1 para ver um subconjunto de um ciclo respiratório completo sintetizado exemplar de um voluntário saudável, começando na expiração, fazendo a transição para a inspiração e depois retornando à expiração. Para obter uma ilustração do algoritmo de classificação, consulte a Figura 4.
- Cálculo de parâmetros
NOTA: Usando a respiração completa sintetizada e os ciclos cardíacos, pode-se derivar outros parâmetros. Uma seleção dos parâmetros mais importantes é descrita a seguir. - Ventilação regional (RVent)
- Usando a fase inspiratória, derive RVent de acordo com:
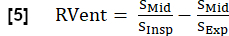
- Usando a fase inspiratória, derive RVent de acordo com:
- Métrica de correlação fluxo-volume-loop (FVL-CM)
NOTA: Para avaliar todas as fases da respiração, uma série de etapas é realizada para gerar uma ressonância magnética equivalente à análise do FVL em analogia ao teste de função pulmonar.- Calcule a inclinação da ventilação regional (RVent) como um substituto para o fluxo usando a primeira derivada de tempo de RVent. Empregue um quociente de diferença simétrica com comprimento de passo h:
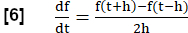
- Opcionalmente, exiba as inclinações regionais ou médias do RVent em função do respectivo RVent, gerando assim um equivalente PREFUL à análise FVL.
- Determine uma ROI de referência identificando a maior região conectada com valores de RVent na faixa do percentil 80 a 90 na ROI do parênquima pulmonar.
- Calcule a média dos loops de fluxo-volume dentro do ROI de referência determinado.
- Para determinar a semelhança de cada CVF pulmonar com a referência, correlacione cada CVF na ROI do parênquima pulmonar com a referência com defasagem zero:
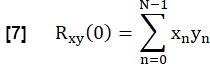
- Normalize-o de acordo com:
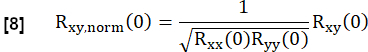
Aqui, x e y representam a referência e a respectiva curva de fluxo RVent.
NOTA: Observe que o atraso zero é empregado para que a ventilação atrasada resulte em uma correlação mais baixa.
NOTA: Consulte a Figura 5 para obter uma ilustração do cálculo do FVL e da métrica FVL-CM derivada.
- Calcule a inclinação da ventilação regional (RVent) como um substituto para o fluxo usando a primeira derivada de tempo de RVent. Empregue um quociente de diferença simétrica com comprimento de passo h:
- Perfusão quantificada
NOTA: A quantificação é realizada de acordo com Glandorf et al. usando as primeiras imagens adquiridas durante o estadotransiente 36.- Normalize as primeiras quatro imagens registradas para o nível médio de inspiração usando a quantidade de voxel pulmonar A, conforme calculado na etapa 3.1.2. Essa redução da modulação causada pela variação da densidade de prótons é expressa como:
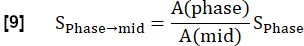
- Execute um ajuste exponencial para estimar o sinal associado à magnetização máxima usando o modelo:
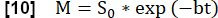
- Determine um mapa Q relacionado à perfusão parenquimatosa usando a fase do ciclo cardíaco que mostra os sinais mais máximos na ROI do parênquima pulmonar.
- Para a estimativa da fração sanguínea regional (GC), normalize o valor de S0 calculando a média dos valores acima do percentil 99,99 na pesquisa ROI (voxel sanguíneo completo):
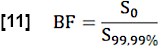
- Estime a fração de troca (FE) durante um ciclo cardíaco considerando a razão entre a diferença mediana máxima do sinal entre o estado estacionário (SS) e o estado inicial, conforme determinado por S0 , e a diferença de sinal relacionada ao fluxo Q:
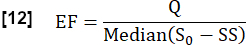
- Determine a frequência cardíaca fCoração em 1/s a partir da ROI do vaso usando a análise de Fourier (frequência correspondente ao maior pico).
- Calcule a perfusão quantificada final (QQ) em mL∙min-1∙100 mL-1 da seguinte forma:
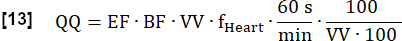
NOTA: Aqui, o volume de voxel (VV) é cancelado [mL/mL], e o fator de conversão 60 s/min e o fator de convenção 100/100 são usados para exibir o resultado final em [mL∙min-1∙100 mL-1]. EF e BF são razões adimensionais.
- Normalize as primeiras quatro imagens registradas para o nível médio de inspiração usando a quantidade de voxel pulmonar A, conforme calculado na etapa 3.1.2. Essa redução da modulação causada pela variação da densidade de prótons é expressa como:
- Limiar e estatísticas
- Descreva estatisticamente os parâmetros acima mencionados para a fatia do meio e todas as fatias com valor médio (todos os valores/valores da fatia do meio) e desvio padrão (todos os valores/apenas valores da fatia do meio).
- Além disso, normalize o desvio padrão para o coeficiente de variação para obter uma conta relativa da dispersão. Selecione o valor médio e o coeficiente de variação como resultados estatísticos finais.
- Aplique limites aos mapas de parâmetros para gerar mapas de defeitos e derivar valores percentuais de defeitos (consulte a Tabela 3).
- Classifique os valores abaixo dos limiares como defeito de ventilação ou perfusão (VD/QD). Combine esses mapas para quantificar a sobreposição de defeitos e regiões normais (classes V/Q), incluindo as seguintes combinações, conforme mostrado na tabela quádrupla na Tabela 3:
- Calcule a porcentagem de defeitos das classes Defeito de Ventilação (VD), Defeito de Perfusão (QD) e Ventilação/Perfusão (V/Q) como o número de voxels com a respectiva classe em relação aos voxels totais do parênquima pulmonar:
Porcentagem de defeito = #DefectVoxels/#LungParenchyma - Calcule essa porcentagem de defeito para cada fatia e as fatias coronais compostas. Para este estudo, escolha a abordagem combinada, onde um defeito ventilatório é determinado por uma operação OR: VD = VD(RVent) OU VD(FVL-CM).
NOTA: A análise descrita foi realizada com um aplicativo de software comercial (consulte a Tabela de Materiais) usando a caixa de ferramentas de registro de Forsberg.
| Parâmetro | Limiar | Comentário |
| RVent | Percentil 90 * 0,4 | Limiar Adaptativo |
| FVL-CM | 90% | Limite fixo |
| Q | Percentil 90 * 0,15 | Limiar Adaptativo |
| V/Q | SEM QD | QD |
| SEM VD | Normal | Incompatibilidade VQ (QD exclusivo) |
| VD | Incompatibilidade VQ (VD Exclusivo) | VQ Correspondência de defeitos |
Resultados
A parte inferior da Figura 2 ilustra a consequência do dimensionamento adequado e inadequado com um efeito correspondente na faixa dinâmica. A Figura 6 mostra a distribuição de sinal não homogênea, que é representativa de varreduras sem e com normalização da bobina. Recomenda-se evitar uma faixa dinâmica baixa e imagens sem normalização da bobina.
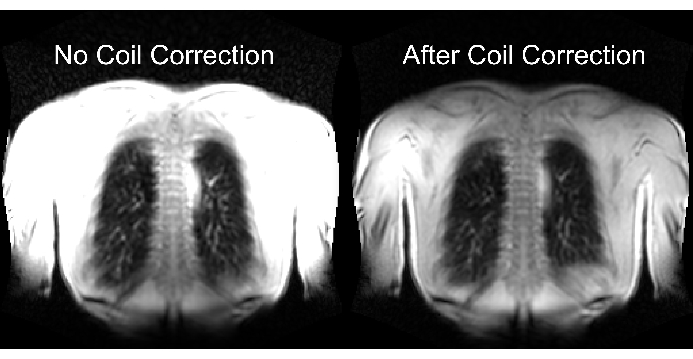
Figura 6: Imagens exemplares após aquisição sem correção da bobina (incorreta) e com correção da bobina (correta). Observe o aprimoramento do sinal artificial nos limites do corpo perto dos elementos da bobina. Clique aqui para ver uma versão maior desta figura.
A Figura 7 ilustra a segmentação automática bem-sucedida e com falha. Observe que a segmentação com falha não inclui todos os voxels pulmonares, o que falsificará análises e estatísticas adicionais. Cuidados especiais são necessários para casos com infiltrados, pois esses voxels podem ser classificados erroneamente como vasos devido ao seu alto sinal por modelos de IA ou não segmentados.
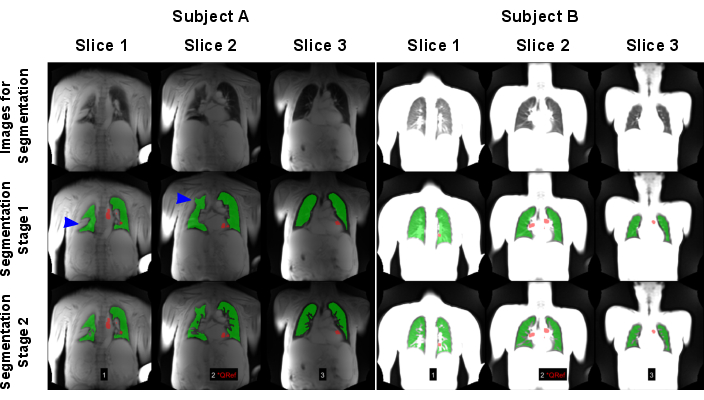
Figura 7: Um exemplo de segmentação automatizada resultando em uma falha (Sujeito A: homem de 83 anos com DPOC) e um resultado bem-sucedido (Sujeito B: controle saudável feminino de 30 anos). A primeira linha mostra as imagens, que foram usadas como entrada para os modelos de IA. A segunda linha mostra os resultados do primeiro estágio de segmentação que consiste em encontrar o limite pulmonar. A terceira linha mostra o resultado final após a exclusão dos vasos. Conforme mostrado pelas setas azuis, o algoritmo foi desafiado pelas variações pulmonares de alto sinal, causando detecção incorreta de limites pulmonares. Observe que as imagens foram normalizadas pelo sinal máximo, o que levou a resultados diferentes devido à falta de normalização da bobina da varredura realizada no sujeito A. As regiões vermelhas mostram as ROIs, que foram detectadas automaticamente para classificação da fase de perfusão. Abreviaturas: DPOC = doença pulmonar obstrutiva crônica; ROIs = regiões de interesse. Clique aqui para ver uma versão maior desta figura.
A Figura 8 e a Figura 9 mostram mapas de parâmetros representativos para um controle saudável (30 anos, mulher) e um paciente com DPOC (60 anos, homem). Observe que o controle saudável mostra uma ventilação e perfusão mais homogêneas e, portanto, menos voxels defeituosos. Os relatórios correspondentes das estatísticas de ROI podem ser encontrados na Tabela 4 e na Tabela 5.
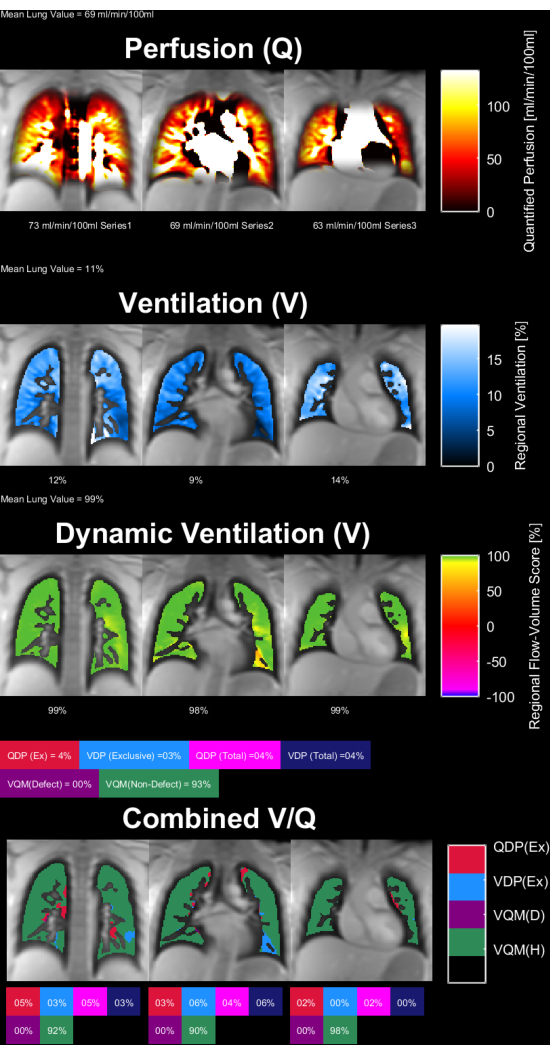
Figura 8: Mapas de parâmetros PREFUL de uma mulher controle saudável de 30 anos. A perfusão (1ª linha), ventilação regional (2ª linha), métrica de correlação de loop fluxo-volume (3ª linha) e mapas V/Q limiares (4ª linha). Observe a distribuição homogênea dos valores do parênquima e as baixas porcentagens de defeitos. Abreviaturas: PREFUL = pulmão funcional resolvido em fase; V = ventilação; Q = perfusão. Clique aqui para ver uma versão maior desta figura.
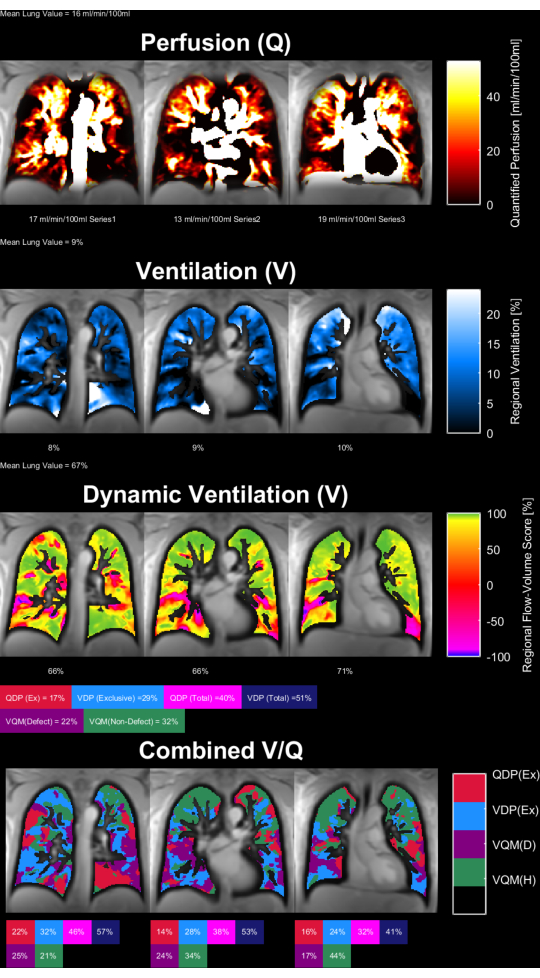
Figura 9: Mapas de parâmetros PREFUL de um paciente com DPOC do sexo masculino de 60 anos. A perfusão (1ª linha), ventilação regional (2ª linha), métrica de correlação de loop fluxo-volume (3ª linha) e mapas V/Q limiares (4ª linha). Observe a distribuição heterogênea dos valores do parênquima e altas porcentagens de defeitos. Abreviaturas: DPOC = doença pulmonar obstrutiva crônica; PREFUL = pulmão funcional resolvido em fase; V = ventilação; Q = perfusão. Clique aqui para ver uma versão maior desta figura.
Tabela 4: Relatório exemplar dos parâmetros PREFUL obtidos para um controle saudável (mulher de 30 anos). Observe os baixos valores de coeficiente de variação e defeito, que estão de acordo com os mapas de parâmetros apresentados na Figura 8 para o mesmo assunto. Veja também a Tabela 5 e a Figura 9. Abreviatura: PREFUL = pulmão funcional resolvido em fase. Clique aqui para baixar esta tabela.
Tabela 5: Relatório exemplar dos parâmetros PREFUL obtidos para um paciente com DPOC (homem de 60 anos). Observe os altos valores de coeficiente de variação e defeito, que estão de acordo com os mapas de parâmetros apresentados na Figura 9 para o mesmo assunto. Veja também a Tabela 4 e a Figura 8. Clique aqui para baixar esta tabela.
Material Suplementar: Explicação animada do algoritmo PREFUL. Clique aqui para baixar este arquivo.
Discussão
Etapas críticas
Uma das armadilhas mais comuns durante a aquisição é o dimensionamento inadequado do sinal, que causa uma perda de informações durante a conversão DICOM pela precisão reduzida da representação de dados digitais. Consequentemente, isso pode levar a problemas durante o estágio de pós-processamento. Outra armadilha ainda mais crítica é a aquisição de várias fatias de forma intercalada. Assim, a resolução temporal efetiva das fatias individuais é criticamente reduzida. Além disso, dependendo da distância das fatias, isso pode ter um impacto no contraste e na quantificação da perfusão, uma vez que o fluxo de entrada depende de spins frescos sem histórico de magnetização. É necessário cuidado especial durante a configuração do protocolo, especialmente em relação à força do gradiente, eco assimétrico, largura de banda e imagens paralelas. Desvios das configurações sugeridas para apenas um desses parâmetros podem levar a TE e resolução temporal inadequadas.
O pós-processamento consiste em várias etapas, que devem ser seguidas na ordem descrita. Por exemplo, um registro após a filtragem passa-baixa não é significativo. Consequentemente, a falha em uma etapa leva a uma falha durante as próximas etapas. Isso torna a etapa de registro especialmente importante. Como não existe um algoritmo de registro único, dependendo da respectiva implementação, os parâmetros devem ser definidos empiricamente. Sem o ajuste fino desses parâmetros, um registro falso impedirá a geração de qualquer resultado significativo. Outra etapa possivelmente demorada e crítica durante o pós-processamento é a segmentação. Segmentações falsas podem levar a cálculos de parâmetros completamente errados (por exemplo, incluindo regiões não pulmonares) no relatório final. Essas segmentações incorretas são mais prováveis de ocorrer com algoritmos de aprendizado profundo, que estão acostumados a certas aparências de imagem e são aplicados a imagens de outro fornecedor/máquina com uma aparência ligeiramente diferente. Uma verificação de qualidade visual da precisão da segmentação, com possível correção manual, é, portanto, obrigatória.
Solucionando problemas
O procedimento típico de solução de problemas é seguir todas as etapas uma a uma e verificar a plausibilidade dos resultados intermediários. O procedimento para as etapas principais é o seguinte: Verifique se as imagens são adquiridas em respiração livre com a sequência e configurações corretas. Em seguida, verifique se a faixa dinâmica dos sinais é apropriada (~ 50 UA no parênquima pulmonar). Se os dados brutos ainda estiverem disponíveis, repita a reconstrução das imagens com um fator de escala apropriado, evitando a necessidade de uma nova aquisição de dados. Verifique se o registro foi realizado sem grandes artefatos e movimento restante. Em seguida, verifique se pequenas ROIs mostram uma série temporal com modulações esperadas relacionadas à ventilação e perfusão. Em seguida, verifique se os filtros aplicados alteram as imagens da maneira esperada (por exemplo, sem modulações de alta frequência em dados filtrados passa-baixa). Verifique se os ciclos respiratório e cardíaco sintetizados são fisiológicos e não apresentam saltos bruscos. Verifique a precisão da segmentação. Observe que uma pesquisa em um nível de resolução mais fino pode ser necessária assim que a etapa principal, durante a qual o problema ocorre, for identificada.
Limitações
Embora o protocolo apresentado seja conhecido por produzir resultados reprodutíveis e sensíveis, o número de etapas e parâmetros envolvidos durante a aquisição e o pós-processamento permitem uma otimização quase infinita e estão interligados. Portanto, uma abordagem de baixo para cima deve ser seguida por primeiro abordar as otimizações do protocolo de sequência (por exemplo, em relação à SNR e à relação contraste-ruído funcional). Para as otimizações de pós-processamento a seguir, uma verdade predefinida na forma de um modelo de pulmão digital pode ser útil40. Conforme apresentado, este modelo mimetiza uma aquisição de respiração livre e inclui várias classes para simular defeitos de ventilação/perfusão. Incluindo uma deformação conhecida devido ao movimento, os algoritmos de registro também podem ser testados diretamente. Apesar dessas vantagens, cada modelo é inerentemente limitado pela precisão do mapeamento da realidade complexa para um modelo finito e simplificado.
Os limiares apresentados neste protocolo mostraram resultados razoáveis para voluntários saudáveis e em diferentes coortes de pacientes por análise empírica. No entanto, conforme descrito anteriormente, o ajuste provavelmente é necessário dependendo da sequência, intensidade do campo e coorte.
Uma limitação geral do PREFUL é o extenso pós-processamento, que ainda não está prontamente disponível como produto médico, embora as primeiras versões em andamento da Siemens Healthineers e BioVisioneers estejam disponíveis para fins científicos em um ambiente de colaboração científica/comercial. Os cálculos geralmente envolvem processamento paralelo, que exige muito de CPU e RAM e pode exigir estações de trabalho modernas ou soluções de servidor para processar efetivamente grandes quantidades de dados. Além disso, as etapas demoradas de pós-processamento atualmente impedem uma apresentação instantânea dos resultados, o que seria desejável para o fluxo de trabalho clínico.
Comparação com outros métodos
Há uma infinidade de abordagens semelhantes, como o PREFUL, incluindo o antecessor Fourier Decomposition e seus outros derivados, como Matrix Pencil Decomposition41 e a abordagem ligeiramente diferente Self-gated Non-Contrast-enhanced Functional Lung MRI (SENCEFUL MRI)42. Enquanto a decomposição de Fourier e métodos semelhantes operam no domínio da frequência, o PREFUL usa filtragem de Fourier menos rigorosa e subsequente cálculo de amplitudes no domínio do tempo. Portanto, não há necessidade de selecionar picos específicos correspondentes à ventilação/perfusão. Isso pode resultar em menos suscetibilidade à variabilidade da respiração, que é conhecida por ocorrer em seres humanos.
Enquanto o PREFUL realiza a classificação de imagens, o SENCEFUL usa a classificação de linhas de espaço k, levando a mais flexibilidade. No entanto, o SENCEFUL requer sequências com recursos de auto-controle, enquanto o PREFUL pode ser realizado com uma sequência convencional de gradiente eco estragado. Da mesma forma, o bSSFP comumente usado em abordagens baseadas em decomposição de Fourier é conhecido por melhor SNR e contraste de fluxo sanguíneo, mas normalmente requer mais otimização para aquisição pulmonar, especialmente em 3T43. No entanto, fora isso, não há razão para não combinar o PREFUL com a aquisiçãobSSFP 44.
Todas essas abordagens baseadas em sinal assumem que certas influências indesejadas do sinal, incluindo T1, T2 / T2 *, difusão, movimento através do plano e voxels não perfundidos ortogonalmente, são insignificantes. Embora a validação progressiva do PREFUL sugira indiretamente que, de fato, tais influências não são críticas, Triphan et al. mostraram que há uma dependência do T1 e TE efetivos, o que é explicado pela ponderação diferente dos componentes sanguíneos e parenquimatosos dependendo do TE45. Sob essa luz, a vantagem inicial do bSSFP para visualizar o sangue devido ao contraste T2/T1 pode representar um desafio adicional para estabelecer uma quantificação precisa em comparação com a mecânica de contraste mais simples de um SPGRE. No entanto, novos estudos que abordem diretamente a influência de várias variáveis de RM, por exemplo, como realizado por Glandorf et al. para meios de contraste46,47, são desejáveis, pois podem quantificar diretamente o efeito sobre o PREFUL.
Importância
Sendo um método de respiração livre e sem meios de contraste, o PREFUL compartilha muitas vantagens com os métodos relacionados mencionados anteriormente: 1) Sem radiação ionizante e aplicação de agente de contraste, 2) Sem necessidade de hardware ou pessoal adicional, 3) aquisição, que depende apenas da adesão mínima do paciente. Essas vantagens tornam o PREFUL uma ferramenta de monitoramento conveniente, especialmente para grupos vulneráveis, como crianças com doença pulmonar crônica. Embora o SNR seja baixo com a sequência SPGRE, a disponibilidade e a falta de necessidade de programação/compartilhamento de sequência adicional promovem ainda mais a disseminação dessa abordagem.
Conforme discutido na seção de introdução, o número de estudos que mostram boa validação, reprodutibilidade, resultados de sensibilidade e recursos de monitoramento mostram que a importância dessa técnica e dos parâmetros dinâmicos correspondentes está em uma trajetória crescente e será ainda mais apoiada por ampla disseminação.
Divulgações
Filip Klimeš, Andreas Voskrebenzev e Jens Vogel-Claussen são acionistas da BioVisioneers GmbH, uma empresa que tem interesse em métodos de ressonância magnética pulmonar.
Agradecimentos
Este trabalho foi financiado pelo Centro Alemão de Pesquisa Pulmonar (DZL). Os autores gostariam de expressar uma profunda gratidão a todos que contribuíram e apoiaram o desenvolvimento do PREFUL, em particular: Marcel Gutberlet, Till F. Kaireit, Lea Behrendt, Julian Glandorf, Sonja Lüdiger, Tawfik Moher Alsady, Katharina Bünemann, Marius Wernz, Robin Müller, Maximilian Zubke, Gesa Pöhler, Agilo Kern, Cristian Crisosto, Milan Speth, Arnd Obert, Julienne Scheller, Jim Wild, Edwin van Beek, Helen Marshall, Jens Gottlieb, Martha Dohna, Diane Renz, Anna-Maria Dittrich, Tobias Welte, Jens Hohlfeld, Patrick Zardo, Giles Santyr, Franz Wolfgang Hirsch, Robert Grimm, Bastian Bier, Bassem Ismail, André Fischer, Berthold Kiefer, Gregor Thoermer e Rebecca Ramb. Além disso, os autores também gostariam de agradecer aos radiologistas e participantes do estudo. Em particular, agradecemos a Frank Schröder e Sven Thiele, do Departamento de Radiologia da Escola de Medicina de Hannover, pela excelente assistência técnica na realização dos exames de ressonância magnética.
Materiais
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
Referências
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados