Method Article
Resonancia magnética pulmonar funcional resuelta en fase para la evaluación de la ventilación pulmonar y la perfusión (V/Q)
En este artículo
Resumen
En este trabajo, describimos la implementación de la resonancia magnética pulmonar funcional resuelta en fase como una técnica de resonancia magnética de protones sin agente de contraste para la evaluación de la ventilación pulmonar y la dinámica de la perfusión. Validado y aplicable en diferentes campos y grupos de edad, podría mejorar la toma de decisiones clínicas en el futuro al ayudar en la cuantificación de enfermedades y el seguimiento de la terapia.
Resumen
La descomposición de Fourier es un método de resonancia magnética de 1 H sin agente de contraste para la evaluación de la perfusión pulmonar (Q) y la ventilación (V). Después del registro de la imagen, se analizan las series temporales de cada vóxel con respecto a los componentes de frecuencia cardíaca y respiratoria.
Utilizando una secuencia estándar de eco de gradiente estropeado en 2D con una resolución temporal de ~300 ms, se desarrolló un algoritmo de clasificación de imágenes para producir imágenes pulmonares funcionales resueltas en fase (PREFUL) con una resolución temporal aumentada. Por lo tanto, es factible evaluar los bucles de volumen de flujo regional (FVL) durante la respiración con volumen corriente y representar la propagación de la onda de pulso durante el ciclo cardíaco. Este método se puede aplicar a 1.5T o 3T con hardware MR estándar sin necesidad de programación de secuencia, ya que el protocolo descrito se puede implementar con la secuencia SPGRE predeterminada en la mayoría de los sistemas.
La resonancia magnética de ventilación PREFUL se ha validado utilizando imágenes de gas 129Xe y 19F con buena concordancia regional. La resonancia magnética PREFUL ponderada por perfusión se ha validado mediante SPECT y resonancia magnética mejorada con contraste dinámico (DCE). PREFUL se ha probado en un entorno de doble centro y doble proveedor, y actualmente se aplica en varias pruebas multicéntricas en curso. Además, es factible en una gama de intensidades de campo (0,55T-3T) y diferentes grupos de edad, incluidos los recién nacidos.
La resonancia magnética cuantitativa V/Q PREFUL se ha utilizado en pacientes con fibrosis quística, enfermedad pulmonar obstructiva crónica, hipertensión pulmonar tromboembólica crónica y enfermedad por coronavirus-2019 para cuantificar la enfermedad y monitorear el cambio de tratamiento después de la terapia. Además, se ha demostrado que las imágenes PREFUL V/Q predicen la pérdida del trasplante debido a la disfunción crónica del aloinjerto pulmonar en pacientes después del trasplante pulmonar. En resumen, PREFUL MRI es una técnica validada para la ventilación cuantitativa y la imagen de onda de pulso/perfusión pulmonar para la detección, cuantificación y seguimiento del tratamiento de la enfermedad pulmonar regional con un potencial valor añadido a la rutina clínica actual.
Introducción
El sistema respiratorio, con sus intrincados mecanismos, es vulnerable a diversas enfermedades. Cabe destacar que las afecciones respiratorias crónicas como la enfermedad pulmonar obstructiva crónica (EPOC), la fibrosis quística (FQ) y la hipertensión pulmonar tromboembólica crónica (HPTEC) reducen considerablemente la esperanza de vida1. Como resultado, el diagnóstico temprano, el seguimiento y la evaluación de la respuesta terapéutica se han vuelto primordiales.
Las pruebas de función pulmonar (PFT) pueden derivar parámetros globales de la función pulmonar como el índice de Tiffeneau-Pinelli, definido como la relación entre el volumen espiratorio forzado en un segundo (FEV1) y la capacidad vital forzada (FVC)2. Dichos parámetros están bien establecidos en la rutina clínica, pero carecen de información regional y requieren un alto nivel de cumplimiento por parte del paciente. En este sentido, las imágenes pueden ofrecer información adicional y posibilidades para parámetros más sensibles. La tomografía computarizada (TC) ofrece imágenes de alta resolución de la morfología parenquimatosa, y técnicas recientes como el mapeo de respuesta paramétrica también recuperan información funcional3. Sin embargo, la tomografía computarizada por emisión de fotón único (SPECT) sigue siendo el estándar de oro actual para describir la ventilación y la perfusión (V/Q) en el pulmón4. Comunes a todos, las modalidades de imagen mencionadas requieren la exposición a radiaciones ionizantes, lo que requiere una consideración especial en casos de monitoreo y grupos vulnerables. En consecuencia, hay un esfuerzo continuo para promover la resonancia magnética como una modalidad alternativa.
Inherentemente, el pulmón es un órgano difícil para la resonancia magnética debido a su baja densidad de protones y su rápida decaimiento de la señal5. Entre la multitud de enfoques, las soluciones más extendidas incluyen el uso de gas hiperpolarizado (p. ej., resonancia magnética de 129Xe) para la ventilación6 y la aplicación de agentes de contraste intravenosos a base de gadolinio para la representación de la perfusión7. Estos métodos ofrecen una alta relación señal-ruido (SNR) y son ampliamente considerados como métodos de referencia en la comunidad de RM. Un enfoque más reciente evita la aplicación de cualquier agente de contraste y es factible con la RM de protones convencional en respiración libre con un tiempo total de adquisición de ~1 min/corte. De este modo, se evitan los posibles acontecimientos adversos y los efectos a largo plazo de los agentes de contraste, recientemente debatidos, y se facilita la diseminación sin necesidad de hiperpolarización adicional y de hardware multinuclear. Además, el problema de encontrar un estado de inflado adecuado, que puede afectar alos valores de defecto de ventilación derivados 8, se evita mediante la adquisición de respiración libre.
Este enfoque indirecto basado en señales de RM fue introducido por primera vez por Zapke et al., quienes utilizaron la relación recíproca de la señal ponderada por protones S y el volumen pulmonar V: S ~ 1 / V.9 Se basa en el proceso de transformación de imágenes adquiridas en la respiración libre a un estado de inflado común (generalmente en una posición intermedia entre el final de la espiración y el final de la inspiración), compensando así el movimiento y permitiendo analizar las series de tiempo de la señal en cada vóxel. A partir de entonces, se puede derivar una medición de la ventilación a partir de estas llamadas imágenes registradas utilizando la ecuación (1) de Klimeš et al.10:
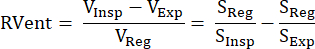 (1)
(1)
Con los volúmenes/señales en inspiración (Insp), caducidad (Exp) y estado registrado (Reg). A partir de entonces, el método se amplió introduciendo la descomposición de Fourier para diferenciar entre las modulaciones de señal asociadas con la frecuencia de la respiración (ventilación) y la frecuencia de pulso (perfusión) y, por lo tanto, derivar un mapa V/Q perfectamente adaptado espacialmente a partir de una adquisición11. Esto es posible gracias a la brecha típica entre la respiración y las frecuencias cardíacas, de modo que ambos componentes, que están uno encima del otro en el dominio del tiempo, se discriminan efectivamente en el dominio de la frecuencia mediante el análisis de Fourier. Después de la transición de campo bajo (0,35T) a 1,5T con una secuencia de precesión libre de estado estacionario equilibrada optimizada (bSSFP)12, este método comenzó a ganar más atención con varios estudios de seguimiento 13,14,15.
Dado que la respiración y el pulso están sujetos a variabilidad y las imágenes bSSFP (compensadas por gradiente) disponibles comercialmente a 1,5T pueden dar lugar a artefactos de banda sustanciales (líneas claras de vacío de señal), se propuso un método relacionado con la secuencia de eco de gradiente estropeado (SPGRE) en combinación con un filtrado amplio de paso bajo y paso alto16,17. Esto captura el espectro más complejo de modulaciones reales relacionadas con la respiración y el pulso. El siguiente cálculo de la amplitud en el dominio del tiempo evita la necesidad de seleccionar un pico de frecuencia específico. Se logró una optimización adicional dividiendo el registro típico de un solo paso hacia un estado de referencia en dos pasos separados. Por lo tanto, se utiliza el hecho de que durante la respiración libre se adquieren una gama de diferentes fases de respiración entre el final de la inspiración y el final de la espiración, con diversos grados de deformación requerida hacia un estado fijo. Después de elegir varios grupos e identificar el grupo de las imágenes individuales, se realiza el siguiente procedimiento: 1) Registro dentro del grupo de estado de respiración respectivo, 2) Registro intergrupal paso a paso de un grupo adyacente al siguiente (por ejemplo, 1->2, 2->3,...) al grupo que representa el grupo de referencia. Este enfoque se amplió aún más mediante la estimación de fase para cada imagen para establecer una resolución temporal aparente más alta para facilitar el análisis de la dinámica de ventilación y perfusión, lo que llevó a la terminología de RM pulmonar funcional resuelta en fase (PREFUL) para diferenciar esta rama de otras técnicas relacionadas18. Los estudios de seguimiento utilizaron la información adicional proporcionada por los ciclos respiratorios y cardíacos completos y mostraron un aumento potencial de la sensibilidad de dichos parámetros 19,20,21.
La validación con el estándar de oro SPECT reveló un coeficiente de dados de ≥67% para las regiones defectuosas22, y la medición más directa de la ventilación con 129Xe mostró una correlación de porcentajes de defectos de ventilación ≥62% en una cohorte mixta de EPOC/FQ/sana23 y del 84% en una cohorte multicéntrica y multiproveedora de FQ24, que también demostró una correlación similar con el índice de aclaramiento pulmonar de PREFUL y 129Xe (r = 0,82 y r = 0,91). El análisis de perfusión del mismo estudio mostró que no hubo diferencias significativas en el solapamiento espacial con DCE entre los centros evaluados25. También se reportó la concordancia con el DCE y la concordancia de los resultados de PREFUL entre centros para un subestudio prospectivo que incluyó nueve centros26. Un análisis de reproducibilidad en pacientes con EPOC resultó en un coeficiente de variación inferior al 15% para todos los parámetros27. Los estudios actuales sugieren que el parámetro FVL tiene un mayor poder predictivo y sensibilidad para detectar cambios en el tratamiento en comparación con el parámetro de ventilación "estática", que solo tiene en cuenta las fases final inspiratoria y final espiratoria. Se demostró la capacidad de respuesta al tratamiento con mediciones de bucle de flujo-volumen regional (FVL) después del tratamiento con inhaladores con indacaterol-glicopirronio (IND/GLY) en la EPOC28. En concordancia, el parámetro FVL predijo la pérdida del injerto en los pacientes con doble trasplante pulmonar, mientras que la espirometría no pudo (P = 0,02 vs. P = 0,33)29. Los primeros estudios de factibilidad muestran que las imágenes pulmonares funcionales con PREFUL se pueden realizar en lactantes y neonatos que respiran libremente con hardware de resonancia magnética clínica estándar30,31. Glandorf et al. compararon los parámetros de PREFUL a 1,5T y 3T (secuencia SPGRE) y no encontraron diferencias significativas para la mayoría de los parámetros, que eran altamente reproducibles a pesar de la diferencia en la intensidad de campo32. Esto podría ser una ventaja importante, ya que no todos los sitios tienen acceso a escáneres de 1,5T o de menor intensidad de campo. Recientemente, se demostró la viabilidad y detección de síntomas persistentes después de la infección por COVID-19 a 0,55T mediante la evaluación de los datos de bSSFP con PREFUL33.
En resumen, a pesar de ser una técnica relativamente novedosa, PREFUL ha sido ampliamente estudiada. Se evaluaron criterios importantes como la validación con mediciones más directas y establecidas, la reproducibilidad, la sensibilidad para la patología y la capacidad de respuesta al tratamiento y los cambios en la progresión. Sin embargo, todavía son pocos los centros especializados que utilizan esta técnica a pesar de los bajos requisitos tecnológicos. Por lo tanto, el objetivo de este trabajo es resumir la metodología más reciente de PREFUL MR en forma escrita y visual. Esta información puede ser utilizada para establecer esta técnica en más centros y así, a largo plazo, conducir a una técnica más madura.
Protocolo
Este estudio recibió la aprobación del comité de ética de la Facultad de Medicina de Hannover, lo que garantiza que se adhirió a rigurosos estándares éticos durante todo el proceso de investigación. La investigación siguió estrictamente las directrices esbozadas en la Declaración de Helsinki, haciendo hincapié en la conducta ética de la investigación médica. Además, se obtuvo diligentemente el consentimiento informado de todos los participantes del estudio (o de sus padres o tutores legales) antes de su participación en el examen de resonancia magnética. Consulte la Figura 1 para obtener una descripción general simplificada de los pasos básicos del protocolo, que consisten en la adquisición, el registro, el filtrado y la clasificación y, finalmente, la síntesis del ciclo cardíaco y respiratorio. En las siguientes secciones, se describen con todo detalle todos los pasos involucrados.
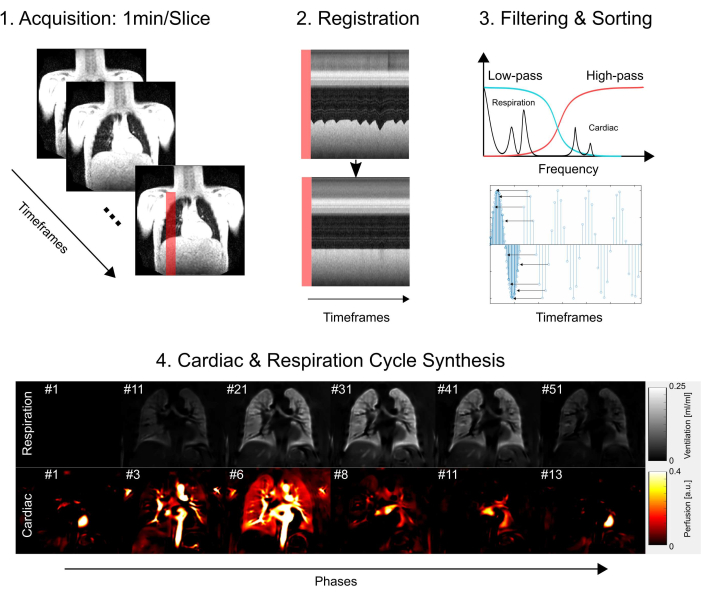
Figura 1: Resumen esquemático de los componentes principales de PREFUL. 1) Adquisición en respiración libre, que requiere 2) compensación de movimiento a través del registro, como se demuestra con los gráficos de perfil y permite un análisis vóxel por vóxel de los componentes de Fourier, como se ilustra en el paso 3) filtrado y clasificación. Después del filtrado de paso bajo (ventilación) y paso alto (perfusión), 4) se utiliza la fase estimada para clasificar las imágenes a una resolución temporal aparente más alta y sintetizar un ciclo cardíaco y respiratorio completo. Tenga en cuenta que este es un esquema simplificado y los detalles completos se describen en el manuscrito. Otros pasos, que se omiten en esta figura, incluyen la cuantificación de parámetros y la generación de informes. Abreviatura: PREFUL = pulmón funcional con resolución de fase. Haga clic aquí para ver una versión más grande de esta figura.
1. Contratación
- Reclutar a pacientes adultos o menores de edaden un ensayo de resonancia magnética PREFUL para pacientes y controles sanos en función de su diagnóstico de un trastorno pulmonar basado en un examen de espirometría y/o imágenes previas (p. ej., radiografías o tomografías computarizadas); capacidad de dar su consentimiento informado; capacidad de acostarse y permanecer quieto durante la duración de la resonancia magnética; y no se conocen contraindicaciones para la resonancia magnética (p. ej., implantes metálicos, claustrofobia).
- Excluir a las pacientes que estén embarazadas, que hayan tenido una cirugía pulmonar previa en los últimos 6 meses, que tengan dificultad respiratoria grave o que requieran suplementación continua de oxígeno, o que hayan tenido reacciones adversas previas a los agentes de contraste a base de gadolinio si se utiliza una resonancia magnética con contraste además de PREFUL.
- Reclutar controles sanos si no hayantecedentes conocidos de enfermedad pulmonar basados en el examen clínico y el autoinforme; las pruebas de función pulmonar son normales; son capaces de dar su consentimiento informado; son capaces de permanecer acostados y quietos durante la duración de la resonancia magnética; y no tienen contraindicaciones conocidas para la resonancia magnética.
- Excluir a las personas como controles sanos de acuerdo con los antecedentes actuales o pasados de tabaquismo, la exposición a toxinas pulmonares conocidas o riesgos ocupacionales, los antecedentes familiares de enfermedades pulmonares hereditarias, cualquier enfermedad crónica conocida que pueda influir en la función pulmonar y el embarazo.
- Adquirir formularios de consentimiento. Continuar con el protocolo si se obtiene un formulario de consentimiento informado por escrito del participante que contenga el propósito y los procedimientos de la investigación, los riesgos y beneficios potenciales, las garantías de confidencialidad, la duración del estudio y el derecho a retirarse sin consecuencias.
- Aplique los siguientes pasos adicionales cuando el reclutamiento incluya menores de edad.
- Obtener el consentimiento informado por escrito de al menos uno de los padres o tutores, además del consentimiento del menor.
- Presentar todo el proceso de una manera apropiada para su edad que sea comprensible para el menor.
- Para los menores más pequeños, use ayudas visuales, libros de cuentos o explicaciones simplificadas.
- Asegurarse de que el estudio sea pertinente para el grupo de edad y que no se incluya innecesariamente a los menores.
- Permitir que los menores estén acompañados por un adulto de confianza (por ejemplo, padre, tutor) durante todos los procedimientos relacionados con el juicio, a menos que esto interfiera con la integridad del juicio.
NOTA: Los pasos descritos asumen que el ensayo fue revisado y aprobado por el Comité de Ética.
- Aplique los siguientes pasos adicionales cuando el reclutamiento incluya menores de edad.
2. Adquisición
- Lleve a cabo el procedimiento de seguridad previo a la exploración.
- Antes de una resonancia magnética, realice una evaluación previa detallada de los pacientes para identificar posibles contraindicaciones, como cirugías previas, dispositivos implantados, tatuajes o exposición a fragmentos de metal.
- A su llegada, eduque a los pacientes sobre las propiedades magnéticas y los riesgos del procedimiento.
- Indique a los pacientes que se quiten todos los artículos metálicos personales, incluidas joyas, relojes y ciertos componentes de la ropa, y que les proporcionen una bata si es necesario.
- Pida a un profesional capacitado que inspeccione visualmente a los pacientes en busca de objetos metálicos que se hayan pasado por alto.
- Examine todos los dispositivos médicos o implantes para verificar la compatibilidad con la resonancia magnética.
- Asegúrese de que se implementen protocolos de emergencia para la seguridad del personal y del paciente.
- Posición del participante y escaneo
- Oriente al paciente de cabeza y colóquelo en posición supina en un sistema de 0,55T, 1,5T o 3T.
- Proporcione protección auditiva, un timbre de emergencia, almohadillas y una manta para mayor seguridad y comodidad.
- Coloque una bobina flexible multicanal justo debajo de la barbilla para garantizar una sensibilidad óptima de la bobina en todas las áreas pulmonares.
- Asegure la colocación de la bobina para mantener la estabilidad sin obstaculizar la respiración del paciente.
- Indique al paciente que cierre los ojos y luego marque el centro del pulmón con el láser de resonancia magnética.
- Alinee el centro pulmonar con el isocentro y permita que el paciente vuelva a abrir los ojos.
- Exploración de los localizadores iniciales para establecer una orientación general, seguida de una exploración morfológica transversal para identificar la bifurcación traqueal.
- Anclar el primer corte coronal en la bifurcación traqueal como un punto de referencia consistente para mejorar la reproducibilidad.
- Dependiendo del protocolo de exploración, capture tres cortes espaciados con una distancia de corte a corte (medida de borde a borde) del 100% (del grosor del corte) o adquiera múltiples cortes que abarquen todo el pulmón con una distancia del 20% o 33%.
- Adquiera cada rebanada completamente por separado y no intercalada.
- Cargue las imágenes reconstruidas en el sistema de comunicación y archivo de imágenes (PACS) para su posterior acceso y análisis. Alternativamente, para cumplir con los estándares de privacidad y protección de datos, exporte manualmente las imágenes a una unidad de red designada o a una solución de almacenamiento similar.
NOTA: Para obtener información detallada sobre el protocolo y los parámetros de secuencia, consulte la Tabla 1 y la Tabla 2. Para obtener una representación visual de la posición de los sectores, consulte la figura 2.
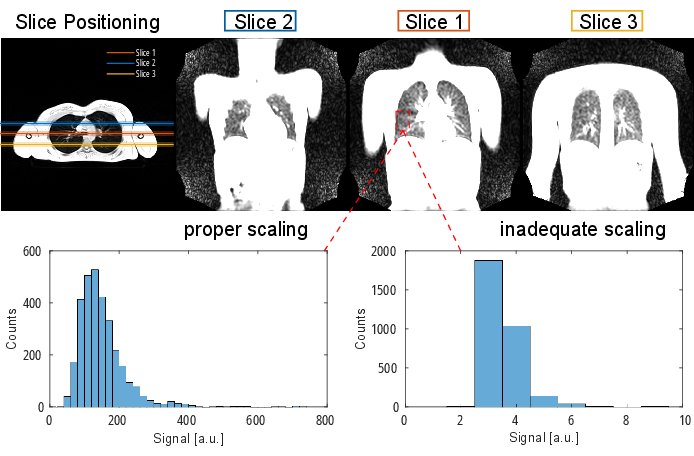
Figura 2: Un posicionamiento de corte típico para un experimento PREFUL visualizado con un eco de gradiente 3D en orientación transversal. Tenga en cuenta que el primer corte se coloca en la bifurcación traqueal como un punto de referencia reproducible. La2ª y3ª rebanadas se colocan con un espacio de rebanada del 100% en las direcciones anterior y posterior. Los histogramas ejemplares muestran distribuciones de valores con un escalado adecuado e inadecuado (bajo). Esto último conduce a un bajo rango dinámico y pérdida de precisión. También se debe evitar un escalado alto inadecuado, que conduce a un recorte (no se muestra aquí). Abreviatura: PREFUL = pulmón funcional con resolución de fase. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Esquema típico de un protocolo PREFUL. Después de un localizador, se adquiere un volumen 3D del pulmón en orientación transversal. Esta adquisición se utiliza para planificar las siguientes adquisiciones de PREFUL (consulte también la Tabla 2 para la configuración de la secuencia y la Figura 2 para el posicionamiento de los sectores). Se pueden añadir otras secuencias en función del estudio. Abreviatura: PREFUL = pulmón funcional con resolución de fase. Haga clic aquí para descargar esta tabla.
Tabla 2: Resumen de los parámetros de secuencia para la adquisición de PREFUL con secuencia de eco de gradiente estropeada. Abreviaturas: PREFUL = pulmón funcional con resolución de fase; SPGRE = secuencia de eco de gradiente estropeada. Por favor, haga clic aquí para descargar esta tabla.
3. Posprocesamiento
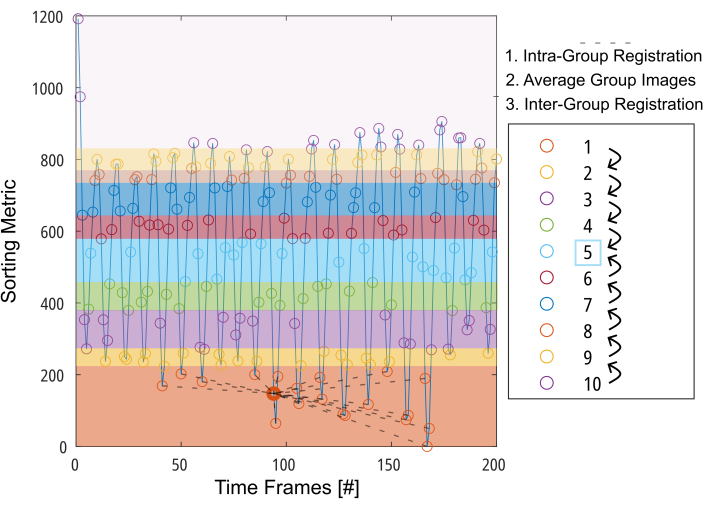
Figura 3: Presentación esquemática del registro orientado a grupos para minimizar la deformación requerida para la compensación de movimiento. Después de dividir las imágenes (representadas por círculos) en 10 grupos en función de una métrica de clasificación (por ejemplo, área pulmonar segmentada), las imágenes se registran dentro de cada grupo en una posición intermedia (ilustrada con líneas discontinuas para el grupo 1). A continuación, las imágenes registradas se promedian y se utilizan para el paso final del registro entre grupos paso a paso hacia el grupo intermedio. Abreviatura: GOREG = registro orientado a grupos. Haga clic aquí para ver una versión más grande de esta figura.
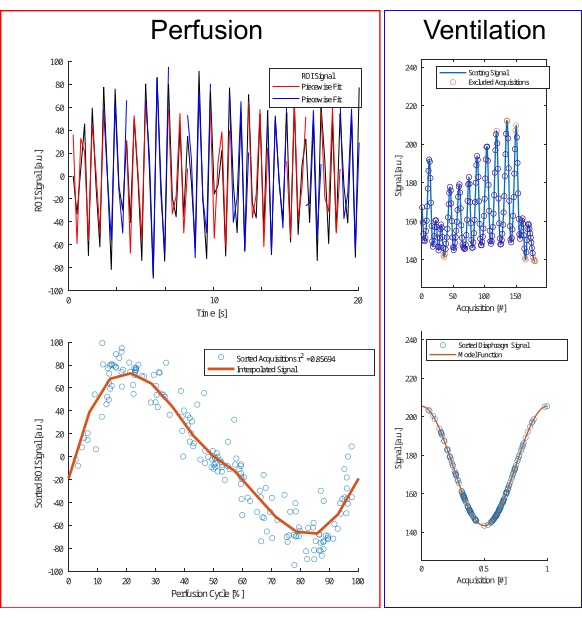
Figura 4: Ilustración del algoritmo de clasificación para perfusión y ventilación. Para la perfusión (izquierda), se realiza un ajuste por piezas (fila superior) para estimar la fase y recurrir las adquisiciones (fila inferior). Para la ventilación (derecha), los valores atípicos se excluyen (fila superior) y se ordenan según un modelo de coseno (fila inferior) basado en la amplitud y el diferencial de amplitud para distinguir entre las fases de espiración e inspiración. Haga clic aquí para ver una versión más grande de esta figura.
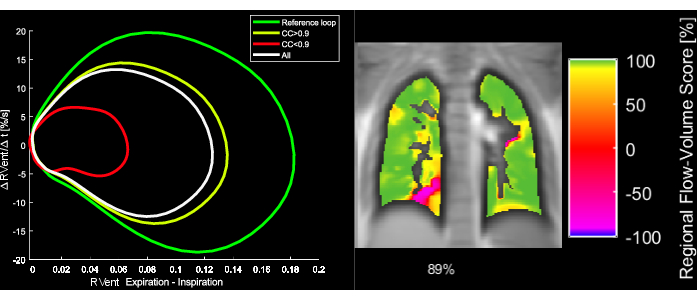
Figura 5: Ejemplos de bucles de flujo-volumen y la métrica de correlación FVL correspondiente de una paciente femenina de 43 años con EPOC. Tenga en cuenta que al cambiar la FVL, la FVL-CM disminuye. Abreviaturas: FVL = bucle flujo-volumen; FVL-CM = métrica de correlación FVL; EPOC = enfermedad pulmonar obstructiva crónica. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 3: Aplicación de umbrales a los mapas de parámetros y combinación de mapas de defectos. Haga clic aquí para descargar esta tabla.
- Registro
NOTA: En la siguiente sección, se describe el procedimiento para el registro no rígido a un volumen de referencia (preferiblemente el nivel medio de respiración) utilizando un esquema orientado a grupos (GOREG) para la compensación de la respiración y el movimiento cardíaco.- Recupera las imágenes.
- Inicialmente, realice la segmentación pulmonar en todas las imágenes no registradas, con un U-Net entrenado y aplique un filtro de paso bajo con un corte de 0,7 Hz para obtener una estimación de las fases respiratorias.
NOTA: Esto iniciará la canalización de procesamiento totalmente automatizada, que realizará los pasos posteriores en segundo plano. Los pasos de procesamiento demostrados y descritos no se limitan a una aplicación o lenguaje específico y, por lo tanto, se pueden implementar en una aplicación personalizada con muchos lenguajes de programación. - Clasifique la alta cantidad de vóxeles segmentados como inspiración y la baja cantidad como caducidad.
- Agrupe las imágenes dividiéndolas en percentiles 10, asegurándose de que cada grupo de los 10 grupos resultantes contenga el mismo número de imágenes.
- Seleccione ANTs34 (BSplineSyN con métrica de correlación cruzada) o Forsberg35,36 (expansión polinómica con regularización elástica y fluida) como algoritmo de registro.
- Realizar el registro interno de cada grupo hacia la posición pulmonar intermedia del grupo respectivo.
- Promedie los resultados del grupo para obtener una imagen para cada grupo.
- Llevar a cabo el inter-registro yendo desde cada imagen de grupo hacia el siguiente vecino en la dirección del5º grupo.
- Aplique la cadena de deformaciones a las imágenes originales, según sea necesario para alcanzar la posición respiratoria representada por la imagen promediada en el grupo 5. Por ejemplo, para la imagen 36, que pertenece al grupo 3, se aplican los siguientes campos de deformación : 36->Imagen 57 (~Posición pulmonar intermedia en el grupo 3) -> Paso 3->4 -> Paso 4->5.
NOTA: Para obtener una descripción detallada del procedimiento GOREG, consulte la Figura 3. Realice el registro con computación paralela para reducir el tiempo de procesamiento. El registro GOREG se realiza para minimizar la cantidad de deformación requerida para cada paso de registro y, por lo tanto, garantizar una convergencia estable del algoritmo. Sin embargo, el registro también se puede realizar con un solo paso de deformación hacia la posición pulmonar intermedia. Si bien todos los estudios 2D PREFUL publicados utilizaron ANT, Forsberg arroja resultados hasta 6 veces más rápidos, con resultados de calidad comparable a los reportados por un estudio 3D PREFUL37. Los resultados ejemplares de este informe se generaron con el registro de Forsberg. Consulte la Figura 1 para ver una ilustración del efecto del registro en el movimiento del diafragma.
- Filtrado general
- Elimine el ruido de las imágenes registradas mediante el filtrado guiado por imágenes38, empleando la imagen registrada promediada temporalmente como imagen guía. Aplique la siguiente configuración: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- Para el análisis de ventilación y perfusión, utilice un filtro de paso bajo o de paso alto con un corte a 0,7 Hz para suprimir el otro componente respectivo. Excluya las primeras 20 imágenes de todos los pasos de procesamiento posteriores, excepto para el cálculo de perfusión cuantificado, para garantizar el estado estable en las series temporales incluidas.
NOTA: Puede ser necesario un cambio del límite si los sujetos tienen una frecuencia respiratoria superior a ~40 respiraciones/min.
- Segmentación
NOTA: La segmentación final se realiza utilizando las imágenes registradas en posición pulmonar intermedia en un procedimiento de dos pasos como se describe a continuación.- Realice la segmentación del límite pulmonar (ROI pulmonar) en las imágenes registradas promediadas temporalmente con un U-Net entrenado o manualmente.
- A continuación, excluya los vasos centrales grandes para refinar la segmentación del límite pulmonar y obtener una región de interés o ROI para el parénquima pulmonar.
- Perfusión
NOTA: Se requieren los siguientes pasos para estimar con precisión la fase cardíaca de cada imagen de la serie adquirida, que se muestrean a una frecuencia relativamente baja (~3-5 imágenes/s), especialmente en comparación con la frecuencia cardíaca (normalmente 40-90 lpm). El reordenamiento de los datos de acuerdo con las fases cardíacas determinadas se utiliza para obtener el ciclo cardíaco completo con una resolución temporal mejorada, superando la frecuencia de muestreo de la adquisición de datos18 (consulte la Figura 4 para una ilustración del procedimiento de clasificación). Para la estimación de fases, se requiere un ROI de búsqueda con una señal ponderada por perfusión fuerte. Emplee un algoritmo de búsqueda iterativo, como se indica acontinuación: 22.- Conecte el ROI del límite pulmonar para incluir el mediastino en la búsqueda ROI.
- Genere un mapa simple ponderado por perfusión calculando la desviación estándar a través de la secuencia de imágenes.
- Identifique las regiones correspondientes al percentil 98 de este mapa dentro del ROI de la búsqueda como ROI inicial para los pasos posteriores.
- Realice el ajuste por piezas, aumentando el tamaño de los puntos de siembra siempre que mejore el rendimiento del ajuste.
- Clasifique el ROI de las semillas expandidas de acuerdo con su rendimiento adecuado.
- Combine de forma iterativa los ROI de las semillas mejor expandidos con el segundo mejor, el tercero mejor, etc., hasta que la combinación no mejore la métrica o se consideren todos los ROI de las semillas. Considere que el ROI final es el ROI del vaso utilizado para la estimación de la fase cardíaca.
- Promedie espacialmente la señal dentro de la estimación de fase optimizada para producir una serie de tiempo de señal para la estimación de fase.
- Realice la estimación por partes segmentando la señal en porciones más pequeñas utilizando los máximos locales de la señal, seguido de un ajuste sinusoidal por partes considerando parámetros como la amplitud, el desplazamiento de fase y la frecuencia (Figura 4).
- Ordene las fases de las imágenes para representar un ciclo cardíaco.
- Emplee la regresión del kernel de Nadaraya-Watson con un kernel gaussiano (sigma = 0.1) para interpolar 15 fases en una cuadrícula de tiempo espaciada uniformemente que abarca un solo ciclo cardíaco.
NOTA: Consulte la Figura 1 para ver un subconjunto de un ejemplo de un ciclo cardíaco completo sintetizado de un voluntario sano, comenzando en la diástole, pasando a la sístole y volviendo a la diástole.
- Ventilación
NOTA: Para el análisis de perfusión, tenga en cuenta que la frecuencia cardíaca permanece relativamente estable con variaciones de amplitud insignificantes. Por el contrario, la ventilación tiende a experimentar más variaciones en el volumen corriente y la frecuencia, lo que lleva a diferentes estados respiratorios con fases respiratorias idénticas que no siempre tienen la misma amplitud. Inspirado en el enfoque de autocompuerta de Fischer et al., es esencial categorizar la ventilación en función de la amplitud de la señal.- Excluya los valores atípicos extremos utilizando reglas empíricas (datos por debajo del percentil 5 o por encima del percentil 97).
- Dive el rango de amplitud R y el desplazamiento C de la serie de tiempo de señal creada para la agrupación de registros.
- Defina una función modelo A(t) con una frecuencia seleccionada arbitrariamente fRespiración (aquí 0,3 Hz):
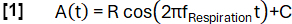
- Clasifique los datos en estados de inspiración y caducidad en función de la pendiente.
- Logre una determinación de fase más refinada de acuerdo con la función del modelo:
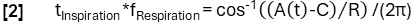
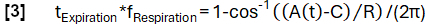
- Posteriormente, alinee las muestras en función de su fase y aplique la regresión del kernel de Nadaraya-Watson para calcular la ventilación a intervalos uniformemente espaciados durante el ciclo respiratorio.
- Calcule la ventilación regional (RVent) para cada fase en analogía con la ecuación 1, sustituyendo la fase de inspiración por la fase respectiva.
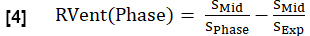
NOTA: Consulte la Figura 1 para ver un subconjunto de un ciclo respiratorio completo sintetizado ejemplar de un voluntario sano, comenzando en la espiración, pasando a la inspiración y luego volviendo a la espiración. Para ver una ilustración del algoritmo de ordenación, consulte la figura 4.
- Cálculo de parámetros
NOTA: Utilizando la respiración completa sintetizada y los ciclos cardíacos, se pueden derivar más parámetros. A continuación se describe una selección de los parámetros más importantes. - Ventilación regional (RVent)
- Utilizando la fase inspiratoria se deriva RVent según:
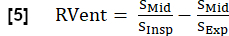
- Utilizando la fase inspiratoria se deriva RVent según:
- Métrica de correlación flujo-volumen-bucle (FVL-CM)
NOTA: Para evaluar todas las fases de la respiración, se realizan una serie de pasos para generar una resonancia magnética equivalente al análisis de FVL en analogía con las pruebas de función pulmonar.- Calcule la pendiente de ventilación regional (RVent) como sustituto del flujo utilizando la primera derivada temporal de RVent. Emplee un cociente de diferencia simétrica con longitud de paso h:
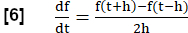
- Opcionalmente, se muestran las pendientes regionales o promediadas del RVent en función del RVent respectivo, generando así un equivalente PREFUL al análisis FVL.
- Determine un ROI de referencia identificando la región conectada más grande con valores de RVent en el rango de percentil 80 a 90 en el ROI del parénquima pulmonar.
- Promedie los bucles de flujo-volumen dentro del ROI de referencia determinado.
- Para determinar la similitud de cada CVF pulmonar con la referencia, se correlacione de forma cruzada cada CVF en el ROI del parénquima pulmonar con la referencia con rezago cero:
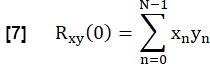
- Normalízalo según:
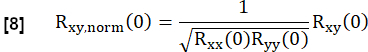
Aquí, x e y representan la referencia y la respectiva curva de flujo RVent.
NOTA: Tenga en cuenta que se emplea el retraso cero para que la ventilación retrasada dé como resultado una correlación más baja.
NOTA: Consulte la Figura 5 para obtener una ilustración del cálculo de FVL y la métrica FVL-CM derivada.
- Calcule la pendiente de ventilación regional (RVent) como sustituto del flujo utilizando la primera derivada temporal de RVent. Emplee un cociente de diferencia simétrica con longitud de paso h:
- Perfusión cuantificada
NOTA: La cuantificación se realiza de acuerdo con Glandorf et al. utilizando las primeras imágenes adquiridas durante el estado transitorio36.- Normalice las primeras cuatro imágenes registradas al nivel medio de inspiración utilizando la cantidad de vóxel pulmonar A calculada en el paso 3.1.2. Esta reducción de la modulación causada por la variación de la densidad de protones se expresa como:
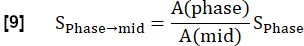
- Realice un ajuste exponencial para estimar la señal asociada con la magnetización máxima utilizando el modelo:
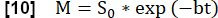
- Determinar un mapa Q relacionado con la perfusión parenquimatosa utilizando la fase del ciclo cardíaco que muestra las señales más máximas en el ROI del parénquima pulmonar.
- Para la estimación de la fracción sanguínea regional (BF), normalice el valor S0 promediando los valores por encima del percentil 99,99 en la búsqueda ROI (vóxel de sangre completa):
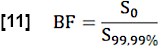
- Estime la fracción de intercambio (FE) durante un ciclo cardíaco considerando la relación entre la diferencia de señal mediana máxima entre el estado estacionario (SS) y el estado inicial determinado por S0 y la diferencia de señal relacionada con el flujo Q:
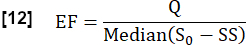
- Determine la frecuencia cardíaca fCorazón en 1/s a partir del ROI del vaso utilizando el análisis de Fourier (frecuencia correspondiente al pico más grande).
- Calcule la perfusión (QQ) final cuantificada en mL∙min-1∙100 mL-1 de la siguiente manera:
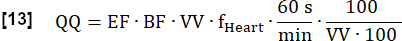
NOTA: Aquí, el volumen del vóxel (VV) se cancela [mL/mL] y el factor de conversión 60 s/min y el factor de convención 100/100 se utilizan para mostrar el resultado final en [mL∙min-1∙100 mL-1]. EF y BF son proporciones adimensionales.
- Normalice las primeras cuatro imágenes registradas al nivel medio de inspiración utilizando la cantidad de vóxel pulmonar A calculada en el paso 3.1.2. Esta reducción de la modulación causada por la variación de la densidad de protones se expresa como:
- Umbrales y estadísticas
- Describa estadísticamente los parámetros mencionados anteriormente para el segmento central y todos los segmentos con valor medio (todos los valores/valores del segmento central) y desviación estándar (todos los valores / solo los valores del segmento central).
- Además, normalice la desviación estándar al coeficiente de variación para obtener una cuenta relativa de la dispersión. Seleccione el valor medio y el coeficiente de variación como resultados estadísticos finales.
- Aplique umbrales a los mapas de parámetros para generar mapas de defectos y derivar valores de porcentaje de defectos (consulte la Tabla 3).
- Clasificar los valores por debajo de los umbrales como defecto de ventilación o perfusión (VD/QD). Combine estos mapas aún más para cuantificar la superposición de defectos y regiones normales (clases V/Q), incluidas las siguientes combinaciones, como se muestra en la tabla cuádruple de la Tabla 3:
- Calcule el porcentaje de defectos de las clases Defecto de ventilación (VD), Defecto de perfusión (QD) y Ventilación/Perfusión (V/Q) como el número de vóxeles con la clase respectiva en relación con los vóxeles totales del parénquima pulmonar:
Porcentaje de defectos = #DefectVoxels/#LungParenchyma - Calcule este porcentaje de defectos para cada corte y los cortes coronales compuestos. Para este estudio, elija el enfoque combinado, donde un defecto de ventilación se determina mediante una operación OR: VD = VD(RVent) O VD(FVL-CM).
NOTA: El análisis descrito se realizó con una aplicación de software comercial (consulte la Tabla de materiales) utilizando la caja de herramientas de registro de Forsberg.
| Parámetro | Umbral | Comentario |
| RVent | Percentil 90 * 0,4 | Umbral adaptativo |
| FVL-CM | 90% | Umbral fijo |
| Q | Percentil 90 * 0,15 | Umbral adaptativo |
| V/Q | SIN QD | QD |
| SIN VD | Normal | Desajuste de VQ (QD exclusivo) |
| VD | Discrepancia de VQ (VD exclusivo) | Coincidencia de defectos de VQ |
Resultados
La parte inferior de la Figura 2 ilustra las consecuencias de un escalado adecuado e inadecuado con el correspondiente efecto en el rango dinámico. La Fig. 6 muestra la distribución no homogénea de la señal, que es representativa de los escaneos sin y con normalización de bobina. Se recomienda evitar un rango dinámico bajo e imágenes sin normalización de bobina.
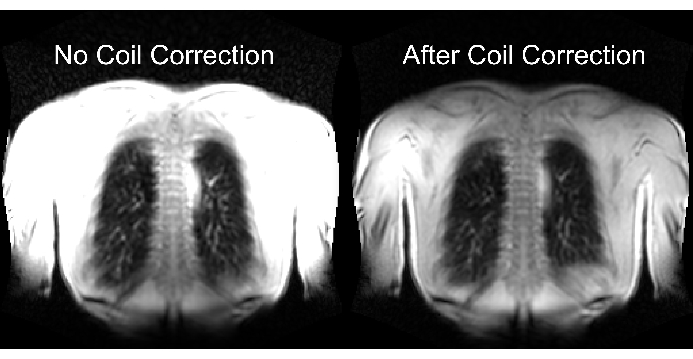
Figura 6: Imágenes ejemplares después de la adquisición sin corrección de bobina (incorrecta) y con corrección de bobina (correcta). Obsérvese la mejora artificial de la señal en los límites del cuerpo cerca de los elementos de la bobina. Haga clic aquí para ver una versión más grande de esta figura.
En la figura 7 se muestra la segmentación automática correcta y fallida. Tenga en cuenta que la segmentación fallida no incluye todos los vóxeles pulmonares, lo que falsificará análisis y estadísticas posteriores. Se requiere especial cuidado para los casos con infiltrados, ya que dichos vóxeles pueden clasificarse erróneamente como recipientes debido a su alta señal por los modelos de IA o no estar segmentados en absoluto.
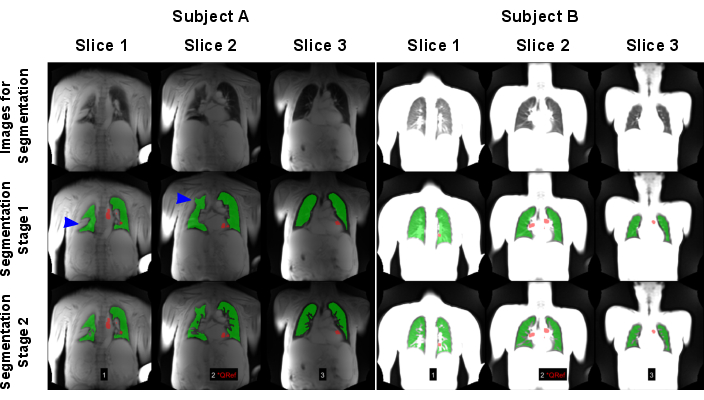
Figura 7: Un ejemplo de segmentación automatizada que da como resultado un resultado fallido (Sujeto A: hombre de 83 años con EPOC) y un resultado exitoso (Sujeto B: control sano femenino de 30 años). La primera fila muestra las imágenes, que se utilizaron como entrada para los modelos de IA. La segunda fila muestra los resultados de la primera etapa de segmentación que consiste en encontrar el límite pulmonar. La tercera fila muestra el resultado final después de la exclusión de los buques. Como se muestra en las flechas azules, el algoritmo se vio desafiado por las varianzas pulmonares de alta señal que causaron una detección incorrecta del límite pulmonar. Tenga en cuenta que las imágenes se normalizaron mediante la señal máxima, lo que condujo a resultados diferentes debido a la falta de normalización de la bobina del escaneo realizado en el sujeto A. Las regiones rojas muestran los ROI, que se detectaron automáticamente para la clasificación de la fase de perfusión. Abreviaturas: EPOC = enfermedad pulmonar obstructiva crónica; ROI = regiones de interés. Haga clic aquí para ver una versión más grande de esta figura.
Las figuras 8 y 9 muestran mapas de parámetros representativos para un control sano (30 años, mujeres) y un paciente con EPOC (60 años, hombres). Nótese que el control sano muestra una ventilación y perfusión más homogéneas y, por lo tanto, menos vóxeles defectuosos. Los informes correspondientes de las estadísticas de ROI se pueden encontrar en la Tabla 4 y la Tabla 5.
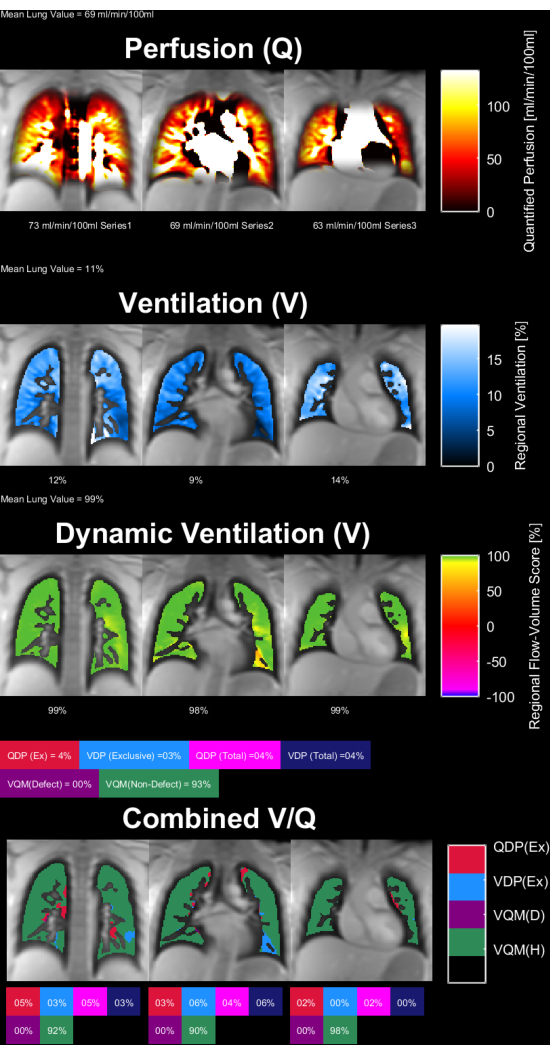
Figura 8: Mapas de parámetros PREFUL de una mujer de 30 años de edad sana control. Los mapas de perfusión (1ª fila), ventilación regional (2ª fila), métrica de correlación de bucle de flujo-volumen (3ª fila) y mapas V/Q con umbral (4ª fila). Obsérvese la distribución homogénea de los valores parenquimatoso y los bajos porcentajes de defectos. Abreviaturas: PREFUL = pulmón funcional con resolución de fase; V = ventilación; Q = perfusión. Haga clic aquí para ver una versión más grande de esta figura.
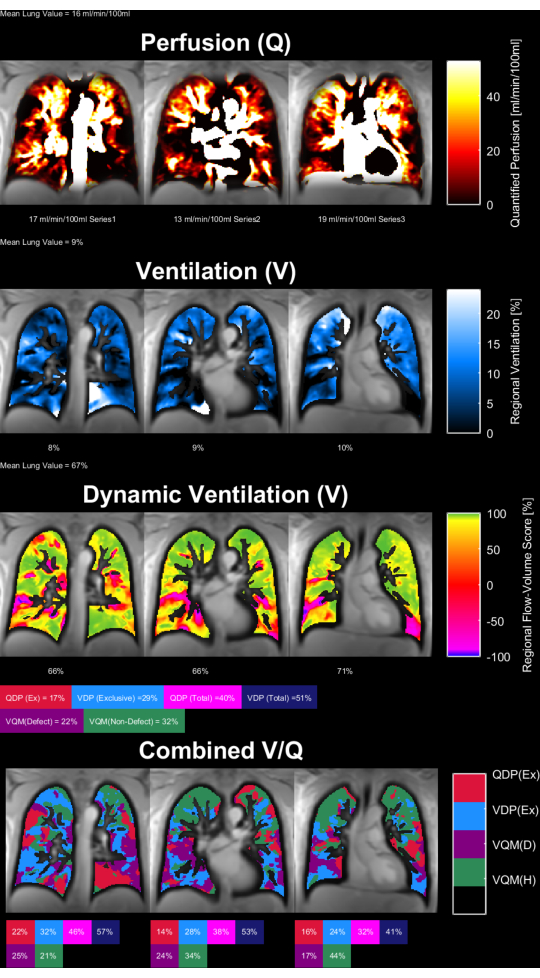
Figura 9: Mapas de parámetros PREFUL de un paciente masculino con EPOC de 60 años. Los mapas de perfusión (1ª fila), ventilación regional (2ª fila), métrica de correlación de bucle de flujo-volumen (3ª fila) y mapas V/Q con umbral (4ª fila). Obsérvese la distribución heterogénea de los valores parenquimatosos y los altos porcentajes de defectos. Abreviaturas: EPOC = enfermedad pulmonar obstructiva crónica; PREFUL = pulmón funcional con resolución de fase; V = ventilación; Q = perfusión. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 4: Reporte ejemplar de los parámetros PREFUL obtenidos para un control sano (mujer de 30 años). Obsérvense los bajos valores de coeficiente de variación y defecto, que están en línea con los mapas de parámetros presentados en la Figura 8 para el mismo sujeto. Véanse también la Tabla 5 y la Figura 9. Abreviatura: PREFUL = pulmón funcional con resolución de fase. Haga clic aquí para descargar esta tabla.
Tabla 5: Reporte ejemplar de los parámetros PREFUL obtenidos para un paciente con EPOC (varón de 60 años). Obsérvense los altos valores de coeficiente de variación y defecto, que están en línea con los mapas de parámetros presentados en la Figura 9 para el mismo sujeto. Véanse también la Tabla 4 y la Figura 8. Haga clic aquí para descargar esta tabla.
Material complementario: Explicación animada del algoritmo PREFUL. Haga clic aquí para descargar este archivo.
Discusión
Pasos críticos
Uno de los escollos más comunes durante la adquisición es el escalado inadecuado de la señal, que provoca una pérdida de información durante la conversión DICOM por la reducción de la precisión de la representación digital de los datos. En consecuencia, esto puede provocar problemas durante la etapa de posprocesamiento. Otro escollo aún más crítico es la adquisición de múltiples rebanadas de forma intercalada. De este modo, la resolución temporal efectiva de los cortes individuales se reduce críticamente. Además, dependiendo de la distancia de las rebanadas, esto puede tener un impacto en el contraste de perfusión y la cuantificación, ya que el flujo de entrada se basa en espines frescos sin historial de magnetización. Se requiere un cuidado especial durante la configuración del protocolo, especialmente en lo que respecta a la intensidad del gradiente, el eco asimétrico, el ancho de banda y las imágenes paralelas. Las desviaciones de la configuración sugerida incluso para uno solo de estos parámetros pueden conducir a una TE y una resolución temporal inadecuadas.
El posprocesamiento consta de varios pasos, que deben seguirse en el orden descrito. Por ejemplo, un registro después del filtrado de paso bajo no tiene sentido. En consecuencia, el fallo en un paso conduce a una avería durante los siguientes pasos. Esto hace que la etapa de registro sea especialmente importante. Dado que no existe un algoritmo de registro único, dependiendo de la implementación respectiva, los parámetros deben establecerse empíricamente. Sin un ajuste fino de estos parámetros, un registro falso impedirá la generación de cualquier resultado significativo. Otro paso crítico y que puede llevar mucho tiempo durante el posprocesamiento es la segmentación. Las segmentaciones falsas pueden llevar a cálculos de parámetros completamente erróneos (por ejemplo, al incluir regiones no pulmonares) en el informe final. Es más probable que estas segmentaciones erróneas ocurran con algoritmos de aprendizaje profundo, que están acostumbrados a ciertas apariencias de imágenes y se aplican a imágenes de otro proveedor/máquina con una apariencia ligeramente diferente. Por lo tanto, es obligatorio un control de calidad visual de la precisión de la segmentación, con posible corrección manual.
Solución de problemas
El procedimiento típico de solución de problemas es seguir todos los pasos uno por uno y verificar la plausibilidad de los resultados intermedios. El procedimiento para los pasos principales es el siguiente: Verifique que las imágenes se adquieran en respiración libre con la secuencia y los ajustes correctos. A continuación, compruebe que el rango dinámico de las señales es el adecuado (~50 UA en el parénquima pulmonar). Si aún se dispone de datos sin procesar, repita la reconstrucción de las imágenes con un factor de escala adecuado, evitando la necesidad de una nueva adquisición de datos. Compruebe que el registro se ha realizado sin artefactos importantes y movimiento restante. A continuación, compruebe si los ROI pequeños muestran una serie temporal con modulaciones esperadas relacionadas con la ventilación y la perfusión. A continuación, compruebe si los filtros aplicados alteran las imágenes de la manera esperada (por ejemplo, sin modulaciones de alta frecuencia en datos filtrados de paso bajo). Comprueba si los ciclos respiratorio y cardíaco sintetizados son fisiológicos y no muestran saltos bruscos. Compruebe la precisión de la segmentación. Tenga en cuenta que puede ser necesaria una búsqueda en un nivel de resolución más preciso tan pronto como se identifique el paso principal, durante el cual se produce el problema.
Limitaciones
Aunque se sabe que el protocolo presentado produce resultados reproducibles y sensibles, el número de pasos y parámetros involucrados durante la adquisición y el posprocesamiento permiten una optimización casi infinita y están entrelazados. Por lo tanto, debe seguirse un enfoque ascendente abordando primero las optimizaciones del protocolo de secuencia (por ejemplo, en lo que respecta a la SNR y la relación contraste-ruido funcional). Para las siguientes optimizaciones de posprocesamiento, podría ser útil una realidad fundamental predefinida en forma de un modelo de pulmón digital40. Tal como se presenta, este modelo imita una adquisición de respiración libre e incluye varias clases para simular defectos de ventilación/perfusión. Incluyendo una deformación conocida debido al movimiento, los algoritmos de registro también se pueden probar directamente. A pesar de estas ventajas, cada modelo está inherentemente limitado por la precisión de mapear la realidad compleja a un modelo finito y simplificado.
Se encontró que los umbrales presentados en este protocolo mostraron resultados razonables para voluntarios sanos y en diferentes cohortes de pacientes mediante análisis empírico. Sin embargo, como se ha señalado anteriormente, es probable que sea necesario realizar ajustes en función de la secuencia, la intensidad de campo y la cohorte.
Una limitación general de PREFUL es el extenso posprocesamiento, que aún no está disponible como producto médico, aunque las primeras versiones en curso de Siemens Healthineers y BioVisioneers están disponibles para fines científicos en un entorno comercial o de colaboración científica. Los cálculos suelen implicar un procesamiento paralelo, lo que plantea demandas especialmente altas en la CPU y la RAM y puede requerir estaciones de trabajo modernas o soluciones de servidor para procesar eficazmente grandes cantidades de datos. Además, los lentos pasos de posprocesamiento impiden actualmente una presentación instantánea de los resultados, lo que sería deseable para el flujo de trabajo clínico.
Comparación con otros métodos
Existe una multitud de enfoques similares como PREFUL, incluido el predecesor de la descomposición de Fourier y sus otros derivados, como la descomposición de la matriz a lápiz41 y el enfoque ligeramente diferente Self-gated Non-Contrast-enhanced Functional Lung MRI (senceful MRI)42. Mientras que la descomposición de Fourier y métodos similares operan en el dominio de la frecuencia, PREFUL utiliza un filtrado de Fourier menos estricto y el cálculo posterior de las amplitudes en el dominio del tiempo. Por lo tanto, no es necesario seleccionar picos específicos correspondientes a la ventilación/perfusión. Esto puede resultar en una menor susceptibilidad a la variabilidad de la respiración, que se sabe que ocurre en sujetos humanos.
Mientras que PREFUL realiza la clasificación de imágenes, SENCEFUL utiliza la clasificación de líneas de k-espacio, lo que genera una mayor flexibilidad. Sin embargo, SENCEFUL requiere secuencias con capacidades de auto-compuerta, mientras que PREFUL se puede realizar con una secuencia convencional de eco de gradiente estropeado. De manera similar, bSSFP comúnmente utilizado en los enfoques basados en la descomposición de Fourier es conocido por una mejor SNR y contraste de flujo sanguíneo, pero generalmente requiere más optimización para la adquisición pulmonar, especialmente en 3T43. Sin embargo, aparte de eso, no hay ninguna razón para no combinar PREFUL con la adquisición de bSSFP44.
Todos estos enfoques basados en señales suponen que ciertas influencias de señal no deseadas, incluidas T1, T2/T2*, difusión, movimiento a través del plano y vóxeles perfundidos no ortogonalmente, son insignificantes. Mientras que la validación progresiva de PREFUL sugiere indirectamente que, en efecto, tales influencias no son críticas, Triphan et al. demostraron que existe una dependencia de la T1 y la TE efectivas, lo que se explica por el diferente peso de los componentes sanguíneos y parenquimatoso en función de la TE45. En este sentido, la ventaja inicial de bSSFP para visualizar la sangre debido al contraste T2/T1 podría plantear un desafío adicional para establecer una cuantificación precisa en comparación con la mecánica de contraste más simple de un SPGRE. Sin embargo, son deseables estudios adicionales que aborden directamente la influencia de diversas variables de RM, por ejemplo, como el realizado por Glandorf et al. para medios de contraste46,47, ya que pueden cuantificar directamente el efecto sobre PREFUL.
Importancia
Al ser un método de respiración libre y sin medios de contraste, PREFUL comparte muchas ventajas con los métodos relacionados mencionados anteriormente: 1) Sin aplicación de radiación ionizante y agente de contraste, 2) Sin necesidad de hardware o personal adicional, 3) Adquisición, que depende solo de un cumplimiento mínimo por parte del paciente. Estas ventajas hacen de PREFUL una herramienta de seguimiento conveniente, especialmente para grupos vulnerables como los niños con enfermedad pulmonar crónica. Aunque la SNR es baja con la secuencia SPGRE, la disponibilidad y la falta de requisitos para la programación/compartición de secuencias adicionales promueven aún más la difusión de este enfoque.
Como se discutió en la sección de introducción, el número de estudios que muestran una buena validación, reproducibilidad, resultados de sensibilidad y capacidades de monitoreo muestra que la importancia de esta técnica y los parámetros dinámicos correspondientes está en una trayectoria creciente y será respaldada por una amplia difusión.
Divulgaciones
Filip Klimeš, Andreas Voskrebenzev y Jens Vogel-Claussen son accionistas de BioVisioneers GmbH, una empresa interesada en los métodos de imagen por resonancia magnética pulmonar.
Agradecimientos
Este trabajo fue financiado por el Centro Alemán de Investigación Pulmonar (DZL). Los autores desean expresar su profunda gratitud a todos los que contribuyeron y apoyaron el desarrollo de PREFUL, en particular: Marcel Gutberlet, Till F. Kaireit, Lea Behrendt, Julian Glandorf, Sonja Lüdiger, Tawfik Moher Alsady, Katharina Bünemann, Marius Wernz, Robin Müller, Maximilian Zubke, Gesa Pöhler, Agilo Kern, Cristian Crisosto, Milan Speth, Arnd Obert, Julienne Scheller, Jim Wild, Edwin van Beek, Helen Marshall, Jens Gottlieb, Martha Dohna, Diane Renz, Anna-Maria Dittrich, Tobias Welte, Jens Hohlfeld, Patrick Zardo, Giles Santyr, Franz Wolfgang Hirsch, Robert Grimm, Bastian Bier, Bassem Ismail, André Fischer, Berthold Kiefer, Gregor Thoermer y Rebecca Ramb. Además, los autores también quieren agradecer a los radiólogos y a los participantes en el estudio. En particular, agradecemos a Frank Schröder y Sven Thiele del Departamento de Radiología de la Facultad de Medicina de Hannover por su excelente asistencia técnica en la realización de los exámenes de resonancia magnética.
Materiales
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
Referencias
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados