Method Article
Pulmoner Ventilasyon ve Perfüzyon (V/Q) Değerlendirmesi için Faz Çözümlü Fonksiyonel Akciğer MRG
Bu Makalede
Özet
Burada, pulmoner ventilasyon ve perfüzyon dinamiklerinin değerlendirilmesi için kontrast madde içermeyen bir proton MR tekniği olarak faz çözümlü fonksiyonel akciğer MRG uygulamasını tanımladık. Farklı alan güçleri ve yaş grupları arasında doğrulanmış ve uygulanabilir olan bu kitap, hastalık nicelleştirmesine ve tedavi izlemeye yardımcı olarak gelecekte klinik karar vermeyi geliştirebilir.
Özet
Fourier ayrışması, akciğer perfüzyonu (Q) ve ventilasyon (V) değerlendirmesi için kontrast madde içermeyen bir 1H MRG yöntemidir. Görüntü kaydından sonra, her bir vokselin zaman serisi, kardiyak ve solunum frekansı bileşenlerine göre analiz edilir.
~300 ms'lik zamansal çözünürlüğe sahip standart bir 2D bozulmuş gradyan-yankı dizisi kullanılarak, artırılmış zamansal çözünürlüğe sahip faz çözümlü fonksiyonel akciğer görüntüleme (PREFUL) üretmek için bir görüntü sıralama algoritması geliştirilmiştir. Bu nedenle, tidal hacim solunumu sırasında bölgesel akış hacmi döngülerini (FVL) değerlendirmek ve kardiyak döngü sırasında nabız dalgasının yayılmasını göstermek mümkündür. Bu yöntem, dizi programlamaya gerek kalmadan standart MR donanımı ile 1.5T veya 3T'de uygulanabilir, çünkü açıklanan protokol çoğu sistemde varsayılan SPGRE dizisi ile uygulanabilir.
PREFUL ventilasyon MRG, iyi bir bölgesel uyum ile 129Xe ve 19F gaz görüntüleme kullanılarak doğrulanmıştır. Perfüzyon ağırlıklı PREFUL MRG, SPECT ve dinamik kontrastlı (DCE) MRG kullanılarak doğrulanmıştır. PREFUL, çift merkezli, çift satıcılı bir ortamda test edilmiştir ve şu anda devam eden birkaç çok merkezli denemede uygulanmaktadır. Ayrıca, yeni doğanlar da dahil olmak üzere çeşitli alan kuvvetlerinde (0.55T-3T) ve farklı yaş gruplarında uygulanabilir.
Kantitatif V/Q PREFUL MRG, kistik fibrozis, kronik obstrüktif akciğer hastalığı, kronik tromboembolik pulmoner hipertansiyon ve corona virüs hastalığı-2019 olan hastalarda hastalığı ölçmek ve tedaviden sonra tedavi değişikliğini izlemek için kullanılmıştır. Ayrıca, PREFUL V/Q görüntülemenin akciğer nakli sonrası hastalarda kronik akciğer allogreft disfonksiyonuna bağlı nakil kaybını öngördüğü gösterilmiştir. Özetle, PREFUL MRG, bölgesel akciğer hastalığı tespiti, miktar tayini ve tedavi izleme için kantitatif ventilasyon ve pulmoner nabız dalgası/perfüzyon görüntüleme için doğrulanmış bir tekniktir ve mevcut klinik rutine potansiyel katma değer sağlar.
Giriş
Solunum sistemi, karmaşık mekanizmaları ile çeşitli hastalıklara karşı savunmasızdır. Belirgin bir şekilde, kronik obstrüktif akciğer hastalığı (KOAH), kistik fibroz (KF) ve kronik tromboembolik pulmoner hipertansiyon (KTEPH) gibi kronik solunum koşulları yaşam beklentisini önemli ölçüde azaltır1. Sonuç olarak, erken tanı, izleme ve terapötik yanıt değerlendirmesi çok önemli hale geldi.
Solunum fonksiyon testleri (PFT'ler), bir saniyedeki zorlu ekspiratuar hacmin oranı (FEV1) ve zorlanmış vital kapasite (FVC) olarak tanımlanan Tiffeneau-Pinelli indeksi gibi küresel akciğer fonksiyon parametrelerini türetebilir.2. Bu tür parametreler klinik rutinde iyi bir şekilde yerleşmiştir, ancak bölgesel bilgilerden yoksundur ve yüksek düzeyde hasta uyumu gerektirir. Bu bağlamda, görüntüleme daha hassas parametreler için ek bilgiler ve olanaklar sunabilir. Bilgisayarlı tomografi (BT), parankimal morfolojinin yüksek çözünürlüklü görüntülemesini sağlar ve parametrik yanıt haritalama gibi yeni teknikler de fonksiyonel bilgileri alır3. Bununla birlikte, tek foton emisyonlu bilgisayarlı tomografi (SPECT), akciğerdeki ventilasyon ve perfüzyonu (V/Q) göstermek için mevcut altın standart olmaya devam etmektedir4. Hepsinde ortak olan, bahsedilen görüntüleme yöntemleri, izleme ve savunmasız gruplar için özel dikkat gerektiren iyonlaştırıcı radyasyona maruz kalmayı gerektirir. Sonuç olarak, MRG'yi alternatif bir modalite olarak teşvik etmek için devam eden bir çaba vardır.
Doğası gereği akciğer, düşük proton yoğunluğu ve hızlı sinyal bozulması nedeniyle MRG için zorlu bir organdır5. Çok sayıda yaklaşım arasında en yaygın çözümler arasında ventilasyon6 için hiperpolarize gaz (örneğin, 129Xe MRG) kullanımı ve perfüzyon tasviri7 için intravenöz gadolinyum bazlı kontrast madde uygulaması yer alır. Bu yöntemler yüksek bir sinyal-gürültü (SNR) oranı sunar ve MR topluluğunda yaygın olarak altın standart yöntemler olarak kabul edilir. Daha yeni bir yaklaşım, herhangi bir kontrast maddenin uygulanmasını önler ve toplam ~ 1 dakika / dilim edinme süresi ile serbest solunumda geleneksel proton MR ile mümkündür. Böylece, kontrast maddelerin potansiyel advers olaylarından ve son zamanlarda tartışılan uzun vadeli etkilerinden kaçınılır ve ek hiperpolarizasyon ve çoklu nükleer donanım gereksinimi olmadan daha kolay yayılma sağlanır. Ek olarak, türetilen ventilasyon kusuru değerlerini8 etkileyebilecek yeterli bir şişirme durumu bulma sorunu, serbest solunum edinimi ile önlenir.
Bu dolaylı MR sinyaline dayalı yaklaşım ilk olarak proton ağırlıklı sinyal S ve akciğer hacmi V'nin karşılıklı ilişkisini kullanan Zapke ve arkadaşları tarafından tanıtıldı: S~1/V.9 Serbest nefes almada elde edilen görüntülerin tek bir ortak şişirme durumuna (tipik olarak son kullanma sonu ile son kullanma tarihi arasında bir ara konumda) dönüştürülmesi sürecine dayanır, böylece hareketi telafi eder ve her vokseldeki sinyal zaman serilerini analiz etmeye izin verir. Daha sonra, Klimeš ve ark.10 tarafından denklem (1) kullanılarak bu sözde kayıtlı görüntülerden bir havalandırma ölçümü elde edilebilir:
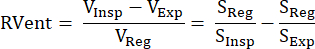 (1)
(1)
İnspirasyon (Insp), sona erme (Exp) ve kayıtlı durumdaki (Reg) hacimler/sinyaller ile. Daha sonra, yöntem, solunum frekansı (ventilasyon) ve darbe frekansı (perfüzyon) ile ilişkili sinyal modülasyonları arasında ayrım yapmak için Fourier Ayrıştırması tanıtılarak genişletildi ve bu nedenle, bir edinimden mükemmel uzamsal olarak eşleşen bir V/Q haritası türetildi11. Bu, solunum ve kalp frekansları arasındaki tipik boşluk ile mümkün olur, böylece zaman alanında birbirinin üzerinde olan her iki bileşen de Fourier analizi ile frekans alanında etkili bir şekilde ayırt edilir. Optimize edilmiş dengeli kararlı durum serbest presesyon dizisi (bSSFP)12 ile düşük alandan (0.35T) 1.5T'ye geçişten sonra, bu yöntem çeşitli takip çalışmaları ile daha fazla dikkat çekmeye başladı 13,14,15.
Solunum ve nabız değişkenliğe tabi olduğundan ve 1.5T'de ticari olarak temin edilebilen bSSFP (gradyan kompanzasyonlu) görüntüleme, önemli bantlama artefaktlarına (net sinyal boşluğu çizgileri) neden olabileceğinden, geniş alçak geçiren ve yüksek geçiren filtreleme ile kombinasyon halinde bozulmuş gradyan yankı dizisi (SPGRE) ile ilgili bir yöntem önerilmiştir16,17. Bu, gerçek solunum ve nabızla ilgili modülasyonların daha karmaşık spektrumunu yakalar. Zaman alanındaki genliğin aşağıdaki hesaplaması, belirli bir frekans tepe noktası seçme gerekliliğini ortadan kaldırır. Tipik tek adımlı kaydın bir referans durumuna doğru iki ayrı adıma bölünmesiyle daha fazla optimizasyon sağlandı. Bu nedenle, serbest nefes alma sırasında, inspirasyon sonu ile son sona erme arasında bir dizi farklı solunum aşamasının elde edildiği ve sabit bir duruma doğru değişen derecelerde gerekli deformasyonun elde edildiği gerçeğinden yararlanılır. Birkaç grup seçtikten ve tek tek görüntülerin grubunu tanımladıktan sonra aşağıdaki prosedür gerçekleştirilir: 1) İlgili solunum durumu grubu içinde kayıt, 2) Bir bitişik gruptan diğerine adım adım gruplar arası kayıt (örneğin, 1->2, 2->3,...) referans grubunu temsil eden gruba. Bu yaklaşım, ventilasyon ve perfüzyon dinamiklerinin analizini kolaylaştırmak için daha yüksek bir görünür zamansal çözünürlük oluşturmak için her görüntü için faz tahmini ile daha da genişletildi ve bu dalı diğer ilgili tekniklerden ayırmak için faz çözümlü fonksiyonel akciğer (PREFUL) MR terminolojisine yol açtı18. Takip çalışmaları, tam solunum ve kalp döngüleri tarafından sağlanan ek bilgileri kullandı ve bu tür parametrelerin potansiyel olarak artmış duyarlılığını gösterdi 19,20,21.
Altın standart SPECT ile doğrulama, defekt bölgeleri22 için %≥67'lik bir zar katsayısı ortaya çıkardı ve 129Xe ile daha doğrudan ventilasyon ölçümü, karışık bir KOAH/CF/sağlıklı kohortta%23 %84 ventilasyon defekti yüzdeleri korelasyonu gösterdi ≥23 ve CF çok merkezli, çok satıcılı kohortta24% 84, bu da PREFUL ve 129Xe'nin akciğer klerens indeksi ile benzer bir korelasyon gösterdi (r = 0.82 ve r = 0.91). Aynı çalışmanın perfüzyon analizi, değerlendirilen merkezler arasında DCE ile mekansal örtüşme açısından anlamlı bir fark olmadığını göstermiştir25. DCE ile uyum ve merkezler arasında PREFUL sonuçlarının uyumu, dokuz merkezi içeren prospektif bir alt çalışma için de rapor edilmiştir26. KOAH hastalarında tekrarlanabilirlik analizi, tüm parametreler için %15'in altında bir varyasyon katsayısı ile sonuçlandı27. Mevcut çalışmalar, FVL parametresinin, yalnızca inspiratuar ve ekspiratuar fazları hesaba katan "statik" ventilasyon parametresine kıyasla tedavi değişikliklerini tespit etmek için daha yüksek öngörü gücüne ve hassasiyete sahip olduğunu göstermektedir. KOAH28'de indacaterol-glikopirronyum (IND / GLY) ile inhaler tedavisinden sonra bölgesel akış-hacim döngüsü (FVL) ölçümleri ile tedaviye yanıt gösterilmiştir. Buna paralel olarak, FVL parametresi çift akciğer nakli hastalarında greft kaybını öngörürken, spirometri bunu öngöremedi (P = .02'ye karşı P = 0.33)29. İlk fizibilite çalışmaları, standart klinik MRG donanımı ile serbest nefes alan bebek ve yenidoğanlarda PREFUL ile fonksiyonel pulmoner görüntülemenin gerçekleştirilebileceğini göstermektedir30,31. Glandorf ve ark. 1.5T ve 3T'de (SPGRE dizisi) PREFUL parametrelerini karşılaştırdı ve alan kuvveti32'deki farka rağmen yüksek oranda tekrarlanabilir olan çoğu parametre için anlamlı bir fark bulamadı. Her sitenin 1.5T veya daha düşük alan gücü tarayıcılarına erişimi olmadığı için bu önemli bir avantaj olabilir. Son zamanlarda, 0.55T'de COVID-19 enfeksiyonu sonrası kalıcı semptomların fizibilitesi ve tespiti, bSSFP verilerinin PREFUL33 ile değerlendirilmesiyle gösterilmiştir.
Özetle, nispeten yeni bir teknik olmasına rağmen, PREFUL kapsamlı bir şekilde incelenmiştir. Daha doğrudan ve yerleşik ölçümlerle validasyon, tekrarlanabilirlik, patolojiye duyarlılık, tedavi ve progresyon değişikliklerine yanıt verme gibi önemli kriterler değerlendirildi. Bununla birlikte, yine de, düşük teknolojik gereksinimlere rağmen sadece birkaç uzman merkez bu tekniği kullanmaktadır. Bu nedenle, bu çalışmanın amacı, PREFUL MR'ın en son metodolojisini yazılı ve görsel olarak özetlemektir. Bu bilgi, bu tekniği daha fazla merkezde kurmak için kullanılabilir ve böylece uzun vadede daha olgun bir tekniğe yol açabilir.
Protokol
Bu çalışma, Hannover Tıp Fakültesi etik kurulundan onay aldı ve araştırma süreci boyunca titiz etik standartlara bağlı kalmasını sağladı. Soruşturma, tıbbi araştırmaların etik olarak yürütülmesini vurgulayan Helsinki Bildirgesi'nde belirtilen yönergeleri sıkı bir şekilde takip etti. Ek olarak, MRG incelemesine katılmadan önce tüm çalışma katılımcılarından (veya ebeveynlerinden veya yasal vasilerinden) özenle bilgilendirilmiş onam alınmıştır. Edinim, kayıt, filtreleme ve sıralama ve son olarak kardiyak ve solunum döngüsü sentezinden oluşan temel protokol adımlarına basitleştirilmiş bir genel bakış için Şekil 1'e bakın. Aşağıdaki bölümlerde, ilgili tüm adımlar tüm ayrıntılarıyla açıklanmıştır.
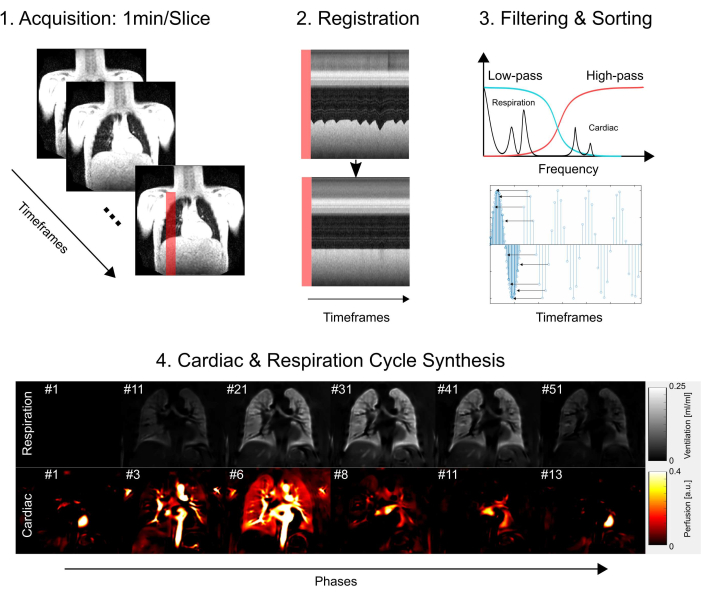
Şekil 1: PREFUL'un temel bileşenlerine şematik genel bakış. 1) 2) profil çizimlerinde gösterildiği gibi kayıt yoluyla hareket telafisi gerektiren ve adım 3'te gösterildiği gibi Fourier bileşenlerinin voksel voksel analizini mümkün kılan serbest nefes almada edinim) filtreleme ve sıralama. Düşük geçiren (ventilasyon) ve yüksek geçiren (perfüzyon) filtrelemeden sonra, 4) tahmini faz, görüntüleri daha yüksek bir görünür zamansal çözünürlüğe sıralamak ve bir tam kardiyak ve solunum döngüsünü sentezlemek için kullanılır. Bunun basitleştirilmiş bir taslak olduğunu ve tüm ayrıntıların el yazmasında açıklandığını unutmayın. Bu şekilden çıkarılan diğer adımlar, parametre nicelemesi ve rapor oluşturmayı içerir. Kısaltma: PREFUL = faz çözümlü fonksiyonel akciğer. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. İşe Alım
- Spirometri muayenesi ve / veya önceki görüntülemeye (örneğin, X-ışını veya BT taraması) dayalı bir pulmoner bozukluk teşhisine dayalı olarak hastalar ve sağlıklı kontroller için bir PREFUL MRI denemesine yetişkin hastaları veya reşit olmayanlarıişe alın; bilgilendirilmiş onam verme yeteneği; MRI taraması süresince düz yatma ve hareketsiz kalma yeteneği; ve MRG'ye bilinen bir kontrendikasyon yoktur (ör., metalik implantlar, klostrofobi).
- Hamilelerse, son 6 ay içinde daha önce akciğer ameliyatı geçirmişlerse, ciddi solunum sıkıntısı çekiyorlarsa veya sürekli oksijen takviyesi gereksinimi varsa veya kontrastlı MRG kullanılıyorsa gadolinyum bazlı kontrast maddelere daha önce advers reaksiyonlar geçirmişlerse hastaları hariç tutun.
- Klinik muayene ve öz rapora dayalı olarak bilinen bir akciğer hastalığı öyküsü yoksa sağlıklı kontroller yapın; akciğer fonksiyon testleri normaldir; bilgilendirilmiş onam verebilirler; MRG taraması süresince düz yatabilir ve hareketsiz kalabilirler; ve MRG'ye bilinen bir kontrendikasyonları yoktur.
- Mevcut veya geçmiş sigara içme öyküsüne, bilinen akciğer toksinlerine veya mesleki tehlikelere maruz kalmaya, kalıtsal akciğer hastalıklarının aile öyküsüne, akciğer fonksiyonunu etkileyebilecek bilinen herhangi bir kronik hastalığa ve hamileliğe göre bireyleri sağlıklı kontroller olarak hariç tutun.
- Onay formları alın. Katılımcıdan araştırmanın amacını ve prosedürlerini, olası risk ve faydaları, gizlilik güvencelerini, çalışmanın süresini ve sonuçsuz çekilme hakkını içeren yazılı bir bilgilendirilmiş onam formu alınırsa protokole devam edilir.
- İşe alım reşit olmayanları içeriyorsa aşağıdaki ek adımları uygulayın.
- Reşit olmayan kişinin onayına ek olarak en az bir ebeveyn veya veliden yazılı bilgilendirilmiş onay alın.
- Tüm süreci, reşit olmayanların anlayabileceği yaşa uygun bir şekilde sunun.
- Daha küçük küçükler için görsel yardımcılar, hikaye kitapları veya basitleştirilmiş açıklamalar kullanın.
- Çalışmanın yaş grubuyla ilgili olduğundan ve reşit olmayanların gereksiz yere dahil edilmediğinden emin olun.
- Araştırmanın bütünlüğüne müdahale etmediği sürece, reşit olmayanlara denemeyle ilgili tüm prosedürler sırasında güvenilir bir yetişkinin (örn. ebeveyn, vasi) eşlik etmesine izin verin.
NOT: Açıklanan adımlar, çalışmanın Etik Kurul tarafından incelendiğini ve onaylandığını varsayar.
- İşe alım reşit olmayanları içeriyorsa aşağıdaki ek adımları uygulayın.
2. Edinme
- Ön tarama güvenlik prosedürünü yürütün.
- Bir MRG'den önce, önceki ameliyatlar, implante edilmiş cihazlar, dövmeler veya metal parçalara maruz kalma gibi potansiyel kontrendikasyonları belirlemek için hastaların ayrıntılı bir ön taramasını yapın.
- Varışta, hastaları prosedürün manyetik özellikleri ve riskleri hakkında eğitin.
- Hastalara mücevher, saat ve bazı giysi bileşenleri de dahil olmak üzere tüm kişisel metal eşyaları çıkarmalarını ve gerekirse onlara bir önlük sağlamalarını söyleyin.
- Eğitimli bir profesyonelin hastaları gözden kaçan metalik nesneler için görsel olarak incelemesini sağlayın.
- Tüm tıbbi cihazları veya implantları MRG uyumluluğu açısından inceleyin.
- Hem personel hem de hasta güvenliği için acil durum protokollerinin yürürlükte olduğundan emin olun.
- Katılımcıyı konumlandırın ve tarayın
- Hastayı önce yönlendirin ve 0,55 T, 1,5 T veya 3 T sistemi üzerinde sırtüstü pozisyonda yatırın.
- Güvenlik ve konfor için işitme koruması, acil durum zili, dolgu ve battaniye sağlayın.
- Tüm akciğer bölgelerinde optimum bobin hassasiyetini sağlamak için çenenin hemen altına çok kanallı esnek bir bobin yerleştirin.
- Hastanın nefes almasını engellemeden stabiliteyi korumak için bobinin yerleşimini sabitleyin.
- Hastaya gözlerini kapatmasını söyleyin, ardından MR lazeri kullanarak akciğerin merkezini işaretleyin.
- Akciğer merkezini izomerkezde hizalayın ve hastanın gözlerini tekrar açmasına izin verin.
- Genel bir oryantasyon oluşturmak için ilk lokalizatörleri tarayın, ardından trakeal bifurkasyonu tanımlamak için enine morfolojik bir tarama yapın.
- Tekrarlanabilirliği artırmak için ilk koronal dilimi trakeal çatallanmaya tutarlı bir dönüm noktası olarak sabitleyin.
- Tarama protokolüne bağlı olarak, ya %100'lük bir dilim dilimi (dilim kalınlığı) dilimden dilime mesafeyle (kenardan kenara ölçülür) aralıklı üç dilim yakalayın ya da %20 veya %33'lük bir mesafeyle tüm akciğeri kapsayan birden fazla dilim elde edin.
- Her dilimi tamamen ayrı ayrı alın ve serpiştirmeyin.
- Yeniden oluşturulan görüntüleri, daha sonra erişim ve analiz için resim arşivleme ve iletişim sistemine (PACS) yükleyin. Alternatif olarak, gizlilik ve veri koruma standartlarına uymak için, görüntüleri belirlenmiş bir ağ sürücüsüne veya benzer bir depolama çözümüne manuel olarak aktarın.
NOT: Dizi protokolü ve parametreleri hakkında ayrıntılı bilgi için Tablo 1 ve Tablo 2'ye bakın. Dilim konumlandırmanın görsel bir temsili için Şekil 2'ye bakın.
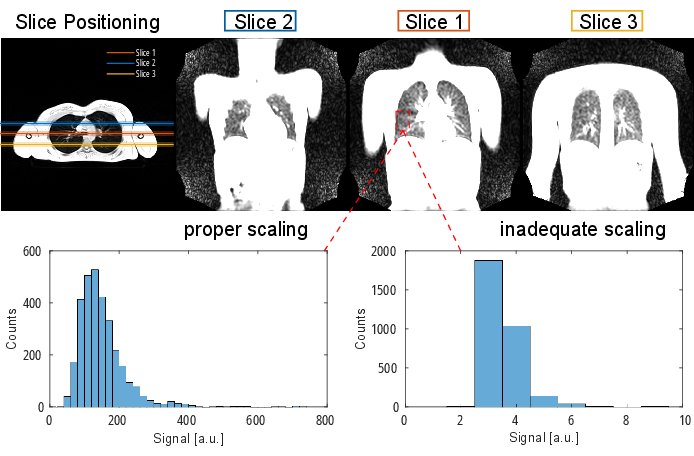
Şekil 2: Enine oryantasyonda bir 3B gradyan yankısı ile görselleştirilen bir PREFUL deneyi için tipik bir dilim konumlandırma. İlk dilimin trakeal bifurkasyonda tekrarlanabilir bir dönüm noktası olarak konumlandırıldığına dikkat edin. 2. ve 3. dilimler ön ve arka yönlerde %100 dilim boşluk bırakılarak konumlandırılır. Örnek histogramlar, uygun ve yetersiz (düşük) ölçeklendirme ile değer dağılımlarını gösterir. İkincisi, düşük dinamik aralığa ve doğruluk kaybına yol açar. Kırpmaya yol açan yetersiz bir yüksek ölçeklemeden (burada gösterilmemiştir) de kaçınılmalıdır. Kısaltma: PREFUL = faz çözümlü fonksiyonel akciğer. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Bir PREFUL protokolünün tipik bir taslağı. Bir lokalizörden sonra, enine oryantasyonda akciğerin 3 boyutlu bir hacmi elde edilir. Bu edinim, aşağıdaki PREFUL alımlarını planlamak için kullanılır (ayrıca sıra ayarları için Tablo 2'ye ve dilim konumlandırma için Şekil 2'ye bakın). Çalışmaya bağlı olarak başka diziler de eklenebilir. Kısaltma: PREFUL = faz çözümlü fonksiyonel akciğer. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 2: Bozulmuş gradyan yankı dizisi ile PREFUL edinimi için dizi parametreleri özeti. Kısaltmalar: PREFUL = faz çözümlü fonksiyonel akciğer; SPGRE = bozulmuş gradyan yankı dizisi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
3. İşlem sonrası
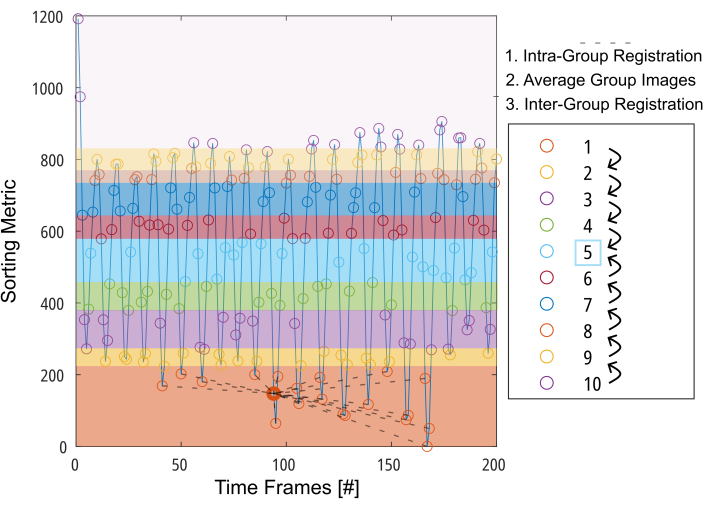
Şekil 3: Hareket telafisi için gerekli deformasyonu en aza indirmek için grup yönelimli kaydın şematik sunumu. Görüntüleri (dairelerle temsil edilir) bir sıralama metriğine (örneğin, segmentli akciğer alanı) dayalı olarak 10 gruba ayırdıktan sonra, görüntüler her grubun içinde bir ara konuma kaydedilir (grup 1 için kesikli çizgilerle gösterilir). Daha sonra, kaydedilen görüntülerin ortalaması alınır ve Gruplar Arası kaydın son adımı için ara gruba doğru adım adım kullanılır. Kısaltma: GOREG = grup odaklı kayıt. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
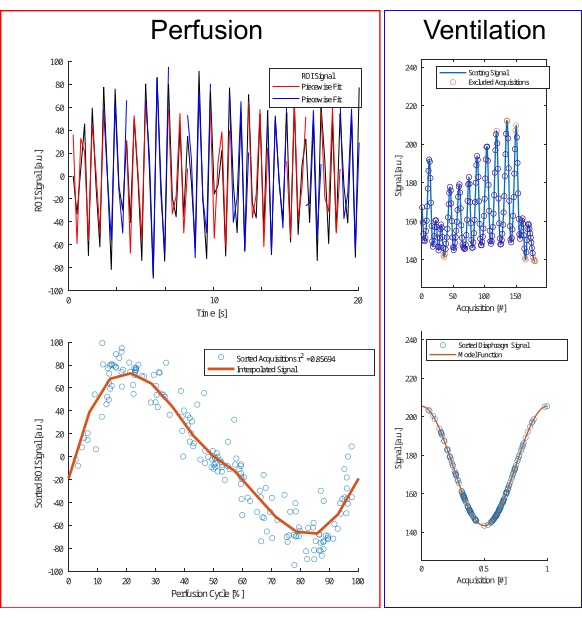
Şekil 4: Perfüzyon ve ventilasyon için sıralama algoritmasının gösterimi. Perfüzyon için (solda), fazı tahmin etmek ve edinimleri (alt sıra) yeniden belirlemek için parça bazında bir bağlantı (üst sıra) gerçekleştirilir. Havalandırma için (sağda), aykırı değerler hariç tutulur (üst sıra) ve ekspirasyon ve inspirasyon fazlarını ayırt etmek için genlik ve genlik farkına dayalı olarak bir kosinüs modeline (alt sıra) göre sıralanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
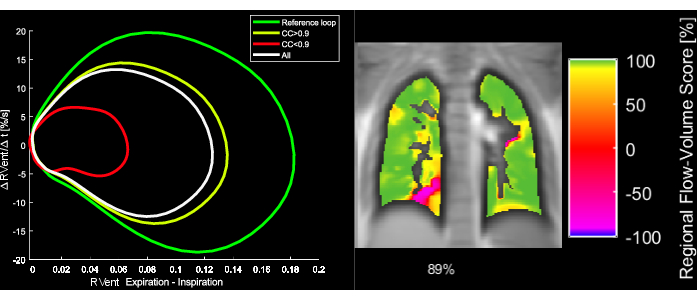
Şekil 5: KOAH'lı 43 yaşında bir kadın hastanın örnek akış-hacim döngüleri ve karşılık gelen FVL-Korelasyon Metriği. FVL'nin değiştirilmesiyle FVL-CM'nin azaldığını unutmayın. Kısaltmalar: FVL = akış-hacim döngüsü; FVL-CM = FVL-korelasyon metriği; KOAH = kronik obstrüktif akciğer hastalığı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 3: Eşiklerin parametre haritalarına uygulanması ve kusur haritalarının kombinasyonu. Bu Tabloyu indirmek için lütfen buraya tıklayın.
- Kayıt
NOT: Aşağıdaki bölümde, solunum ve kardiyak hareketin telafisi için grup yönelimli (GOREG) bir şema kullanılarak bir referans hacmine (tercihen orta seviye solunum seviyesi) rijit olmayan kayıt prosedürü açıklanmaktadır.- Görüntüleri alın.
- Başlangıçta, eğitimli bir U-Net ile tüm kayıtsız görüntüler üzerinde akciğer segmentasyonu yapın ve solunum fazları için bir tahmin elde etmek için 0,7 Hz'lik bir kesme ile düşük geçiren bir filtre uygulayın.
NOT: Bu, sonraki adımları arka planda gerçekleştirecek olan tam otomatik işleme işlem hattını başlatacaktır. Gösterilen ve açıklanan işlem adımları belirli bir uygulama veya dille sınırlı değildir ve bu nedenle birçok programlama diliyle özel bir uygulamada uygulanabilir. - Yüksek miktarda segmentli vokselleri ilham kaynağı ve düşük miktarı son kullanma tarihi olarak sınıflandırın.
- Görüntüleri 10. yüzdebirlik dilimlere bölerek gruplandırın ve elde edilen 10 grubun her birinin eşit sayıda görüntü içerdiğinden emin olun.
- Kayıt algoritması olarak ANTs34'ü (çapraz korelasyon metriği ile BSplineSyN) veya Forsberg 35,36'yı (elastik ve akışkan düzenlemeli polinom genişlemesi) seçin.
- Her grup için ilgili grubun orta akciğer pozisyonuna doğru intra-kayıt yapın.
- Her grup için bir görüntü elde etmek için grup sonuçlarının ortalamasını alın.
- Her grup görüntüsünden 5. grup yönünde bir sonraki komşuya doğru giderek Ara Kayıt yapın.
- Grup 5'teki ortalama görüntü ile temsil edilen solunum pozisyonuna ulaşmak için gerektiği gibi deformasyon zincirini orijinal görüntülere uygulayın. Örneğin 3. gruba ait olan Resim 36 için aşağıdaki deformasyon alanları uygulanır: 36->Resim 57 (~Grup 3'te Orta Akciğer Pozisyonu) -> Adım 3->4 -> Adım 4->5.
NOT: GOREG prosedürünün ayrıntılı bir açıklaması için Şekil 3'e bakın. İşlem süresini azaltmak için paralel bilgi işlem ile kayıt gerçekleştirin. GOREG kaydı, her kayıt adımı için gereken deformasyon miktarını en aza indirmek ve dolayısıyla kararlı algoritma yakınsamasını sağlamak için gerçekleştirilir. Bununla birlikte, kayıt, orta akciğer pozisyonuna doğru sadece bir deformasyon adımı ile de gerçekleştirilebilir. Yayınlanmış tüm 2D PREFUL çalışmaları ANT'leri kullanırken, Forsberg 6 kata kadar daha hızlı sonuçlar verir ve sonuçlar bir 3D PREFUL çalışması tarafından bildirildiği gibi karşılaştırılabilir kalitededir37. Bu raporda örnek sonuçlar Forsberg kaydı ile oluşturulmuştur. Diyafram hareketi üzerindeki kayıt etkisinin bir resmini görmek için Şekil 1'e bakın.
- Genel filtreleme
- Görüntü kılavuzlu filtrelemeyi38 kullanarak kayıtlı görüntülerin gürültüsünü giderin ve zaman ortalaması alınmış kayıtlı görüntüyü kılavuz görüntü olarak kullanın. Aşağıdaki ayarları uygulayın: NeighborhoodSize = [10, 10], DegreeOfSmoothing = 1.
- Ventilasyon ve perfüzyon analizi için, ilgili diğer bileşeni bastırmak için 0.7 Hz'de kesme özelliğine sahip düşük geçiren veya yüksek geçiren bir filtre kullanın. Dahil edilen zaman serisinde kararlı durumu sağlamak için ilk 20 görüntüyü, niceliksel perfüzyon hesaplaması dışındaki tüm sonraki işleme adımlarından hariç tutun.
NOT: Deneklerin solunum hızı ~ 40 nefes / dakikanın üzerindeyse, kesmenin değiştirilmesi gerekebilir.
- Segmentasyon
NOT: Son segmentasyon, aşağıda belirtildiği gibi iki aşamalı bir prosedürde ara akciğer pozisyonunda kayıtlı görüntüler kullanılarak gerçekleştirilir.- Eğitimli bir U-Net ile veya manuel olarak zamansal olarak ortalama kayıtlı görüntüler üzerinde akciğer sınırı (akciğer ROI) segmentasyonu gerçekleştirin.
- Ardından, akciğer sınır segmentasyonunu rafine etmek ve akciğer parankimi için bir ilgi alanı veya ROI elde etmek için büyük merkezi damarları hariç tutun.
- Perfüzyon
NOT: Özellikle kalp atış hızına (tipik olarak 40-90 bpm) kıyasla nispeten düşük bir frekansta (~ 3-5 görüntü/sn) örneklenen elde edilen serideki her bir görüntü için kardiyak fazı kesin olarak tahmin etmek için aşağıdaki adımlar gereklidir. Verilerin belirlenen kardiyak fazlara göre yeniden düzenlenmesi, veri toplamanın örnekleme hızını18 aşan, gelişmiş zamansal çözünürlüğe sahip tam kardiyak döngüyü elde etmek için kullanılır (sıralama prosedürünün bir örneği için Şekil 4'e bakın). Faz tahmini için, güçlü bir perfüzyon ağırlıklı sinyale sahip bir arama ROI'si gereklidir. Aşağıdaki gibi yinelemeli bir arama algoritması kullanın22.- Mediasteni arama ROI'sine dahil etmek için akciğer sınırı ROI'sini bağlayın.
- Görüntü dizisi boyunca standart sapmayı hesaplayarak basit bir perfüzyon ağırlıklı harita oluşturun.
- Arama YG'sinde bu haritanın 98. yüzdebirlik dilimine karşılık gelen bölgeleri, sonraki adımlar için çekirdek YG'ler olarak belirleyin.
- Parça bazında montajı gerçekleştirin, montaj performansı iyileştiği sürece tohum noktalarının boyutunu artırın.
- Genişletilmiş tohum yatırım getirilerini uygun performanslarına göre sıralayın.
- En iyi genişletilmiş tohum yatırım getirilerini, kombinasyon metriği iyileştirmeyene veya tüm tohum yatırım getirileri dikkate alınana kadar ikinci en iyi, üçüncü en iyi vb. ile yinelemeli olarak birleştirin. Nihai ROI'yi, kardiyak faz tahmini için kullanılan damar ROI'si olarak düşünün.
- Faz tahmini için bir sinyal-zaman serisi üretmek için optimize edilmiş faz tahmini içindeki sinyalin uzamsal olarak ortalamasını alın.
- Sinyalin yerel maksimumlarını kullanarak sinyali daha küçük parçalara bölerek ve ardından genlik, faz ofseti ve frekans gibi parametreleri göz önünde bulundurarak parça parça sinüzoidal bir uyum sağlayarak parça bazında tahmini gerçekleştirin (Şekil 4).
- Görüntüleri bir kardiyak döngüyü temsil edecek şekilde faz sıralayın.
- 15 fazı tek bir kardiyak döngüyü kapsayan düzgün aralıklı bir zaman ızgarasına enterpolasyon yapmak için bir Gauss çekirdeği (sigma = 0.1) ile Nadaraya-Watson çekirdek regresyonu kullanın.
NOT: Sağlıklı bir gönüllünün diyastolden başlayan, sistole geçiş yapan ve diyastole geri dönen, örnek sentezlenmiş tam kardiyak döngüsünün bir alt kümesi için Şekil 1'e bakın.
- Havalandırma
NOT: Perfüzyon analizi için, kalp frekansının ihmal edilebilir genlik varyasyonlarıyla nispeten sabit kaldığını unutmayın. Buna karşılık, ventilasyon, tidal hacim ve frekansta daha fazla varyasyon yaşama eğilimindedir ve bu da aynı solunum fazlarının her zaman aynı genliğe sahip olmadığı farklı solunum durumlarına yol açar. Fischer ve ark.'nın kendi kendine geçit yaklaşımından esinlenerek, ventilasyonu sinyal genliğine göre kategorize etmek önemlidir.- Ampirik kurallar kullanarak aşırı aykırı değerleri hariç tutun (5. yüzdelik dilimin altındaki veya 97. yüzdelik dilimin üzerindeki veriler).
- Kayıt gruplaması için oluşturulan sinyal-zaman serisinden R genlik aralığını türetin ve C ofsetini yapın.
- Keyfi olarak seçilmiş bir frekansa sahip bir model fonksiyonu A(t) tanımlayın fSolunum (burada 0.3 Hz):
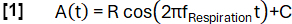
- Verileri eğime göre ilham ve sona erme durumlarına göre sınıflandırın.
- Model işlevine göre daha rafine faz belirleme elde edin:
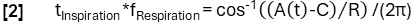
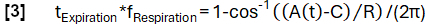
- Daha sonra, numuneleri fazlarına göre hizalayın ve solunum döngüsü sırasında eşit aralıklı aralıklarla ventilasyonu hesaplamak için Nadaraya-Watson çekirdek regresyonunu uygulayın.
- Denklem 1'e benzer şekilde her faz için bölgesel ventilasyonu (RVent) hesaplayın ve inspirasyon fazını ilgili faz ile değiştirin.
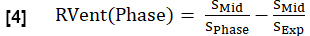
NOT: Sağlıklı bir gönüllünün örnek olarak sentezlenmiş tam solunum döngüsünün bir alt kümesini görmek için Şekil 1'e bakın, son kullanma tarihinden başlayarak, inhama geçiş yapan ve daha sonra son kullanma tarihine geri dönen. Sıralama algoritmasının bir gösterimi için Şekil 4'e bakın.
- Parametre hesaplama
NOT: Sentezlenen tam solunum ve kardiyak döngüler kullanılarak daha fazla parametre elde edilebilir. En önemli parametrelerin bir seçimi aşağıda açıklanmıştır. - Bölgesel havalandırma (RVent)
- İnspiratuar fazı kullanarak RVent'i aşağıdakilere göre türetir:
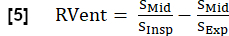
- İnspiratuar fazı kullanarak RVent'i aşağıdakilere göre türetir:
- Akış-hacim-döngü korelasyonu metriği (FVL-CM)
NOT: Tüm solunum fazlarını değerlendirmek için, solunum fonksiyon testine benzer şekilde FVL analizine eşdeğer bir MRI oluşturmak için bir dizi adım gerçekleştirilir.- RVent'in ilk kez türevini kullanarak akış için bir vekil olarak bölgesel havalandırmanın (RVent) eğimini hesaplayın. Adım uzunluğu h ile simetrik bir fark bölümü kullanın:
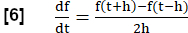
- İsteğe bağlı olarak, bölgesel veya ortalama RVent eğimlerini ilgili RVent'in bir fonksiyonu olarak görüntüleyin, böylece FVL analizine eşdeğer bir PREFUL oluşturun.
- Akciğer parankimi ROI'sinde 80. ila 90. persentil aralığında RVent değerlerine sahip en büyük bağlantılı bölgeyi belirleyerek bir referans ROI belirleyin.
- Belirlenen referans ROI içindeki akış-hacim döngülerinin ortalamasını alın.
- Her bir akciğer FVC'sinin referansa benzerliğini belirlemek için, akciğer parankimi ROI'sindeki her bir FVC'yi sıfır gecikmeli referansla çapraz ilişkilendirin:
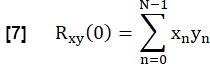
- Şuna göre normalleştirin:
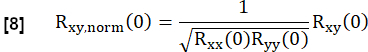
Burada, x ve y referansı ve ilgili RVent akış eğrisini temsil eder.
NOT: Gecikmeli ventilasyonun daha düşük bir korelasyonla sonuçlanması için sıfır gecikmenin kullanıldığını unutmayın.
NOT: FVL hesaplamasının ve türetilmiş FVL-CM metriğinin bir gösterimi için Şekil 5'e bakın.
- RVent'in ilk kez türevini kullanarak akış için bir vekil olarak bölgesel havalandırmanın (RVent) eğimini hesaplayın. Adım uzunluğu h ile simetrik bir fark bölümü kullanın:
- Kantitatif perfüzyon
NOT: Niceleme, Glandorf ve ark. geçici durum36 sırasında elde edilen ilk görüntüler kullanılarak.- Kaydedilen ilk dört görüntüyü, adım 3.1.2'de hesaplandığı gibi akciğer voksel miktarı A'yı kullanarak orta inspirasyon seviyesine normalleştirin. Değişen proton yoğunluğunun neden olduğu bu modülasyon azalması şu şekilde ifade edilir:
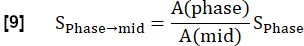
- Modeli kullanarak maksimum manyetizasyon ile ilişkili sinyali tahmin etmek için üstel bir uyum gerçekleştirin:
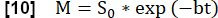
- Akciğer parankimi ROI'sinde en maksimal sinyalleri gösteren kardiyak döngü fazını kullanarak parankimal perfüzyon ile ilgili bir Q haritası belirleyin.
- Bölgesel kan fraksiyonunun (BF) tahmini için, arama ROI'sindeki (tam kan voksel) 99,99. yüzdelik dilimin üzerindeki değerlerin ortalamasını alarak S0 değerini normalleştirin:
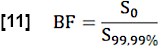
- S0 ile belirlenen kararlı durum (SS) ile başlangıç durumu arasındaki maksimum medyan sinyal farkının oranını ve akışla ilgili sinyal farkı Q'yu dikkate alarak bir kardiyak döngü sırasında değişim fraksiyonunu (EF) tahmin edin:
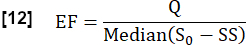
- Fourier analizini (en büyük zirveye karşılık gelen frekans) kullanarak damar ROI'sinden 1/s cinsinden kalp frekansı fHeart'ı belirleyin.
- mL∙min-1∙100 mL-1 cinsinden nihai kantitatif Perfüzyonu (QQ) aşağıdaki gibi hesaplayın:
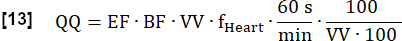
NOT: Burada, voksel hacmi (VV) [mL/mL] iptal edilir ve nihai sonucu [mL∙min-1∙100 mL-1] olarak görüntülemek için 60 s/dk dönüştürme faktörü ve 100/100 konvansiyon faktörü kullanılır. EF ve BF boyutsuz oranlardır.
- Kaydedilen ilk dört görüntüyü, adım 3.1.2'de hesaplandığı gibi akciğer voksel miktarı A'yı kullanarak orta inspirasyon seviyesine normalleştirin. Değişen proton yoğunluğunun neden olduğu bu modülasyon azalması şu şekilde ifade edilir:
- Eşik ve istatistik
- Orta dilim ve tüm dilimler için yukarıda belirtilen parametreleri ortalama değer (tüm değerler/orta dilim değerleri) ve standart Sapma (tüm değerler / yalnızca orta dilim değerleri) ile istatistiksel olarak tanımlayın.
- Ek olarak, göreceli bir dağılım hesabı elde etmek için standart sapmayı varyasyon katsayısına göre normalleştirin. Nihai istatistiksel çıktılar olarak ortalama değeri ve varyasyon katsayısını seçin.
- Hata haritaları oluşturmak ve kusur yüzdesi değerlerini türetmek için parametre haritalarına eşikler uygulayın (bkz. Tablo 3).
- Eşiklerin altındaki değerleri ventilasyon veya perfüzyon kusuru (VD/QD) olarak sınıflandırın. Tablo 3'teki dört katlı tabloda gösterildiği gibi aşağıdaki kombinasyonlar da dahil olmak üzere, kusurların ve normal bölgelerin (V/Q sınıfları) örtüşmesini ölçmek için bu haritaları daha fazla birleştirin:
- Ventilasyon Defekti (VD), Perfüzyon Defekti (QD) ve Ventilasyon/Perfüzyon (V/Q) sınıflarının kusur yüzdesini, toplam akciğer parankimi voksellerine göre ilgili sınıfa sahip voksel sayısı olarak hesaplayın:
Kusur Yüzdesi = #DefectVoxels/#LungParenchyma - Her dilim ve bileşik koronal dilimler için bu kusur yüzdesini hesaplayın. Bu çalışma için, bir ventilasyon kusurunun bir ameliyathane işlemi ile belirlendiği kombine yaklaşımı seçin: VD = VD(RVent) VEYA VD(FVL-CM).
NOT: Açıklanan analiz, Forsberg kayıt araç kutusu kullanılarak ticari bir yazılım uygulamasıyla (bkz. Malzeme Tablosu) gerçekleştirilmiştir.
| Parametre | Eşik | Yorum |
| RVent (Cesaret) | 90. Yüzdebirlik * 0.4 | Uyarlanabilir Eşik |
| FVL-CM | 90% | Sabit eşik |
| Q | 90. Yüzdelik Dilim * 0,15 | Uyarlanabilir Eşik |
| V/Q | QD YOK | QD |
| VD YOK | Normal | VQ Uyumsuzluğu (Özel QD) |
| VD | VQ Uyumsuzluğu (Özel VD) | VQ Kusur Eşleşmesi |
Sonuçlar
Şekil 2'nin alt kısmı, dinamik aralık üzerinde karşılık gelen bir etki ile uygun ve yetersiz ölçeklendirmenin sonucunu göstermektedir. Şekil 6, bobin normalizasyonu olmayan ve olmayan taramaları temsil eden homojen olmayan sinyal dağılımını göstermektedir. Düşük dinamik aralıktan ve bobin normalizasyonu olmayan görüntülerden kaçınılması önerilir.
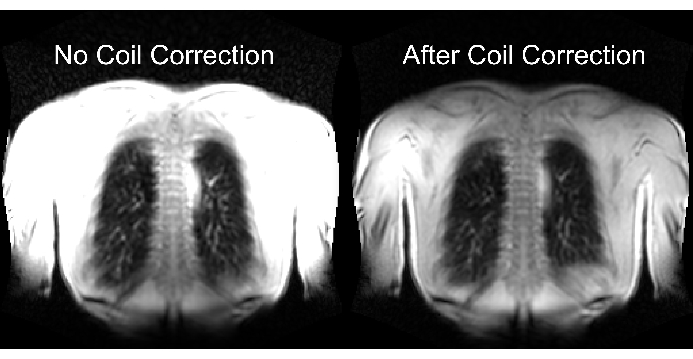
Şekil 6: Bobin düzeltmesi olmadan (yanlış) ve bobin düzeltmesi (doğru) ile alımdan sonra örnek görüntüler. Bobin elemanlarının yakınındaki gövde sınırlarındaki yapay sinyal geliştirmesine dikkat edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 7'de başarılı ve başarısız otomatik segmentasyon gösterilmektedir. Başarısız segmentasyonun, daha fazla analiz ve istatistiği tahrif edecek tüm akciğer voksellerini içermediğini unutmayın. Sızıntıları olan vakalar için özel dikkat gereklidir, çünkü bu tür vokseller, AI modelleri tarafından yüksek sinyalleri nedeniyle damar olarak yanlış sınıflandırılabilir veya hiç segmentlere ayrılmaz.
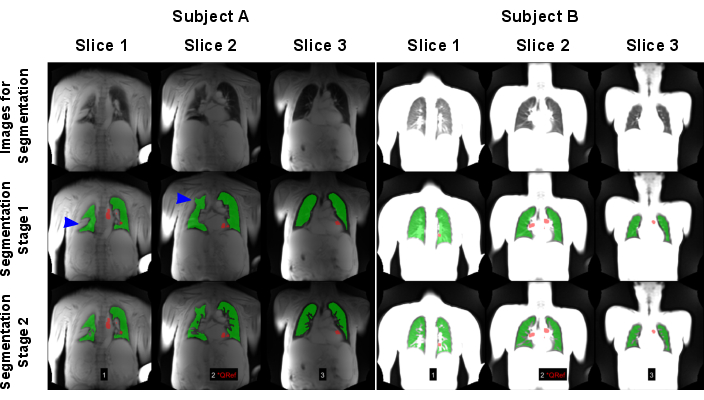
Şekil 7: Başarısız (Denek A: KOAH'lı 83 yaşında erkek) ve başarılı bir sonuçla (Denek B: 30 yaşında kadın sağlıklı kontrol) sonuçlanan otomatik segmentasyon örneği. İlk satır, yapay zeka modelleri için girdi olarak kullanılan görüntüleri gösterir. İkinci sıra, akciğer sınırının bulunmasından oluşan ilk segmentasyon aşamasının sonuçlarını gösterir. Üçüncü sıra, gemilerin dışlanmasından sonraki nihai sonucu gösterir. Mavi oklarla gösterildiği gibi, algoritma, yanlış akciğer sınırı tespitine neden olan yüksek sinyalli akciğer varyansları tarafından sorgulandı. Görüntülerin maksimum sinyalle normalleştirildiğini, bunun da denek A'da gerçekleştirilen taramanın eksik bobin normalizasyonu nedeniyle farklı sonuçlara yol açtığını unutmayın. Kırmızı bölgeler, perfüzyon fazı sıralaması için otomatik olarak algılanan ROI'leri gösterir. Kısaltmalar: KOAH = kronik obstrüktif akciğer hastalığı; ROI'ler = ilgi alanları. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 8 ve Şekil 9 , sağlıklı bir kontrol (30 yaş, kadın) ve bir KOAH hastası (60 yaş, erkek) için temsili parametre haritalarını göstermektedir. Sağlıklı kontrolün daha homojen bir ventilasyon ve perfüzyon gösterdiğini ve dolayısıyla daha az defekt voksel gösterdiğini unutmayın. ROI istatistiklerinin ilgili raporları Tablo 4 ve Tablo 5'te bulunabilir.
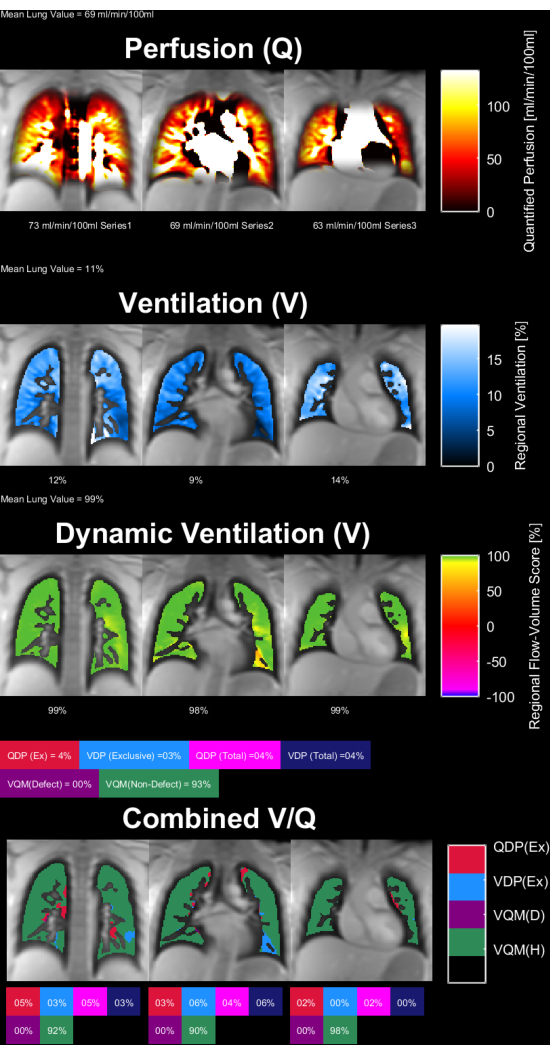
Şekil 8: 30 yaşında bir kadın sağlıklı kontrolün PREFUL parametre haritaları. Perfüzyon (1. sıra), bölgesel ventilasyon (2. sıra), akış-hacim döngü korelasyon metriği (3. sıra) ve eşikli V/Q haritaları (4. sıra). Parankimal değerlerin homojen dağılımına ve düşük kusur yüzdelerine dikkat edin. Kısaltmalar: PREFUL = faz çözümlü fonksiyonel akciğer; V = havalandırma; Q = perfüzyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
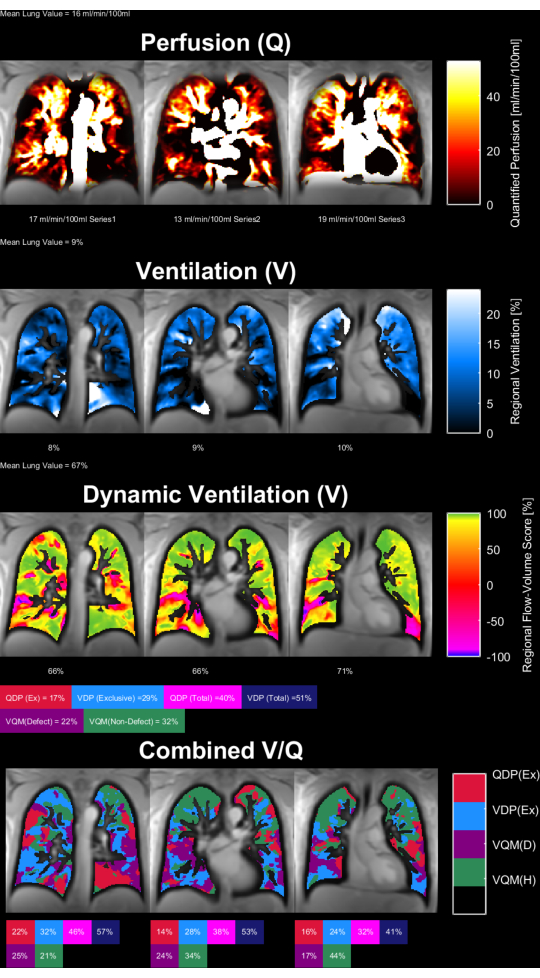
Şekil 9: 60 yaşında bir erkek KOAH hastasının PREFUL parametre haritaları. Perfüzyon (1. sıra), bölgesel ventilasyon (2. sıra), akış-hacim döngü korelasyon metriği (3. sıra) ve eşikli V/Q haritaları (4. sıra). Parankimal değerlerin heterojen dağılımına ve yüksek kusur yüzdelerine dikkat edin. Kısaltmalar: KOAH = kronik obstrüktif akciğer hastalığı; PREFUL = faz çözümlü fonksiyonel akciğer; V = havalandırma; Q = perfüzyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 4: Sağlıklı bir kontrol (30 yaşında kadın) için elde edilen PREFUL parametrelerinin örnek raporu. Aynı konu için Şekil 8'de sunulan parametre haritalarıyla uyumlu olan düşük varyasyon katsayısı ve kusur değerlerine dikkat edin. Ayrıca bakınız Tablo 5 ve Şekil 9. Kısaltma: PREFUL = faz çözümlü fonksiyonel akciğer. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tablo 5: KOAH'lı bir hasta (60 yaşında erkek) için elde edilen PREFUL parametrelerinin örnek raporu. Aynı konu için Şekil 9'da sunulan parametre haritalarıyla uyumlu olan yüksek varyasyon katsayısı ve kusur değerlerine dikkat edin. Ayrıca Tablo 4 ve Şekil 8'e bakınız. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tamamlayıcı Materyal: PREFUL algoritmasının animasyonlu açıklaması. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Kritik adımlar
Edinme sırasındaki en yaygın tuzaklardan biri, dijital veri gösteriminin hassasiyetini azaltarak DICOM dönüşümü sırasında bilgi kaybına neden olan yetersiz sinyal ölçeklendirmesidir. Sonuç olarak, bu, işlem sonrası aşamada sorunlara yol açabilir. Daha da kritik bir başka tuzak, serpiştirilmiş bir şekilde birden fazla dilimin elde edilmesidir. Böylece, tek tek dilimlerin etkin zamansal çözünürlüğü kritik bir şekilde azaltılır. Ek olarak, dilimlerin mesafesine bağlı olarak, bu, perfüzyon kontrastı ve niceliği üzerinde bir etkiye sahip olabilir, çünkü akış, manyetizasyon geçmişi olmayan taze dönüşlere dayanır. Protokol kurulumu sırasında, özellikle gradyan kuvveti, asimetrik yankı, bant genişliği ve paralel görüntüleme ile ilgili olarak özel dikkat gereklidir. Bu parametrelerden sadece biri için bile önerilen ayarlardan sapmalar, yetersiz TE ve zamansal çözünürlüğe yol açabilir.
Son işlem, açıklanan sırayla izlenmesi gereken birden fazla adımdan oluşur. Örneğin, alçak geçiren filtrelemeden sonra yapılan bir kayıt anlamlı değildir. Sonuç olarak, bir adımdaki başarısızlık, sonraki adımlarda bir arızaya yol açar. Bu, kayıt aşamasını özellikle önemli hale getirir. Tek bir kayıt algoritması olmadığından, ilgili uygulamaya bağlı olarak, parametrelerin ampirik olarak ayarlanması gerekir. Bu parametrelerin ince ayarı yapılmadan, yanlış bir kayıt, anlamlı bir sonucun oluşturulmasını engelleyecektir. İşlem sonrası sırasında muhtemelen zaman alıcı ve kritik bir başka adım da segmentasyondur. Yanlış segmentasyonlar, nihai raporda tamamen yanlış parametre hesaplamalarına (örneğin, akciğer dışı bölgeleri dahil ederek) yol açabilir. Bu tür yanlış segmentasyonların, belirli görüntü görünümlerine alışkın olan ve biraz farklı bir görünüme sahip başka bir satıcıdan/makineden alınan görüntülere uygulanan derin öğrenme algoritmalarında ortaya çıkma olasılığı daha yüksektir. Bu nedenle, potansiyel manuel düzeltme ile segmentasyon doğruluğunun görsel kalite kontrolü zorunludur.
Sorun giderme
Tipik sorun giderme prosedürü, tüm adımları tek tek takip etmek ve ara sonuçların akla yatkınlığını kontrol etmektir. Ana adımlar için prosedür aşağıdaki gibidir: Görüntülerin doğru sıra ve ayarlarla serbest nefes alarak elde edildiğini kontrol edin. Ardından, sinyallerin dinamik aralığının uygun olup olmadığını kontrol edin (akciğer parankiminde ~ 50 AU). Ham veriler hala mevcutsa, yeni bir veri alımına gerek kalmadan görüntülerin yeniden oluşturulmasını uygun bir ölçeklendirme faktörüyle tekrarlayın. Kaydın büyük artefaktlar ve kalan hareket olmadan gerçekleştirilip gerçekleştirilmediğini kontrol edin. Ardından, küçük ROI'lerin beklenen ventilasyon ve perfüzyonla ilgili modülasyonlara sahip bir zaman serisi gösterip göstermediğini kontrol edin. Ardından, uygulanan filtrelerin görüntüleri beklenen şekilde değiştirip değiştirmediğini kontrol edin (örneğin, düşük geçişli filtrelenmiş verilerde yüksek frekans modülasyonu yok). Sentezlenen solunum ve kalp döngülerinin fizyolojik olup olmadığını ve ani sıçramalar gösterip göstermediğini kontrol edin. Segmentasyon doğruluğunu kontrol edin. Sorunun ortaya çıktığı ana adım belirlenir belirlenmez daha hassas bir çözünürlük düzeyinde bir arama yapılması gerekebileceğini unutmayın.
Sınırlama
Sunulan protokolün tekrarlanabilir ve hassas sonuçlar ürettiği bilinmesine rağmen, edinme ve işlem sonrası sırasında ilgili adımların ve parametrelerin sayısı neredeyse sonsuz optimizasyona izin verir ve iç içe geçmiştir. Bu nedenle, aşağıdan yukarıya bir yaklaşım, önce dizi protokolünün optimizasyonlarını ele alarak izlenmelidir (örneğin, SNR ve işlevsel kontrast-gürültü oranı ile ilgili olarak). Aşağıdaki işlem sonrası optimizasyonlar için, dijital akciğer modeli biçiminde önceden tanımlanmış bir temel gerçek yararlı olabilir40. Sunulduğu gibi, bu model serbest nefes almayı taklit eder ve ventilasyon/perfüzyon kusurlarını simüle etmek için çeşitli sınıflar içerir. Harekete bağlı bilinen bir deformasyon da dahil olmak üzere, kayıt algoritmaları doğrudan da test edilebilir. Bu avantajlara rağmen, her model, karmaşık gerçekliği sonlu ve basitleştirilmiş bir modele eşlemenin doğruluğu ile doğal olarak sınırlıdır.
Bu protokolde sunulan eşiklerin, ampirik analizle sağlıklı gönüllüler ve farklı hasta kohortları arasında makul sonuçlar gösterdiği bulunmuştur. Bununla birlikte, daha önce belirtildiği gibi, sıraya, alan kuvvetine ve kohorta bağlı olarak muhtemelen ayarlama yapılması gerekecektir.
PREFUL'un genel bir sınırlaması, Siemens Healthineers ve BioVisioneers'ın ilk devam eden çalışma versiyonları bilimsel bir işbirliği/ticari ortamda bilimsel amaçlar için mevcut olmasına rağmen, henüz tıbbi bir ürün olarak hazır bulunmayan kapsamlı son işlemedir. Hesaplamalar tipik olarak, özellikle CPU ve RAM üzerinde yüksek talepler oluşturan ve büyük miktarda veriyi etkili bir şekilde işlemek için modern iş istasyonları veya sunucu çözümleri gerektirebilen paralel işlemeyi içerir. Ayrıca, zaman alan son işlem adımları şu anda sonuçların anında sunulmasını engellemektedir ve bu da klinik iş akışı için arzu edilen bir durumdur.
Diğer yöntemlerle karşılaştırma
Selefi Fourier Ayrışması ve Matrix Pencil Decomposition41 gibi diğer türevleri ve biraz farklı yaklaşım olan Kendinden Kapılı Kontrastla Geliştirilmiş Fonksiyonel Akciğer MRI (Senceful MRI)42 dahil olmak üzere PREFUL gibi çok sayıda benzer yaklaşım vardır. Fourier Ayrıştırması ve benzer yöntemler frekans alanında çalışırken, PREFUL daha az katı Fourier filtrelemesi ve ardından zaman alanındaki genliklerin hesaplanmasını kullanır. Bu nedenle, ventilasyon/perfüzyona karşılık gelen belirli piklerin seçilmesine gerek yoktur. Bu, insan deneklerde meydana geldiği bilinen solunum değişkenliğine karşı daha az duyarlılığa neden olabilir.
PREFUL görüntü sıralaması gerçekleştirirken, SENCEFUL k-uzay çizgilerinin sıralamasını kullanır ve bu da daha fazla esneklik sağlar. Bununla birlikte, SENCEFUL, kendi kendine geçit özelliklerine sahip diziler gerektirirken, PREFUL geleneksel bir şımarık gradyan yankı dizisi ile gerçekleştirilebilir. Benzer şekilde, Fourier Ayrıştırma tabanlı yaklaşımlarda yaygın olarak kullanılan bSSFP, daha iyi SNR ve kan akışı kontrastı ile bilinir, ancak tipik olarak, özellikle 3T43'te akciğer edinimi için daha fazla optimizasyon gerektirir. Bununla birlikte, bunun dışında PREFUL'u bSSFP edinimi44 ile birleştirmemek için hiçbir neden yoktur.
Tüm bu sinyal tabanlı yaklaşımlar, T1, T2/T2*, difüzyon, düzlem boyunca hareket ve ortogonal olarak perfüze olmayan vokseller dahil olmak üzere belirli istenmeyen sinyal etkilerinin ihmal edilebilir olduğunu varsayar. PREFUL'un ilerlemiş validasyonu, dolaylı olarak bu tür etkilerin gerçekten de kritik olmadığını düşündürürken, Triphan ve ark. TE45'e bağlı olarak kan ve parankimal bileşenlerin farklı ağırlıklandırılmasıyla açıklanan etkili T1 ve TE'ye bir bağımlılık olduğunu göstermiştir. Bu bağlamda, bSSFP'nin T2/T1 kontrastına bağlı kanı görselleştirmek için ilk avantajı, bir SPGRE'nin daha basit kontrast mekaniğine kıyasla doğru bir miktar belirleme oluşturmak için ek bir zorluk oluşturabilir. Bununla birlikte, örneğin Glandorf ve ark.kontrast madde 46,47 için yaptığı gibi, çeşitli MR değişkenlerinin etkisini doğrudan ele alan daha ileri çalışmalar, PREFUL üzerindeki etkiyi doğrudan ölçebildikleri için arzu edilir.
Önem
Serbest nefes alan, kontrast madde içermeyen bir yöntem olan PREFUL, daha önce bahsedilen ilgili yöntemlerle birçok avantajı paylaşır: 1) İyonlaştırıcı radyasyon ve kontrast madde uygulaması yok, 2) Ek donanım veya personel gerektirmez, 3) yalnızca minimum hasta uyumuna bağlı olan edinim. Bu avantajlar, PREFUL'u özellikle kronik akciğer hastalığı olan çocuklar gibi savunmasız gruplar için uygun bir izleme aracı haline getirir. SPGRE dizisi ile SNR düşük olmasına rağmen, kullanılabilirlik ve ek dizi programlama/paylaşımı için gereklilik eksikliği, bu yaklaşımın yayılmasını daha da teşvik etmektedir.
Giriş bölümünde tartışıldığı gibi, iyi doğrulama, tekrarlanabilirlik, duyarlılık sonuçları ve izleme yetenekleri gösteren çalışmaların sayısı, bu tekniğin ve karşılık gelen dinamik parametrelerin öneminin yükselen bir yörüngede olduğunu ve geniş bir yaygınlaştırma ile daha da destekleneceğini göstermektedir.
Açıklamalar
Filip Klimeš, Andreas Voskrebenzev ve Jens Vogel-Claussen, pulmoner manyetik rezonans görüntüleme yöntemleriyle ilgilenen bir şirket olan BioVisioneers GmbH'nin hissedarlarıdır.
Teşekkürler
Bu çalışma Alman Akciğer Araştırmaları Merkezi (DZL) tarafından finanse edildi. Yazarlar, PREFUL'un daha da geliştirilmesine katkıda bulunan ve destekleyen herkese, özellikle de Marcel Gutberlet, Till F. Kaireit, Lea Behrendt, Julian Glandorf, Sonja Lüdiger, Tawfik Moher Alsady, Katharina Bünemann, Marius Wernz, Robin Müller, Maximilian Zubke, Gesa Pöhler, Agilo Kern, Cristian Crisosto, Milan Speth, Arnd Obert, Julienne Scheller, Jim Wild, Edwin van Beek, Helen Marshall, Jens Gottlieb, Martha Dohna, Diane Renz, Anna-Maria Dittrich, Tobias Welte, Jens Hohlfeld, Patrick Zardo, Giles Santyr, Franz Wolfgang Hirsch, Robert Grimm, Bastian Bier, Bassem Ismail, André Fischer, Berthold Kiefer, Gregor Thoermer ve Rebecca Ramb. Ayrıca, yazarlar radyograflara ve çalışma katılımcılarına da teşekkür etmek isterler. Özellikle, Radyoloji Bölümü'nden (Hannover Tıp Fakültesi) Frank Schröder ve Sven Thiele'ye MRG incelemelerinin gerçekleştirilmesindeki olağanüstü teknik yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Advanced Normalization Tools (ANTs) | - | Image registration toolbox (https://stnava.github.io/ANTs/; https://github.com/fordanic/image-registration) | |
| Forsberg | - | Image registration toolbox | |
| MRI | Siemens Healthineers AG, Munich, Germany | 0.55T / 1.5T / 3T Scanner | |
| PREFUL App | BioVisioneers GmbH, Laatzen, Germany | PREFUL analysis, Figures and reports |
Referanslar
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Eur Respir J. 49 (3), 1700214 (2017).
- Ranu, H., Wilde, M., Madden, B. Pulmonary function tests. Ulster Med J. 80 (2), 84-90 (2011).
- Galbán, C. J., et al. Computed tomography-based biomarker provides unique signature for diagnosis of COPD phenotypes and disease progression. Nat Med. 18 (11), 1711-1715 (2012).
- Roach, P. J., Schembri, G. P., Bailey, D. L. V/Q Scanning using SPECT and SPECT/CT. J Nucl Med. 54 (9), 1588-1596 (2013).
- Wild, J. M., et al. MRI of the lung (1/3): methods. Insights Imaging. 3 (4), 345-353 (2012).
- Albert, M. S., et al. Biological magnetic resonance imaging using laser-polarized 129Xe. Nature. 370 (6486), 199-201 (1994).
- Berthezène, Y., et al. Contrast-enhanced MR imaging of the lung: assessments of ventilation and perfusion. Radiology. 183 (3), 667-672 (1992).
- Hughes, P. J. C., et al. Assessment of the influence of lung inflation state on the quantitative parameters derived from hyperpolarized gas lung ventilation MRI in healthy volunteers. J Appl Physiol. 126 (1), 183-192 (2019).
- Zapke, M., et al. Magnetic resonance lung function - a breakthrough for lung imaging and functional assessment? A phantom study and clinical trial. Respir Res. 7 (1), 106 (2006).
- Klimeš, F., et al. Free-breathing quantification of regional ventilation derived by phase-resolved functional lung (PREFUL) MRI. NMR Biomed. 32 (6), e4088 (2019).
- Deimling, M., Jellus, V., Geiger, B., Chefd'hotel, C. Time resolved lung ventilation imaging by Fourier decomposition. Proc. Intl. Soc. Mag. Reson. Med. 16, 2639 (2008).
- Bauman, G., et al. Non-contrast-enhanced perfusion and ventilation assessment of the human lung by means of fourier decomposition in proton MRI. Magn Reson Med. 62 (3), 656-664 (2009).
- Bauman, G., et al. Lung ventilation- and perfusion-weighted Fourier decomposition magnetic resonance imaging: In vivo validation with hyperpolarized 3He and dynamic contrast-enhanced MRI. Magn Reson Med. 69 (1), 229-237 (2013).
- Bauman, G., et al. Validation of Fourier decomposition MRI with dynamic contrast-enhanced MRI using visual and automated scoring of pulmonary perfusion in young cystic fibrosis patients. Eur J Radiol. 82 (12), 2371-2377 (2013).
- Sommer, G., et al. Non-contrast-enhanced preoperative assessment of lung perfusion in patients with non-small-cell lung cancer using Fourier decomposition magnetic resonance imaging. Eur J Radiol. 82 (12), e879-e887 (2013).
- Voskrebenzev, A., Gutberlet, M., Becker, L., Wacker, F., Vogel-Claussen, J. Reproducibility of fractional ventilation derived by Fourier decomposition after adjusting for tidal volume with and without an MRI compatible spirometer. Magn Reson Med. 76 (5), 1542-1550 (2016).
- Voskrebenzev, A., Gutberlet, M., Kaireit, T. F., Wacker, F., Vogel-Claussen, J. Low-pass imaging of dynamic acquisitions (LIDA) with a group-oriented registration (GOREG) for proton MR imaging of lung ventilation. Magn Reson Med. 78 (4), 1496-1505 (2017).
- Voskrebenzev, A., et al. Feasibility of quantitative regional ventilation and perfusion mapping with phase-resolved functional lung (PREFUL) MRI in healthy volunteers and COPD, CTEPH, and CF patients. Magn Reson Med. 79 (4), 2306-2314 (2018).
- Voskrebenzev, A., et al. Imaging-based spirometry in chronic obstructive pulmonary disease (COPD) patients using phase resolved functional lung imaging (PREFUL). Proc. Intl. Soc. Mag. Reson. Med. 26, 1079 (2018).
- Alsady, T. M., et al. MRI-derived regional flow-volume loop parameters detect early-stage chronic lung allograft dysfunction. J Magn Reson Imaging. 50 (6), 1873-1882 (2019).
- Pöhler, G. H., et al. Chronic thromboembolic pulmonary hypertension perioperative monitoring using phase-resolved functional lung (PREFUL)-MRI. J Magn Reson Imaging JMRI. 52 (2), 610-619 (2020).
- Behrendt, L., et al. Validation of automated perfusion-weighted phase-resolved functional lung (PREFUL)-MRI in patients with pulmonary diseases. J Magn Reson Imaging. 52 (1), 103-114 (2020).
- Kaireit, T. F., et al. Flow volume loop and regional ventilation assessment using phase-resolved functional lung (PREFUL) MRI: comparison with 129 xenon ventilation MRI and lung function testing. J Magn Reson Imaging JMRI. 53 (4), 1092-1105 (2021).
- Marshall, H., et al. 129Xe and free-breathing 1H ventilation MRI in patients with cystic fibrosis: a dual-center study. J Magn Reson Imaging. 57 (6), 1908-1921 (2023).
- Behrendt, L., et al. A dual center and dual vendor comparison study of automated perfusion-weighted phase-resolved functional lung magnetic resonance imaging with dynamic contrast-enhanced magnetic resonance imaging in patients with cystic fibrosis. Pulm Circ. 12 (2), e12054 (2022).
- Moher Alsady, T., et al. Multicenter standardization of phase-resolved functional lung MRI in patients with suspected chronic thromboembolic pulmonary hypertension. J Magn Reson Imaging. , (2023).
- Pöhler, G. H., et al. Repeatability of phase-resolved functional lung (PREFUL)-MRI ventilation and perfusion parameters in healthy subjects and COPD patients. J Magn Reson Imaging. 53 (3), 915-927 (2021).
- Voskrebenzev, A., et al. PREFUL MRI depicts dual bronchodilator changes in COPD: a retrospective analysis of a randomized controlled trial. Radiol Cardiothorac Imaging. 4 (2), e210147 (2022).
- Vogel-Claussen, J., et al. Phase-resolved functional lung (PREFUL) MRI-derived ventilation and perfusion parameters predict future lung transplant loss. Radiology. 307 (4), e221958 (2023).
- Zanette, B., et al. Clinical feasibility of structural and functional MRI in free-breathing neonates and infants. J Magn Reson Imaging. 55 (6), 1696-1707 (2022).
- Dyke, J. P., et al. Assessment of lung ventilation of premature infants with bronchopulmonary dysplasia at 1.5 Tesla using phase-resolved functional lung magnetic resonance imaging. Pediatr Radiol. 53 (6), 1076-1084 (2023).
- Glandorf, J., et al. Comparison of phase-resolved functional lung (PREFUL) MRI derived perfusion and ventilation parameters at 1.5T and 3T in healthy volunteers. PLOS ONE. 15 (12), e0244638 (2020).
- Lévy, S., et al. Free-breathing low-field MRI of the lungs detects functional alterations associated with persistent symptoms after COVID-19 infection. Invest Radiol. 57 (11), 742-751 (2022).
- Avants, B. B., et al. A reproducible evaluation of ANTs similarity metric performance in brain image registration. NeuroImage. 54 (3), 2033-2044 (2011).
- Forsberg, D., Andersson, M., Knutsson, H. Extending image registration using polynomial expansion to diffeomorphic deformations. SSBA Symposium on Image Analysis. , (2012).
- . fordanic/image-registration Available from: https://github.com/fordanic/image-registration (2022)
- Klimeš, F., et al. Evaluation of image registration algorithms for 3D phase-resolved functional lung ventilation magnetic resonance imaging in healthy volunteers and chronic obstructive pulmonary disease patients. NMR Biomed. 36 (3), e4860 (2023).
- He, K., Sun, J., Tang, X. Guided image filtering. IEEE Trans Pattern Anal Mach Intell. 35 (6), 1397-1409 (2013).
- Glandorf, J., et al. Perfusion quantification using voxel-wise proton density and median signal decay in PREFUL MRI. Magn Reson Med. 86 (3), 1482-1493 (2021).
- Voskrebenzev, A., Gutberlet, M., Klimeš, F., Wacker, F., Vogel-Claussen, J. Introduction of a Digital Lung Model for Validation and Refinement of Functional Lung Imaging Methods. Proc. Intl. Soc. Mag. Reson. Med. 31, 4820 (2023).
- Bauman, G., Bieri, O. Matrix pencil decomposition of time-resolved proton MRI for robust and improved assessment of pulmonary ventilation and perfusion. Magn Reson Med. 77 (1), 336-342 (2017).
- Fischer, A., et al. SElf-gated Non-Contrast-Enhanced FUnctional Lung imaging (SENCEFUL) using a quasi-random fast low-angle shot (FLASH) sequence and proton MRI. NMR Biomed. 27 (8), 907-917 (2014).
- Bauman, G., Pusterla, O., Bieri, O. Functional lung imaging with transient spoiled gradient echo. Magn Reson Med. 81 (3), 1915-1923 (2019).
- Rotärmel, A., et al. GRE bSSFP vs. FLASH based Fourier decomposition lung MRI at 1.5T: evaluation of image quality, fractional ventilation and lung perfusion in healthy volunteers. Prog Intl Soc Mag Reson. 26, 2-4 (2018).
- Triphan, S. M. F., et al. Echo time-dependent observed lung T1 in patients with chronic obstructive pulmonary disease in correlation with quantitative imaging and clinical indices. J Magn Reson Imaging. 54 (5), 1562-1571 (2021).
- Glandorf, J., et al. Effect of intravenously injected gadolinium-based contrast agents on functional lung parameters derived by PREFUL MRI. Magnetic Resonance in Medicine. 83 (3), 1045-1054 (2020).
- Glandorf, J., et al. Influence of gadolinium, field-strength and sequence type on quantified perfusion values in phase-resolved functional lung MRI. PloS One. 18 (8), e0288744 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır