需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用肽:主要组织相容性复合物四聚体鉴定小鼠肺中的稀有抗原特异性 T 细胞
摘要
我们提供了详细的方案,用于通过基于磁珠的 T 细胞富集和肽:主要组织相容性复合物 (MHC) 四聚体来分离和鉴定小鼠肺中罕见的抗原特异性 T 细胞群。
摘要
在健康和疾病过程中抗原特异性 T 细胞的鉴定和表征仍然是提高我们对免疫病理生理学理解的关键。肽:MHC 四聚体试剂的开发大大推进了在内源性 T 细胞库中追踪抗原特异性 T 细胞群的技术挑战。这些荧光标记的 MHC I 类或 II 类分子的可溶性多聚体与抗原肽表位复合,直接与具有相应 T 细胞受体 (TCR) 特异性的 T 细胞结合,因此可以识别天然状态下的抗原特异性 T 细胞群,而无需离 体 诱导的功能反应刺激。对于极其罕见的群体,可以磁性富集四聚体结合的 T 细胞,以提高检测的灵敏度和可靠性。
随着组织驻留 T 细胞免疫研究的深入,迫切需要识别转运到非淋巴组织并驻留在非淋巴组织中的抗原特异性 T 细胞。在该协议中,我们提出了一组详细的说明,用于分离和表征小鼠肺中存在的抗原特异性 T 细胞。这包括从消化的肺组织中分离 T 细胞,然后进行一般的 T 细胞磁性富集步骤和四聚体染色,以进行流式细胞术分析和分选。该方案中强调的步骤利用了常用技术和现成的试剂,使其几乎适用于任何从事小鼠 T 细胞免疫学的研究人员,并且高度适用于驻留在肺内的任何低频抗原特异性 T 细胞群的各种下游分析。
引言
适应性免疫系统的核心在于 T 细胞识别和响应特定抗原的能力。T 细胞何时何地对其同源抗原做出反应,决定了感染与自身免疫、体内平衡与癌症、健康与疾病1 的平衡。因此,在免疫的特定背景下对 T 细胞的研究应侧重于对感兴趣的相关抗原具有特异性的细胞。在大大增强表征抗原特异性 T 细胞群能力的技术进步中,主要组织相容性复合体 (MHC) I 类或 II 类分子的荧光标记的可溶性多聚体(通常是四聚体)与抗原肽表位复合,更广为人知的是"肽:MHC 四聚体"2,3,4,5 .通过代表 T 细胞抗原受体 (TCR) 的天然配体,peptide:MHC I 类和 II 类四聚体提供了一种在免疫系统中 T 细胞的内源性库中分别直接识别抗原特异性 CD8+ 和 CD4+ T 细胞的方法,而无需在测定中对抗原刺激做出反应。与 TCR 转基因 T 细胞过继转移模型相比,四聚体代表了一种更优雅的抗原特异性 T 细胞研究方法6,并且已越来越多地用于识别实验小鼠模型和人类疾病中的外源和自身抗原特异性 T 细胞群 4,5。
虽然四聚体可以很容易地识别响应抗原刺激而扩增的高频 T 细胞群,但它们对幼稚、自身抗原特异性或记忆 T 细胞的使用受到这些细胞群的极低频率的限制7。我们小组和其他人已经开发并推广了基于四聚体的磁性富集策略,这些策略提高了检测的灵敏度,从而能够研究小鼠淋巴组织中的这些细胞群 8,9,10,11。
该领域组织驻留 T 细胞的出现使开发研究非淋巴间隙 T 细胞的新方法变得更加重要。与许多其他粘膜表面一样,肺部的 T 细胞会遇到一系列来自宿主上皮、共生和感染性微生物以及环境实体(包括过敏原)的自身抗原和外来抗原。对从非淋巴组织 (NLT) 收获的 T 细胞的转录分析表明,一种记忆样表型,具有独特的组织特异性命运和功能,通常针对运输和组织稳态12。此外,组织驻留记忆 T 细胞 (Trm) 往往比循环中的记忆 T 细胞更受克隆限制13。确定抗原如何以及为何驱动 T 细胞在 NLT 中驻留,对于了解免疫系统如何抵御感染、维持组织稳态以及有时演变为自身免疫至关重要。然而,与其他 NLT14 相比,来自肺部的组织驻留 T 细胞似乎存在更大的损耗。因此,识别和表征具有给定抗原特异性的肺内源性 T 细胞的能力受到其固有稀有性的限制。
通过将基于磁珠的细胞富集技术和肽:MHC 四聚体染色相结合,我们成功检测了小鼠肺中扩增但罕见的自身抗原特异性 T 细胞15,16。在这里,我们详细描述了一种方案,我们对其进行了优化,以可靠地分离和表征小鼠肺中存在的任何罕见抗原特异性 T 细胞群(图 1)。该方案包括一个体内抗体染色步骤,以区分组织驻留 T 细胞和血管 T 细胞17,然后采用两种不同的肺组织处理方法以适应资源可用性。然后进行一般的 T 细胞磁性富集步骤、四聚体染色和流式细胞术分析。在该方案中,通过添加氨基胍进一步增强细胞活力和四聚体染色,氨基胍阻断诱导型一氧化氮合酶 (iNOS) 介导的 T 细胞活化诱导的细胞凋亡18 和达沙替尼,限制 TCR 下调19。该方案中强调的步骤利用了常用技术和现成的试剂,使几乎所有从事小鼠 T 细胞免疫学的研究人员都可以使用,并且高度适用于各种下游分析。虽然在肺部不太可能发现幼稚 T 细胞,但我们相信该方案将特别有助于研究肺部的自身抗原特异性 T 细胞和 Trms。
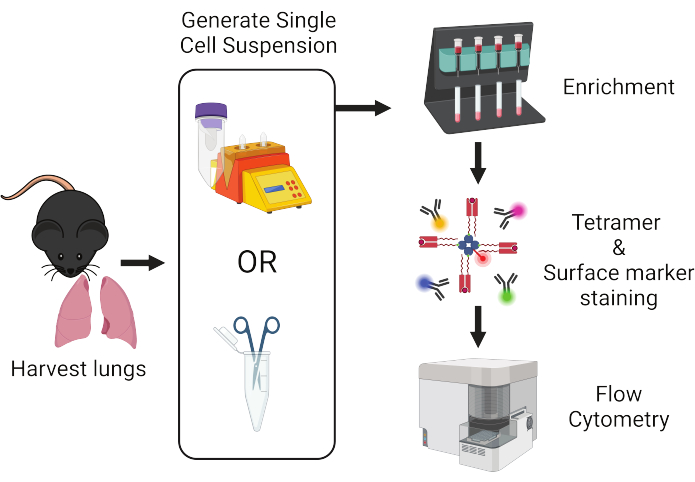
图 1:方案工作流程概述。 从小鼠身上收获肺并解离成单个细胞。随后,在用 peptide:MHC 四聚体和荧光标记抗体染色之前,样品中富集 T 细胞,用于流式细胞术分析。 请单击此处查看此图的较大版本。
研究方案
本协议中描述的程序是根据马萨诸塞州总医院机构动物护理和使用委员会 (IACUC) 制定的指导方针批准和制定的,该委员会是美国实验动物护理认证协会 (AAALAC) 认可的动物管理计划。在 8-12 周龄雄性和雌性小鼠身上进行了实验,其遗传背景是在 MGH 动物设施中在特定无病原体条件下培育和维持的 C57BL/6 遗传背景。
1. 制备储备液
- 通过溶解 10 mM HEPES、5 mM KCl、1.8 mM CaCl2、150 mM NaCl 和 1 mM MgCl2 来制备 HEPES 缓冲液,并调节至 pH 7.4。
- 通过将 700 μg/mL 的 Liberase 嗜热菌蛋白酶培养基 (TM)(参见 材料表)溶解在含 Ca++ 和 Mg++ 的 Hank 平衡盐溶液中,制备 10x Liberase 储备液(参见 材料表)。
- 通过将 100 mM 氨基胍半硫酸盐(参见 材料表)溶解在含 Ca++ 和 Mg++ 的 Hank 平衡盐溶液中,制备 10x 氨基胍储备液(参见 材料表)。
- 通过将 EHAA 培养基(参见 材料表)与 10% 胎牛血清 (FBS)、100 U/mL 青霉素/链霉素、50 μg/mL 庆大霉素、2 mM L-谷氨酰胺和 55 μM 2-巯基乙醇混合,制备完整的鹰火腿氨基酸 (EHAA) 培养基。
注:也可以使用其他常见的 T 细胞培养基,例如 RPMI 或 DMEM。 - 通过将 1x PBS 与 2% FBS 和 0.05% 叠氮化钠混合来制备分选缓冲液。
- 通过在分选缓冲液中以 1:100 v/v 稀释纯化的抗小鼠 CD16/32 抗体(参见 材料表)来制备 Fc 阻滞。
- 在不含 L-谷氨酰胺的 RPMI 1640 培养基中加入 100 μg/mL Liberase TM 和 50 μg/mL DNase I(参见 材料表),制备 Liberase TM/DNase 消化液(参见 材料表)。
- 通过在生理盐水 (0.9% NaCl) 中加入 10 mg/mL 氯胺酮(参见材料表)和 1 mg/mL 甲苯噻嗪(参见材料表)来制备氯胺酮/甲苯噻嗪混合物。
2. 通过自动组织解离器从肺组织生成单细胞悬液
- 对于每只小鼠,在专门的组织解离管中准备 4 mL 冰冷的 HEPES 缓冲液(参见 材料表)并将其保存在冰上。
- 通过腹膜内注射 150-200 μL 氯胺酮/甲苯噻嗪混合物麻醉小鼠。将 1-3 μg 荧光团偶联的抗小鼠 CD45 抗体(参见 材料表)用 100 μL 生理盐水静脉注射到每只麻醉的小鼠中。抗体给药后 3 分钟,腹膜内注射 500-600 μL 氯胺酮/甲苯噻嗪混合物,对小鼠实施安乐死。
- 切除肺并将它们放入各自的组织解离管中,并在冰上冷却。将试管放在自动组织分离器上(参见 材料表)并运行肺组织的第一个程序(预设程序)。
- 向含有解离肺组织的每根试管中加入 500 μL Liberase 储备溶液和 500 μL 氨基胍储备溶液。在 37 °C 下在章动混合器上孵育 30 分钟。
- 将试管放回分离器上,然后对肺组织运行第二个程序(预设程序)。
- 将组织解离管中的单细胞悬液通过 100 μm 细胞过滤器(参见 材料表)倒入 50 mL 锥形管中。用 5 mL 完全 EHAA(或任何等效的 T 细胞培养基)冲洗组织分离管,然后通过过滤器进入 50 mL 管中。
- 取下过滤器,将细胞悬液的体积增加到 50 mL,含完全 EHAA。将细胞悬液在 4 °C 下以 400 x g 离心 5 分钟。 小心吸出上清液,留下大约 100 μL 的上清液和细胞沉淀。
- 加入约 100 μL Fc Block 溶液,使总体积达到 200 μL,并剧烈涡旋以重悬沉淀。
3. 替代方案:通过手动解离从肺组织生成单细胞悬液
- 对于每只小鼠,在 1.5 mL 微量离心管中制备 1 mL 完全 EHAA,并保持在冰上。
- 通过腹膜内注射 150-200 μL 氯胺酮/甲苯噻嗪混合物麻醉小鼠。将 1-3 μg 荧光团偶联的抗小鼠 CD45 抗体在 100 μL 生理盐水中稀释,静脉注射到每只麻醉的小鼠中。抗体给药后 3 分钟,腹膜内注射 500-600 μL 氯胺酮/甲苯噻嗪混合物,对小鼠实施安乐死。
- 切除肺部并将它们放入各自的 1.5 mL 微量离心管中,并在冰上冷却。
- 收集完所有肺后,将每个肺转移到不含任何细胞培养基的新鲜微量离心管中。
- 在微量离心管内用剪刀将肺切成小块(~2-3 毫米块)。
- 向每个试管中加入 1 mL Liberase TM/DNase I 消化混合物。
- 在 37 °C 下在水浴中孵育 30 分钟。之后将样品放回冰中以防止过度消化。
- 将样品倒入放置在 50 mL 锥形管顶部的 100 μm 细胞过滤器上。用无菌 1 mL 注射器中柱塞的橡胶端将组织捣碎在网眼上。
- 用冷分选缓冲液冲洗过滤器,在试管中收集 7 mL 的最终体积。将细胞悬液在 4 °C 下以 400 x g 离心 5 分钟。 小心吸出上清液,留下约 100 μL 的上清液和细胞沉淀。
- 加入 100 μL Fc Block 溶液,使总体积达到 200 μL,并剧烈涡旋以重悬沉淀。
4. 通过磁珠富集富集肺部样品中的 T 细胞
- 加入 50 μL 抗小鼠 CD90.2 微珠(参见 材料表)。涡旋并在 4 °C 下孵育 10 分钟。
注意:CD90.2 对应于 C57BL/6 小鼠中 T 细胞表达的等位基因。如果使用其他小鼠品系,请检查等位基因基因型。 - 同时,将顺磁性细胞分离柱(参见 材料表)放在一个或四个位置的细胞分离磁体上(参见 材料表)。在每根色谱柱下方放置一根开口的 15 mL 锥形管,以捕获流出物。用 3 mL 冷分选缓冲液灌注色谱柱,使色谱柱在重力作用下排入下面的锥形管中。
- 细胞与微珠一起孵育 10 分钟后,加入 1 mL 体积的冷分选缓冲液,并通过放置在柱顶部的 100 μm 细胞过滤器转移。将色谱柱流收集到放置在色谱柱下方的新鲜 15 mL 锥形管中。
- 一旦细胞悬液在重力作用下完全排空通过色谱柱,用额外的 3 mL 冷分选缓冲液冲洗原管,然后通过网片将其涂抹到色谱柱上,从而冲洗过滤器。取下过滤器。
- 当样品再次完全排空到色谱柱中,并且没有进一步的流出色谱柱时,从磁力架上取下色谱柱,并将其放在新的 15 mL 锥形管上。
- 向色谱柱中加入 5 mL 冷分选缓冲液。
- 将色谱柱柱塞以一个连续动作推入顶部,并将分选缓冲液从色谱柱底部推入新管中,立即洗脱与色谱柱结合的细胞。
- 将洗脱的样品在 4 °C 下以 400 x g 离心 5 分钟。 小心吸出上清液,留下大约 100 μL 的上清液和细胞沉淀。
- 加入 100 μL 冷分选缓冲液,使总体积达到 200 μL,并剧烈涡旋以重悬沉淀。
- 如果需要,分析含有未结合细胞组分的流通样品。
5. 用 peptide:MHC 四聚体对抗原特异性 T 细胞进行染色
- 向每个样品中加入 1 μL 10 μM 达沙替尼(参见 材料表),涡旋,并在室温下孵育 5 分钟。
- 添加 PE 或 APC 偶联肽:MHC 四聚体至终浓度为 10 nM(或给定四聚体的经验优化浓度)。
- 涡旋并在室温下在黑暗中孵育 1 小时(或根据经验优化的时间和温度)。
6. 通过流式细胞术分析四聚体标记的 T 细胞
- 当样品用 peptide:MHC 四聚体染色时,制备抗体预混液以对细胞表面标志物进行染色(表 1)。
注:避免使用与静脉内给药的 CD45 抗体或四聚体冲突的荧光团。 - 在四聚体染色的孵育期剩余 15 分钟时,向每个样品中加入 1:100(或经验优化浓度)的表面抗体预混液。
- 在 RT 下继续在黑暗中孵育 1 小时孵育期的剩余时间。
- 加入 50,000 个流式细胞计数微珠(参见 材料表),并加入冷分选缓冲液至最终体积约为 5 mL。将染色样品在 4 °C 下以 400 x g 离心 5 分钟。 小心吸出上清液,留下大约 100 μL 的上清液和细胞/微珠沉淀。
- 用额外的 200 μL 分选缓冲液重悬样品,并将样品转移到 5 mL 荧光激活细胞分选 (FACS) 管中。
- 在流式细胞仪上分析样品。收集尽可能多的单元格,最多收集 2,500,000 个事件。确保至少收集了 20,000 个 count bead 事件。将采集速率保持在每秒 5000 个事件或以下。
- 将所有数据另存为 FCS 文件。
| 荧光染料 | 抗体 |
| BUV395 | CD90.2 |
| 太平洋蓝 | CD45 (早期通过静脉注射添加) |
| 太平洋橙 | CD8型 |
| 璀璨紫罗兰色 785 | CD4 |
| FITC | CD3 系列 |
| PerCP-Cy5.5 | 卸载(B220、CD11b、CD11c、F4/80) |
| 体育 | pMHC 四聚体或表型标志物 |
| PE-Cy7 系列 | 表型标志物(例如 CD44、PD-1、CD69 等) |
| APC公司 | pMHC 四聚体或表型标志物 |
| AlexaFluor 700 系列 | 表型标志物(例如 CD44、PD-1、CD69 等) |
| APC-Cy7 系列 | 活/死污 |
表 1:样品染色基质。 一组典型的荧光团偶联流式细胞术抗体,用于鉴定和表征抗原特异性 T 细胞。
7. 分析数据
- 使用适当的流式细胞术软件分析 FCS 数据文件。
- 设置一系列连续的包涵体门来识别 1) 淋巴细胞样,2) 单个,3) 活细胞,4) 血管外,5) dump 阴性,以及 6) CD4 或 CD8 阳性的 CD90.2 阳性事件(图 2)。
- 鉴定这些群体中的四聚体阳性 T 细胞。
- 通过计算添加的磁珠数 (50,000) 与样品运行期间收集的磁珠数的比率,并将该值乘以收集的四聚体阳性细胞总数,确定绝对四聚体阳性细胞计数。
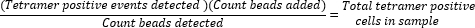
结果
图 2 描述了使用 peptide:MHC II 类四聚体鉴定肺部稀有抗原特异性 CD4 + T 细胞时使用的代表性门控策略。相同的过程可应用于具有肽:MHC I 类四聚体的抗原特异性 CD8+ T 细胞(数据未显示)。
由于肺部非淋巴细胞数量众多,因此通过四聚体对稀有抗原特异性 T 细胞进行可靠检测需要对感兴趣的 T 细胞进行某种形式的事先富集,以改善信噪比。...
讨论
来自肺部的抗原特异性 T 细胞的先前表征受益于抗原特异性 T 细胞的大量生长,这些 T 细胞在急性引发事件(如鼻内免疫或感染)后扩增 20,21,22。然而,如果不对感兴趣的 T 细胞进行某种形式的样本富集,就很难检测到肺部较稀有的 T 细胞群,例如自身抗原特异性 T 细胞或组织驻留记忆 T 细胞 15,16,23。
披露声明
作者没有要披露的冲突。
致谢
我们感谢 L. Kuhn 在组织加工和四聚体生产方面的技术援助。这项工作由美国国立卫生研究院 (R01 AI107020 和 P01 AI165072 JJM、T32 AI007512 到 DSS)、马萨诸塞州病原体准备联盟 (JJM) 和马萨诸塞州总医院研究执行委员会 (J.J.M.) 资助。
材料
| Name | Company | Catalog Number | Comments |
| 100 mm cell strainer | Fisher Scientific | 22-363-549 | |
| 10x PBS without Ca++ or Mg++ | Corning | 46-013-CM | |
| 1x PBS without Ca++ or Mg++ | Corning | 21-031-CV | |
| AccuCheck Counting Beads | Invitrogen | PCB100 | |
| Aminoguanidine Hemisulfate Salt | Sigma-Aldrich | A7009 | |
| CD90.2 microbeads, mouse | Miltenyi | 130-121-278 | |
| Cell separation magnet (MidiMACS Separator) | Miltenyi | 130-042-302 | Holds single LS column |
| Cell separation magnet (QuadroMACS Separator) | Miltenyi | 130-090-976 | Holds 4 LS columns |
| Dasatinib | Sigma-Aldrich | CDS023389 | |
| DNase I | Roche | 10104159001 | |
| Eagle’s Ham’s Amino Acids medium | Sigma-Aldrich | C5572 | |
| gentleMACS | Miltenyi | 130-093-235 | Automated tissue dissociator |
| gentleMACS C Tubes | Miltenyi | 130-093-237 | Automated tissue dissociator tubes |
| Hank's Balanced Salt Solution with Ca++ or Mg++ | Corning | 21-020-CM | |
| HEPES | Gibco | 15630080 | |
| Ketamine | Vedco | NDC 50989-996-06 | |
| Liberase TM | Roche | 5401119001 | |
| Pacific Blue anti-mouse CD45 antibody (Clone: 30-F11) | Biolegend | 103126 | |
| Paramagnetic cell separation columns (LS Columns) | Miltenyi | 130-042-401 | Comes with plunger |
| Purified anti mouse CD16/32 antibody (Clone: 93) | Biolegend | 101302 | |
| RPMI 1640 medium without L-glutamine | Corning | 15-040-CM | |
| Sodium Chloride 0.9% (Normal Saline) | Cytiva | Z1376 | |
| Xylazine | Pivetal | NDC 466066-750-02 |
参考文献
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235 (2023).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Crawford, F., Kozono, H., White, J., Marrack, P., Kappler, J. Detection of antigen-specific T cells with multivalent soluble class II MHC covalent peptide complexes. Immunity. 8 (6), 675-682 (1998).
- Nepom, G. T., et al. HLA class II tetramers: tools for direct analysis of antigen-specific CD4+ T cells. Arthritis Rheum. 46 (1), 5-12 (2002).
- Davis, M. M., Altman, J. D., Newell, E. W. Interrogating the repertoire: broadening the scope of peptide-MHC multimer analysis. Nat Rev Immunol. 11 (8), 551-558 (2011).
- Moon, J. J., et al. Tracking epitope-specific T cells. Nat Protoc. 4 (4), 565-581 (2009).
- Jenkins, M. K., Moon, J. J. The role of naive T cell precursor frequency and recruitment in dictating immune response magnitude. J Immunol. 188 (9), 4135-4140 (2012).
- Moon, J. J., et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Obar, J. J., Khanna, K. M., Lefrancois, L. Endogenous naive CD8+ T cell precursor frequency regulates primary and memory responses to infection. Immunity. 28 (6), 859-869 (2008).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. J Immunol. 181 (3), 2124-2133 (2008).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J Vis Exp. (68), e4420 (2012).
- Szabo, P. A., Miron, M., Farber, D. L. Location, location, location: Tissue resident memory T cells in mice and humans. Sci Immunol. 4 (34), 9673 (2019).
- Poon, M. M. L., et al. Tissue adaptation and clonal segregation of human memory T cells in barrier sites. Nat Immunol. 24 (2), 309-319 (2023).
- Zheng, M. Z. M., Wakim, L. M. Tissue resident memory T cells in the respiratory tract. Mucosal Immunol. 15 (3), 379-388 (2022).
- Legoux, F. P., et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T Cells rather than deletion. Immunity. 43 (5), 896-908 (2015).
- Shin, D. S., et al. Lung injury induces a polarized immune response by self-antigen-specific CD4(+) Foxp3(+) regulatory T cells. Cell Rep. 42 (8), 112839 (2023).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nat Protoc. 9 (1), 209-222 (2014).
- Vig, M., et al. Inducible nitric oxide synthase in T cells regulates T cell death and immune memory. J Clin Invest. 113 (12), 1734-1742 (2004).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. J Immunol Methods. 340 (1), 11-24 (2009).
- Hogan, R. J., et al. Protection from respiratory virus infections can be mediated by antigen-specific CD4(+) T cells that persist in the lungs. J Exp Med. 193 (8), 981-986 (2001).
- Hogan, R. J., et al. Activated antigen-specific CD8+ T cells persist in the lungs following recovery from respiratory virus infections. J Immunol. 166 (3), 1813-1822 (2001).
- Zhao, J., et al. Airway memory CD4(+) T cells mediate protective immunity against emerging respiratory coronaviruses. Immunity. 44 (6), 1379-1391 (2016).
- Hondowicz, B. D., et al. Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma. Immunity. 44 (1), 155-166 (2016).
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. J Vis Exp. (29), e1266 (2009).
- Faustino, L. D., et al. Interleukin-33 activates regulatory T cells to suppress innate gammadelta T cell responses in the lung. Nat Immunol. 21 (11), 1371-1383 (2020).
- Atif, S. M., Gibbings, S. L., Jakubzick, C. V. Isolation and identification of interstitial macrophages from the lungs using different digestion enzymes and staining strategies. Methods Mol Biol. 1784, 69-76 (2018).
- Pape, K. A., Taylor, J. J., Maul, R. W., Gearhart, P. J., Jenkins, M. K. Different B cell populations mediate early and late memory during an endogenous immune response. Science. 331 (6021), 1203-1207 (2011).
- Naeher, D., et al. A constant affinity threshold for T cell tolerance. J Exp Med. 204 (11), 2553-2559 (2007).
- Moon, J. J., et al. Quantitative impact of thymic selection on Foxp3+ and Foxp3- subsets of self-peptide/MHC class II-specific CD4+ T cells. Proc Natl Acad Sci U S A. 108 (35), 14602-14607 (2011).
- Koehli, S., Naeher, D., Galati-Fournier, V., Zehn, D., Palmer, E. Optimal T-cell receptor affinity for inducing autoimmunity. Proc Natl Acad Sci U S A. 111 (48), 17248-17253 (2014).
- Zhang, Z., Legoux, F. P., Vaughan, S. W., Moon, J. J. Opposing peripheral fates of tissue-restricted self antigen-specific conventional and regulatory CD4(+) T cells. Eur J Immunol. 50 (1), 63-72 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。