É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Methods Article
Identificação de células T raras específicas de antígenos de pulmões de camundongos com peptídeos: tetrâmeros do complexo principal de histocompatibilidade
Neste Artigo
Resumo
Fornecemos um protocolo detalhado para isolar e identificar populações raras de células T específicas de antígenos em pulmões de camundongos por meio de enriquecimento de células T baseadas em esferas magnéticas e tetrâmeros peptídicos: complexo principal de histocompatibilidade (MHC).
Resumo
A identificação e caracterização de células T específicas do antígeno durante a saúde e a doença continua sendo a chave para melhorar nossa compreensão da fisiopatologia imunológica. Os desafios técnicos de rastrear populações de células T específicas do antígeno dentro do repertório de células T endógenas foram muito avançados pelo desenvolvimento de reagentes de tetrâmero peptídeo: MHC. Esses multímeros solúveis marcados com fluorescência de moléculas MHC classe I ou classe II complexadas a epítopos de peptídeos antigênicos ligam-se diretamente às células T com especificidade correspondente do receptor de células T (TCR) e podem, portanto, identificar populações de células T específicas do antígeno em seu estado nativo sem a necessidade de uma resposta funcional induzida por ex vivo estimulação. Para populações extremamente raras, as células T ligadas ao tetrâmero podem ser enriquecidas magneticamente para aumentar a sensibilidade e a confiabilidade da detecção.
À medida que a investigação da imunidade das células T residentes no tecido se aprofunda, há uma necessidade premente de identificar células T específicas do antígeno que trafegam e residem em tecidos não linfoides. Neste protocolo, apresentamos um conjunto detalhado de instruções para o isolamento e caracterização de células T específicas do antígeno presentes nos pulmões de camundongos. Isso envolve o isolamento de células T do tecido pulmonar digerido, seguido por uma etapa geral de enriquecimento magnético de células T e coloração de tetrâmero para análise e classificação por citometria de fluxo. As etapas destacadas neste protocolo utilizam técnicas comuns e reagentes prontamente disponíveis, tornando-o acessível para quase qualquer pesquisador envolvido em imunologia de células T de camundongos, e são altamente adaptáveis para uma variedade de análises a jusante de qualquer população de células T específicas de antígeno de baixa frequência que residam nos pulmões.
Introdução
No coração do sistema imunológico adaptativo está a capacidade de uma célula T de reconhecer e responder a um antígeno específico. Quando e onde uma célula T responde ao seu antígeno cognato determina o equilíbrio entre infecção e autoimunidade, homeostase e câncer, saúde e doença1. Segue-se que o estudo de células T em um contexto específico de imunidade deve se concentrar nas células com especificidade para um antígeno relevante de interesse. Entre os avanços tecnológicos que aumentaram muito a capacidade de caracterizar populações de células T específicas do antígeno estão multímeros solúveis marcados com fluorescência (geralmente tetrâmeros) de moléculas de classe I ou classe II do complexo principal de histocompatibilidade (MHC) complexadas a epítopos de peptídeos antigênicos, mais conhecidos como "tetrâmeros peptídeo: MHC" 2 , 3 , 4 , 5. Ao representar os ligantes naturais dos receptores de antígenos de células T (TCRs), os tetrâmeros peptídeo:MHC classe I e classe II fornecem um meio de identificar diretamente as células T CD8+ e CD4+ específicas do antígeno, respectivamente, dentro do repertório endógeno de células T no sistema imunológico sem a necessidade de uma resposta à estimulação do antígeno em um ensaio. Os tetrâmeros representam uma abordagem mais elegante para o estudo de células T específicas do antígeno do que os modelos de transferência adotiva de células T transgênicas TCR6 e têm sido cada vez mais usados para identificar populações de células T estranhas e auto-específicas de antígenos em modelos experimentais de camundongos e doenças humanas 4,5.
Embora os tetrâmeros possam identificar prontamente populações de alta frequência de células T que se expandiram em resposta à estimulação de antígenos, seu uso para células T ingênuas, autoantígenas específicas ou de memória é limitado pelas frequências muito baixas dessas populações7. Nosso grupo e outros desenvolveram e popularizaram estratégias de enriquecimento magnético baseadas em tetrâmeros que aumentam a sensibilidade de detecção para permitir estudos dessas populações de células em tecidos linfóides de camundongos 8,9,10,11.
O surgimento de células T residentes no tecido no campo colocou uma ênfase maior no desenvolvimento de novas maneiras de investigar células T no espaço não linfóide. Como muitas outras superfícies mucosas, as células T nos pulmões encontram uma variedade de antígenos próprios e estranhos derivados do epitélio do hospedeiro, micróbios comensais e infecciosos e entidades ambientais, incluindo alérgenos. A análise transcricional de células T colhidas de tecido não linfóide (NLT) demonstra um fenótipo semelhante à memória que tem destino e função únicos específicos do tecido, muitas vezes direcionados ao tráfego e à homeostase do tecido12. Além disso, as células T de memória residentes no tecido (Trms) tendem a ser mais restritas clonalmente do que aquelas em circulação13. Determinar como e por que os antígenos impulsionam a residência das células T na NLT é fundamental para entender como o sistema imunológico protege contra infecções, mantém a homeostase do tecido e, às vezes, se transforma em autoimunidade. No entanto, parece haver maior atrito entre as células T residentes nos tecidos dos pulmões em comparação com outros NLT14. Consequentemente, a capacidade de identificar e caracterizar células T endógenas do pulmão com uma determinada especificidade de antígeno é limitada por sua raridade inerente.
Ao combinar o uso de técnicas de enriquecimento celular baseadas em esferas magnéticas e coloração de tetrâmero peptídeo: MHC, conseguimos detectar células T auto-específicas expandidas, mas raras, em pulmões de camundongos15,16. Aqui, apresentamos uma descrição detalhada de um protocolo que otimizamos para isolar e caracterizar de forma confiável qualquer população rara de células T específicas do antígeno presente nos pulmões de camundongos (Figura 1). Este protocolo incorpora uma etapa de coloração de anticorpos in vivo para distinguir células T residentes no tecido das células T vasculares17, seguida por dois métodos diferentes para processamento de tecido pulmonar para acomodar a disponibilidade de recursos. Isso é seguido por uma etapa geral de enriquecimento magnético de células T, coloração de tetrâmero e análise por citometria de fluxo. A viabilidade celular e a coloração do tetrâmero são aprimoradas ainda mais neste protocolo pela adição de aminoguanidina, que bloqueia a apoptose induzida por ativação de células T mediada por óxido nítrico sintase induzível (iNOS)18 e Dasatinibe, que limita a regulação negativa do TCR19. As etapas destacadas neste protocolo utilizam técnicas comuns e reagentes prontamente disponíveis, tornando-o acessível para quase todos os pesquisadores envolvidos em imunologia de células T de camundongos e é altamente adaptável para uma variedade de análises posteriores. Embora não seja provável que as células T virgens sejam encontradas nos pulmões, acreditamos que este protocolo será particularmente útil para o estudo de células T autoantígenas específicas e Trms nos pulmões.
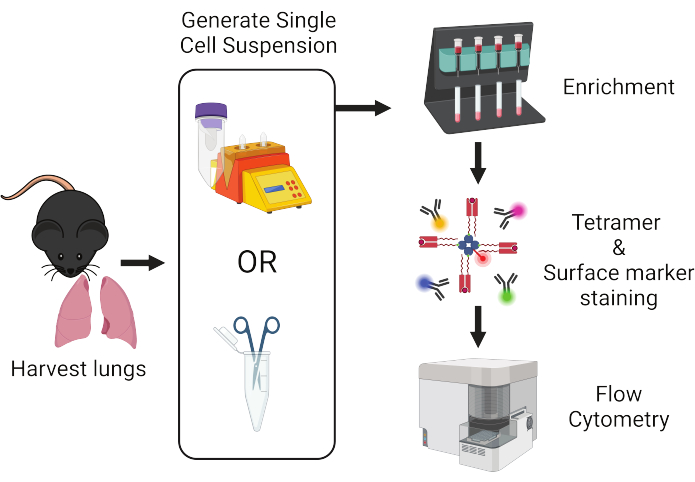
Figura 1: Visão geral do fluxo de trabalho do protocolo. Os pulmões são colhidos de camundongos e dissociados em células únicas. As amostras são posteriormente enriquecidas para células T antes da coloração com tetrâmeros peptídicos:MHC e anticorpos marcados com fluorescência para análise de citometria de fluxo. Clique aqui para ver uma versão maior desta figura.
Protocolo
Os procedimentos descritos neste protocolo são aprovados e desenvolvidos de acordo com as diretrizes estabelecidas pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Massachusetts General Hospital, um programa de manejo de animais credenciado pela Associação Americana para o Credenciamento de Cuidados com Animais de Laboratório (AAALAC). Os experimentos foram realizados em camundongos machos e fêmeas de 8 a 12 semanas de idade em um fundo genético C57BL / 6 criados e mantidos no biotério MGH sob condições específicas livres de patógenos.
1. Preparação de soluções de estoque
- Prepare o tampão HEPES dissolvendo 10 mM HEPES, 5 mM KCl, 1.8 mM CaCl2, 150 mM NaCl e 1 mM MgCl2 e ajuste para pH 7.4.
- Prepare 10x solução estoque de Liberase dissolvendo 700 μg/mL de Meio de Termolisina Liberase (TM) (ver Tabela de Materiais) na Solução Salina Balanceada de Hank com Ca++ e Mg++ (ver Tabela de Materiais).
- Prepare 10x solução estoque de aminoguanidina dissolvendo 100 mM de sal de hemissulfato de aminoguanidina (consulte a Tabela de Materiais) na solução salina balanceada de Hank com Ca++ e Mg++ (consulte a Tabela de Materiais).
- Prepare o meio completo de Aminoácidos do Presunto de Águia (EHAA) misturando o meio EHAA (ver Tabela de Materiais) com 10% de soro fetal bovino (FBS), 100 U / mL de penicilina / estreptomicina, 50 μg / mL de gentamicina, 2 mM de L-glutamina e 55 μM de 2-mercaptoetanol.
NOTA: Outros meios de células T comuns, como RPMI ou DMEM, também podem ser usados. - Prepare o tampão classificador misturando 1x PBS com 2% de FBS e 0,05% de azida de sódio.
- Prepare o bloqueio Fc diluindo o anticorpo anti-camundongo CD16 / 32 purificado (consulte a Tabela de Materiais) a 1: 100 v / v no tampão classificador.
- Prepare a solução de digestão Liberase TM / DNase adicionando 100 μg / mL de Liberase TM e 50 μg / mL DNase I (ver Tabela de Materiais) em meio RPMI 1640 sem L-glutamina (ver Tabela de Materiais).
- Prepare a mistura de cetamina / xilazina adicionando 10 mg / mL de cetamina (ver Tabela de Materiais) e 1 mg / mL de xilazina (ver Tabela de Materiais) em solução salina normal (0,9% NaCl) (ver Tabela de Materiais).
2. Geração de suspensão unicelular a partir do tecido pulmonar via dissociador de tecido automatizado
- Para cada camundongo, prepare 4 mL de tampão HEPES gelado em um tubo dissociador de tecido especializado (consulte a Tabela de Materiais) e mantenha-o no gelo.
- Anestesiar camundongos por injeção intraperitoneal de 150-200 μL de mistura de cetamina / xilazina. Injete 1-3 μg de anticorpo CD45 de camundongo conjugado com fluoróforo (ver Tabela de Materiais) diluído em 100 μL de solução salina normal por via intravenosa em cada camundongo anestesiado. Eutanasiar o camundongo 3 min após a administração do anticorpo com uma injeção intraperitoneal de 500-600 μL de mistura de cetamina/xilazina.
- Ressecção os pulmões e coloque-os em seus respectivos tubos dissociadores de tecidos resfriados em gelo. Coloque os tubos no dissociador de tecido automatizado (consulte a Tabela de Materiais) e execute o primeiro programa (programa predefinido) para o tecido pulmonar.
- Adicione 500 μL de solução-mãe de Liberase e 500 μL de solução-mãe de aminoguanidina a cada tubo que contém o tecido pulmonar dissociado. Incubar num misturador de nutantes durante 30 min a 37 °C.
- Coloque os tubos de volta no dissociador e execute o segundo programa (programa predefinido) para o tecido pulmonar.
- Despeje a suspensão de célula única do tubo dissociador de tecido através de um filtro de células de 100 μm (consulte a Tabela de Materiais) em um tubo cônico de 50 mL. Enxágue o tubo dissociador de tecido com 5 mL de EHAA completo (ou qualquer meio de células T equivalente) e passe pelo filtro para o tubo de 50 mL.
- Remova o filtro e aumente o volume da suspensão celular para 50 mL com EHAA completo. Centrifugar a suspensão celular a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente o sobrenadante, deixando para trás aproximadamente 100 μL de sobrenadante e pellet celular.
- Adicione aproximadamente 100 μL de solução de bloco Fc para elevar o volume total até 200 μL e vortex vigorosamente para ressuspender o pellet.
3. Protocolo alternativo: Gerando suspensão de célula única do tecido pulmonar por meio de dissociação manual
- Para cada camundongo, prepare 1 mL de EHAA completo em um tubo de microcentrífuga de 1,5 mL e mantenha no gelo.
- Anestesiar camundongos por injeção intraperitoneal de 150-200 μL de mistura de cetamina / xilazina. Injete 1-3 μg de anticorpo CD45 de camundongo conjugado com fluoróforo diluído em 100 μL de solução salina normal por via intravenosa em cada camundongo anestesiado. Eutanasiar o camundongo 3 min após a administração do anticorpo com uma injeção intraperitoneal de 500-600 μL de mistura de cetamina/xilazina.
- Ressecção os pulmões e coloque-os em seus respectivos tubos de microcentrífuga de 1,5 mL resfriados no gelo.
- Depois que todos os pulmões forem colhidos, transfira cada pulmão para um novo tubo de microcentrífuga sem nenhum meio celular.
- Corte os pulmões em pequenos fragmentos (pedaços de ~ 2-3 mm) usando uma tesoura dentro do tubo de microcentrífuga.
- Adicione 1 mL de coquetel de digestão Liberase TM / DNase I a cada tubo.
- Incubar durante 30 min a 37 °C em banho-maria. Retorne as amostras ao gelo depois para evitar a digestão excessiva.
- Despeje a amostra sobre um filtro de células de 100 μm colocado em cima de um tubo cônico de 50 mL. Amasse o tecido contra a malha com a extremidade de borracha do êmbolo de uma seringa estéril de 1 mL.
- Enxágue o filtro com tampão classificador frio, coletando um volume final de 7 mL no tubo. Centrifugar a suspensão celular a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente o sobrenadante, deixando aproximadamente 100 μL de sobrenadante e pellet celular.
- Adicione 100 μL de solução de bloco Fc para elevar o volume total até 200 μL e vortex vigorosamente para ressuspender o pellet.
4. Enriquecimento da amostra de pulmão para células T por meio do enriquecimento de esferas magnéticas
- Adicione 50 μL de microesferas CD90.2 anti-mouse (consulte a Tabela de Materiais). Vortex e incubar por 10 min a 4 °C.
NOTA: CD90.2 corresponde ao alelo expresso por células T em camundongos C57BL/6. Verifique o genótipo do alelo se outras cepas de camundongos forem usadas. - Enquanto isso, coloque uma coluna de separação de células paramagnéticas (consulte a Tabela de Materiais) em um ímã de separação de células de uma ou quatro posições (consulte a Tabela de Materiais). Posicione um tubo cônico aberto de 15 mL sob cada coluna para capturar o fluxo. Prepare a coluna com 3 mL de tampão classificador frio, permitindo que a coluna seja drenada por gravidade para o tubo cônico abaixo.
- Depois que as células forem incubadas com as microesferas por 10 min, adicione tampão classificador frio a um volume de 1 mL e transfira através de um filtro de células de 100 μm colocado no topo da coluna. Recolha o fluxo da coluna para um novo tubo cónico de 15 ml colocado por baixo da coluna.
- Uma vez que a suspensão celular tenha drenado completamente através da coluna por gravidade, lave a coluna enxaguando o tubo original com mais 3 mL de tampão classificador a frio e aplicando-o na coluna através da malha, enxaguando assim o filtro. Remova o filtro.
- Quando a amostra tiver sido novamente completamente drenada para a coluna e nenhum fluxo adicional estiver saindo da coluna, remova a coluna do ímã e coloque-a sobre um novo tubo cônico de 15 mL.
- Adicione 5 mL de tampão classificador frio à coluna.
- Eluir imediatamente as células ligadas à coluna empurrando o êmbolo da coluna para o topo em um movimento contínuo e forçando o buffer do classificador para fora da parte inferior da coluna para o novo tubo.
- Centrifugar as amostras eluídas a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente o sobrenadante, deixando para trás aproximadamente 100 μL de sobrenadante e pellet celular.
- Adicione 100 μL de tampão classificador a frio para elevar o volume total até 200 μL e vortex vigorosamente para ressuspender o pellet.
- Analise a amostra de fluxo contendo a fração de células não ligadas, se desejar.
5. Coloração das células T específicas do antígeno com peptídeo: tetrâmeros MHC
- Adicione 1 μL de 10 μM de Dasatinibe (consulte a Tabela de Materiais) a cada amostra, vórtice e incube por 5 min em RT.
- Adicione peptídeo conjugado com PE ou APC: tetrâmero MHC a uma concentração final de 10 nM (ou concentração empiricamente otimizada para um determinado tetrâmero).
- Vórtice e incubar no escuro por 1 h em RT (ou tempo e temperatura empiricamente otimizados).
6. Análise das células T marcadas com tetrâmero por citometria de fluxo
- Enquanto a amostra está sendo corada com tetrâmeros peptídeo: MHC, prepare uma mistura mestre de anticorpos para corar os marcadores de superfície das células (Tabela 1).
NOTA: Evite fluoróforos que entrem em conflito com o anticorpo CD45 administrado por via intravenosa ou com os tetrâmeros. - Com 15 minutos restantes no período de incubação para coloração com tetrâmero, adicione a mistura principal de anticorpos de superfície a 1:100 (ou concentração empiricamente otimizada) a cada amostra.
- Continue a incubar no escuro em RT pelo restante do período de incubação de 1 h.
- Adicione 50.000 grânulos de contagem de citometria de fluxo (consulte a Tabela de Materiais) e adicione tampão classificador frio a um volume final de aproximadamente 5 mL. Centrifugue a amostra corada a 400 x g durante 5 min a 4 °C. Aspire cuidadosamente o sobrenadante, deixando para trás aproximadamente 100 μL de sobrenadante e pellet de célula/esfera.
- Ressuspenda a amostra com mais 200 μL de tampão classificador e transfira a amostra para um tubo de classificação de células ativadas por fluorescência (FACS) de 5 mL.
- Analisar a amostra num citómetro de fluxo. Colete o maior número possível de células, até um máximo de 2.500.000 eventos no total. Certifique-se de que pelo menos 20.000 eventos de contagem de contas tenham sido coletados. Mantenha a taxa de aquisição igual ou inferior a 5.000 eventos por segundo.
- Salve todos os dados como arquivos FCS.
| Fluorochrome | Anticorpo |
| BUV395 | CD90.2 |
| Azul Pacífico | CD45 (adicionado anteriormente por injeção intravenosa) |
| Laranja do Pacífico | CD8 |
| Violeta Brilhante 785 | CD4 |
| FITC | CD3 |
| PerCP-Cy5.5 | Despejo (B220, CD11b, CD11c, F4/80) |
| PE | tetrâmero pMHC ou marcador fenotípico |
| PE-Cy7 | Marcador fenotípico (por exemplo, CD44, PD-1, CD69, etc.) |
| APC | tetrâmero pMHC ou marcador fenotípico |
| AlexaFluor 700 | Marcador fenotípico (por exemplo, CD44, PD-1, CD69, etc.) |
| APC-Cy7 | Mancha viva/morta |
Tabela 1: Matriz de coloração da amostra. Um painel típico de anticorpos de citometria de fluxo conjugados com fluoróforo utilizados para identificar e caracterizar células T específicas do antígeno.
7. Análise de dados
- Analise os arquivos de dados FCS usando o software de citometria de fluxo apropriado.
- Configure uma sequência de portões de inclusão sucessivos para identificar 1) eventos semelhantes a linfócitos, 2) únicos, 3) vivos, 4) extravasculares, 5) negativos para despejo e 6) CD90.2 positivos para CD4 ou CD8 positivos (Figura 2).
- Identifique as células T positivas para tetrâmero nessas populações.
- Determine a contagem absoluta de células tetrâmero positivo calculando a proporção de grânulos adicionados (50.000) para o número de grânulos coletados durante a execução da amostra e multiplicando o valor pelo número total de células tetrâmero positivas coletadas.
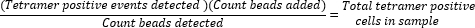
Resultados
A Figura 2 mostra a estratégia de gating representativa usada na identificação de células T CD4+ específicas para antígenos raros nos pulmões com tetrâmeros peptídeo:MHC classe II. O mesmo processo pode ser aplicado para células T CD8+ específicas do antígeno com tetrâmeros peptídeo:MHC classe I (dados não mostrados).
Devido ao alto número de células não linfóides nos pulmões, a detecção confiável de células T raras es...
Discussão
Caracterizações anteriores de células T específicas do antígeno dos pulmões se beneficiaram do número robusto de células T específicas do antígeno que se expandem após um evento de priming agudo, como imunização intranasal ou infecção 20,21,22. No entanto, populações de células T mais raras nos pulmões, como células T específicas do autoantígeno ou células T de memória residentes no tecido, são difíceis...
Divulgações
Os autores não têm conflitos a divulgar.
Agradecimentos
Agradecemos a L. Kuhn pela assistência técnica no processamento de tissue e na produção de tetrâmeros. Este trabalho foi financiado pelos Institutos Nacionais de Saúde (R01 AI107020 e P01 AI165072 para J.J.M., T32 AI007512 para D.S.S.), o Massachusetts Consortium on Pathogen Readiness (J.J.M) e o Comitê Executivo de Pesquisa do Hospital Geral de Massachusetts (J.J.M.).
Materiais
| Name | Company | Catalog Number | Comments |
| 100 mm cell strainer | Fisher Scientific | 22-363-549 | |
| 10x PBS without Ca++ or Mg++ | Corning | 46-013-CM | |
| 1x PBS without Ca++ or Mg++ | Corning | 21-031-CV | |
| AccuCheck Counting Beads | Invitrogen | PCB100 | |
| Aminoguanidine Hemisulfate Salt | Sigma-Aldrich | A7009 | |
| CD90.2 microbeads, mouse | Miltenyi | 130-121-278 | |
| Cell separation magnet (MidiMACS Separator) | Miltenyi | 130-042-302 | Holds single LS column |
| Cell separation magnet (QuadroMACS Separator) | Miltenyi | 130-090-976 | Holds 4 LS columns |
| Dasatinib | Sigma-Aldrich | CDS023389 | |
| DNase I | Roche | 10104159001 | |
| Eagle’s Ham’s Amino Acids medium | Sigma-Aldrich | C5572 | |
| gentleMACS | Miltenyi | 130-093-235 | Automated tissue dissociator |
| gentleMACS C Tubes | Miltenyi | 130-093-237 | Automated tissue dissociator tubes |
| Hank's Balanced Salt Solution with Ca++ or Mg++ | Corning | 21-020-CM | |
| HEPES | Gibco | 15630080 | |
| Ketamine | Vedco | NDC 50989-996-06 | |
| Liberase TM | Roche | 5401119001 | |
| Pacific Blue anti-mouse CD45 antibody (Clone: 30-F11) | Biolegend | 103126 | |
| Paramagnetic cell separation columns (LS Columns) | Miltenyi | 130-042-401 | Comes with plunger |
| Purified anti mouse CD16/32 antibody (Clone: 93) | Biolegend | 101302 | |
| RPMI 1640 medium without L-glutamine | Corning | 15-040-CM | |
| Sodium Chloride 0.9% (Normal Saline) | Cytiva | Z1376 | |
| Xylazine | Pivetal | NDC 466066-750-02 |
Referências
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235 (2023).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Crawford, F., Kozono, H., White, J., Marrack, P., Kappler, J. Detection of antigen-specific T cells with multivalent soluble class II MHC covalent peptide complexes. Immunity. 8 (6), 675-682 (1998).
- Nepom, G. T., et al. HLA class II tetramers: tools for direct analysis of antigen-specific CD4+ T cells. Arthritis Rheum. 46 (1), 5-12 (2002).
- Davis, M. M., Altman, J. D., Newell, E. W. Interrogating the repertoire: broadening the scope of peptide-MHC multimer analysis. Nat Rev Immunol. 11 (8), 551-558 (2011).
- Moon, J. J., et al. Tracking epitope-specific T cells. Nat Protoc. 4 (4), 565-581 (2009).
- Jenkins, M. K., Moon, J. J. The role of naive T cell precursor frequency and recruitment in dictating immune response magnitude. J Immunol. 188 (9), 4135-4140 (2012).
- Moon, J. J., et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Obar, J. J., Khanna, K. M., Lefrancois, L. Endogenous naive CD8+ T cell precursor frequency regulates primary and memory responses to infection. Immunity. 28 (6), 859-869 (2008).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. J Immunol. 181 (3), 2124-2133 (2008).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J Vis Exp. (68), e4420 (2012).
- Szabo, P. A., Miron, M., Farber, D. L. Location, location, location: Tissue resident memory T cells in mice and humans. Sci Immunol. 4 (34), 9673 (2019).
- Poon, M. M. L., et al. Tissue adaptation and clonal segregation of human memory T cells in barrier sites. Nat Immunol. 24 (2), 309-319 (2023).
- Zheng, M. Z. M., Wakim, L. M. Tissue resident memory T cells in the respiratory tract. Mucosal Immunol. 15 (3), 379-388 (2022).
- Legoux, F. P., et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T Cells rather than deletion. Immunity. 43 (5), 896-908 (2015).
- Shin, D. S., et al. Lung injury induces a polarized immune response by self-antigen-specific CD4(+) Foxp3(+) regulatory T cells. Cell Rep. 42 (8), 112839 (2023).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nat Protoc. 9 (1), 209-222 (2014).
- Vig, M., et al. Inducible nitric oxide synthase in T cells regulates T cell death and immune memory. J Clin Invest. 113 (12), 1734-1742 (2004).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. J Immunol Methods. 340 (1), 11-24 (2009).
- Hogan, R. J., et al. Protection from respiratory virus infections can be mediated by antigen-specific CD4(+) T cells that persist in the lungs. J Exp Med. 193 (8), 981-986 (2001).
- Hogan, R. J., et al. Activated antigen-specific CD8+ T cells persist in the lungs following recovery from respiratory virus infections. J Immunol. 166 (3), 1813-1822 (2001).
- Zhao, J., et al. Airway memory CD4(+) T cells mediate protective immunity against emerging respiratory coronaviruses. Immunity. 44 (6), 1379-1391 (2016).
- Hondowicz, B. D., et al. Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma. Immunity. 44 (1), 155-166 (2016).
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. J Vis Exp. (29), e1266 (2009).
- Faustino, L. D., et al. Interleukin-33 activates regulatory T cells to suppress innate gammadelta T cell responses in the lung. Nat Immunol. 21 (11), 1371-1383 (2020).
- Atif, S. M., Gibbings, S. L., Jakubzick, C. V. Isolation and identification of interstitial macrophages from the lungs using different digestion enzymes and staining strategies. Methods Mol Biol. 1784, 69-76 (2018).
- Pape, K. A., Taylor, J. J., Maul, R. W., Gearhart, P. J., Jenkins, M. K. Different B cell populations mediate early and late memory during an endogenous immune response. Science. 331 (6021), 1203-1207 (2011).
- Naeher, D., et al. A constant affinity threshold for T cell tolerance. J Exp Med. 204 (11), 2553-2559 (2007).
- Moon, J. J., et al. Quantitative impact of thymic selection on Foxp3+ and Foxp3- subsets of self-peptide/MHC class II-specific CD4+ T cells. Proc Natl Acad Sci U S A. 108 (35), 14602-14607 (2011).
- Koehli, S., Naeher, D., Galati-Fournier, V., Zehn, D., Palmer, E. Optimal T-cell receptor affinity for inducing autoimmunity. Proc Natl Acad Sci U S A. 111 (48), 17248-17253 (2014).
- Zhang, Z., Legoux, F. P., Vaughan, S. W., Moon, J. J. Opposing peripheral fates of tissue-restricted self antigen-specific conventional and regulatory CD4(+) T cells. Eur J Immunol. 50 (1), 63-72 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados