Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Identifizierung seltener antigenspezifischer T-Zellen aus der Lunge von Mäusen mit Peptid:Major-Histokompatibilitätskomplex-Tetrameren
In diesem Artikel
Zusammenfassung
Wir bieten ein detailliertes Protokoll für die Isolierung und Identifizierung seltener antigenspezifischer T-Zellpopulationen in der Lunge von Mäusen durch magnetische T-Zell-Anreicherung und Peptid:Major Histocompatibility Complex (MHC)-Tetramere.
Zusammenfassung
Die Identifizierung und Charakterisierung antigenspezifischer T-Zellen während der Zeit von Gesundheit und Krankheit ist nach wie vor ein Schlüssel zur Verbesserung unseres Verständnisses der Immunpathophysiologie. Die technischen Herausforderungen bei der Verfolgung antigenspezifischer T-Zellpopulationen innerhalb des endogenen T-Zell-Repertoires wurden durch die Entwicklung von Peptid:MHC-Tetramerreagenzien erheblich vorangetrieben. Diese fluoreszenzmarkierten löslichen Multimere von MHC-Molekülen der Klasse I oder II, die an antigene Peptidepitope komplexiert sind, binden direkt an T-Zellen mit entsprechender T-Zell-Rezeptor (TCR)-Spezifität und können daher antigenspezifische T-Zellpopulationen in ihrem nativen Zustand identifizieren, ohne dass eine durch ex vivo induzierte funktionelle Reaktion erforderlich ist Anregung. Für äußerst seltene Populationen können tetramergebundene T-Zellen magnetisch angereichert werden, um die Empfindlichkeit und Zuverlässigkeit des Nachweises zu erhöhen.
Da sich die Untersuchung der geweberesidenten T-Zell-Immunität vertieft, besteht ein dringender Bedarf, antigenspezifische T-Zellen zu identifizieren, die zu nicht-lymphoiden Geweben gelangen und sich dort aufhalten. In diesem Protokoll stellen wir eine detaillierte Reihe von Anweisungen für die Isolierung und Charakterisierung von antigenspezifischen T-Zellen vor, die in der Lunge von Mäusen vorhanden sind. Dies beinhaltet die Isolierung von T-Zellen aus verdautem Lungengewebe, gefolgt von einem allgemeinen Schritt der magnetischen Anreicherung von T-Zellen und einer Tetramerfärbung für die durchflusszytometrische Analyse und Sortierung. Die in diesem Protokoll hervorgehobenen Schritte verwenden gängige Techniken und leicht verfügbare Reagenzien, so dass es für nahezu jeden Forscher, der sich mit Maus-T-Zell-Immunologie beschäftigt, zugänglich ist, und sind hochgradig anpassbar für eine Vielzahl von nachgelagerten Analysen jeder niederfrequenten antigenspezifischen T-Zell-Population, die sich in der Lunge befindet.
Einleitung
Das Herzstück des adaptiven Immunsystems ist die Fähigkeit einer T-Zelle, ein bestimmtes Antigen zu erkennen und darauf zu reagieren. Wann und wo eine T-Zelle auf ihr verwandtes Antigen reagiert, bestimmt das Gleichgewicht von Infektion und Autoimmunität, Homöostase und Krebs, Gesundheit und Krankheit1. Daraus folgt, dass sich die Untersuchung von T-Zellen in einem spezifischen Kontext der Immunität auf die Zellen konzentrieren sollte, die spezifisch für ein relevantes Antigen von Interesse sind. Zu den technologischen Fortschritten, die die Fähigkeit zur Charakterisierung antigenspezifischer T-Zellpopulationen erheblich verbessert haben, gehören fluoreszenzmarkierte lösliche Multimere (in der Regel Tetramere) von Molekülen der Klasse I oder II des Haupthistokompatibilitätskomplexes (MHC), die an antigene Peptidepitope komplexiert sind, besser bekannt als "Peptid:MHC-Tetramere"2,3,4,5 . Indem sie die natürlichen Liganden von T-Zell-Antigenrezeptoren (TCRs) darstellen, bieten Peptid:MHC-Tetramere der Klassen I und II ein Mittel zur direkten Identifizierung von antigenspezifischen CD8+- bzw. CD4+-T-Zellen innerhalb des endogenen Repertoires von T-Zellen im Immunsystem, ohne dass eine Reaktion auf die Antigenstimulation in einem Assay erforderlich ist. Tetramere stellen einen eleganteren Ansatz für die Untersuchung antigenspezifischer T-Zellen dar als TCR-transgene T-Zell-Adoptionstransfermodelle6 und werden zunehmend zur Identifizierung fremder und selbstantigenspezifischer T-Zellpopulationen sowohl in experimentellen Mausmodellen als auch in menschlichen Krankheiten verwendet 4,5.
Während Tetramere hochfrequente Populationen von T-Zellen, die sich als Reaktion auf Antigenstimulation vergrößert haben, leicht identifizieren können, ist ihre Verwendung für naive, selbstantigenspezifische oder Gedächtnis-T-Zellen durch die sehr niedrigen Frequenzen dieser Populationen begrenzt7. Unsere Gruppe und andere haben Tetramer-basierte magnetische Anreicherungsstrategien entwickelt und populär gemacht, die die Empfindlichkeit des Nachweises erhöhen, um Studien dieser Zellpopulationen in lymphatischen Geweben der Maus zu ermöglichen 8,9,10,11.
Das Auftauchen von geweberesidenten T-Zellen in diesem Feld hat einen verstärkten Schwerpunkt auf die Entwicklung neuer Wege zur Untersuchung von T-Zellen im nicht-lymphoiden Raum gelegt. Wie viele andere Schleimhautoberflächen treffen auch T-Zellen in der Lunge auf eine Reihe von eigenen und fremden Antigenen, die vom Wirtsepithel, kommensalen und infektiösen Mikroben und Umweltentitäten, einschließlich Allergenen, abgeleitet sind. Die transkriptionelle Analyse von T-Zellen, die aus nicht-lymphatischem Gewebe (NLT) gewonnen wurden, zeigt einen gedächtnisähnlichen Phänotyp, der ein einzigartiges gewebespezifisches Schicksal und eine einzigartige Funktion aufweist und oft auf den Transport und die Gewebehomöostase gerichtet ist12. Darüber hinaus neigen geweberesidente Gedächtnis-T-Zellen (Trms) dazu, klonal stärker eingeschränkt zu sein als solche, die sich im Blut befinden13. Die Bestimmung, wie und warum Antigene die T-Zell-Residenz bei NLT antreiben, ist entscheidend für das Verständnis, wie das Immunsystem vor Infektionen schützt, die Gewebehomöostase aufrechterhält und sich manchmal in Autoimmunität verwandelt. Es scheint jedoch eine größere Abnutzung bei geweberesidenten T-Zellen aus der Lunge im Vergleich zu anderen NLT14 zu geben. Dementsprechend ist die Fähigkeit, endogene T-Zellen der Lunge mit einer gegebenen Antigenspezifität zu identifizieren und zu charakterisieren, durch ihre inhärente Seltenheit begrenzt.
Durch die Kombination von magnetischen Kügelchen-basierten Zellanreicherungstechniken und Peptid:MHC-Tetramerfärbung ist es uns gelungen, expandierte, aber seltene selbstantigenspezifische T-Zellen in der Lunge von Mäusen nachzuweisen15,16. Hier präsentieren wir eine detaillierte Beschreibung eines Protokolls, das wir optimiert haben, um jede seltene antigenspezifische T-Zellpopulation in der Lunge von Mäusen zuverlässig zu isolieren und zu charakterisieren (Abbildung 1). Dieses Protokoll umfasst einen In-vivo-Antikörperfärbeschritt zur Unterscheidung von geweberesidenten von vaskulären T-Zellen17, gefolgt von zwei verschiedenen Verfahren zur Verarbeitung von Lungengewebe, um die Verfügbarkeit von Ressourcen zu berücksichtigen. Darauf folgt ein allgemeiner Schritt der magnetischen Anreicherung von T-Zellen, eine Tetramerfärbung und eine Analyse mittels Durchflusszytometrie. Die Lebensfähigkeit der Zellen und die Tetramerfärbung werden in diesem Protokoll durch die Zugabe von Aminoguanidin, das die induzierbare Stickstoffmonoxidsynthase (iNOS)-vermittelte T-Zell-Aktivierungs-induzierte Apoptose blockiert18, und Dasatinib, das die TCR-Herunterregulierung begrenzt19, weiter verbessert. Die in diesem Protokoll hervorgehobenen Schritte verwenden gängige Techniken und leicht verfügbare Reagenzien, so dass es für nahezu jeden Forscher zugänglich ist, der sich mit Maus-T-Zell-Immunologie beschäftigt, und sehr anpassungsfähig für eine Vielzahl von nachgelagerten Analysen ist. Obwohl naive T-Zellen wahrscheinlich nicht in der Lunge zu finden sind, glauben wir, dass dieses Protokoll besonders hilfreich für die Untersuchung von selbstantigenspezifischen T-Zellen und Trms in der Lunge sein wird.
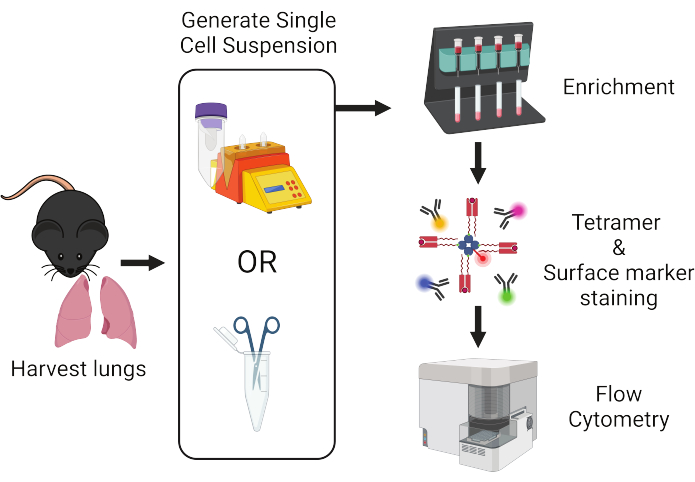
Abbildung 1: Überblick über den Protokoll-Workflow. Lungen werden von Mäusen entnommen und in einzelne Zellen dissoziiert. Die Proben werden anschließend für T-Zellen angereichert, bevor sie mit Peptid:MHC-Tetrameren und fluoreszenzmarkierten Antikörpern für die durchflusszytometrische Analyse gefärbt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Die in diesem Protokoll beschriebenen Verfahren sind in Übereinstimmung mit den Richtlinien des Institutional Animal Care and Use Committee (IACUC) des Massachusetts General Hospital, einem von der American Association for the Accreditation of Laboratory Animal Care (AAALAC) akkreditierten Tiermanagementprogramm, genehmigt und entwickelt. Die Experimente wurden an 8-12 Wochen alten männlichen und weiblichen Mäusen mit einem genetischen Hintergrund von C57BL/6 durchgeführt, die in der MGH-Tieranlage unter spezifischen pathogenfreien Bedingungen gezüchtet und gehalten wurden.
1. Herstellung von Stammlösungen
- Bereiten Sie HEPES-Puffer vor, indem Sie 10 mM HEPES, 5 mM KCl, 1,8 mM CaCl2, 150 mM NaCl und 1 mM MgCl2 auflösen und auf pH 7,4 einstellen.
- Bereiten Sie 10x Liberase Stammlösung her, indem Sie 700 μg/ml Liberase Thermolysin Medium (TM) (siehe Materialtabelle) in Hank's Balanced Salt Solution mit Ca++ und Mg++ (siehe Materialtabelle) lösen.
- Bereiten Sie 10x Aminoguanidin-Stammlösung her, indem Sie 100 mM Aminoguanidin-Hemisulfatsalz (siehe Materialtabelle) in Hank's Balanced Salt Solution mit Ca++ und Mg++ auflösen (siehe Materialtabelle).
- Bereiten Sie das komplette Eagle's Ham's Amino Acids (EHAA)-Medium vor, indem Sie EHAA-Medium (siehe Materialtabelle) mit 10 % fötalem Rinderserum (FBS), 100 U/ml Penicillin/Streptomycin, 50 μg/ml Gentamycin, 2 mM L-Glutamin und 55 μM 2-Mercaptoethanol mischen.
HINWEIS: Andere gängige T-Zell-Medien wie RPMI oder DMEM können ebenfalls verwendet werden. - Bereiten Sie den Sortierpuffer vor, indem Sie 1x PBS mit 2 % FBS und 0,05 % Natriumazid mischen.
- Bereiten Sie den Fc-Block vor, indem Sie den gereinigten Anti-Maus-CD16/32-Antikörper (siehe Materialtabelle) bei 1:100 v/v in einem Sortierpuffer verdünnen.
- Bereiten Sie die Aufschlusslösung für Liberase TM/DNase vor, indem Sie 100 μg/ml Liberase TM und 50 μg/ml DNase I (siehe Materialtabelle) in RPMI 1640 Medium ohne L-Glutamin (siehe Materialtabelle) hinzufügen.
- Bereiten Sie eine Ketamin/Xylazin-Mischung vor, indem Sie 10 mg/ml Ketamin (siehe Materialtabelle) und 1 mg/ml Xylazin (siehe Materialtabelle) in normaler Kochsalzlösung (0,9 % NaCl) (siehe Materialtabelle) hinzufügen.
2. Erzeugung einer einzelligen Suspension aus Lungengewebe mittels automatisiertem Gewebedissoziator
- Bereiten Sie für jede Maus 4 ml eiskalten HEPES-Puffer in einem speziellen Gewebedissoziatorröhrchen vor (siehe Materialtabelle) und bewahren Sie es auf Eis auf.
- Betäuben Sie Mäuse durch intraperitoneale Injektion von 150-200 μl Ketamin/Xylazin-Gemisch. Injizieren Sie 1-3 μg Fluorophor-konjugierten Anti-Maus-CD45-Antikörper (siehe Materialtabelle), verdünnt in 100 μl normaler Kochsalzlösung, intravenös in jede anästhesierte Maus. Euthanasieren Sie die Maus 3 Minuten nach der Antikörperverabreichung mit einer intraperitonealen Injektion von 500-600 μl Ketamin/Xylazin-Gemisch.
- Die Lunge wird reseziert und in das entsprechende Gewebedissoziatorröhrchen gelegt, das auf Eis gekühlt wird. Legen Sie die Schläuche auf den automatisierten Gewebedissoziator (siehe Materialtabelle) und führen Sie das erste Programm (voreingestelltes Programm) für Lungengewebe aus.
- 500 μl Lichase-Stammlösung und 500 μl Aminoguanidin-Stammlösung werden in jedes Röhrchen gegeben, das das dissoziierte Lungengewebe enthält. Auf einem Nuktionsmischer 30 min bei 37 °C inkubieren.
- Setzen Sie die Schläuche wieder auf den Dissoziator und führen Sie das zweite Programm (voreingestelltes Programm) für Lungengewebe aus.
- Gießen Sie die Einzelzellsuspension aus dem Gewebedissoziatorröhrchen durch ein 100-μm-Zellsieb (siehe Materialtabelle) in ein konisches 50-ml-Röhrchen. Spülen Sie das Gewebedissoziatorröhrchen mit 5 mL vollständigem EHAA (oder einem gleichwertigen T-Zell-Medium) und geben Sie es durch das Sieb in das 50 ml-Röhrchen.
- Entfernen Sie das Sieb und erhöhen Sie das Volumen der Zellsuspension auf 50 mL mit vollständigem EHAA. Die Zellsuspension bei 400 x g für 5 min bei 4 °C zentrifugieren. Saugen Sie den Überstand vorsichtig ab und lassen Sie etwa 100 μl Überstand und Zellpellet zurück.
- Fügen Sie ca. 100 μl Fc-Blocklösung hinzu, um das Gesamtvolumen auf 200 μl zu erhöhen, und wirbeln Sie kräftig vortexen, um das Pellet wieder zu suspendieren.
3. Alternatives Protokoll: Erzeugung einer einzelligen Suspension aus Lungengewebe durch manuelle Dissoziation
- Bereiten Sie für jede Maus 1 ml vollständiges EHAA in einem 1,5-ml-Mikrofuge-Röhrchen vor und bewahren Sie es auf Eis auf.
- Betäuben Sie Mäuse durch intraperitoneale Injektion von 150-200 μl Ketamin/Xylazin-Gemisch. Injizieren Sie 1-3 μg Fluorophor-konjugierten Anti-Maus-CD45-Antikörper, verdünnt in 100 μl normaler Kochsalzlösung, intravenös in jede anästhesierte Maus. Euthanasieren Sie die Maus 3 Minuten nach der Antikörperverabreichung mit einer intraperitonealen Injektion von 500-600 μl Ketamin/Xylazin-Gemisch.
- Resezieren Sie die Lunge und legen Sie sie in das entsprechende 1,5-ml-Mikrofuge-Röhrchen, das auf Eis gekühlt wird.
- Sobald alle Lungen entnommen wurden, übertragen Sie jede Lunge ohne Zellmedien in ein frisches Mikrofuge-Röhrchen.
- Schneiden Sie die Lunge mit einer Schere in das Mikrofuge-Röhrchen in kleine Fragmente (~2-3 mm große Stücke).
- Geben Sie 1 ml Liberase TM/DNase I Aufschlusscocktail in jedes Röhrchen.
- 30 min bei 37 °C im Wasserbad inkubieren. Legen Sie die Proben anschließend wieder auf Eis, um eine Überverdauung zu vermeiden.
- Gießen Sie die Probe über ein 100-μm-Zellsieb, das auf einem konischen 50-ml-Röhrchen platziert ist. Drücken Sie das Tuch mit dem Gummiende des Kolbens einer sterilen 1-ml-Spritze gegen das Netz.
- Spülen Sie das Sieb mit Kaltsortierpuffer und sammeln Sie ein Endvolumen von 7 mL im Röhrchen. Die Zellsuspension bei 400 x g für 5 min bei 4 °C zentrifugieren. Der Überstand wird vorsichtig abgesaugt, wobei ca. 100 μl Überstand und Zellpellet übrig bleiben.
- Fügen Sie 100 μl Fc-Blocklösung hinzu, um das Gesamtvolumen auf 200 μl zu erhöhen, und wirbeln Sie kräftig vortexen, um das Pellet wieder zu suspendieren.
4. Anreicherung der Lungenprobe für T-Zellen mittels magnetischer Bead-Anreicherung
- Fügen Sie 50 μl Anti-Maus-CD90.2-Mikrokügelchen hinzu (siehe Materialtabelle). Vortexen und 10 min bei 4 °C inkubieren.
HINWEIS: CD90.2 entspricht dem Allel, das von T-Zellen in C57BL/6-Mäusen exprimiert wird. Überprüfen Sie den Allelgenotyp, wenn andere Mäusestämme verwendet werden. - Platzieren Sie in der Zwischenzeit eine paramagnetische Zelltrennsäule (siehe Materialtabelle) auf einen ein- oder vierstufigen Zelltrennmagneten (siehe Materialtabelle). Positionieren Sie ein offenes konisches 15-ml-Röhrchen unter jeder Säule, um den Durchfluss aufzufangen. Grundieren Sie die Säule mit 3 mL Kaltsortierpuffer, so dass die Säule durch die Schwerkraft in das darunter liegende konische Rohr abfließen kann.
- Sobald die Zellen 10 Minuten lang mit den Mikrokügelchen inkubiert haben, fügen Sie kalten Sortierpuffer zu einem Volumen von 1 ml hinzu und übertragen Sie ihn durch ein 100-μm-Zellsieb, das auf der Säule platziert ist. Sammeln Sie den Säulenfluss in ein frisches konisches 15-ml-Röhrchen, das sich unter der Säule befindet.
- Sobald die Zellsuspension durch die Schwerkraft vollständig durch die Säule abgeflossen ist, waschen Sie die Säule, indem Sie das Originalröhrchen mit zusätzlichen 3 mL Kaltsortierpuffer spülen und durch das Netz auf die Säule auftragen, wodurch das Sieb gespült wird. Entfernen Sie das Sieb.
- Wenn die Probe wieder vollständig in die Säule abgelassen ist und kein weiterer Durchfluss aus der Säule austritt, nehmen Sie die Säule aus dem Magneten und setzen Sie sie auf ein frisches konisches 15-ml-Röhrchen.
- Geben Sie 5 ml Kaltsortierpuffer in die Säule.
- Eluieren Sie sofort die an die Säule gebundenen Zellen, indem Sie den Säulenkolben in einer kontinuierlichen Bewegung nach oben schieben und den Sortierpuffer aus dem Boden der Säule in das neue Rohr drücken.
- Zentrifugieren Sie die eluierten Proben bei 400 x g für 5 min bei 4 °C. Saugen Sie den Überstand vorsichtig ab und lassen Sie etwa 100 μl Überstand und Zellpellet zurück.
- Fügen Sie 100 μl Kaltsortierpuffer hinzu, um das Gesamtvolumen auf 200 μl zu erhöhen, und wirbeln Sie kräftig vortexen, um das Pellet wieder zu suspendieren.
- Analysieren Sie bei Bedarf die Durchflussprobe, die die ungebundene Zellfraktion enthält.
5. Färbung der antigenspezifischen T-Zellen mit Peptid:MHC-Tetrameren
- 1 μl 10 μM Dasatinib (siehe Materialtabelle) zu jeder Probe geben, vortexen und 5 Minuten bei RT inkubieren.
- Fügen Sie PE- oder APC-konjugiertes Peptid:MHC-Tetramer bis zu einer Endkonzentration von 10 nM (oder einer empirisch optimierten Konzentration für ein gegebenes Tetramer) hinzu.
- Vortex und Inkubation im Dunkeln für 1 h bei RT (oder empirisch optimierter Zeit und Temperatur).
6. Analyse der Tetramer-markierten T-Zellen mittels Durchflusszytometrie
- Während die Probe mit Peptid:MHC-Tetrameren gefärbt wird, bereiten Sie einen Mastermix aus Antikörpern vor, um die Oberflächenmarker der Zellen zu färben (Tabelle 1).
HINWEIS: Vermeiden Sie Fluorophore, die mit dem intravenös verabreichten CD45-Antikörper oder den Tetrameren in Konflikt stehen. - Mit 15 Minuten verbleibender Inkubationszeit für die Tetramerfärbung geben Sie Oberflächenantikörper-Mastermix in 1:100 (oder empirisch optimierter Konzentration) zu jeder Probe.
- Die Inkubation im Dunkeln bei RT für den Rest der 1-stündigen Inkubationszeit fortsetzen.
- Fügen Sie 50.000 Durchflusszytometrie-Zählkügelchen hinzu (siehe Materialtabelle) und fügen Sie einen Kaltsortierpuffer zu einem Endvolumen von ca. 5 ml hinzu. Die gefärbte Probe wird bei 400 x g für 5 min bei 4 °C zentrifugiert. Der Überstand wird vorsichtig abgesaugt, wobei ca. 100 μl Überstand und Zell-/Kügelchenpellet zurückbleiben.
- Resuspendieren Sie die Probe mit zusätzlichen 200 μl Sortierpuffer und überführen Sie die Probe in ein 5-ml-Fluoreszenz-aktiviertes Zellsortierungsröhrchen (FACS).
- Analysieren Sie die Probe auf einem Durchflusszytometer. Sammeln Sie so viele Zellen wie möglich, bis zu einem Maximum von insgesamt 2.500.000 Ereignissen. Stellen Sie sicher, dass mindestens 20.000 Zähl-Bead-Ereignisse erfasst wurden. Halten Sie die Erfassungsrate bei oder unter 5.000 Ereignissen pro Sekunde.
- Speichern Sie alle Daten als FCS-Dateien.
| Fluorochrom | Antikörper |
| BUV395 | CD90.2 |
| Pazifisches Blau | CD45 (früher durch intravenöse Injektion hinzugefügt) |
| Pazifische Orange | CD8 |
| Strahlendes Violett 785 | CD4 |
| FITC | CD3 |
| PerCP-Cy5.5 | Dump (B220, CD11b, CD11c, F4/80) |
| PE | pMHC-Tetramer oder phänotypischer Marker |
| PE-Cy7 | Phänotypischer Marker (z.B. CD44, PD-1, CD69, etc.) |
| APC | pMHC-Tetramer oder phänotypischer Marker |
| AlexaFluor 700 | Phänotypischer Marker (z.B. CD44, PD-1, CD69, etc.) |
| APC-CY7 | Lebender/toter Fleck |
Tabelle 1: Färbematrix der Probe. Ein typisches Panel von Fluorophor-konjugierten Durchflusszytometrie-Antikörpern, die zur Identifizierung und Charakterisierung antigenspezifischer T-Zellen verwendet werden.
7. Analysieren von Daten
- Analysieren Sie die FCS-Datendateien mit einer geeigneten Durchflusszytometrie-Software.
- Richten Sie eine Sequenz von aufeinanderfolgenden Einschlussgates ein, um 1) lymphozytenähnliche, 2) einzelne, 3) lebende, 4) extravaskuläre, 5) dump-negative und 6) CD90.2-positive Ereignisse zu identifizieren, die entweder CD4- oder CD8-positiv sind (Abbildung 2).
- Identifizieren Sie die tetramerpositiven T-Zellen innerhalb dieser Populationen.
- Bestimmen Sie die absolute Anzahl der tetramerpositiven Küvetten, indem Sie das Verhältnis der hinzugefügten Kügelchen (50.000) zur Anzahl der während des Probenlaufs gesammelten Kügelchen berechnen und den Wert mit der Gesamtzahl der gesammelten tetramerpositiven Zellen multiplizieren.
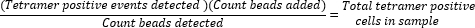
Ergebnisse
Abbildung 2 zeigt die repräsentative Gating-Strategie, die bei der Identifizierung seltener antigenspezifischer CD4+ T-Zellen in der Lunge mit Peptid:MHC-Klasse-II-Tetrameren verwendet wird. Das gleiche Verfahren kann für antigenspezifische CD8+ T-Zellen mit Peptid:MHC-Klasse-I-Tetrameren angewendet werden (Daten nicht gezeigt).
Aufgrund der hohen Anzahl nicht-lymphatischer Zellen in der Lunge erfordert der zuverlässige Nachweis seltener a...
Diskussion
Frühere Charakterisierungen von antigenspezifischen T-Zellen aus der Lunge haben von der robusten Anzahl antigenspezifischer T-Zellen profitiert, die sich nach einem akuten Priming-Ereignis wie einer intranasalen Immunisierung oder Infektion vermehren 20,21,22. Seltenere T-Zellpopulationen in der Lunge, wie z. B. selbstantigenspezifische T-Zellen oder geweberesidente Gedächtnis-T-Zellen, sind jedoch ohne irgendeine Form der Pr...
Offenlegungen
Die Autoren haben keine Konflikte offenzulegen.
Danksagungen
Wir danken L. Kuhn für die technische Unterstützung bei der Gewebeverarbeitung und der Tetramerproduktion. Diese Arbeit wurde von den National Institutes of Health (R01 AI107020 und P01 AI165072 an J.J.M., T32 AI007512 an D.S.S.), dem Massachusetts Consortium on Pathogen Readiness (J.J.M.) und dem Massachusetts General Hospital Executive Committee on Research (J.J.M.) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mm cell strainer | Fisher Scientific | 22-363-549 | |
| 10x PBS without Ca++ or Mg++ | Corning | 46-013-CM | |
| 1x PBS without Ca++ or Mg++ | Corning | 21-031-CV | |
| AccuCheck Counting Beads | Invitrogen | PCB100 | |
| Aminoguanidine Hemisulfate Salt | Sigma-Aldrich | A7009 | |
| CD90.2 microbeads, mouse | Miltenyi | 130-121-278 | |
| Cell separation magnet (MidiMACS Separator) | Miltenyi | 130-042-302 | Holds single LS column |
| Cell separation magnet (QuadroMACS Separator) | Miltenyi | 130-090-976 | Holds 4 LS columns |
| Dasatinib | Sigma-Aldrich | CDS023389 | |
| DNase I | Roche | 10104159001 | |
| Eagle’s Ham’s Amino Acids medium | Sigma-Aldrich | C5572 | |
| gentleMACS | Miltenyi | 130-093-235 | Automated tissue dissociator |
| gentleMACS C Tubes | Miltenyi | 130-093-237 | Automated tissue dissociator tubes |
| Hank's Balanced Salt Solution with Ca++ or Mg++ | Corning | 21-020-CM | |
| HEPES | Gibco | 15630080 | |
| Ketamine | Vedco | NDC 50989-996-06 | |
| Liberase TM | Roche | 5401119001 | |
| Pacific Blue anti-mouse CD45 antibody (Clone: 30-F11) | Biolegend | 103126 | |
| Paramagnetic cell separation columns (LS Columns) | Miltenyi | 130-042-401 | Comes with plunger |
| Purified anti mouse CD16/32 antibody (Clone: 93) | Biolegend | 101302 | |
| RPMI 1640 medium without L-glutamine | Corning | 15-040-CM | |
| Sodium Chloride 0.9% (Normal Saline) | Cytiva | Z1376 | |
| Xylazine | Pivetal | NDC 466066-750-02 |
Referenzen
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235 (2023).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Crawford, F., Kozono, H., White, J., Marrack, P., Kappler, J. Detection of antigen-specific T cells with multivalent soluble class II MHC covalent peptide complexes. Immunity. 8 (6), 675-682 (1998).
- Nepom, G. T., et al. HLA class II tetramers: tools for direct analysis of antigen-specific CD4+ T cells. Arthritis Rheum. 46 (1), 5-12 (2002).
- Davis, M. M., Altman, J. D., Newell, E. W. Interrogating the repertoire: broadening the scope of peptide-MHC multimer analysis. Nat Rev Immunol. 11 (8), 551-558 (2011).
- Moon, J. J., et al. Tracking epitope-specific T cells. Nat Protoc. 4 (4), 565-581 (2009).
- Jenkins, M. K., Moon, J. J. The role of naive T cell precursor frequency and recruitment in dictating immune response magnitude. J Immunol. 188 (9), 4135-4140 (2012).
- Moon, J. J., et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Obar, J. J., Khanna, K. M., Lefrancois, L. Endogenous naive CD8+ T cell precursor frequency regulates primary and memory responses to infection. Immunity. 28 (6), 859-869 (2008).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. J Immunol. 181 (3), 2124-2133 (2008).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J Vis Exp. (68), e4420 (2012).
- Szabo, P. A., Miron, M., Farber, D. L. Location, location, location: Tissue resident memory T cells in mice and humans. Sci Immunol. 4 (34), 9673 (2019).
- Poon, M. M. L., et al. Tissue adaptation and clonal segregation of human memory T cells in barrier sites. Nat Immunol. 24 (2), 309-319 (2023).
- Zheng, M. Z. M., Wakim, L. M. Tissue resident memory T cells in the respiratory tract. Mucosal Immunol. 15 (3), 379-388 (2022).
- Legoux, F. P., et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T Cells rather than deletion. Immunity. 43 (5), 896-908 (2015).
- Shin, D. S., et al. Lung injury induces a polarized immune response by self-antigen-specific CD4(+) Foxp3(+) regulatory T cells. Cell Rep. 42 (8), 112839 (2023).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nat Protoc. 9 (1), 209-222 (2014).
- Vig, M., et al. Inducible nitric oxide synthase in T cells regulates T cell death and immune memory. J Clin Invest. 113 (12), 1734-1742 (2004).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. J Immunol Methods. 340 (1), 11-24 (2009).
- Hogan, R. J., et al. Protection from respiratory virus infections can be mediated by antigen-specific CD4(+) T cells that persist in the lungs. J Exp Med. 193 (8), 981-986 (2001).
- Hogan, R. J., et al. Activated antigen-specific CD8+ T cells persist in the lungs following recovery from respiratory virus infections. J Immunol. 166 (3), 1813-1822 (2001).
- Zhao, J., et al. Airway memory CD4(+) T cells mediate protective immunity against emerging respiratory coronaviruses. Immunity. 44 (6), 1379-1391 (2016).
- Hondowicz, B. D., et al. Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma. Immunity. 44 (1), 155-166 (2016).
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. J Vis Exp. (29), e1266 (2009).
- Faustino, L. D., et al. Interleukin-33 activates regulatory T cells to suppress innate gammadelta T cell responses in the lung. Nat Immunol. 21 (11), 1371-1383 (2020).
- Atif, S. M., Gibbings, S. L., Jakubzick, C. V. Isolation and identification of interstitial macrophages from the lungs using different digestion enzymes and staining strategies. Methods Mol Biol. 1784, 69-76 (2018).
- Pape, K. A., Taylor, J. J., Maul, R. W., Gearhart, P. J., Jenkins, M. K. Different B cell populations mediate early and late memory during an endogenous immune response. Science. 331 (6021), 1203-1207 (2011).
- Naeher, D., et al. A constant affinity threshold for T cell tolerance. J Exp Med. 204 (11), 2553-2559 (2007).
- Moon, J. J., et al. Quantitative impact of thymic selection on Foxp3+ and Foxp3- subsets of self-peptide/MHC class II-specific CD4+ T cells. Proc Natl Acad Sci U S A. 108 (35), 14602-14607 (2011).
- Koehli, S., Naeher, D., Galati-Fournier, V., Zehn, D., Palmer, E. Optimal T-cell receptor affinity for inducing autoimmunity. Proc Natl Acad Sci U S A. 111 (48), 17248-17253 (2014).
- Zhang, Z., Legoux, F. P., Vaughan, S. W., Moon, J. J. Opposing peripheral fates of tissue-restricted self antigen-specific conventional and regulatory CD4(+) T cells. Eur J Immunol. 50 (1), 63-72 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten