È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Identificazione di rare cellule T antigene-specifiche da polmoni di topo con tetrameri del complesso peptide:istocompatibilità maggiore
In questo articolo
Riepilogo
Forniamo un protocollo dettagliato per l'isolamento e l'identificazione di rare popolazioni di cellule T antigene-specifiche nei polmoni di topo attraverso l'arricchimento di cellule T basato su biglie magnetiche e i tetrameri peptide:complesso maggiore di istocompatibilità (MHC).
Abstract
L'identificazione e la caratterizzazione delle cellule T antigene-specifiche durante la salute e la malattia rimane una chiave per migliorare la nostra comprensione della fisiopatologia immunitaria. Le sfide tecniche legate al tracciamento delle popolazioni di cellule T antigene-specifiche all'interno del repertorio endogeno delle cellule T sono state notevolmente avanzate dallo sviluppo dei reagenti tetrameri peptide:MHC. Questi multimeri solubili marcati in fluorescenza di molecole MHC di classe I o II complessate con epitopi di peptidi antigenici si legano direttamente alle cellule T con corrispondente specificità del recettore delle cellule T (TCR) e possono, quindi, identificare popolazioni di cellule T antigene-specifiche nel loro stato nativo senza la necessità di una risposta funzionale indotta da ex vivo stimolazione. Per popolazioni estremamente rare, le cellule T legate ai tetrameri possono essere arricchite magneticamente per aumentare la sensibilità e l'affidabilità del rilevamento.
Con l'approfondimento dello studio dell'immunità delle cellule T residenti nei tessuti, vi è un urgente bisogno di identificare le cellule T antigene-specifiche che viaggiano e risiedono nei tessuti non linfoidi. In questo protocollo, presentiamo una serie dettagliata di istruzioni per l'isolamento e la caratterizzazione delle cellule T antigene-specifiche presenti all'interno dei polmoni di topo. Ciò comporta l'isolamento delle cellule T dal tessuto polmonare digerito, seguito da una fase generale di arricchimento magnetico delle cellule T e dalla colorazione con tetramero per l'analisi e lo smistamento della citometria a flusso. Le fasi evidenziate in questo protocollo utilizzano tecniche comuni e reagenti prontamente disponibili, rendendolo accessibile a quasi tutti i ricercatori impegnati nell'immunologia delle cellule T di topo, e sono altamente adattabili per una varietà di analisi a valle di qualsiasi popolazione di cellule T antigene-specifiche a bassa frequenza che risiedono nei polmoni.
Introduzione
Al centro del sistema immunitario adattativo c'è la capacità di una cellula T di riconoscere e rispondere a un antigene specifico. Quando e dove una cellula T risponde al suo antigene affine determina l'equilibrio tra infezione e autoimmunità, omeostasi e cancro, salute e malattia1. Ne consegue che lo studio delle cellule T in un contesto specifico di immunità dovrebbe concentrarsi sulle cellule con specificità per un antigene rilevante di interesse. Tra i progressi tecnologici che hanno notevolmente migliorato la capacità di caratterizzare popolazioni di cellule T antigene-specifiche vi sono multimeri solubili marcati in fluorescenza (solitamente tetrameri) di molecole di complesso maggiore di istocompatibilità (MHC) di classe I o di classe II complessate a epitopi peptidici antigenici, meglio noti come "tetrameri peptide:MHC"2,3,4,5 . Rappresentando i ligandi naturali dei recettori dell'antigene delle cellule T (TCR), i tetrameri peptide:MHC di classe I e II forniscono un mezzo per identificare direttamente le cellule T CD8+ e CD4+ antigene-specifiche, rispettivamente, all'interno del repertorio endogeno delle cellule T nel sistema immunitario senza la necessità di una risposta alla stimolazione dell'antigene in un test. I tetrameri rappresentano un approccio più elegante allo studio delle cellule T antigene-specifiche rispetto ai modelli di trasferimento adottivo delle cellule T transgeniche TCR6 e sono stati sempre più utilizzati per identificare popolazioni di cellule T estranee e auto-antigene-specifiche sia in modelli murini sperimentali che in malattie umane 4,5.
Mentre i tetrameri possono facilmente identificare popolazioni ad alta frequenza di cellule T che si sono espanse in risposta alla stimolazione dell'antigene, il loro uso per le cellule T naive, auto-antigene-specifiche o di memoria è limitato dalle frequenze molto basse di queste popolazioni7. Il nostro gruppo e altri hanno sviluppato e reso popolari strategie di arricchimento magnetico basate su tetrameri che aumentano la sensibilità di rilevamento per consentire studi di queste popolazioni cellulari nei tessuti linfoidi di topo 8,9,10,11.
L'emergere di cellule T residenti nei tessuti in questo campo ha posto una maggiore enfasi sullo sviluppo di nuovi modi per studiare le cellule T nello spazio non linfoide. Come molte altre superfici mucose, le cellule T nei polmoni incontrano una serie di antigeni propri ed estranei derivati dall'epitelio ospite, dai microbi commensali e infettivi e dalle entità ambientali, compresi gli allergeni. L'analisi trascrizionale delle cellule T raccolte da tessuto non linfoide (NLT) dimostra un fenotipo simile alla memoria che ha un destino e una funzione tessuto-specifici unici, spesso diretti al traffico e all'omeostasi tissutale12. Inoltre, le cellule T di memoria residenti nei tessuti (Trms) tendono ad essere più limitate clonalmente rispetto a quelle in circolazione13. Determinare come e perché gli antigeni guidano la residenza delle cellule T nella NLT è fondamentale per capire come il sistema immunitario protegge dalle infezioni, mantiene l'omeostasi dei tessuti e, a volte, si trasforma in autoimmunità. Tuttavia, sembra esserci un maggiore attrito tra le cellule T residenti nei tessuti dai polmoni rispetto ad altri NLT14. Di conseguenza, la capacità di identificare e caratterizzare le cellule T endogene del polmone con una data antigene-specificità è limitata dalla loro rarità intrinseca.
Combinando l'uso di tecniche di arricchimento cellulare basate su biglie magnetiche e la colorazione con tetramero peptide:MHC, siamo riusciti a rilevare cellule T auto-antigene specifiche espanse ma rare nei polmoni di topo15,16. Qui, presentiamo una descrizione dettagliata di un protocollo che abbiamo ottimizzato per isolare e caratterizzare in modo affidabile qualsiasi rara popolazione di cellule T antigene-specifiche presente nei polmoni di topo (Figura 1). Questo protocollo incorpora una fase di colorazione degli anticorpi in vivo per distinguere le cellule T vascolari residenti nel tessuto17, seguita da due diversi metodi per l'elaborazione del tessuto polmonare per soddisfare la disponibilità di risorse. Questo è quindi seguito da una fase generale di arricchimento magnetico delle cellule T, dalla colorazione del tetramero e dall'analisi mediante citometria a flusso. La vitalità cellulare e la colorazione del tetramero sono ulteriormente migliorate in questo protocollo dall'aggiunta di aminoguanidina, che blocca l'apoptosi indotta dall'attivazione delle cellule T18 mediata dall'ossido nitrico sintasi (iNOS) e Dasatinib che limita la sottoregolazione del TCR19. Le fasi evidenziate in questo protocollo utilizzano tecniche comuni e reagenti prontamente disponibili, rendendolo accessibile a quasi tutti i ricercatori impegnati nell'immunologia delle cellule T di topo ed è altamente adattabile per una varietà di analisi a valle. Sebbene non sia probabile che le cellule T naive si trovino nei polmoni, riteniamo che questo protocollo sarà particolarmente utile per lo studio delle cellule T auto-antigene-specifiche e dei Trm nei polmoni.
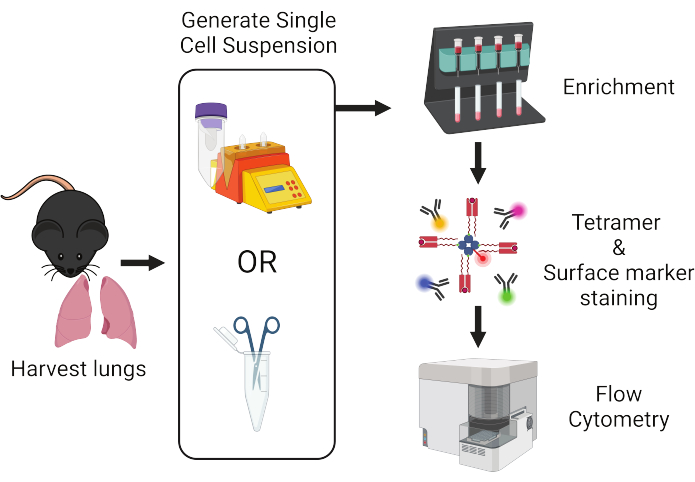
Figura 1: Panoramica del flusso di lavoro del protocollo. I polmoni vengono prelevati dai topi e dissociati in singole cellule. I campioni vengono successivamente arricchiti per le cellule T prima della colorazione con tetrameri peptide:MHC e anticorpi marcati con fluorescenza per l'analisi citofluorimetrica. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Le procedure descritte in questo protocollo sono approvate e sviluppate in conformità con le linee guida stabilite dall'Institutional Animal Care and Use Committee (IACUC) del Massachusetts General Hospital, un programma di gestione degli animali accreditato dall'American Association for the Accreditation of Laboratory Animal Care (AAALAC). Gli esperimenti sono stati eseguiti su topi maschi e femmine di 8-12 settimane su un background genetico C57BL/6 allevati e mantenuti nella struttura per animali MGH in specifiche condizioni prive di agenti patogeni.
1. Preparazione delle soluzioni madre
- Preparare il tampone HEPES sciogliendo 10 mM di HEPES, 5 mM di KCl, 1,8 mM di CaCl2, 150 mM di NaCl e 1 mM di MgCl2 e regolare a pH 7,4.
- Preparare 10 volte la soluzione madre di Liberase sciogliendo 700 μg/mL di terreno di Liberase Thermolysin (TM) (vedere la Tabella dei materiali) nella soluzione salina bilanciata di Hank con Ca++ e Mg++ (vedere la Tabella dei materiali).
- Preparare 10 volte la soluzione madre di aminoguanidina sciogliendo 100 mM di sale di amiguanidina emisolfato (vedi Tabella dei materiali) nella soluzione salina bilanciata di Hank con Ca++ e Mg++ (vedi Tabella dei materiali).
- Preparare il terreno completo degli aminoacidi del prosciutto d'aquila (EHAA) mescolando il terreno EHAA (vedere la tabella dei materiali) con il 10% di siero fetale bovino (FBS), 100 U/mL di penicillina/streptomicina, 50 μg/mL di gentamicina, 2 mM di L-glutammina e 55 μM di 2-mercaptoetanolo.
NOTA: Possono essere utilizzati anche altri comuni mezzi di comunicazione delle cellule T, come RPMI o DMEM. - Preparare il tampone di smistamento mescolando 1x PBS con FBS al 2% e azoturo di sodio allo 0,05%.
- Preparare il blocco Fc diluendo l'anticorpo CD16/32 purificato anti-topo (vedere la tabella dei materiali) a 1:100 v/v nel tampone di smistamento.
- Preparare la soluzione di digestione Liberase TM/DNasi aggiungendo 100 μg/mL di Liberase TM e 50 μg/mL di DNasi I (vedere la Tabella dei materiali) in terreno RPMI 1640 senza L-glutammina (vedere la Tabella dei materiali).
- Preparare la miscela ketamina/xilazina aggiungendo 10 mg/mL di ketamina (vedere la Tabella dei Materiali) e 1 mg/mL di xilazina (vedere la Tabella dei Materiali) in soluzione salina normale (0,9% NaCl) (vedere la Tabella dei Materiali).
2. Generazione di sospensioni unicellulari dal tessuto polmonare tramite dissociatore tissutale automatizzato
- Per ogni topo, preparare 4 mL di tampone HEPES ghiacciato in una provetta specializzata per dissociazione tissutale (vedere la Tabella dei materiali) e tenerlo in ghiaccio.
- Anestetizzare i topi mediante iniezione intraperitoneale di 150-200 μL di miscela ketamina/xilazina. Iniettare 1-3 μg di anticorpo CD45 anti-topo coniugato con fluorofori (vedere la Tabella dei materiali) diluito in 100 μL di soluzione fisiologica normale per via endovenosa in ciascun topo anestetizzato. Eutanasia nel topo 3 minuti dopo la somministrazione degli anticorpi con un'iniezione intraperitoneale di 500-600 μL di miscela ketamina/xilazina.
- Resecare i polmoni e metterli nel rispettivo tubo dissociatore tissutale raffreddato su ghiaccio. Posizionare le provette sul dissociatore tissutale automatizzato (vedere Tabella dei materiali) ed eseguire il primo programma (programma preimpostato) per il tessuto polmonare.
- Aggiungere 500 μL di soluzione madre di Liberase e 500 μL di soluzione madre di aminoguanidina a ciascuna provetta contenente il tessuto polmonare dissociato. Incubare su un miscelatore nutante per 30 minuti a 37 °C.
- Riposizionare i tubi sul dissociatore ed eseguire il secondo programma (programma preimpostato) per il tessuto polmonare.
- Versare la sospensione unicellulare dalla provetta dissociatrice tissutale attraverso un filtro cellulare da 100 μm (vedere la Tabella dei materiali) in una provetta conica da 50 mL. Sciacquare la provetta del dissociatore tissutale con 5 mL di EHAA completo (o qualsiasi terreno di coltura a cellule T equivalente) e farla passare attraverso il colino nella provetta da 50 mL.
- Rimuovere il filtro e aumentare il volume della sospensione cellulare a 50 mL con EHAA completo. Centrifugare la sospensione cellulare a 400 x g per 5 minuti a 4 °C. Aspirare con cura il surnatante, lasciando circa 100 μl di surnatante e pellet cellulare.
- Aggiungere circa 100 μl di soluzione di blocco Fc per portare il volume totale fino a 200 μl e agitare energicamente per risospendere il pellet.
3. Protocollo alternativo: generazione di sospensioni unicellulari dal tessuto polmonare mediante dissociazione manuale
- Per ogni topo, preparare 1 mL di EHAA completo in una provetta microfuge da 1,5 mL e conservare in ghiaccio.
- Anestetizzare i topi mediante iniezione intraperitoneale di 150-200 μL di miscela ketamina/xilazina. Iniettare 1-3 μg di anticorpo CD45 anti-topo coniugato con fluorofori diluito in 100 μL di soluzione fisiologica normale per via endovenosa in ciascun topo anestetizzato. Eutanasia nel topo 3 minuti dopo la somministrazione degli anticorpi con un'iniezione intraperitoneale di 500-600 μL di miscela ketamina/xilazina.
- Resecare i polmoni e metterli nella rispettiva provetta per microfuge da 1,5 ml raffreddata su ghiaccio.
- Una volta che tutti i polmoni sono stati prelevati, trasferire ciascun polmone in una nuova provetta per microfugi senza alcun mezzo cellulare.
- Tagliare i polmoni in piccoli frammenti (~2-3 mm di pezzi) usando le forbici all'interno del tubo di microfuga.
- Aggiungere 1 mL di cocktail digestivo Liberase TM/DNase I in ciascuna provetta.
- Incubare per 30 minuti a 37 °C a bagnomaria. Rimettere i campioni nel ghiaccio per evitare una digestione eccessiva.
- Versare il campione su un colino cellulare da 100 μm posizionato sopra una provetta conica da 50 mL. Schiacciare il tessuto contro la rete con l'estremità in gomma dello stantuffo da una siringa sterile da 1 ml.
- Sciacquare il colino con un tampone selezionatore freddo, raccogliendo un volume finale di 7 mL nella provetta. Centrifugare la sospensione cellulare a 400 x g per 5 minuti a 4 °C. Aspirare con cautela il surnatante, lasciando circa 100 μL di surnatante e pellet cellulare.
- Aggiungere 100 μl di soluzione Fc Block per portare il volume totale fino a 200 μl e agitare energicamente per risospendere il pellet.
4. Arricchimento del campione polmonare per le cellule T tramite arricchimento di biglie magnetiche
- Aggiungere 50 μl di microsfere CD90.2 anti-topo (vedere la tabella dei materiali). Agitare e incubare per 10 minuti a 4 °C.
NOTA: CD90.2 corrisponde all'allele espresso dalle cellule T nei topi C57BL/6. Controllare il genotipo dell'allele se vengono utilizzati altri ceppi di topi. - Nel frattempo, posizionare una colonna di separazione cellulare paramagnetica (vedi Tabella dei materiali) su un magnete di separazione delle celle a una o quattro posizioni (vedi Tabella dei materiali). Posizionare una provetta conica aperta da 15 mL sotto ciascuna colonna per catturare il flusso. Adescare la colonna con 3 mL di tampone selezionatore a freddo, consentendo alla colonna di drenare per gravità nella provetta conica sottostante.
- Una volta che le cellule sono state incubate con le microsfere per 10 minuti, aggiungere un tampone selezionatore a freddo a un volume di 1 mL e trasferire attraverso un colino cellulare da 100 μm posizionato sopra la colonna. Raccogliere il flusso della colonna in una provetta conica fresca da 15 mL posizionata sotto la colonna.
- Una volta che la sospensione cellulare è stata completamente drenata attraverso la colonna per gravità, lavare la colonna risciacquando la provetta originale con altri 3 mL di tampone selezionatore a freddo e applicandolo alla colonna attraverso la rete, risciacquando così il filtro. Rimuovere il colino.
- Quando il campione è di nuovo completamente drenato nella colonna e non esce più alcun flusso dalla colonna, rimuovere la colonna dal magnete e posizionarla sopra una provetta conica fresca da 15 mL.
- Aggiungere 5 mL di tampone per lo smistamento a freddo alla colonna.
- Eluire immediatamente le celle legate alla colonna spingendo lo stantuffo della colonna verso l'alto con un movimento continuo e forzando il tampone di selezione fuori dal fondo della colonna nella nuova provetta.
- Centrifugare i campioni eluiti a 400 x g per 5 minuti a 4 °C. Aspirare con cura il surnatante, lasciando circa 100 μl di surnatante e pellet cellulare.
- Aggiungere 100 μl di tampone per selezionatrice a freddo per portare il volume totale fino a 200 μl e agitare energicamente per risospendere il pellet.
- Analizzare il campione di flusso contenente la frazione di cella non legata, se lo si desidera.
5. Colorazione delle cellule T antigene-specifiche con tetrameri peptide:MHC
- Aggiungere 1 μL di Dasatinib da 10 μM (vedere la Tabella dei materiali) a ciascun campione, agitare e incubare per 5 minuti a RT.
- Aggiungere peptide:MHC coniugato con PE o APC a una concentrazione finale di 10 nM (o concentrazione empiricamente ottimizzata per un dato tetramero).
- Vorticare e incubare al buio per 1 ora a RT (o tempo e temperatura ottimizzati empiricamente).
6. Analisi delle cellule T marcate con tetrameri mediante citometria a flusso
- Mentre il campione viene colorato con i tetrameri peptide:MHC, preparare una miscela master di anticorpi per colorare i marcatori di superficie delle cellule (Tabella 1).
NOTA: Evitare i fluorofori che entrano in conflitto con l'anticorpo CD45 somministrato per via endovenosa o con i tetrameri. - A 15 minuti dalla fine del periodo di incubazione per la colorazione con tetramero, aggiungere la miscela master di anticorpi di superficie a 1:100 (o concentrazione empiricamente ottimizzata) a ciascun campione.
- Continuare a incubare al buio a RT per il resto del periodo di incubazione di 1 ora.
- Aggiungere 50.000 microsfere per citometria a flusso (vedere la Tabella dei materiali) e aggiungere un tampone per selezionatrice a freddo fino a un volume finale di circa 5 mL. Centrifugare il campione colorato a 400 x g per 5 minuti a 4 °C. Aspirare con cautela il surnatante, lasciando circa 100 μl di surnatante e pellet di cellule/perline.
- Risospendere il campione con altri 200 μL di tampone di selezione e trasferire il campione in una provetta da 5 mL di smistamento cellulare attivato a fluorescenza (FACS).
- Analizzare il campione su un citometro a flusso. Raccogli il maggior numero possibile di celle, fino a un massimo di 2.500.000 eventi totali. Assicurarsi che siano stati raccolti almeno 20.000 eventi di conteggio delle perline. Mantieni la velocità di acquisizione pari o inferiore a 5.000 eventi al secondo.
- Salva tutti i dati come file FCS.
| Fluorocromo | Anticorpo |
| BUV395 | CD90.2 |
| Blu Pacifico | CD45 (aggiunto in precedenza per iniezione endovenosa) |
| Arancio Pacifico | CD8 |
| Viola Brillante 785 | CD4 |
| FITC | CD3 |
| PerCP-Cy5.5 | Scarico (B220, CD11b, CD11c, F4/80) |
| PE | tetramero pMHC o marcatore fenotipico |
| PE-Cy7 | Marcatore fenotipico (es. CD44, PD-1, CD69, ecc.) |
| APC | tetramero pMHC o marcatore fenotipico |
| AlexaFluor 700 | Marcatore fenotipico (es. CD44, PD-1, CD69, ecc.) |
| APC-Cy7 | Macchia viva/morta |
Tabella 1: Matrice di colorazione del campione. Un tipico pannello di anticorpi per citometria a flusso coniugati con fluorofori utilizzati per identificare e caratterizzare le cellule T antigene-specifiche.
7. Analisi dei dati
- Analizzare i file di dati FCS utilizzando un software di citometria a flusso appropriato.
- Impostare una sequenza di porte di inclusione successive per identificare 1) eventi simili ai linfociti, 2) singoli, 3) vivi, 4) extravascolari, 5) negativi al dump e 6) CD90.2-positivi che sono CD4 o CD8 positivi (Figura 2).
- Identificare le cellule T tetramero-positive all'interno di queste popolazioni.
- Determinare il numero assoluto di cellule tetrameri-positive calcolando il rapporto tra le perle aggiunte (50.000) e il numero di perle raccolte durante l'esecuzione del campione e moltiplicando il valore per il numero totale di cellule tetrameri-positive raccolte.
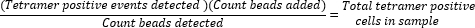
Risultati
La Figura 2 illustra la strategia di gating rappresentativa utilizzata nell'identificazione di rare cellule T CD4+ antigene-specifiche nei polmoni con tetrameri peptide:MHC di classe II. Lo stesso processo può essere applicato per le cellule T CD8+ antigene-specifiche con tetrameri peptide:MHC di classe I (dati non mostrati).
A causa dell'elevato numero di cellule non linfoidi nei polmoni, la rilevazione affidabile di cellule T rare antigene...
Discussione
Le precedenti caratterizzazioni delle cellule T antigene-specifiche dei polmoni hanno beneficiato del robusto numero di cellule T antigene-specifiche che si espandono a seguito di un evento di priming acuto come l'immunizzazione intranasale o l'infezione 20,21,22. Tuttavia, le popolazioni di cellule T più rare nei polmoni, come le cellule T auto-antigene-specifiche o le cellule T di memoria residenti nei tessuti, sono difficili...
Divulgazioni
Gli autori non hanno conflitti da rivelare.
Riconoscimenti
Ringraziamo L. Kuhn per l'assistenza tecnica nella lavorazione dei tessuti e nella produzione di tetrameri. Questo lavoro è stato finanziato dal National Institutes of Health (R01 AI107020 e P01 AI165072 a J.J.M., T32 AI007512 a D.S.S.), dal Massachusetts Consortium on Pathogen Readiness (J.J.M) e dal Massachusetts General Hospital Executive Committee on Research (J.J.M.).
Materiali
| Name | Company | Catalog Number | Comments |
| 100 mm cell strainer | Fisher Scientific | 22-363-549 | |
| 10x PBS without Ca++ or Mg++ | Corning | 46-013-CM | |
| 1x PBS without Ca++ or Mg++ | Corning | 21-031-CV | |
| AccuCheck Counting Beads | Invitrogen | PCB100 | |
| Aminoguanidine Hemisulfate Salt | Sigma-Aldrich | A7009 | |
| CD90.2 microbeads, mouse | Miltenyi | 130-121-278 | |
| Cell separation magnet (MidiMACS Separator) | Miltenyi | 130-042-302 | Holds single LS column |
| Cell separation magnet (QuadroMACS Separator) | Miltenyi | 130-090-976 | Holds 4 LS columns |
| Dasatinib | Sigma-Aldrich | CDS023389 | |
| DNase I | Roche | 10104159001 | |
| Eagle’s Ham’s Amino Acids medium | Sigma-Aldrich | C5572 | |
| gentleMACS | Miltenyi | 130-093-235 | Automated tissue dissociator |
| gentleMACS C Tubes | Miltenyi | 130-093-237 | Automated tissue dissociator tubes |
| Hank's Balanced Salt Solution with Ca++ or Mg++ | Corning | 21-020-CM | |
| HEPES | Gibco | 15630080 | |
| Ketamine | Vedco | NDC 50989-996-06 | |
| Liberase TM | Roche | 5401119001 | |
| Pacific Blue anti-mouse CD45 antibody (Clone: 30-F11) | Biolegend | 103126 | |
| Paramagnetic cell separation columns (LS Columns) | Miltenyi | 130-042-401 | Comes with plunger |
| Purified anti mouse CD16/32 antibody (Clone: 93) | Biolegend | 101302 | |
| RPMI 1640 medium without L-glutamine | Corning | 15-040-CM | |
| Sodium Chloride 0.9% (Normal Saline) | Cytiva | Z1376 | |
| Xylazine | Pivetal | NDC 466066-750-02 |
Riferimenti
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235 (2023).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Crawford, F., Kozono, H., White, J., Marrack, P., Kappler, J. Detection of antigen-specific T cells with multivalent soluble class II MHC covalent peptide complexes. Immunity. 8 (6), 675-682 (1998).
- Nepom, G. T., et al. HLA class II tetramers: tools for direct analysis of antigen-specific CD4+ T cells. Arthritis Rheum. 46 (1), 5-12 (2002).
- Davis, M. M., Altman, J. D., Newell, E. W. Interrogating the repertoire: broadening the scope of peptide-MHC multimer analysis. Nat Rev Immunol. 11 (8), 551-558 (2011).
- Moon, J. J., et al. Tracking epitope-specific T cells. Nat Protoc. 4 (4), 565-581 (2009).
- Jenkins, M. K., Moon, J. J. The role of naive T cell precursor frequency and recruitment in dictating immune response magnitude. J Immunol. 188 (9), 4135-4140 (2012).
- Moon, J. J., et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Obar, J. J., Khanna, K. M., Lefrancois, L. Endogenous naive CD8+ T cell precursor frequency regulates primary and memory responses to infection. Immunity. 28 (6), 859-869 (2008).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. J Immunol. 181 (3), 2124-2133 (2008).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J Vis Exp. (68), e4420 (2012).
- Szabo, P. A., Miron, M., Farber, D. L. Location, location, location: Tissue resident memory T cells in mice and humans. Sci Immunol. 4 (34), 9673 (2019).
- Poon, M. M. L., et al. Tissue adaptation and clonal segregation of human memory T cells in barrier sites. Nat Immunol. 24 (2), 309-319 (2023).
- Zheng, M. Z. M., Wakim, L. M. Tissue resident memory T cells in the respiratory tract. Mucosal Immunol. 15 (3), 379-388 (2022).
- Legoux, F. P., et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T Cells rather than deletion. Immunity. 43 (5), 896-908 (2015).
- Shin, D. S., et al. Lung injury induces a polarized immune response by self-antigen-specific CD4(+) Foxp3(+) regulatory T cells. Cell Rep. 42 (8), 112839 (2023).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nat Protoc. 9 (1), 209-222 (2014).
- Vig, M., et al. Inducible nitric oxide synthase in T cells regulates T cell death and immune memory. J Clin Invest. 113 (12), 1734-1742 (2004).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. J Immunol Methods. 340 (1), 11-24 (2009).
- Hogan, R. J., et al. Protection from respiratory virus infections can be mediated by antigen-specific CD4(+) T cells that persist in the lungs. J Exp Med. 193 (8), 981-986 (2001).
- Hogan, R. J., et al. Activated antigen-specific CD8+ T cells persist in the lungs following recovery from respiratory virus infections. J Immunol. 166 (3), 1813-1822 (2001).
- Zhao, J., et al. Airway memory CD4(+) T cells mediate protective immunity against emerging respiratory coronaviruses. Immunity. 44 (6), 1379-1391 (2016).
- Hondowicz, B. D., et al. Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma. Immunity. 44 (1), 155-166 (2016).
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. J Vis Exp. (29), e1266 (2009).
- Faustino, L. D., et al. Interleukin-33 activates regulatory T cells to suppress innate gammadelta T cell responses in the lung. Nat Immunol. 21 (11), 1371-1383 (2020).
- Atif, S. M., Gibbings, S. L., Jakubzick, C. V. Isolation and identification of interstitial macrophages from the lungs using different digestion enzymes and staining strategies. Methods Mol Biol. 1784, 69-76 (2018).
- Pape, K. A., Taylor, J. J., Maul, R. W., Gearhart, P. J., Jenkins, M. K. Different B cell populations mediate early and late memory during an endogenous immune response. Science. 331 (6021), 1203-1207 (2011).
- Naeher, D., et al. A constant affinity threshold for T cell tolerance. J Exp Med. 204 (11), 2553-2559 (2007).
- Moon, J. J., et al. Quantitative impact of thymic selection on Foxp3+ and Foxp3- subsets of self-peptide/MHC class II-specific CD4+ T cells. Proc Natl Acad Sci U S A. 108 (35), 14602-14607 (2011).
- Koehli, S., Naeher, D., Galati-Fournier, V., Zehn, D., Palmer, E. Optimal T-cell receptor affinity for inducing autoimmunity. Proc Natl Acad Sci U S A. 111 (48), 17248-17253 (2014).
- Zhang, Z., Legoux, F. P., Vaughan, S. W., Moon, J. J. Opposing peripheral fates of tissue-restricted self antigen-specific conventional and regulatory CD4(+) T cells. Eur J Immunol. 50 (1), 63-72 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon