JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
펩타이드를 이용한 생쥐 폐의 희귀 항원 특이적 T 세포 식별: 주요 조직적합성 복합체 테트라머
요약
자사는 자기 비드 기반 T 세포 농축 및 펩타이드:주요 조직 적합성 복합체(MHC) 사량체를 통해 쥐 폐에서 희귀 항원 특이적 T 세포 집단을 분리하고 식별하기 위한 상세한 프로토콜을 제공합니다.
초록
건강 및 질병 중 항원 특이적 T 세포의 식별 및 특성 분석은 면역 병태 생리학에 대한 이해를 향상시키는 열쇠로 남아 있습니다. 내인성 T 세포 레퍼토리 내에서 항원 특이적 T 세포 집단을 추적하는 기술적 과제는 펩타이드:MHC 테트라머 시약의 개발로 크게 발전했습니다. 항원 펩타이드 에피토프에 복합된 MHC 클래스 I 또는 클래스 II 분자의 이러한 형광 표지된 용해성 멀티머는 해당 T 세포 수용체(TCR) 특이성을 가진 T 세포에 직접 결합하므로 생체 외(ex vivo )에 의해 유도된 기능 반응 없이 원래 상태의 항원 특이적 T 세포 집단을 식별할 수 있습니다 자극. 극히 드문 집단의 경우, tetramer-bound T cell을 자기적으로 강화하여 검출의 민감도와 신뢰성을 높일 수 있습니다.
조직에 상주하는 T 세포 면역에 대한 연구가 심화됨에 따라 비림프 조직으로 이동하고 상주하는 항원 특이적 T 세포를 식별해야 할 필요성이 시급합니다. 이 프로토콜에서는 마우스 폐 내에 존재하는 항원 특이적 T 세포의 분리 및 특성 분석을 위한 자세한 지침을 제시합니다. 여기에는 소화된 폐 조직에서 T 세포를 분리한 후 일반 T 세포 자기 농축 단계와 유세포 분석 및 분류를 위한 테트라머 염색이 포함됩니다. 이 프로토콜에서 강조된 단계는 일반적인 기술과 쉽게 구할 수 있는 시약을 활용하여 마우스 T 세포 면역학에 종사하는 거의 모든 연구자가 이용할 수 있도록 하며, 폐 내에 상주하는 저주파 항원 특이적 T 세포 집단의 다양한 다운스트림 분석에 매우 적합합니다.
서문
적응 면역 체계의 핵심은 특정 항원을 인식하고 반응하는 T 세포의 능력입니다. T세포가 동족 항원에 반응하는 시기와 위치는 감염과 자가면역, 항상성과 암, 건강과 질병의 균형을 결정한다1. 따라서 면역의 특정 맥락에서 T 세포에 대한 연구는 관련 관심 항원에 대한 특이성을 가진 세포에 초점을 맞춰야 합니다. 항원 특이적 T 세포 집단을 특성화하는 능력을 크게 향상시킨 기술 발전 중에는 "펩타이드:MHC 사량체"로 더 잘 알려진 항원 펩타이드 에피토프에 복합된 주요 조직적합성 복합체(MHC) 클래스 I 또는 클래스 II 분자의 형광 표지된 용해성 멀티머(일반적으로 테트라머)가 있습니다2,3,4,5 . 펩타이드:MHC class I 및 class II tetramers는 T 세포 항원 수용체(TCR)의 천연 리간드를 나타내어 면역 체계에서 T 세포의 내인성 레퍼토리 내에서 항원 특이적 CD8+ 및 CD4+ T 세포를 각각 직접 식별할 수 있는 수단을 제공합니다. Tetramers는 TCR 형질전환 T 세포 채택전달 모델보다 항원 특이적 T 세포 연구에 대한 더 우아한 접근 방식을 나타내며6, 실험 마우스 모델과 인간 질병 모두에서 외부 및 자가 항원 특이적 T 세포 집단을 식별하는 데 점점 더 많이 사용되고 있습니다 4,5.
테트라머는 항원 자극에 반응하여 증식한 고주파 T 세포 집단을 쉽게 식별할 수 있지만, 순진한 자기 항원 특이적 또는 기억 T 세포에 대한 사용은 이러한 집단의 매우 낮은 빈도로 인해 제한된다7. 우리 그룹과 다른 연구자들은 마우스 림프 조직에서 이러한 세포 집단을 연구할 수 있도록 검출 감도를 높이는 테트라머 기반 자기 농축 전략을 개발하고 대중화했습니다 8,9,10,11.
이 분야에서 조직에 상주하는 T 세포가 출현함에 따라 비림프 공간에서 T 세포를 조사하는 새로운 방법 개발에 대한 중요성이 높아졌습니다. 다른 많은 점막 표면과 마찬가지로 폐의 T 세포는 숙주 상피, 공생 및 감염성 미생물, 알레르겐을 포함한 환경 개체에서 유래한 다양한 자체 항원 및 외부 항원과 마주합니다. 비림프 조직(NLT)에서 채취한 T 세포의 전사 분석은 종종 밀매 및 조직 항상성을 대상으로 하는 고유한 조직 특이적 운명과 기능을 지닌 기억과 같은 표현형을 보여줍니다12. 더욱이, 조직에 상주하는 기억 T 세포(Trm)는 순환 중인 세포보다 클론이 더 제한되는 경향이 있다13. 항원이 NLT에서 T 세포 거주를 촉진하는 방법과 이유를 규명하는 것은 면역 체계가 감염으로부터 보호하고, 조직 항상성을 유지하며, 때로는 자가면역으로 전환되는 방법을 이해하는 데 중요합니다. 그러나, 다른 NLT14에 비해 폐의 조직에 상주하는 T 세포 사이에서 더 큰 감소가 있는 것으로 보인다. 따라서, 주어진 항원 특이성을 가진 폐의 내인성 T 세포를 식별하고 특성화하는 능력은 고유한 희귀성에 의해 제한됩니다.
마그네틱 비드 기반 세포 농축 기술과 펩타이드:MHC 테트라머 염색을 결합하여 마우스 폐에서 확장되었지만 희귀한 자기 항원 특이적 T 세포를 검출하는 데 성공했습니다15,16. 여기에서는 쥐의 폐에 존재하는 모든 희귀 항원 특이적 T 세포 집단을 신뢰성 있게 분리하고 특성화하기 위해 최적화한 프로토콜에 대한 자세한 설명을 제공합니다(그림 1). 이 프로토콜은 조직 상주하는 혈관 T 세포를 구별하기 위한 생체 내 항체 염색 단계를 통합하고(17) 자원 가용성을 수용하기 위해 폐 조직 처리를 위한 두 가지 다른 방법을 따릅니다. 그런 다음 일반 T 세포 자기 농축 단계, tetramer 염색 및 유세포 분석을 수행합니다. 이 프로토콜에서는 유도성 산화질소 합성효소(iNOS) 매개 T 세포 활성화 유도 세포사멸18을 차단하는 아미노구아니딘과 TCR 하향 조절19를 제한하는 다사티닙을 추가함으로써 세포 생존도 및 테트라머 염색이 더욱 향상됩니다. 이 프로토콜에서 강조된 단계는 일반적인 기술과 쉽게 구할 수 있는 시약을 활용하므로 마우스 T 세포 면역학에 종사하는 거의 모든 연구자가 이용할 수 있으며 다양한 다운스트림 분석에 매우 적합합니다. 미성숙 T 세포가 폐에서 발견될 가능성은 낮지만, 이 프로토콜은 폐의 자기 항원 특이적 T 세포 및 Trms 연구에 특히 도움이 될 것이라고 믿습니다.
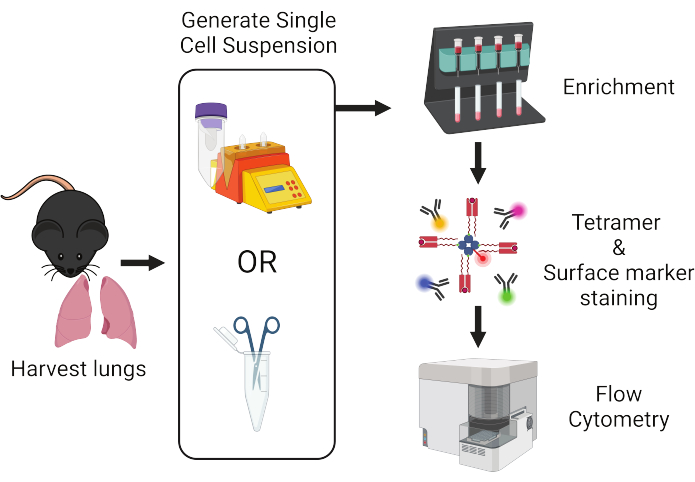
그림 1: 프로토콜 워크플로우 개요. 쥐에서 폐를 채취하여 단일 세포로 해리합니다. 이후 펩타이드:MHC tetramers 및 유세포 분석을 위한 형광 표지 항체로 염색하기 전에 T 세포에 대해 샘플을 농축합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
이 프로토콜에 설명된 절차는 AAALAC(American Association for the Accreditation of Laboratory Animal Care) 인증 동물 관리 프로그램인 Massachusetts General Hospital의 IACUC(Institutional Animal Care and Use Committee)에서 정한 지침에 따라 승인 및 개발되었습니다. 실험은 특정 병원체가 없는 조건에서 MGH 동물 시설에서 사육 및 유지된 C57BL/6 유전적 배경에 대해 8-12주 된 수컷 및 암컷 마우스를 대상으로 수행되었습니다.
1. 스톡 솔루션 준비
- 10 mM HEPES, 5 mM KCl, 1.8 mM CaCl2, 150 mM NaCl 및 1 mM MgCl2 를 용해시켜 HEPES 완충액을 제조하고 pH 7.4로 조정합니다.
- Ca++ 및 Mg++(재료 표 참조)를 사용한 Hank의 Balanced Salt Solution에 700μg/mL의 Liberase Thermolysin Medium(TM)(재료 표 참조)을 용해시켜 10x Liberase 원액을 준비합니다.
- Ca++ 및 Mg++(재료 표 참조)를 사용하여 Hank의 균형 염 용액에 100mM Aminoguanidine Hemisulfate Salt(재료 표 참조)를 용해시켜 10x aminoguanidine 원액을 준비합니다.
- EHAA 배지( 재료 표 참조)를 10% 소 태아 혈청(FBS), 100U/mL 페니실린/스트렙토마이신, 50μg/mL 겐타마이신, 2mM L-글루타민 및 55μM 2-메르캅토에탄올과 혼합하여 완전한 Eagle's Ham's Amino Acids(EHAA) 배지를 준비합니다.
참고: RPMI 또는 DMEM과 같은 다른 일반적인 T 세포 매체도 사용할 수 있습니다. - 1x PBS와 2% FBS 및 0.05% 아지드화나트륨을 혼합하여 분류기 버퍼를 준비합니다.
- 정제된 anti-mouse CD16/32 항체( 재료 표 참조)를 분류기 버퍼에서 1:100 v/v로 희석하여 Fc 블록을 준비합니다.
- L-글루타민이 없는 RPMI 1640 배지에 100μg/mL Liberase TM 및 50μg/mL DNase I( 재료 표 참조)을 추가하여 Liberase TM/DNase 분해 용액을 준비합니다( 재료 표 참조).
- 생리식염수(0.9% NaCl)에 10mg/mL 케타민( 재료 표 참조)과 1mg/mL 자일라진( 재료 표 참조)을 첨가하여 케타민/자일라진 혼합물을 준비합니다( 재료 표 참조).
2. 자동화된 조직 dissociator를 통해 폐 조직에서 단세포 현탁액을 생성하기
- 각 마우스에 대해 특수 조직 해리기 튜브( 재료 표 참조)에 얼음처럼 차가운 HEPES 완충액 4mL를 준비하고 얼음 위에 보관합니다.
- 150-200 μL의 케타민/자일라진 혼합물을 복강내 주사하여 마우스를 마취합니다. 100 μL 생리식염수로 희석한 1-3 μg의 형광단 접합 항-마우스 CD45 항체( 재료 표 참조)를 마취된 각 마우스에 정맥 주사합니다. 항체 투여 3분 후 500-600 μL의 케타민/자일라진 혼합물을 복강내 주사하여 마우스를 안락사시킵니다.
- 폐를 절제하고 얼음 위에서 식힌 각각의 조직 해리기 튜브에 넣습니다. 튜브를 자동 조직 분리기에 놓고( 재료 표 참조) 폐 조직에 대한 첫 번째 프로그램(사전 설정 프로그램)을 실행합니다.
- 500 μL의 Liberase 원액과 500 μL의 aminoguanidine 원액을 해리된 폐 조직이 들어있는 각 튜브에 추가합니다. 너트 믹서에서 37 ° C에서 30 분 동안 배양합니다.
- 튜브를 분리기에 다시 놓고 폐 조직에 대한 두 번째 프로그램(사전 설정 프로그램)을 실행합니다.
- 조직 해리기 튜브의 단일 세포 현탁액을 100μm 세포 여과기( 재료 표 참조)를 통해 50mL 원뿔형 튜브에 붓습니다. 조직 해리기 튜브를 5mL의 완전한 EHAA(또는 이에 상응하는 T 세포 배지)로 헹구고 여과기를 통해 50mL 튜브로 통과시킵니다.
- 여과기를 제거하고 완전한 EHAA로 세포 현탁액의 부피를 50mL로 올립니다. 셀 현탁액을 400 x g 에서 4°C에서 5분 동안 원심분리합니다. 약 100μL의 상층액과 세포 펠릿을 남기고 상층액을 조심스럽게 흡입합니다.
- 약 100 μL의 Fc Block 용액을 추가하여 총 부피를 200 μL까지 끌어올리고 펠릿을 재현탁시키기 위해 세게 소용돌이칩니다.
3. 대체 프로토콜: 수동 해리를 통해 폐 조직에서 단세포 현탁액 생성
- 각 마우스에 대해 1.5mL 미세분리 튜브에 1mL의 완전한 EHAA를 준비하고 얼음에 보관합니다.
- 150-200 μL의 케타민/자일라진 혼합물을 복강내 주사하여 마우스를 마취합니다. 100 μL의 생리식염수에 희석된 1-3 μg의 형광단 접합 항-마우스 CD45 항체를 마취된 각 마우스에 정맥 주사합니다. 항체 투여 3분 후 500-600 μL의 케타민/자일라진 혼합물을 복강내 주사하여 마우스를 안락사시킵니다.
- 폐를 절제하고 얼음으로 식힌 각각의 1.5mL 미세분리 튜브에 넣습니다.
- 모든 폐를 채취한 후에는 각 폐를 세포 배지가 없는 새로운 미세분리 튜브로 옮깁니다.
- 미세분리기 튜브 내에서 가위를 사용하여 폐를 작은 조각(~2-3mm 덩어리)으로 자릅니다.
- 각 튜브에 Liberase TM/DNase I 분해 칵테일 1mL를 추가합니다.
- 37°C의 수조에서 30분 동안 배양합니다. 과다 소화를 방지하기 위해 나중에 샘플을 얼음에 되돌려 놓으십시오.
- 50mL 코니컬 튜브 위에 놓인 100μm 세포 여과기 위에 샘플을 붓습니다. 멸균 1mL 주사기에서 플런저의 고무 끝으로 메쉬에 조직을 으깬다.
- 콜드 소터 버퍼로 여과기를 헹구고 튜브에 최종 부피 7mL를 수집합니다. 셀 현탁액을 400 x g 에서 4°C에서 5분 동안 원심분리합니다. 상층액을 조심스럽게 흡인하여 약 100μL의 상층액과 세포 펠릿을 남깁니다.
- 100 μL의 Fc Block 용액을 추가하여 총 부피를 200 μL까지 끌어올리고 펠릿을 재현탁시키기 위해 세게 와류합니다.
4. 마그네틱 비드 농축을 통한 T 세포의 폐 샘플 농축
- 50μL의 항-마우스 CD90.2 마이크로비드를 추가합니다( 재료 표 참조). 4 °C에서 10분 동안 와류하고 배양합니다.
참고: CD90.2는 C57BL/6 마우스에서 T 세포에 의해 발현되는 대립유전자에 해당합니다. 다른 생쥐 균주가 사용되는 경우 대립유전자 유전자형을 확인하십시오. - 그 동안 상자성 셀 분리 컬럼( 재료 표 참조)을 1위치 또는 4위치 셀 분리 자석( 재료 표 참조)에 놓습니다. 각 컬럼 아래에 열린 15mL 코니컬 튜브를 배치하여 흐름을 포착합니다. 3mL의 콜드 소터 버퍼로 컬럼을 프라이밍하여 컬럼이 중력에 의해 아래의 원뿔형 튜브로 배출되도록 합니다.
- 세포가 마이크로비즈와 함께 10분 동안 배양되면 콜드 소터 버퍼를 1mL 부피에 추가하고 컬럼 위에 놓인 100μm 세포 여과기를 통해 옮깁니다. 컬럼 플로우를 모아 컬럼 아래에 배치된 새로운 15mL 코니컬 튜브로 넣습니다.
- 셀 현탁액이 중력에 의해 컬럼을 통해 완전히 배출되면 원래 튜브를 3mL의 콜드 소터 버퍼로 헹구고 메쉬를 통해 컬럼에 적용하여 여과기를 헹구어 컬럼을 세척합니다. 여과기를 제거하십시오.
- 샘플이 다시 컬럼으로 완전히 배출되고 컬럼에서 더 이상 플로우스루가 나오지 않으면 자석에서 컬럼을 제거하고 새 15mL 코니컬 튜브 위에 놓습니다.
- 컬럼에 5mL의 콜드 소터 버퍼를 추가합니다.
- 컬럼 플런저를 한 번의 연속 동작으로 상단으로 밀어 넣고 선별기 버퍼를 컬럼 하단에서 새 튜브로 밀어 넣어 컬럼에 결합된 세포를 즉시 용리합니다.
- 용리된 샘플을 400 x g 에서 4°C에서 5분 동안 원심분리합니다. 약 100μL의 상층액과 세포 펠릿을 남기고 상층액을 조심스럽게 흡입합니다.
- 100 μL의 콜드 소터 버퍼를 추가하여 총 부피를 200 μL까지 끌어올리고 펠릿을 재현탁시키기 위해 세게 와류합니다.
- 원하는 경우 결합되지 않은 세포 분획을 포함하는 플로우 스루 샘플을 분석합니다.
5. 펩타이드로 항원 특이적 T 세포 염색 : MHC tetramers
- 1 μL의 10 μM Dasatinib ( 재료 표 참조)를 각 샘플, 와류에 추가하고 RT에서 5 분 동안 배양합니다.
- PE- 또는 APC-복합 펩타이드:MHC 테트라머를 최종 농도 10nM(또는 주어진 테트라머에 대해 경험적으로 최적화된 농도)에 추가합니다.
- RT에서 1시간 동안 어둠 속에서 소용돌이치고 배양합니다(또는 경험적으로 최적화된 시간 및 온도).
6. 유세포 분석을 통한 tetramer-labeled T cell 분석
- 샘플이 펩타이드:MHC 테트라머로 염색되는 동안 세포의 표면 마커를 염색하기 위해 항체의 마스터 믹스를 준비합니다(표 1).
참고: 정맥 주사로 투여되는 CD45 항체 또는 테트라머와 충돌하는 형광단을 피하십시오. - tetramer-staining을 위한 배양 기간이 15분 남았을 때 표면 항체 마스터 믹스를 1:100(또는 경험적으로 최적화된 농도)으로 각 샘플에 추가합니다.
- 1시간의 배양 기간의 나머지 기간 동안 RT에서 어두운 곳에서 계속 배양합니다.
- 50,000개의 유세포 분석 카운트 비드를 추가하고( 재료 표 참조) 약 5mL의 최종 부피에 콜드 분류기 완충액을 추가합니다. 염색된 샘플을 400 x g 에서 4°C에서 5분 동안 원심분리합니다. 약 100μL의 상층액과 세포/비드 펠릿을 남기고 상층액을 조심스럽게 흡입합니다.
- 추가로 200μL의 분류기 완충액으로 시료를 재현탁하고 시료를 5mL 형광 활성 세포 분류(FACS) 튜브로 옮깁니다.
- 유세포분석기에서 시료를 분석합니다. 최대 2,500,000개의 총 이벤트까지 가능한 한 많은 셀을 수집합니다. 최소 20,000개의 카운트 비드 이벤트가 수집되었는지 확인합니다. 획득 속도를 초당 5,000개 이벤트 이하로 유지합니다.
- 모든 데이터를 FCS 파일로 저장합니다.
| 플루오로크롬 | 항체 |
| 뷰브395 | CD90.2 시리즈 |
| 퍼시픽 블루 | CD45 (i.v. injection에 의해 이전에 추가됨) |
| 퍼시픽 오렌지 | CD8 (CD8) |
| 브릴리언트 바이올렛 785 | CD4 (CD4) |
| (주)핏 | CD3 (CD3) |
| 재질 보기 PerCP-Cy5.5 | 덤프(B220, CD11b, CD11c, F4/80) |
| 체육 | pMHC tetramer 또는 표현형 마커 |
| PE-사이7 | 표현형 마커(예: CD44, PD-1, CD69 등) |
| 증권 시세 표시기 | pMHC tetramer 또는 표현형 마커 |
| 알렉사플루어 700 | 표현형 마커(예: CD44, PD-1, CD69 등) |
| APC-사이7 | 살아있는/죽은 얼룩 |
표 1: 샘플 염색 매트릭스. 항원 특이적 T 세포를 식별하고 특성화하는 데 사용되는 형광단 접합 유세포 분석 항체의 전형적인 패널입니다.
7. 데이터 분석
- 적절한 유세포 분석 소프트웨어를 사용하여 FCS 데이터 파일을 분석합니다.
- CD4 또는 CD8 양성인 1) 림프구 유사, 2) 단일, 3) 살아 있는, 4) 혈관 외, 5) 덤프 음성, 6) CD90.2 양성 이벤트를 식별하기 위해 일련의 연속 포함 게이트를 설정합니다(그림 2).
- 이러한 집단 내에서 tetramer-positive T cell을 식별합니다.
- 샘플 실행 중에 수집된 비드 수에 대해 추가된 비드(50,000)의 비율을 계산하고 값에 수집된 총 테트라머 양성 세포 수를 곱하여 절대 테트라머 양성 세포 수를 결정합니다.
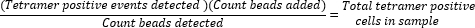
결과
그림 2 는 펩타이드:MHC class II tetramers를 사용하여 폐에서 희귀 항원 특이적 CD4+ T 세포를 식별하는 데 사용되는 대표적인 gating 전략을 보여줍니다. 펩타이드:MHC class I tetramers가 있는 항원 특이적 CD8+ T 세포에도 동일한 과정을 적용할 수 있습니다(데이터는 표시되지 않음).
폐에는 비림프성 세포의 수가 많기 때문에 tetramer에 의한 희귀 항원...
토론
폐에서 채취한 항원 특이적 T 세포의 이전 특성 분석은 비강 내 면역 또는 감염과 같은 급성 프라이밍 사건 후에 증식하는 항원 특이적 T 세포의 강력한 수로부터 이익을 얻었습니다 20,21,22. 그러나, 자기 항원 특이적 T 세포 또는 조직 상주 기억 T 세포와 같은 폐 내의 더 드문 T 세포 집단은 관심 T 세포에 대한 어떤 형태의 샘플 ...
공개
저자는 공개할 충돌이 없습니다.
감사의 말
조직 가공 및 테트라머 생산에 대한 기술 지원을 제공한 L. Kuhn에게 감사드립니다. 이 연구는 미국 국립보건원(National Institutes of Health, R01 AI107020 및 P0 AI165072 1은 J.J.M., T32 AI007512는 D.S.S.), 매사추세츠 병원체 준비 컨소시엄(Massachusetts Consortium on Pathogen Readiness, J.J.M) 및 매사추세츠 종합병원 연구 집행 위원회(Massachusetts General Hospital Executive Committee on Research)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 mm cell strainer | Fisher Scientific | 22-363-549 | |
| 10x PBS without Ca++ or Mg++ | Corning | 46-013-CM | |
| 1x PBS without Ca++ or Mg++ | Corning | 21-031-CV | |
| AccuCheck Counting Beads | Invitrogen | PCB100 | |
| Aminoguanidine Hemisulfate Salt | Sigma-Aldrich | A7009 | |
| CD90.2 microbeads, mouse | Miltenyi | 130-121-278 | |
| Cell separation magnet (MidiMACS Separator) | Miltenyi | 130-042-302 | Holds single LS column |
| Cell separation magnet (QuadroMACS Separator) | Miltenyi | 130-090-976 | Holds 4 LS columns |
| Dasatinib | Sigma-Aldrich | CDS023389 | |
| DNase I | Roche | 10104159001 | |
| Eagle’s Ham’s Amino Acids medium | Sigma-Aldrich | C5572 | |
| gentleMACS | Miltenyi | 130-093-235 | Automated tissue dissociator |
| gentleMACS C Tubes | Miltenyi | 130-093-237 | Automated tissue dissociator tubes |
| Hank's Balanced Salt Solution with Ca++ or Mg++ | Corning | 21-020-CM | |
| HEPES | Gibco | 15630080 | |
| Ketamine | Vedco | NDC 50989-996-06 | |
| Liberase TM | Roche | 5401119001 | |
| Pacific Blue anti-mouse CD45 antibody (Clone: 30-F11) | Biolegend | 103126 | |
| Paramagnetic cell separation columns (LS Columns) | Miltenyi | 130-042-401 | Comes with plunger |
| Purified anti mouse CD16/32 antibody (Clone: 93) | Biolegend | 101302 | |
| RPMI 1640 medium without L-glutamine | Corning | 15-040-CM | |
| Sodium Chloride 0.9% (Normal Saline) | Cytiva | Z1376 | |
| Xylazine | Pivetal | NDC 466066-750-02 |
참고문헌
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235 (2023).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Crawford, F., Kozono, H., White, J., Marrack, P., Kappler, J. Detection of antigen-specific T cells with multivalent soluble class II MHC covalent peptide complexes. Immunity. 8 (6), 675-682 (1998).
- Nepom, G. T., et al. HLA class II tetramers: tools for direct analysis of antigen-specific CD4+ T cells. Arthritis Rheum. 46 (1), 5-12 (2002).
- Davis, M. M., Altman, J. D., Newell, E. W. Interrogating the repertoire: broadening the scope of peptide-MHC multimer analysis. Nat Rev Immunol. 11 (8), 551-558 (2011).
- Moon, J. J., et al. Tracking epitope-specific T cells. Nat Protoc. 4 (4), 565-581 (2009).
- Jenkins, M. K., Moon, J. J. The role of naive T cell precursor frequency and recruitment in dictating immune response magnitude. J Immunol. 188 (9), 4135-4140 (2012).
- Moon, J. J., et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Obar, J. J., Khanna, K. M., Lefrancois, L. Endogenous naive CD8+ T cell precursor frequency regulates primary and memory responses to infection. Immunity. 28 (6), 859-869 (2008).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. J Immunol. 181 (3), 2124-2133 (2008).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J Vis Exp. (68), e4420 (2012).
- Szabo, P. A., Miron, M., Farber, D. L. Location, location, location: Tissue resident memory T cells in mice and humans. Sci Immunol. 4 (34), 9673 (2019).
- Poon, M. M. L., et al. Tissue adaptation and clonal segregation of human memory T cells in barrier sites. Nat Immunol. 24 (2), 309-319 (2023).
- Zheng, M. Z. M., Wakim, L. M. Tissue resident memory T cells in the respiratory tract. Mucosal Immunol. 15 (3), 379-388 (2022).
- Legoux, F. P., et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T Cells rather than deletion. Immunity. 43 (5), 896-908 (2015).
- Shin, D. S., et al. Lung injury induces a polarized immune response by self-antigen-specific CD4(+) Foxp3(+) regulatory T cells. Cell Rep. 42 (8), 112839 (2023).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nat Protoc. 9 (1), 209-222 (2014).
- Vig, M., et al. Inducible nitric oxide synthase in T cells regulates T cell death and immune memory. J Clin Invest. 113 (12), 1734-1742 (2004).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. J Immunol Methods. 340 (1), 11-24 (2009).
- Hogan, R. J., et al. Protection from respiratory virus infections can be mediated by antigen-specific CD4(+) T cells that persist in the lungs. J Exp Med. 193 (8), 981-986 (2001).
- Hogan, R. J., et al. Activated antigen-specific CD8+ T cells persist in the lungs following recovery from respiratory virus infections. J Immunol. 166 (3), 1813-1822 (2001).
- Zhao, J., et al. Airway memory CD4(+) T cells mediate protective immunity against emerging respiratory coronaviruses. Immunity. 44 (6), 1379-1391 (2016).
- Hondowicz, B. D., et al. Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma. Immunity. 44 (1), 155-166 (2016).
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. J Vis Exp. (29), e1266 (2009).
- Faustino, L. D., et al. Interleukin-33 activates regulatory T cells to suppress innate gammadelta T cell responses in the lung. Nat Immunol. 21 (11), 1371-1383 (2020).
- Atif, S. M., Gibbings, S. L., Jakubzick, C. V. Isolation and identification of interstitial macrophages from the lungs using different digestion enzymes and staining strategies. Methods Mol Biol. 1784, 69-76 (2018).
- Pape, K. A., Taylor, J. J., Maul, R. W., Gearhart, P. J., Jenkins, M. K. Different B cell populations mediate early and late memory during an endogenous immune response. Science. 331 (6021), 1203-1207 (2011).
- Naeher, D., et al. A constant affinity threshold for T cell tolerance. J Exp Med. 204 (11), 2553-2559 (2007).
- Moon, J. J., et al. Quantitative impact of thymic selection on Foxp3+ and Foxp3- subsets of self-peptide/MHC class II-specific CD4+ T cells. Proc Natl Acad Sci U S A. 108 (35), 14602-14607 (2011).
- Koehli, S., Naeher, D., Galati-Fournier, V., Zehn, D., Palmer, E. Optimal T-cell receptor affinity for inducing autoimmunity. Proc Natl Acad Sci U S A. 111 (48), 17248-17253 (2014).
- Zhang, Z., Legoux, F. P., Vaughan, S. W., Moon, J. J. Opposing peripheral fates of tissue-restricted self antigen-specific conventional and regulatory CD4(+) T cells. Eur J Immunol. 50 (1), 63-72 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유