Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Идентификация редких антиген-специфических Т-клеток из легких мышей с помощью пептид:Тетрамеры основного комплекса гистосовместимости
В этой статье
Резюме
Мы предоставляем подробный протокол для выделения и идентификации популяций редких антиген-специфических Т-клеток в легких мышей с помощью обогащения Т-клеток на основе магнитных гранул и тетрамеров комплекса пептида:главного комплекса гистосовместимости (MHC).
Аннотация
Идентификация и характеристика антиген-специфических Т-клеток в период здоровья и болезни остается ключом к улучшению нашего понимания иммунной патофизиологии. Технические проблемы отслеживания антиген-специфических популяций Т-клеток в эндогенном репертуаре Т-клеток значительно усложнились благодаря разработке реагентов пептида: тетрамера MHC. Эти флуоресцентно меченные растворимые мультимеры молекул MHC класса I или II, комплексованных с антигенными пептидными эпитопами, связываются непосредственно с Т-клетками с соответствующей специфичностью рецептора Т-клеток (TCR) и, следовательно, могут идентифицировать антиген-специфические популяции Т-клеток в их нативном состоянии без необходимости функционального ответа, индуцированного ex vivo стимуляция. Для чрезвычайно редких популяций Т-клетки, связанные с тетрамером, могут быть обогащены магнитами для повышения чувствительности и надежности обнаружения.
По мере углубления исследований тканевого резидентного Т-клеточного иммунитета существует насущная потребность в идентификации антиген-специфических Т-клеток, которые перемещаются и находятся в нелимфоидных тканях. В этом протоколе мы представляем подробный набор инструкций по выделению и характеристике антиген-специфических Т-клеток, присутствующих в легких мыши. Это включает в себя выделение Т-клеток из переваренной легочной ткани с последующим этапом общего магнитного обогащения Т-клеток и окрашивание тетрамерами для анализа и сортировки проточной цитометрии. Этапы, описанные в этом протоколе, используют общие методы и легкодоступные реагенты, что делает его доступным практически для любого исследователя, занимающегося иммунологией Т-клеток мышей, и хорошо адаптируется для различных последующих анализов любой популяции низкочастотных антиген-специфических Т-клеток, находящихся в легких.
Введение
В основе адаптивной иммунной системы лежит способность Т-клеток распознавать и реагировать на определенный антиген. Когда и где Т-клетка реагирует на родственный ей антиген, определяет баланс инфекции и аутоиммунитета, гомеостаза и рака, здоровья и болезни1. Из этого следует, что изучение Т-клеток в конкретном контексте иммунитета должно быть сосредоточено на клетках, специфичных к соответствующему антигену, представляющему интерес. К числу технологических достижений, которые значительно расширили возможности по освидетельствованию антиген-специфических популяций Т-клеток, относятся флуоресцентно меченые растворимые мультимеры (обычно тетрамеры) молекул основного комплекса гистосовместимости (MHC) класса I или класса II, интегрированные в антигенные пептидные эпитопы, более известные как «пептид: тетрамеры MHC»2,3,4,5 . Представляя собой естественные лиганды Т-клеточных антигенных рецепторов (TCR), тетрамеры пептида:MHC класса I и класса II обеспечивают средства для прямой идентификации антиген-специфических CD8+ и CD4+ Т-клеток соответственно в эндогенном репертуаре Т-клеток в иммунной системе без необходимости ответа на стимуляцию антигена в анализе. Тетрамеры представляют собой более элегантный подход к изучению антиген-специфичных Т-клеток, чем модели адаптивного переноса трансгенных Т-клеток TCR6, и все чаще используются для идентификации чужеродных и собственных антиген-специфических популяций Т-клеток как в экспериментальных моделях мышей, так и в моделях заболеваний человека 4,5.
В то время как тетрамеры могут легко идентифицировать высокочастотные популяции Т-клеток, которые разрослись в ответ на стимуляцию антигена, их использование для наивных, самоантиген-специфичных Т-клеток или Т-клеток памяти ограничено очень низкими частотами этихпопуляций. Наша группа и другие разработали и популяризировали стратегии магнитного обогащения на основе тетрамеров, которые увеличивают чувствительность обнаружения, что позволяет изучать эти клеточные популяции в лимфоидных тканях мышей 8,9,10,11.
Появление тканевых резидентных Т-клеток в этой области поставило повышенный акцент на разработку новых способов исследования Т-клеток в нелимфоидном пространстве. Как и многие другие поверхности слизистых оболочек, Т-клетки в легких сталкиваются с рядом собственных и чужеродных антигенов, полученных из эпителия хозяина, комменсальных и инфекционных микробов, а также объектов окружающей среды, включая аллергены. Транскрипционный анализ Т-клеток, полученных из нелимфоидной ткани (НЛТ), демонстрирует фенотип, подобный памяти, который несет уникальную тканеспецифическую судьбу и функцию, часто направленную на транспортировку и тканевый гомеостаз12. Более того, тканевые резидентные Т-клетки памяти (Trms), как правило, более клонально ограничены, чем те, которые находятсяв циркуляции. Определение того, как и почему антигены стимулируют проживание Т-клеток в NLT, имеет решающее значение для понимания того, как иммунная система защищает от инфекции, поддерживает гомеостаз тканей и, иногда, переходит в аутоиммунную систему. Тем не менее, по-видимому, наблюдается больший истирание среди тканевых резидентных Т-клеток легких по сравнению с другими NLT14. Соответственно, возможность идентификации и характеристики эндогенных Т-клеток легкого с заданной антиген-специфичностью ограничена присущей им редкостью.
Комбинируя использование методов обогащения клеток на основе магнитных шариков и окрашивание пептидом:тетрамером MHC, нам удалось обнаружить расширенные, но редкие аутоантиген-специфические Т-клетки в легких мышей15,16. В этой статье мы представляем подробное описание протокола, который мы оптимизировали для надежной изоляции и характеристики любой популяции редких антиген-специфических Т-клеток, присутствующих в легких мышей (Рисунок 1). Этот протокол включает в себя стадию окрашивания антителами in vivo для отличия резидентных в ткани Т-клеток от сосудистых Т-клеток17, за которыми следуют два различных метода обработки легочной ткани для учета имеющихся ресурсов. Затем следует этап общего магнитного обогащения Т-клеток, окрашивание тетрамером и анализ с помощью проточной цитометрии. Жизнеспособность клеток и окрашивание тетрамерами дополнительно усиливаются в этом протоколе за счет добавления аминогуанидина, который блокирует индуцируемый апоптоз Т-клеток, индуцируемый активацией оксида азота (iNOS)18, и дазатиниба, который ограничивает подавление TCR19. Этапы, описанные в этом протоколе, используют общие методы и легкодоступные реагенты, что делает его доступным практически для любого исследователя, занимающегося иммунологией Т-клеток мышей, и легко адаптируется для различных последующих анализов. Несмотря на то, что наивные Т-клетки вряд ли будут обнаружены в легких, мы считаем, что этот протокол будет особенно полезен для изучения собственных антиген-специфических Т-клеток и Trm в легких.
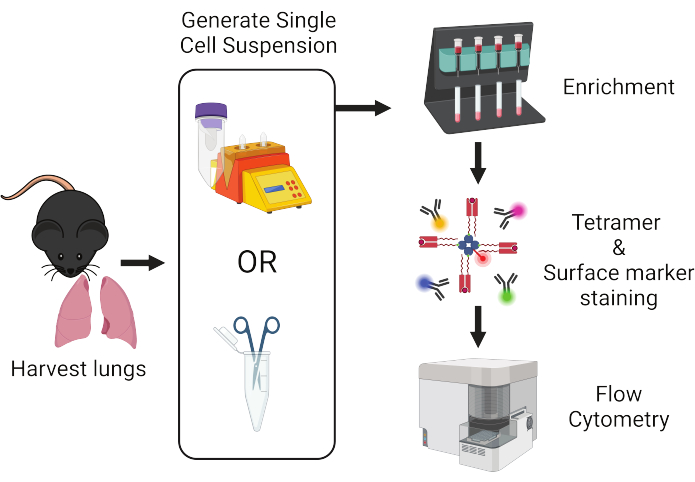
Рисунок 1: Обзор рабочего процесса протокола. Легкие собирают у мышей и диссоциируют на отдельные клетки. Образцы затем обогащают для Т-клеток перед окрашиванием тетрамисами пептида:МНС и флуоресцентно меченными антителами для проточного цитометрического анализа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
Процедуры, описанные в этом протоколе, одобрены и разработаны в соответствии с руководящими принципами, изложенными Комитетом по институциональному уходу за животными и их использованию (IACUC) Массачусетской больницы общего профиля, программой по содержанию животных, аккредитованной Американской ассоциацией по аккредитации ухода за лабораторными животными (AAALAC). Эксперименты проводились на 8-12-недельных самцах и самках мышей с генетическим фоном C57BL/6, выращенных и содержащихся в животноводческом хозяйстве MGH в специфических условиях, свободных от патогенов.
1. Приготовление исходных растворов
- Приготовьте буфер HEPES, растворив 10 мМ HEPES, 5 мМ KCl, 1,8 мМ CaCl2, 150 мМ NaCl и 1 мМ MgCl2, и доведите до pH 7,4.
- Приготовьте 10-кратный стоковый раствор либеразы, растворив 700 мкг/мл термолизиновой среды (ТМ) либеразы (см. Таблицу материалов) в сбалансированном солевом растворе Хэнка с Ca++ и Mg++ (см. Таблицу материалов).
- Приготовьте 10-кратный стоковый раствор аминогуанидина, растворив 100 мМ соли аминогуанидина гемисульфата (см. Таблицу материалов) в сбалансированном солевом растворе Хэнка с Ca++ и Mg++ (см. Таблицу материалов).
- Приготовьте полную среду Eagle's Ham's Aminoacids (EHAA), смешав среду EHAA (см. Таблицу материалов) с 10% фетальной бычьей сывороткой (FBS), 100 Ед/мл пенициллина/стрептомицина, 50 мкг/мл гентамицина, 2 мМ L-глутамина и 55 мкМ 2-меркаптоэтанола.
ПРИМЕЧАНИЕ: Также можно использовать другие распространенные среды для Т-клеток, такие как RPMI или DMEM. - Приготовьте буфер для сортировщика, смешав 1x PBS с 2% FBS и 0,05% азидом натрия.
- Приготовьте Fc-блок, разбавив очищенное антитело против мыши CD16/32 (см. Таблицу материалов) при 1:100 v/v в буфере сортировщика.
- Приготовьте раствор для разложения Либераза ТМ/ДНКаза путем добавления 100 мкг/мл Либеразы ТМ и 50 мкг/мл ДНКазы I (см. Таблицу материалов) в среду RPMI 1640 без L-глютамина (см. Таблицу материалов).
- Приготовьте смесь кетамина/ксилазина, добавив 10 мг/мл кетамина (см. Таблицу материалов) и 1 мг/мл ксилазина (см. Таблицу материалов) в обычный физиологический раствор (0,9% NaCl) (см. Таблицу материалов).
2. Генерация суспензии одиночных клеток из легочной ткани с помощью автоматического диссоциатора тканей
- Для каждой мыши приготовьте 4 мл ледяного буфера HEPES в специализированной пробирке для диссоциации тканей (см. Таблицу материалов) и держите его на льду.
- Обезболивание мышей путем внутрибрюшинного введения 150-200 мкл смеси кетамина/ксилазина. Введите 1-3 мкг флуорофор-конъюгированного антитела против мыши CD45 (см. Таблицу материалов), разведенного в 100 мкл физиологического раствора, внутривенно каждой мыши, находящейся под наркозом. Усыпить мышь через 3 минуты после введения антител с внутрибрюшинным введением 500-600 мкл смеси кетамина/ксилазина.
- Резецируйте легкие и поместите их в соответствующие тканевые диссоциаторные трубки, охлажденные на льду. Поместите трубки на автоматический тканевый диссоциатор (см. Таблицу материалов) и запустите первую программу (предустановленную программу) для легочной ткани.
- Добавьте 500 мкл стокового раствора либеразы и 500 мкл стокового раствора аминогуанидина в каждую пробирку, содержащую диссоциированную легочную ткань. Выдерживать на смесителе в течение 30 минут при температуре 37 °C.
- Поместите трубки обратно на диссоциатор и запустите вторую программу (предустановленную программу) для легочной ткани.
- Вылейте одноклеточную суспензию из пробирки для диссоциатора тканей через клеточный фильтр 100 мкм (см. Таблицу материалов) в коническую пробирку объемом 50 мл. Промойте пробирку для диссоциатора тканей 5 мл полной EHAA (или любой эквивалентной Т-клеточной среды) и пропустите через ситечко в пробирку объемом 50 мл.
- Снимите ситечко и увеличьте объем клеточной суспензии до 50 мл с помощью полного EHAA. Центрифугируйте клеточную суспензию при 400 x g в течение 5 мин при 4 °C. Осторожно отсасывайте надосадочную жидкость, оставляя после себя примерно 100 мкл надосадочной жидкости и клеточной гранулы.
- Добавьте примерно 100 μL раствора Fc Block, чтобы довести общий объем до 200 μL и энергично завихрите, чтобы повторно суспендировать гранулу.
3. Альтернативный протокол: получение суспензии одиночных клеток из легочной ткани путем ручной диссоциации
- Для каждой мыши приготовьте 1 мл полной EHAA в микрофуге объемом 1,5 мл и держите на льду.
- Обезболивание мышей путем внутрибрюшинного введения 150-200 мкл смеси кетамина/ксилазина. Введите 1-3 мкг флуорофор-конъюгированного антитела против мыши CD45, разведенного в 100 мкл нормального физиологического раствора, внутривенно каждой мыши, находящейся под наркозом. Усыпить мышь через 3 минуты после введения антител с внутрибрюшинным введением 500-600 мкл смеси кетамина/ксилазина.
- Резецируйте легкие и поместите их в соответствующую микрофужную пробирку объемом 1,5 мл, охлажденную на льду.
- После того, как все легкие будут собраны, перенесите каждое легкое в свежую микрофугальную пробирку без какой-либо клеточной среды.
- Разрежьте легкие на мелкие фрагменты (кусочки ~2-3 мм) с помощью ножниц внутри микрофуговой пробирки.
- Добавьте в каждую тюбик по 1 мл коктейля для пищеварения Liberase TM/DNase I.
- Выдерживать 30 минут при температуре 37 °C на водяной бане. После этого верните образцы на лед, чтобы предотвратить переваривание.
- Налейте образец через сетчатое фильтр размером 100 мкм, помещенное поверх конической пробирки объемом 50 мл. Разомните ткань о сетку резиновым концом поршня из стерильного шприца объемом 1 мл.
- Промойте сетчатое фильтр с помощью буфера холодного сортировщика, собрав итоговый объем 7 мл в пробирке. Центрифугируйте клеточную суспензию при 400 x g в течение 5 мин при 4 °C. Осторожно отсасывайте надосадочную жидкость, оставляя примерно 100 мкл надосадочной жидкости и клеточной гранулы.
- Добавьте 100 μL раствора Fc Block, чтобы довести общий объем до 200 μL и энергично завихрите, чтобы ресуспендировать гранулу.
4. Обогащение образца легких на Т-клетки с помощью магнитных шариков
- Добавьте 50 мкл микрогранул CD90.2, противомышиных (см. Таблицу материалов). Вдохните и инкубируйте в течение 10 минут при 4 °C.
Примечание: CD90.2 соответствует аллелю, экспрессируемому Т-клетками у мышей C57BL/6. Проверьте аллельный генотип, если используются другие линии мышей. - Тем временем поместите парамагнитную разделительную колонку (см. Таблицу материалов) на одно- или четырехпозиционный разделительный магнит (см. Таблицу материалов). Поместите открытую коническую трубку объемом 15 мл под каждую колонну, чтобы улавливать поток. Заправьте колонну 3 мл буфера для холодной сортировки, чтобы колонна могла стекать под действием силы тяжести в коническую трубу внизу.
- После того, как клетки инкубируются с микрогранулами в течение 10 минут, добавьте холодный сортировочный буфер объемом 1 мл и пропустите через клеточное сетчатое фильтр размером 100 мкм, расположенное на вершине колонки. Соберите поток из колонны в свежую коническую трубку объемом 15 мл, расположенную ниже колонны.
- После того, как клеточная суспензия полностью прососалась через колонну под действием силы тяжести, промойте колонку, промыв исходную пробирку дополнительными 3 мл холодного буфера сортировщика и нанеся его на колонну через сетку, тем самым промыв сетчатое фильтр. Снимите ситечко.
- Когда образец снова полностью стекает в колонку и больше не будет протекать из колонки, снимите колонку с магнита и поместите ее на свежую коническую пробирку объемом 15 мл.
- Добавьте в колонку 5 мл буфера холодного сортировщика.
- Немедленно элюируйте ячейки, связанные с колонной, одним непрерывным движением вдавливая поршень колонны в верхнюю часть и выталкивая буфер сортировщика из нижней части колонны в новую трубку.
- Центрифугируйте элюированные образцы при давлении 400 x g в течение 5 мин при 4 °C. Осторожно отсасывайте надосадочную жидкость, оставляя после себя примерно 100 мкл надосадочной жидкости и клеточной гранулы.
- Добавьте 100 μL буфера для холодной сортировки, чтобы довести общий объем до 200 μL и энергично завихрите, чтобы повторно суспендировать гранулу.
- При необходимости проанализируйте проточный образец, содержащий несвязанную фракцию клетки.
5. Окрашивание антиген-специфических Т-клеток тетрамерами пептид:МНС
- Добавьте 1 мкл 10 мкМ дазатиниба (см. Таблицу материалов) в каждый образец, вихрь и инкубируйте в течение 5 мин при RT.
- Добавьте PE- или APC-конъюгированный пептид:тетрамер MHC до конечной концентрации 10 нМ (или эмпирически оптимизированной концентрации для данного тетрамера).
- Сделайте вихрь и инкубируйте в темноте в течение 1 ч при RT (или эмпирически оптимизированном времени и температуре).
6. Анализ меченных тетрамером Т-клеток с помощью проточной цитометрии
- В то время как образец окрашивается тетрамеров пептида:МНС, готовят мастер-смесь антител для окрашивания поверхностных маркеров клеток (табл. 1).
Примечание: Избегайте флуорофонов, которые конфликтуют с внутривенно вводимыми антителами к CD45 или тетрамерами. - За 15 минут до окончания инкубационного периода для окрашивания тетрамером добавьте поверхностную смесь антител в соотношении 1:100 (или эмпирически оптимизированной концентрации) к каждому образцу.
- Продолжайте инкубацию в темноте в RT в течение оставшейся части 1-часового инкубационного периода.
- Добавьте 50 000 шариков проточной цитометрии (см. Таблицу материалов) и добавьте буфер холодного сортировщика до конечного объема около 5 мл. Центрифугируйте окрашенный образец при 400 x g в течение 5 минут при 4 °C. Осторожно отсасывайте надосадочную жидкость, оставляя после себя около 100 μл надосадочной жидкости и клеточных/гранулированных гранул.
- Повторно суспендируйте образец с помощью дополнительного буфера для сортировки объемом 200 мкл и перенесите образец в пробирку для сортировки флуоресцентных активированных клеток (FACS) объемом 5 мл.
- Проанализируйте образец на проточном цитометре. Соберите как можно больше ячеек, максимум до 2 500 000 событий. Убедитесь, что собрано не менее 20 000 событий с количеством бусин. Поддерживайте скорость привлечения на уровне 5 000 событий в секунду или ниже.
- Сохраните все данные в виде файлов FCS.
| Флуорохром | Антитело |
| БУВ395 | КД90.2 |
| Тихоокеанский синий | CD45 (добавлен ранее при внутривенном введении) |
| Тихоокеанский апельсин | СД8 |
| Бриллиантовый фиолетовый 785 | СД4 |
| ФИТК | CD3 |
| ПерХП-Cy5.5 | Дамп (B220, CD11b, CD11c, F4/80) |
| ПЭ | Тетрамер pMHC или фенотипический маркер |
| ПЭ-CY7 | Фенотипический маркер (например, CD44, PD-1, CD69 и т.д.) |
| БТР | Тетрамер pMHC или фенотипический маркер |
| АлексаФлюор 700 | Фенотипический маркер (например, CD44, PD-1, CD69 и т.д.) |
| БТР-CY7 | Живое/мертвое пятно |
Таблица 1: Образец матрицы окрашивания. Типичная панель антител флуорофор-конъюгированной проточной цитометрии, используемая для идентификации и характеристики антиген-специфических Т-клеток.
7. Анализ данных
- Проанализируйте файлы данных FCS с помощью соответствующего программного обеспечения для проточной цитометрии.
- Установите последовательность последовательных ворот включения, чтобы идентифицировать 1) лимфоцитоподобные, 2) одиночные, 3) живые, 4) экстраваскулярные, 5) дамп-отрицательные и 6) CD90.2-положительные события, которые являются либо CD4, либо CD8-положительными (рис. 2).
- Определите тетрамер-положительные Т-клетки в этих популяциях.
- Определите абсолютное количество тетрамеров-положительных клеток, рассчитав отношение добавленных гранул (50 000) к количеству гранул, собранных во время выборки, и умножив это значение на общее количество собранных тетрамеров-положительных клеток.
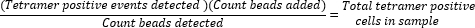
Результаты
На рисунке 2 показана репрезентативная стратегия гейтирования, используемая при идентификации редких антиген-специфичных CD4+ Т-клеток в легких с тетрамеров класса II пептид:МНС. Тот же процесс может быть применен к антиген-специфичным CD8+ Т-клеткам с тетрамеро...
Обсуждение
Предыдущая характеристика антиген-специфических Т-клеток из легких выиграла от значительного количества антиген-специфических Т-клеток, которые расширяются после острого прайминг-события, такого как интраназальная иммунизация или инфекция 20,21,22.
Раскрытие информации
У авторов нет никаких противоречий для раскрытия.
Благодарности
Мы благодарим Л. Куна за техническую помощь в обработке тканей и производстве тетрамеров. Эта работа финансировалась Национальными институтами здравоохранения (R01 AI107020 и P01 AI165072 к J.J.M., T32 AI007512 к D.S.S.), Массачусетским консорциумом по готовности к патогенам (J.J.M) и Исполнительным комитетом по исследованиям Массачусетской больницы общего профиля (J.J.M.).
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm cell strainer | Fisher Scientific | 22-363-549 | |
| 10x PBS without Ca++ or Mg++ | Corning | 46-013-CM | |
| 1x PBS without Ca++ or Mg++ | Corning | 21-031-CV | |
| AccuCheck Counting Beads | Invitrogen | PCB100 | |
| Aminoguanidine Hemisulfate Salt | Sigma-Aldrich | A7009 | |
| CD90.2 microbeads, mouse | Miltenyi | 130-121-278 | |
| Cell separation magnet (MidiMACS Separator) | Miltenyi | 130-042-302 | Holds single LS column |
| Cell separation magnet (QuadroMACS Separator) | Miltenyi | 130-090-976 | Holds 4 LS columns |
| Dasatinib | Sigma-Aldrich | CDS023389 | |
| DNase I | Roche | 10104159001 | |
| Eagle’s Ham’s Amino Acids medium | Sigma-Aldrich | C5572 | |
| gentleMACS | Miltenyi | 130-093-235 | Automated tissue dissociator |
| gentleMACS C Tubes | Miltenyi | 130-093-237 | Automated tissue dissociator tubes |
| Hank's Balanced Salt Solution with Ca++ or Mg++ | Corning | 21-020-CM | |
| HEPES | Gibco | 15630080 | |
| Ketamine | Vedco | NDC 50989-996-06 | |
| Liberase TM | Roche | 5401119001 | |
| Pacific Blue anti-mouse CD45 antibody (Clone: 30-F11) | Biolegend | 103126 | |
| Paramagnetic cell separation columns (LS Columns) | Miltenyi | 130-042-401 | Comes with plunger |
| Purified anti mouse CD16/32 antibody (Clone: 93) | Biolegend | 101302 | |
| RPMI 1640 medium without L-glutamine | Corning | 15-040-CM | |
| Sodium Chloride 0.9% (Normal Saline) | Cytiva | Z1376 | |
| Xylazine | Pivetal | NDC 466066-750-02 |
Ссылки
- Sun, L., Su, Y., Jiao, A., Wang, X., Zhang, B. T cells in health and disease. Signal Transduct Target Ther. 8 (1), 235 (2023).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
- Crawford, F., Kozono, H., White, J., Marrack, P., Kappler, J. Detection of antigen-specific T cells with multivalent soluble class II MHC covalent peptide complexes. Immunity. 8 (6), 675-682 (1998).
- Nepom, G. T., et al. HLA class II tetramers: tools for direct analysis of antigen-specific CD4+ T cells. Arthritis Rheum. 46 (1), 5-12 (2002).
- Davis, M. M., Altman, J. D., Newell, E. W. Interrogating the repertoire: broadening the scope of peptide-MHC multimer analysis. Nat Rev Immunol. 11 (8), 551-558 (2011).
- Moon, J. J., et al. Tracking epitope-specific T cells. Nat Protoc. 4 (4), 565-581 (2009).
- Jenkins, M. K., Moon, J. J. The role of naive T cell precursor frequency and recruitment in dictating immune response magnitude. J Immunol. 188 (9), 4135-4140 (2012).
- Moon, J. J., et al. Naive CD4(+) T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude. Immunity. 27 (2), 203-213 (2007).
- Obar, J. J., Khanna, K. M., Lefrancois, L. Endogenous naive CD8+ T cell precursor frequency regulates primary and memory responses to infection. Immunity. 28 (6), 859-869 (2008).
- Kotturi, M. F., et al. Naive precursor frequencies and MHC binding rather than the degree of epitope diversity shape CD8+ T cell immunodominance. J Immunol. 181 (3), 2124-2133 (2008).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J Vis Exp. (68), e4420 (2012).
- Szabo, P. A., Miron, M., Farber, D. L. Location, location, location: Tissue resident memory T cells in mice and humans. Sci Immunol. 4 (34), 9673 (2019).
- Poon, M. M. L., et al. Tissue adaptation and clonal segregation of human memory T cells in barrier sites. Nat Immunol. 24 (2), 309-319 (2023).
- Zheng, M. Z. M., Wakim, L. M. Tissue resident memory T cells in the respiratory tract. Mucosal Immunol. 15 (3), 379-388 (2022).
- Legoux, F. P., et al. CD4+ T cell tolerance to tissue-restricted self antigens is mediated by antigen-specific regulatory T Cells rather than deletion. Immunity. 43 (5), 896-908 (2015).
- Shin, D. S., et al. Lung injury induces a polarized immune response by self-antigen-specific CD4(+) Foxp3(+) regulatory T cells. Cell Rep. 42 (8), 112839 (2023).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nat Protoc. 9 (1), 209-222 (2014).
- Vig, M., et al. Inducible nitric oxide synthase in T cells regulates T cell death and immune memory. J Clin Invest. 113 (12), 1734-1742 (2004).
- Lissina, A., et al. Protein kinase inhibitors substantially improve the physical detection of T-cells with peptide-MHC tetramers. J Immunol Methods. 340 (1), 11-24 (2009).
- Hogan, R. J., et al. Protection from respiratory virus infections can be mediated by antigen-specific CD4(+) T cells that persist in the lungs. J Exp Med. 193 (8), 981-986 (2001).
- Hogan, R. J., et al. Activated antigen-specific CD8+ T cells persist in the lungs following recovery from respiratory virus infections. J Immunol. 166 (3), 1813-1822 (2001).
- Zhao, J., et al. Airway memory CD4(+) T cells mediate protective immunity against emerging respiratory coronaviruses. Immunity. 44 (6), 1379-1391 (2016).
- Hondowicz, B. D., et al. Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma. Immunity. 44 (1), 155-166 (2016).
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. J Vis Exp. (29), e1266 (2009).
- Faustino, L. D., et al. Interleukin-33 activates regulatory T cells to suppress innate gammadelta T cell responses in the lung. Nat Immunol. 21 (11), 1371-1383 (2020).
- Atif, S. M., Gibbings, S. L., Jakubzick, C. V. Isolation and identification of interstitial macrophages from the lungs using different digestion enzymes and staining strategies. Methods Mol Biol. 1784, 69-76 (2018).
- Pape, K. A., Taylor, J. J., Maul, R. W., Gearhart, P. J., Jenkins, M. K. Different B cell populations mediate early and late memory during an endogenous immune response. Science. 331 (6021), 1203-1207 (2011).
- Naeher, D., et al. A constant affinity threshold for T cell tolerance. J Exp Med. 204 (11), 2553-2559 (2007).
- Moon, J. J., et al. Quantitative impact of thymic selection on Foxp3+ and Foxp3- subsets of self-peptide/MHC class II-specific CD4+ T cells. Proc Natl Acad Sci U S A. 108 (35), 14602-14607 (2011).
- Koehli, S., Naeher, D., Galati-Fournier, V., Zehn, D., Palmer, E. Optimal T-cell receptor affinity for inducing autoimmunity. Proc Natl Acad Sci U S A. 111 (48), 17248-17253 (2014).
- Zhang, Z., Legoux, F. P., Vaughan, S. W., Moon, J. J. Opposing peripheral fates of tissue-restricted self antigen-specific conventional and regulatory CD4(+) T cells. Eur J Immunol. 50 (1), 63-72 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены