Method Article
原代 T 细胞中初始 Ca2+ 微结构域的成像
* 这些作者具有相同的贡献
摘要
在这里,我们提供了一个全面的方案,可以使用荧光显微镜解析原代小鼠和人 T 细胞中的初始局部 Ca2 + 信号,称为 Ca2 + 微结构域。该方案为研究人员检查免疫细胞内的 Ca2+ 信号通路并进一步揭示其功能提供了宝贵的资源。
摘要
局部的亚秒级 Ca2+ 信号,称为 Ca2+ 微结构域,是高度动态且短寿命的 Ca2+ 信号,会导致整体 [Ca2+]i 升高,并且可能已经决定了 T 细胞的命运。T 细胞受体激活后,NAADP 迅速形成,与位于细胞内 Ca2+ 储存(如 ER 和溶酶体)上的 NAADP 结合蛋白(HN1L/JPT2、LSM12)及其各自的受体(RyR1、TPC2)结合,并导致 [Ca2+]i 随后释放和升高。为了捕获这些快速且动态发生的 Ca2+ 信号,我们开发了一种高分辨率成像技术,结合使用两种 Ca2+ 指示剂 Fluo-4 AM 和 FuraRed AM。对于后处理,基于编程语言 Python 开发了一种开源的半自动 Ca2+ 微域检测方法。使用该工作流程,我们能够在高时间和空间分辨率荧光视频中可靠地检测原代小鼠和人 T 细胞中的亚细胞水平上的 Ca2+ 微结构域。该方法也适用于其他细胞类型,如 NK 细胞和小鼠神经元细胞系。
引言
所提出的荧光显微镜技术能够可视化原代小鼠 T 细胞中的局部、时间初始钙 (Ca2+) 信号,称为 Ca2+ 微结构域。Ca2+ 微结构域代表高度动态和短寿命的 Ca2+ 信号转导事件,对有效的活细胞成像和分析构成挑战1。
由于中央和外周荧光强度的相对差异,T 细胞对活细胞成像具有挑战性,这可归因于它们的球形和 ~6-8 μm 的小直径。在刺激和免疫突触形成后,T 细胞发生形态变化,使 T 细胞的成像进一步复杂化 1。因此,采用比率分析变得势在必行,通过记录代表 Ca2+ 染料不同特性的两张图像或利用两种 Ca2+ 染料的组合来实现。Ca2+ 微结构域的要求很高,包括其快速、时间和空间限制的性质。为了实现这一目标,所使用的 Ca2+ 染料必须具有高基础亮度和高信噪比 (SNR),以获得尽可能高的时间和空间分辨率。使用双波长染料 Fura Red 和单波长染料 Fluo-4 的组合已获得最佳结果。使用 Fluo-4 和 Fura Red 的共加载槽可缓解双发射波长染料的强光漂白和与双激发染料相关的时间延迟带来的挑战,确保适用于快速图像采集。这种方法进一步促进了形状变化和细微运动的可视化。成像系统在空间分辨率方面也提出了特殊要求,以便能够可视化来自小通道簇甚至单个通道1 的 Ca2+ 信号。
Ca2+ 信号转导在激活 T 细胞内的免疫功能中起关键作用,包括突触形成和细胞因子的产生和释放 2,3。细胞的特定命运通过不同发音和局部分布的 Ca2+ 信号 Ca2+ 微结构域3 进行调节。值得注意的是,这些局部 Ca2+ 信号先于 T 细胞中细胞内 Ca2+ 水平的广泛升高,并且 Ca2+ 微结构域的形成取决于 Ca2+ 的进入和释放 1,4,5。在 T 细胞受体 (TCR)/CD3 刺激后,Ca2+ 的形成释放第二信使,如烟酸腺嘌呤二核苷酸磷酸 (NAADP)、D-肌醇 1,4,5-三磷酸 (IP3) 和环状 ADP 核糖 (cADPR),导致细胞内 Ca2+ 水平升高至 1 μM 6,7。早期 Ca2+ 信号转导事件与细胞内 Ca2+ 储存(如内质网 (ER))释放 Ca2+ 有关,兰尼碱受体 1 (RyR1) 和 IP3 受体 (IP3R) 等通道主要负责这种信号传导。随后触发细胞外 Ca2+ 内流,并通过商店操作的 Ca2+ 进入 (SOCE) 产生全局 Ca2+ 信号8。此外,在 T 细胞活化过程中,还有其他通道参与 Ca2+ 信号转导9,例如 P2X4 和 P2X7 通道确保三磷酸腺苷 (ATP) 依赖性阳离子内流,有助于细胞内 Ca2+ 的增加。值得注意的是,初始粘附依赖性 Ca2+ 微结构域 (ADCM) 在 TCR 刺激之前已经形成,但 Ca2+ 振幅和频率较低。这些不依赖 TCR 的初始 Ca2+ 信号很可能有助于 T 细胞迁移到炎症部位,并引发 T 细胞在感染部位进行再刺激10,11。
通过开发所描述的局部 Ca2 + 成像方法,我们获得了一个额外的工具,用于探索早期 Ca2 + 信号在 T 细胞活化中的起源和意义。这种方法使用户能够检测到比以前更小、更短且出现速度更快的 Ca2+ 信号。此外,基于 Python 的分析管道 Deconvolution, Analysis, Registration, Tracking, and Shape normalization (DARTS) 可以与更广泛的受众共享分析工具12.
研究方案
所有动物实验均根据汉堡-埃彭多夫大学医学中心机构动物护理和使用委员会的动物福利指南获得批准和进行。
1. 从淋巴结和脾脏中分离原代小鼠 T 细胞
- 根据伦理指南,在无菌条件下收获脾脏/淋巴结,并将它们放入装有冰冷的 Clicks 培养基(10% 胎牛血清 (FCS)、2 mM L-谷氨酰胺、青霉素/链霉素 (P/S) 100 U/mL、50 nM β-巯基乙醇)的试管中。
注:野生型和 KO 小鼠 T 细胞以相同的方式分离。 - 将离心机冷却至 4 °C。
- 将脾脏和淋巴结放入无菌培养皿中的 70 μm 细胞过滤器中,并加入脾分离培养基(RPMI 培养基 + 7.5% NCS + 1% P/S)至总体积为 20 mL。
- 使用塑料砂浆彻底但温和地破坏脾脏。然后将细胞转移到 50 mL 离心管中。
注:50 mL 离心管中的总体积现在应为 20 mL。脾脏和淋巴结应完全破坏。从这一点开始在冰上工作。将细胞保存在冰上会减慢它们的新陈代谢并防止细胞死亡,确保它们保持活力和功能完整。这有助于更长时间地保持它们的生理状态,这对于准确的下游实验尤为重要。 - 将细胞悬液在 4 °C 下以 300 x g 离心 5 分钟。
- 弃去上清液,确保所得沉淀重悬于 2 mL Dulbecco 磷酸盐缓冲盐水 (DPBS)(不含 Ca2+ 和 Mg2+)中。转移至新的 12 mL 离心管中。
2. CD4+ T 细胞的阴性选择
注:对于 CD4 + T 细胞的阴性选择,使用含有 FcR 阻滞剂、针对非 CD4 + T 细胞的生物素化抗体和链霉亲和素包被的磁性颗粒的 T 细胞分离试剂盒。
- 将 T 细胞分离试剂盒中的 20 μL/mL 小鼠 FcR 阻滞剂添加到细胞悬液中。
- 此外,加入 100 μL 浓度为 50 μL/mL 的小鼠 CD4 + T 细胞分离混合物,充分混合,并在室温 (RT) 下孵育 10 分钟。
- 涡旋链霉亲和素包被的磁珠 30 秒,向细胞悬液中加入 150 μL,充分混合,并在室温下孵育 2 分钟 30 秒。
- 将 DPBS 添加到细胞悬液中,填充至总体积为 7 mL。确保轻轻上下移液,然后在 RT 下在磁铁中孵育 2 分钟 30 秒。
- 随后,轻轻收集上清液中富集的 T 细胞,并将其转移到新的 12 mL 离心管中。
- 在 RT 下以 300 x g 离心细胞 5 分钟。
- 丢弃上清液。
- 将分离和富集的 CD4 + T 细胞重悬于 1 mL DPBS 中,彻底上下吹打。将混合物在 RT 下在磁力架中孵育 2 分钟 30 秒,以确保没有珠子污染。
- 收集上清液,将其转移到新的离心管中,并对富集的 T 细胞进行计数。
- 要对细胞进行计数,请用台盼蓝对细胞进行染色,并使用自动细胞计数仪进行计数。
注:最好直接加载分离的 CD4 + T 细胞并在分离的同一天对其进行成像。然而,原代小鼠 T 细胞可以在 37 °C 和 5 % CO2 的分离培养基 (RPMI 1640 + 10% FCS + P/S) 的培养箱中培养过夜,而无需任何刺激。
3. 原代小鼠 CD4+ T 细胞的加载
注:为了测量游离胞质 Ca2+ 浓度,在 Ca2+ 成像实验中使用荧光和膜渗透性染料。Fluo-4-乙酰氧基甲酯 (AM) 和比率染料 Fura Red-AM 的组合用作快速检测局部 Ca2+ 信号的指示剂。使用荧光染料时,确保在黑暗中工作。
- 将 2-5 x 106 个细胞离心 5 分钟,300 x g,弃去上清液并重悬于 480 μL T 细胞培养基(RPMI 1640,10% FCS)中,含 10 μM Fluo-4-AM(原液:[1 mM])和 20 μM Fura Red-AM(原液:[4 mM])。
- 最初在 RT 中在黑暗中的长凳下孵育 20 分钟,用铝箔覆盖猎鹰。
注:不要超过第一次孵育时间,因为 Ca2+ 指示剂在 DMSO 中稀释,在低总体积下较长的暴露时间可能会对细胞有害。由于染料的光敏性,上样后保持细胞避光。 - 在初始 20 分钟孵育结束时,向细胞中加入 2 mL T 细胞培养基,并在室温下避光继续孵育 30 分钟。
- 在 RT 下以 300 x g 离心细胞悬液 5 分钟。
- 弃去上清液,用 2 mL Ca2+ 测量缓冲液(140 mM NaCl、5 mM KCl、1 mM MgSO4、1 mM CaCl2、20 mM HEPES、1 mM NaH2PO4、5 mM 葡萄糖,pH 7.4)洗涤沉淀,然后在室温下以 300 x g 离心 5 分钟。
- 最后,弃去上清液,用 Ca2+ 测量缓冲液重悬。将细胞数量调整为每 10 μL ~100,000 个细胞。
注:一次测量使用 10 μL 的体积。避免过度稀释细胞,因为可能需要在显微镜下进一步调整细胞计数以达到测量条件的最佳状态。 - 让细胞孵育 ~20 分钟,以确保染料完全浸润和细胞脱酯。将细胞储存在冰上和黑暗中,直到测量。
注:加载的原代小鼠 T 细胞可在加载后长达 ~4 小时使用。
4. 局部 Ca2+ 成像
- 玻片制备
- 用牛血清白蛋白(BSA,5 mg/mL)和聚-L-赖氨酸(PLL,0.1 mg/mL)涂覆显微镜盖玻片 (24 mm x 46 mm)(图 1A)。在应用 PLL 之前让 BSA 静置 ~20 分钟。
注:涂层有助于细胞粘附。为了获得适当的细胞粘附,准确铺展 BSA 和 PLL,直到不再看到条纹。 - 要创建反应室,请使用硅胶膏将可重复使用的橡胶 O 形圈粘在载玻片上(图 1B,C)。
注:其他载玻片/腔室或板(如 35 mm 载玻片、可重复使用的金属腔室或 8、24 或 48 孔板)可用于图像采集。
- 用牛血清白蛋白(BSA,5 mg/mL)和聚-L-赖氨酸(PLL,0.1 mg/mL)涂覆显微镜盖玻片 (24 mm x 46 mm)(图 1A)。在应用 PLL 之前让 BSA 静置 ~20 分钟。
- 用抗体包被蛋白 G 磁珠(直径 10 μm)
- 轻轻混合蛋白质磁珠悬浮液,并将 12.5 μL 转移到新试管中。
- 将试管放在磁力架上以去除储存缓冲液,让珠子迁移到磁力架上。通过在磁力架的另一侧移液来轻轻去除储存缓冲液。
- 要去除任何剩余的储存缓冲液,请加入 500 μL PBS-T(PBS,0.1% 吐温)并涡旋 10 秒来洗涤珠子。将试管再次放入磁力架中并取出缓冲液。
- 要用抗体包被珠子,请将它们重悬于 7.5 μL PBS-T 中,并分别添加 5 μL 抗 CD3 (0.5 mg/mL) 和抗 CD28 (0.5 mg/mL)。在 RT 下连续混合孵育 30-60 分钟。
- 用 500 μL PBS-T 洗涤包被的珠子 3 次,然后使用磁力架用 500 μL Ca2+ 测量缓冲液洗涤一次。
- 将微珠重悬于 200-400 μL Ca2+ 测量缓冲液中。
注:在测量过程中检查微珠密度,必要时进一步稀释。
- 局部 Ca2+ 成像显微镜检查
注:使用放大倍数为 100 倍的明场光学显微镜进行成像,配备氙弧灯作为光源。帧以 14 位模式捕获,并使用电子倍增电荷耦合相机进行双重合并。为了记录和分割两种染料的发射波长,采用了双视图模块,具有以下以 nm 为单位的滤光片(例如,480/40;bs,495;em1,542/50;em2,650/57)。成像装置包括一个采集中心和用于图像采集的成像软件。- 将 10 μL 加载的细胞放在准备好的载玻片上,让它们附着在载玻片上 3-5 分钟。
- 向载玻片中轻轻加入 80 μL Ca2+ 测量缓冲液。
- 选择 100 倍油浸透镜并涂抹一小滴浸油。将载玻片放在显微镜台上。
- 在明场模式下调整焦点,仔细选择最多 10 个彼此不接触的单元格的视野,然后获取图像。
注意:重叠和接触单元格稍后将很难分析。- 打开灯,检查荧光和 T 细胞的负载,并比较两个通道中的细胞以验证它们是否未被预激活。
- 确保在测量前后拍摄明场和荧光通道的视场照片,以检查细胞移动和负载。
- 开始测量并捕获基础活性 1 分钟,采集速率为每 5 秒 1 帧。
- 1 分钟后加入 10 μL 化合物/兴奋剂(珠子或刺激剂/抑制剂),并使用每秒 40 帧或可能的最大帧速率测量总共 3 分钟。
注意:添加珠子是关键步骤;确保将珠子添加到玻片上的激发光附近,同时不要移动玻片。图 2 显示了 WT 和 P2x4-/- 和 P2x7-/- 小鼠微珠接触后原代 CD4 + T 细胞中 Ca2+ 微结构域的代表性示例。
5. 后处理/数据分析
注意:对于图像处理和数据分析,使用基于 Python 的开源管道 DARTS。它是由 Woelk 等人12 根据 Diercks 等人 13 的工作开发的。
- 安装 DARTS 管道
- 安装 Python 3.10.014、anaconda15 和 git16,并使用终端命令 git clone 克隆 GitHub 存储库 :https://github.com/IPMI-ICNS-UKE/DARTS.git
- 使用 conda create --name DARTS 创建 conda 环境,并使用 pip install <package> 安装所有必要的 Python 包。
注意:请按照 DARTS GitHub 存储库17,18 中的安装说明了解更多详细信息。 - 在使用 Bioformats 之前,请确保正确安装了 Java 运行时环境19.
- DARTS 管道的使用
注意:安装后,可以从终端窗口启动 DARTS。- 导航到包含 main.py 文件的 DARTS 存储库的本地副本 (cd path/to/DARTS)。确保 conda 环境已激活 (conda activate DARTS)。
- 通过在终端窗口中键入 python main.py 并按 Enter 键来执行 DARTS。
- 在图形用户界面 (GUI) 中,指定源和结果目录以及左上角的图像格式(参见 图 3)。
- 定义测量的属性,例如比例 (像素/微米)、帧速率、单元格类型等。可以根据特定的图像数据和研究问题组装处理管道。
注意:例如,在相应的文档20 中阅读有关反卷积参数的更多信息。 - 在单击之前将设置保存在计算机上 Start 开始.有关 GUI 的更详细说明,请参阅 DARTS 文档。
- Ca2+ 微结构域成像和微珠接触
注:对于使用珠子进行局部成像和刺激以及随后的图像分析,用户需要定义细胞特异性珠子接触,以确定感兴趣测量周期的起点 (t = 0)(参见 图 4)。微珠接触定义为(刺激性)微珠与目标细胞的接触位点。它包括 (1) 磁珠接触时间的规范,例如,第 300 帧,以及 (2) 磁珠相对于电池中心的磁珠接触位置,例如,1 点钟或 12 点钟。使用当前的 DARTS 版本,用户需要手动定义并输入每个拉延筋触点的信息。使用以下过程定义拉延筋接触:- 使用滑块确定微珠与目标细胞之间的接触时间。
- 在右侧的选项菜单中,选择 Bead contact: x, y, t.
- 选择图像左侧细胞和磁珠接触的位置。
- 选择 选择单元格 通过单击内部的点。单击受此珠子刺激的细胞,最好在中心。
- 单击 ADD bead contact(添加磁珠触点)。
- 对此文件中每个附加的拉延筋触点重复步骤 5.3.1 - 5.3.5。定义完所有拉延筋触点后,单击 Continue 按钮。
- 继续处理其他文件。到达最后一个文件后,脚本将自动启动对所有文件的分析。
- 数据分析
- 在结果文件夹中找到处理后的比率图像、每个单元格随时间变化的微域数据(包括定位、振幅、大小)、飞镖靶投影的源数据以及更多资源。
- 要创建 dartboard,请导航到包含脚本 DartboardPlotGUI.py 的 DARTS 文件夹(模式:cd path/to/DARTS/src/analysis)中的 /src/analysis/ 文件夹。然后,键入 python DartboardPlotGUI.py 并按 Enter。
- 确保提供了必要的信息,并且 results 文件夹中的电子表格文件被准确选为生成 dartboard 的源文件。
结果
在该协议中,我们概述了一种更新的方法,根据我们小组 1,13 之前的工作对原代小鼠 T 细胞中的初始 Ca2 + 微结构域进行成像和分析。这种方法有助于揭示 CRAC 通道(如 ORAI1、STIM1 和 STIM2)以及细胞内 Ca2+ 释放通道(如 RyR1)在早期 Ca2+ 信号转导事件中的参与4。
为此,我们通过对未刺激的原代小鼠 Orai1-/-、Stim1-/-、Stim2-/-和 Ryr1-/- 进行成像来研究自发的 Ca2+ 微结构域形成,并将它们与 WT 原代小鼠 T 细胞进行比较。Ca2+ 微结构域形成的分析包括信号起始速度、Ca2+ 振幅和每个共聚焦平面的信号数量。值得注意的是,与 WT 细胞相比,除 Stim2-/-T 细胞外,所有 KO T 细胞的局部 Ca2+ 信号均显著减少,且基底游离胞质 Ca2+ 浓度降低。这使我们得出结论,Ca2+ 微结构域的形成与 ORAI1、STIM1 和 RyR14 的相互作用错综复杂地相关。此外,我们成功地鉴定和表征了质膜上的自发性 Ca2+ 微结构域。这些 Ca2+ 微结构域的特征是 Ca2+ 振幅为 290 nm ± 12 nm。对 Ca2+ 信号使用颜色编码方法,可以在整个细胞中可视化 Ca2+ 微结构域。结果进一步强调了 Ca2+ 微结构域的快速起效,可在几毫秒内可见,并且该方法能够以几毫秒的持续时间检测 Ca2+ 信号4。这些自发的 Ca2+ 微结构域后来被鉴定为粘附依赖性 Ca2+ 微结构域 (ADCM),不仅依赖于 SOCE,还通过 FAK/PLC-γ/IP3 信号级联10 和 P2X4 的参与发挥作用9。此外,该技术对于确认双氧化酶 1 和 2 (DUOX1/2) 是产生 NAADP 的酶21 和 HN1L/JPT222 是新发现的 NAADP 结合蛋白之一23 至关重要。
图 2 显示了 WT 以及 P2x4-/- 和 P2x7-/- 小鼠微珠接触后原代 CD4+ T 细胞中 Ca2+ 微结构域的代表性示例。用 Ca2+ 染料 Fluo-4 AM 和 Fura Red AM 加载细胞,并以 25 ms (40 帧/秒) 的采集速率成像。为了模拟 T 细胞突触的形成,用抗 CD3/抗 CD28 包被的磁珠刺激细胞。使用 DARTS 管道在珠子接触前 1 秒和珠子接触后 15 秒分析初始 Ca2 + 微结构域形成。在磁珠接触后,WT 细胞在磁珠接触部位刺激后的第一秒内显示出 Ca2 + 微结构域的快速形成(图 2A)。这些 Ca2 + 微结构域在磁珠接触后的 15 秒内进一步扩展到整个细胞。与 WT 细胞相反,P2x4-/-和 P2x7-/-细胞(图 2B)在磁珠刺激后显示 Ca2+ 微结构域形成减少,P2x4-/-a 在磁珠接触前的基础水平较低。这些代表性发现与 Brock 等人之前发表的结果一致9,表明在微珠接触 15 秒后立即在 WT T 细胞中形成 Ca2+ 微结构域,而在 P2x4-/- 和 P2x7-/- 细胞中每帧信号较低。此外,P2x4 - /-细胞中的振幅显着降低,进一步确立了嘌呤能信号转导在粘附依赖性 Ca2 + 微结构域中的作用。
此外,该方法还可用于可视化原代人 CD4 + T 细胞中的初始 Ca2 + 微结构域(图 3)。与原代小鼠 T 细胞一致,初始 Ca2+ 微结构域在微珠接触位点诱发。然而,与小鼠 CD4+ T 细胞相比,总体 Ca2+ 反应似乎发生在不同的时间尺度上。
以手动方式分析局部 Ca2+ 信号是不可行的,因为它对个人研究者来说非常费力且主观。因此,我们之前在 MATLAB Simulink 中开发了一种算法,使用其图像处理和优化工具箱进行后处理13 来分析局部 Ca2+ 微域。
最近,我们开发了一种新的开源后处理管道,称为 DARTS,用于使用软件平台 Python12 在高分辨率活细胞成像中进行 Ca2+ 微域分析。在这里,可以根据用户的偏好选择不同的反卷积算法,执行细胞形状归一化以补偿形态细胞形状变化,并定义显微镜和测量特定参数(例如,比例、帧速率、测量时间)(图 4)。
选择 Ca2 + 微域分析的参数后,为每个单独的测量打开第二个弹出窗口,以定义珠子接触(图 5)。要定义焊缝接触,用户可以使用滑块手动滚动 tiff 文件,并单独选择焊缝接触框架。通过单击微珠接触部位(图 5,微珠和微珠接触由黄色环和箭头表示)以及细胞选择来选择微珠接触。必须对每个感兴趣的细胞重复此步骤。最后,应用自动图像后处理,并将结果数据汇总并保存在电子表格中。
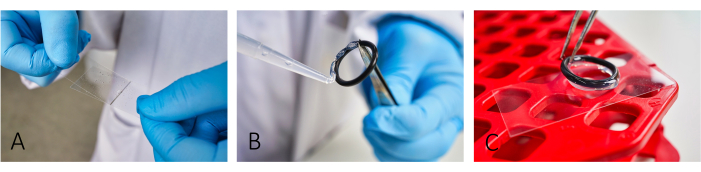
图 1:成像玻片制备的工作流程。 (A) 使用第二个玻璃盖玻片在载玻片上添加和铺展 BSA 和 PLL。(B,C)要构建腔室,请使用硅脂将橡胶 O 形圈粘在载玻片上。确保整个环上覆盖一层薄薄的润滑脂,以适当隔离腔室。请单击此处查看此图的较大版本。
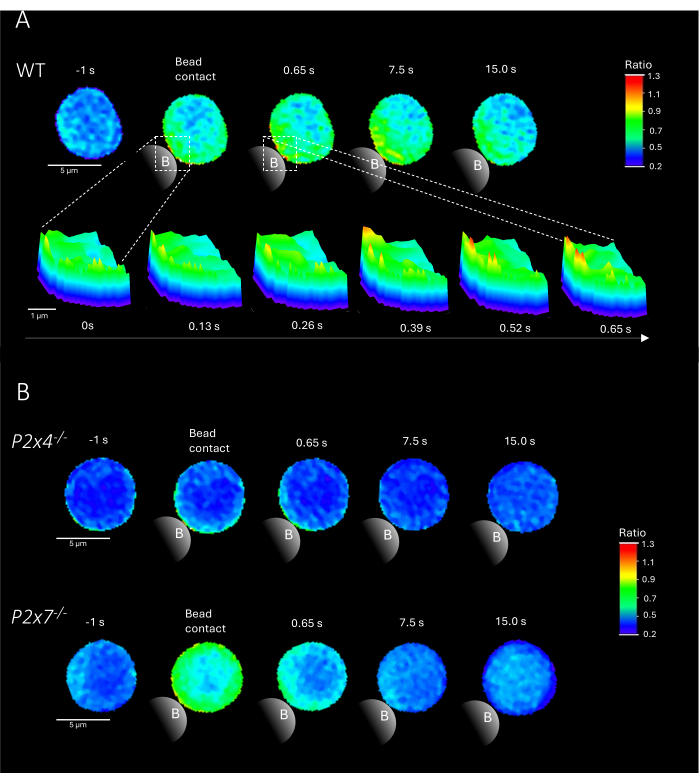
图 2:原代小鼠野生型 (WT) (A)、P2x4-/- 或 P2x7-/-(B) CD4+ T 细胞中 T 细胞受体依赖性 Ca2+ 微结构域的代表性细胞。如上所述,对 CD4 + T 细胞进行阴性分离并加载 Fluo-4 AM 和 Fura Red。使用 DARTS 管道分析 T 细胞,得到的细胞图像与之前发表的结果相当9。(A) 用抗 CD3/抗 CD28 包被的珠子刺激前 1 秒和刺激后长达 15 秒(比例尺 5 μm)的 WT 原代 T 细胞,以及珠子接触区域从 0 秒放大到 0.65 秒的 3D 表面图(比例尺 1 μm)。(B) 上泳道:珠刺激前 1 秒和刺激后 15 秒的代表性 P2x4-/- 原代 T 细胞。下泳道:珠子刺激前 1 秒和珠子刺激后 15 秒的代表性 P2x7-/- 原代 T 细胞。请单击此处查看此图的较大版本。
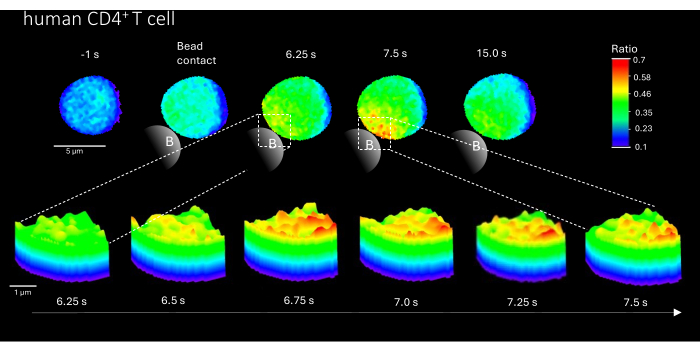
图 3:TCR 刺激后代表性原代人 T 细胞中的 Ca2+ 微结构域。 如上所述,通过荧光激活细胞分选 (FACS) 从血沉棕黄层中从外周血单核细胞 (PBMC) 中分离原代人 CD4 + T 细胞,并加载 Fluo-4 AM 和 Fura Red。该图显示了用抗 CD3 包被的珠子刺激前 1 秒和刺激后长达 15 秒(比例尺 5 μm)的原代人 T 细胞,以及珠子接触区域从 6.25 秒放大到 7.5 秒的 3D 表面图(比例尺 1 μm)。 请单击此处查看此图的较大版本。
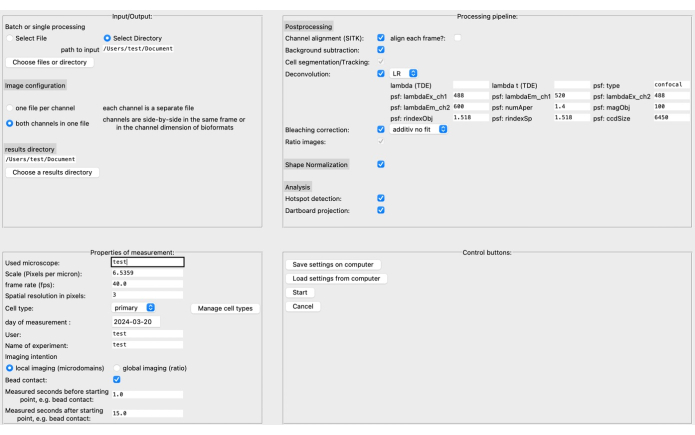
图 4:DARTS 图形用户界面 (GUI)。 GUI 分为四个区域。在 Input/Output 区域中,您需要提供有关原始数据的信息,包括源目录和图像配置(每个文件两个通道或单独的通道)以及结果目录。在 Properties of Measurement 区域中,需要描述实验及其所有相关信息,例如比例 (每像素微米)、帧速率和相对于后来确定的起点的测量间隔。接下来,可以组装一个由后处理步骤、形状归一化和实际分析(微域检测和飞镖靶数据积累)组成的处理管道。最后,可以将设置保存到计算机或从计算机加载。设置分析后,单击 Start 继续。要了解有关设置的更多信息,请访问 https://ipmi-icns-uke.github.io/DARTS/General/Usage.html。请单击此处查看此图的较大版本。
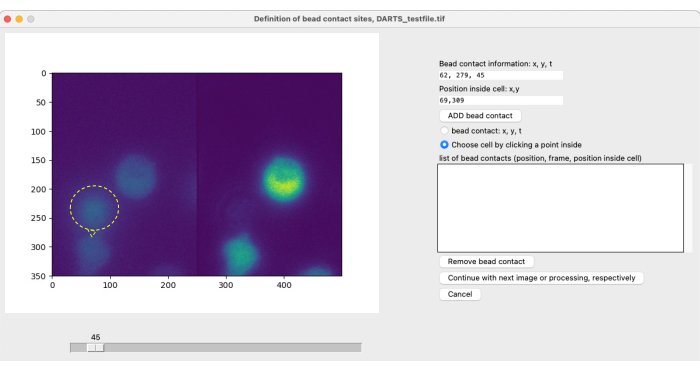
图 5:磁珠触点的手动定义。如果在实验期间将微珠添加到细胞中,则必须手动定义微珠与目标细胞的初始微珠接触时间和接触位置。这是通过使用滑块滚动帧并在时间点 t 处找到位置 (x,y) 来完成的。要自动填充微珠接触信息字段,用户单击微珠接触位置的显微镜图像的左半部分。接下来,要将单元与磁珠触点相关联,用户单击单元中具有磁珠触点的位置。必须通过选择 ADD bead 来确认该信息。请单击此处查看此图的较大版本。
讨论
我们描述了一种广泛的方案,用于对原代小鼠和人 T 细胞中的局部 Ca2 + 微结构域进行高分辨率活细胞成像,该方案由 TCR/CD3 刺激通过抗体包被的珠子触发。此外,我们还实现了一种用户友好且基于 Python 的开源算法来识别和分析本地 Ca2+ 信号。值得注意的是,该方案不仅限于在 TCR/CD3 刺激的背景下检测 Ca2+ 微结构域,而且适用于其他(免疫)细胞类型,例如 NK 细胞系 (KHYG-1)12 或不依赖 TCR 的 Ca2+ 微结构域10,11。
该方案中的一个关键步骤是刺激珠的大小和数量。为了模拟免疫突触,珠子的大小应与细胞相似。因此,对于原代小鼠和人 T 细胞以及细胞系(Jurkat 和 KHYG1),我们使用直径为 10 μm 的磁珠。此外,每个细胞都应该只受到一个珠子的刺激。因此,一方面,添加到每张载玻片上的磁珠数量应该足够,但如果视野中的磁珠太多,背景就会增加,并且无法检测到单个激活时间点和接触侧。
该方案以比率方式利用荧光 Ca2+ 染料 Fluo-4 AM 和 FuraRed AM,因此允许校准数据13。此外,该方案可以适用于其他 Ca2 + 指示剂对,但在选择过程中必须谨慎对待 Ca2 + 结合动力学、亚细胞分布和光漂白1。此外,必须针对每种细胞类型开发和优化上样条件,但此处指示的浓度是一个很好的起点。为了可视化 Ca2 + 微结构域,Ca2 + 染料的 Kd 应在 300-1200 nM 范围内,每帧采集时间应为 ≤60 ms。如果荧光强度太低,则必须检查滤光片组,但也可以将双倍量的 Ca2+ 染料加载到 T 细胞中。然而,Ca2+ 染料可能会误位到其他细胞器或隔离到囊泡,但它也可能充当 Ca2+ 缓冲液并影响 Ca2+ 反应。
分析算法的一个限制是假设细胞的球形;因此,具有不同形态的细胞类型可能需要调整 Analysis Toolbox。该算法已用于分析原代小鼠 T 细胞以及 Jurkat T 细胞和 NK 细胞系 (KHYG-1)12 中的局部 Ca2+ 微结构域,并成功分析小鼠神经元细胞系的 Ca2+ 微结构域(N2a,未发表的数据)。原则上,协议和分析工具箱可用于分析非球形细胞类型,例如 HEK293 或 HeLa 细胞,但对于这些细胞类型,飞镖靶投影不能适应,因为它基于细胞的圆形结构和形状归一化。此外,在磁珠刺激下检测局部初始 Ca2+ 微结构域的方案可以适用于分析来自其他刺激的局部 Ca2+ 信号,例如可溶性激活或抑制化合物,以及粘附依赖性和 TCR/CD3 非依赖性 Ca2+ 微结构域10,11。值得注意的是,从时间和位置的角度定义单个微珠接触比确定可溶性化合物后活化的起点更容易。
检测 Ca2+ 微结构域形成的一般限制在于所需的高时空分辨率和必要的高信噪比 (SNR)。目前,从我们的设置中得出的分辨率达到了 ~0.368 μm 的计算空间分辨率和 ~40 帧/秒 (fps)1 的时间分辨率。相机和检测器开发的最新进展,以及荧光染料的改进,可能会导致实现光学单通道记录的可能性,正如 ORAI-GECI(基因表达的 Ca2+ 指标)构建体24 所描述的那样,用于活细胞成像,未来使用具有更高时间和空间分辨率的 Ca2+ 指标。
综上所述,此处描述的高分辨率 Ca2 + 微结构域成像的方案和分析工具不仅可以用于分析 T 细胞中的初始局部 Ca2 + 信号,还可以适用于其他细胞类型,以破译局部 Ca2 + 信号在这些细胞中的重要性。
披露声明
作者声明,该研究是在没有任何可被视为潜在利益冲突的商业或财务关系的情况下进行的。
致谢
这项工作得到了 Deutsche Forschungsgemeinschaft (DFG) 的支持(项目编号 335447717;SFB1328、A02 至 B-PD 和 RW;A14 到 ET;项目编号516286863 B-PD)。作者感谢献血者和 UKE 输血医学系的合作。
材料
| Name | Company | Catalog Number | Comments |
| α-CD3 | BD Pharmingen | 553058 | |
| α-CD28 | BD Pharmingen | 553295 | |
| Anaconda | Anaconda | https://docs.anaconda.com/free/anaconda/install/index.html | |
| Bovine serum albumin | Sigma-Aldrich | A2058 | |
| Cell strainer | Biofil | CSS-013-070 | 70 µm diameter |
| Countess Automated Cell Counter | Invitrogen | A49865 | |
| Cover slips | Paul Marienfeld GmbH | 101202 | |
| DARTS | GitHub | https://github.com/IPMI-ICNS-UKE/DARTS | |
| Dulbecco’s Phosphate buffered saline | Gibco, Thermo Fisher | 14190144 | |
| EasySep CD4+ T cell Isolation Kit | Stemcell | 19852 | |
| EasySep Magnetic Multistand | Stemcell | 18010 | |
| Fluo 4-AM | Invitrogen | F14201 | |
| Fura Red-AM | Invitrogen | F3020 | |
| Gibco RPMI 1640 medium | Gibco, Thermo Fisher | 11875093 | |
| Git | GitHub | https://git-scm.com/book/en/v2/Getting-Started-Installing-Git | |
| immersion oil | Leica | 11513859 | |
| Newborn calf serum | Sigma-Aldrich | N4637 | |
| Oracle | Oracle | https://www.oracle.com/de/java/technologies/downloads/ | |
| Penicillin/Streptamycin | Gibco, Thermo Fisher | 15240062 | |
| Poly-L-lysine | Sigma-Aldrich | P4707 | |
| Protein G magnetic beads | Merck | LSKMAGG02 | 10 µM diameter |
| Python | Python | https://www.python.org/downloads/ | |
| Silicon grease (basylone) | Bayer | 291-1220 | |
| Time-Dependent Entropy Deconvolution | GitHub | https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters | |
| Tween | q-biogene | TWEEN201 |
参考文献
- Wolf, I. M. A., et al. Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor. Sci Signal. 8 (398), 102 (2015).
- Taguchi, T., Mukai, K. Innate immunity signalling and membrane trafficking. Curr Opin Cell Biol. 59, 1-7 (2019).
- Trebak, M., Kinet, J. -. P. Calcium signalling in T cells. Nat Rev Immunol. 19 (3), 154-169 (2019).
- Diercks, B. -. P., et al. ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation. Sci Signal. 11, 0358 (2018).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: Elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1 (1), 11-21 (2000).
- Kummerow, C., Junker, C., Kruse, K., Rieger, H., Quintana, A., Hoth, M. The immunological synapse controls local and global calcium signals in T lymphocytes. Immunol Rev. 231 (1), 132-147 (2009).
- Brock, V. J., et al. P2X4 and P2X7 are essential players in basal T cell activity and Ca2+ signaling milliseconds after T cell activation. Sci Adv. 8 (5), 9770 (2022).
- Weiß, M., et al. Adhesion to laminin-1 and collagen IV induces the formation of Ca2+ microdomains that sensitize mouse T cells for activation. Sci Signal. 16 (790), 9405 (2023).
- Diercks, B. -. P. The importance of Ca2+ microdomains for the adaptive immune response. Biochim Biophys Acta Mol Cell Res. 1871 (5), 119710 (2024).
- Woelk, L. -. M., et al. DARTS: an open-source Python pipeline for Ca2+ microdomain analysis in live cell imaging data. Front Immunol. 14, 1299435 (2024).
- Diercks, B. -. P., Werner, R., Schetelig, D., Wolf, I. M. A., Guse, A. H. High-resolution calcium imaging method for local calcium signaling. Methods Mol Biol. 1929, 27-39 (2019).
- . Python Available from: https://www.python.org/downloads/ (2024)
- . Anaconda Available from: https://docs.anaconda.com/free/anaconda/install/index.html (2024)
- . git Available from: https://git-scm.com/book/en/v2/Getting-Started-Installing-Git (2024)
- . DARTS Available from: https://github.com/IPMI-ICNS-UKE/DARTS (2024)
- . DARTS GitHub Repository Available from: https://ipmi-icns-uke.github.io/DARTS/ (2024)
- . Oracle Available from: https://www.oracle.com/de/java/technologies/downloads/ (2024)
- . Time-Dependent Entropy Deconvolution Available from: https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters (2024)
- Gu, F., et al. Dual NADPH oxidases DUOX1 and DUOX2 synthesize NAADP and are necessary for Ca2+ signaling during T cell activation. Sci Signal. 14 (709), 3800 (2021).
- Roggenkamp, H. G., et al. HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation. Sci Signal. 14 (675), 5647 (2021).
- Heßling, L. D., Troost-Kind, B., Weiß, M. NAADP-binding proteins - Linking NAADP signaling to cancer and immunity. Biochim Biophy. Acta Mol Cell Res. 1870 (7), 119531 (2023).
- Dynes, J. L., Amcheslavsky, A., Cahalan, M. D. Genetically targeted single-channel optical recording reveals multiple Orai1 gating states and oscillations in calcium influx. Proc Natl Acad Sci U S A. 113 (2), 440-445 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。