Method Article
일차 T 세포에서 초기 Ca2+ 마이크로도메인 이미징
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 형광 현미경을 사용하여 원발성 쥐 및 인간 T 세포에서 Ca2+ 마이크로도메인으로 알려진 초기 국소 Ca2+ 신호를 분석하기 위한 포괄적인 프로토콜을 제공합니다. 이 프로토콜은 면역 세포 내의 Ca2+ 신호 경로를 조사하고 그 기능을 더 자세히 밝히는 데 귀중한 리소스 역할을 합니다.
초록
Ca2+ 마이크로도메인이라고 하는 국소적인 초 미만의 Ca2+ 신호는 매우 동적이고 수명이 짧은 Ca2+ 신호로, 전체적인 [Ca2+]i 상승을 초래하고 이미 T 세포의 운명을 결정할 수 있습니다. T 세포 수용체가 활성화되면 NAADP가 빠르게 형성되어 NAADP 결합 단백질(HN1L/JPT2, LSM12) 및 ER 및 리소좀과 같은 세포 내 Ca2+ 저장소에 있는 각각의 수용체(RyR1, TPC2)에 결합하고 [Ca2+]i의 후속 방출 및 상승을 유도합니다. 이처럼 빠르고 동적으로 발생하는 Ca2+ 신호를 포착하기 위해 Fluo-4 AM과 FuraRed AM의 두 가지 Ca2+ 지시약을 조합하여 고해상도 이미징 기술을 개발했습니다. 후처리를 위해 프로그래밍 언어 Python을 기반으로 오픈 소스 반자동 Ca2+ 마이크로도메인 감지 접근 방식이 개발되었습니다. 이 워크플로우를 사용하여 고시간적, 공간적 해상도의 형광 비디오에서 일차 쥐 및 인간 T 세포의 세포 내 수준에서 Ca2+ 마이크로도메인을 안정적으로 검출할 수 있습니다. 이 방법은 NK 세포 및 쥐 신경 세포주와 같은 다른 세포 유형에도 적용할 수 있습니다.
서문
제시된 형광 현미경 기법을 사용하면 Ca2+ 마이크로도메인이라고 하는 1차 마우스 T 세포에서 국소적, 시간적 초기 칼슘(Ca2+) 신호를 시각화할 수 있습니다. Ca2+ 마이크로도메인은 매우 동적이고 수명이 짧은 Ca2+ 신호 이벤트를 나타내며 효과적인 라이브 셀 이미징 및 분석에 문제를 제기합니다1.
T 세포는 중심 형광 강도와 말초 형광 강도의 상대적인 차이로 인해 살아있는 세포 이미징이 까다로울 수 있으며, 이는 구형 모양과 ~6-8 μm의 작은 직경에 기인할 수 있습니다. 자극과 면역 시냅스 형성 시 T 세포는 형태학적 변화를 겪어 T 세포의 이미징을 더욱 복잡하게 만듭니다1. 따라서 Ca2 + 염료의 서로 다른 특성을 나타내는 두 개의 이미지를 기록하거나 두 개의 Ca2 + 염료의 조합을 사용하여 달성 할 수있는 비율 계량 분석을 사용하는 것이 필수적입니다. Ca2+ 마이크로도메인의 까다로운 특성에는 빠르고, 시간적이며, 공간적으로 제한된 특성이 포함됩니다. 이를 포착하기 위해 사용된 Ca2+ 염료는 가능한 가장 높은 시간적 및 공간적 분해능을 얻기 위해 높은 기초 밝기와 높은 신호 대 잡음비(SNR)를 모두 가져야 합니다. 이중 파장 염료 Fura Red와 단일 파장 염료 Fluo-4의 조합을 사용하여 최적의 결과를 얻었습니다. Fluo-4 및 Fura Red를 사용한 공동 로딩 셀은 이중 방출 파장 염료의 강력한 광표백과 이중 여기 염료와 관련된 시간적 지연으로 인한 문제를 완화하여 빠른 이미지 획득에 대한 적합성을 보장합니다. 이 접근 방식은 모양과 미묘한 움직임의 변화를 더욱 쉽게 시각화할 수 있습니다. 또한 이미징 시스템에는 작은 채널 클러스터 또는 단일 채널1의 개방에서 발생하는 Ca2+ 신호를 시각화할 수 있도록 공간 해상도 측면에서도 특별한 요구 사항이 있습니다.
Ca2+ 신호전달은 시냅스 형성, 사이토카인 생성 및방출 2,3을 포함한 T 세포 내 면역 기능을 활성화하는 데 중추적인 역할을 합니다. 세포의 특정 운명은 다르게 발음되고 국소적으로 분포된 Ca2+ 신호인 Ca2+ 마이크로도메인(microdomains)3을 통해 조절된다. 특히, 이러한 국소 Ca2 + 신호는 T 세포에서 세포 내 Ca2 + 수준의 광범위한 상승에 선행하며 Ca2 + 마이크로 도메인의 형성은 Ca2 + 진입 및 방출 1,4,5에 따라 달라집니다. T 세포 수용체(TCR)/CD3 자극 시 니코틴산 아데닌 디뉴클레오티드 포스페이트(NAADP), D-마이오-이노시톨 1,4,5-트리스포스페이트(IP3) 및 고리형 ADP 리보스(cADPR)와 같은 Ca2+를 방출하는 2차 전달체의 형성이 촉발되어 세포 내 Ca2+ 수준이 최대 1μM 6,7까지 상승합니다. 초기 Ca2+ 신호 전달 이벤트는 소포체(ER)와 같은 세포 내 Ca2+ 저장소에서 Ca2+의 방출과 관련이 있으며, ryanodine 수용체 1(RyR1) 및 IP3 수용체(IP3R)와 같은 채널이 주로 이 신호 전달을 담당합니다. 이는 이후 세포외 Ca2+ 유입을 유발하고 매장에서 운영하는 Ca2+ 진입(SOCE)8을 통해 글로벌 Ca2+ 신호를 생성합니다. 또한, T 세포 활성화9 동안 Ca2+ 신호전달에 관여하는 다른 채널들이 있는데, 예를 들어, P2X4 및 P2X7 채널은 아데노신 삼인산(ATP) 의존성 양이온 유입을 보장하여 세포 내 Ca2+의 상승에 기여한다. 놀랍게도, 초기 접착 의존성 Ca2 + 마이크로 도메인 (ADCM)은 TCR 자극 전에 이미 형성되었지만 더 낮은 Ca2 + 진폭과 주파수를 가지고 있습니다. 이러한 초기 TCR-독립적 Ca2+ 신호는 T 세포가 염증 부위로 이동하는 데 도움이 될 가능성이 가장 높으며, 감염 부위에서 재활성화를 위해 T 세포를 프라이밍합니다10,11.
국소 Ca2+ 이미징을 위해 설명된 방법을 개발함으로써 T 세포 활성화에서 초기 Ca2+ 신호의 기원과 중요성을 탐구하기 위한 추가 도구를 얻었습니다. 이 방법을 통해 사용자는 이전에 가능했던 것보다 더 작고 수명이 짧으며 더 빠르게 발생하는 Ca2+ 신호를 감지할 수 있습니다. 또한 Python 기반 분석 파이프라인인 DARTS(Deconvolution, Analysis, Registration, Tracking, and Shape Normalization)를 통해 분석 도구를 더 많은 사용자와 공유할 수 있습니다12.
프로토콜
모든 동물 실험은 함부르크-에펜도르프 대학 의료 센터(University Medical Centre Hamburg-Eppendorf)의 기관 동물 관리 및 사용 위원회(Institutional Animal Care and Use Committee)의 동물 복지 지침에 따라 승인되고 수행되었습니다.
1. 림프절과 비장에서 일차 마우스 T 세포의 분리
- 윤리 지침에 따라 멸균 상태에서 비장/림프절을 적출하고 얼음처럼 차가운 클릭 배지(10% 태아 송아지 혈청(FCS), 2mM L-글루타민, 페니실린/스트렙토마이신(P/S) 100U/mL, 50nM β-메르캅토에탄올)이 있는 튜브에 넣습니다.
참고: 야생형 및 KO 마우스 T 세포는 동일한 방식으로 분리됩니다. - 원심분리기를 4°C로 냉각합니다.
- 멸균 페트리 접시의 70μm 세포 여과기에 비장과 림프절을 놓고 비장 분리 배지(RPMI 배지 + 7.5% NCS + 1% P/S)를 총 부피 20mL에 추가합니다.
- 철저하지만 부드럽게 플라스틱 모르타르를 사용하여 비장을 파괴합니다. 그런 다음 세포를 50mL 원심분리 튜브로 옮깁니다.
참고: 이제 총 20mL의 부피가 50mL 원심분리 튜브에 있어야 합니다. 비장과 림프절은 완전히 파괴되어야 합니다. 이 시점부터 얼음 작업을 하십시오. 세포를 얼음 위에 유지하면 신진대사가 느려지고 세포가 죽는 것을 방지하여 세포가 생존 가능하고 기능적으로 온전한 상태를 유지할 수 있습니다. 이는 더 오랜 기간 동안 생리적 상태를 보존하는 데 도움이 되며, 이는 정확한 다운스트림 실험에 특히 중요합니다. - 셀 현탁액을 300 x g 에서 4°C에서 5분 동안 원심분리합니다.
- 상층액을 버리고 생성된 펠릿을 Dulbecco의 인산염 완충 식염수(DPBS) 2mL(Ca2+ 및 Mg2+ 제외)에 재현탁하도록 합니다. 새 12mL 원심분리기 튜브로 옮깁니다.
2. CD4+ T 세포의 negative selection
참고: CD4+ T 세포의 음성 선택을 위해 FcR 차단제, non-CD4+ T 세포에 대한 비오틴화 항체 및 스트렙타비딘 코팅 자성 입자가 포함된 T 세포 분리 키트가 사용됩니다.
- T 세포 분리 키트의 마우스 FcR 차단제 20μL/mL를 세포 현탁액에 추가합니다.
- 또한 50μL/mL 농도의 마우스 CD4+ T 세포 분리 칵테일 100μL를 넣고 잘 섞은 다음 실온(RT)에서 10분 동안 배양합니다.
- 30초 동안 Vortex 스트렙타비딘 코팅된 자성 입자, 세포 현탁액에 150μL를 추가하고 잘 혼합한 다음 RT에서 2분 30초 동안 배양합니다.
- 세포 현탁액에 DPBS를 추가하여 총 부피가 7mL가 되도록 채웁니다. 부드럽게 위아래로 피펫팅한 다음 RT에서 2분 30초 동안 자석에서 배양합니다.
- 그 후, 상층액에서 농축된 T 세포를 부드럽게 수집하고 새로운 12mL 원심분리 튜브로 옮깁니다.
- RT에서 300 x g 에서 5분 동안 셀을 원심분리합니다.
- 상층액을 버리십시오.
- 분리되고 농축된 CD4+ T 세포를 1mL의 DPBS에 재현탁시키고 위아래로 철저히 피펫팅합니다. 비드 오염이 없는지 확인하기 위해 RT의 자석에서 혼합물을 2분 30초 동안 배양합니다.
- 상층액을 채취하여 새 원심분리 튜브로 옮기고 농축된 T 세포를 계수합니다.
- 세포를 계수하려면 트리판 블루로 세포를 염색하고 자동 세포 카운터를 사용하여 계수합니다.
참고: 분리된 CD4+ T 세포를 직접 로드하고 분리 당일에 이미징하는 것이 가장 좋습니다. 그러나 원발성 쥐 T 세포는 분리 배지(RPMI 1640 + 10% FCS + P/S)에서 5%CO2 로 37°C의 인큐베이터에서 하룻밤 동안 자극 없이 배양할 수 있습니다.
3. primary mouse CD4+ T cell 로딩
참고: 유리 세포질 Ca2+ 농도를 측정하기 위해 형광 및 막 투과성 염료가 Ca2+ 이미징 실험에 사용됩니다. Fluo-4-acetoxymethyl ester (AM)와 비율계량 염료 Fura Red-AM의 조합은 국소 Ca2+ 신호의 신속한 검출을 위한 지표 역할을 합니다. 형광 염료를 사용하는 동안 어두운 곳에서 작업해야 합니다.
- 원심분리기 2-5 x 106 세포, 300 x g, 상층액을 버리고 480 μL의 T 세포 배지(RPMI 1640, 10% FCS)에 10 μM Fluo-4-AM(재고: [1 mM]) 및 20 μM Fura Red-AM(재고: [4 mM])으로 재현탁합니다.
- 처음에 어둠 속의 벤치 아래 RT에서 20 분 동안 부화하고 매를 알루미늄 호일로 덮습니다.
알림: Ca2+ 지시약은 DMSO에 희석되어 낮은 총 부피에서 더 긴 노출 시간에 세포에 해로울 수 있으므로 첫 번째 배양 시간을 초과하지 마십시오. 염료의 빛 민감성 때문에 로딩 후 세포를 빛으로부터 보호하십시오. - 초기 20분 배양이 끝나면 2mL의 T 세포 배지를 세포에 추가하고 RT의 어두운 곳에서 추가로 30분 동안 배양을 계속합니다.
- 셀 현탁액을 RT에서 300 x g 에서 5분 동안 원심분리합니다.
- 상층액을 버리고 2mL의 Ca2+ 측정 완충액(140mM NaCl, 5mM KCl, 1mM MgSO4, 1mM CaCl2, 20mM HEPES, 1mM NaH2PO4, 5mM 포도당, pH 7.4)으로 세척한 후 RT에서 300 x g에서 5분 동안 원심분리합니다.
- 마지막으로, 상층액을 버리고 Ca2+ 측정 버퍼로 재현탁시킵니다. 세포 수를 10μL당 ~100,000개 세포로 조정합니다.
참고: 한 번의 측정에 10μL의 부피가 사용됩니다. 측정 조건에 대한 최적에 도달하기 위해 현미경으로 세포 수를 추가로 조정해야 할 수 있으므로 세포를 과도하게 희석하지 마십시오. - 염료의 완전한 세포 침투 및 탈에스테르화를 보장하기 위해 세포를 ~20분 동안 배양합니다. 측정할 때까지 세포를 얼음 위와 어두운 곳에 보관하십시오.
참고: 로드된 1차 쥐 T 세포는 로딩 후 최대 ~4시간까지 사용할 수 있습니다.
4. 로컬 Ca2+ 이미징
- 슬라이드 준비
- 현미경 커버슬립(24mm x 46mm)에 소 혈청 알부민(BSA, 5mg/mL) 및 폴리-L-라이신(PLL, 0.1mg/mL)을 코팅합니다(그림 1A). PLL을 적용하기 전에 BSA를 ~20분 동안 그대로 두십시오.
참고: 코팅은 세포 접착을 용이하게 합니다. 적절한 세포 접착을 위해 줄무늬가 더 이상 보이지 않을 때까지 BSA와 PLL을 정확하게 펴 바릅니다. - 반응 챔버를 만들려면 실리콘 페이스트를 사용하여 재사용 가능한 고무 O-링을 슬라이드에 붙입니다(그림 1B,C).
참고: 35mm 슬라이드, 재사용 가능한 금속 챔버 또는 8웰, 24웰 또는 48웰 플레이트와 같은 다른 슬라이드/챔버 또는 플레이트를 이미지 획득에 사용할 수 있습니다.
- 현미경 커버슬립(24mm x 46mm)에 소 혈청 알부민(BSA, 5mg/mL) 및 폴리-L-라이신(PLL, 0.1mg/mL)을 코팅합니다(그림 1A). PLL을 적용하기 전에 BSA를 ~20분 동안 그대로 두십시오.
- Protein G 마그네틱 비드(직경 10μm)와 항체 코팅
- 단백질 마그네틱 비드 현탁액을 부드럽게 혼합하고 12.5μL를 새 튜브에 옮깁니다.
- 튜브를 마그네틱 스탠드에 올려 보관 버퍼를 제거하고 비드가 자석으로 이동하도록 합니다. 저장 버퍼를 자석의 반대쪽에 피펫으로 삽입하여 부드럽게 제거합니다.
- 남아 있는 저장 버퍼를 제거하려면 500μL의 PBS-T(PBS, 0.1% 트윈)를 추가하고 10초 동안 볼텍싱하여 비드를 세척합니다. 튜브를 마그네틱 스탠드에 다시 놓고 버퍼를 제거합니다.
- 비드를 항체로 코팅하려면 7.5μL의 PBS-T에 재현탁하고 각각 5μL의 항-CD3(0.5mg/mL) 및 항-CD28(0.5mg/mL)을 추가합니다. RT에서 연속 혼합으로 30-60분 동안 배양합니다.
- 코팅된 비드를 500 μL의 PBS-T로 3회 세척한 후 마그네틱 스탠드를 사용하여 500 μL의 Ca2+ 측정 버퍼로 한 번 세척합니다.
- 200-400 μL의 Ca2+ 측정 버퍼에 비드를 재현탁시킵니다.
알림: 측정 중 비드 밀도를 확인하고 필요한 경우 더 희석하십시오.
- Local Ca2+ 이미징 현미경
참고: 이미징은 크세논 아크 램프를 광원으로 장착한 100배 배율의 명시야 광학 현미경을 사용하여 수행됩니다. 프레임은 전자 증식 전하 결합 카메라를 사용하여 2중 비닝으로 14비트 모드에서 캡처됩니다. 두 염료의 방출 파장을 기록하고 분할하기 위해 nm 단위의 다음 필터(예: 480/40; bs, 495; em1, 542/50; em2, 650/57)를 특징으로 하는 듀얼 뷰 모듈이 사용됩니다. 이미징 설정에는 이미지 획득을 위한 수집 허브와 이미징 소프트웨어가 포함됩니다.- 로드된 셀의 10μL를 준비된 슬라이드에 놓고 3-5분 동안 슬라이드에 부착합니다.
- 80 μL의 Ca2+ 측정 버퍼를 슬라이드에 부드럽게 추가합니다.
- 100x 오일 이멀젼 렌즈를 선택하고 이멀젼 오일을 소량 떨어뜨립니다. 현미경 테이블에 슬라이드를 놓습니다.
- 명시야 모드에서 초점을 조정하고, 서로 접촉하지 않는 최대 10개의 셀이 있는 시야를 신중하게 선택하고, 이미지를 획득합니다.
참고: 겹치거나 닿는 셀은 나중에 분석하기 어렵습니다.- 램프를 켜고, T 세포의 형광 및 로딩을 확인하고, 두 채널의 세포를 비교하여 사전 활성화되지 않았는지 확인합니다.
- 측정 전후에 명시야 채널과 형광 채널 모두의 시야를 사진으로 찍어 세포의 움직임과 로딩을 확인하십시오.
- 측정을 시작하고 5초당 1프레임의 획득 속도로 1분 동안 기초 활동을 캡처합니다.
- 1분 후 10μL의 화합물/자극제(비드 또는 자극기/억제제)를 추가하고 초당 40프레임 또는 가능한 최대 프레임 속도를 사용하여 총 3분 동안 측정합니다.
참고: 비드를 추가하는 것이 중요한 단계입니다. 슬라이드를 움직이지 않으면서 비드가 슬라이드의 여기 조명 가까이에 추가되었는지 확인하십시오. WT 및 P2x4-/- 및 P2x7-/- 마우스의 비드 접촉 시 일차 CD4+ T 세포에서 Ca2+ 마이크로도메인의 대표적인 예가 그림 2에 나와 있습니다.
5. 후처리/데이터 분석
참고: 이미지 처리 및 데이터 분석을 위해 Python 기반 오픈 소스 파이프라인 DARTS가 사용됩니다. Diercks et al.13 의 작업을 기반으로 Woelk et al.12에 의해 개발되었습니다.
- DARTS 파이프라인 설치
- Python 3.10.014, anaconda15 및 git16을 설치하고 터미널 명령 git clone을 사용하여 GitHub 리포지토리를 복제합니다 https://github.com/IPMI-ICNS-UKE/DARTS.git.
- conda create --name DARTS를 사용하여 conda 환경을 만들고 pip install <package>를 사용하여 필요한 모든 Python 패키지를 설치합니다.
참고: 자세한 내용은 DARTS GitHub 리포지토리17,18의 설치 지침을 따르십시오. - Bioformats를 사용하기 전에 Java Runtime Environment가 올바르게 설치되었는지 확인하십시오19.
- DARTS 파이프라인 사용
알림: 설치가 완료되면 터미널 창에서 DARTS를 시작할 수 있습니다.- main.py 파일이 포함된 DARTS 저장소의 로컬 복사본(cd path/to/DARTS)으로 이동합니다. conda 환경이 활성화되어 있는지 확인합니다(conda activate DARTS).
- 터미널 창에 python main.py 를 입력하고 Enter 키를 눌러 DARTS를 실행합니다.
- 그래픽 사용자 인터페이스(GUI)에서 소스 및 결과 디렉토리와 왼쪽 상단 섹션의 이미지 형식을 지정합니다( 그림 3 참조).
- scale(마이크로미터당 픽셀 수), frame rate, cell type 등과 같은 측정 속성을 정의합니다. 처리 파이프라인은 특정 이미지 데이터 및 연구 질문을 기반으로 조립할 수 있습니다.
참고: 디콘볼루션 매개변수에 대한 자세한 내용은 해당 문서20에서 확인할 수 있습니다. - 시작을 클릭하기 전에 컴퓨터의 설정을 저장하십시오. GUI에 대한 자세한 설명은 DARTS 설명서에서 확인할 수 있습니다.
- Ca2+ 마이크로도메인 이미징 및 비드 접촉
참고: 비드를 사용한 국소 이미징 및 자극 및 후속 이미지 분석을 위해 사용자는 관심 측정 기간의 시작점(t = 0)을 식별하기 위해 세포 특이적 비드 접촉을 정의해야 합니다( 그림 4 참조). bead contact는 관심 세포가 있는 (자극적) bead의 접촉 부위로 정의됩니다. 이는 (1) 비드 접촉 시간, 예를 들어, 프레임(300), (2) 셀의 중심에 대한 비드 접촉 위치, 예: 1시 방향 또는 12시 방향의 사양으로 구성된다. 현재 DARTS 버전에서는 사용자가 각 비드 접촉에 대한 정보를 수동으로 정의하고 입력해야 합니다. 다음 절차에 따라 비드 접촉을 정의합니다.- 슬라이더를 사용하여 비드와 관심 셀 사이의 접촉 시간을 정확히 찾아낼 수 있습니다.
- 오른쪽의 옵션 메뉴에서 비드 접촉(x, y, t)을 선택합니다.
- 이미지 왼쪽에서 셀과 비드가 접촉하는 지점을 선택합니다.
- 안쪽 점을 클릭하여 셀 선택을 선택합니다. 이 구슬에 의해 자극된 세포, 가급적이면 중앙을 클릭하십시오.
- ADD bead contact를 클릭합니다.
- 이 파일의 각 추가 비드 접촉에 대해 5.3.1-5.3.5단계를 반복합니다. 모든 비드 접촉이 정의되면 계속 버튼을 클릭합니다.
- 추가 파일을 계속 진행합니다. 마지막 파일에 도달하면 스크립트가 자동으로 모든 파일의 분석을 시작합니다.
- 데이터 분석
- 처리된 비율 이미지, 시간 경과에 따른 각 셀의 마이크로도메인 데이터(위치추정, 진폭, 크기 포함), 다트판 투영을 위한 소스 데이터 및 결과 폴더의 추가 리소스를 찾습니다.
- 다트판을 만들려면 스크립트 DartboardPlotGUI.py 가 포함된 DARTS 폴더(패턴: cd path/to/DARTS/src/analysis) 내의 /src/analysis/ 폴더로 이동합니다. 그런 다음 python DartboardPlotGUI.py 를 입력하고 Enter 키를 누릅니다.
- 필요한 정보가 제공되고 결과 폴더의 스프레드시트 파일이 다트판 생성을 위한 소스 파일로 정확하게 선택되었는지 확인하십시오.
결과
이 프로토콜에서는 그룹 1,13의 이전 연구를 기반으로 1차 마우스 T 세포에서 초기 Ca2+ 마이크로도메인을 이미지화하고 분석하는 업데이트된 방법을 설명했습니다. 이 접근법은 ORAI1, STIM1 및 STIM2와 같은 CRAC 채널뿐만 아니라 초기 Ca2+ 신호 이벤트에서 RyR1과 같은 세포 내 Ca2+ 방출 채널의 관여를 밝히는 데 중요한 역할을 했습니다4.
이를 위해 비자극 1차 마우스 Orai1-/-, Stim1-/-, Stim2-/-, Ryr1-/-를 이미징하여 자발적인 Ca2+ 마이크로도메인 형성을 조사하고 이를 WT 1차 마우스 T 세포와 비교했습니다. Ca2 + 마이크로 도메인 형성 분석에는 신호 시작 속도, Ca2 + 진폭 및 공초점 평면당 신호 수가 포함되었습니다. 특히, Stim2-/- T 세포를 제외하고, 모든 KO T 세포는 WT 세포에 비해 국소 Ca2+ 신호가 유의하게 감소하고 기저 유리 세포질 Ca2+ 농도가 감소한 것으로 나타났습니다. 이를 통해 Ca2+ 마이크로도메인의 형성이 ORAI1, STIM1 및 RyR14의 상호 작용과 복잡하게 연결되어 있다는 결론을 내렸습니다. 또한, 원형질막에서 자발적인 Ca2+ 마이크로도메인을 성공적으로 식별하고 특성화했습니다. 이러한 Ca2 + 마이크로 도메인은 290 nm ± 12 nm의 Ca2 + 진폭으로 특징 지어졌습니다. Ca2 + 신호에 대해 색상으로 구분 된 접근 방식을 사용하면 셀 전체에서 Ca2 + 마이크로 도메인을 시각화 할 수 있습니다. 그 결과, 밀리초 내에 볼 수 있는 Ca2+ 마이크로도메인의 빠른 시작과 이 방법이 몇 밀리초의 수명으로 Ca2+ 신호를 검출할 수 있는 능력이 더욱 강조되었다4. 이러한 자발적인 Ca2+ 마이크로도메인은 나중에 SOCE뿐만 아니라 FAK/PLC-γ/IP3 신호 캐스케이드10 및 P2X49의 관여를 통해 작용하는 접착 의존성 Ca2+ 마이크로도메인(ADCM)으로 확인되었습니다. 또한, 이 기술은 NAADP 생성 효소21인 이중 산화효소 1 및 2(DUOX1/2)와 새로 발견된 NAADP 결합 단백질23 중 하나인 HN1L/JPT22를 확인하는 데 기본이 되었습니다.
그림 2는 P2x4-/- 및 P2x7-/- 마우스뿐만 아니라 WT의 비드 접촉 시 일차 CD4+ T 세포에서 Ca2+ 마이크로도메인의 대표적인 예를 보여줍니다. 세포에 Ca2+ 염료 Fluo-4 AM 및 Fura Red AM을 로드하고 25ms(40프레임/초)의 획득 속도로 이미징했습니다. T 세포 시냅스 형성을 모방하기 위해 anti-CD3/anti-CD28 코팅 비드로 세포를 자극했습니다. 초기 Ca2+ 마이크로도메인 형성은 DARTS 파이프라인을 사용하여 비드 접촉 1초 전과 최대 15초 후에 분석되었습니다. 비드 접촉 시 WT 세포는 비드 접촉 부위에서 자극 후 첫 번째 초 내에 Ca2+ 마이크로도메인의 빠른 형성을 보여주었습니다(그림 2A). 이러한 Ca2+ 마이크로도메인은 비드 접촉 후 15초 동안 세포 전체로 더욱 확장되었습니다. WT 세포와 대조적으로, P2x4-/- 및 P2x7-/- 세포(그림 2B)는 비드 자극 시 Ca2+ 마이크로도메인 형성이 감소한 것으로 나타났으며, 비드 접촉 전 P2x4-/-a 낮은 기저 수준에 대해서도 감소한 것으로 나타났습니다. 이러한 대표적인 결과는 Brock et al.9가 이전에 발표한 결과와 일치하며, 15초 이상 비드 접촉 직후 WT T 세포에서 Ca2+ 마이크로도메인 형성이 나타나고 P2x4-/- 및 P2x7-/- 세포에서 프레임당 신호가 더 낮다는 것을 나타냅니다. 또한, P2x4-/-셀의 진폭이 크게 감소하여 접착 의존성 Ca2+ 마이크로도메인에서 퓨린성 신호전달의 역할을 더욱 확립했습니다.
또한 이 방법은 1차 인간 CD4+ T 세포에서 초기 Ca2+ 마이크로도메인을 시각화하는 데에도 사용할 수 있습니다(그림 3). 일차 쥐 T 세포와 마찬가지로 초기 Ca2+ 마이크로도메인이 비드 접촉 부위에서 유발됩니다. 그러나, 전체적인 Ca2+ 반응은 쥐 CD4+ T 세포와 비교하여 다른 시간 척도에서 발생하는 것으로 보인다.
수동 방식으로 로컬 Ca2+ 신호를 분석하는 것은 개별 조사자에게 매우 힘들고 주관적이기 때문에 실현 가능하지 않습니다. 따라서 우리는 이전에 MATLAB Simulink에서 로컬 Ca2+ 마이크로도메인을 분석하기 위한 후처리13을 위한 이미지 처리 및 최적화 도구 상자를 사용하여 알고리즘을 개발했습니다.
최근에는 소프트웨어 플랫폼 Python12를 사용하여 고해상도 라이브 셀 이미징에서 Ca2+ 마이크로도메인 분석을 위한 DARTS라는 새로운 오픈 소스 후처리 파이프라인을 개발했습니다. 여기에서 사용자의 선호도에 따라 다양한 디콘볼루션 알고리즘을 선택할 수 있으며, 형태학적 세포 형태 변화를 보상하기 위해 수행된 세포 형상 정규화, 정의된 현미경 및 측정 특정 매개변수(예: 스케일, 프레임 속도, 측정 시간)에 따라 선택할 수 있습니다(그림 4).
Ca2+ 마이크로도메인 분석을 위한 파라미터를 선택하면 각 개별 측정에 대해 두 번째 팝업 창이 열려 비드 접촉을 정의합니다(그림 5). 비드 접촉을 정의하기 위해 사용자는 슬라이더를 사용하여 tiff 파일을 수동으로 스크롤하고 비드 접촉 프레임을 개별적으로 선택할 수 있습니다. 비드 접촉은 비드 접촉 부위(그림 5, 노란색 링과 화살표로 표시된 비드 및 비드 접촉)를 클릭하고 셀을 선택하여 선택합니다. 관심 있는 각 셀에 대해 이 단계를 반복해야 합니다. 마지막으로 자동화된 이미지 후처리가 적용되고 결과 데이터가 요약되어 스프레드시트에 저장됩니다.
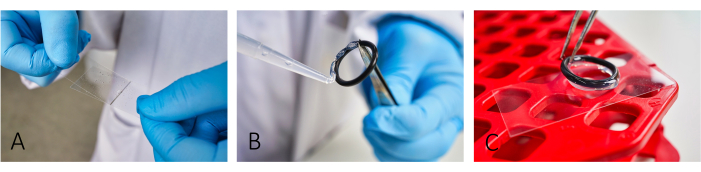
그림 1: 이미징을 위한 슬라이드 준비 작업 흐름. (A) 두 번째 유리 커버 슬립을 사용하여 슬라이드에 BSA와 PLL을 모두 추가하고 펴 바릅니다. (나,씨) 챔버를 만들려면 실리콘 그리스를 사용하여 고무 O-링을 슬라이드에 붙입니다. 챔버를 적절하게 격리하기 위해 전체 링이 얇은 그리스 층으로 덮여 있는지 확인하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
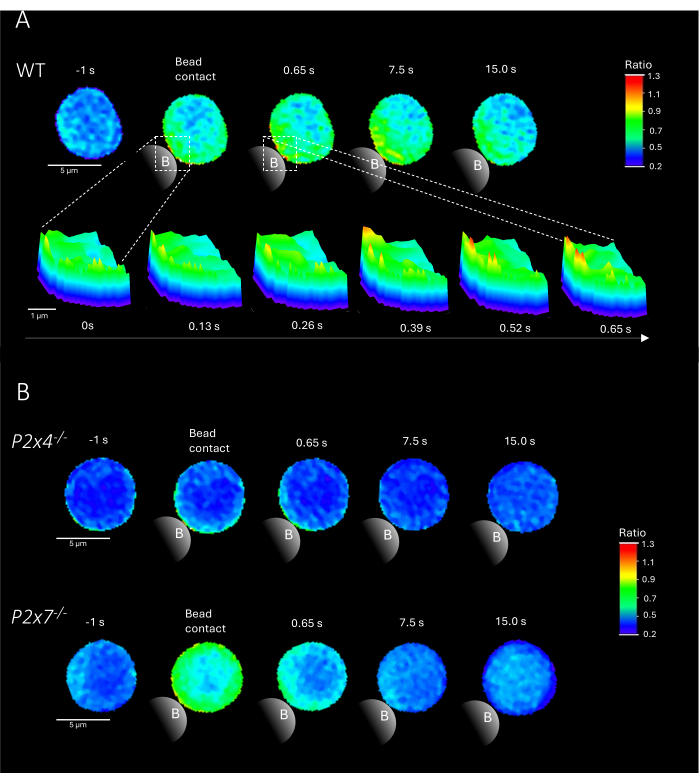
그림 2: 원발성 쥐 야생형(WT)(A), P2x4-/- 또는 P2x7-/-(B) CD4+ T 세포에서 T 세포 수용체 의존성 Ca2+ 마이크로도메인의 대표 세포. CD4+ T 세포는 위에서 설명한 대로 음성으로 분리하고 Fluo-4 AM 및 Fura Red로 로드했습니다. T 세포는 DARTS 파이프라인을 사용하여 분석되었으며, 그 결과 이전에 발표된 결과와 유사한 세포 이미지가 생성되었습니다9. (A) anti-CD3/anti-CD28 코팅 비드로 자극하기 1초 전, 자극 후 최대 15초(스케일 바 5μm) 및 비드 접촉 영역(스케일 바 1μm)에서 0초에서 0.65초까지 확대하는 3D 표면 플롯. (B) 상부 레인: 대표 P2x4-/- 비드 자극 전 1초 및 비드 자극 후 최대 15초의 1차 T 세포. 하단 레인: 대표적인 P2x7-/- 1차 T 세포 비드 자극 1초 전과 후 최대 15초. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
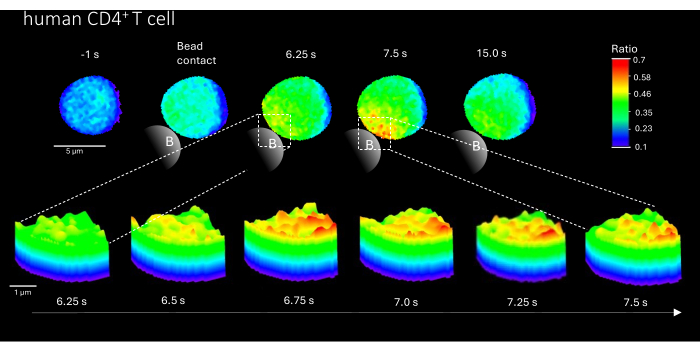
그림 3: TCR 자극 후 대표적인 일차 인간 T 세포의 Ca2+ 마이크로도메인. 일차 인간 CD4+ T 세포는 버피 코트에서 형광 활성화 세포 분류(FACS)에 의해 말초 혈액 단핵 세포(PBMC)에서 분리하고 위에서 설명한 대로 Fluo-4 AM 및 Fura Red를 로딩했습니다. 이 그림은 anti-CD3 코팅 비드로 자극하기 1초 전과 자극 후 최대 15초(눈금 막대 5μm)의 원차 인간 T 세포와 비드 접촉 영역(눈금 막대 1μm)에서 6.25초에서 7.5초까지 확대한 3D 표면 플롯을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
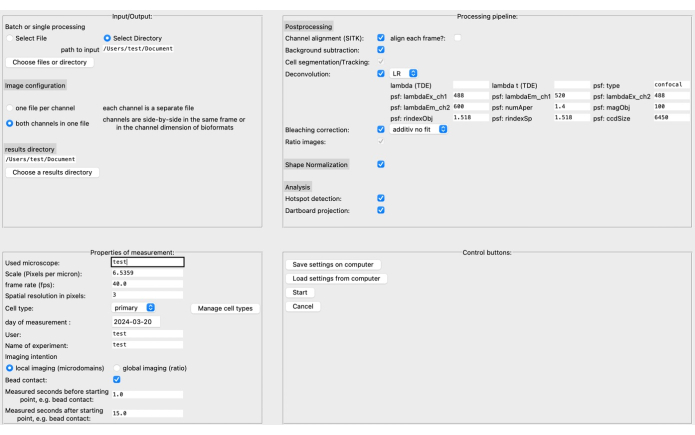
그림 4: DARTS 그래픽 사용자 인터페이스(GUI). GUI는 네 가지 영역으로 나뉩니다. 입력/출력 영역에서 소스 디렉터리 및 이미지 구성(파일당 두 개의 채널 또는 별도의 채널)과 결과 디렉터리를 포함하여 원시 데이터에 대한 정보를 제공해야 합니다. Properties of Measurement(측정 속성) 영역에서 스케일(픽셀당 미크론), 프레임 속도, 나중에 결정된 시작 지점을 기준으로 한 측정 간격과 같은 모든 관련 정보와 함께 실험을 설명해야 합니다. 다음으로, 후처리 단계, 형상 정규화 및 실제 분석(마이크로도메인 감지 및 다트판 데이터 축적)으로 구성된 처리 파이프라인을 조립할 수 있습니다. 마지막으로 설정을 컴퓨터에 저장하거나 컴퓨터에서 로드할 수 있습니다. 분석이 설정되면 시작 을 클릭하여 계속 진행합니다. 설정에 대한 자세한 내용은 https://ipmi-icns-uke.github.io/DARTS/General/Usage.html 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
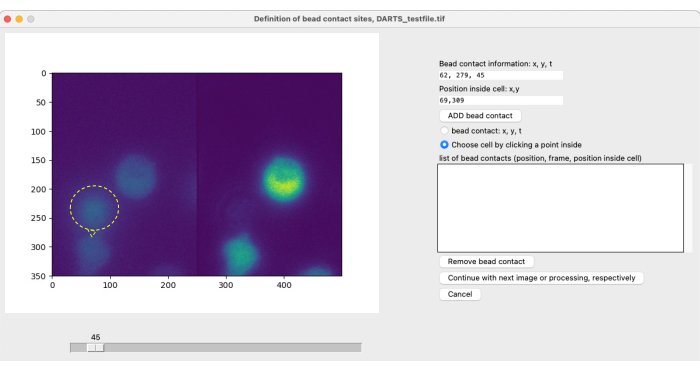
그림 5: 비드 접촉의 수동 정의. 실험 중에 비드가 셀에 추가되면 관심 세포와의 초기 비드 접촉 시간과 접촉 위치를 수동으로 정의해야 합니다. 이것은 슬라이더로 프레임을 스크롤하고 시점 t에서 위치(x,y)를 찾아 수행됩니다. 비드 연락처 정보 필드를 자동으로 채우려면 사용자는 비드 접촉 위치에서 현미경 이미지의 왼쪽 절반을 클릭합니다. 다음으로, 셀을 비드 접촉과 연결하기 위해 사용자는 비드 접촉이 있는 셀 내의 위치를 클릭합니다. ADD bead를 선택하여 정보를 확인해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
항체 코팅 비드를 통한 TCR/CD3 자극에 의해 유발된 원발성 쥐 및 인간 T 세포에서 국소 Ca2+ 마이크로도메인의 고해상도 라이브 셀 이미징을 위한 광범위한 프로토콜을 설명했습니다. 또한 사용자 친화적인 오픈 소스 Python 기반 알고리즘을 구현하여 로컬 Ca2+ 신호를 식별하고 분석했습니다. 특히, 이 프로토콜은 TCR/CD3 자극의 맥락에서 Ca2+ 마이크로도메인의 검출에 국한되지 않고 NK 세포주(KHYG-1)12 또는 TCR 독립적 Ca2+ 마이크로도메인(10,11)과 같은 다른 (면역) 세포 유형에 적용할 수 있습니다.
프로토콜 내에서 중요한 단계는 자극 비드의 크기와 수입니다. 면역 시냅스를 모방하려면 구슬의 크기가 세포와 비슷해야 합니다. 따라서 원발성 쥐 및 인간 T 세포와 세포주(Jurkat 및 KHYG1)의 경우 직경 10μm의 마그네틱 비드를 사용합니다. 또한 각 세포는 하나의 단일 구슬에 의해 자극되어야 합니다. 따라서 각 슬라이드에 추가되는 비드의 수는 한편으로는 충분해야 하지만 시야에 비드가 너무 많으면 배경이 증가하고 단일 활성화 시점과 접촉면을 감지할 수 없습니다.
이 프로토콜은 형광 Ca2+ 염료 Fluo-4 AM 및 FuraRed AM을 비율계량 방식으로 사용하므로 데이터13의 보정이 가능합니다. 또한, 이 프로토콜은 다른 Ca2+ 지시자 쌍에 적용될 수 있지만, Ca2+ 결합 역학, 세포 내 분포 및 광표백1 측면에서 선택 과정에서 주의를 기울여야 합니다. 또한 로딩 조건은 각 개별 세포 유형에 대해 개발되고 최적화되어야 하지만 여기에 표시된 농도는 좋은 시작점입니다. Ca2 + 마이크로 도메인을 시각화하려면 Ca2 + 염료의 Kd가 300-1200 nM 범위에 있어야하며 프레임 당 획득 시간은 ≤60 ms이어야합니다. 형광 강도가 너무 낮으면 필터 세트를 확인해야 하지만 T 세포에 두 배의 Ca2+ 염료를 로드하는 것도 가능합니다. 그러나 Ca2 + 염료는 다른 소기관으로 잘못 배치되거나 소포에 격리 될 수 있지만 Ca2 + 완충액으로 작용하여 Ca2 + 반응에 영향을 미칠 수도 있습니다.
분석 알고리즘의 한 가지 제한 사항은 셀의 구형이 가정된다는 것입니다. 따라서 형태가 다른 세포 유형은 분석 도구 상자의 조정이 필요할 수 있습니다. 이 알고리즘은 Jurkat T 세포 및 NK 세포주(KHYG-1)12뿐만 아니라 일차 쥐 T 세포에서 국소 Ca2+ 마이크로도메인을 분석하는 데 사용되었으며, 쥐 신경 세포주(N2a, 미공개 데이터)에 대한 Ca2+ 마이크로도메인 분석에 성공했습니다. 원칙적으로 프로토콜 및 분석 도구 상자는 HEK293 또는 HeLa 세포와 같은 비구형 세포 유형을 분석하는 데 사용할 수 있지만, 이러한 세포 유형의 경우 세포의 원형 구조 및 모양 정규화를 기반으로 하기 때문에 다트판 투영을 조정할 수 없습니다. 또한, 비드 자극 시 국부적인 초기 Ca2+ 마이크로도메인을 검출하는 프로토콜은 접착 의존성 및 TCR/CD3 독립적 Ca2+ 마이크로도메인(10,11)뿐만 아니라 용해성 활성화 또는 억제 화합물과 같은 다른 자극에서 파생된 국소 Ca2+ 신호를 분석하도록 조정할 수 있습니다. 주목할 점은 용해성 화합물 후 활성화 시작점을 결정하는 것보다 시간과 위치 측면에서 단일 비드 접촉을 정의하는 것이 더 쉽다는 것입니다.
Ca2+ 마이크로도메인 형성의 검출에 대한 일반적인 한계는 필요한 높은 시간-공간 분해능과 필요한 높은 신호 대 잡음비(SNR)에 있습니다. 현재 설정에서 파생된 해상도는 ~0.368μm의 계산된 공간 해상도와 ~40fps(초당 프레임)1의 시간 해상도에 도달합니다. 형광 염료의 개선뿐만 아니라 카메라 및 검출기 개발의 최근 발전은 미래에 더 높은 시간 및 공간 해상도를 가진 Ca2+ 지시자를 사용하여 살아있는 세포 이미징을 위한 ORAI-GECI(유전자 발현 Ca2+ 지표) 구조(24)에 대해 설명된 대로 광학 단일 채널 기록에 도달할 수 있는 가능성으로 이어질 수 있습니다.
종합하면, 여기에 설명된 고분해능 Ca2+ 마이크로도메인 이미징을 위한 프로토콜 및 분석 도구는 T 세포에서 초기 국소 Ca2+ 신호를 분석하는 데 사용할 수 있을 뿐만 아니라 이러한 세포 유형에서 국소 Ca2+ 신호의 중요성을 해독하기 위해 다른 세포 유형에도 적용할 수 있습니다.
공개
저자는 연구가 잠재적인 이해 상충으로 간주될 수 있는 상업적 또는 재정적 관계가 없는 상태에서 수행되었다고 선언합니다.
감사의 말
이 작업은 DFG(Deutsche Forschungsgemeinschaft)(프로젝트 번호 335447717; SFB1328, A02 내지 B-PD 및 RW; A14에서 ET로; 프로젝트 번호516286863 B-PD로). 저자들은 헌혈자들과 영국 수혈의학과(Department of Transfusion Medicine)의 협조에 감사를 표한다.
자료
| Name | Company | Catalog Number | Comments |
| α-CD3 | BD Pharmingen | 553058 | |
| α-CD28 | BD Pharmingen | 553295 | |
| Anaconda | Anaconda | https://docs.anaconda.com/free/anaconda/install/index.html | |
| Bovine serum albumin | Sigma-Aldrich | A2058 | |
| Cell strainer | Biofil | CSS-013-070 | 70 µm diameter |
| Countess Automated Cell Counter | Invitrogen | A49865 | |
| Cover slips | Paul Marienfeld GmbH | 101202 | |
| DARTS | GitHub | https://github.com/IPMI-ICNS-UKE/DARTS | |
| Dulbecco’s Phosphate buffered saline | Gibco, Thermo Fisher | 14190144 | |
| EasySep CD4+ T cell Isolation Kit | Stemcell | 19852 | |
| EasySep Magnetic Multistand | Stemcell | 18010 | |
| Fluo 4-AM | Invitrogen | F14201 | |
| Fura Red-AM | Invitrogen | F3020 | |
| Gibco RPMI 1640 medium | Gibco, Thermo Fisher | 11875093 | |
| Git | GitHub | https://git-scm.com/book/en/v2/Getting-Started-Installing-Git | |
| immersion oil | Leica | 11513859 | |
| Newborn calf serum | Sigma-Aldrich | N4637 | |
| Oracle | Oracle | https://www.oracle.com/de/java/technologies/downloads/ | |
| Penicillin/Streptamycin | Gibco, Thermo Fisher | 15240062 | |
| Poly-L-lysine | Sigma-Aldrich | P4707 | |
| Protein G magnetic beads | Merck | LSKMAGG02 | 10 µM diameter |
| Python | Python | https://www.python.org/downloads/ | |
| Silicon grease (basylone) | Bayer | 291-1220 | |
| Time-Dependent Entropy Deconvolution | GitHub | https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters | |
| Tween | q-biogene | TWEEN201 |
참고문헌
- Wolf, I. M. A., et al. Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor. Sci Signal. 8 (398), 102(2015).
- Taguchi, T., Mukai, K. Innate immunity signalling and membrane trafficking. Curr Opin Cell Biol. 59, 1-7 (2019).
- Trebak, M., Kinet, J. -P. Calcium signalling in T cells. Nat Rev Immunol. 19 (3), 154-169 (2019).
- Diercks, B. -P., et al. ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation. Sci Signal. 11, 0358(2018).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: Elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1 (1), 11-21 (2000).
- Kummerow, C., Junker, C., Kruse, K., Rieger, H., Quintana, A., Hoth, M. The immunological synapse controls local and global calcium signals in T lymphocytes. Immunol Rev. 231 (1), 132-147 (2009).
- Brock, V. J., et al. P2X4 and P2X7 are essential players in basal T cell activity and Ca2+ signaling milliseconds after T cell activation. Sci Adv. 8 (5), 9770(2022).
- Weiß, M., et al. Adhesion to laminin-1 and collagen IV induces the formation of Ca2+ microdomains that sensitize mouse T cells for activation. Sci Signal. 16 (790), 9405(2023).
- Diercks, B. -P. The importance of Ca2+ microdomains for the adaptive immune response. Biochim Biophys Acta Mol Cell Res. 1871 (5), 119710(2024).
- Woelk, L. -M., et al. DARTS: an open-source Python pipeline for Ca2+ microdomain analysis in live cell imaging data. Front Immunol. 14, 1299435(2024).
- Diercks, B. -P., Werner, R., Schetelig, D., Wolf, I. M. A., Guse, A. H. High-resolution calcium imaging method for local calcium signaling. Methods Mol Biol. 1929, 27-39 (2019).
- Python. Python. , Available from: https://www.python.org/downloads/ (2024).
- Anaconda. Anaconda. , Available from: https://docs.anaconda.com/free/anaconda/install/index.html (2024).
- git. git. , Available from: https://git-scm.com/book/en/v2/Getting-Started-Installing-Git (2024).
- DARTS. DARTS. , Available from: https://github.com/IPMI-ICNS-UKE/DARTS (2024).
- DARTS. DARTS GitHub Repository. , Available from: https://ipmi-icns-uke.github.io/DARTS/ (2024).
- Oracle. , Available from: https://www.oracle.com/de/java/technologies/downloads/ (2024).
- Time-Dependent Entropy Deconvolution. , Available from: https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters (2024).
- Gu, F., et al. Dual NADPH oxidases DUOX1 and DUOX2 synthesize NAADP and are necessary for Ca2+ signaling during T cell activation. Sci Signal. 14 (709), 3800(2021).
- Roggenkamp, H. G., et al. HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation. Sci Signal. 14 (675), 5647(2021).
- Heßling, L. D., Troost-Kind, B., Weiß, M. NAADP-binding proteins - Linking NAADP signaling to cancer and immunity. Biochim Biophy. Acta Mol Cell Res. 1870 (7), 119531(2023).
- Dynes, J. L., Amcheslavsky, A., Cahalan, M. D. Genetically targeted single-channel optical recording reveals multiple Orai1 gating states and oscillations in calcium influx. Proc Natl Acad Sci U S A. 113 (2), 440-445 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유