Method Article
初代T細胞における初期Ca2+ マイクロドメインのイメージング
* これらの著者は同等に貢献しました
要約
ここでは、蛍光顕微鏡法を用いて、初代マウスおよびヒトT細胞におけるCa2+マイクロドメインとして知られる初期の局所Ca2+シグナルを分離するための包括的なプロトコールを提供します。このプロトコルは、免疫細胞内のCa2+シグナル伝達経路を研究し、その機能をさらに解明するための研究者にとって貴重なリソースとして機能します。
要約
局所的なサブセカンドCa2+ シグナルは、Ca2+ マイクロドメインと呼ばれ、非常に動的で短命のCa2+ シグナルであり、その結果、全体的な[Ca2+]i 上昇を引き起こし、すでにT細胞の運命を決定している可能性があります。T細胞受容体が活性化すると、NAADPは急速に形成され、NAADP結合タンパク質(HN1L/JPT2、LSM12)およびERやリソソームなどの細胞内Ca2+ 貯蔵庫にあるそれぞれの受容体(RyR1、TPC2)に結合し、その後の[Ca2+]iの放出と上昇につながります。これらの高速で動的に発生するCa2+ シグナルを捕捉するために、Fluo-4 AMとFuraRed AMの2つのCa2+ インジケーターを組み合わせて高解像度イメージング技術を開発しました。後処理については、プログラミング言語のPythonに基づいて、オープンソースの半自動Ca2+ マイクロドメイン検出アプローチが開発されました。このワークフローを使用すると、高時間分解能および空間分解能の蛍光ビデオで、初代マウスおよびヒトT細胞の細胞内レベルでCa2+ マイクロドメインを確実に検出することができます。この方法は、NK細胞やマウス神経細胞株など、他の細胞タイプにも適用できます。
概要
提示された蛍光顕微鏡法は、Ca2+マイクロドメインと呼ばれる初代マウスT細胞における局所的で時間的な初期カルシウム(Ca2+)シグナルの可視化を可能にします。Ca2+マイクロドメインは、非常に動的で短寿命のCa2+シグナル伝達イベントを表しており、効果的なライブセルイメージングと解析に課題を提起しています1。
T細胞は、球形と直径が6~8μmと小さいため、中心と末梢の蛍光強度が相対的に異なるため、生細胞イメージングには困難です。刺激と免疫シナプスの形成により、T細胞は形態学的変化を受け、T細胞のイメージングをさらに複雑にします1。したがって、Ca2+色素の異なる特性を表す2つの画像を記録するか、2つのCa2+色素の組み合わせを利用することによって、レシオメトリック分析を採用することが不可欠になります。Ca2+マイクロドメインの厳しい特性には、その急速性、時間的、空間的に制限された性質が含まれます。これを捕捉するために、使用するCa2+色素は、可能な限り高い時間的および空間的分解能を得るために、高い基礎輝度と高い信号対雑音比(SNR)の両方を備えている必要があります。最適な結果は、2波長色素Fura Redと単一波長色素Fluo-4の組み合わせによって達成されました。Fluo-4およびFura Redを細胞にコローディングすると、二重発光波長色素の強力な光退色と二重励起色素に関連する時間遅延によってもたらされる課題が軽減され、高速画像取得への適合性が確保されます。このアプローチにより、形状の変化や微妙な動きの視覚化がさらに容易になります。また、イメージングシステムには、チャネルの小さなクラスターの開口部から発生するCa2+信号の可視化を可能にするための空間分解能の面でも特別な要求が課せられています1。
Ca2+シグナル伝達は、シナプス形成やサイトカインの産生と放出など、T細胞内の免疫機能を活性化する上で極めて重要な役割を果たします2,3。細胞の特異的な運命は、異なる発音と局所的に分布したCa2+シグナル、Ca2+マイクロドメイン3を通じて調節される。特に、これらの局所的なCa2+シグナルは、T細胞の細胞内Ca2+レベルの広範な上昇に先行し、Ca2+マイクロドメインの形成は、Ca2+の侵入と放出の両方に依存します1,4,5。T細胞受容体(TCR)/CD3を刺激すると、ニコチン酸アデニンジヌクレオチドリン酸(NAADP)、D-ミオイノシトール1,4,5-三リン酸(IP3)、環状ADPリボース(cADPR)などのCa2+放出セカンドメッセンジャーの形成が引き起こされ、細胞内Ca2+レベルが最大1 μM 6,7まで上昇します。初期のCa2+シグナル伝達イベントは、小胞体(ER)などの細胞内Ca2+貯蔵庫からのCa2+の放出に関連しており、リアノジン受容体1(RyR1)やIP3受容体(IP3R)などのチャネルがこのシグナル伝達に主に関与しています。これにより、その後、細胞外Ca2+の流入が引き起こされ、店舗で運用されるCa2+エントリー(SOCE)8を介して全体的なCa2+シグナルが生成されます。さらに、T細胞活性化9の際のCa2+シグナル伝達に関与する他のチャネル、例えば、P2X4およびP2X7チャネルはアデノシン三リン酸(ATP)依存性陽イオン流入を確保し、細胞内Ca2+の上昇に寄与しています。驚くべきことに、初期の接着依存性Ca2+マイクロドメイン(ADCM)は、TCR刺激の前にすでに形成されていますが、Ca2+の振幅と周波数は低くなっています。これらの初期のTCR非依存性Ca2+シグナルは、T細胞の炎症部位への移動に役立ち、感染部位での再刺激のためにT細胞をプライミングする可能性が最も高い10,11。
記載されているような局所的なCa2+ イメージングの方法を開発することで、T細胞活性化における初期のCa2+ シグナルの起源と意義を探るための追加のツールを得ることができました。この方法により、ユーザーは以前よりも小さく、寿命が短く、急速に発生するCa2+ シグナルを検出できます。さらに、Pythonベースの解析パイプラインであるDARTS(Deconvolution, Analysis, Registration, Tracking, and Shape normalization)により、解析ツールをより広範な利用者と共有することが可能になる12。
プロトコル
すべての動物実験は、ハンブルク・エッペンドルフ大学医療センターの動物管理・使用委員会の動物福祉ガイドラインに従って承認され、実施されました。
1. マウス初代T細胞のリンパ節および脾臓からの単離
- 倫理ガイドラインに従って無菌条件下で脾臓/リンパ節を採取し、氷冷したクリックス培地(10%子牛血清(FCS)、2 mM L-グルタミン、ペニシリン/ストレプトマイシン(P / S)100 U / mL、50 nM β-メルカプトエタノール))を入れたチューブに入れます。.
注:野生型T細胞とKOマウスT細胞は同じ方法で単離されます。 - 遠心分離機を4°Cに冷却します。
- 脾臓とリンパ節を滅菌ペトリ皿の70 μm細胞ストレーナーに入れ、脾臓分離培地(RPMI培地+ 7.5% NCS + 1% P / S)を総容量20 mLまで加えます。
- プラスチック製の乳鉢を使用して脾臓を徹底的に、しかし穏やかに破壊します。その後、細胞を50mLの遠心チューブに移します。
注:これで、合計容量20 mLが50 mL遠心チューブに入るはずです。脾臓とリンパ節は完全に破壊されるべきです。この時点から氷上で作業します。細胞を氷上に保持すると、細胞の代謝が遅くなり、細胞死が防止され、細胞が生存し、機能的に損なわれないようにすることができます。これにより、生理学的状態を長期間維持することができ、これは正確な下流実験にとって特に重要です。 - 細胞懸濁液を300 x g で4°Cで5分間遠心分離します。
- 上清を捨て、得られたペレットを2 mLのダルベッコリン酸緩衝生理食塩水(DPBS)(Ca2+ およびMg2+なし)に再懸濁します。新しい12 mL遠心チューブに移します。
2. CD4+ T細胞のネガティブセレクション
注:CD4+ T細胞のネガティブセレクションには、FcRブロッカー、非CD4+ T細胞に対するビオチン化抗体、およびストレプトアビジン被覆磁性粒子を含むT細胞単離キットが使用されます。
- T細胞単離キットから20 μL/mLのマウスFcRブロッカーを細胞懸濁液に加えます。
- さらに、マウスCD4+ T細胞単離カクテル100 μLを50 μL/mLの濃度で加え、よく混合し、室温(RT)で10分間インキュベートします。
- ストレプトアビジン被覆磁性粒子をボルテックスで30秒間渦巻き、細胞懸濁液に150μLを加えてよく混合し、室温で2分30秒間インキュベートします。
- 細胞懸濁液にDPBSを添加し、総容量7mLまで充填します。ピペットで優しく上下させてから、室温で磁石で2分30秒間インキュベートします。
- 続いて、濃縮されたT細胞を上清に穏やかに集め、新しい12 mL遠心チューブに移します。
- 細胞を300 x g で室温で5分間遠心分離します。
- 上清を捨てます。
- 単離および濃縮されたCD4+ T細胞を1 mLのDPBSに再懸濁し、完全にピペッティングして下降します。混合物をRTの磁石で2分30秒間インキュベートし、ビーズの汚染がないことを確認します。
- 上清を採取し、新しい遠心チューブに移し、濃縮されたT細胞を数えます。
- 細胞をカウントするには、細胞をトリパンブルーで染色し、自動セルカウンターを使用してカウントします。
注:単離されたCD4+ T細胞を直接ロードし、単離の同じ日にそれらをイメージングするのが最善です。ただし、初代マウスT細胞は、インキュベーターで37°C、5%CO2 の分離培地(RPMI 1640 + 10% FCS + P / S)で一晩刺激なしで培養できます。
3. マウスCD4+ T初代細胞のローディング
注:遊離細胞質Ca2+ 濃度を測定するために、Ca2+ イメージング実験では蛍光色素および膜透過性色素が使用されます。Fluo-4-アセトキシメチルエステル(AM)とレシオメトリック染料Fura Red-AMの組み合わせは、局所的なCa2+ シグナルの迅速な検出の指標として機能します。蛍光染料を使用しながら、暗闇で作業するようにしてください。
- 2-5 x 106 細胞を5分間、300 x gで遠心分離し、上清を廃棄し、10 μM Fluo-4-AM(ストック:[1 mM])および20 μM Fura Red-AM(ストック:[4 mM])を含む480 μLのT細胞培地(RPMI 1640、10% FCS)に再懸濁します。
- 最初に暗闇のベンチの下のRTで20分間インキュベートし、ハヤブサをアルミホイルで覆います。
注:Ca2+ インジケーターはDMSOで希釈されているため、最初のインキュベーション時間を超えないようにしてください。ローディング後は、色素の光感受性により、細胞を光から遮蔽してください。 - 最初の20分間のインキュベーションの終了時に、2 mLのT細胞培地を細胞に加え、室温で暗所でさらに30分間インキュベーションを続けます。
- 細胞懸濁液を300 x g でRTで5分間遠心分離します。
- 上清を捨て、ペレットを2 mLのCa2+ 測定バッファー(140 mM NaCl、5 mM KCl、1 mM MgSO4、1 mM CaCl2、20 mM HEPES、1 mM NaH2PO4、5 mM グルコース、pH 7.4)で洗浄し、続いて300 x g でRTで5分間遠心分離します。
- 最後に、上清を捨て、Ca2+ 測定バッファーで再懸濁します。細胞数を 10 μL あたり ~100,000 細胞に調整します。
注:1回の測定に10μLの容量が使用されます。測定条件に最適な細胞数に到達するために、顕微鏡下で細胞数をさらに調整する必要がある可能性があるため、細胞を過度に希釈することは避けてください。 - 細胞を~20分間インキュベートして、色素の完全な細胞浸潤と脱エステル化を確保します。細胞は測定まで氷上および暗闇で保管します。
注:ロードされた初代マウスT細胞は、ロード後~4時間まで使用できます。
4. ローカルCa2+ イメージング
- スライドの準備
- 顕微鏡カバースリップ(24 mm x 46 mm)にウシ血清アルブミン(BSA、5 mg/mL)およびポリ-L-リジン(PLL、0.1 mg/mL)をコーティングします(図1A)。BSA を ~20 分間放置してから、PLL を適用します。
注:コーティングは細胞接着を促進します。適切な細胞接着のためには、BSAとPLLの両方を正確に広げて、縞が見えなくなるまでします。 - 反応チャンバーを作成するには、シリコンペーストを使用して、再利用可能なゴム製Oリングをスライドに接着します(図1B、C)。
注:35 mmスライド、再利用可能な金属チャンバー、8ウェル、24ウェル、48ウェルプレートなどの他のスライド/チャンバーまたはプレートを画像取得に使用できます。
- 顕微鏡カバースリップ(24 mm x 46 mm)にウシ血清アルブミン(BSA、5 mg/mL)およびポリ-L-リジン(PLL、0.1 mg/mL)をコーティングします(図1A)。BSA を ~20 分間放置してから、PLL を適用します。
- プロテインG磁気ビーズ(直径10μm)の抗体コーティング
- タンパク質磁気ビーズ懸濁液を穏やかに混合し、12.5 μLを新しいチューブに移します。
- チューブを磁気スタンドに置いてストレージバッファーを取り外し、ビーズを磁石に移動します。ストレージバッファーを磁石の反対側にピペッティングして、静かに取り外します。
- 残っている保存バッファーを除去するには、500 μLのPBS-T(PBS、0.1% Tween)を加えてビーズを洗浄し、10秒間ボルテックスします。チューブを再び磁気スタンドに置き、バッファーを取り外します。
- ビーズを抗体でコーティングするには、ビーズを7.5 μLのPBS-Tに再懸濁し、5 μLの抗CD3(0.5 mg/mL)と抗CD28(0.5 mg/mL)をそれぞれ加えます。RTで連続混合しながら30〜60分間インキュベートします。
- コーティングされたビーズを500μLのPBS-Tで3回洗浄し、続いて磁気スタンドを使用して500μLのCa2+測定バッファーで1回洗浄します。
- ビーズを200-400 μLのCa2+測定バッファーに再懸濁します。
注:測定中にビーズ密度を確認し、必要に応じてさらに希釈します。
- 局所Ca2+ イメージング顕微鏡
注:イメージングは、光源としてキセノンアークランプを装備した100倍率の明視野光学顕微鏡を使用して行われます。フレームは、電子増倍電荷結合カメラを使用して2倍ビニングで14ビットモードでキャプチャされます。両方の色素の発光波長を記録および分割するために、nm単位のフィルター(例:480/40、bs、495、em1、542/50、em2、650/57)を備えたデュアルビューモジュールが採用されています。イメージングセットアップには、画像取得用の取得ハブとイメージングソフトウェアが含まれています。- 準備したスライドに10μLのロードセルを置き、スライドに3〜5分間取り付けます。
- 80 μLのCa2+ 測定バッファーをスライドに穏やかに加えます。
- 100倍オイル浸漬レンズを選択し、少量の浸漬油を塗布します。スライドを顕微鏡テーブルに置きます。
- 明視野モードで焦点を調整し、互いに接触していない最大10個のセルを含む視野を慎重に選択し、画像を取得します。
注:セルが重なったり接触したりしていると、後で分析するのが難しくなります。- ランプを点灯し、T細胞の蛍光と負荷を確認し、両方のチャネルの細胞を比較して、それらが事前に活性化されていないことを確認します。
- 測定の前後に明視野と蛍光チャネルの両方の視野の写真を撮って、細胞の動きと負荷を確認してください。
- 測定を開始し、5 秒あたり 1 フレームの取得速度で 1 分間基礎活動をキャプチャします。
- 1分後に10 μLの化合物/刺激剤(ビーズまたは刺激装置/阻害剤)を添加し、40フレーム/秒または可能な最大フレームレートを使用して合計3分間測定します。
注:ビーズの追加は重要なステップです。スライドを動かさずに、ビーズがスライド上の励起光の近くに追加されることを確認してください。WTマウス、P2x4-/-マウス、P2x7-/-マウスのビーズ接触による初代CD4+ T細胞のCa2+マイクロドメインの代表例を図2に示します。
5. 後処理/データ分析
注: 画像処理とデータ分析には、Python ベースのオープンソース パイプライン DARTS が使用されます。これは、Diercks et al.13 の研究に基づいて Woelk et al.12 によって開発されました。
- DARTSパイプラインの設置
- Python 3.10.014、anaconda15、git16 をインストールし、ターミナル コマンド git clone: を使用して GitHub リポジトリをクローンします https://github.com/IPMI-ICNS-UKE/DARTS.git
- conda create --name DARTSを使用してconda環境を作成し、pip install を使用して必要なすべてのPythonパッケージをインストールします。
注:詳細については、DARTS GitHubリポジトリ17,18のインストール手順に従ってください。 - Bioformatsを使用する前に、Javaランタイム環境が正しくインストールされていることを確認してください19。
- DARTSパイプラインの使用
注:インストールが完了すると、DARTSはターミナルウィンドウから起動できます。- main.py ファイルが含まれているDARTSリポジトリのローカルコピー(cd path/to/DARTS)に移動します。conda環境がアクティブになっていることを確認します(conda activate DARTS)。
- ターミナルウィンドウに python main.py と入力し、Enterキーを押してDARTSを実行します。
- グラフィカルユーザーインターフェース(GUI)で、ソースと結果ディレクトリ、および左上の画像形式を指定します( 図3を参照)。
- スケール(マイクロメートルあたりのピクセル数)、フレームレート、セルタイプなど、測定のプロパティを定義します。処理パイプラインは、特定の画像データと研究課題に基づいて組み立てることができます。
注: デコンボリューション パラメーターの詳細については、たとえば、対応するドキュメント20 を参照してください。 - [スタート]をクリックする前に、コンピューターに設定を保存します。GUIの詳細については、DARTSのドキュメントを参照してください。
- Ca2+ マイクロドメインイメージングおよびビーズコンタクト
注:ビーズによる局所イメージングと刺激、およびその後の画像解析では、細胞特異的なビーズの接触をユーザーが定義して、対象の測定期間の開始点(t = 0)を特定する必要があります( 図4を参照)。ビーズ接触は、目的の細胞との(刺激性)ビーズの接触部位として定義されます。これは、(1)ビーズ接触時間、例えばフレーム300、および(2)セルの中心に対するビード接触位置、例えば、1時または12時の位置の仕様からなる。現在のDARTSバージョンでは、ユーザーは各ビード接触の情報を手動で定義して入力する必要があります。ビード接触を定義するには、以下の手順に従います。- スライダーを使用して、ビーズと目的のセルとの間の接触時間を特定します。
- 右側のオプションメニューで、 ビード接触(x、y、t)を選択します。
- 画像の左側で、セルとビーズが接触するスポットを選択します。
- [セルの選択] を選択するには 、内部のポイントをクリックします。このビーズによって刺激された細胞、できれば中央をクリックします。
- [ADD bead contact]をクリックします。
- このファイル内の追加のビード接触ごとに、手順5.3.1〜5.3.5を繰り返します。すべてのビード接触を定義したら、[ 続行 ]ボタンをクリックします。
- 追加のファイルに進みます。最後のファイルに到達すると、スクリプトはすべてのファイルの分析を自動的に開始します。
- データ分析
- 処理された比率画像、各セルの経時的なマイクロドメインデータ(ローカリゼーション、振幅、サイズを含む)、ダーツボード投影のソースデータ、および結果フォルダ内のその他のリソースを見つけます。
- ダーツボードを作成するには、スクリプト DartboardPlotGUI.py が含まれているDARTSフォルダ内のフォルダ/src/analysis/(パターン:cd path/to/DARTS/src/analysis)に移動します。次に、「python DartboardPlotGUI.py」と入力して Enter キーを押します。
- 必要な情報が提供されていること、および結果フォルダのスプレッドシートファイルがダーツボード生成のソースファイルとして正確に選択されていることを確認します。
結果
このプロトコルでは、私たちのグループによる以前の研究に基づいて、初代マウスT細胞の初期Ca2+マイクロドメインを画像化および分析するための更新された方法を概説しました1,13。このアプローチは、初期のCa2+シグナル伝達イベントにおけるORAI1、STIM1、STIM2などのCRACチャネル、およびRyR1などの細胞内Ca2+放出チャネルの関与を解明するのに役立ちました4。
そのために、非刺激初代マウスOrai1-/-、Stim1-/-、Stim2-/-、およびRyr1-/-をイメージングすることにより、自発的なCa2+マイクロドメイン形成を調査し、それらをWT初代マウスT細胞と比較しました。Ca2+マイクロドメイン形成の解析には、シグナル開始速度、Ca2+振幅、共焦点面あたりのシグナル数が含まれていました。特に、Stim2-/-T細胞を除いて、すべてのKO T細胞は、WT細胞と比較して、局所Ca2+シグナルの有意な減少と基礎遊離細胞質Ca2+濃度の低下を示しました。このことから、Ca2+ミクロドメインの形成は、ORAI1、STIM1、およびRyR14の相互作用と複雑に関連していると結論付けました。さらに、原形質膜における自発的なCa2+マイクロドメインの同定と特性評価に成功しました。これらのCa2+マイクロドメインは、290 nm±12 nmのCa2+振幅によって特徴付けられました。Ca2+シグナルに色分けされたアプローチを利用することで、細胞全体のCa2+マイクロドメインを可視化することができました。その結果、Ca2+マイクロドメインが数ミリ秒以内に急速に発現し、この方法が数ミリ秒の長寿命でCa2+シグナルを検出する能力がさらに強調されました4。これらの自発的なCa2+マイクロドメインは、後に接着依存性Ca2+マイクロドメイン(ADCM)として同定され、SOCEだけでなく、FAK/PLC-γ/IP3シグナル伝達カスケード10およびP2X49の関与を介しても作用します。さらに、この技術は、NAADP産生酵素21としてデュアルオキシダーゼ1および2(DUOX1/2)を、新たに発見されたNAADP結合タンパク質23の1つとしてHN1L/JPT22を確認するための基本的なものでした。
図2は、WTおよびP2x4-/-およびP2x7-/-マウスからのビーズ接触時の初代CD4+ T細胞におけるCa2+マイクロドメインの代表的な例を示しています。細胞にCa2+色素Fluo-4 AMおよびFura Red AMをロードし、25 ms(40 frame/s)の取得速度でイメージングしました。T細胞のシナプス形成を模倣するために、細胞を抗CD3/抗CD28コーティングビーズで刺激した。初期のCa2+マイクロドメイン形成は、DARTSパイプラインを使用してビーズ接触の1秒前と最大15秒後に分析しました。ビーズ接触後、WT細胞は、ビーズ接触部位での刺激後の最初の1秒間にCa2+マイクロドメインの急速な形成を示しました(図2A)。これらのCa2+マイクロドメインは、ビーズ接触後15秒で細胞全体にさらに拡大しました。WT細胞とは対照的に、P2x4-/-細胞およびP2x7-/-細胞(図2B)は、ビーズ刺激時にCa2+マイクロドメイン形成の減少を示し、ビーズ接触前のP2x4-/-a下部基底レベルでも減少しました。これらの代表的な知見は、Brockら9が以前に発表した結果と一致しており、ビーズ接触直後のWT T細胞におけるCa2+マイクロドメイン形成が15秒以上で、P2x4-/-およびP2x7-/-細胞のフレームあたりのシグナルが低いことを示しています。さらに、P2x4-/-細胞の振幅は大幅に減少し、接着依存性Ca2+マイクロドメインにおけるプリン作動性シグナル伝達の役割をさらに確立しました。
さらに、この方法は、初代ヒトCD4+ T細胞の初期Ca2+マイクロドメインを可視化するためにも使用できます(図3)。初代マウスT細胞に沿って、ビーズ接触部位に初期Ca2+マイクロドメインが誘発されます。しかし、全体的なCa2+応答は、マウスのCD4+ T細胞とは異なる時間スケールで起こるようです。
ローカルの Ca2+ シグナルを手動で分析することは、個々の研究者にとって非常に面倒で主観的であるため、実行可能ではありません。そのため、MATLAB Simulink で、ローカルの Ca2+ マイクロドメインを解析するための後処理13 用の画像処理および最適化ツールボックスを使用して、アルゴリズムを以前に開発しました。
最近、ソフトウェアプラットフォームPython12を使用した高解像度ライブセルイメージングでのCa2+マイクロドメイン解析のためのDARTSと呼ばれる新しいオープンソースの後処理パイプラインを開発しました。ここでは、ユーザーの好みに応じて、さまざまなデコンボリューションアルゴリズムを選択し、形態学的細胞形状の変化を補正するために実行される細胞形状の正規化、および顕微鏡および測定固有のパラメータ(スケール、フレームレート、測定時間など)を定義できます(図4)。
Ca2+ マイクロドメイン解析のパラメータを選択すると、ビーズの接触を定義するために、個々の測定ごとに2つ目のポップアップウィンドウが開きます(図5)。ビード接触を定義するには、スライダーを使用してtiffファイルを手動でスクロールし、ビード接触フレームを個別に選択します。ビーズ接触は、ビーズ接触部位(図5、ビーズとビーズ接触は黄色のリングと矢印で示される)をクリックし、セルを選択することによって選択されます。この手順は、対象のセルごとに繰り返す必要があります。最後に、自動化された画像後処理が適用され、結果データが集計されてスプレッドシートに保存されます。
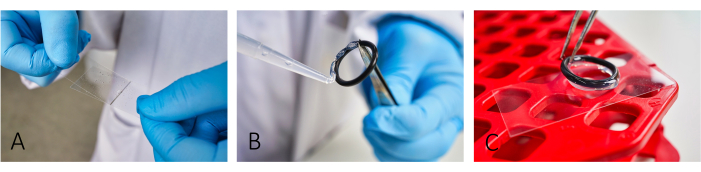
図1:イメージング用のスライド調製のワークフロー。 (A)2枚目のガラスカバースリップを使用して、BSAとPLLの両方をスライドに追加して広げます。(B,C)チャンバーを構築するには、シリコングリースを使用してゴム製のOリングをスライドに接着します。チャンバーを適切に隔離するために、リング全体が薄いグリースの層で覆われていることを確認してください。この図の拡大版を表示するには、ここをクリックしてください。
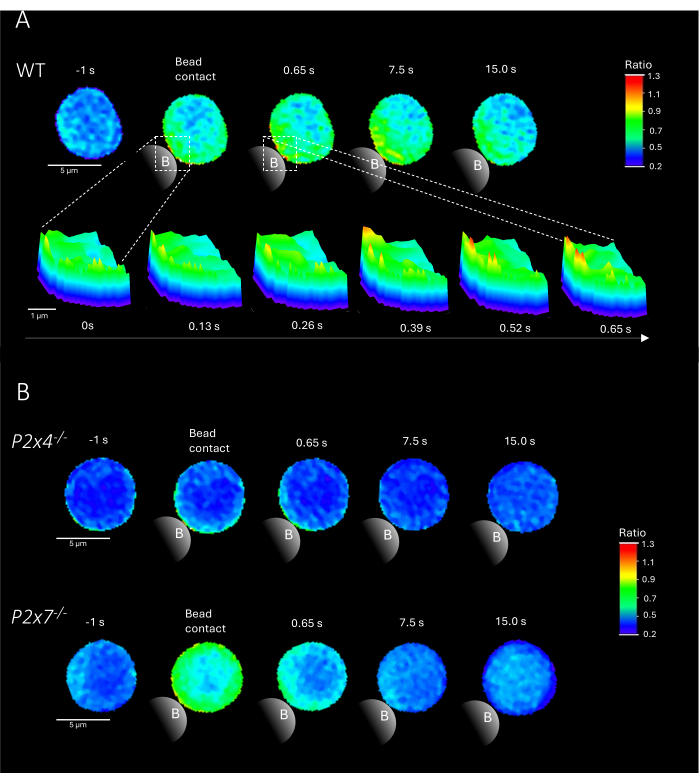
図2:初代マウス野生型(WT)(A)、P2x4-/-またはP2x7-/-(B)CD4+ T細胞におけるT細胞受容体依存性Ca2+マイクロドメインの代表細胞。CD4+ T細胞は、上記のように負に単離され、Fluo-4 AMおよびFura Redがロードされました。T細胞はDARTSパイプラインを使用して分析され、以前に発表された結果と同等の細胞画像が得られました9。(A)WT初代T細胞を抗CD3/抗CD28コーティングビーズによる刺激の1秒前および刺激の最大15秒後(スケールバー5μm)、およびビーズ接触領域の0秒から0.65秒までのズームインの3D表面プロット(スケールバー1μm)。(B)アッパーレーン:ビーズ刺激の1秒前と15秒後までの代表的なP2x4-/-初代T細胞。下側レーン:ビーズ刺激の1秒前と15秒後までの代表的なP2x7-/-初代T細胞。この図の拡大版を表示するには、ここをクリックしてください。
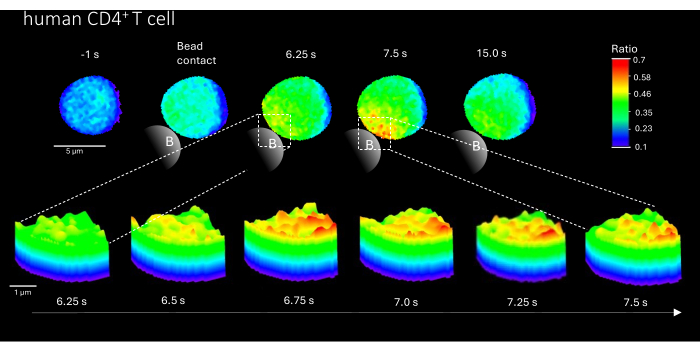
図3:TCR刺激後の代表的な初代ヒトT細胞におけるCa2+ マイクロドメイン。 初代ヒトCD4+ T細胞は、バフィーコートからの蛍光活性化細胞選別(FACS)により末梢血単核細胞(PBMC)から単離され、上記のようにFluo-4 AMおよびFura Redをロードした。図は、抗CD3コーティングビーズによる刺激の1秒前と刺激の最大15秒後(スケールバー5μm)の初代ヒトT細胞と、ビーズ接触領域での6.25秒から7.5秒までのズームイン(スケールバー1μm)の3D表面プロットを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
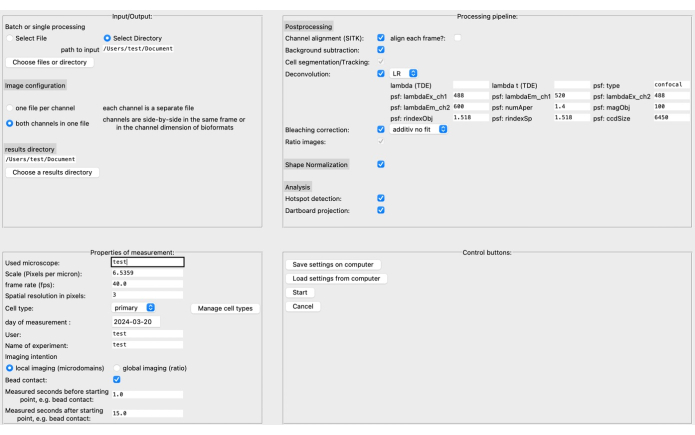
図4:DARTSグラフィカルユーザーインターフェース(GUI)。 GUI は 4 つの領域に分かれています。 [Input/Output] 領域では、ソース ディレクトリとイメージ設定 (ファイルごとに 2 つのチャネルまたは個別のチャネル)、結果ディレクトリなど、生データに関する情報を指定する必要があります。 [測定のプロパティ]領域では、スケール(ピクセルあたりのミクロン数)、フレームレート、後で決定された開始点を基準とした測定間隔など、すべての関連情報とともに実験を説明する必要があります。次に、後処理ステップ、形状正規化、および実際の解析(マイクロドメイン検出とダーツボードデータ蓄積)で構成される処理パイプラインを組み立てることができます。最後に、設定をコンピューターに保存したり、コンピューターからロードしたりできます。解析を設定したら、[ 開始 ]をクリックして続行します。セットアップの詳細については、https://ipmi-icns-uke.github.io/DARTS/General/Usage.html を参照してください。この図の拡大版を表示するには、ここをクリックしてください。
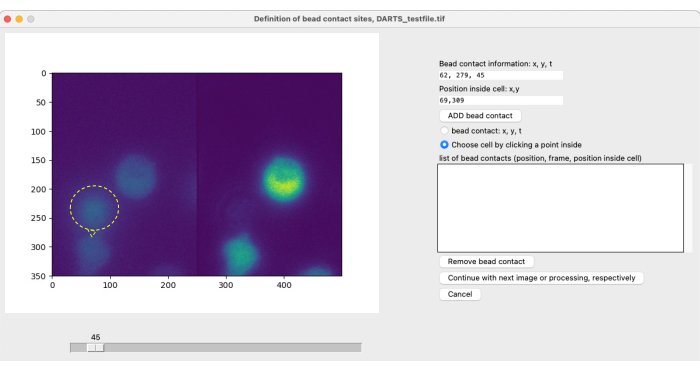
図5:ビード接点の手動定義。実験中にビーズを細胞に添加する場合、目的の細胞との最初のビーズ接触時間と接触位置を手動で定義する必要があります。これは、スライダーでフレームをスクロールし、ある時点 t の位置 (x,y) を見つけることによって行われます。ビーズの連絡先情報フィールドを自動的に入力するには、ユーザーは顕微鏡画像の左半分のビーズ接触位置をクリックします。次に、セルをビード接触に関連付けるために、ユーザーはビーズ接触を持つセル内の位置をクリックします。情報は、[ADD bead]を選択して確認する必要があります。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
私たちは、抗体コーティングビーズを介したTCR/CD3刺激によってトリガーされる初代マウスおよびヒトT細胞の局所Ca2+マイクロドメインの高解像度ライブセルイメージングのための広範なプロトコルについて説明しました。さらに、ユーザーフレンドリーなオープンソースのPythonベースのアルゴリズムを実装して、ローカルのCa2+信号を識別および分析しました。特に、このプロトコルは、TCR/CD3刺激の文脈におけるCa2+マイクロドメインの検出に限定されず、NK細胞株(KHYG-1)12またはTCR非依存性のCa2+マイクロドメイン10,11などの他の(免疫)細胞タイプに適応可能である。
プロトコール内の重要なステップは、刺激ビーズのサイズと数です。免疫シナプスを模倣するには、ビーズのサイズが細胞と同程度である必要があります。したがって、初代マウスT細胞とヒトT細胞、および細胞株(JurkatおよびKHYG1)には、直径10μmの磁気ビーズを使用します。さらに、各細胞は1つのビーズによって刺激されるべきです。したがって、各スライドに追加されるビーズの数は、一方では十分であるべきですが、視野内にビーズが多すぎると背景が大きくなり、単一の活性化時間点と接触側を検出することができません。
このプロトコルは、蛍光Ca2+ 色素Fluo-4 AMおよびFuraRed AMをレシオメトリック方式で利用するため、データ13のキャリブレーションが可能です。さらに、このプロトコルは他のCa2+ インジケーターペアに適合させることができますが、Ca2+ 結合速度、細胞内分布、および光退色1の観点から、選択プロセスには注意が必要です。さらに、負荷条件は個々の細胞タイプごとに開発および最適化する必要がありますが、ここに示す濃度は適切な出発点です。Ca2+ マイクロドメインを可視化するには、Ca2+ 色素のKdが300〜1200 nMの範囲にあり、フレームあたりの取得時間が≤60 msである必要があります。蛍光強度が低すぎるとフィルターセットのチェックが必要になりますが、T細胞に2倍の量のCa2+ 色素をロードすることも可能です。しかし、Ca2+ 色素は他のオルガネラに誤って配置されたり、小胞に隔離されたりする可能性がありますが、Ca2+ バッファーとしても機能し、Ca2+ 応答に影響を与える可能性があります。
解析アルゴリズムの 1 つの制限は、セルの球形が想定されることです。したがって、形態の異なる細胞タイプには、解析ツールボックスの適応が必要になる場合があります。このアルゴリズムは、初代マウスT細胞、Jurkat T細胞、NK細胞株(KHYG-1)12の局所Ca2+マイクロドメインの解析に使用されており、マウス神経細胞株(N2a、未発表データ)のCa2+マイクロドメインの解析に成功しました。原則として、プロトコルと解析ツールボックスは、HEK293細胞やHeLa細胞などの非球状細胞タイプの解析に使用できますが、これらの細胞タイプでは、細胞の丸い構造と形状の正規化に基づいているため、ダーツボード投影を適応させることはできません。さらに、ビーズ刺激時に局在する初期Ca2+マイクロドメインを検出するプロトコルは、他の刺激、例えば可溶性活性化または阻害化合物、ならびに接着依存性およびTCR/CD3非依存性のCa2+マイクロドメイン10,11に由来する局所Ca2+シグナルを分析するために適合させることができる。注目すべきは、可溶性化合物の活性化開始点を決定するよりも、時間と位置の観点から単一のビーズ接触を定義する方が容易であることです。
Ca2+マイクロドメイン形成の検出における一般的な制限は、必要な高い時間空間分解能と必要な高い信号対雑音比(SNR)にあります。現在、私たちのセットアップから導き出された解像度は、計算された空間解像度~0.368μm、時間分解能~40フレーム/秒(fps)1に達しています。近年のカメラや検出器の開発の進歩、蛍光色素の改良により、将来的には、より高い時間分解能と空間分解能を持つCa2+インジケーターを用いた生細胞イメージングのためのORAI-GECI(genetically expressed Ca2+ indicators)コンストラクト24に記載されているように、光学的シングルチャネル記録に到達する可能性がある。
まとめると、ここで説明する高分解能Ca2+ マイクロドメインイメージングのプロトコルと解析ツールは、T細胞の初期局所Ca2+ シグナルの解析だけでなく、他の細胞タイプにも適応させて、T細胞の局所Ca2+ シグナル伝達の重要性を解読することができます。
開示事項
著者らは、この研究は、潜在的な利益相反と見なされる可能性のある商業的または金銭的関係がない状態で実施されたと宣言します。
謝辞
この研究は、ドイツ研究振興協会(DFG)(プロジェクト番号335447717;SFB1328、A02からB-PDおよびRW。A14からET;プロジェクト番号516286863 B-PDへ)。著者らは、献血者とUKEの輸血医学部門の協力に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| α-CD3 | BD Pharmingen | 553058 | |
| α-CD28 | BD Pharmingen | 553295 | |
| Anaconda | Anaconda | https://docs.anaconda.com/free/anaconda/install/index.html | |
| Bovine serum albumin | Sigma-Aldrich | A2058 | |
| Cell strainer | Biofil | CSS-013-070 | 70 µm diameter |
| Countess Automated Cell Counter | Invitrogen | A49865 | |
| Cover slips | Paul Marienfeld GmbH | 101202 | |
| DARTS | GitHub | https://github.com/IPMI-ICNS-UKE/DARTS | |
| Dulbecco’s Phosphate buffered saline | Gibco, Thermo Fisher | 14190144 | |
| EasySep CD4+ T cell Isolation Kit | Stemcell | 19852 | |
| EasySep Magnetic Multistand | Stemcell | 18010 | |
| Fluo 4-AM | Invitrogen | F14201 | |
| Fura Red-AM | Invitrogen | F3020 | |
| Gibco RPMI 1640 medium | Gibco, Thermo Fisher | 11875093 | |
| Git | GitHub | https://git-scm.com/book/en/v2/Getting-Started-Installing-Git | |
| immersion oil | Leica | 11513859 | |
| Newborn calf serum | Sigma-Aldrich | N4637 | |
| Oracle | Oracle | https://www.oracle.com/de/java/technologies/downloads/ | |
| Penicillin/Streptamycin | Gibco, Thermo Fisher | 15240062 | |
| Poly-L-lysine | Sigma-Aldrich | P4707 | |
| Protein G magnetic beads | Merck | LSKMAGG02 | 10 µM diameter |
| Python | Python | https://www.python.org/downloads/ | |
| Silicon grease (basylone) | Bayer | 291-1220 | |
| Time-Dependent Entropy Deconvolution | GitHub | https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters | |
| Tween | q-biogene | TWEEN201 |
参考文献
- Wolf, I. M. A., et al. Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor. Sci Signal. 8 (398), 102(2015).
- Taguchi, T., Mukai, K. Innate immunity signalling and membrane trafficking. Curr Opin Cell Biol. 59, 1-7 (2019).
- Trebak, M., Kinet, J. -P. Calcium signalling in T cells. Nat Rev Immunol. 19 (3), 154-169 (2019).
- Diercks, B. -P., et al. ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation. Sci Signal. 11, 0358(2018).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: Elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1 (1), 11-21 (2000).
- Kummerow, C., Junker, C., Kruse, K., Rieger, H., Quintana, A., Hoth, M. The immunological synapse controls local and global calcium signals in T lymphocytes. Immunol Rev. 231 (1), 132-147 (2009).
- Brock, V. J., et al. P2X4 and P2X7 are essential players in basal T cell activity and Ca2+ signaling milliseconds after T cell activation. Sci Adv. 8 (5), 9770(2022).
- Weiß, M., et al. Adhesion to laminin-1 and collagen IV induces the formation of Ca2+ microdomains that sensitize mouse T cells for activation. Sci Signal. 16 (790), 9405(2023).
- Diercks, B. -P. The importance of Ca2+ microdomains for the adaptive immune response. Biochim Biophys Acta Mol Cell Res. 1871 (5), 119710(2024).
- Woelk, L. -M., et al. DARTS: an open-source Python pipeline for Ca2+ microdomain analysis in live cell imaging data. Front Immunol. 14, 1299435(2024).
- Diercks, B. -P., Werner, R., Schetelig, D., Wolf, I. M. A., Guse, A. H. High-resolution calcium imaging method for local calcium signaling. Methods Mol Biol. 1929, 27-39 (2019).
- Python. Python. , Available from: https://www.python.org/downloads/ (2024).
- Anaconda. Anaconda. , Available from: https://docs.anaconda.com/free/anaconda/install/index.html (2024).
- git. git. , Available from: https://git-scm.com/book/en/v2/Getting-Started-Installing-Git (2024).
- DARTS. DARTS. , Available from: https://github.com/IPMI-ICNS-UKE/DARTS (2024).
- DARTS. DARTS GitHub Repository. , Available from: https://ipmi-icns-uke.github.io/DARTS/ (2024).
- Oracle. , Available from: https://www.oracle.com/de/java/technologies/downloads/ (2024).
- Time-Dependent Entropy Deconvolution. , Available from: https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters (2024).
- Gu, F., et al. Dual NADPH oxidases DUOX1 and DUOX2 synthesize NAADP and are necessary for Ca2+ signaling during T cell activation. Sci Signal. 14 (709), 3800(2021).
- Roggenkamp, H. G., et al. HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation. Sci Signal. 14 (675), 5647(2021).
- Heßling, L. D., Troost-Kind, B., Weiß, M. NAADP-binding proteins - Linking NAADP signaling to cancer and immunity. Biochim Biophy. Acta Mol Cell Res. 1870 (7), 119531(2023).
- Dynes, J. L., Amcheslavsky, A., Cahalan, M. D. Genetically targeted single-channel optical recording reveals multiple Orai1 gating states and oscillations in calcium influx. Proc Natl Acad Sci U S A. 113 (2), 440-445 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved