Method Article
הדמיה ראשונית של מיקרודומיינים Ca2+ בתאי T ראשוניים
* These authors contributed equally
In This Article
Summary
כאן, אנו מספקים פרוטוקול מקיף לפתרון אותות Ca2+ מקומיים ראשוניים, המכונים מיקרו-דומיינים Ca2+ , בתאי מורין ראשוניים ובתאי T אנושיים באמצעות מיקרוסקופ פלואורסצנטי. פרוטוקול זה משמש כמשאב רב ערך לחוקרים הבוחנים מסלולי איתות Ca2+ בתוך תאי מערכת החיסון ולפענח עוד יותר את תפקודם.
Abstract
אותות Ca2+ מקומיים, תת-שנייה, המכונים מיקרו-דומיינים Ca2+ , הם אותות Ca2+ דינמיים מאוד וקצרי מועד, הגורמים לעלייה גלובלית [Ca2+] i ועשויים כבר לקבוע את גורלו של תא T. עם הפעלת קולטן תאי T, NAADP נוצר במהירות, נקשר לחלבונים קושרי NAADP (HN1L/JPT2, LSM12) ולקולטנים המתאימים שלהם (RyR1, TPC2) היושבים על מאגרי Ca2+ תוך תאיים, כמו ER וליזוזומים, ומוביל לשחרור והעלאה הבאים של [Ca2+]i. כדי ללכוד אותות Ca2+ מהירים ודינמיים אלה, פיתחנו טכניקת הדמיה ברזולוציה גבוהה באמצעות שילוב של שני מחווני Ca2+ , Fluo-4 AM ו- FuraRed AM. עבור עיבוד לאחר מכן, פותחה גישת זיהוי מיקרו-דומיין Ca2+ חצי אוטומטית בקוד פתוח, המבוססת על שפת התכנות Python. באמצעות זרימת עבודה זו, אנו מסוגלים לזהות באופן אמין מיקרו-דומיינים Ca2+ ברמה תת-תאית בתאי T ראשוניים ואנושיים בסרטוני פלואורסצנטיות ברזולוציה טמפורלית ומרחבית גבוהה. שיטה זו יכולה להיות מיושמת גם על סוגי תאים אחרים, כמו תאי NK וקווי תאים עצביים מורין.
Introduction
טכניקת המיקרוסקופ הפלואורסצנטי המוצגת מאפשרת הדמיה של אותות סידן ראשוניים מקומיים וזמניים (Ca2+) בתאי T ראשוניים של עכבר, המכונים מיקרו-דומיינים Ca2+ . מיקרו-דומיינים Ca2+ מייצגים אירועי איתות Ca2+ דינמיים וקצרי מועד, ומציבים אתגרים לדימות וניתוח יעילים של תאים חיים1.
תאי T מאתגרים לדימות תאים חיים בשל ההבדלים היחסיים בעוצמת הפלואורסצנטיות המרכזית וההיקפית, שניתן לייחס לצורתם הכדורית וקוטרם הקטן של ~6-8 מיקרומטר. עם גירוי ויצירת סינפסות חיסוניות, תאי T עוברים שינויים מורפולוגיים, מה שמסבך עוד יותר את ההדמיה של תאי T1. לכן, שימוש בניתוח יחסימטרי הופך להיות הכרחי, המושג על ידי הקלטת שתי תמונות המייצגות תכונות שונות של צבע Ca2+ או שימוש בשילוב של שני צבעי Ca2+ . המאפיינים התובעניים של מיקרו-דומיינים Ca2+ כוללים את אופיים המהיר, הזמני והמוגבל מרחבית. כדי ללכוד זאת, צבעי Ca2+ המשמשים חייבים להיות בעלי בהירות בסיסית גבוהה ויחס אות לרעש גבוה (SNR) כדי להשיג את הרזולוציה הטמפורלית והמרחבית הגבוהה ביותר האפשרית. תוצאות אופטימליות הושגו באמצעות שילוב של צבע באורך גל כפול Fura Red וצבע באורך גל יחיד Fluo-4. העמסה משותפת של תאים עם Fluo-4 ו-Fura Red מקלה על האתגרים שמציבה הלבנה חזקה של צבעי אורכי גל בעלי פליטה כפולה וההשהיה הטמפורלית הקשורה לצבעי עירור כפול, ומבטיחה התאמה לקליטת תמונה מהירה. גישה זו מקלה עוד יותר על הדמיה של שינויים בצורה ותנועות עדינות. דרישות מיוחדות מוטלות גם על מערכת ההדמיה במונחים של רזולוציה מרחבית כדי לאפשר הדמיה של אותות Ca2+ שמקורם בפתיחת אשכולות קטנים של ערוצים או אפילו ערוצים בודדים1.
איתות Ca2+ ממלא תפקיד מרכזי בהפעלת תפקודי מערכת החיסון בתוך תאי T, כולל היווצרות סינפסות וייצור ציטוקיניםושחרור 2,3. גורלו הספציפי של התא מווסת באמצעות אותות Ca2+ המבוטא באופן שונה ומופץ באופן מקומי, המיקרודומייניםCa 2+ 3. יש לציין כי אותות Ca2+ מקומיים אלה מקדימים עלייה נרחבת ברמות Ca2+ תוך תאיות בתאי T והיווצרות מיקרו-דומיינים Ca2+ תלויה הן בכניסה והןבשחרור Ca 2+ 1,4,5. עם גירוי קולטן תאי T (TCR)/CD3, מופעלת היווצרות של Ca2+ המשחרר שליחים שניים, כמו חומצה ניקוטינית אדנין דינוקלאוטיד פוספט (NAADP), D-מיו-אינוסיטול 1,4,5-trisphosphate (IP3) וריבוז ADP מחזורי (cADPR), מה שמוביל לעלייה ברמות Ca2+ תוך תאי עד 1 מיקרומטר 6,7. אירועי איתות מוקדמים של Ca2+ קשורים לשחרור Ca2+ ממאגרי Ca2+ תוך תאיים כגון הרשתית האנדופלסמית (ER), כאשר ערוצים כגון קולטן הריאנודין 1 (RyR1) וקולטן IP3 (IP3R) אחראים בעיקר לאיתות זה. זה גורם לאחר מכן לזרם Ca2+ חוץ-תאי וגורם לאות Ca2+ גלובלי באמצעות כניסת Ca2+ המופעלת בחנות (SOCE)8. בנוסף, ישנם ערוצים אחרים המעורבים באיתות Ca2+ במהלך הפעלת תאי T9, למשל, ערוצי P2X4 ו- P2X7 מבטיחים שטף קטיון תלוי אדנוזין טריפוספט (ATP), מה שתורם לעלייה ב- Ca2+ תוך תאי. למרבה הפלא, מיקרו-דומיינים Ca2+ תלויי הידבקות ראשוניים (ADCMs) נוצרים כבר לפני גירוי TCR אך עם אמפליטודות ותדרים נמוכים יותר של Ca2+. אותות Ca2+ ראשוניים אלה, שאינם תלויים ב-TCR, משרתים ככל הנראה את נדידת תא ה-T לאתר הדלקת ומכינים את תאי ה-T לרסטימולציה באתר הזיהום10,11.
על ידי פיתוח השיטה המתוארת לדימות Ca2+ מקומי, השגנו כלי נוסף לחקר המקור והמשמעות של אותות Ca2+ מוקדמים בהפעלת תאי T. שיטה זו מאפשרת למשתמש לזהות אותות Ca2+ קטנים יותר, קצרי מועד ומהירים יותר ממה שהיה אפשרי בעבר. יתר על כן, Deconvolution, Analysis, Registration, Tracking, and Shape normalization (DARTS), צינור הניתוח מבוסס Python, מאפשר שיתוף כלי הניתוח עם קהל רחב יותר12.
Protocol
כל הניסויים בבעלי חיים אושרו ובוצעו בהתאם להנחיות רווחת בעלי החיים של הוועדה המוסדית לטיפול ושימוש בבעלי חיים במרכז הרפואי האוניברסיטאי המבורג-אפנדורף.
1. בידוד תאי T ראשוניים של עכבר מבלוטות הלימפה והטחול
- יש לקצור את הטחול/בלוטות הלימפה בתנאים סטריליים בהתאם להנחיות האתיות ולהניחם בצינור עם מדיום קליקים קרים כקרח (10% סרום עגל עוברי (FCS), 2 מ"מ L-גלוטמין, פניצילין/סטרפטומיצין (P/S) 100 U/mL, 50 ננומטר β-מרקפטואתנול).
הערה: תאי T מסוג Wild ועכבר KO מבודדים באותו אופן. - מצננים את הצנטריפוגה ל-4°C.
- מניחים את הטחול ובלוטות הלימפה במסננת תאים של 70 מיקרומטר בצלחת פטרי סטרילית ומוסיפים מדיום בידוד טחול (מדיום RPMI + 7.5% NCS + 1% P/S) לנפח כולל של 20 מ"ל.
- יש לשבש ביסודיות אך בעדינות את הטחול באמצעות מכתש פלסטיק. מעבירים את התאים לאחר מכן לצינור צנטריפוגה של 50 מ"ל.
הערה: נפח כולל של 20 מ"ל אמור להיות כעת בצינור הצנטריפוגה של 50 מ"ל. הטחול ובלוטות הלימפה צריכים להיות משובשים לחלוטין. עבדו על קרח מנקודה זו ואילך. שמירה על התאים על קרח מאטה את חילוף החומרים שלהם ומונעת מוות תאי, מה שמבטיח שהם יישארו בני קיימא ושלמים מבחינה תפקודית. זה עוזר לשמר את המצב הפיזיולוגי שלהם לתקופה ארוכה יותר של זמן, וזה חשוב במיוחד עבור ניסויים מדויקים במורד הזרם. - צנטריפוגה את תרחיף התא ב 300 x גרם במשך 5 דקות ב 4 ° C.
- יש להשליך את הסופרנאטנט ולהבטיח השעיה של הגלולה המתקבלת ב-2 מ"ל של מלח חוצץ פוספט (DPBS) של Dulbecco (ללא Ca2+ ו-Mg2+). מעבירים לצינור צנטריפוגה חדש בנפח 12 מ"ל.
2. בחירה שלילית של תאי T CD4+
הערה: עבור הבחירה השלילית של תאי T CD4+ , ערכת בידוד תאי T המכילה חוסם FcR, נוגדנים biotinylated נגד תאים שאינם CD4+ T, וחלקיקים מגנטיים מצופים סטרפטווידין.
- הוסף 20 μL/מ"ל של חוסם FcR עכבר מערכת בידוד תאי T לתרחיף התא.
- יתר על כן, להוסיף 100 μL של עכבר CD4+ T בידוד תאים קוקטיילים בריכוז של 50 μL / mL, לערבב היטב, לדגור במשך 10 דקות בטמפרטורת החדר (RT).
- חלקיקים מגנטיים מצופים סטרפטווידין במשך 30 שניות, מוסיפים 150 μL לתרחיף התא, מערבבים היטב ודגרים במשך 2 דקות 30 שניות ב-RT.
- הוסף DPBS להשעיית התא, למלא אותו לנפח כולל של 7 מ"ל. הקפד לקמט למעלה ולמטה בעדינות, ולאחר מכן לדגור במגנט במשך 2 דקות 30 שניות ב- RT.
- לאחר מכן, לאסוף בעדינות את תאי T מועשר supernatant ולהעביר אותם צינור צנטריפוגה חדש 12 מ"ל.
- תאי צנטריפוגה ב 300 x גרם ב RT במשך 5 דקות.
- השליכו את הסופרנטנט.
- השהה מחדש את תאי CD4+ T המבודדים והמועשרים ב- 1 מ"ל של DPBS, תוך פיטום יסודי למעלה ולמטה. דגרו על התערובת במשך 2 דקות 30 שניות במגנט ב-RT כדי להבטיח שאין זיהום חרוזים.
- אספו את הסופרנטנט, העבירו אותו לצינור צנטריפוגה חדש וספרו את תאי ה-T המועשרים.
- כדי לספור את התאים, צבעו את התאים בכחול טריפאן וספרו באמצעות מונה תאים אוטומטי.
הערה: עדיף לטעון ישירות את תאי CD4+ T המבודדים ולצלם אותם באותו יום של בידוד. עם זאת, תאי T ראשוניים של מורין יכולים להיות בתרבית ללא כל גירוי בן לילה באינקובטור ב 37 ° C עם 5% CO2 בתווך בידוד (RPMI 1640 + 10% FCS + P / S).
3. טעינת תאי T ראשיים CD4+ של עכבר
הערה: כדי למדוד ריכוזי Ca2+ ציטוסוליים חופשיים, משתמשים בצבעים פלואורסצנטיים וחדירים לממברנה בניסויי ההדמיה Ca2+ . שילוב של Fluo-4- אצטוקסימתיל אסטר (AM) והצבע היחסימטרי Fura Red-AM משמש כאינדיקטור לזיהוי מהיר של אותות Ca2+ מקומיים. הקפידו לעבוד בחושך תוך שימוש בצבעים פלואורסצנטיים.
- צנטריפוגה 2-5 x 106 תאים למשך 5 דקות, 300 x גרם, להשליך את supernatant ו resuspend ב 480 μL של תא T בינוני (RPMI 1640, 10% FCS) עם 10 μM Fluo-4-AM (מלאי: [1 mM]), ו 20 μM Fura Red-AM (מלאי: [4 mM]).
- דוגרים בתחילה במשך 20 דקות ב- RT מתחת לספסל בחושך, מכסים את הבז ברדיד אלומיניום.
הערה: אין לחרוג מזמן הדגירה הראשון, מכיוון שמחווני Ca2+ מדוללים ב- DMSO, מה שעלול להזיק לתאים בזמן חשיפה ארוך יותר בנפח הכולל הנמוך. שמור על התאים מוגנים מפני אור לאחר הטעינה בשל רגישות האור של הצבעים. - בתום הדגירה הראשונית של 20 דקות, מוסיפים 2 מ"ל של תווך תאי T לתאים וממשיכים את הדגירה במשך 30 דקות נוספות בחושך ב- RT.
- צנטריפוגה את מתלה התא ב 300 x גרם במשך 5 דקות ב RT.
- יש להשליך את הסופרנאטנט ולנקות את הגלולה על ידי שטיפתה עם 2 מ"ל של חיץ מדידה Ca2+ (140 mM NaCl, 5 mM KCl, 1 mM MgSO4, 1 mM CaCl2, 20 mM HEPES, 1 mM NaH2PO4, 5 mM גלוקוז, pH 7.4) ולאחר מכן צנטריפוגה ב 300 x גרם במשך 5 דקות ב RT.
- לבסוף, השליכו את הסופרנאטנט והשעו אותו מחדש עם מאגר המדידה Ca2+ . התאם את מספר התא ל~100,000 תאים לכל 10 μL.
הערה: נפח של 10 μL משמש למדידה אחת. הימנעו מדילול יתר של התאים, מכיוון שייתכן שיהיה צורך להתאים עוד יותר את ספירת התאים מתחת למיקרוסקופ כדי להגיע לאופטימליות לתנאי המדידה. - אפשרו לתאים לדגור במשך ~20 דקות כדי להבטיח חדירה מלאה לתאים ודה-אסטריפיקציה של הצבעים. אחסנו תאים על קרח ובחושך עד למדידה.
הערה: ניתן להשתמש בתאי T ראשוניים טעונים עד ~4 שעות לאחר הטעינה.
4. הדמיה מקומית Ca2+
- הכנת שקופיות
- כיסויי מיקרוסקופ מעיל (24 מ"מ x 46 מ"מ) עם אלבומין בסרום בקר (BSA, 5 מ"ג/מ"ל) ופולי-L-ליזין (PLL, 0.1 מ"ג/מ"ל) (איור 1A). אפשר BSA לשבת ~ 20 דקות לפני החלת PLL.
הערה: הציפוי מקל על הידבקות תאים. להידבקות תאים תקינה, פזרו במדויק גם BSA וגם PLL עד שלא נראים יותר פסים. - ליצירת תאי תגובה, הדביקו אורינגי גומי רב-פעמיים לשקופיות באמצעות משחת סיליקון (איור 1B,C).
הערה: ניתן להשתמש בשקופיות/תאים או לוחות אחרים כגון שקופיות 35 מ"מ, תאי מתכת לשימוש חוזר או לוחות 8, 24 או 48 בארות לרכישת תמונות.
- כיסויי מיקרוסקופ מעיל (24 מ"מ x 46 מ"מ) עם אלבומין בסרום בקר (BSA, 5 מ"ג/מ"ל) ופולי-L-ליזין (PLL, 0.1 מ"ג/מ"ל) (איור 1A). אפשר BSA לשבת ~ 20 דקות לפני החלת PLL.
- ציפוי חרוזים מגנטיים של חלבון G (קוטר 10 מיקרומטר) בנוגדנים
- מערבבים בעדינות את תרחיף החרוזים המגנטי של החלבון ומעבירים 12.5 μL לצינור חדש.
- הניחו את הצינור על מעמד מגנטי כדי להסיר את מאגר האחסון ולאפשר לחרוזים לנדוד אל המגנט. הסירו בעדינות את מאגר האחסון על ידי הצבתו בצד הנגדי של המגנט.
- כדי להסיר את מאגר האחסון שנותר, שטפו את החרוזים על ידי הוספת 500 μL של PBS-T (PBS, 0.1% טווין) וערבול במשך 10 שניות. הניחו שוב את הצינור במעמד המגנטי והסירו את החיץ.
- כדי לצפות את החרוזים בנוגדנים, השהה אותם מחדש ב- 7.5 μL של PBS-T והוסף 5 μL של anti-CD3 (0.5 מ"ג / מ"ל) ו- anti-CD28 (0.5 מ"ג / מ"ל), בהתאמה. יש לדגור במשך 30-60 דקות עם ערבוב רציף ב-RT.
- שטפו את החרוזים המצופים שלוש פעמים עם 500 μL של PBS-T, ולאחר מכן שטפו פעם אחת עם 500 μL של חיץ מדידה Ca2+ באמצעות המעמד המגנטי.
- יש להשהות חרוזים ב-200-400 מיקרוליטר של חיץ מדידה Ca2+.
הערה: בדוק את צפיפות החרוזים במהלך המדידות, דלל עוד יותר במידת הצורך.
- מיקרוסקופ הדמיה מקומי Ca2+
הערה: ההדמיה מתבצעת באמצעות מיקרוסקופ אור בהיר עם הגדלה של פי 100, המצויד במנורת קשת קסנון כמקור אור. פריימים נלכדים במצב 14 סיביות עם כריכה כפולה באמצעות מצלמה מצומדת מטען מכפילת אלקטרונים. כדי להקליט ולפצל את אורכי גל הפליטה של שני הצבעים, נעשה שימוש במודול תצוגה כפולה, הכולל את המסננים הבאים בננומטר (לדוגמה, 480/40; bs, 495; em1, 542/50; em2, 650/57). מערך ההדמיה כולל רכזת רכישה ותוכנת הדמיה לרכישת תמונה.- מניחים 10 μL של התאים הטעונים על השקופית מוכנה ולתת להם להתחבר לשקופית במשך 3-5 דקות.
- הוסף בעדינות 80 μL של חיץ מדידה Ca2+ לשקופית.
- בחר את עדשת טבילת השמן 100x ומרח טיפה קטנה של שמן טבילה. הניחו את השקופית על שולחן המיקרוסקופ.
- התאם את המיקוד במודוס שדה בהיר, בחר בקפידה שדה ראייה עם עד 10 תאים שאינם במגע זה עם זה, וקבל תמונה.
הערה: יהיה קשה לנתח תאים חופפים ונוגעים בהם מאוחר יותר.- הדליקו את המנורה, בדקו את הפלואורסצנטיות והטעינה של תאי T והשוו תאים בשני הערוצים כדי לוודא שהם אינם מופעלים מראש.
- הקפד לצלם תמונות של שדה הראייה הן עבור ערוצי שדה בהיר והן עבור ערוצי פלואורסצנטיות לפני ואחרי המדידה כדי לבדוק את תנועת התאים והעמסתם.
- התחל למדוד וללכוד את הפעילות הבסיסית במשך דקה אחת עם קצב רכישה של פריים אחד לכל 5 שניות.
- הוסף 10 μL של תרכובת/ממריץ (חרוז או מגרה/מעכב) לאחר דקה אחת ומדוד במשך 3 דקות בסך הכל באמצעות 40 מסגרות לשנייה או קצב המסגרות המרבי האפשרי.
הערה: הוספת חרוזים היא השלב המכריע; ודא שהחרוזים מתווספים קרוב לנורית העירור בשקופית מבלי להזיז את השקופית. דוגמאות מייצגות של מיקרו-דומיינים Ca2+ בתאי CD4+ T ראשוניים במגע חרוזים מעכברי WT ו-P2x4-/- ו-P2x7-/- מוצגות באיור 2.
5. עיבוד לאחר / ניתוח נתונים
הערה: לעיבוד תמונה וניתוח נתונים, נעשה שימוש בצינור הקוד הפתוח מבוסס Python DARTS. הוא פותח על ידי Woelk et al.12 בהתבסס על עבודתם של Diercks et al.13.
- התקנת צינור DARTS
- התקן את Python 3.10.014, anaconda15 ו- git16, ושכפל את מאגר GitHub באמצעות פקודת המסוף git clone: https://github.com/IPMI-ICNS-UKE/DARTS.git
- צור סביבת קונדה עם קונדה צור --שם DARTS והתקן את כל חבילות Python הדרושות עם התקנת פיפ <חבילה>.
הערה: בצע את הוראות ההתקנה במאגר DARTS GitHub17,18 לקבלת מידע מפורט יותר. - לפני השימוש ב- Bioformats, ודא שסביבת Java Runtime מותקנת כראוי19.
- שימוש בצינור DARTS
הערה: לאחר ההתקנה, ניתן להפעיל חצים מחלון הטרמינל.- נווט אל העותק המקומי של מאגר DARTS (נתיב תקליטור/אל/DARTS) המכיל את קובץ main.py. ודא שסביבת קונדה מופעלת (conda מפעילה DARTS).
- הפעל DARTS על ידי הקלדת python main.py בחלון הטרמינל והקשה על Enter.
- בממשק המשתמש הגרפי (GUI), ציין את ספריית המקור והתוצאות וכן את תבנית התמונה בחלק השמאלי העליון (ראה איור 3).
- הגדר את תכונות המדידה, כגון קנה המידה (פיקסלים למיקרומטר), קצב פריימים, סוג תא וכו '. ניתן להרכיב את צינור העיבוד על סמך נתוני התמונה הספציפיים ושאלת המחקר.
הערה: קרא עוד על פרמטרי deconvolution, לדוגמה, בתיעוד המתאים20. - שמור את ההגדרות במחשב לפני לחיצה על התחל. תיאור מפורט יותר של ממשק המשתמש הגרפי ניתן למצוא בתיעוד של DARTS.
- Ca2+ הדמיית מיקרו-דומיין ומגעי חרוזים
הערה: לצורך הדמיה וגירוי מקומיים עם חרוזים וניתוח תמונה לאחר מכן, המשתמש צריך להגדיר את מגעי החרוזים הספציפיים לתא כדי לזהות את נקודת ההתחלה (t = 0) של תקופת המדידה המעניינת (ראה איור 4). מגע חרוז מוגדר כאתר מגע של חרוז (גירוי) עם תא עניין. הוא מורכב ממפרט של (1) זמן מגע החרוז, למשל, מסגרת 300, ו-(2) מיקום מגע החרוז ביחס למרכז התא, למשל, שעה 1 או 12. בגרסת DARTS הנוכחית, המשתמש צריך להגדיר ולהזין ידנית את המידע עבור כל איש קשר בחרוזים. השתמש בהליך הבא כדי להגדיר אנשי קשר מחרוזים:- השתמש במחוון כדי לאתר את זמן המגע בין חרוז לתא מעניין.
- בתפריט האפשרויות בצד ימין, בחר איש קשר לחרוז: x, y, t.
- בחרו בנקודה בצד שמאל של התמונה שבה התא והחרוז יוצרים קשר.
- בחר בחר תא על-ידי לחיצה על נקודה בפנים. לחץ על התא המגורה על ידי חרוז זה, רצוי במרכז.
- לחץ על הוסף איש קשר חרוז.
- חזור על שלבים 5.3.1 - 5.3.5 עבור כל איש קשר חרוז נוסף בקובץ זה. לאחר הגדרת כל אנשי הקשר לחרוזים, לחץ על כפתור המשך .
- המשך עם קבצים נוספים. לאחר ההגעה לקובץ האחרון, הסקריפט יתחיל ניתוח אוטומטי של כל הקבצים.
- ניתוח נתונים
- מצא את תמונות היחס המעובד, נתוני מיקרו-דומיין עבור כל תא לאורך זמן (כולל לוקליזציה, משרעת, גודל), נתוני מקור עבור הקרנת לוח החיצים ומשאבים נוספים בתיקיית התוצאות.
- ליצירת משטחי חצים, נווט אל התיקייה /src/analysis/ בתוך התיקייה DARTS (תבנית: נתיב תקליטור/אל/DARTS/src/analysis) המכילה את DartboardPlotGUI.py הסקריפט. לאחר מכן, הקלד python DartboardPlotGUI.py והקש Enter.
- ודא שהמידע הדרוש מסופק ושקובצי הגיליון האלקטרוני מתיקיית התוצאות נבחרו במדויק כקובצי המקור ליצירת לוח חצים.
תוצאות
בפרוטוקול זה, תיארנו שיטה מעודכנת לתמונה וניתוח ראשוניים של מיקרו-דומיינים Ca2+ בתאי T ראשוניים של עכבר בהתבסס על עבודה קודמת של הקבוצה שלנו 1,13. גישה זו סייעה בחשיפת מעורבותם של ערוצי CRAC כגון ORAI1, STIM1 ו-STIM2, כמו גם ערוצי שחרור תוך-תאיים Ca2+ כמו RyR1 באירועי איתות מוקדמיםשל Ca2+ 4.
כדי לעשות זאת, חקרנו היווצרות ספונטנית של מיקרו-דומיין Ca2+ על ידי הדמיה של עכבר ראשי לא מגורה Orai1-/-, Stim1-/-, Stim2-/-, ו-Ryr1-/- והשווינו אותם לתאי T של עכבר WT ראשי. הניתוח של היווצרות מיקרו-דומיין Ca2+ הקיף את מהירות תחילת האות, משרעת Ca2+ ומספר האותות למישור קונפוקלי. יש לציין כי למעט תאי Stim2-/- T, כל תאי KO T הציגו ירידה משמעותית באותות Ca2+ מקומיים וריכוז Ca2+ ציטוסולי חופשי בסיסי מופחת בהשוואה לתאי WT. זה הוביל אותנו למסקנה כי היווצרות של Ca2+ microdomains קשורה באופן מורכב לאינטראקציה של ORAI1, STIM1, ו RyR14. בנוסף, זיהינו ואפיינו בהצלחה מיקרודומיינים ספונטניים של Ca2+ בקרום הפלזמה. מיקרודומיינים אלה של Ca2+ התאפיינו באמפליטודה Ca2+ של 290 ננומטר ± 12 ננומטר. שימוש בגישה מקודדת צבע עבור אותות Ca2+ איפשר הדמיה של מיקרו-דומיינים Ca2+ ברחבי התא. התוצאות הדגישו עוד יותר את ההתחלה המהירה של מיקרו-דומיינים Ca2+ , הנראים תוך אלפיות השנייה, ואת היכולת של שיטה זו לזהות אותות Ca2+ עם תוחלת חיים של כמה אלפיות שנייה4. מיקרו-דומיינים ספונטניים אלה של Ca2+ זוהו מאוחר יותר כמיקרו-דומיינים Ca2+ תלויי הידבקות (ADCM), התלויים לא רק ב-SOCE אלא גם פועלים באמצעות מפל האיתות FAK/PLC-γ/IP3 10 ומעורבות של P2X49. יתר על כן, טכניקה זו הייתה בסיסית באישור אוקסידזות כפולות 1 ו-2 (DUOX1/2) כאנזימים מייצרי NAADP21 ו-HN1L/JPT222 כאחד החלבונים קושרי NAADPשהתגלו לאחרונה 23.
איור 2 מציג דוגמאות מייצגות של מיקרו-דומיינים מסוג Ca2+ בתאי T ראשוניים מסוג CD4+ במגע חרוזים מ-WT וכן בעכברי P2x4-/- ו-P2x7-/-. התאים הועמסו בצבעי Ca2+ Fluo-4 AM ו-Fura Red AM וצולמו בקצב רכישה של 25 מילישניות (40 פריימים לשנייה). כדי לחקות את היווצרות סינפסת תאי T, התאים עוררו באמצעות חרוזים מצופים אנטי-CD3/אנטי-CD28. היווצרות ראשונית של מיקרו-דומיין Ca2+ נותחה 1 שניות לפני ועד 15 שניות לאחר מגע חרוזים באמצעות צינור DARTS. במגע עם חרוזים, תא WT הראה היווצרות מהירה של מיקרו-דומיינים Ca2+ בשנייה הראשונה לאחר הגירוי באתר מגע החרוזים (איור 2A). מיקרו-דומיינים אלה של Ca2+ התרחבו עוד יותר ברחבי התא ב-15 השניות הבאות לאחר מגע החרוזים. בניגוד לתא WT, תאי P2x4-/- ו-P2x7-/- (איור 2B) הראו ירידה בהיווצרות מיקרו-דומיין Ca2+ לאחר גירוי חרוזים, כמו גם עבור P2x4-/-- רמה בסיסית נמוכה יותר לפני מגע חרוזים. ממצאים מייצגים אלה עולים בקנה אחד עם התוצאות שפורסמו בעבר על ידי Brock et al.9, המצביעות על היווצרות מיקרודומיין Ca2+ בתאי WT T מיד לאחר מגע חרוזים מעל 15 שניות ואותות נמוכים יותר לכל מסגרת בתאי P2x4-/- ו- P2x7-/- . יתר על כן, המשרעת בתאי P2x4-/-הופחתה באופן משמעותי, מה שביסס עוד יותר את התפקיד של איתות פורינרגי במיקרו-דומיינים Ca2+ תלויי הידבקות.
יתר על כן, שיטה זו יכולה לשמש גם כדי להמחיש מיקרו-דומיינים ראשוניים של Ca2+ בתאי CD4+ T אנושיים ראשוניים (איור 3). בהתאם לתאי T ראשוניים, מיקרו-דומיינים ראשוניים של Ca2+ מתעוררים באתר הקשר עם החרוזים. עם זאת, נראה כי התגובה הכוללת של Ca2+ מתרחשת בסקאלת זמן שונה בהשוואה לתאי T CD4+ murine.
ניתוח של אותות Ca2+ מקומיים באופן ידני אינו אפשרי מכיוון שהוא די מייגע וסובייקטיבי לחוקר הבודד. לכן, פיתחנו בעבר אלגוריתם ב-MATLAB Simulink באמצעות ארגזי הכלים שלה לעיבוד תמונהואופטימיזציה לעיבוד 13 לניתוח מיקרו-דומיינים מקומיים של Ca2+ .
לאחרונה, פיתחנו צינור חדש, קוד פתוח, לאחר עיבוד בשם DARTS עבור ניתוח מיקרו-דומיין Ca2+ בדימות תאים חיים ברזולוציה גבוהה באמצעות פלטפורמת התוכנה Python12. כאן, ניתן לבחור אלגוריתמים שונים של דה-קונבולוציה, בהתאם להעדפת המשתמש, נורמליזציה של צורת התא המבוצעת כדי לפצות על שינויים מורפולוגיים בצורת התא, ומיקרוסקופ ופרמטרים ספציפיים למדידה מוגדרים (למשל, קנה מידה, קצב פריימים, זמן נמדד) (איור 4).
לאחר בחירת פרמטרים לניתוח מיקרו-דומייןCa 2+ , נפתח חלון קופץ שני עבור כל מדידה בנפרד כדי להגדיר את מגע החרוז (איור 5). כדי להגדיר את איש הקשר של החרוז, המשתמש יכול לגלול ידנית בקובץ tiff באמצעות המחוון ולבחור את מסגרת איש הקשר של החרוז בנפרד. איש קשר לחרוז נבחר על-ידי לחיצה באתר איש הקשר של החרוז (איור 5, מגע חרוז וחרוז מסומן על-ידי טבעת צהובה וחץ) וכן על-ידי בחירת תאים. יש לחזור על שלב זה עבור כל תא מעניין. לבסוף, עיבוד התמונה האוטומטי מוחל ונתוני התוצאות מסוכמים ונשמרים בגיליון אלקטרוני.
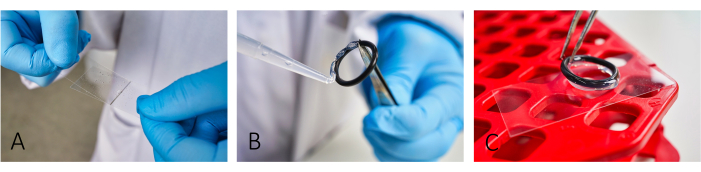
איור 1: זרימת עבודה של הכנת שקופיות להדמיה. (A) הוסף ופיזר BSA ו- PLL על השקופית באמצעות החלקה שנייה של כיסוי זכוכית. (ב,ג) כדי לבנות תא, הדביקו את טבעות הגומי באמצעות שומן סיליקון על המגלשה. ודא כי הטבעת כולה מכוסה בשכבה דקה של שומן כדי לקבל בידוד נאות של החדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
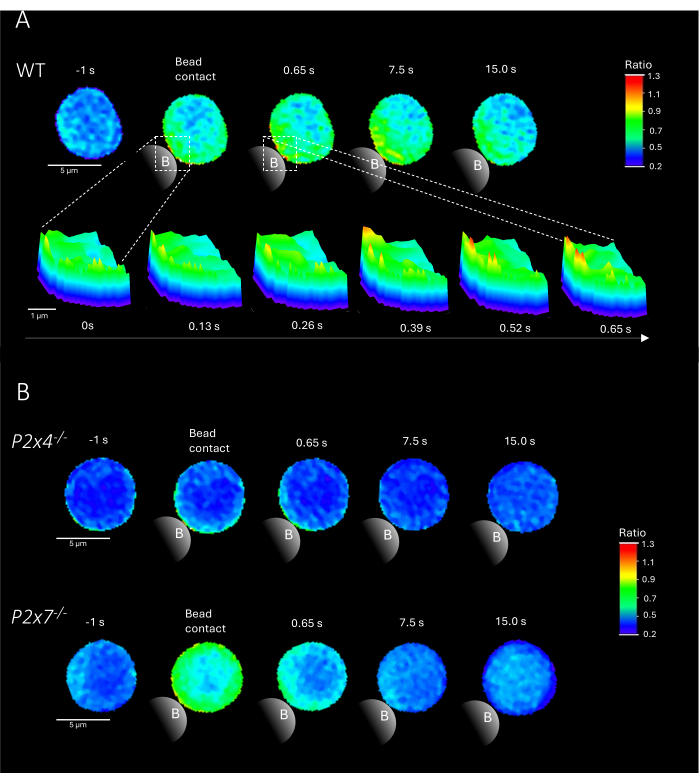
איור 2: תאים מייצגים של מיקרו-דומיינים Ca2+ תלויי קולטן תאי T בתא בר מוריני ראשוני (WT) (A), P2x4-/- או P2x7-/-(B) CD4+ T. תאי CD4+ T בודדו באופן שלילי והועמסו עם Fluo-4 AM ו- Fura Red, כמתואר לעיל. תאי T נותחו באמצעות צינור DARTS, וכתוצאה מכך תמונות תאים דומות לתוצאותשפורסמו בעבר 9. (A) תא T ראשי WT 1 שניות לפני גירוי עם חרוזים מצופים נגד CD3/anti-CD28 ועד 15 שניות לאחר גירוי (סרגל קנה מידה 5 מיקרומטר), וכן תרשים משטח תלת-ממדי של התקרבות מ-0 שניות עד 0.65 שניות באזור מגע החרוזים (סרגל קנה מידה 1 מיקרומטר). (B) נתיב עליון: נציג P2x4-/- תא T ראשי 1 שניות לפני ועד 15 שניות אחרי גירוי חרוזים. נתיב תחתון: נציג P2x7-/- תא T ראשי 1 שניות לפני ועד 15 שניות אחרי גירוי חרוזים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
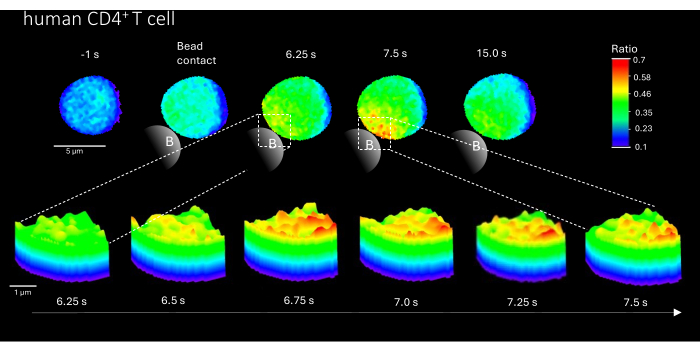
איור 3: מיקרו-דומיינים Ca2+ בתא T אנושי ראשוני מייצג לאחר גירוי TCR. תאי CD4+ T אנושיים ראשוניים בודדו מתאי דם חד-גרעיניים היקפיים (PBMCs) על ידי מיון תאים המופעלים על ידי פלואורסצנטיות (FACS) ממעילים באפי והועמסו ב- Fluo-4 AM ו- Fura Red, כמתואר לעיל. האיור מראה תא T אנושי ראשוני 1 שניות לפני גירוי עם חרוזים מצופים נגד CD3 ועד 15 שניות לאחר גירוי (סרגל קנה מידה 5 מיקרומטר), כמו גם תרשים משטח תלת-ממדי של זום מ-6.25 שניות עד 7.5 שניות באזור מגע החרוזים (סרגל קנה מידה 1 מיקרומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
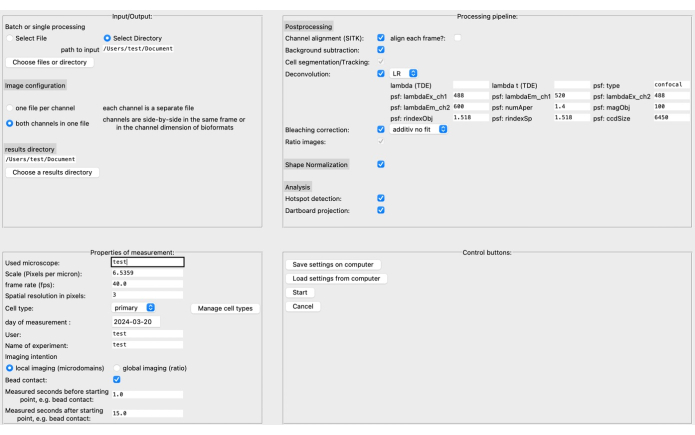
איור 4: ממשק המשתמש הגרפי (GUI) של DARTS. ממשק המשתמש הגרפי מחולק לארבעה תחומים. באזור קלט/פלט, עליך לספק מידע על הנתונים הגולמיים, כולל ספריית המקור ותצורת התמונה (שני ערוצים לכל קובץ או ערוצים נפרדים), וכן ספריית התוצאות. באזור תכונות המדידה, יש לתאר את הניסוי עם כל המידע הרלוונטי שלו, כגון קנה מידה (מיקרון לפיקסל), קצב פריימים ומרווח מדידה ביחס לנקודת ההתחלה שנקבעה מאוחר יותר. לאחר מכן, ניתן להרכיב צינור עיבוד המורכב משלבים לאחר עיבוד, נורמליזציה של צורה, והניתוח בפועל (זיהוי מיקרו-דומיין וצבירת נתונים של לוח חיצים). לבסוף, ניתן לשמור את ההגדרות במחשב או לטעון אותן. לאחר הגדרת הניתוח, לחץ על התחל כדי להמשיך. כדי לקרוא עוד על ההגדרה, בקר בכתובת https://ipmi-icns-uke.github.io/DARTS/General/Usage.html. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
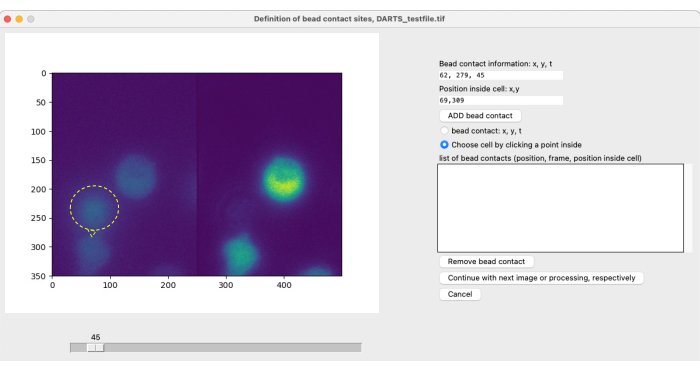
איור 5: הגדרה ידנית של מגעי חרוזים. אם מוסיפים חרוזים לתאים במהלך הניסוי, יש להגדיר ידנית את זמן המגע הראשוני של החרוז עם תא מעניין ואת מיקום המגע. זה נעשה על ידי גלילה בין המסגרות עם המחוון ומציאת מיקום (x,y) בנקודת זמן t. כדי למלא באופן אוטומטי את שדה פרטי הקשר של החרוז, המשתמש לוחץ על החצי השמאלי של תמונת המיקרוסקופ במיקום איש הקשר של החרוז. לאחר מכן, כדי לשייך תא לאיש הקשר של החרוז, המשתמש לוחץ על מיקום בתוך התא שיש לו איש קשר לחרוזים. יש לאשר את המידע על-ידי בחירה באפשרות הוסף חרוז. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
תיארנו פרוטוקול נרחב לדימות תאים חיים ברזולוציה גבוהה של מיקרו-דומיינים מקומיים מסוג Ca2+ בתאי T ראשוניים ובתאי T אנושיים המופעלים על ידי גירוי TCR/CD3 באמצעות חרוזים מצופים נוגדנים. יתר על כן, יישמנו אלגוריתם ידידותי למשתמש ומבוסס קוד פתוח מבוסס Python כדי לזהות ולנתח אותות Ca2+ מקומיים. יש לציין כי הפרוטוקול אינו מוגבל לזיהוי מיקרו-דומיינים Ca2+ בהקשר של גירוי TCR/CD3, אלא ניתן להתאמה לסוגי תאים אחרים (חיסוניים) כגון קווי תאי NK (KHYG-1)12 או מיקרו-דומיינים Ca2+ 10,11 שאינם תלויים ב-TCR.
שלב קריטי בפרוטוקול הוא גודל ומספר החרוזים המעוררים. כדי לחקות סינפסה חיסונית, החרוזים צריכים להיות דומים בגודלם לתאים. לפיכך, עבור תאי מורין ראשוניים ותאי T אנושיים, כמו גם קווי תאים (Jurkat ו- KHYG1), אנו משתמשים בחרוזים מגנטיים בקוטר של 10 מיקרומטר. יתר על כן, כל תא צריך להיות מגורה רק על ידי חרוז אחד בודד. לכן, מספר החרוזים שנוסף לכל שקופית אמור להספיק מצד אחד, אך אם יש יותר מדי חרוזים בשדה הראייה, הרקע גדל, ולא ניתן לזהות נקודת זמן הפעלה אחת וצד מגע.
הפרוטוקול משתמש בצבעים הפלואורסצנטיים Ca2+ Fluo-4 AM ו- FuraRed AM באופן יחסי, ולכן מאפשר כיול של הנתונים13. בנוסף, ניתן להתאים את הפרוטוקול לזוגות אינדיקטורים אחרים של Ca2+ , אך יש לנקוט משנה זהירות בתהליך הבחירה במונחים של קינטיקה קושרת Ca2+ , פיזור תת-תאי והלבנה1. יתר על כן, תנאי העמסה חייבים להיות מפותחים ומותאמים לכל סוג תא בודד, אך הריכוזים המצוינים כאן הם נקודת התחלה טובה. כדי לדמיין מיקרו-דומיינים של Ca2+ , ה-Kd של צבעי Ca2+ צריך להיות בטווח של 300-1200 ננומטר וזמן הרכישה לכל מסגרת צריך להיות ≤60 אלפיות השנייה. אם עוצמת הפלואורסצנטיות נמוכה מדי, יש לבדוק את מערך הפילטרים, אך ניתן גם לטעון כמות כפולה של צבע Ca2+ לתאי T. עם זאת, צבע Ca2+ יכול להיות בטעות לאברונים אחרים או sequester לשלפוחיות, אבל זה יכול גם לפעול כמו חיץ Ca2+ ולהשפיע על תגובות Ca2+ .
מגבלה אחת של אלגוריתם הניתוח היא שמניחים צורה כדורית של התא; לפיכך, סוגי תאים עם מורפולוגיות שונות עשויים להזדקק להתאמה של ארגז הכלים לניתוח. האלגוריתם שימש לניתוח מיקרו-דומיינים מקומיים של Ca2+ בתאי T ראשוניים, כמו גם תאי Jurkat T וקו תאי NK (KHYG-1)12 והצליח בניתוח מיקרו-דומיינים Ca2+ עבור קו תאים עצביים מורין (N2a, נתונים שלא פורסמו). באופן עקרוני, פרוטוקול וארגז הכלים לניתוח יכולים לשמש לניתוח סוגי תאים לא כדוריים כגון תאי HEK293 או HeLa, אך עבור סוגי תאים אלה, לא ניתן להתאים את היטל לוח החיצים מכיוון שהוא מבוסס על מבנה עגול ונורמליזציה צורנית של התאים. בנוסף, ניתן להתאים את הפרוטוקול לזיהוי מיקרו-דומיינים ראשוניים מקומיים של Ca2+ בעת גירוי חרוזים לניתוח אותות Ca2+ מקומיים הנגזרים מגירויים אחרים, כגון תרכובות מפעילות או מעכבות מסיסות, כמו גם מיקרו-דומיינים Ca 2+ תלויי הידבקות ובלתי תלויים ב-TCR/CD3 Ca2+ 10,11. יש לציין כי קל יותר להגדיר מגע חרוז יחיד במונחים של זמן ומיקום מאשר לקבוע את נקודת ההתחלה של ההפעלה לאחר תרכובות מסיסות.
מגבלה כללית לזיהוי היווצרות מיקרודומיין Ca2+ טמונה ברזולוציה הטמפורלית-מרחבית הגבוהה הנדרשת וביחס אות לרעש גבוה (SNR) הנדרש. נכון לעכשיו, הרזולוציה הנגזרת מההתקנה שלנו מגיעה לרזולוציה מרחבית מחושבת של ~0.368 מיקרומטר ורזולוציה זמנית של ~40 פריימים לשנייה (fps)1. ההתקדמות האחרונה בפיתוח מצלמות וגלאים, כמו גם שיפור הצבעים הפלואורסצנטיים, עשויים להוביל לאפשרות להגיע להקלטות אופטיות חד-ערוציות כפי שתוארו עבור ORAI-GECI (אינדיקטורים Ca2+ המתבטאים גנטית) מבנים24 עבור דימות תאים חיים באמצעות אינדיקטורים Ca2+ עם רזולוציה טמפורלית ומרחבית גבוהה יותר בעתיד.
יחד, ניתן להשתמש בכלי הפרוטוקול והניתוח להדמיית מיקרו-דומיין Ca2+ ברזולוציה גבוהה המתוארים כאן לא רק כדי לנתח אותות Ca2+ מקומיים ראשוניים בתאי T, אלא גם ניתן להתאים אותם לסוגי תאים אחרים כדי לפענח את המשמעות של איתות Ca2+ מקומי בתאים אלה.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר כל קשר מסחרי או פיננסי שיכול להיחשב כניגוד עניינים פוטנציאלי.
Acknowledgements
עבודה זו נתמכה על ידי Deutsche Forschungsgemeinschaft (DFG) (פרויקט מספר 335447717; SFB1328, A02 עד B-PD ו-RW; A14 עד ET; מספר הפרויקט 516286863 ל-B-PD). המחברים מודים לתורמי הדם ולמחלקה לרפואת עירוי בבריטניה על שיתוף הפעולה.
Materials
| Name | Company | Catalog Number | Comments |
| α-CD3 | BD Pharmingen | 553058 | |
| α-CD28 | BD Pharmingen | 553295 | |
| Anaconda | Anaconda | https://docs.anaconda.com/free/anaconda/install/index.html | |
| Bovine serum albumin | Sigma-Aldrich | A2058 | |
| Cell strainer | Biofil | CSS-013-070 | 70 µm diameter |
| Countess Automated Cell Counter | Invitrogen | A49865 | |
| Cover slips | Paul Marienfeld GmbH | 101202 | |
| DARTS | GitHub | https://github.com/IPMI-ICNS-UKE/DARTS | |
| Dulbecco’s Phosphate buffered saline | Gibco, Thermo Fisher | 14190144 | |
| EasySep CD4+ T cell Isolation Kit | Stemcell | 19852 | |
| EasySep Magnetic Multistand | Stemcell | 18010 | |
| Fluo 4-AM | Invitrogen | F14201 | |
| Fura Red-AM | Invitrogen | F3020 | |
| Gibco RPMI 1640 medium | Gibco, Thermo Fisher | 11875093 | |
| Git | GitHub | https://git-scm.com/book/en/v2/Getting-Started-Installing-Git | |
| immersion oil | Leica | 11513859 | |
| Newborn calf serum | Sigma-Aldrich | N4637 | |
| Oracle | Oracle | https://www.oracle.com/de/java/technologies/downloads/ | |
| Penicillin/Streptamycin | Gibco, Thermo Fisher | 15240062 | |
| Poly-L-lysine | Sigma-Aldrich | P4707 | |
| Protein G magnetic beads | Merck | LSKMAGG02 | 10 µM diameter |
| Python | Python | https://www.python.org/downloads/ | |
| Silicon grease (basylone) | Bayer | 291-1220 | |
| Time-Dependent Entropy Deconvolution | GitHub | https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters | |
| Tween | q-biogene | TWEEN201 |
References
- Wolf, I. M. A., et al. Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor. Sci Signal. 8 (398), 102 (2015).
- Taguchi, T., Mukai, K. Innate immunity signalling and membrane trafficking. Curr Opin Cell Biol. 59, 1-7 (2019).
- Trebak, M., Kinet, J. -. P. Calcium signalling in T cells. Nat Rev Immunol. 19 (3), 154-169 (2019).
- Diercks, B. -. P., et al. ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation. Sci Signal. 11, 0358 (2018).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: Elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1 (1), 11-21 (2000).
- Kummerow, C., Junker, C., Kruse, K., Rieger, H., Quintana, A., Hoth, M. The immunological synapse controls local and global calcium signals in T lymphocytes. Immunol Rev. 231 (1), 132-147 (2009).
- Brock, V. J., et al. P2X4 and P2X7 are essential players in basal T cell activity and Ca2+ signaling milliseconds after T cell activation. Sci Adv. 8 (5), 9770 (2022).
- Weiß, M., et al. Adhesion to laminin-1 and collagen IV induces the formation of Ca2+ microdomains that sensitize mouse T cells for activation. Sci Signal. 16 (790), 9405 (2023).
- Diercks, B. -. P. The importance of Ca2+ microdomains for the adaptive immune response. Biochim Biophys Acta Mol Cell Res. 1871 (5), 119710 (2024).
- Woelk, L. -. M., et al. DARTS: an open-source Python pipeline for Ca2+ microdomain analysis in live cell imaging data. Front Immunol. 14, 1299435 (2024).
- Diercks, B. -. P., Werner, R., Schetelig, D., Wolf, I. M. A., Guse, A. H. High-resolution calcium imaging method for local calcium signaling. Methods Mol Biol. 1929, 27-39 (2019).
- . Python Available from: https://www.python.org/downloads/ (2024)
- . Anaconda Available from: https://docs.anaconda.com/free/anaconda/install/index.html (2024)
- . git Available from: https://git-scm.com/book/en/v2/Getting-Started-Installing-Git (2024)
- . DARTS Available from: https://github.com/IPMI-ICNS-UKE/DARTS (2024)
- . DARTS GitHub Repository Available from: https://ipmi-icns-uke.github.io/DARTS/ (2024)
- . Oracle Available from: https://www.oracle.com/de/java/technologies/downloads/ (2024)
- . Time-Dependent Entropy Deconvolution Available from: https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters (2024)
- Gu, F., et al. Dual NADPH oxidases DUOX1 and DUOX2 synthesize NAADP and are necessary for Ca2+ signaling during T cell activation. Sci Signal. 14 (709), 3800 (2021).
- Roggenkamp, H. G., et al. HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation. Sci Signal. 14 (675), 5647 (2021).
- Heßling, L. D., Troost-Kind, B., Weiß, M. NAADP-binding proteins - Linking NAADP signaling to cancer and immunity. Biochim Biophy. Acta Mol Cell Res. 1870 (7), 119531 (2023).
- Dynes, J. L., Amcheslavsky, A., Cahalan, M. D. Genetically targeted single-channel optical recording reveals multiple Orai1 gating states and oscillations in calcium influx. Proc Natl Acad Sci U S A. 113 (2), 440-445 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved