Method Article
Primer T Hücrelerinde İlk Ca2+ Mikro Alanlarının Görüntülenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, floresan mikroskobu kullanarak birincil murin ve insan T hücrelerinde Ca2+ mikro alanları olarak bilinen ilk yerel Ca 2+ sinyallerini çözmek için kapsamlı bir protokol sunuyoruz. Bu protokol, bağışıklık hücreleri içindeki Ca2+ sinyal yolaklarını inceleyen ve işlevlerini daha da çözen araştırmacılar için değerli bir kaynak görevi görür.
Özet
Ca2+ mikro alanları olarak adlandırılan yerel, saniyenin altındaki Ca 2+ sinyalleri, küresel bir [Ca2 +] i yükselmesi ile sonuçlanan ve bir T hücresinin kaderini zaten belirleyebilecek olan oldukça dinamik ve kısa ömürlü Ca2 + sinyalleridir. T hücresi reseptörü aktivasyonu üzerine, NAADP hızlı bir şekilde oluşur, NAADP bağlayıcı proteinlere (HN1L / JPT2, LSM12) ve bunların ilgili reseptörlerine (RyR1, TPC2) bağlanır, ER ve lizozomlar gibi hücre içi Ca2 + depoları üzerinde oturur ve daha sonra [Ca2 +] i'nin salınmasına ve yükselmesine yol açar. Bu hızlı ve dinamik olarak oluşan Ca2+ sinyallerini yakalamak için, iki Ca2+ göstergesi, Fluo-4 ve FuraRed'nin bir kombinasyonunu kullanarak yüksek çözünürlüklü bir görüntüleme tekniği geliştirdik. İşlem sonrası için, Python programlama diline dayalı olarak açık kaynaklı, yarı otomatik bir Ca2+ mikro alan algılama yaklaşımı geliştirilmiştir. Bu iş akışını kullanarak, yüksek zamansal ve uzamsal çözünürlüklü floresan videolarında birincil fare ve insan T hücrelerinde hücre altı düzeyde Ca2+ mikro alanlarını güvenilir bir şekilde tespit edebiliyoruz. Bu yöntem, NK hücreleri ve murin nöronal hücre hatları gibi diğer hücre tiplerine de uygulanabilir.
Giriş
Sunulan floresan mikroskobu tekniği, Ca2+ mikro alanları olarak adlandırılan birincil fare T hücrelerinde lokal, temporal başlangıç kalsiyum (Ca 2+) sinyallerinin görselleştirilmesini sağlar. Ca2+ mikro alanları, etkili canlı hücre görüntüleme ve analizi için zorluklar ortaya çıkaran, son derece dinamik ve kısa ömürlü Ca2+ sinyal olaylarını temsil eder1.
T hücreleri, küresel şekillerine ve ~6-8 μm'lik küçük çaplarına atfedilebilecek merkezi ve periferik floresan yoğunluğundaki nispi farklılıklar nedeniyle canlı hücre görüntüleme için zordur. Stimülasyon ve immün sinaps oluşumu üzerine, T hücreleri morfolojik değişikliklere uğrar ve bu da T hücreleriningörüntülenmesini daha da karmaşık hale getirir 1. Bu nedenle, bir Ca2 + boyasının farklı özelliklerini temsil eden iki görüntünün kaydedilmesi veya iki Ca2 + boyasının bir kombinasyonunun kullanılmasıyla elde edilen bir oransal analizin kullanılması zorunlu hale gelir. Ca2+ mikro alan adlarının zorlu özellikleri, hızlı, zamansal ve mekansal olarak sınırlı doğalarını içerir. Bunu yakalamak için, kullanılan Ca2+ boyaları, mümkün olan en yüksek zamansal ve uzamsal çözünürlüğü elde etmek için hem yüksek bir bazal parlaklığa hem de yüksek bir sinyal-gürültü oranına (SNR) sahip olmalıdır. Çift dalga boylu boya Fura Red ve tek dalga boylu boya Fluo-4'ün bir kombinasyonu kullanılarak optimum sonuçlar elde edilmiştir. Fluo-4 ve Fura Red ile birlikte yüklenen hücreler, çift emisyonlu dalga boylu boyaların güçlü foto-ağartılmasının ve çift uyarmalı boyalarla ilişkili zamansal gecikmenin yarattığı zorlukları azaltarak hızlı görüntü elde etmek için uygunluk sağlar. Bu yaklaşım, şekil ve ince hareketlerdeki değişikliklerin görselleştirilmesini daha da kolaylaştırır. Küçük kanal kümelerinin ve hatta tek kanalların1 açılmasından kaynaklanan Ca2+ sinyallerinin görselleştirilmesini sağlamak için uzamsal çözünürlük açısından görüntüleme sistemine de özel talepler getirilmektedir.
Ca2+ sinyali, sinaps oluşumu ve sitokin üretimi vesalınımı 2,3 dahil olmak üzere T hücreleri içindeki bağışıklık fonksiyonlarını aktive etmede çok önemli bir rol oynar. Hücrenin spesifik kaderi, farklı şekilde telaffuz edilen ve yerel olarak dağıtılan Ca2 + sinyalleri, Ca2 + mikro alanları3 aracılığıyla düzenlenir. Özellikle, bu yerel Ca2 + sinyalleri, T hücrelerinde hücre içi Ca2 + seviyelerinde yaygın bir artıştan önce gelir ve Ca2 + mikro alanlarının oluşumu hem Ca2 + girişine hem de 1,4,5 salınımına bağlıdır. T hücre reseptörü (TCR)/CD3 stimülasyonu üzerine, nikotinik asit adenin dinükleotid fosfat (NAADP), D-miyo-inositol 1,4,5-trisfosfat (IP3) ve siklik ADP riboz (cADPR) gibi Ca2+ salgılayan ikinci habercilerin oluşumu tetiklenir ve hücre içi Ca2+ seviyelerinin 1 μM 6,7'ye kadar yükselmesine yol açar. Erken Ca2 + sinyal olayları, endoplazmik retikulum (ER) gibi hücre içi Ca2 + mağazalarından Ca2 + salınımı ile bağlantılıdır ve riyanodin reseptörü 1 (RyR1) ve IP3 reseptörü (IP3R) gibi kanallar bu sinyallemeden ağırlıklı olarak sorumludur. Bu daha sonra hücre dışı Ca2 + akışını tetikler ve mağaza tarafından işletilen Ca2 + girişi (SOCE) 8 yoluyla küresel bir Ca 2+ sinyali ile sonuçlanır. Ek olarak, T hücresi aktivasyonu9 sırasında Ca2+ sinyallemesinde yer alan başka kanallar da vardır, örneğin P2X4 ve P2X7 kanalları, adenozin trifosfat (ATP) bağımlı katyon akışını sağlayarak hücre içi Ca2 + 'daki artışa katkıda bulunur. Dikkat çekici bir şekilde, ilk yapışmaya bağlı Ca2 + mikro alanları (ADCM'ler), TCR stimülasyonundan önce zaten oluşturulmuştur, ancak daha düşük Ca2 + genlikleri ve frekansları vardır. Bu ilk TCR'den bağımsız Ca2+ sinyalleri büyük olasılıkla T hücresinin iltihaplanma bölgesine göçüne hizmet eder ve T hücrelerini enfeksiyon bölgesinde yeniden uyarılma için hazırlar10,11.
Lokal Ca2 + görüntüleme için tarif edilen yöntemi geliştirerek, T hücresi aktivasyonundaki erken Ca2 + sinyallerinin kökenini ve önemini keşfetmek için ek bir araç kazandık. Bu yöntem, kullanıcının daha önce mümkün olandan daha küçük, kısa ömürlü ve daha hızlı oluşan Ca2+ sinyallerini algılamasını sağlar. Ayrıca, Python tabanlı analiz hattı olan Deconvolution, Analysis, Registration, Monitoring ve Shape normalization (DARTS), analiz araçlarının daha geniş bir kitle ile paylaşılmasını sağlar12.
Protokol
Tüm hayvan deneyleri, Hamburg-Eppendorf Üniversitesi Tıp Merkezi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin hayvan refahı yönergelerine uygun olarak onaylanmış ve gerçekleştirilmiştir.
1. Primer fare T hücrelerinin lenf düğümlerinden ve dalaklardan izolasyonu
- Dalakları/lenf düğümlerini etik kurallara göre steril koşullar altında toplayın ve buz gibi soğuk Tıklama ortamı (%10 Fetal Buzağı Serumu (FCS), 2 mM L-Glutamin, Penisilin/Streptomisin (P/S) 100 U/mL, 50 nM β-Merkaptoetanol) içeren bir tüpe koyun.
NOT: Yabani tip ve KO fare T hücreleri aynı şekilde izole edilir. - Santrifüjü 4 °C'ye soğutun.
- Dalak ve lenf düğümlerini steril bir Petri kabına 70 μm'lik bir hücre süzgecine yerleştirin ve toplam 20 mL hacme dalak izolasyon ortamı (RPMI ortamı +% 7.5 NCS +% 1 P / S) ekleyin.
- Plastik bir harç kullanarak dalağı iyice ama nazikçe parçalayın. Hücreleri daha sonra 50 mL'lik bir santrifüj tüpüne aktarın.
NOT: Şimdi 50 mL'lik santrifüj tüpünde toplam 20 mL'lik bir hacim olmalıdır. Dalak ve lenf bezleri tamamen bozulmalıdır. Bu noktadan itibaren buz üzerinde çalışın. Hücreleri buz üzerinde tutmak metabolizmalarını yavaşlatır ve hücre ölümünü önleyerek canlı ve işlevsel olarak sağlam kalmalarını sağlar. Bu, fizyolojik durumlarını daha uzun süre korumaya yardımcı olur, bu da özellikle doğru aşağı akış deneyleri için önemlidir. - Hücre süspansiyonunu 300 ° C'de 5 dakika boyunca 4 x g'da santrifüjleyin.
- Süpernatanı atın ve elde edilen peletin 2 mL Dulbecco'nun Fosfat Tamponlu Salin (DPBS) (Ca2 + ve Mg2 + olmadan) içinde yeniden süspansiyonunu sağlayın. 12 mL'lik yeni bir santrifüj tüpüne aktarın.
2. CD4 + T hücrelerinin negatif seçimi
NOT: CD4 + T hücrelerinin negatif seçimi için, bir FcR blokeri, CD4 + olmayan T hücrelerine karşı biyotinile antikorlar ve streptavidin kaplı manyetik partiküller içeren bir T hücresi izolasyon kiti kullanılır.
- T hücresi izolasyon kitinden hücre süspansiyonuna 20 μL/mL fare FcR blokeri ekleyin.
- Ayrıca, 50 μL / mL konsantrasyonda 100 μL fare CD4 + T hücre izolasyon kokteyli ekleyin, iyice karıştırın ve oda sıcaklığında (RT) 10 dakika inkübe edin.
- Streptavidin kaplı manyetik parçacıkları 30 saniye boyunca vorteksleyin, hücre süspansiyonuna 150 μL ekleyin, iyice karıştırın ve RT'de 2 dakika 30 saniye inkübe edin.
- DPBS'yi hücre süspansiyonuna ekleyin ve toplam 7 mL hacme kadar doldurun. Nazikçe yukarı ve aşağı pipetlediğinizden emin olun, ardından RT'de 2 dakika 30 saniye boyunca mıknatısta inkübe edin.
- Daha sonra, süpernatanttaki zenginleştirilmiş T hücrelerini nazikçe toplayın ve bunları yeni bir 12 mL santrifüj tüpüne aktarın.
- Hücreleri RT'de 300 x g'da 5 dakika santrifüjleyin.
- Süpernatanı atın.
- İzole edilmiş ve zenginleştirilmiş CD4 + T hücrelerini 1 mL DPBS'de yeniden süspanse edin, iyice yukarı ve aşağı pipetleyin. Boncuk kontaminasyonu olmadığından emin olmak için karışımı RT'deki mıknatısta 2 dakika 30 saniye inkübe edin.
- Süpernatanı toplayın, yeni bir santrifüj tüpüne aktarın ve zenginleştirilmiş T hücrelerini sayın.
- Hücreleri saymak için, hücreleri tripan mavisi ile boyayın ve otomatik bir hücre sayacı kullanarak sayın.
NOT: İzole edilmiş CD4 + T hücrelerini doğrudan yüklemek ve bunları aynı izolasyon gününde görüntülemek en iyisidir. Bununla birlikte, primer murin T hücreleri, bir izolasyon ortamında (RPMI 1640 +% 10 FCS + P / S) % 5 CO2 ile 37 ° C'de bir inkübatörde gece boyunca herhangi bir stimülasyon olmadan kültürlenebilir.
3. Birincil fare CD4 + T hücrelerinin yüklenmesi
NOT: Serbest sitozolik Ca2+ konsantrasyonlarını ölçmek için Ca2+ görüntüleme deneylerinde floresan ve membran geçirgen boyalar kullanılır. Fluo-4-asetoksimetil ester () ve oransal boya Fura Red-'nin bir kombinasyonu, yerel Ca2 + sinyallerinin hızlı tespiti için bir gösterge görevi görür. Floresan boyaları kullanırken karanlıkta çalıştığınızdan emin olun.
- 2-5 x 106 hücreyi 5 dakika, 300 x g santrifüjleyin, süpernatanı atın ve 10 μM Fluo-4-(Stok: [1 mM]) ve 20 μM Fura Red-(Stok: [4 mM]) ile 480 μL T hücre ortamında (RPMI 1640,% 10 FCS) yeniden süspanse edin.
- Başlangıçta karanlıkta tezgahın altında RT'de 20 dakika inkübe edin ve şahini alüminyum folyo ile kaplayın.
NOT: Ca2+ göstergeleri DMSO'da seyreltildiğinden, ilk inkübasyon süresini aşmayın, bu da düşük toplam hacimde daha uzun bir maruz kalma süresinde hücreler için zararlı olabilir. Boyaların ışığa duyarlılığı nedeniyle yüklemeden sonra hücreleri ışıktan koruyun. - İlk 20 dakikalık inkübasyonun sonunda, hücrelere 2 mL T hücre ortamı ekleyin ve inkübasyona RT'de karanlıkta 30 dakika daha devam edin.
- Hücre süspansiyonunu RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatanı atın ve peleti 2 mL Ca2+ ölçüm tamponu (140 mM NaCl, 5 mM KCl, 1 mM MgSO4, 1 mM CaCl2, 20 mM HEPES, 1 mM NaH2PO4, 5 mM glikoz, pH 7.4) ile yıkayarak temizleyin ve ardından RT'de 5 dakika boyunca 300 x g'da santrifüjleyin.
- Son olarak, süpernatanı atın ve Ca2+ ölçüm tamponu ile yeniden süspanse edin. Hücre sayısını 10 μL'de ~100.000 hücre olarak ayarlayın.
NOT: Bir ölçüm için 10 μL'lik bir hacim kullanılır. Hücreleri aşırı seyreltmekten kaçının, çünkü ölçüm koşulları için optimum seviyeye ulaşmak için hücre sayısını mikroskop altında daha fazla ayarlamanız gerekebilir. - Tam hücre sızmasını ve boyaların de-esterifikasyonunu sağlamak için hücrelerin ~ 20 dakika inkübe etmesine izin verin. Hücreleri ölçüme kadar buz üzerinde ve karanlıkta saklayın.
NOT: Yüklenen birincil murin T hücreleri, yüklemeden sonra ~ 4 saate kadar kullanılabilir.
4. Yerel Ca2+ görüntüleme
- Slayt hazırlama
- Sığır serum albümini (BSA, 5 mg / mL) ve poli-L-lizin (PLL, 0.1 mg / mL) ile kaplama mikroskobu lameller (24 mm x 46 mm) (Şekil 1A). PLL uygulamadan önce BSA'nın ~ 20 dakika oturmasına izin verin.
NOT: Kaplama, hücre yapışmasını kolaylaştırır. Uygun hücre yapışması için, daha fazla çizgi görünmeyene kadar hem BSA'yı hem de PLL'yi doğru bir şekilde yayın. - Reaksiyon odaları oluşturmak için, yeniden kullanılabilir kauçuk O-ringleri bir silikon macun kullanarak slaytlara yapıştırın (Şekil 1B,C).
NOT: Görüntü elde etmek için 35 mm slaytlar, yeniden kullanılabilir metal hazneler veya 8, 24 veya 48 oyuklu plakalar gibi diğer slaytlar/hazneler veya plakalar kullanılabilir.
- Sığır serum albümini (BSA, 5 mg / mL) ve poli-L-lizin (PLL, 0.1 mg / mL) ile kaplama mikroskobu lameller (24 mm x 46 mm) (Şekil 1A). PLL uygulamadan önce BSA'nın ~ 20 dakika oturmasına izin verin.
- Protein G manyetik boncukların (10 μm çapında) antikorlarla kaplanması
- Protein manyetik boncuk süspansiyonunu yavaşça karıştırın ve 12.5 μL'yi yeni bir tüpe aktarın.
- Depolama tamponunu çıkarmak için tüpü manyetik bir stand üzerine yerleştirin ve boncukların mıknatısa geçmesine izin verin. Depolama tamponunu mıknatısın karşı tarafına pipetleyerek nazikçe çıkarın.
- Kalan depolama tamponunu çıkarmak için, 500 μL PBS-T (PBS, %0,1 Ara) ekleyerek ve 10 saniye boyunca girdaplayarak boncukları yıkayın. Tüpü tekrar manyetik standa yerleştirin ve tamponu çıkarın.
- Boncukları antikorlarla kaplamak için, bunları 7.5 μL PBS-T içinde yeniden süspanse edin ve sırasıyla 5 μL anti-CD3 (0.5 mg / mL) ve anti-CD28 (0.5 mg / mL) ekleyin. RT'de sürekli karıştırarak 30-60 dakika inkübe edin.
- Kaplanmış boncukları 500 μL PBS-T ile üç kez yıkayın, ardından manyetik standı kullanarak 500 μL Ca2+ ölçüm tamponu ile bir kez yıkayın.
- Boncukları 200-400 μL Ca2+ ölçüm tamponunda yeniden süspanse edin.
NOT: Ölçümler sırasında boncuk yoğunluğunu kontrol edin, gerekirse daha fazla seyreltin.
- Lokal Ca2+ görüntüleme mikroskobu
NOT: Görüntüleme, ışık kaynağı olarak bir ksenon ark lambası ile donatılmış, 100 kat büyütmeli bir parlak alan ışık mikroskobu kullanılarak gerçekleştirilir. Kareler, elektron çarpan şarj bağlantılı bir kamera kullanılarak iki katlı gruplama ile 14 bit modunda yakalanır. Her iki boyanın emisyon dalga boylarını kaydetmek ve bölmek için, nm cinsinden aşağıdaki filtreleri içeren bir çift görünüm modülü kullanılır (örn, 480/40; bs, 495; em1, 542/50; em2, 650/57). Görüntüleme kurulumu, görüntü elde etmek için bir toplama merkezi ve görüntüleme yazılımı içerir.- Hazırlanan slaytın üzerine 10 μL yüklü hücre yerleştirin ve 3-5 dakika boyunca slayta yapışmalarına izin verin.
- Slayta yavaşça 80 μL Ca2+ ölçüm tamponu ekleyin.
- 100x yağa daldırma lensini seçin ve küçük bir damla daldırma yağı uygulayın. Slaytı mikroskop masasına yerleştirin.
- Parlak alan modunda odağı ayarlayın, birbiriyle temas halinde olmayan en fazla 10 hücreden oluşan bir görüş alanını dikkatlice seçin ve bir görüntü elde edin.
NOT: Üst üste binen ve birbirine değen hücrelerin daha sonra analiz edilmesi zor olacaktır.- Lambayı açın, floresansı ve T hücrelerinin yüklenmesini kontrol edin ve önceden etkinleştirilmediklerini doğrulamak için her iki kanaldaki hücreleri karşılaştırın.
- Hücre hareketini ve yüklenmesini kontrol etmek için ölçümden önce ve sonra hem parlak alan hem de floresan kanalları için görüş alanının resimlerini çektiğinizden emin olun.
- Ölçümü başlatın ve 5 saniyede 1 kare çekim hızıyla 1 dakika boyunca bazal aktiviteyi yakalayın.
- 1 dakika sonra 10 μL bileşik/uyarıcı (boncuk veya uyarıcı/inhibitör) ekleyin ve saniyede 40 kare veya mümkün olan maksimum kare hızını kullanarak toplam 3 dakika ölçün.
NOT: Boncukların eklenmesi çok önemli bir adımdır; Slaytı hareket ettirmeden boncukların slayt üzerindeki uyarma ışığına yakın yerleştirildiğinden emin olun. WT ve P2x4-/- ve P2x7-/- farelerden boncuk teması üzerine birincil CD4+ T hücrelerindeki Ca 2+ mikro alanlarının temsili örnekleri Şekil 2'de gösterilmektedir.
5. İşlem sonrası / veri analizi
NOT: Görüntü işleme ve veri analizi için Python tabanlı açık kaynaklı boru hattı DARTS kullanılır. Diercks ve ark.13'ün çalışmalarına dayanarak Woelk ve ark.12 tarafından geliştirilmiştir.
- DARTS boru hattının montajı
- Python 3.10.014, anaconda15 ve git16'yı yükleyin ve git clone terminal komutunu kullanarak GitHub deposunu klonlayın : https://github.com/IPMI-ICNS-UKE/DARTS.git
- conda create --name DARTS ile bir conda ortamı oluşturun ve pip install <package> ile gerekli tüm Python paketlerini kurun.
NOT: Daha ayrıntılı bilgi için DARTS GitHub deposu 17,18'deki kurulum talimatlarını izleyin. - Biyobiçimleri kullanmadan önce, Java Runtime Environment'ın doğru şekilde kurulduğundanemin olun 19.
- DARTS boru hattının kullanımı
NOT: Kurulduktan sonra, DARTS terminal penceresinden başlatılabilir.- main.py dosyasını içeren DARTS deposunun (cd path/to/DARTS) yerel kopyasına gidin. Conda ortamının etkinleştirildiğinden emin olun (conda activate DARTS).
- Terminal penceresine python main.py yazıp Enter tuşuna basarak DARTS'ı çalıştırın.
- Grafik kullanıcı arayüzünde (GUI), sol üst bölümde kaynak ve sonuçlar dizininin yanı sıra görüntü formatını belirtin (bkz. Şekil 3).
- Ölçek (mikrometre başına piksel), kare hızı, hücre tipi vb. gibi ölçüm özelliklerini tanımlayın. İşleme boru hattı, belirli görüntü verilerine ve araştırma sorusuna dayalı olarak monte edilebilir.
NOT: Dekonvolüsyon parametreleri hakkında daha fazla bilgi edinin, örneğin, ilgili belgelerde20. - Başlat'a tıklamadan önce ayarları bilgisayara kaydedin. GUI'nin daha ayrıntılı bir açıklaması DARTS belgelerinde bulunabilir.
- Ca2+ mikro alan görüntüleme ve boncuk kontakları
NOT: Boncuklarla lokal görüntüleme ve stimülasyon ve müteakip görüntü analizi için, ilgilenilen ölçüm periyodunun başlangıç noktasını (t = 0) belirlemek için hücreye özgü boncuk kontaklarının kullanıcı tarafından tanımlanması gerekir (bkz. Şekil 4). Bir boncuk teması, ilgilenilen bir hücre ile (uyarıcı) bir boncuğun temas yeri olarak tanımlanır. (1) boncuk temas süresi, örneğin çerçeve 300 ve (2) hücrenin merkezine göre boncuk temas konumu, örneğin saat 1 veya saat 12 spesifikasyonundan oluşur. Mevcut DARTS sürümünde, kullanıcının her bir boncuk kontağı için bilgileri manuel olarak tanımlaması ve girmesi gerekir. Boncuk temas noktalarını tanımlamak için aşağıdaki yordamı kullanın:- Bir boncuk ile ilgilenilen bir hücre arasındaki temas süresini tam olarak belirlemek için kaydırıcıyı kullanın.
- Sağ taraftaki seçenekler menüsünde boncuk temasını seçin: x, y, t.
- Görüntünün sol tarafında, hücre ve boncuğun temas ettiği noktayı seçin.
- İçindeki bir noktayı tıklatarak Hücre seç'i seçin. Bu boncuk tarafından uyarılan hücreye, tercihen merkeze tıklayın.
- Boncuk kontağı ekle'ye tıklayın.
- Bu dosyadaki her ek boncuk teması için 5.3.1- 5.3.5 adımlarını tekrarlayın. Tüm boncuk kontakları tanımlandıktan sonra Devam düğmesine tıklayın.
- Ek dosyalarla devam edin. Son dosyaya ulaşıldıktan sonra, komut dosyası otomatik olarak tüm dosyaların analizini başlatır.
- Veri analizi
- İşlenmiş oran görüntülerini, zaman içinde her hücre için mikro etki alanı verilerini (yerelleştirme, genlik, boyut dahil), dart tahtası projeksiyonu için kaynak verileri ve sonuçlar klasöründeki diğer kaynakları bulun.
- Dart tahtaları oluşturmak için, komut dosyası DartboardPlotGUI.py içeren DARTS klasörünün (desen: cd yolu/to/DARTS/src/analysis) içindeki /src/analysis/ klasörüne gidin. Ardından python DartboardPlotGUI.py yazın ve enter tuşuna basın.
- Gerekli bilgilerin sağlandığından ve sonuçlar klasöründeki elektronik tablo dosyalarının dart tahtası oluşturma için kaynak dosyalar olarak doğru bir şekilde seçildiğinden emin olun.
Sonuçlar
Bu protokolde, grubumuz 1,13 tarafından yapılan önceki çalışmalara dayalı olarak birincil fare T hücrelerindeki ilk Ca2+ mikro alanlarını görüntülemek ve analiz etmek için güncellenmiş bir yöntem belirledik. Bu yaklaşım, ORAI1, STIM1 ve STIM2 gibi CRAC kanallarının yanı sıra RyR1 gibi hücre içi Ca2+ salım kanallarının erken Ca2+ sinyal olaylarında4 katılımının çözülmesinde etkili olmuştur.
Bunu yapmak için, uyarılmamış birincil fare Orai1-/-, Stim1-/-, Stim2-/- ve Ryr1-/- görüntüleyerek spontan Ca2+ mikro alan oluşumunu araştırdık ve bunları WT birincil fare T hücreleri ile karşılaştırdık. Ca2+ mikro alan oluşumunun analizi, sinyal başlangıç hızını, Ca2+ genliğini ve konfokal düzlem başına sinyal sayısını kapsıyordu. Özellikle, Stim2-/- T hücreleri hariç, tüm KO T hücreleri, WT hücrelerine kıyasla lokal Ca2 + sinyallerinde önemli bir azalma ve azalmış bazal serbest sitozolik Ca2 + konsantrasyonu göstermiştir. Bu, Ca2+ mikro alanlarının oluşumunun ORAI1, STIM1 ve RyR14'ün etkileşimiyle karmaşık bir şekilde bağlantılı olduğu sonucuna varmamıza neden oldu. Ek olarak, plazma membranında spontan Ca2+ mikro alanlarını başarıyla tanımladık ve karakterize ettik. Bu Ca2+ mikro alanları, 290 nm ± 12 nm'lik bir Ca2+ genliği ile karakterize edildi. Ca2+ sinyalleri için renk kodlu bir yaklaşımın kullanılması, hücre boyunca Ca2+ mikro alanlarının görselleştirilmesine izin verdi. Sonuçlar ayrıca, milisaniyeler içinde görülebilen Ca2+ mikro alanlarının hızlı başlangıcını ve bu yöntemin birkaç milisaniye uzunluğunda Ca2+ sinyallerini algılama yeteneğini vurguladı4. Bu spontan Ca2+ mikro alanları daha sonra, yalnızca SOCE'ye değil, aynı zamanda FAK/PLC-γ/IP3 sinyal kaskad10 ve P2X49'un katılımı yoluyla da hareket eden, yapışmaya bağlı Ca2+ mikro alanları (ADCM) olarak tanımlandı. Ayrıca, bu teknik, çift oksidaz 1 ve 2'nin (DUOX1/2) NAADP üreten enzimler21 ve HN1L/JPT222'nin yeni keşfedilen NAADP bağlayıcı proteinlerden23 biri olarak doğrulanmasında temeldi.
Şekil 2, WT'nin yanı sıra P2x4-/- ve P2x4-/- farelerden boncuk teması üzerine birincil CD4+ T hücrelerindeki Ca 2+ mikro alanlarının temsili örneklerini göstermektedir. Hücreler Ca2+ boyaları Fluo-4 ve Fura Red ile yüklendi ve 25 ms'lik (40 kare / s) bir edinme hızında görüntülendi. T hücresi sinaps oluşumunu taklit etmek için, hücreler anti-CD3 / anti-CD28 kaplı boncuklarla uyarıldı. İlk Ca2+ mikro alan oluşumu, DARTS boru hattı kullanılarak boncuk temasından 1 saniye önce ve 15 saniye sonrasına kadar analiz edildi. Boncuk teması üzerine, WT hücresi, boncuk temas bölgesinde stimülasyondan sonraki ilk saniyede hızlı Ca2+ mikro alan oluşumu gösterdi (Şekil 2A). Bu Ca2+ mikro alanları, boncuk temasından sonraki 15 saniye içinde hücre boyunca daha da genişledi. WT hücresinin aksine, P2x4-/- ve P2x7-/- hücreleri (Şekil 2B), boncuk stimülasyonu üzerine azalmış Ca2 + mikroalan oluşumunun yanı sıra boncuk temasından önce P2x4-/- daha düşük bir bazal seviye gösterdi. Bu temsili bulgular, Brock ve ark.9 tarafından daha önce yayınlanan sonuçlarla uyumludur ve P2x4-/- ve P2x7-/- hücrelerinde 15 saniyenin üzerinde boncuk temasından hemen sonra WT T hücrelerinde Ca 2+ mikro alan oluşumunu ve çerçeve başına daha düşük sinyalleri gösterir. Ayrıca, P2x4-/- hücrelerindeki genlik önemli ölçüde azaldı ve yapışmaya bağlı Ca2 + mikro alanlarında purinerjik sinyallemenin rolünü daha da belirledi.
Ayrıca, bu yöntem, birincil insan CD4 + T hücrelerinde ilk Ca2 + mikro alanlarını görselleştirmek için de kullanılabilir (Şekil 3). Birincil murin T hücreleri ile uyumlu olarak, boncuk temas bölgesinde ilk Ca2 + mikro alanları uyarılır. Bununla birlikte, genel Ca2 + yanıtı, murin CD4 + T hücrelerine kıyasla farklı bir zaman ölçeğinde ortaya çıkıyor gibi görünmektedir.
Yerel Ca2+ sinyallerinin manuel bir şekilde analizi, bireysel araştırmacı için oldukça zahmetli ve öznel olduğu için mümkün değildir. Bu nedenle, daha önce MATLAB Simulink'te yerel Ca 2+ mikro alanlarını analiz etmek için son işlem13 için görüntü işleme ve optimizasyon araç kutularını kullanarak bir algoritma geliştirdik.
Kısa bir süre önce, Python12 yazılım platformunu kullanarak yüksek çözünürlüklü canlı hücre görüntülemede Ca2+ mikro alan analizi için DARTS adlı yeni, açık kaynaklı, son işlem hattı geliştirdik. Burada, kullanıcının tercihine bağlı olarak farklı evrişim algoritmaları seçilebilir, morfolojik hücre şekli değişikliklerini telafi etmek için gerçekleştirilen bir hücre şekli normalizasyonu ve mikroskop ve ölçüme özgü parametreler tanımlanabilir (örneğin, ölçek, kare hızı, ölçülen süre) (Şekil 4).
Ca2+ mikro alan analizi için parametreler seçildikten sonra, boncuk temasını tanımlamak için her bir ölçüm için ikinci bir açılır pencere açılır (Şekil 5). Boncuk temasını tanımlamak için kullanıcı, kaydırıcıyı kullanarak tiff dosyasında manuel olarak gezinebilir ve boncuk temas çerçevesini tek tek seçebilir. Boncuk teması, boncuk temas yerine tıklanarak seçilir (Şekil 5, boncuk ve boncuk teması, sarı halka ve okla gösterilir) ve ayrıca hücre seçimi. Bu adım, ilgilenilen her hücre için tekrarlanmalıdır. Son olarak, otomatik görüntü işleme uygulanır ve sonuç verileri özetlenir ve bir elektronik tabloya kaydedilir.
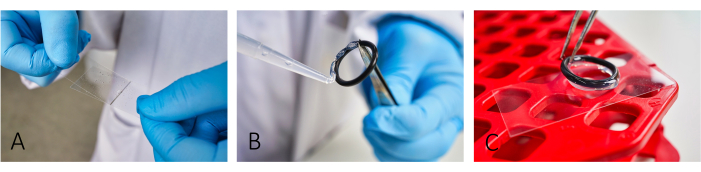
Şekil 1: Görüntüleme için slayt hazırlama iş akışı. (A) İkinci bir cam kapak fişi kullanarak slayta hem BSA hem de PLL'yi ekleyin ve yayın. (B,C) Bir hazne inşa etmek için, kauçuk o-ringleri silikon gres kullanarak sürgünün üzerine yapıştırın. Haznenin uygun şekilde izole edilmesi için tüm halkanın ince bir yağ tabakası ile kaplandığından emin olun. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
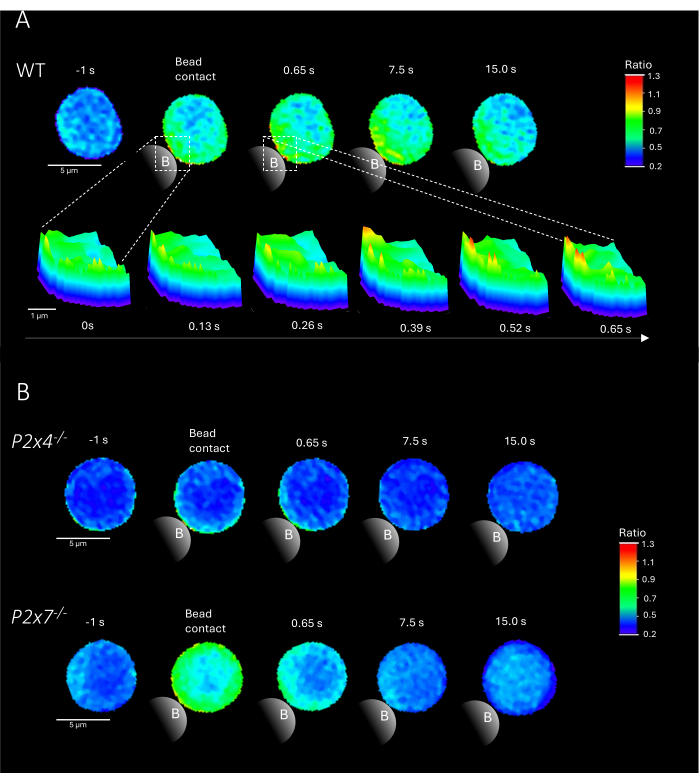
Şekil 2: Primer murin vahşi tip (WT) (A), P2x4-/- veya P2x7-/-(B) CD4+ T hücresinde T hücresi reseptörüne bağımlı Ca2+ mikro alanlarının temsili hücreleri. CD4 + T hücreleri negatif olarak izole edildi ve yukarıda tarif edildiği gibi Fluo-4 ve Fura Red ile yüklendi. T hücreleri, DARTS boru hattı kullanılarak analiz edildi ve daha önce yayınlanmış sonuçlarla karşılaştırılabilir hücre görüntüleri elde edildi9. (A) WT birincil T hücresi, anti-CD3 / anti-CD28 kaplı boncuklarla stimülasyondan 1 saniye önce ve stimülasyondan 15 saniye sonra (ölçek çubuğu 5 μm) ve ayrıca boncuk temas bölgesinde 0 s ila 0,65 s arasında bir yakınlaştırmanın 3D yüzey çizimi (ölçek çubuğu 1 μm). (B) Üst şerit: temsili P2x4-/- birincil T hücresi, boncuk stimülasyonundan 1 saniye önce ve 15 saniye sonraya kadar. Alt şerit: temsili P2x7-/- birincil T hücresi, boncuk stimülasyonundan 1 saniye önce ve boncuk stimülasyonundan 15 saniye sonraya kadar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
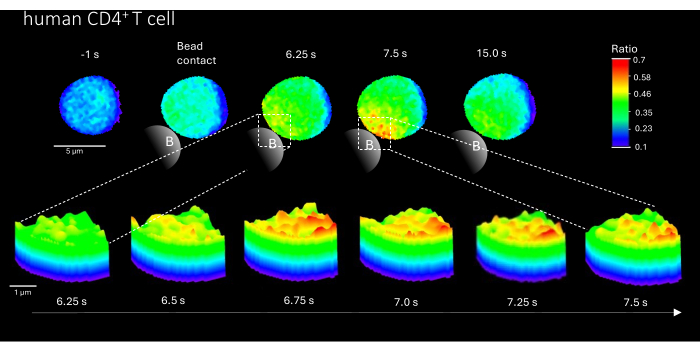
Şekil 3: TCR stimülasyonundan sonra temsili bir birincil insan T hücresinde Ca2+ mikro alanları. Birincil insan CD4 + T hücreleri, periferik kan mononükleer hücrelerinden (PBMC'ler) buffy paltolardan floresanla aktive edilen hücre sınıflandırması (FACS) ile izole edildi ve yukarıda tarif edildiği gibi Fluo-4 ve Fura Red ile yüklendi. Şekil, anti-CD3 kaplı boncuklarla stimülasyondan 1 saniye önce ve stimülasyondan 15 saniye sonra (ölçek çubuğu 5 μm) birincil insan T hücresini ve ayrıca boncuk temas bölgesinde 6,25 sn ila 7,5 sn arasında bir yakınlaştırmanın 3D yüzey grafiğini göstermektedir (ölçek çubuğu 1 μm). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
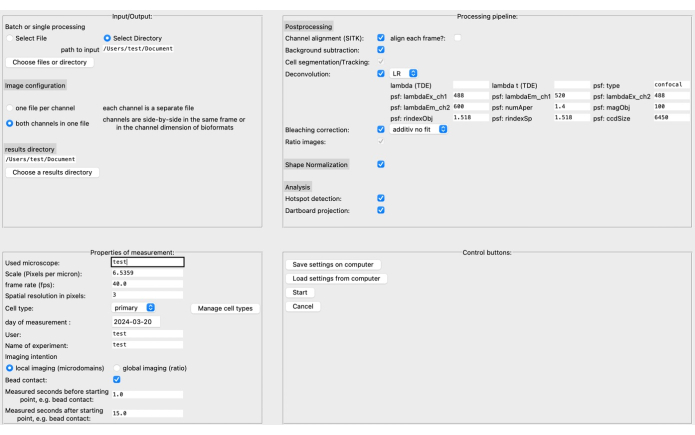
Şekil 4: DARTS grafik kullanıcı arayüzü (GUI). GUI dört alana ayrılmıştır. Giriş/Çıkış alanında, kaynak dizin ve görüntü yapılandırması (dosya başına iki kanal veya ayrı kanallar) ve sonuç dizini dahil olmak üzere ham veriler hakkında bilgi sağlamanız gerekir. Ölçümün Özellikleri alanında, deneyin ölçek (piksel başına mikron), kare hızı ve daha sonra belirlenen başlangıç noktasına göre ölçüm aralığı gibi tüm ilgili bilgileriyle açıklanması gerekir. Daha sonra, işlem sonrası adımlardan, şekil normalleştirmeden ve gerçek analizden (mikro alan algılama ve dart tahtası veri birikimi) oluşan bir işleme boru hattı monte edilebilir. Son olarak, ayarlar bilgisayara kaydedilebilir veya bilgisayardan yüklenebilir. Analiz ayarlandıktan sonra, devam etmek için Başlat'a tıklayın. Kurulum hakkında daha fazla bilgi edinmek için https://ipmi-icns-uke.github.io/DARTS/General/Usage.html ziyaret edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
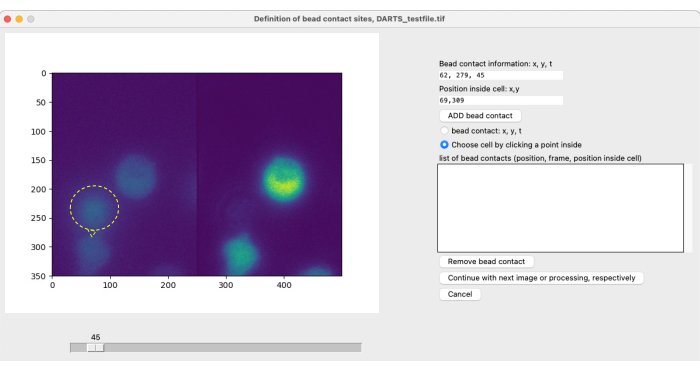
Şekil 5: Boncuk kontaklarının manuel tanımı. Deney sırasında hücrelere boncuklar eklenirse, ilgilenilen bir hücre ile ilk boncuk temas süresi ve temas yeri manuel olarak tanımlanmalıdır. Bu, kaydırıcı ile çerçeveler arasında kaydırarak ve t zaman noktasında bir konum (x,y) bularak yapılır. Boncuk temas bilgileri alanını otomatik olarak doldurmak için kullanıcı, boncuk temas konumunda mikroskop görüntüsünün sol yarısına tıklar. Daha sonra, bir hücreyi boncuk temasıyla ilişkilendirmek için kullanıcı, hücre içinde boncuk kontağı olan bir konuma tıklar. Bilgiler, boncuk ekle seçilerek onaylanmalıdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Antikor kaplı boncuklar yoluyla TCR / CD3 stimülasyonu ile tetiklenen primer murin ve insan T hücrelerinde lokal Ca2+ mikroalanlarının yüksek çözünürlüklü canlı hücre görüntülemesi için kapsamlı bir protokol tanımladık. Ayrıca, yerel Ca2+ sinyallerini tanımlamak ve analiz etmek için kullanıcı dostu ve açık kaynaklı Python tabanlı bir algoritma uyguladık. Özellikle, protokol, TCR / CD3 stimülasyonu bağlamında Ca2+ mikro alanlarının tespiti ile sınırlı değildir, ancak NK hücre hatları (KHYG-1) 12 veya TCR'den bağımsız Ca2+ mikro alanları10,11 gibi diğer (bağışıklık) hücre tiplerine uyarlanabilir.
Protokol içindeki kritik bir adım, uyarıcı boncukların boyutu ve sayısıdır. Bir bağışıklık sinapsını taklit etmek için, boncukların hücrelere benzer boyutta olması gerekir. Bu nedenle, birincil murin ve insan T hücrelerinin yanı sıra hücre hatları (Jurkat ve KHYG1) için 10 μm çapında manyetik boncuklar kullanıyoruz. Ayrıca, her hücre sadece tek bir boncuk tarafından uyarılmalıdır. Bu nedenle, her slayta eklenen boncuk sayısı bir yandan yeterli olmalıdır, ancak görüş alanında çok fazla boncuk varsa, arka plan artar ve tek bir aktivasyon zaman noktası ve temas tarafını tespit etmek mümkün değildir.
Protokol, floresan Ca2+ boyaları Fluo-4 ve FuraRed'yi oransal bir şekilde kullanır, bu nedenle verilerinkalibrasyonuna izin verir 13. Ek olarak, protokol diğer Ca2+ gösterge çiftlerine uyarlanabilir, ancak seçim sürecinde Ca2+ bağlanma kinetiği, hücre altı dağılımı ve fotoağartma1 açısından dikkatli olunmalıdır. Ayrıca, her bir hücre tipi için yükleme koşulları geliştirilmeli ve optimize edilmelidir, ancak burada belirtilen konsantrasyonlar iyi bir başlangıç noktasıdır. Ca2+ mikro alanlarını görselleştirmek için, Ca2+ boyalarının Kd'si 300-1200 nM aralığında olmalı ve çerçeve başına edinme süresi ≤60 ms olmalıdır. Floresan yoğunluğu çok düşükse, filtre setinin kontrol edilmesi gerekir, ancak T hücrelerine iki kat Ca2+ boya yüklemek de mümkündür. Bununla birlikte, Ca2 + boyası diğer organellere yanlış yerleşebilir veya veziküllere sekester olabilir, ancak aynı zamanda bir Ca2 + tamponu olarak işlev görebilir ve Ca2 + tepkilerini etkileyebilir.
Analiz algoritmasının bir sınırlaması, hücrenin küresel bir şeklinin varsayılmasıdır; Bu nedenle, farklı morfolojilere sahip hücre tipleri, analiz araç kutusunun uyarlanmasına ihtiyaç duyabilir. Algoritma, birincil murin T hücrelerinde yerel Ca2+ mikro alanlarının yanı sıra Jurkat T hücreleri ve bir NK hücre hattını (KHYG-1) analiz etmek için kullanılmıştır.12 ve bir murin nöronal hücre hattı için Ca2+ mikro alanlarının analizinde başarılı olmuştur (N2a, yayınlanmamış veriler). Prensip olarak, protokol ve analiz araç kutusu, HEK293 veya HeLa hücreleri gibi küresel olmayan hücre tiplerini analiz etmek için kullanılabilir, ancak bu hücre tipleri için dart tahtası projeksiyonu, hücrelerin yuvarlak bir yapıya ve şekil normalizasyonuna dayandığı için uyarlanamaz. Ek olarak, boncuk stimülasyonu üzerine lokalize başlangıç Ca2+ mikro alanlarını tespit etme protokolü, çözünür aktive edici veya inhibe edici bileşikler gibi diğer uyaranlardan türetilen yerel Ca2+ sinyallerinin yanı sıra yapışmaya bağımlı ve TCR/CD3'ten bağımsız Ca2+ mikro alanlarını analiz etmek için uyarlanabilir10,11. Dikkat çekici bir şekilde, zaman ve konum açısından tek bir boncuk teması tanımlamak, çözünebilir bileşiklerden sonra aktivasyonun başlangıç noktasını belirlemekten daha kolaydır.
Ca2+ mikro alan oluşumunun tespiti için genel bir sınırlama, gerekli yüksek zamansal-uzamsal çözünürlük ve gerekli yüksek sinyal-gürültü oranında (SNR) yatmaktadır. Şu anda, kurulumumuzdan elde edilen çözünürlük, ~0,368 μm'lik hesaplanan uzamsal çözünürlüğe ve ~40 kare/saniye (fps)1 zamansal çözünürlüğe ulaşıyor. Kamera ve dedektör geliştirmedeki son gelişmelerin yanı sıra floresan boyaların iyileştirilmesi, gelecekte daha yüksek zamansal ve mekansal çözünürlüğe sahip Ca2+ göstergeleri kullanılarak canlı hücre görüntüleme için ORAI-GECI (genetik olarak ifade edilen Ca2+ göstergeleri) yapıları24 için tanımlandığı gibi optik tek kanallı kayıtlara ulaşma olasılığına yol açabilir.
Birlikte ele alındığında, burada açıklanan yüksek çözünürlüklü Ca2 + mikro alanlı görüntüleme için protokol ve analiz aracı, yalnızca T hücrelerindeki ilk yerel Ca2 + sinyallerini analiz etmek için değil, aynı zamanda yerel Ca2 + sinyalinin önemini deşifre etmek için diğer hücre tiplerine de uyarlanabilir.
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak kabul edilebilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yürütüldüğünü beyan ederler.
Teşekkürler
Bu çalışma Deutsche Forschungsgemeinschaft (DFG) tarafından desteklenmiştir (proje numarası 335447717; SFB1328, A02'den B-PD ve RW'ye; A14 ile ET arasında; proje numarası 516286863'den B-PD'ye). Yazarlar, kan bağışçılarına ve UKE'deki Transfüzyon Tıbbı Bölümü'ne işbirlikleri için teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| α-CD3 | BD Pharmingen | 553058 | |
| α-CD28 | BD Pharmingen | 553295 | |
| Anaconda | Anaconda | https://docs.anaconda.com/free/anaconda/install/index.html | |
| Bovine serum albumin | Sigma-Aldrich | A2058 | |
| Cell strainer | Biofil | CSS-013-070 | 70 µm diameter |
| Countess Automated Cell Counter | Invitrogen | A49865 | |
| Cover slips | Paul Marienfeld GmbH | 101202 | |
| DARTS | GitHub | https://github.com/IPMI-ICNS-UKE/DARTS | |
| Dulbecco’s Phosphate buffered saline | Gibco, Thermo Fisher | 14190144 | |
| EasySep CD4+ T cell Isolation Kit | Stemcell | 19852 | |
| EasySep Magnetic Multistand | Stemcell | 18010 | |
| Fluo 4-AM | Invitrogen | F14201 | |
| Fura Red-AM | Invitrogen | F3020 | |
| Gibco RPMI 1640 medium | Gibco, Thermo Fisher | 11875093 | |
| Git | GitHub | https://git-scm.com/book/en/v2/Getting-Started-Installing-Git | |
| immersion oil | Leica | 11513859 | |
| Newborn calf serum | Sigma-Aldrich | N4637 | |
| Oracle | Oracle | https://www.oracle.com/de/java/technologies/downloads/ | |
| Penicillin/Streptamycin | Gibco, Thermo Fisher | 15240062 | |
| Poly-L-lysine | Sigma-Aldrich | P4707 | |
| Protein G magnetic beads | Merck | LSKMAGG02 | 10 µM diameter |
| Python | Python | https://www.python.org/downloads/ | |
| Silicon grease (basylone) | Bayer | 291-1220 | |
| Time-Dependent Entropy Deconvolution | GitHub | https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters | |
| Tween | q-biogene | TWEEN201 |
Referanslar
- Wolf, I. M. A., et al. Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor. Sci Signal. 8 (398), 102(2015).
- Taguchi, T., Mukai, K. Innate immunity signalling and membrane trafficking. Curr Opin Cell Biol. 59, 1-7 (2019).
- Trebak, M., Kinet, J. -P. Calcium signalling in T cells. Nat Rev Immunol. 19 (3), 154-169 (2019).
- Diercks, B. -P., et al. ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation. Sci Signal. 11, 0358(2018).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: Elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1 (1), 11-21 (2000).
- Kummerow, C., Junker, C., Kruse, K., Rieger, H., Quintana, A., Hoth, M. The immunological synapse controls local and global calcium signals in T lymphocytes. Immunol Rev. 231 (1), 132-147 (2009).
- Brock, V. J., et al. P2X4 and P2X7 are essential players in basal T cell activity and Ca2+ signaling milliseconds after T cell activation. Sci Adv. 8 (5), 9770(2022).
- Weiß, M., et al. Adhesion to laminin-1 and collagen IV induces the formation of Ca2+ microdomains that sensitize mouse T cells for activation. Sci Signal. 16 (790), 9405(2023).
- Diercks, B. -P. The importance of Ca2+ microdomains for the adaptive immune response. Biochim Biophys Acta Mol Cell Res. 1871 (5), 119710(2024).
- Woelk, L. -M., et al. DARTS: an open-source Python pipeline for Ca2+ microdomain analysis in live cell imaging data. Front Immunol. 14, 1299435(2024).
- Diercks, B. -P., Werner, R., Schetelig, D., Wolf, I. M. A., Guse, A. H. High-resolution calcium imaging method for local calcium signaling. Methods Mol Biol. 1929, 27-39 (2019).
- Python. Python. , Available from: https://www.python.org/downloads/ (2024).
- Anaconda. Anaconda. , Available from: https://docs.anaconda.com/free/anaconda/install/index.html (2024).
- git. git. , Available from: https://git-scm.com/book/en/v2/Getting-Started-Installing-Git (2024).
- DARTS. DARTS. , Available from: https://github.com/IPMI-ICNS-UKE/DARTS (2024).
- DARTS. DARTS GitHub Repository. , Available from: https://ipmi-icns-uke.github.io/DARTS/ (2024).
- Oracle. , Available from: https://www.oracle.com/de/java/technologies/downloads/ (2024).
- Time-Dependent Entropy Deconvolution. , Available from: https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters (2024).
- Gu, F., et al. Dual NADPH oxidases DUOX1 and DUOX2 synthesize NAADP and are necessary for Ca2+ signaling during T cell activation. Sci Signal. 14 (709), 3800(2021).
- Roggenkamp, H. G., et al. HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation. Sci Signal. 14 (675), 5647(2021).
- Heßling, L. D., Troost-Kind, B., Weiß, M. NAADP-binding proteins - Linking NAADP signaling to cancer and immunity. Biochim Biophy. Acta Mol Cell Res. 1870 (7), 119531(2023).
- Dynes, J. L., Amcheslavsky, A., Cahalan, M. D. Genetically targeted single-channel optical recording reveals multiple Orai1 gating states and oscillations in calcium influx. Proc Natl Acad Sci U S A. 113 (2), 440-445 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır