Method Article
Визуализация начальных микродоменов Ca2+ в первичных Т-клетках
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этой статье мы предоставляем комплексный протокол для определения начальных локальных сигналов Ca2+ , известных как микродомены Ca2+ , в первичных Т-клетках мыши и человека с помощью флуоресцентной микроскопии. Этот протокол служит ценным ресурсом для исследователей, изучающих сигнальные пути Ca2+ в иммунных клетках и для дальнейшего раскрытия их функции.
Аннотация
Локальные, субсекундные сигналы Ca2+ , называемые микродоменами Ca2+ , представляют собой высокодинамичные и короткоживущие сигналы Ca2+ , которые приводят к глобальному повышению [Ca2+]i и уже могут определять судьбу Т-клеток. При активации Т-клеточных рецепторов NAADP образуется быстро, связываясь с связывающими белками NAADP (HN1L/JPT2, LSM12) и их соответствующими рецепторами (RyR1, TPC2), находящимися во внутриклеточных хранилищахCa2+ , таких как ER и лизосомы, и приводя к последующему высвобождению и повышению [Ca2+]i. Чтобы зафиксировать эти быстрые и динамично возникающие сигналы Ca2+ , мы разработали метод визуализации с высоким разрешением, использующий комбинацию двух индикаторов Ca2+ : Fluo-4 AM и FuraRed AM. Для постобработки был разработан полуавтоматизированный подход к обнаружению микродоменов Ca2+ с открытым исходным кодом на основе языка программирования Python. Используя этот рабочий процесс, мы можем надежно обнаруживать микродомены Ca2+ на субклеточном уровне в первичных мышиных и человеческих Т-клетках в флуоресцентных видео с высоким временным и пространственным разрешением. Этот метод также может быть применен к другим типам клеток, таким как NK-клетки и клеточные линии нейронов мышей.
Введение
Представленный метод флуоресцентной микроскопии позволяет визуализировать локальные, временные начальные сигналы кальция (Ca2+) в первичных Т-клетках мыши, называемых микродоменами Ca2+ . Микродомены Ca2+ представляют собой высокодинамичные и короткоживущие сигнальные события Ca2+ , что создает проблемы для эффективной визуализации и анализа живых клеток1.
Т-клетки представляют трудности для визуализации живых клеток из-за относительных различий в интенсивности центральной и периферической флуоресценции, что можно объяснить их сферической формой и небольшим диаметром ~6-8 мкм. После стимуляции и формирования иммунных синапсов Т-клетки претерпевают морфологические изменения, что еще больше усложняет визуализацию Т-клеток1. Таким образом, использование ратиометрического анализа становится обязательным, что достигается либо путем записи двух изображений, представляющих различные свойства красителя Ca2+ , либо использования комбинации двух красителей Ca2+ . К требовательным характеристикам микродоменов Ca2+ относится их быстрая, временная и пространственная ограниченность. Чтобы зафиксировать это, используемые красители Ca2+ должны обладать как высокой базальной яркостью, так и высоким отношением сигнал/шум (SNR) для получения максимально возможного временного и пространственного разрешения. Оптимальные результаты были достигнуты при использовании комбинации двухволнового красителя Fura Red и одноволнового красителя Fluo-4. Совместная загрузка ячеек с Fluo-4 и Fura Red смягчает проблемы, связанные с сильным фотообесцвечиванием красителей с двойной эмиссией и временной задержкой, связанной с красителями с двойным возбуждением, обеспечивая пригодность для быстрого получения изображений. Такой подход еще больше облегчает визуализацию изменений формы и тонких движений. Особые требования также предъявляются к системе формирования изображений с точки зрения пространственного разрешения, позволяющего визуализировать сигналы Ca2+ , исходящие от открытия небольших кластеров каналов или даже отдельных каналов1.
Передача сигналов Ca2+ играет ключевую роль в активации иммунных функций в Т-клетках, включая образование синапсов и выработку и высвобождение цитокинов 2,3. Специфическая судьба клетки регулируется через по-разному выраженные и локально распределенные сигналы Ca2+, микродомены Ca2+ 3. Примечательно, что эти локальные сигналы Ca2+ предшествуют широкому повышению внутриклеточных уровней Ca2+ в Т-клетках, а образование микродоменов Ca2+ зависит как от поступления, так и от высвобождения Ca2+ 1,4,5. При стимуляции Т-клеточными рецепторами (TCR)/CD3 происходит образование вторичных мессенджеров, высвобождающих Ca2+, таких как адениндинуклеотидфосфат никотиновой кислоты (NAADP), D-мио-инозитол 1,4,5-трисфосфат (IP3) и циклическая АДФ-рибоза (cADPR), что приводит к повышению внутриклеточного уровня Ca2+ до 1 мкМ 6,7. Ранние сигнальные события Ca2+ связаны с высвобождением Ca2+ из внутриклеточных хранилищ Ca2+, таких как эндоплазматический ретикулум (ER), при этом такие каналы, как рецептор рианодина 1 (RyR1) и рецептор IP3 (IP3R), являются преимущественно ответственными за эту сигнализацию. Это впоследствии вызывает внеклеточный приток Ca2+ и приводит к глобальному сигналу Ca2+ через управляемый хранилищем вход Ca2+ (SOCE)8. Кроме того, существуют и другие каналы, участвующие в передаче сигналов Ca2+ во время активации Т-клеток9, например, каналы P2X4 и P2X7 обеспечивают аденозинтрифосфат (АТФ)-зависимый приток катионов, способствуя повышению внутриклеточного Ca2+. Примечательно, что первоначальные адгезионно-зависимые микродомены Ca2+ (ADCM) формируются еще до стимуляции TCR, но с более низкими амплитудами и частотами Ca2+. Эти первоначальные TCR-независимые сигналыCa2+, скорее всего, служат миграции Т-клеток к месту воспаления и подготавливают Т-клетки к рестимуляции в месте инфекции10,11.
Разработав описанный метод локальной визуализации Ca2+ , мы получили дополнительный инструмент для изучения происхождения и значения ранних сигналов Ca2+ в активации Т-клеток. Этот метод позволяет пользователю обнаруживать более мелкие, кратковременные и более быстро возникающие сигналы Ca2+ , чем это было возможно ранее. Кроме того, Deconvolution, Analysis, Registration, Tracking, and Shape Normalization (DARTS), конвейер анализа на основе Python, позволяет делиться инструментами анализа с болееширокой аудиторией.
протокол
Все эксперименты на животных были одобрены и проведены в соответствии с рекомендациями по благополучию животных Комитета по институциональному уходу за животными и их использованию в Университетской клинике Гамбург-Эппендорф.
1. Выделение первичных Т-клеток мыши из лимфатических узлов и селезенки
- Забор селезенки/лимфатических узлов в стерильных условиях в соответствии с этическими нормами и помещение их в пробирку с ледяной средой Clicks (10% сыворотка плода теленка (FCS), 2 мМ L-глютамина, пенициллин/стрептомицин (P/S) 100 ЕД/мл, 50 нМ β-меркаптоэтанол).
ПРИМЕЧАНИЕ: Мышиные Т-клетки дикого типа и KO выделяются таким же образом. - Охладите центрифугу до 4 °C.
- Поместите селезенку и лимфатические узлы в клеточное ситечко размером 70 мкм в стерильной чашке Петри и добавьте среду для изоляции селезенки (среда RPMI + 7,5 % NCS + 1 % P/S) до общего объема 20 мл.
- Тщательно, но аккуратно разрушьте работу селезенки с помощью пластиковой ступки. После этого переложите клетки в центрифужную пробирку объемом 50 мл.
ПРИМЕЧАНИЕ: Теперь в центрифужной пробирке объемом 50 мл должен находиться общий объем 20 мл. Работа селезенки и лимфатических узлов должна быть полностью нарушена. С этого момента работайте на льду. Удержание клеток на льду замедляет их метаболизм и предотвращает их гибель, гарантируя, что они останутся жизнеспособными и функционально неповрежденными. Это помогает сохранить их физиологическое состояние в течение более длительного периода времени, что особенно важно для точных последующих экспериментов. - Центрифугируйте клеточную суспензию при 300 x g в течение 5 мин при 4 °C.
- Выбросьте надосадочную жидкость и обеспечьте ресуспендирование полученной гранулы в 2 мл фосфатно-солевого буфера Дульбекко (DPBS) (без Ca2+ и Mg2+). Переложите в новую центрифужную пробирку объемом 12 мл.
2. Отрицательный отбор CD4+ Т-клеток
Примечание: Для отрицательного отбора CD4+ Т-клеток используется набор для выделения Т-клеток, содержащий блокатор FcR, биотинилированные антитела против не-CD4+ Т-клеток и магнитные частицы, покрытые стрептавидином.
- Добавьте в клеточную суспензию 20 мкл/мл мышиного блокатора FcR из набора для выделения Т-клеток.
- Далее добавьте 100 мкл коктейлей для выделения CD4+ Т-клеток мыши в концентрации 50 мкл/мл, хорошо перемешайте и инкубируйте в течение 10 минут при комнатной температуре (RT).
- Магнитные частицы, покрытые вихревым стрептавидином, в течение 30 с добавить 150 мкл в клеточную суспензию, хорошо перемешать и инкубировать в течение 2 мин 30 с при РТ.
- Добавьте DPBS в клеточную суспензию, заполнив ее до общего объема 7 мл. Осторожно проводите пипеткой вверх и вниз, затем инкубируйте в магните в течение 2 мин 30 с при RT.
- Затем аккуратно соберите обогащенные Т-клетки в надосадочную жидкость и перенесите их в новую центрифужную пробирку объемом 12 мл.
- Центрифугируйте ячейки при 300 x g при RT в течение 5 мин.
- Выбросьте надосадочную жидкость.
- Ресуспендируйте выделенные и обогащенные CD4+ Т-клетки в 1 мл DPBS, тщательно пипетируя вверх и вниз. Инкубируйте смесь в течение 2 мин 30 с в магните при RT, чтобы убедиться в отсутствии загрязнения шариков.
- Соберите надосадочную жидкость, перенесите ее в новую центрифужную пробирку и подсчитайте обогащенные Т-клетки.
- Чтобы подсчитать клетки, покрасьте их трипановым синим цветом и подсчитайте с помощью автоматического счетчика клеток.
ПРИМЕЧАНИЕ: Лучше всего напрямую загрузить выделенные CD4+ Т-клетки и визуализировать их в тот же день изоляции. Тем не менее, первичные мышиные Т-клетки можно культивировать без какой-либо стимуляции в течение ночи в инкубаторе при 37 °C с 5 % CO2 в изоляционной среде (RPMI 1640 + 10% FCS + P/S).
3. Загрузка первичных CD4+ Т-клеток мыши
Примечание: Для измерения концентраций свободного цитозольного Ca2+ в экспериментах по визуализации Ca2+ используются флуоресцентные и мембранопроницаемые красители. Комбинация флуо-4-ацетоксиметилового эфира (АМ) и ратиометрического красителя Фура Ред-АМ служит индикатором для быстрого обнаружения локальных сигналов Са2+ . Убедитесь, что вы работаете в темноте при использовании флуоресцентных красителей.
- Центрифугируйте 2-5 x 106 клеток в течение 5 мин, 300 x g, отбрасывают надосадочную жидкость и ресуспендируют в 480 мкл среды Т-клеток (RPMI 1640, 10% FCS) с 10 мкМ Fluo-4-AM (стока: [1 mM]) и 20 мкМ Fura Red-AM (стока: [4 mM]).
- Инкубировать первоначально в течение 20 мин при РТ под скамейкой в темное время суток, накрыв сокола алюминиевой фольгой.
ПРИМЕЧАНИЕ: Не превышайте время первой инкубации, так как показатели Ca2+ разбавлены в ДМСО, что может быть вредно для клеток при более длительном времени воздействия в низком общем объеме. Держите клетки защищенными от света после загрузки из-за светочувствительности красителей. - В конце начальной 20-минутной инкубации добавьте в клетки 2 мл Т-клеточной среды и продолжайте инкубацию еще 30 минут в темноте при РТ.
- Центрифугируйте клеточную суспензию при 300 x g в течение 5 мин при RT.
- Выбросьте надосадочную жидкость и очистите гранулу, промыв ее 2 мл мерного буфера Ca2+ (140 мМ NaCl, 5 мМ KCl, 1 мМ MgSO4, 1 мМ CaCl2, 20 мМ HEPES, 1 мМ2PO4, 5 мМ глюкозы, pH 7,4) с последующим центрифугированием при 300 x g в течение 5 мин при ЛТ.
- Наконец, выбросьте надосадочную жидкость и снова суспендируйте ее с помощью измерительного буфера Ca2+ . Отрегулируйте количество ячеек до ~100 000 ячеек на 10 μл.
ПРИМЕЧАНИЕ: Для одного измерения используется объем 10 μL. Избегайте чрезмерного разбавления ячеек, так как для достижения оптимального для условий измерения может потребоваться дальнейшая корректировка количества клеток под микроскопом. - Дайте клеткам инкубироваться в течение ~20 минут, чтобы обеспечить полную инфильтрацию клеток и деэтерификацию красителей. Храните клетки на льду и в темноте до измерения.
ПРИМЕЧАНИЕ: Загруженные первичные мышиные Т-клетки можно использовать до ~4 часов после загрузки.
4. Локальная визуализация Ca2+
- Подготовка предметного стекла
- Покровные стекла для микроскопа (24 мм x 46 мм) с бычьим сывороточным альбумином (BSA, 5 мг/мл) и поли-L-лизином (PLL, 0,1 мг/мл) (рис. 1A). Дайте BSA постоять ~20 минут перед нанесением PLL.
ПРИМЕЧАНИЕ: Покрытие способствует адгезии клеток. Для правильной адгезии клеток аккуратно распределите BSA и PLL до тех пор, пока не исчезнут полосы. - Чтобы создать реакционные камеры, приклейте к предметным стеклам многоразовые резиновые уплотнительные кольца с помощью силиконовой пасты (рис. 1B, C).
ПРИМЕЧАНИЕ: Для получения изображений можно использовать другие предметные стекла/камеры или планшеты, такие как 35-миллиметровые слайды, многоразовые металлические камеры или 8-, 24- или 48-луночные планшеты.
- Покровные стекла для микроскопа (24 мм x 46 мм) с бычьим сывороточным альбумином (BSA, 5 мг/мл) и поли-L-лизином (PLL, 0,1 мг/мл) (рис. 1A). Дайте BSA постоять ~20 минут перед нанесением PLL.
- Покрытие магнитных шариков протеина G (диаметром 10 мкм) антителами
- Аккуратно перемешайте протеин магнитной суспензии и переложите 12,5 мкл в новую пробирку.
- Поместите трубку на магнитную подставку, чтобы снять буфер для хранения и позволить бусинам мигрировать к магниту. Аккуратно снимите буфер для хранения, нанеся его пипеткой на противоположную сторону магнита.
- Чтобы удалить остатки буфера для хранения, промойте шарики, добавив 500 μL PBS-T (PBS, 0,1% Tween) и взбейте в течение 10 секунд. Снова поместите трубку в магнитную подставку и снимите буфер.
- Чтобы покрыть гранулы антителами, ресуспендируйте их в 7,5 мкл PBS-T и добавьте 5 мкл анти-CD3 (0,5 мг/мл) и анти-CD28 (0,5 мг/мл) соответственно. Инкубировать в течение 30-60 мин при непрерывном перемешивании при RT.
- Трижды промыть покрытые шарики 500 мкл PBS-T, а затем один раз промыть 500 мкл мерного буфера Ca2+ с помощью магнитной подставки.
- Суспендируйте гранулы в 200-400 мкл мерного буфера Ca2+.
ПРИМЕЧАНИЕ: Проверяйте плотность валиков во время измерений, при необходимости дополнительно разбавляйте.
- Локальная микроскопия с визуализацией Ca2+
ПРИМЕЧАНИЕ: Визуализация осуществляется с помощью светлопольного светового микроскопа со 100-кратным увеличением, оснащенного ксеноновой дуговой лампой в качестве источника света. Кадры захватываются в 14-битном режиме с двукратным биннингом с помощью камеры с зарядовой привязкой, умножающей электроны. Для записи и разделения длин волн излучения обоих красителей используется двухвидовой модуль, содержащий следующие фильтры в нм (например, 480/40; bs, 495; em1, 542/50; em2, 650/57). Система обработки изображений включает в себя концентратор сбора данных и программное обеспечение для получения изображений.- Поместите 10 μл загруженных ячеек на подготовленное предметное стекло и дайте им прикрепиться к предметному стеклу на 3-5 минут.
- Аккуратно добавьте 80 мкл мерного буфера Ca2+ на предметное стекло.
- Выберите 100-кратную масляную иммерсионную линзу и нанесите небольшую каплю иммерсионного масла. Поместите предметное стекло на стол микроскопа.
- Отрегулируйте фокус в режиме светлого поля, тщательно выберите поле зрения, содержащее до 10 ячеек, которые не соприкасаются друг с другом, и получите изображение.
ПРИМЕЧАНИЕ: Перекрывающиеся и соприкасающиеся клетки будет трудно проанализировать позже.- Включите лампу, проверьте флуоресценцию и нагрузку Т-клеток, а также сравните клетки в обоих каналах, чтобы убедиться, что они не активированы.
- Обязательно сделайте снимки поля зрения как для светлопольных, так и для флуоресцентных каналов до и после измерения, чтобы проверить движение и нагрузку ячейки.
- Начните измерение и захватите базальную активность в течение 1 минуты со скоростью захвата 1 кадр в 5 секунд.
- Добавьте 10 μL соединения/стимулятора (шарика или стимулятора/ингибитора) через 1 минуту и измеряйте в общей сложности 3 минуты, используя 40 кадров в секунду или максимально возможную частоту кадров.
ПРИМЕЧАНИЕ: Добавление бусин является решающим шагом; Убедитесь, что бусины добавлены близко к возбуждающему свету на предметном стекле, не двигая предметное стекло. Репрезентативные примеры микродоменов Ca2+ в первичных CD4+ Т-клетках при контакте с шариками от WT и мышей P2x4-/- и P2x7-/- показаны на рисунке 2.
5. Постобработка / анализ данных
ПРИМЕЧАНИЕ: Для обработки изображений и анализа данных используется конвейер с открытым исходным кодом DARTS на основе Python. Он был разработан Woelk et al.12 на основе работы Diercks et al.13.
- Монтаж трубопровода DARTS
- Установите Python 3.10.014, anaconda15 и git16 и клонируйте репозиторий GitHub с помощью команды терминала git clone: https://github.com/IPMI-ICNS-UKE/DARTS.git
- Создайте среду conda с помощью conda create --name DARTS и установите все необходимые пакеты Python с помощью pip install <package>.
ПРИМЕЧАНИЕ: Следуйте инструкциям по установке в репозитории DARTS GitHub17,18 для получения более подробной информации. - Перед использованием биоформатов убедитесь, что среда выполнения Java правильно установлена19.
- Использование конвейера DARTS
ПРИМЕЧАНИЕ: После установки DARTS можно запустить из окна терминала.- Перейдите к локальной копии репозитория DARTS (cd path/to/DARTS), содержащей файл main.py. Убедитесь, что среда conda активирована (conda activate DARTS).
- Запустите DARTS, введя main.py python в окне терминала и нажав Enter.
- В графическом интерфейсе пользователя (GUI) укажите исходный каталог и каталог результатов, а также формат изображения в верхнем левом разделе (см. рис. 3).
- Определите свойства измерения, такие как масштаб (пикселей на микрометр), частота кадров, тип ячейки и т. д. Конвейер обработки может быть собран на основе конкретных данных изображения и исследовательского вопроса.
ПРИМЕЧАНИЕ: Подробнее о параметрах деконволюции, например, читайте в соответствующей документации20. - Сохраните настройки на компьютере перед нажатием кнопки «Пуск». Более подробное описание графического интерфейса можно найти в документации DARTS.
- Визуализация микродоменов Ca2+ и контакты с шариками
ПРИМЕЧАНИЕ: Для локальной визуализации и стимуляции с помощью шариков и последующего анализа изображения пользователь должен определить контакты, специфичные для клеток, чтобы определить начальную точку (t = 0) интересующего нас периода измерения (см. рис. 4). Контакт бусины определяется как место контакта (стимулирующей) бусины с интересующей клеткой. Он состоит из указания (1) времени контакта борта, например, с кадром 300, и (2) положения контакта с бортом относительно центра ячейки, например, в положении «1 час» или «12 часов». В текущей версии DARTS пользователю необходимо вручную определить и ввести информацию для каждого контакта со швами. Используйте следующую процедуру для определения контактов швов:- Используйте ползунок, чтобы точно определить время контакта между бусиной и интересующей клеткой.
- В меню опций справа выберите контакт шва: x, y, t.
- Выберите место в левой части изображения, где клетка и бусина соприкасаются.
- Выберите Выбрать ячейку, щелкнув точку внутри. Кликните по стимулируемой этой бусиной ячейке, желательно в центре.
- Нажмите на кнопку ДОБАВИТЬ контакт с шариком.
- Повторите шаги 5.3.1 - 5.3.5 для каждого дополнительного контакта валика в этом файле. После того, как все контакты валиков определены, нажмите кнопку «Продолжить ».
- Перейдите к работе с дополнительными файлами. После того, как будет достигнут последний файл, скрипт автоматически инициирует анализ всех файлов.
- Анализ данных
- В папке результатов можно найти обработанные изображения соотношений, данные микродоменов для каждой ячейки с течением времени (включая локализацию, амплитуду, размер), исходные данные для проекции дартс и другие ресурсы.
- Чтобы создать доски для дартса, перейдите в папку /src/analysis/ внутри папки DARTS (шаблон: cd path/to/DARTS/src/analysis), содержащую скрипт DartboardPlotGUI.py. Затем введите python DartboardPlotGUI.py и нажмите Enter.
- Убедитесь, что предоставлена необходимая информация и что файлы таблиц из папки результатов точно выбраны в качестве исходных файлов для создания доски для дартса.
Результаты
В этом протоколе мы изложили обновленный метод визуализации и анализа начальных микродоменов Ca2+ в первичных Т-клетках мыши, основанный на предыдущей работе нашей группы 1,13. Этот подход сыграл важную роль в раскрытии участия каналов CRAC, таких как ORAI1, STIM1 и STIM2, а также внутриклеточных каналов высвобождения Ca2+, таких как RyR1, в ранних сигнальных событиях Ca2+ 4.
Для этого мы исследовали спонтанное образование микродомена Ca2+ путем визуализации нестимулированных первичных мышей Orai1-/-, Stim1-/-, Stim2-/- и Ryr1-/- и сравнили их с первичными Т-клетками мыши WT. Анализ формирования микродомена Ca2+ охватывал скорость начала сигнала, амплитуду Ca2+ и количество сигналов в конфокальной плоскости. Примечательно, что за исключением Stim2-/- Т-клеток, все KO Т-клетки продемонстрировали значительное снижение локальных сигналовCa2+ и сниженную базальную концентрацию свободного цитозольногоCa2+ по сравнению с WT-клетками. Это привело нас к выводу, что образование микродоменов Ca2+ неразрывно связано с взаимодействием ORAI1, STIM1 и RyR14. Кроме того, мы успешно идентифицировали и охарактеризовали спонтанные микродомены Ca2+ на плазматической мембране. Эти микродомены Ca2+ характеризовались амплитудой Ca2+ 290 нм ± 12 нм. Использование цветового кодирования сигналов Ca2+ позволило визуализировать микродомены Ca2+ по всей клетке. Полученные результаты также свидетельствуют о быстром возникновении микродоменов Ca2+, видимом в течение миллисекунд, и о способности этого метода обнаруживать сигналы Ca2+ с длительностью в несколько миллисекунд4. Эти спонтанные микродомены Ca2+ были позже идентифицированы как адгезионно-зависимые микродомены Ca2+ (ADCM), зависящие не только от SOCE, но и действующие через сигнальный каскад10 FAK/PLC-γ/IP3 и вовлечение P2X49. Кроме того, этот метод был основополагающим в подтверждении двойных оксидаз 1 и 2 (DUOX1/2) в качестве ферментов21, продуцирующих NAADP, и HN1L/JPT222в качестве одного из недавно открытых NAADP-связывающих белков23.
На рисунке 2 показаны репрезентативные примеры микродоменов Ca2+ в первичных CD4+ Т-клетках при контакте с шариками WT, а также у мышей P2x4-/- и P2x7-/-. Клетки были загружены красителями Ca2+ Fluo-4 AM и Fura Red AM и визуализированы со скоростью сбора данных 25 мс (40 кадров/с). Чтобы имитировать образование синапсов Т-клеток, клетки стимулировали гранулами, покрытыми анти-CD3/анти-CD28. Исходное образование микродомена Ca2+ анализировали за 1 с до и до 15 с после контакта с шариком с помощью конвейера DARTS. При контакте с шариком в клетке WT наблюдалось быстрое образование микродоменов Ca2+ в первую секунду после стимуляции в месте контакта с шариком (рис. 2A). Эти микродомены Ca2+ далее расширялись по всей клетке в течение следующих 15 с после контакта с шариками. В отличие от WT-клеток, P2x4-/- и P2x7-/-клетки (рис. 2B) показали снижение образования микродоменаCa2+ при стимуляции шариками, а также для P2x4-/-a более низкий базальный уровень до контакта с шариками. Эти репрезентативные результаты согласуются с ранее опубликованными результатами Brock et al.9, указывающими на образование микродоменаCa2+ в клетках WT непосредственно после контакта с шариками в течение 15 с и ниже сигналов на кадр в клетках P2x4-/- и P2x7-/- . Кроме того, амплитуда в P2x4-/-клетках была значительно снижена, что еще больше установило роль пуринергической передачи сигналов в адгезионно-зависимых микродоменах Ca2+ .
Кроме того, этот метод также может быть использован для визуализации начальных микродоменов Ca2+ в первичных CD4+ Т-клетках человека (рис. 3). В соответствии с первичными мышиными Т-клетками, начальные микродомены Ca2+ вызываются в месте контакта с шариками. Тем не менее, общий ответ Ca2+ , по-видимому, происходит в другом временном масштабе по сравнению с мышиными CD4+ Т-клетками.
Анализ локальных сигналов Ca2+ вручную невозможен, так как он является достаточно трудоемким и субъективным для конкретного исследователя. Поэтому мы ранее разработали алгоритм в MATLAB Simulink с использованием его инструментов обработки изображений и оптимизации для постобработки13 для анализа локальных микродоменов Ca2+ .
Недавно мы разработали новый конвейер постобработки с открытым исходным кодом под названием DARTS для анализа микродомена Ca2+ в визуализации живых клеток с высоким разрешением с использованием программной платформы Python12. В этом случае можно выбрать различные алгоритмы деконволюции, в зависимости от предпочтений пользователя, выполнить нормализацию формы клетки для компенсации морфологических изменений формы клетки, а также определить специфические параметры микроскопа и измерения (например, масштаб, частоту кадров, измеренное время) (рис. 4).
После выбора параметров для анализа микродомена Ca2+ для каждого отдельного измерения открывается второе всплывающее окно для определения контакта с шариком (рис. 5). Чтобы определить контакт шва, пользователь может вручную прокрутить файл tiff с помощью ползунка и выбрать рамку контакта шва по отдельности. Контакт борта выбирается щелчком мыши на месте контакта борта (рисунок 5, контакт борта и борта обозначен желтым кольцом и стрелкой), а также выбором ячейки. Этот шаг необходимо повторить для каждой интересующей клетки. Наконец, применяется автоматическая постобработка изображений, а данные результатов обобщаются и сохраняются в электронной таблице.
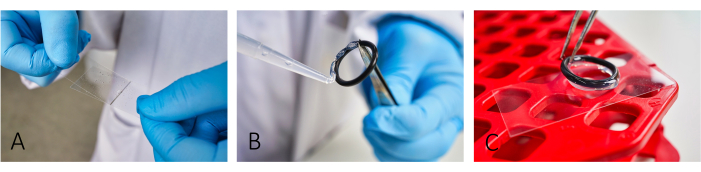
Рисунок 1: Рабочий процесс подготовки слайдов к визуализации. (A) Добавьте и распределите BSA и PLL на предметном стекле с помощью второго стекла. (В,В) Чтобы построить камеру, приклейте резиновые уплотнительные кольца с помощью силиконовой смазки к предметному стеколу. Убедитесь, что все кольцо покрыто тонким слоем смазки, чтобы обеспечить надлежащую изоляцию камеры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
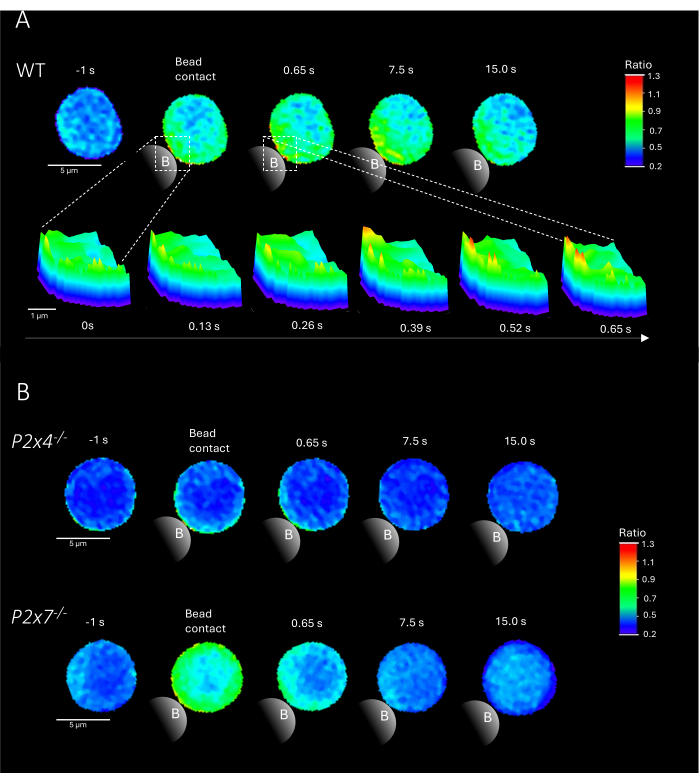
Рисунок 2: Репрезентативные клетки Т-клеточных рецептор-зависимых микродоменов Ca2+ в первичной мышиной дикой клетке (WT) (A), P2x4-/- или P2x7-/-(B) CD4+ Т. CD4+ Т-клетки отрицательно выделяли и загружали Fluo-4 AM и Fura Red, как описано выше. Т-клетки анализировали с помощью конвейера DARTS, в результате чего изображения клеток были сопоставимы с ранее опубликованными результатами9. (A) WT первичная Т-клетка за 1 с до стимуляции гранулами, покрытыми анти-CD3/анти-CD28, и до 15 с после стимуляции (масштабная линейка 5 мкм), а также 3D поверхностный график увеличения от 0 с до 0,65 с в области контакта бусин (масштабная линейка 1 мкм). (B) Верхняя полоса: репрезентативная P2x4-/- первичная Т-клетка за 1 с до и до 15 с после стимуляции бусинами. Нижняя полоса: репрезентативная P2x7-/- первичная Т-клетка за 1 с до и до 15 с после стимуляции бусинами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
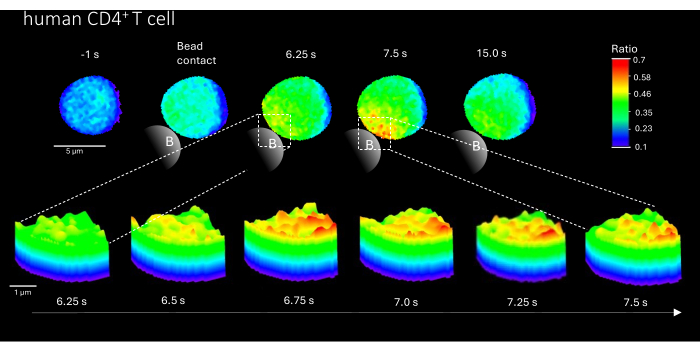
Рисунок 3: Микродомены Ca2+ в репрезентативной первичной Т-клетке человека после стимуляции TCR. Первичные человеческие CD4+ Т-клетки были выделены из мононуклеарных клеток периферической крови (PBMC) методом флуоресцентно-активируемой сортировки клеток (FACS) из охристых оболочек и загружены Fluo-4 AM и Fura Red, как описано выше. На рисунке показана первичная Т-клетка человека за 1 с до стимуляции гранулами, покрытыми анти-CD3-покрытием, и до 15 с после стимуляции (масштабная линейка 5 мкм), а также 3D поверхностный график увеличения от 6,25 с до 7,5 с в области контакта бусин (масштабная линейка 1 мкм). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
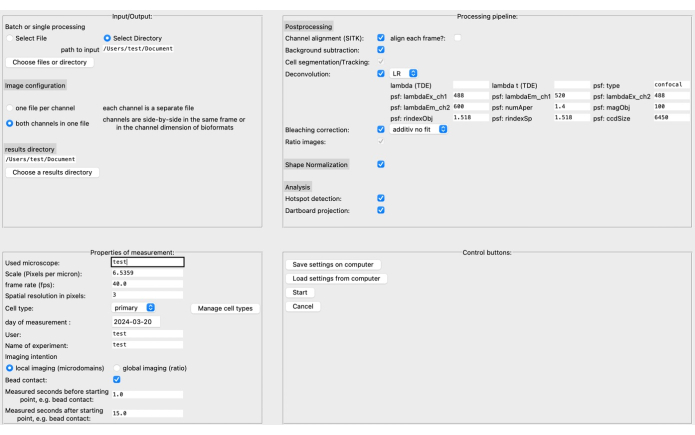
Рисунок 4: Графический интерфейс пользователя (GUI) DARTS. Графический интерфейс пользователя разделен на четыре области. В области ввода/вывода необходимо предоставить информацию о исходных данных, включая исходный каталог и конфигурацию изображения (два канала на файл или отдельные каналы), а также каталог результатов. В области Свойства измерения эксперимент должен быть описан со всей необходимой информацией, такой как масштаб (микроны на пиксель), частота кадров и интервал измерения относительно позже определенной начальной точки. Затем может быть собран конвейер обработки, состоящий из этапов постобработки, нормализации формы и фактического анализа (обнаружение микродоменов и накопление данных дартса). Наконец, настройки можно сохранить или загрузить с компьютера. После того, как анализ будет настроен, нажмите « Старт », чтобы продолжить. Чтобы узнать больше о настройке, посетите https://ipmi-icns-uke.github.io/DARTS/General/Usage.html. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
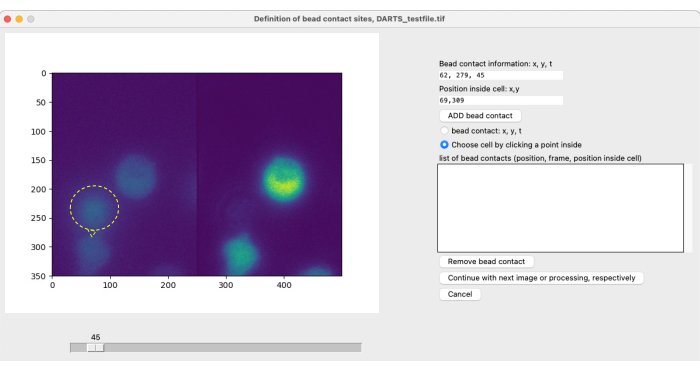
Рисунок 5: Ручное определение бортовых контактов. Если шарики добавляются в клетки во время эксперимента, время первоначального контакта шарика с интересующей клеткой и место контакта должны быть определены вручную. Это делается путем прокрутки кадров с помощью ползунка и нахождения положения (x,y) в момент времени t. Чтобы автоматически заполнить поле контактной информации борта, пользователь нажимает на левую половину изображения микроскопа в месте контакта борта. Затем, чтобы связать ячейку с контактом шарика, пользователь щелкает по позиции внутри ячейки, которая имеет контакт с шариком. Информация должна быть подтверждена нажатием кнопки ДОБАВИТЬ ВАЛИК. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Мы описали обширный протокол визуализации в живых клетках с высоким разрешением локальных микродоменов Ca2+ в первичных Т-клетках мыши и человека, вызванных стимуляцией TCR/CD3 с помощью гранул, покрытых антителами. Кроме того, мы реализовали удобный алгоритм на основе Python с открытым исходным кодом для идентификации и анализа локальных сигналов Ca2+. Следует отметить, что протокол не ограничивается обнаружением микродоменов Ca2+ в контексте стимуляции TCR/CD3, но может быть адаптирован к другим (иммунным) типам клеток, таким как NK-клеточные линии (KHYG-1)12 или TCR-независимые микродомены Ca2+ 10,11.
Важным шагом в рамках протокола является размер и количество стимулирующих шариков. Чтобы имитировать иммунный синапс, шарики должны быть похожи по размеру на клетки. Следовательно, для первичных мышиных и человеческих Т-клеток, а также клеточных линий (Jurkat и KHYG1) мы используем магнитные шарики диаметром 10 мкм. Кроме того, каждая клетка должна стимулироваться только одной бусиной. Поэтому количество бусин, добавляемых на каждый слайд, должно быть достаточным с одной стороны, но если бусин в поле зрения слишком много, фон увеличивается, и обнаружить ни одну точку времени активации и сторону контакта не представляется возможным.
В протоколе используются флуоресцентные красители Ca2+ Fluo-4 AM и FuraRed AM ратиометрическим образом, что позволяет калибровать данные13. Кроме того, протокол может быть адаптирован к другим индикаторным парам Ca2+ , но необходимо соблюдать осторожность в процессе выбора с точки зрения кинетики связывания Ca2+ , субклеточного распределения и фотообесцвечивания1. Кроме того, условия нагрузки должны быть разработаны и оптимизированы для каждого отдельного типа клеток, но указанные здесь концентрации являются хорошей отправной точкой. Для визуализации микродоменов Ca2+ Kd красителей Ca2+ должен находиться в диапазоне 300-1200 нМ, а время захвата за кадр должно составлять ≤60 мс. Если интенсивность флуоресценции слишком низкая, необходимо проверить набор фильтров, но также можно загрузить двойное количество красителя Ca2+ в Т-клетки. Тем не менее, краситель Ca2+ может перемещаться в другие органеллы или секвестироваться в везикулы, но он также может действовать как буфер Ca2+ и влиять на реакции Ca2+ .
Одним из ограничений алгоритма анализа является то, что предполагается сферическая форма ячейки; Следовательно, типы клеток с различной морфологией могут нуждаться в адаптации набора инструментов анализа. Алгоритм был использован для анализа локальных микродоменов Ca2+ в первичных мышиных Т-клетках, а также Т-клетках Jurkat и NK-клеточной линии (KHYG-1)12 и был успешно проведен при анализе микродоменов Ca2+ для нейрональной клеточной линии мыши (N2a, неопубликованные данные). В принципе, набор инструментов для протокола и анализа может быть использован для анализа несферических типов клеток, таких как клетки HEK293 или HeLa, но для этих типов клеток проекция дартс не может быть адаптирована, поскольку она основана на нормализации круглой структуры и формы клеток. Кроме того, протокол для обнаружения локализованных начальных микродоменов Ca2+ при стимуляции шариками может быть адаптирован для анализа локальных сигналов Ca2+, полученных от других стимулов, таких как растворимые активирующие или ингибирующие соединения, а также адгезионно-зависимые и TCR/CD3 независимые от Ca2+ микродомены10,11. Следует отметить, что легче определить контакт одного шарика с точки зрения времени и места, чем определить начальную точку активации после растворимых соединений.
Общим ограничением для обнаружения образования микродомена Ca2+ является требуемое высокое временно-пространственное разрешение и необходимое высокое отношение сигнал/шум (SNR). В настоящее время разрешение, полученное из нашей конфигурации, достигает расчетного пространственного разрешения ~0,368 мкм и временного разрешения ~40 кадров в секунду (кадров в секунду)1. Последние достижения в развитии камер и детекторов, а также усовершенствование флуоресцентных красителей могут привести к возможности достижения оптических одноканальных записей в том виде, в каком они были описаны для конструкций ORAI-GECI (генетически выраженные показатели Ca2+) для визуализации живых клеток с использованием показателей Ca2+ с более высоким временным и пространственным разрешением в будущем.
В совокупности описанные здесь протокол и аналитический инструмент для визуализации микродоменов Ca2+ с высоким разрешением могут быть использованы не только для анализа исходных локальных сигналов Ca2+ в Т-клетках, но также могут быть адаптированы к другим типам клеток для расшифровки значимости локальной передачи сигналов Ca2+ в них.
Раскрытие информации
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые можно было бы считать потенциальным конфликтом интересов.
Благодарности
Эта работа была поддержана Deutsche Forschungsgemeinschaft (DFG) (проект No 335447717; SFB1328, A02 до B-PD и RW; A14 до ET; номер проекта 516286863 в B-PD). Авторы благодарят доноров крови и отделение трансфузионной медицины УКЭ за сотрудничество.
Материалы
| Name | Company | Catalog Number | Comments |
| α-CD3 | BD Pharmingen | 553058 | |
| α-CD28 | BD Pharmingen | 553295 | |
| Anaconda | Anaconda | https://docs.anaconda.com/free/anaconda/install/index.html | |
| Bovine serum albumin | Sigma-Aldrich | A2058 | |
| Cell strainer | Biofil | CSS-013-070 | 70 µm diameter |
| Countess Automated Cell Counter | Invitrogen | A49865 | |
| Cover slips | Paul Marienfeld GmbH | 101202 | |
| DARTS | GitHub | https://github.com/IPMI-ICNS-UKE/DARTS | |
| Dulbecco’s Phosphate buffered saline | Gibco, Thermo Fisher | 14190144 | |
| EasySep CD4+ T cell Isolation Kit | Stemcell | 19852 | |
| EasySep Magnetic Multistand | Stemcell | 18010 | |
| Fluo 4-AM | Invitrogen | F14201 | |
| Fura Red-AM | Invitrogen | F3020 | |
| Gibco RPMI 1640 medium | Gibco, Thermo Fisher | 11875093 | |
| Git | GitHub | https://git-scm.com/book/en/v2/Getting-Started-Installing-Git | |
| immersion oil | Leica | 11513859 | |
| Newborn calf serum | Sigma-Aldrich | N4637 | |
| Oracle | Oracle | https://www.oracle.com/de/java/technologies/downloads/ | |
| Penicillin/Streptamycin | Gibco, Thermo Fisher | 15240062 | |
| Poly-L-lysine | Sigma-Aldrich | P4707 | |
| Protein G magnetic beads | Merck | LSKMAGG02 | 10 µM diameter |
| Python | Python | https://www.python.org/downloads/ | |
| Silicon grease (basylone) | Bayer | 291-1220 | |
| Time-Dependent Entropy Deconvolution | GitHub | https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters | |
| Tween | q-biogene | TWEEN201 |
Ссылки
- Wolf, I. M. A., et al. Frontrunners of T cell activation: Initial, localized Ca2+ signals mediated by NAADP and the type 1 ryanodine receptor. Sci Signal. 8 (398), 102(2015).
- Taguchi, T., Mukai, K. Innate immunity signalling and membrane trafficking. Curr Opin Cell Biol. 59, 1-7 (2019).
- Trebak, M., Kinet, J. -P. Calcium signalling in T cells. Nat Rev Immunol. 19 (3), 154-169 (2019).
- Diercks, B. -P., et al. ORAI1, STIM1/2, and RYR1 shape subsecond Ca2+ microdomains upon T cell activation. Sci Signal. 11, 0358(2018).
- Cheng, H., Lederer, W. J., Cannell, M. B. Calcium sparks: Elementary events underlying excitation-contraction coupling in heart muscle. Science. 262 (5134), 740-744 (1993).
- Feske, S. Calcium signalling in lymphocyte activation and disease. Nat Rev Immunol. 7 (9), 690-702 (2007).
- Berridge, M. J., Lipp, P., Bootman, M. D. The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1 (1), 11-21 (2000).
- Kummerow, C., Junker, C., Kruse, K., Rieger, H., Quintana, A., Hoth, M. The immunological synapse controls local and global calcium signals in T lymphocytes. Immunol Rev. 231 (1), 132-147 (2009).
- Brock, V. J., et al. P2X4 and P2X7 are essential players in basal T cell activity and Ca2+ signaling milliseconds after T cell activation. Sci Adv. 8 (5), 9770(2022).
- Weiß, M., et al. Adhesion to laminin-1 and collagen IV induces the formation of Ca2+ microdomains that sensitize mouse T cells for activation. Sci Signal. 16 (790), 9405(2023).
- Diercks, B. -P. The importance of Ca2+ microdomains for the adaptive immune response. Biochim Biophys Acta Mol Cell Res. 1871 (5), 119710(2024).
- Woelk, L. -M., et al. DARTS: an open-source Python pipeline for Ca2+ microdomain analysis in live cell imaging data. Front Immunol. 14, 1299435(2024).
- Diercks, B. -P., Werner, R., Schetelig, D., Wolf, I. M. A., Guse, A. H. High-resolution calcium imaging method for local calcium signaling. Methods Mol Biol. 1929, 27-39 (2019).
- Python. Python. , Available from: https://www.python.org/downloads/ (2024).
- Anaconda. Anaconda. , Available from: https://docs.anaconda.com/free/anaconda/install/index.html (2024).
- git. git. , Available from: https://git-scm.com/book/en/v2/Getting-Started-Installing-Git (2024).
- DARTS. DARTS. , Available from: https://github.com/IPMI-ICNS-UKE/DARTS (2024).
- DARTS. DARTS GitHub Repository. , Available from: https://ipmi-icns-uke.github.io/DARTS/ (2024).
- Oracle. , Available from: https://www.oracle.com/de/java/technologies/downloads/ (2024).
- Time-Dependent Entropy Deconvolution. , Available from: https://ipmi-icns-uke.github.io/TDEntropyDeconvolution/General/2-usage.html#input-parameters (2024).
- Gu, F., et al. Dual NADPH oxidases DUOX1 and DUOX2 synthesize NAADP and are necessary for Ca2+ signaling during T cell activation. Sci Signal. 14 (709), 3800(2021).
- Roggenkamp, H. G., et al. HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation. Sci Signal. 14 (675), 5647(2021).
- Heßling, L. D., Troost-Kind, B., Weiß, M. NAADP-binding proteins - Linking NAADP signaling to cancer and immunity. Biochim Biophy. Acta Mol Cell Res. 1870 (7), 119531(2023).
- Dynes, J. L., Amcheslavsky, A., Cahalan, M. D. Genetically targeted single-channel optical recording reveals multiple Orai1 gating states and oscillations in calcium influx. Proc Natl Acad Sci U S A. 113 (2), 440-445 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены