Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Live-Kalzium-Bildgebung von virusinfizierten humanen Darm-Organoid-Monolayern unter Verwendung genetisch kodierter Kalziumindikatoren
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt einen Ansatz zur Durchführung von Kalzium-Bildgebung in virusinfizierten menschlichen Darmorganoiden und bietet einen Ansatz für die Analyse.
Zusammenfassung
Die Kalziumsignalisierung ist ein integraler Regulator fast jedes Gewebes. Im Darmepithel ist Kalzium an der Regulierung der sekretorischen Aktivität, der Aktindynamik, der Entzündungsreaktionen, der Stammzellproliferation und vieler anderer nicht charakterisierter zellulärer Funktionen beteiligt. Daher kann die Kartierung der Kalzium-Signaldynamik im Darmepithel Einblicke in homöostatische zelluläre Prozesse geben und einzigartige Reaktionen auf verschiedene Reize aufdecken. Humane intestinale Organoide (HIOs) sind ein vom Menschen abgeleitetes Hochdurchsatzmodell zur Untersuchung des Darmepithels und stellen somit ein nützliches System zur Untersuchung der Kalziumdynamik dar. In diesem Artikel wird ein Protokoll beschrieben, um HIOs mit genetisch kodierten Kalziumindikatoren (GECIs) stabil zu transduzieren, Live-Fluoreszenzmikroskopie durchzuführen und Bilddaten zu analysieren, um Kalziumsignale aussagekräftig zu charakterisieren. Als repräsentatives Beispiel wurden 3-dimensionale HIOs mit Lentivirus transduziert, um GCaMP6s, eine grün fluoreszierende Protein-basierte zytosolische GECI, stabil zu exprimieren. Die entwickelten HIOs wurden dann in einer einzelligen Suspension dispergiert und als Monolagen ausgesät. Nach der Differenzierung wurden die HIO-Monolayer mit Rotaviren infiziert und/oder mit Medikamenten behandelt, von denen bekannt ist, dass sie eine Kalziumreaktion stimulieren. Ein Epifluoreszenzmikroskop, das mit einer temperaturkontrollierten, befeuchteten Live-Imaging-Kammer ausgestattet war, ermöglichte die Langzeitbildgebung von infizierten oder medikamentös behandelten Monoschichten. Im Anschluss an die Bildgebung wurden die aufgenommenen Bilder mit der frei verfügbaren Analysesoftware ImageJ analysiert. Insgesamt etabliert diese Arbeit eine anpassungsfähige Pipeline zur Charakterisierung zellulärer Signaltransduktion in HIOs.
Einleitung
Kalzium ist ein weit verbreiteter sekundärer Botenstoff, der eine entscheidende Rolle bei der Regulierung der Zellphysiologie spielt1. Aufgrund seiner starken Ladung, seiner geringen Größe und seiner hohen Löslichkeit unter physiologischen Bedingungen ist Kalzium ein idealer Manipulator der Proteinkonformation. Dies macht Kalzium zu einem leistungsstarken Mittel, um elektrochemische Signale in enzymatische, transkriptionelle oder posttranskriptionelle Veränderungen umzuwandeln. Die strengen Kalziumkonzentrationsgradienten über das endoplasmatische Retikulum (ER) und die Plasmamembranen erzeugen eine hohe Antriebskraft, die schnelle Änderungen der zytosolischen Kalziumkonzentration ermöglicht. Mehrere Mechanismen, darunter sowohl die Pufferung als auch der aktive Transport, halten diesen Gradienten aufrecht. Diese Aufrechterhaltung ist zwar für normale Zellfunktionen notwendig, aber energetisch teuer, was sie besonders anfällig für Stresszustände macht 2.
Daher ist eine Dysregulation von Kalzium im Zytosol ein nahezu universelles Signal für viele Arten von zellulärem Stress. Stoffwechselstörungen, Toxine, Krankheitserreger, mechanische Schäden und genetische Störungen können die Kalziumsignalisierung stören. Unabhängig vom Stimulus kann ein anhaltender, unkontrollierter Anstieg des zytosolischen Kalziums auf Ganzzellebene die Apoptose und schließlich die Nekrose fördern 3,4. Veränderungen des zytosolischen Kalziumspiegels mit geringerer Amplitude oder höherer Frequenz haben jedoch unterschiedliche Auswirkungen2. Ebenso können die Ergebnisse von Kalziumschwankungen je nach räumlicher Mikrodomäne, in der sie auftreten, unterschiedlich sein5. Die Überwachung des Kalziumspiegels kann daher Aufschluss über dynamische Signalprozesse geben, erfordert jedoch eine Probenahme mit relativ hoher zeitlicher und räumlicher Auflösung.
Genetisch kodierte Kalziumindikatoren (GECIs) sind leistungsfähige Werkzeuge für die kontinuierliche Probenahme in lebenden Zellsystemen6. Einige der am weitesten verbreiteten GECIs sind GFP-basierte, auf Kalzium reagierende fluoreszierende Proteine, die als GCaMPsbekannt sind 7. Die kanonische GCaMP ist eine Fusion von drei verschiedenen Proteindomänen: einem zirkulär permutierten GFP (cpGFP), Calmodulin und M136. Die Calmodulindomäne erfährt bei der Bindung von Kalzium eine Konformationsänderung, die ihre Interaktion mit M13 ermöglicht. Die Calmodulin-M13-Wechselwirkung induziert eine Konformationsänderung des cpGFP, die seine Fluoreszenzemission bei Anregung erhöht. Daher korreliert ein Anstieg der Kalziumkonzentration mit einem Anstieg der GCaMP-Fluoreszenzintensität. Diese Sensoren können zytosolisch oder auf bestimmte Organellen gerichtet sein8.
Ähnlich wie die meisten Gewebe reguliert Kalzium eine Vielzahl von Funktionen innerhalb des Magen-Darm-Epithels. Das Darmepithel ist ein wesentlicher Bestandteil der Nährstoff- und Flüssigkeitsaufnahme, muss aber auch eine dichte Barriere und Immunschnittstelle bilden, um das Eindringen von Krankheitserregern oder toxische Beleidigungen zu vermeiden. Kalziumabhängige Signalwege beeinflussen fast alle diese lebenswichtigen Funktionen 9,10,11. Die Kalziumsignalisierung im Darmepithel ist jedoch nach wie vor ein wenig erforschtes Gebiet mit vielversprechendem Potenzial als therapeutisches Ziel. Während die Überwachung der Kalziumdynamik im Darmepithel in vivo weiterhin eine Herausforderung darstellt, bieten humane Darmorganoide (HIOs) ein anpassungsfähiges ex vivo System für Experimente12. HIOs sind 3-dimensionale (3D) Sphäroide, die aus menschlichen Darmstammzellen gewonnen werden und bei Differenzierung einen Großteil der zellulären Vielfalt des nativen Darmepithels rekapitulieren12.
Dieses Protokoll beschreibt umfassende Methoden zur Entwicklung von HIOs, die GECIs exprimieren, und zur Herstellung von künstlich hergestellten HIOs als Monolayer für die Kalziumbildgebung lebender Zellen. Es bietet eine Virusinfektion als Beispiel für eine pathologische Manipulation, die die Kalziumsignalisierung stört, und bietet einen analytischen Ansatz zur Quantifizierung dieser Veränderungen.
Protokoll
Alle menschlichen Darmorganoide (HIOs), die in diesem Protokoll und den repräsentativen Experimenten verwendet wurden, wurden aus menschlichem Gewebe gewonnen, das vom Texas Medical Center Digestive Diseases Enteroid Core gewonnen und gepflegt wurde. Alle Proben wurden in Übereinstimmung mit einem Protokoll entnommen, das vom Institutional Review Board am Baylor College of Medicine genehmigt wurde.
1. Vorbereitung von Materialien und Reagenzien
- Für die Organoid-Wartung entnehmen Sie mit Zellkulturen behandelte 24-Well-Platten, Basalmembranmatrix (BMM), konische 15-ml-Röhrchen und 1,5-ml-konische Röhrchen.
- Um vollständige Medien ohne Wachstumsfaktoren (CMGF-) herzustellen, fügen Sie zu 500 ml fortgeschrittenem DMEM F12 5 ml 1 M HEPES, 5 ml 100x antibiotisch-antimykotisch, 5 ml 100x Glutaminpräparat hinzu.
- Zur Herstellung von Wnt-, R-Spondin- und Noggin-haltigen (WRNE) Medien mischen Sie zu gleichen Teilen CMGF- und Wnt-konditionierte Medien, fügen Sie Noggin-konditioniertes Medium, 10 Vol.-%, R-Spondin-konditioniertes Medium, 20 Vol.-%, 50 ng/ml humanen epidermalen Wachstumsfaktor, 10 mM Nicotinamid, 10 nM [Leu15]-Gastrin I, 500 nM A-83-01, 10 μM SB202190, 1x B27-Supplement, 1x N2-Supplement und 1 mM N-Acetylcystein hinzu.
- Für die lentivirale Transduktion fötales Kälberserum (FBS), 0,05 % Trypsin-EDTA in 1x phosphatgepufferter Kochsalzlösung (PBS), CMGF- mit 10 % FBS, steril 1x PBS, Polybrene, 10 μM Y-27632, Lentivirus, High Wnt WRNE + 10 μM Y-27632 vorbereiten
- Zur Erzeugung von organoiden Monoschichten wird ein 10-Well-Zellkulturobjektträger mit Glasboden, FBS, Kollagen IV (1 mg/ml in deionisiertem (di)H2O), Basalmembranmatrix, 0,5 mM EDTA in 1x PBS, 5 mM EDTA in 1x PBS, enzymatischer Dissoziationspuffer, CMGF- mit 10% FBS, WRNE + 10 μM Y-27632 hergestellt.
- Für die Virusinfektion von organoiden Monolayern Trypsin, Rotavirus-Stamm, CMGF-, 25G-Nadel, steriles 1x PBS und phenolrotfreies Differenzierungsmedium vorbereiten.
- Zur Herstellung von phenolrotfreien Differenzierungsmedien nehmen Sie 500 ml phenolrotfreies Zellkulturmedium, fügen 5 ml 100x MEM nicht-essentielle Aminosäuren, 5 ml 100x L-Glutamin, 5 ml 100 nM Natriumpyruvat und 7,5 ml 1 M HEPES hinzu.
- Für die Immunfluoreszenzfärbung von Organoiden werden 4 % Formaldehyd (16 % Formaldehyd verdünnt in 1x PBS), Triton X-100 (0,1 % Triton X-100 in 1x PBS), Rinderserumalbumin (3 % Rinderserumalbumin in 1x PBS), NH4Cl-Lösung (50 mM), DAPI (1 μg/ml DAPI-Lösung in 1x PBS) hergestellt.
2. Entwicklung von Organoiden, um genetisch kodierte Kalziumsensoren zu exprimieren
HINWEIS: Dieses Protokoll beschreibt die Schritte zur Transduktion einer einzelnen Vertiefung mit 3-dimensionalen menschlichen Darmorganoiden, die in 30 μl Basalmembranmatrix (BMM) auf einer 24-Well-Platte13 plattiert sind. Die meisten Linien enthalten etwa 400.000 Zellen pro Well. Eine zweite, nicht transduzierte Vertiefung sollte als Kontrolle einbezogen werden. Bewahren Sie alle Reagenzien und Zellsuspensionen auf Eis auf.
- Nach 2-5 Tagen nach der letzten Passage wird das Wartungs-WRNE-Medium aus zwei Vertiefungen mit HIOs entfernt. Ersetzen Sie es durch 300 μl 0,05 % Trypsin-EDTA pro Vertiefung und pipettieren Sie vorsichtig 5x auf und ab, um das BMM von der Platte zu lösen. Für 4 Minuten in einen 37 °C warmen Inkubator geben.
- Fügen Sie 500 μl CMGF- + 10% FBS pro Vertiefung hinzu. Beschichten Sie eine 1-ml-Pipettenspitze mit geringer Bindung mit FBS, indem Sie 1 ml FBS 2x auf und ab pipettieren. FBS kann für mehrere Spitzen wiederverwendet werden. Mit der vorbeschichteten Spitze pipettieren Sie die HIOs 10x nach oben und unten.
- Füllen Sie den Inhalt jeder Vertiefung in ein eigenes, vorbeschichtetes 1,5-ml-Mikrozentrifugenröhrchen um. Spülen Sie jede Vertiefung mit zusätzlichen 500 μL CMGF- und geben Sie das Waschmittel in das jeweilige Röhrchen.
- Die Röhrchen werden bei 100 x g in einer Schwenkeimerzentrifuge 5 min bei 4 °C zentrifugiert. Entfernen Sie den Überstand und alle BMM-Reste.
- Resuspendieren Sie 1 ml 1x PBS. Teilen Sie jedes Röhrchen in zwei Mikrozentrifugenröhrchen für insgesamt 4 Röhrchen auf. Die Röhrchen werden bei 100 x g für 5 min bei 4 °C zentrifugiert. Überstand entfernen.
- Jedes Röhrchen wird ein weiteres Mal in 1x PBS resuspendiert und bei 100 x g für 5 min bei 4 °C zentrifugiert.
- Bereiten Sie 400 μl Transduktionsmedium und Kontrollmedium vor (Tabelle 1). Resuspendieren Sie 2 Röhrchen in 200 μl des Kontrollmediums und 2 Röhrchen in 200 μl des Transduktionsmediums.
- In einem 37 °C heißen Zellkultur-Inkubator für 24 h inkubieren. Resuspendieren, indem Sie regelmäßig mit einer beschichteten Spitze auf und ab pipettieren (z. B. 2 h nach der Transduktion (hpt), 12 hpt, 18 hpt), um eine gleichmäßige Transduktion zu fördern.
- Nach 24 h zentrifugieren Sie die Zentrifugenröhrchen bei 100 x g für 5 min bei 4 °C. Überstand entfernen.
- Resuspendieren Sie das Pellet zum Waschen in 500 μl 1x PBS. Bei 100 x g 5 min bei 4 °C zentrifugieren. Überstand entfernen.
- Resuspendieren Sie mit einer eiskalten 200-μl-Pipettenspitze jedes der 4 Pellets in 30 μl BMM. Pipettieren Sie vorsichtig nach oben und unten, um sich gleichmäßig zu verteilen.
- Verteilen Sie den Inhalt jedes Röhrchens in eine eigene Vertiefung auf einer 24-Well-Platte. 10 Minuten bei 37 °C inkubieren, damit BMM erstarren kann, bevor 500 μl HighWnt WRNE + 10 μM Y-27632 hinzugefügt werden.
- Lassen Sie die transduzierten HIOs 1 Woche lang wachsen und aktualisieren Sie das Medium (HighWnt WRNE + 10 μM Y-27632) jeden zweiten Tag. Nach 1 Woche ist die Expression des fluoreszierenden Indikators durch Mikroskopie zu überprüfen. Wenn das Signal stark ist, beginnen Sie mit der Auswahl des Medikaments. Wenn das Signal schwach ist, wiederholen Sie die Transduktion wie oben beschrieben.
- Sobald die Linie etabliert ist, überprüfen Sie die Funktion des Fluoreszenzindikators durch eine Agonistenbehandlung. 100nM ADP ist ein zuverlässiger Agonist für die GCaMP-Validierung. Testen Sie 3D-Organoide für die erste Validierung, wie unten beschrieben.
- Nach einer Passage wird eine Vertiefung (oder mehrere) von Organoiden in BMM auf eine separate bildgebende Bodenplatte aufgetragen. Platten Sie die Organoide mit etwa 1/3 der normalen Dichte, um eine übermäßige Überlappung bei der Bildgebung zu vermeiden. Fahren Sie mit der Passage dieser HIOs nach einer Behandlung mit Agonisten nicht fort, da es schwierig ist, die Sterilität zu gewährleisten.
- Warten Sie 2-3 Tage, bis sich die HIOs nach der Passage erholt haben. Wechseln Sie das Medium vor der Bildgebung zu phenolrotfreien Differenzierungsmedien.
- Richten Sie mit einem Fluoreszenzmikroskop einen 3-minütigen Lauf mit Bildern ein, die alle 5 s mit einer Anregung von 488 nm und einem FITC/GFP-Filtersatz aufgenommen wurden. Nach 30 s Bildgebung 100 nM ADP oder Fahrzeugsteuerung hinzufügen. Setzen Sie die Bildgebung fort, bis das Signal in die Nähe des Ausgangswerts zurückkehrt, ~2 min. Ein vorübergehender, ~2-facher Anstieg der GCaMP-Fluoreszenz mit ADP-Behandlung deutet auf eine erfolgreiche Transduktion und Biosensorfunktion hin. Für eine genauere Abschätzung der Transduktionseffizienz wiederholen Sie den Agonistentest mit Bildgebung unter Verwendung von Monoschichten, die über das in Teil 3 beschriebene Verfahren erzeugt werden.
3. Präparation von HIO-Monolayern für die Live-Fluoreszenz-Bildgebung
- Beschichten Sie alle Vertiefungen eines 10-Well-Objektträgers mit Kollagen IV. Mischen Sie dazu 34 μl 1 mg/ml Kollagen IV mit 960 μl sterilem deionisiertem Wasser. Geben Sie 95 μl verdünnte Kollagen-IV-Lösung in jede Vertiefung und inkubieren Sie bei 37 °C für 0,5-2 Stunden.
- Entfernen Sie das WRNE-Wartungsmedium aus 4 Vertiefungen von 3D-HIOs. HIOs sollten 5-7 Tage nach ihrer letzten Passage sein.
HINWEIS: Für 1 10-Well-Platte werden in der Regel ~1,25 x 106 Zellen benötigt. Dies erfordert in der Regel 2-4 Wells mit 3D-HIOs, die jeweils mit 30 μl BMM beschichtet sind, variieren jedoch je nach Dichte. - Fügen Sie 500 μl 1x PBS + 0,5 mM EDTA pro Vertiefung hinzu. Mit einer vorbeschichteten 1-ml-Spitze vorsichtig nach oben und unten pipettieren, um BMM von der Platte zu lösen. Die Suspension wird in ein vorbeschichtetes konisches 15-ml-Röhrchen überführt und in demselben Röhrchen vermischt.
- Spülen Sie jede Vertiefung mit zusätzlichen 500 μl PBS + 0,5 mM EDTA. Bei 300 x g 5 min bei 4 °C zentrifugieren. Entfernen Sie den Überstand und die BMM-Reste.
- Resuspendieren Sie das verbleibende Pellet mit einer vorbeschichteten Spitze in 3 ml PBS + 5 mM EDTA (beachten Sie, dass dies 10x mehr EDTA ist als beim ersten Waschen).
- Bei 300 x g 5 min bei 4 °C zentrifugieren. Entfernen Sie den Überstand und die BMM-Reste. Resuspendieren Sie das Pellet in 2 ml enzymatischem Dissoziationspuffer.
- Im 37 °C Kügelchen-/Wasserbad 5 min inkubieren. Fügen Sie 3 ml CMGF- + 10% FBS hinzu und pipettieren Sie vorsichtig zum Mischen.
- Bei 300 x g 5 min bei 4 °C zentrifugieren. Entfernen Sie den Überstand. Fügen Sie 1 ml CMGF- hinzu.
- Pipettieren Sie kräftig mit einer vorbeschichteten Spitze 80x-100x auf und ab, um HIOs mechanisch in einzelne Zellen zu zerlegen. Bei 300 x g 5 min bei 4 °C zentrifugieren. Überstand entfernen.
- Resuspendieren in 1 ml WRNE + 10 μM Y-27632. Ermitteln Sie die Zellzahl für die 1-ml-Suspension.
- Verdünnen Sie die Zellsuspension mit WRNE + 10 μM Y-27632, um eine Konzentration von 1,25 x 105 Zellen/100 μl (1,25 x 106 Zellen/ml) zu erreichen.
- Entfernen Sie mit einer 200-μl-Pipette die Kollagenlösung von der in Schritt 1 vorbereiteten Platte, da sich das Kollagen nun am Boden der Vertiefung abgesetzt hat. Vermeiden Sie es, den Boden der Vertiefung mit der Pipettenspitze zu berühren.
- Mit einer vorbeschichteten 200-μl-Pipettenspitze 100 μl der Zelllösung aus Schritt 3.11 (1,25 x 105 Zellen) pro Vertiefung hinzufügen.
- 24 Stunden in einem 37 °C heißen Zellkultur-Inkubator inkubieren. Entfernen Sie nach 24 Stunden das Nährmedium aus allen Vertiefungen und ersetzen Sie es durch 100 μl Differenzierungsmedium pro Vertiefung.
HINWEIS: Zu diesem Zeitpunkt sollten die Zellen an der Platte haften. Beachten Sie, dass die Monolage wahrscheinlich nicht konfluierend oder vollständig planar sein wird. - Legen Sie den Objektträger wieder in den 37 °C warmen Zellkultur-Inkubator. Aktualisieren Sie das Differenzierungsmedium alle 24 Stunden, bis die Monoschicht konfluent ist. Dies dauert in der Regel 3-5 Tage nach der Beschichtung. Danach sind die Monolayer bereit für Downstream-Anwendungen.
4. Virusinfektion von HIO-Monolayern
- Bereiten Sie das Virusinokulum vor. Bei Bedarf aktiviert Trypsin den Virusbestand. Bei Rotaviren werden 10 μg/ml Worthington-Trypsin zu den Virusvorräten gegeben und 1 Stunde lang bei 37 °C inkubiert.
- Verdünnen Sie den aktivierten Virusvorrat mit einer der beiden folgenden Methoden.
- Wenn Sie die maximale Anzahl infizierter Zellen mit nur einem Virusstamm anstreben, mischen Sie 50 μl des aktivierten Virusstamms mit 50 μl CMGF-.
- Wenn Sie mehrere Stämme vergleichen, bereiten Sie die Inokula vor, um eine gleichwertige Anzahl von Infektionen (MOIs) zu erreichen. Verwenden Sie die folgende Formel, um die Menge des Virusbestands pro Well zu bestimmen, die für das gewünschte MOI erforderlich ist. Addieren Sie CMGF- zu dem Volumen des Virusbestands, das berechnet wurde, um ein Endvolumen von 100 μl pro Well zu erreichen.
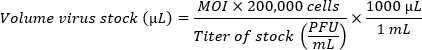
HINWEIS: Eine einzelne HIO-Monoschicht, die in einer Vertiefung mit einem Durchmesser von 5,46 mm (96-Well-Platte) plattiert ist, enthält etwa 200.000 Zellen. Wegen der geringen Effizienz der Infektion in Monolayern wird ein hohes MOI (100-1 Million Viruspartikel pro Zelle) bevorzugt. Das optimale Trägheitsmoment muss empirisch ermittelt werden.
- Infizieren Sie die Monoschichten, indem Sie das Medium vorsichtig mit einer 200-ml-Pipette aus der HIO-Monoschicht entfernen. Durch 100 ml Virusinokulum oder Scheininokulum ersetzen.
- Da die meisten Rotavirus-Bestände in MA104-Zellen vermehrt werden, verwenden Sie ein nicht infiziertes MA104-Zelllysat für das Scheininokulum. Verwenden Sie ein Volumen, das dem Volumen des Virusbestands entspricht, der für die infizierten Vertiefungen verwendet wird, und fügen Sie CMGF- hinzu, um ein Endvolumen von 100 ml pro Vertiefung zu erhalten.
- Bei Viren, die Zellen basolateral infizieren, wie z. B. Rotavirus14, verwenden Sie eine 25G-Nadel, um die Monoschicht einzuritzen. Es ist am einfachsten, eine einzelne Furche über die gesamte Länge der Monoschicht zu erstellen, von unten nach oben in der Vertiefung. Drücken Sie die Nadel vorsichtig schräg mit der abgeschrägten Seite nach oben, entgegen der Bewegungsrichtung, in die Monoschicht und ziehen Sie sie über die Länge der Monoschicht, um eine Narbe zu erzeugen (Abbildung 2A).
- In einem 37 °C warmen Inkubator für 2 h inkubieren. Entfernen Sie das Virus und simulieren Sie das Inokulum. Monolayer einmal mit 1x PBS waschen.
- Fügen Sie 100 μl phenolrotfreies Differenzierungsmedium hinzu. Legen Sie den Objektträger in einen 37 °C warmen Inkubator, bis er für die Aufnahme bereit ist. Das optimale Bildgebungsfenster hängt von der Kinetik der Virusinfektion ab. Bei Rotaviren beginnen Sie mit der Bildgebung 6-8 Stunden nach der Infektion.
- Verdünnen Sie den aktivierten Virusvorrat mit einer der beiden folgenden Methoden.
5. Ca2+ Bildgebung infizierter Monoschichten
- Den Stage-Top-Inkubator auf 37 °C vorheizen. Befeuchtetes CO2 mit 0,02 l/min. Objektträger mit den infizierten Monolayern in die Inkubatorkammer legen und den Deckel verschließen.
- Wählen Sie mit Hellfeldbeleuchtung (BF) und einem 20-fachen Objektiv die X- und Y-Koordinaten der Sichtfelder innerhalb der abzubildenden Monoschicht aus. Es ist am besten, Punkte mit Blick auf die bewertete Region auszuwählen, da sich die meisten infizierten Zellen in der Nähe des Kratzers befinden.
- Optimieren Sie die Bildgebungsparameter und nehmen Sie ein Bild mit einer Anregung von 488 nm auf. Um die Phototoxizität zu minimieren, stellen Sie die Lichtquelle auf 50 % Leistung mit einer Belichtungszeit von 50 ms ein. Die geeigneten Akquisitionsparameter können variieren und sollten durch die Erfassung mehrerer Akquisitionen optimiert werden. Stellen Sie sicher, dass keine Pixel gesättigt sind. Passen Sie die Belichtungszeit und die Lichtleistung nach Bedarf an, um sicherzustellen, dass der gesamte Dynamikbereich des fluoreszierenden Kalziumsensors erkannt werden kann.
- Wenn Sie andere Fluorophore (z. B. fluoreszenzmarkierte Viren) verwenden, wiederholen Sie die Optimierung dieser Kanäle. Richten Sie die Bildgebungsschleife ein und nehmen Sie ein 488-nm-Bild an jeder ausgewählten X- und Y-Koordinate in einer 1-minütigen Schleife auf. Bilde diese Schleife kontinuierlich ab. Wenn Sie einen fluoreszenzmarkierten Virus verwenden, nehmen Sie alle 10Schleifen (d. h. 1 Bild/10 Minuten) ein Bild auf dem entsprechenden Kanal auf.
- Sammeln Sie Bilder für ~18 Stunden. Wenn Sie Viren ohne fluoreszierende Markierung verwenden, fixieren Sie Monoschichten und führen Sie eine Immunfluoreszenzfärbung durch, um infizierte Zellen zu identifizieren. Führen Sie dies nach Abschluss des Imaging-Laufs wie unten beschrieben durch.
- Entfernen Sie das Bildgebungsmedium und ersetzen Sie es durch 100 μl 4%iges Formaldehyd in 1x PBS. 30 Minuten bei Raumtemperatur inkubieren.
- Fixiermittel entfernen und mit 100 μl 50 mM NH4Cl für 10 Minuten löschen. NH4Cl entfernen. Die Monolagen mit 100 μl 0,1% Triton X-100 in 1x PBS für 1 h bei Raumtemperatur oder über Nacht bei 4 °C permeabilisieren.
- Permeabilisierungspuffer entfernen. Blockieren Sie mit 100 μl 3%igem Rinderserumalbumin in 1x PBS für 1 h.
- Entfernen Sie die blockierende Lösung. Primärantikörper verdünnt auf die empfohlene/optimierte Konzentration in 1x PBS zugeben. Fügen Sie 100 μl Antikörperlösung pro Vertiefung hinzu.
- Über Nacht bei 4 °C unter leichtem Schaukeln inkubieren. Entfernen Sie die Primärantikörper. 3x mit 1x PBS waschen.
- Fluoreszenz-konjugierte Sekundärantikörper verdünnt auf die empfohlene/optimierte Konzentration in 1x PBS zugeben. Fügen Sie 100 μl pro Vertiefung hinzu. 2 h bei Raumtemperatur inkubieren.
HINWEIS: FPBase15 ist eine großartige Ressource, um bei der Auswahl von sekundären Systemen zu helfen, die ein Durchbluten beim Multiplexen vermeiden. Die meisten Sekundärpräparate sind bei einer Verdünnung von 1:1000 in 1x PBS wirksam. - Sekundäre Antikörper entfernen. Stellen Sie eine 1 μg/ml DAPI-Lösung in 1x PBS her und fügen Sie 100 μl pro Vertiefung hinzu. 20 Minuten inkubieren. DAPI entfernen. 3x mit 1x PBS waschen.
- Bewahren Sie feste Monoschichten in 100 μl 1x PBS für die Bildgebung auf. Legen Sie den Objektträger wieder auf den Mikroskoptisch, laden Sie die X- und Y-Koordinaten aus dem Live-Imaging-Lauf neu und bilden Sie jeden Multipunkt auf dem Kanal ab, der dem sekundären Antikörper entspricht, der für die Färbung verwendet wurde. Verweisen Sie auf die Bilder aus der Live-Imaging-Ausführung, um sicherzustellen, dass die gleichen Punkte erfasst werden.
6. Quantifizierung interzellulärer Kalziumwellen
- Stellen Sie sicher, dass Fiji is Just ImageJ (FIJI) mit den folgenden Plug-ins installiert ist: Bio-Formate (sollte in FIJI vorinstalliert sein, aber nicht in ImageJ); Rezeptbuch: Navigieren Sie zur Installation im Menü "Fidschi" zu Hilfe > Updates > Update-Sites verwalten. Schauen Sie im Kochbuch nach. Starten Sie Fidschi neu.
- Teilen Sie die Datendatei aus dem Live-Imaging-Lauf in mehrere Dateien auf, wobei Sie die einzelnen X- und Y-Koordinaten trennen. Wählen Sie in Nikon NES Elements die Option Datei > Importieren/Exportieren > Multipoints teilen. Wählen Sie einen Ordner für den Export und ein entsprechendes Präfix aus.
- Öffnen Sie FIJI. Laden Sie eine einzelne Datei aus den geteilten Multipoints. Wenn Sie ein Mehrkanalbild verwenden, teilen Sie die Kanäle auf. Wählen Sie das Fenster mit den Bildern aus dem 488-nm-Kanal (GCaMP) aus.
- Führen Sie die DeltaF-Up-Funktion aus, um die Änderung der einzelnen Pixelwerte von einem Zeitpunkt zum nächsten zu bestimmen. Wählen Sie dazu Cookbook > T-Funktionen > Delta F Up.
- Scrollen Sie durch den Stapel, bis ein Bild mit einer Kalziumwelle gefunden wird. Wenn Sie die Kalziumwelle im Blick haben, legen Sie einen Schwellenwert fest, indem Sie auf Bild > > Schwellenwert anpassen klicken. Passen Sie den unteren Grenzwert an, um die Signalmenge zu minimieren, die nicht Teil der Welle ist, die den Schwellenwert überschreitet. Beginnen Sie bei 16-Bit-Bildern, die mit den oben beschriebenen Parametern aufgenommen wurden, mit einem unteren Schwellenwert von 600 und passen Sie ihn nach Bedarf an.
- Führen Sie den Partikelanalysator aus, um Wellen zu segmentieren, indem Sie auf Analysieren > Partikel analysieren klicken. Stellen Sie die minimale Wellengröße in μm2 ein, indem Sie den Bereich anpassen. Er wird zu Beginn auf 0-unendlich festgelegt. Bei Bildern von MA104-Zellen, die mit einem 20-fach-Objektiv aufgenommen wurden, erhöhen Sie zunächst die untere Grenze auf 10.000μm2 und passen Sie sie entsprechend an.
- Aktivieren Sie die Kontrollkästchen für Ergebnisse anzeigen und Ergebnisse löschen. Wählen Sie im Dropdown-Menü "Anzeigen" die Option "Konturen" aus und klicken Sie dann auf "OK". Dies sollte zu 2 Ausgaben führen: Ein Fenster, Ergebnisse, listet jede erkannte Welle, den Bereich der Welle und ihre mittleren, minimalen und maximalen Intensitätswerte (basierend auf Delta F) auf. Das andere Fenster mit dem Titel Zeichnung von [Dateiname] enthält einen neuen Stapel mit den Umrissen segmentierter Wellen. Verwenden Sie diese Option, um die Wellenerkennung zu überprüfen. Passen Sie bei Bedarf die Schwellenwerte und den Größenbereich an, und überprüfen Sie die Wave-Aufrufe erneut.
- Verwenden Sie für die Stapelverarbeitung das mitgelieferte Makroskript (Supplementary Coding File 1). Um dies zu nutzen, führen Sie die unten beschriebenen Schritte aus.
- Teilen Sie Multi-Punkte in einzelne Dateien auf, wie in Schritt 6.2 beschrieben. Öffnen Sie FIJI. Wählen Sie Verarbeiten > Batch->Makro aus. Geben Sie im Feld "Eingabe" die Zuordnung zu dem Ordner an, der die geteilten Multipoint-Dateien enthält. Lassen Sie das Feld "Ausgabe" leer.
- Fügen Sie das Skript aus der ergänzenden Codierungsdatei 1 in das Feld ein. Passen Sie den Intensitätsschwellenwert und den Größenschwellenwert im Skript an, um die optimierten Parameter aus den Schritten 6.5 und 6.6 widerzuspiegeln.
- Klicken Sie auf Verarbeiten. Abhängig von der Anzahl der Multipoints und der Verarbeitungsgeschwindigkeit des Computers kann es 30 Minuten oder länger dauern, bis alle Bilder verarbeitet sind. Sobald der Vorgang abgeschlossen ist, werden die Daten in eine neue Tabellenkalkulationsdatei mit dem Namen "Nach dem Schreiben umbenennen" auf dem Desktop geschrieben. Die Ausgabedatei sollte für jeden Multipoint eine Wellenanzahl und Wellenmetriken (Fläche, mittlere Intensität, minimale und maximale Intensität und Intensitätsdichte) enthalten.
Ergebnisse
Abbildung 1A zeigt eine BMM-Kuppel mit 3-dimensionalen humanen Darmorganoiden, die transduziert wurden, um GCaMP6s stabil zu exprimieren. Abbildung 1B zeigt die gleiche Linie von Organoiden, die 24, 48 und 72 Stunden nach der Aussaat als Monoschicht neu beschichtet wurden. Um die Funktion von GCaMP6s zu validieren, wurde die Monoschicht alle 2 s für 4 min durch Fluoreszenzmikroskopie abgebildet und nach ~20 s 100 nM ADP zu den Medien hinzugefügt. ADP löst ein...
Diskussion
Veränderungen des zytosolischenCa2+-Spiegels können sowohl Ursache als auch Wirkung von Pathologien innerhalb des Epithels sein 10,16,17. Ein Anstieg des zytosolischen Kalziums kann die Sekretion über die Aktivierung des kalziumabhängigen Chloridkanals direkt antreiben TMEM16A18,19. Die Aktivierung von TMEM16A als Reaktion auf Ca2+ ermöglicht d...
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen offenzulegen.
Danksagungen
Diese Arbeit wurde durch Zuschüsse R01DK115507 und R01AI158683 (PI: J. M. Hyser) der National Institutes of Health (NIH) unterstützt. Die Praktikanten wurden von NIH Grants F30DK131828 (PI: J.T. Gebert), F31DK132942 (PI: F. J. Scribano) und F32DK130288 (PI: K.A. Engevik) unterstützt. Wir danken dem Texas Medical Center Digestive Diseases Enteroid Core für die Bereitstellung der organoiden Erhaltungsmedien.
Materialien
| Name | Company | Catalog Number | Comments |
| Advanced DMEM F12 | Gibco | 12634028 | |
| [Leu15]-Gastrin I | Sigma-Aldrich | G9145 | |
| 0.05% Trypsin EDTA | Gibco | 25300054 | |
| 0.05% Trypsin EDTA | Gibco | 25300054 | |
| 1.5mL microcentrifuge tubes | Fisherbrand | 5408137 | |
| 15mL conical tubes | Thermofisher Scientific | 0553859A | |
| 16% formaldehyde | Thermofisher Scientific | 28906 | |
| 1M HEPES | Gibco | 15630080 | |
| 1M HEPES | Gibco | 15630080 | |
| 1X PBS | Corning | 21-040-CV | |
| 25 gauge needle | Thermofisher Scientific | 1482113D | |
| A-83-01 | Tocris | 2939 | |
| ADP | Sigma-Aldrich | A2754 | |
| Advanced DMEM F12 | Gibco | 12634028 | |
| Antibiotic-antimycocytic | Gibco | 15240062 | |
| Antibiotic-antimycotic | Gibco | 15240062 | |
| B27 Supplement | Gibco | 17504-044 | |
| Bovine serum albumin | FisherScientific | BP1600100 | |
| CellView Cell Culture Slide, PS, 75/25 MM, Glass Bottom, 10 compartments | Greiner | 543979 | |
| Collagen IV | Sigma Aldrich | C5533 | |
| DAPI | Thermofisher Scientific | D1306 | |
| EDTA | Corning | 46-034-CI | |
| Fetal bovine serum | Corning | 35010CV | |
| Fetal bovine serum | Corning | 35010CV | |
| Fluorobrite | Gibco | A1896701 | |
| GlutaMAX | Gibco | 35050079 | |
| GlutaMAX | Gibco | 35050079 | |
| Human epidermal growth factor | ProteinTech | HZ-1326 | |
| Lentivirus | VectorBuilder | (variable) | |
| Matrigel | BD Biosceicen | 356231/CB40230C | |
| N2 Supplement | Gibco | 17502-048 | |
| N-acetylcysteine | Sigma-Aldrich | A9165-5G | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Nunc Cell Culture Treated 24-well Plates | Thermofisher Scientific | 142475 | |
| Polybrene | MilliporeSigma | TR1003G | |
| SB202190 | Sigma-Aldrich | S70767 | |
| Triton X-100 | Fisher BioReagents | BP151100 | |
| TrypLE Express Enzyme, no phenol red | Thermofisher Scientific | 12604013 | |
| Trypsin | Worthington Biochemical | NC9811754 | |
| Y-27632 | Tocris | 1254 |
Referenzen
- Bootman, M. D., Bultynck, G. Fundamentals of cellular calcium signaling: A primer. Cold Spring Harb Perspect Biol. 12 (1), a038802 (2020).
- Clapham, D. E. Calcium signaling. Cell. 131 (6), 1047-1058 (2007).
- Danese, A., et al. Cell death as a result of calcium signaling modulation: A cancer-centric prospective. Biochim Biophys Acta Mol Cell Res. 1868 (8), 119061 (2021).
- Harr, M. W., Distelhorst, C. W. Apoptosis and autophagy: Decoding calcium signals that mediate life or death. Cold Spring Harb Perspect Biol. 2 (10), a005579 (2010).
- Barak, P., Parekh, A. B. Signaling through Ca2+ microdomains from store-operated CRAC channels. Cold Spring Harb Perspect Biol. 12 (7), a035097 (2020).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat Biotechnol. 19 (2), 137-141 (2001).
- Erofeev, A. I., Vinokurov, E. K., Vlasova, O. L., Bezprozvanny, I. B. GCaMP, a family of single-fluorophore genetically encoded calcium indicators. J Evol Biochem Phys. 59 (4), 1195-1214 (2023).
- Suzuki, J., Kanemaru, K., Iino, M. Genetically encoded fluorescent indicators for organellar calcium imaging. Biophys J. 111 (6), 1119-1131 (2016).
- Nászai, M., Cordero, J. B. Intestinal stem cells: Got calcium. Curr Biol. 26 (3), R117-R119 (2016).
- Barrett, K. E. Calcium-mediated chloride secretion in the intestinal epithelium: Significance and regulation. Curr Top Membr. 53, 257-282 (2002).
- Xu, J., et al. Calcium-sensing receptor regulates intestinal dipeptide absorption via Ca2+ signaling and IKCa activation. Physiol Rep. 8 (1), e14337 (2020).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Lin, S. C., Haga, K., Zeng, X. L., Estes, M. K. Generation of CRISPR–Cas9-mediated genetic knockout human intestinal tissue–derived enteroid lines by lentivirus transduction and single-cell cloning. Nat Protoc. 17 (4), 1004-127 (2022).
- Crawford, S. E., Ramani, S., Blutt, S. E., Estes, M. K. Organoids to dissect gastrointestinal virus-host interactions: What have we learned. Viruses. 13 (6), 999 (2021).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nat Methods. 16 (4), 277-278 (2019).
- Lai, Y., et al. Inhibition of calcium-triggered secretion by hydrocarbon-stapled peptides. Nature. 603 (7903), 949-956 (2022).
- Chang-Graham, A. L., et al. Rotavirus induces intercellular calcium waves through ADP signaling. Science. 370 (6519), eabc3621 (2020).
- Lee, B., et al. Anoctamin 1/TMEM16A controls intestinal Cl− secretion induced by carbachol and cholera toxin. Exp Mol Med. 51 (8), 1-14 (2019).
- Saha, T., et al. Intestinal TMEM16A control luminal chloride secretion in a NHERF1 dependent manner. Biochem Biophys Rep. 25, 100912 (2021).
- Mroz, M. S., Keely, S. J. Epidermal growth factor chronically upregulates Ca2+-dependent Cl− conductance and TMEM16A expression in intestinal epithelial cells. J Physiol. 590 (8), 1907-1920 (2012).
- Sui, J., et al. Dual role of Ca2+-activated Cl− channel transmembrane member 16A in lipopolysaccharide-induced intestinal epithelial barrier dysfunction in vitro. Cell Death Dis. 11 (5), 404 (2020).
- Bellono, N. W., et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways. Cell. 170 (1), 185-198.e16 (2017).
- Paradis, T., Bègue, H., Basmaciyan, L., Dalle, F., Bon, F. Tight junctions as a key for pathogens invasion in intestinal epithelial cells. Int J Mol Sci. 22 (5), 2506 (2021).
- Samak, G., et al. Calcium/Ask1/MKK7/JNK2/c-Src signalling cascade mediates disruption of intestinal epithelial tight junctions by dextran sulfate sodium. Biochem J. 465 (3), 503-515 (2015).
- Deng, H., Gerencser, A. A., Jasper, H. Signal integration by Ca2+ regulates intestinal stem cell activity. Nature. 528 (7581), 212-217 (2015).
- Saurav, S., Tanwar, J., Ahuja, K., Motiani, R. K. Dysregulation of host cell calcium signaling during viral infections: Emerging paradigm with high clinical relevance. Mol Aspects Med. 81, 101004 (2021).
- Chang-Graham, A. L., et al. Rotavirus calcium dysregulation manifests as dynamic calcium signaling in the cytoplasm and endoplasmic reticulum. Sci Rep. 9 (1), 10822 (2019).
- Hyser, J. M., Collinson-Pautz, M. R., Utama, B., Estes, M. K. Rotavirus disrupts calcium homeostasis by NSP4 viroporin activity. mBio. 1 (5), e00265-e00310 (2010).
- Pham, T., Perry, J. L., Dosey, T. L., Delcour, A. H., Hyser, J. M. The Rotavirus NSP4 viroporin domain is a calcium-conducting ion channel. Sci Rep. 7, 43487 (2017).
- Crawford, S. E., Hyser, J. M., Utama, B., Estes, M. K. Autophagy hijacked through viroporin-activated calcium/calmodulin-dependent kinase kinase-β signaling is required for rotavirus replication. Proc Natl Acad Sci U S A. 109 (50), E3405-E3413 (2012).
- Crawford, S. E., Criglar, J. M., Liu, Z., Broughman, J. R., Estes, M. K. COPII vesicle transport is required for Rotavirus NSP4 interaction with the autophagy protein LC3 II and trafficking to viroplasms. J Virol. 94 (1), e01341 (2019).
- Pando, V., Iša, P., Arias, C. F., Ló Pez, S. Influence of calcium on the early steps of Rotavirus infection. Virology. 295 (1), 190-200 (2002).
- Hyser, J. M., Estes, M. K. Pathophysiological consequences of calcium-conducting viroporins. Annu Rev Virol. 2 (1), 473-496 (2015).
- Strtak, A. C., et al. Recovirus NS1-2 has viroporin activity that induces aberrant cellular calcium signaling to facilitate virus replication. mSphere. 4 (5), e00506-e00519 (2019).
- In, J. G., Foulke-Abel, J., Clarke, E., Kovbasnjuk, O. Human colonoid monolayers to study interactions between pathogens, commensals, and host intestinal epithelium. J Vis Exp. (146), 59357 (2019).
- Hirota, A., AlMusawi, S., Nateri, A. S., Ordóñez-Morán, P., Imajo, M. Biomaterials for intestinal organoid technology and personalized disease modeling. Acta Biomater. 132, 272-287 (2021).
- Cevallos Porta, D., López, S., Arias, C. F., Isa, P. Polarized rotavirus entry and release from differentiated small intestinal cells. Virology. 499, 65-71 (2016).
- Mirabelli, C., et al. Human Norovirus efficiently replicates in differentiated 3D-human intestinal enteroids. J Virol. 96 (22), e0085522 (2022).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays. 39 (8), 28749075 (2017).
- Li, J., et al. Engineering of NEMO as calcium indicators with large dynamics and high sensitivity. Nat Methods. 20 (6), 918-924 (2023).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten