Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Tejido picado en colágeno comprimido: Un Bio Transplant que contiene células para la reparación reconstructiva-puesta en escena individual
En este artículo
Resumen
La ingeniería de tejidos incluye a menudo la expansión in vitro con el fin de crear autoinjertos para la regeneración de tejidos. En este estudio se desarrolló un método para la expansión del tejido, la regeneración, y la reconstrucción in vivo con el fin de reducir al mínimo el procesamiento de células y materiales biológicos fuera del cuerpo.
Resumen
Conventional techniques for cell expansion and transplantation of autologous cells for tissue engineering purposes can take place in specially equipped human cell culture facilities. These methods include isolation of cells in single cell suspension and several laborious and time-consuming events before transplantation back to the patient. Previous studies suggest that the body itself could be used as a bioreactor for cell expansion and regeneration of tissue in order to minimize ex vivo manipulations of tissues and cells before transplanting to the patient. The aim of this study was to demonstrate a method for tissue harvesting, isolation of continuous epithelium, mincing of the epithelium into small pieces and incorporating them into a three-layered biomaterial. The three-layered biomaterial then served as a delivery vehicle, to allow surgical handling, exchange of nutrition across the transplant, and a controlled degradation. The biomaterial consisted of two outer layers of collagen and a core of a mechanically stable and slowly degradable polymer. The minced epithelium was incorporated into one of the collagen layers before transplantation. By mincing the epithelial tissue into small pieces, the pieces could be spread and thereby the propagation of cells was stimulated. After the initial take of the transplants, cell expansion and reorganization would take place and extracellular matrix mature to allow ingrowth of capillaries and nerves and further maturation of the extracellular matrix. The technique minimizes ex vivo manipulations and allow cell harvesting, preparation of autograft, and transplantation to the patient as a simple one-stage intervention. In the future, tissue expansion could be initiated around a 3D mold inside the body itself, according to the specific needs of the patient. Additionally, the technique could be performed in an ordinary surgical setting without the need for sophisticated cell culturing facilities.
Introducción
La mayoría de los estudios de ingeniería de tejidos en el trasplante a la piel y el tracto urogenital incluyen cosechas de células autólogas a partir de tejido sano y la expansión de células en los centros de cultivo de células especialmente equipados 1,2.
Después de la expansión de células, las células se suelen almacenar para su uso posterior, cuando se prepara al paciente para recibir el autoinjerto. congeladores de nitrógeno permiten el almacenamiento a largo plazo a bajas temperaturas de -150 ° C o inferior. El proceso de congelación debe ser cuidadoso y controlado con el fin de no perder las células. Uno de los riesgos de la muerte celular es la cristalización del agua intracelular durante el proceso de descongelación, lo que puede conducir a la ruptura de las membranas celulares. congelación de células se realiza generalmente por un enfriamiento lento y controlado (-1 ° C por minuto), utilizando una alta concentración de células, suero bovino fetal, y sulfóxido de dimetilo. Después de la descongelación, las células necesitan ser procesados de nuevo mediante la eliminación del medio de congelación y el cultivo sobre plástico de cultivo de células o unabiomaterial antes del trasplante de nuevo al paciente.
Todas las etapas mencionadas anteriormente requieren mucho tiempo, laboriosa y costosa 3. Además, todo el procesamiento in vitro de células destinados a trasplantes paciente son altamente regulado y requiere de personal y laboratorios 4 bien entrenados y acreditados. Con todo, para procurar un proceso de fabricación seguro y fiable, la técnica sólo se puede establecer en un número muy reducido de centros de tecnología avanzada y un uso más amplio de trastornos quirúrgicos comunes es dudosa.
Con el fin de superar las limitaciones de cultivo de células en el entorno de laboratorio, el concepto de trasplantar tejido picado para la expansión de células in vivo se introduce por el uso del cuerpo como un biorreactor. A estos efectos, los autoinjertos preferentemente se trasplantaron en un molde 3D de acuerdo a la forma que se necesita para la reconstrucción final del órgano de interés 5-7.
Originalmente, la idea de trasplantar epitelio picada fue presentado por Meek en 1958 cuando describió cómo el epitelio crece a partir de los bordes de una herida. Demostró que un pequeño trozo de piel aumentaría sus márgenes y por lo tanto su potencial para la expansión de células en un 100% por el corte de la pieza dos veces en direcciones perpendiculares (Figura 1) 8. La teoría ha sido apoyado por el uso de injertos de piel de espesor parcial en malla para el trasplante de piel 9 y en la piel de la herida modelos 10 de cicatrización.
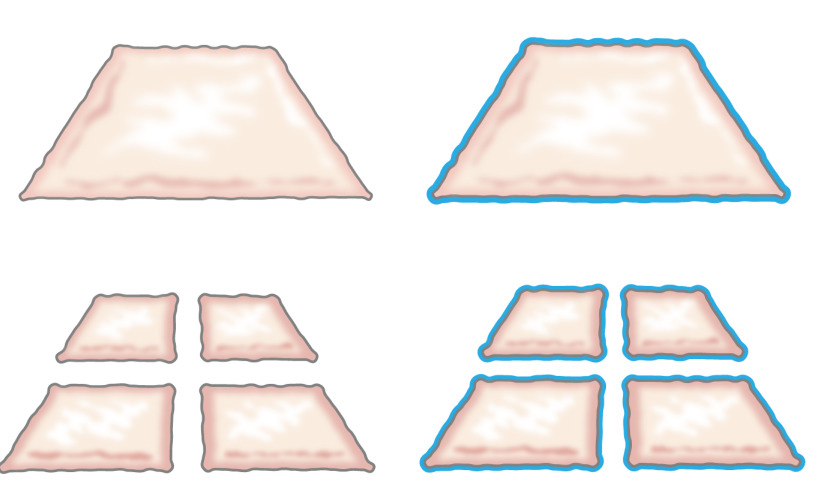
Figura 1:. Teoría Meek Según la teoría de Meek, epitelio crece a partir de los bordes de una herida. Al aumentar el área expuesta por la tecnología de picar carne, tejido picado epithelializes heridas de muchos puntos.
El presente estudio se basa en el hipotesis de que el mismo principio podría aplicarse al tejido subcutáneo mediante la colocación de epitelio picada alrededor de un molde. Las células epiteliales se movilizarían de trasplantes picados (reorganizar), cubren las áreas de heridas (migrar) y dividir (ampliar) con el fin de formar un neoepithelium continua que cubre el área de la herida y separa el cuerpo extraño (el molde) del cuerpo interior ( la Figura 2).
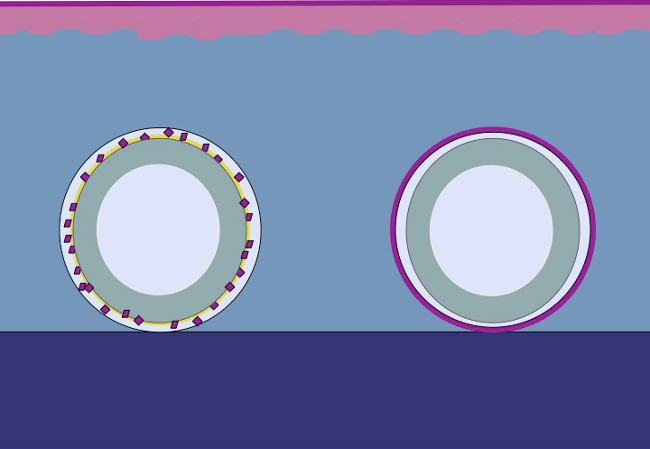
Figura 2:. Dibujos animados de un molde 3D con epitelio picada para la expansión del tejido in vivo intracorporal según la teoría de Meek Mediante el uso de tejido picado colocado en un molde y luego trasplantadas en el tejido subcutáneo, la hipótesis es que las células epiteliales migran desde el bordes del tejido picado, reorganizan, y se expanden con el fin de formar un neoepithelium continua que cubre el área de la herida y se separa el cuerpo extraño (el molde) del cuerpo interior.
Aunque estudios previos in vivo muestran resultados prometedores, mejoras adicionales podrían alcanzarse mediante el refuerzo de los autoinjertos de modo que el epitelio regenerado podría soportar trauma mecánico mejor 7. A estos efectos, se identificaron requisitos importantes para un biomaterial éxito, tales como: fácil difusión de nutrientes y productos de desecho, posibilidad de molde de una manera 3D y facilidad de manejo quirúrgico. Conclusiones Se hicieron que estas necesidades podrían satisfacerse mediante la adición de un biomaterial compuesto al tejido picado.
El estudio tuvo como objetivo desarrollar un andamio compuesto de tejido colágeno en picada plástico comprimido que contiene un núcleo de refuerzo de un tejido biodegradable. Por estos medios, las células viables podrían migrar de las partículas de tejido desmenuzado y proliferar con características morfológicas característica del epitelio original (piel o urotelio). Uso de la compresión de plástico, el andamio era reducird en tamaño de 1 cm a alrededor de 420 micras como las partículas picadas se encerrado en el colágeno de la capa superior. El tejido básico podría ser cualquier polímero pero necesita ser modificado con una superficie hidrófila con el fin de interconectar con las capas de colágeno que cubren 11.
El método proporciona una integridad andamio mejorada mediante la incorporación de una malla tejida que consiste en poli (ε-caprolactona) (PCL) dentro de los dos geles de colágeno de plástico comprimido de usarlo como un andamio para el cultivo de la mucosa de la vejiga o de la piel picada picada a partir de cerdos. La construcción se mantiene en condiciones de cultivo celular para un máximo de 6 semanas in vitro, lo que demuestra la formación con éxito de una, de varias capas urotelio o epitelio estratificado escamoso de piel en la parte superior de una construcción híbrida bien consolidada. La construcción era fácil de manejar y puede ser suturado en su lugar con fines de aumento de la vejiga o de cobertura de defectos de la piel. Todas las partes del andamio de tejido están aprobados por la FDA y la técnicapodría ser utilizado para los procedimientos de una sola etapa por la recolección de tejido, picado, compresión de plástico, y el trasplante de nuevo al paciente como una intervención por etapas sola. El procedimiento puede ser realizado por la expansión del tejido y la reconstrucción en condiciones estériles en cualquier unidad de cirugía general.
Protocolo
Todos los animales protocolos fueron aprobados previamente por el Comité del Condado de Estocolmo sobre los animales y todos los procedimientos se ajustaban a las normas para el uso de animales, así como las leyes federales pertinentes.
1. Procedimientos de Animales
- Preparación del animal para la cirugía
- Preparar la mesa de operaciones con todos los materiales y los instrumentos necesarios para la operación en condiciones estériles. Realizar la cirugía exclusivamente en condiciones estériles para reducir el riesgo de infección y de optimizar las condiciones en la cirugía de la supervivencia.
- Ayunar el animal durante 12 horas antes de la cirugía y medir su peso. Administrar una inyección intramuscular de azaperona (2 mg / kg) para la premedicación. Anestesiar al animal con inyecciones intramusculares de hipoclorito de tiletamina (2,5 mg / kg), hipoclorito de zolazepam (2,5 mg / kg), medetomidina (25 mg / kg) y atropina (25 mg / kg).
- Inyectar phenobarbiturate (15 mg / kg) antes de la endotracheAl continuar con la intubación y anestesia general con 0,8% y el 2% de isoflurano. Insertar un catéter de la vena periférica en un oído y de infundir la glucosa (25 mg / ml) por vía intravenosa durante el procedimiento para mantener el bienestar del animal.
- Colocar dispositivos en el oído o en la cola de control para comprobar la temperatura, la presión arterial, la saturación y el pulso periférico. La anestesia de control por el estímulo del dolor de los oídos o cascos. Aplique un ungüento para los ojos para evitar la sequedad, mientras que bajo anestesia.
- La escisión de la vejiga La biopsia de muestras
- Cateterizar la vejiga mediante un catéter de silicona 10-francesa mediante la introducción de un espéculo para observar la uretra e insertar el catéter a través de la uretra hasta la vejiga urinaria para vaciar la orina en condiciones semi-estériles. Llenar la vejiga con solución salina estéril hasta una presión de 20 a 25 cm H 2 O, alrededor de 100 a 300 ml, y luego vacío a 20 cm H 2 O (aprox. 8 ml / kg de peso corporal).
- con THe cerdo volvió cuidadosamente a una posición lado, realizar una esterilización preoperatoria básica de la piel con la aplicación de gluconato de clorhexidina. Aplicar una placa de diatermia en el hombro después de retirar el pelaje con unas tijeras de afeitar.
- Girar el cerdo cuidadosamente en una posición supina y retire el pelaje abdominal utilizando tijeras de afeitar y hacer una esterilización preoperatorio básico de la piel del abdomen con la aplicación de gluconato de clorhexidina.
- Incrustar las extremidades con la ropa suave para reducir al mínimo el riesgo de dañar la hiperextensión de las articulaciones de las extremidades. Esterilizar la piel abdominal del animal con aplicaciones sucesivas de gluconato de clorhexidina y colocar drapeado estéril alrededor del campo quirúrgico.
- Antes de la incisión de la piel, aplicar un analgésico intravenosa que consta de buprenorfina (45 mg / kg), carprofeno (3 mg / kg) y la inyección local de lidocaína en la línea media por debajo del ombligo. Compruebe si hay reacción al dolor agarrando el skcon fórceps. Hacer una incisión en la línea media inferior a través de la fascia y el peritoneo mediante diatermia para el control de la hemorragia. Localizar la vejiga que tiene una posición completamente intraperitoneal en el cerdo y puede ser expuesto libremente mediante la movilización a través de la herida quirúrgica.
- Echa mano de la vejiga con el fórceps y medir con una cinta métrica esterilizada y marque una muestra de biopsia con forma elíptica-aproximadamente 2 cm longitudinalmente y 1 cm transversalmente, o menor, utilizando una pluma esterilizada (el cerdo tolera una reducción trimestre del tamaño de la vejiga muy bien). Escindir el área marcada, utilizando un bisturí, y coloque la muestra de biopsia de vejiga en DMEM bajo condiciones estériles.
- Realizar autotrasplante con el Bio Transplant o cerrar la vejiga mediante la sutura con 5-0 Vicryl en dos capas. Cerrar la fascia abdominal cuidadosamente con 2-0 o 3-0 Vicryl corriendo. Cierre la hipodermis con Vicryl 3-0 y 3-0 con la piel Ethilon. Colocar un apósito en la herida y cuidadosamentetienden al animal hasta que se ha recuperado suficientemente de la anestesia y no expresar dolor.
- Mover el animal a la instalación de cuidado de los animales para asegurar las condiciones para el cuidado postoperatorio. Poner al animal en una jaula individual con una lámpara de calefacción y atender al animal hasta la recuperación completa de la anestesia y luego dejar que los animales a ser instaladas en pares.
- Proporcionar una recuperación sin complicaciones en relación con el dolor y el bienestar y la administración de buprenorfina (45 mg / kg) por vía intramuscular para la analgesia postoperatoria y trimetoprim (4 mg / kg) y sulfonamida (20 mg / kg) dos veces al día durante tres días y una vez al día durante cinco días para reducir el riesgo de infecciones postoperatorias.
- La escisión de la piel Biopsia de muestras
- Preparar la mesa de operaciones con todos los materiales necesarios. Anestesiar al animal como se describe anteriormente en 1.1. Retire el pelaje con cera, lavar y esterilizar el área de la incisión con betadine y alcohol al 70% y luego colocar drapeado estéril todas partes del mundod la zona de la incisión.
- Use un dermatoma para cosechar unas 0,3 mm de espesor parcial muestra de biopsia de piel. Colocar la muestra de piel en DMEM antes de ser picada, como se describe en 2.2. Cubrir el área de la herida con un ungüento graso y un vestidor.
2. Preparación del tejido picada
- La mucosa de la vejiga
- Se lava la biopsia de vejiga dos veces en DMEM. Coloque la muestra de biopsia de la vejiga en una placa de disección esterilizada con la mucosa hacia arriba y fijar uno de los lados a la placa usando pasadores de disección.
- Separar el tejido de la mucosa del músculo detrusor usando tijeras finas y pinzas (Figura 3) y mantener la mucosa húmeda por goteo de solución salina o DMEM sobre él.
- Utilice el dispositivo de picar carne colocándola en la mucosa y luego pasar el dispositivo de un extremo a otro en vertical y horizontal, aplicando presión manual para obtener piezas de tejido picado de 0,8 mm x 0,8 mm (0,8 mm es la distancia entre el rotating cuchillas de corte).
- Piel
- Si el Biosis piel gruesa son: colocar la piel sobre una placa de disección estéril y utilizar tijeras quirúrgicas para separar la epidermis de la dermis y la grasa subcutánea. La epidermis es delgada y translúcida (aprox. 0,3 mm) cuando está listo para picar.
- Utilice el dispositivo de picado colocándolo en la epidermis. Con la presión, pasar el dispositivo de un extremo a otro verticalmente y horizontalmente para obtener piezas de tejido picado de 0,8 mm x 0,8 mm.
3. Preparación de comprimidos de plástico PCL / autoinjertos de colágeno
- Colocar todos los ingredientes en el hielo para mantener fría. Utensilios necesarios: tubo Falcon, 10x DMEM, 1x DMEM, NaOH 1 N y cola de rata colágeno tipo 1.
- Mezclar 2 ml de 10x DMEM (con cuidado para evitar burbujas) con 12 ml de colágeno de tipo 1. Añadir 1 N NaOH, gota a gota, para llevar el pH hasta 7,4 a 8 (color en el medio debe indicar el pH mediante el cambio de la intensa amarillo a la clavijak). Además, utilizar una tira de pH.
- Añadir cuidadosamente 2 ml de 1x DMEM y se mezcla la solución. Plate aproximadamente 2 ml de colágeno en cada pocillo del molde rectangular de acero (20x30x10 mm) y se incuba a 37 ° C en 5% de CO2 durante 10 min.
NOTA: La concentración de colágeno debería ser 2,06 mg / ml en ácido acético 0,6% y la cantidad de colágeno 1 ml / cm 2. - Una vez que el colágeno coloca en el molde, colocar el biomaterial (PCL) en la parte superior del gel de colágeno (20 mm x 30 mm) y se vierte el colágeno restante (aproximadamente 6 ml) en la parte superior de la misma. Incubar a 37 ° C en 5% de CO2 durante 20 min.
- Coloque el tejido picado (de 1: 6 de expansión) en la parte superior del gel de colágeno. Pulsar el agua fuera de la construcción por fuerza mecánica mediante la compresión de plástico de la siguiente manera (figuras 3 y 4).
- Coloque una capa gruesa de compresas de gasa sobre una superficie estéril. Colocar una malla de acero inoxidable (400 m de espesor) en la parte superior de la GAUZe almohadillas y luego una hoja de malla de nylon (110 m de espesor). Transferir cuidadosamente el gel de colágeno / tejido picado sobre la malla de nylon y retirar con cuidado el molde de acero rectangular.
- Colocar una nueva capa de malla de nylon en la parte superior del gel de colágeno del tejido / picada. Colocar una segunda malla de acero en la parte superior de la malla de nylon. Colocar en posición la placa de presión o carga con un peso mínimo de 120 g (es decir, una placa de vidrio) durante 5 min.
- Retire las mallas de peso, de nylon y acero. Los autoinjertos son ahora listo para ser suturado a la vejiga de cerdo en las heridas de espesor completo de la piel o cultivadas in vitro.
- Para el cultivo in vitro, cortar el constructo delgada en pequeñas piezas de montaje placas de 12 pocillos. Añadir 1 ml de medio de queratinocitos. Colocar las placas en la incubadora a 37 ° C, 5% de CO 2 y la cultura hasta 6 semanas y cambiar el medio 3 veces por semana.
4. Sutura de autoinjertos
- Sutura de autoinjerto con lapicada mucosa de la vejiga de la vejiga de cerdo
- Mantenga el autoinjerto húmeda en DMEM durante el tiempo de espera. Suturar el autoinjerto con suturas de monofilamento funcionando muy bien. Utilice no absorbible 5-0 Ethilon con fines de investigación.
- Compruebe si estanco llenando la vejiga con solución salina a través del catéter urinario permanente. Si es posible, cubrir el autoinjerto con una capa de epiplón mayor. Cierre de la pared abdominal, el tejido subcutáneo y la piel como se describe en 1.2.6. Aplicar un apósito de la herida.
- Sutura en el autoinjerto con la epidermis de la piel picada a una herida de espesor total
- Mantenga el autoinjerto húmeda en DMEM durante el tiempo de espera.
- Suturar el autoinjerto a la parte inferior de la piel de espesor total de la herida por suturas interrumpidas en las esquinas y en el centro del autoinjerto para mantener el autoinjerto estrechamente unida a la superficie subyacente.
- Cubra la herida con un apósito de plástico que mantiene la herida húmeda.
5. Terminación
- Sedar al animal con la inyección intramuscular de hipoclorito de zolazepam (2,5 mg / kg) y medetomidina (25 mg / kg) antes de la terminación y aplicar los dispositivos de supervisión a la oreja o cola para comprobar el pulso y la presión arterial.
- La eutanasia a los animales mediante la administración de una dosis letal de pentobarbital sódico (60 a 140 mg / kg) por vía intravenosa. Compruebe el pulso y la presión sanguínea hasta que se produce la muerte.
6. Cultivo in vitro
NOTA: Para evaluar histológicamente la progresión de la tejido picado en los constructos PCL / colágeno in vitro, el colágeno / PCL / parches picada se cultivan en placas de 12 pocillos usando medio de queratinocitos.
- Preparación del medio de queratinocitos:
- Esterilizar una botella de vidrio de 500 ml.
- Mezclar 400 ml de DMEM con 100 ml de F12 de Ham (mezcla 4: 1). Suplemento con suero bovino fetal al 10%, insulina 5 mg / ml,0,4 mg / ml de hidrocortisona, 21 mg / ml de adenina, 10 -10 mol / L toxina del cólera, 2 x 10 -9 mol / L triyodotironina, 5 mg / ml de transferrina, 10 ng / ml factor de crecimiento epidérmico, 50 U / ml de penicilina y 50 mg / ml de estreptomicina.
- Esterilizar por filtración de través de un filtro 0,2 micras y recoger el filtrado en la botella 500 ml estéril.
7. La inmunohistoquímica
NOTA: El protocolo de inmunohistoquímica se divide generalmente en los siguientes pasos: (1) la fijación e inclusión en parafina, (2) micro-seccionar a 5 micras rodajas, la colocación en portaobjetos, desparafinación y rehidratación, (3) desenmascaramiento de antígeno, la tinción y montaje . Antes de comenzar los últimos pasos en el procedimiento de inmunohistoquímica, preparar los tampones de lavado y la solución de antígeno desenmascarar (ver detalles materiales separados). Preparar la solución del complejo ABC al menos 30 minutos antes de su uso.
- Fijación
NOTE: Al final del cultivo in vitro, fijar los parches de la siguiente manera:- Preparar tubos Eppendorf con 1 ml de formaldehído al 4% tamponado (PFA) (Precaución:. Formaldehído es tóxico Lea las hojas de datos de seguridad de materiales antes de trabajar con este producto químico Use guantes y gafas de seguridad y preparar la solución dentro de una campana de humos.).
- Transferir cada uno de los parches de colágeno a un tubo Eppendorf que contiene 4% PFA. Fijar durante la noche a temperatura ambiente.
- Colocar las muestras en etanol al 70% para el almacenamiento a largo plazo a 4 ° C. Las muestras están ahora listos para la deshidratación y la incrustación en bloques de parafina antes de seccionar.
- rehidratación
- Colocar los portaobjetos en una cubeta de tinción con X-tra solv durante 15 minutos. Repita mediante el uso de una nueva cubeta de tinción con solv X-tra. Colocar los portaobjetos en una cubeta de tinción con etanol absoluto durante 10 min. Repita mediante el uso de una nueva cubeta de tinción con etanol absoluto. Colocar los portaobjetos en una cubeta de tinción con etanol al 95% durante 10 minutos y, posteriormente,a una cubeta con 70% de etanol durante 10 min. Finalmente lavar los portaobjetos dos veces durante 5 minutos con agua destilada.
- El desenmascaramiento de antígeno
- Poner diapositivas en una jarra Coplin con TE-solución y poner el frasco en un baño de agua a hervir durante 20 minutos. Tome el frasco fuera del baño de agua con cuidado. Enfriar los portaobjetos a temperatura ambiente durante 30 min y se lava dos veces durante 5 minutos en tampón Tris. Colocar los portaobjetos en una cubeta de tinción con peróxido de hidrógeno al 3% durante 10 min. Lavar los portaobjetos dos veces durante 5 min en tampón Tris. Dibujar un círculo alrededor de las muestras utilizando un repelente al agua pluma de marca.
- Bloquear la unión no específica del anticuerpo usando 100 a 300 l de solución de bloqueo. Eliminar la solución de bloqueo y añadir 100 a 300 l de anticuerpo primario disuelto a la concentración recomendada en tampón Tris. Incubar toda la noche. Retirar la solución de anticuerpo y lavar las secciones en tampón Tris dos veces por 5 min.
- Incubar con el anticuerpo secundario durante 1 hora a temperat habitaciónUre. Lavar dos veces durante 5 min en tampón Tris. Incubar 30 minutos utilizando el kit ABC Elite (siga las instrucciones del fabricante). Lavar dos veces en tampón Tris.
- Desarrollar reacción de anticuerpos utilizando el Kit de VIP Vector, siguiendo las instrucciones del fabricante (1-7 min de incubación generalmente produce una intensidad de color violeta claro). Poner los portaobjetos en agua destilada. Contratinción con hematoxilina de Mayer durante 30 seg.
- Lavar en agua corriente durante 5 min. Colocar los portaobjetos en una cubeta de tinción con 70% de etanol durante 1 min. Repita mediante el uso de una nueva cubeta de tinción con un 70% de etanol. Colocar los portaobjetos en una cubeta de tinción con 95% de etanol durante 1 min. Repita mediante el uso de una nueva cubeta de tinción con un 95% de etanol.
- Colocar los portaobjetos en una cubeta de tinción con X-tra solv durante 5 min. Eliminar, uno a la vez para mantener la humedad. Coloque una gota de medio de montaje en la parte superior de cada diapositiva y poner una cubierta de vidrio en la parte superior (hacerlo con cuidado para evitar burbujas de aire). Deje que los portaobjetos se secan durante la noche y ver las diapositivas bajo un microalcance.
Resultados
Este estudio presenta un método que muestra cómo producir un biomaterial para el trasplante utilizando la compresión de plástico de colágeno y tejido picado.
Mucosa de la vejiga y la piel pueden ser cosechadas mecánicamente y luego picado en pequeñas partículas (Figura 3). Por compresión de plástico, las partículas picadas se incorporan dentro de la armazón de material compuesto compuesta de un polímero biodegradable colocado en posición central que es mecánic...
Discusión
Este estudio presenta un enfoque fácil de usar para producir parches pared de la vejiga con tejido autólogo para el trasplante en la mesa quirúrgica. Los parches están formados por la combinación de un tejido de punto de polímero biodegradable en el medio y el colágeno, con y sin tejido picado en las superficies exteriores en combinación con la compresión de plástico. Compresión de plástico es un método descrito previamente por otros autores y se puede definir como una rápida expulsión de fluido a partir ...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
The authors thank the Swedish Society for Medical Research, the Promobilia Foundation, the Crown Princess Lovisa Foundation, the Freemason Foundation for Children’s Welfare, the Swedish Society of Medicine, the Solstickan Foundation, Karolinska Institutet, and the Stockholm City Council for financial support.
Materiales
| Name | Company | Catalog Number | Comments |
| Silicone catheter 10-French | Preparing the animal for surgery, Section 1 | ||
| DMEM 10x | Gibco | 31885-023 | Plastic compression section 4 |
| 24 well plates | Falcon | 08-772-1 | Plastic compression section 4 |
| 3',3',5-Triiodothyronine | Sigma-Aldrich | IRMM469 | In vitro culture; Section 5 |
| 4% PFA | Labmed Solutions | 200-001-8 | Immunocytochemistry; Section 6 |
| 70% ethanol | Histolab | Immunocytochemistry; Section 6 | |
| ABC Elite kit: Biotin-Streptavidin detection kit | Vector | PK6102 | Immunocytochemistry; Section 6 |
| Absolute ethanol | Histolab | 1399.01 | Immunocytochemistry; Section 6 |
| Adenine | Sigma-Aldrich | A8626 | In vitro culture; Section 5 |
| Atropine 25 μg/kg | Temgesic, RB Pharmaceuticals, Great Britain | Preparing the animal for surgery, Section 1 | |
| Azaperone 2 mg/kg | Stresnil, Janssen-Cilag, Pharma, Austria | Preparing the animal for surgery, Section 1 | |
| Biosafety Level 2 hood | Plastic compression; Section 4 | ||
| Blocking solution: Normal serum from the same species as the secondary secondary antibody was generated in. | Vector | The blocking solution depends of the origin of first antibody | Immunocytochemistry; Section 6 |
| Buprenorphine 45 μg/kg | Atropin, Mylan Inc, Canonsburg, PA | Preparing the animal for surgery, Section 1 | |
| Carprofen 3 mg/kg | Rimadyl, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Chlorhexidine gluconate | Hibiscrub 40 mg/mL, Regent Medical, England | Preparing the animal for surgery, Section 1 | |
| Cholera toxin | Sigma-Aldrich | C8052 | In vitro culture; Section 5 |
| Coplin jar: staining jar for boiling | Histolab | 6150 | Immunocytochemistry; Section 6 |
| Stainless mold (33 mm x 22 mm x 10 mm) custom made | Plastic compression; Section 4 | ||
| DMEM | Gibco | 3188-5023 | Plastic compression section 4. Keep on ice when using it in plastic compression |
| Epidermal growth factor | Sigma-Aldrich | E9644 | In vitro culture; Section 5 |
| Ethilon (non-absorbable monofilament for skin sutures) | Ethicon | Surgery, Section 1 | |
| Fetal bovine serum (FBS) | Gibco | 10437-036 | Plastic compression section 4 |
| Forceps (Adison with tooth) | Preparing the animal for surgery, Section 1 | ||
| Gauze (Gazin Mullkompresse) | Preparing the animal for surgery, Section 1 | ||
| Ham's F12 | Gibco | 31765-027 | Plastic compression section 4 |
| Hematoxylin | Histolab | 1820 | Immunocytochemistry; Section 6 |
| Humidity chamber | DALAB | Immunocytochemistry; Section 6 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | In vitro culture; Section 5 |
| Hydrogen peroxide Solution 30% | Sigma-Aldrich | H1009 | Immunocytochemistry; Section 6 |
| Insulin | Sigma-Aldrich | I3536 | In vitro culture; Section 5 |
| Isoflurane | Isoflurane, Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Lidocaine 5 mg/ml | Xylocaine, AstraZeneca, Sweden | Preparing the animal for surgery, Section 1 | |
| Lucose 25 mg/ml | Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Marker pen pap pen | Sigma-Aldrich | Z377821-1EA | Immunocytochemistry; Section 6 |
| Medetomidine 25 μg/kg | Domitor, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Mincing device | Applied Tissue Technologies LLC | Minced tissue preparation, section 2 | |
| Monocryl (absorbable monofilament) | Ethicon | Surgery, Section 1 | |
| NaCl | Sigma-Aldrich | S7653 | Immunocytochemistry; Section 6 |
| NaOH 1 N | Merck Millipore | 106462 | Plastic compression section 4 and cell culture |
| Nylon mesh, 110 μM thick pore size 0.04 sqmm | Plastic compression; Section 4 | ||
| Oculentum simplex APL: ointment for eye protection | APL | Vnr 336164 | Surgery, Section 1 |
| PBS | Gibco | 14190-094 | Plastic compression section 4 |
| Penicillin-Streptomycin | Gibco | 15140-122 | Plastic compression section 4 |
| Phenobarbiturate 15 mg/kg | Pentobarbital, APL, Sweden | Preparing the animal for surgery, Section 1 | |
| PCL Knitted fabric | Plastic compression; Section 4 | ||
| Rat-tail collagen | First LINK, Ltd, UK | 60-30-810 | Plastic compression section 4, keep on ice |
| Scalpel blade - 15 | Preparing the animal for surgery, Section 1 | ||
| Shaving shears | Preparing the animal for surgery, Section 1 | ||
| Stainless stell mesh, 400 μM thick pore size | Plastic compression; Section 4 | ||
| Steril gloves | Preparing the animal for surgery, Section 1 | ||
| Sterile gowns | Preparing the animal for surgery, Section 1 | ||
| Sterile drapes | |||
| Sterilium | Bode Chemie HAMBURG | Preparing the animal for surgery, Section 1 | |
| Suture Thread Ethilon | Preparing the animal for surgery, Section 1 | ||
| TE-solution (antigen unmasking solution) consist of 10 mM Tris and 1 mM EDTA, pH 9.0 | 10 mM Tris/1 mM EDTA, adjust pH to 9.0 | ||
| Tiletamine hypochloride 2.5 mg/kg | Preparing the animal for surgery, Section 1 | ||
| Transferrin | Sigma-Aldrich | T8158 | In vitro culture; Section 5 |
| Trizma Base, H2NC | Sigma-Aldrich | T6066 | Immunocytochemistry; Section 6 |
| Vector VIP kit: Enzyme peroxidase substrate kit | Vector | SK4600 | Immunocytochemistry; Section 6 |
| Vicryl (absorbable braded) | Ethicon | Surgery, Section 1 | |
| Tris buffer pH 7.6 (washing buffer) | TE solution: Make 10x (0.5 M Tris, 1.5 M NaCl) by mixing: 60.6 g Tris (Trizma Base, H2NC(CH2OH)3, M=121.14 g/mol), add 800 ml distilled water adjust the pH till 7.6, add 87.7 g NaCl and fill to 1,000 ml with distilled water. Dilute to 1x with distilled water. | ||
| X-tra solv (solvent) | DALAB | 41-5213-810 | Immunocytochemistry; Section 6. Use under fume hood |
| Zolazepam hypochloride | Zoletil, Virbac, France | Preparing the animal for surgery, Section 1 | |
| Depilatory wax strips | Veet | Preparing the animal for surgery, Section 1 | |
| Pentobarbital sodium | Lundbeck | Termination, Section 3 |
Referencias
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6, 331-343 (1975).
- Fossum, M., Nordenskjold, A., Kratz, G. Engineering of multilayered urinary tissue in vitro. Tissue Engineering. 10, 175-180 (2004).
- Salmikangas, P., et al. Manufacturing, characterization and control of cell-based medicinal products: challenging paradigms toward commercial use. Regen Med. 10, 65-78 (2015).
- Fossum, M., et al. Minced skin for tissue engineering of epithelialized subcutaneous tunnels. Tissue Engineering. Part A. 15, 2085-2092 (2009).
- Fossum, M., et al. Minced urothelium to create epithelialized subcutaneous conduits. The Journal of Urology. 184, 757-761 (2010).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. L., Nordenskjold, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. BioMed Research International. 2013, 212734 (2013).
- Meek, C. P. Successful microdermagrafting using the Meek-Wall microdermatome. Am J Surg. 96, 557-558 (1958).
- Tanner, J. C., Vandeput, J., Olley, J. F. The Mesh skin graft. Plastic and Reconstructive Surgery. 34, 287-292 (1964).
- Svensjo, T., et al. Autologous skin transplantation: comparison of minced skin to other techniques. The Journal of Surgical Research. 103, 19-29 (2002).
- Ajalloueian, F., Zeiai, S., Rojas, R., Fossum, M., Hilborn, J. One-stage tissue engineering of bladder wall patches for an easy-to-use approach at the surgical table. Tissue Engineering. Part C, Methods. 19, 688-696 (2013).
- Engelhardt, E. M., et al. A collagen-poly(lactic acid-co-varepsilon-caprolactone) hybrid scaffold for bladder tissue regeneration. Biomaterials. 32, 3969-3976 (2011).
- Brown, R. A., Wiseman, M., Chuo, C. B., Cheema, U., Nazhat, S. N. Ultrarapid engineering of biomimetic materials and tissues: fabrication of nano- and microstructures by plastic compression. Adv Funct Mater. 15, 1762-1770 (2005).
- Fumagalli Romario, U., Puccetti, F., Elmore, U., Massaron, S., Rosati, R. Self-gripping mesh versus staple fixation in laparoscopic inguinal hernia repair: a prospective comparison. Surg Endosc. 27, 1798-1802 (2013).
- Muangman, P., et al. Complex Wound Management Utilizing an Artificial Dermal Matrix. Annals of Plastic Surgery. 57, 199-202 (2006).
- Ajalloueian, F., Zeiai, S., Fossum, M., Hilborn, J. G. Constructs of electrospun PLGA, compressed collagen and minced urothelium for minimally manipulated autologous bladder tissue expansion. Biomaterials. 35, 5741-5748 (2014).
- Orabi, H., AbouShwareb, T., Zhang, Y., Yoo, J. J., Atala, A. Cell-seeded tubularized scaffolds for reconstruction of long urethral defects: a preclinical study. Eur Urol. 63, 531-538 (2013).
- Blais, M., Parenteau-Bareil, R., Cadau, S., Berthod, F. Concise review: tissue-engineered skin and nerve regeneration in burn treatment. Stem Cells Transl Med. 2, 545-551 (2013).
- Serpooshan, V., Muja, N., Marelli, B., Nazhat, S. N. Fibroblast contractility and growth in plastic compressed collagen gel scaffolds with microstructures correlated with hydraulic permeability. J Biomed Mater Res A. 96, 609-620 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados