Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tissu haché en comprimé Collagen: Un Biotransplant contenant des cellules de réparation Reconstructive simple mise en scène
Dans cet article
Résumé
L'ingénierie tissulaire comprend souvent dans l'expansion in vitro dans le but de créer des autogreffes pour la régénération tissulaire. Dans cette étude, un procédé pour l'expansion des tissus, la régénération, la reconstruction et in vivo a été mis au point afin de réduire la transformation des cellules et des matières biologiques en dehors du corps.
Résumé
Conventional techniques for cell expansion and transplantation of autologous cells for tissue engineering purposes can take place in specially equipped human cell culture facilities. These methods include isolation of cells in single cell suspension and several laborious and time-consuming events before transplantation back to the patient. Previous studies suggest that the body itself could be used as a bioreactor for cell expansion and regeneration of tissue in order to minimize ex vivo manipulations of tissues and cells before transplanting to the patient. The aim of this study was to demonstrate a method for tissue harvesting, isolation of continuous epithelium, mincing of the epithelium into small pieces and incorporating them into a three-layered biomaterial. The three-layered biomaterial then served as a delivery vehicle, to allow surgical handling, exchange of nutrition across the transplant, and a controlled degradation. The biomaterial consisted of two outer layers of collagen and a core of a mechanically stable and slowly degradable polymer. The minced epithelium was incorporated into one of the collagen layers before transplantation. By mincing the epithelial tissue into small pieces, the pieces could be spread and thereby the propagation of cells was stimulated. After the initial take of the transplants, cell expansion and reorganization would take place and extracellular matrix mature to allow ingrowth of capillaries and nerves and further maturation of the extracellular matrix. The technique minimizes ex vivo manipulations and allow cell harvesting, preparation of autograft, and transplantation to the patient as a simple one-stage intervention. In the future, tissue expansion could be initiated around a 3D mold inside the body itself, according to the specific needs of the patient. Additionally, the technique could be performed in an ordinary surgical setting without the need for sophisticated cell culturing facilities.
Introduction
La plupart des études d'ingénierie tissulaire sur la transplantation de la peau et des voies génito-urinaire comprennent récoltes de cellules autologues de tissu sain et l'expansion des cellules spécialement aménagées dans les installations de culture de cellules 1,2.
Après l'expansion des cellules, les cellules sont généralement stockés pour une utilisation ultérieure lorsque le patient est prêt à recevoir l'autogreffe. congélateurs d'azote permettent un stockage à long terme à de basses températures de -150 ° C ou moins. Le processus de congélation doit être prudent et contrôlé afin de ne pas perdre les cellules. Un risque de mort cellulaire est cristallisation de l'eau intracellulaire au cours du processus de décongélation, ce qui peut conduire à la rupture des membranes cellulaires. Cellule gel est généralement effectuée par un refroidissement lent et contrôlé (-1 ° C par minute) en utilisant une concentration élevée de cellules, du sérum foetal bovin, et le diméthylsulfoxyde. Après décongélation, les cellules doivent être traitées à nouveau par l'élimination du milieu de congélation et mise en culture sur des cellules de culture en matière plastique ou d'unbiomatériaux avant la transplantation au patient.
Toutes les étapes mentionnées ci-dessus sont longs, laborieux et coûteux 3. En outre, tout le traitement in vitro de cellules destinés à la transplantation des patients sont très réglementé et nécessite du personnel et les laboratoires 4 bien formés et accrédités. Dans l'ensemble, de se procurer un coffre-fort et fiable processus de fabrication, la technique ne pouvait être établie dans un très petit nombre de centres techniquement avancés et une plus large utilisation dans les troubles chirurgicales courantes est douteux.
Afin de surmonter les limitations de la culture de cellules dans l'environnement du laboratoire, le concept de la transplantation de tissu haché pour l'expansion des cellules in vivo est introduit en utilisant le corps lui-même en tant que bioréacteur. A ces fins, les autogreffes seraient préférentiellement être transplantés sur un moule 3D en fonction de la forme qui est nécessaire pour la reconstruction finale de l'organe d'iINTÉRÊT 5-7.
À l'origine, l'idée de transplanter épithélium hachée a été présenté par Meek en 1958 quand il a décrit comment l'épithélium se développe à partir des bords de la plaie. Il a démontré qu'un petit morceau de peau augmenterait ses marges et ainsi leur potentiel pour l'expansion des cellules de 100% en coupant la pièce deux fois dans des directions perpendiculaires (figure 1) 8. La théorie a été soutenue par l'utilisation de greffes partielles maillés de peau d'épaisseur pour la transplantation de la peau 9 et dans la peau cicatrisation modèles 10.
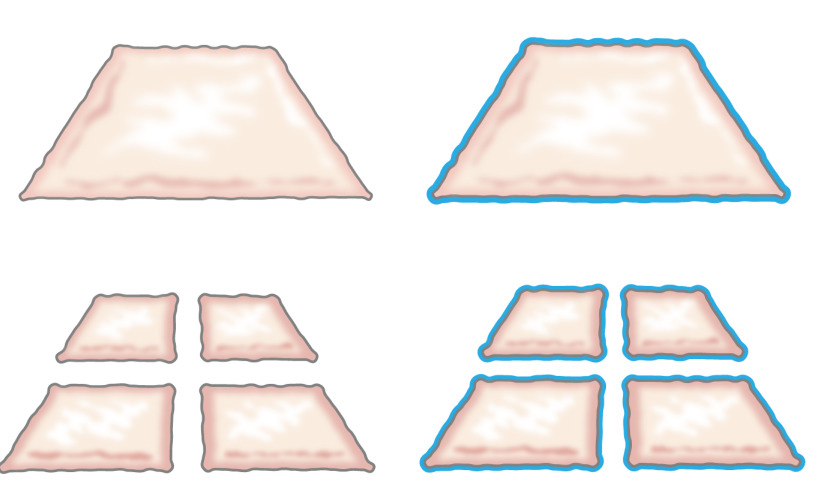
Figure 1:. Théorie Meek Selon la théorie de Meek, l'épithélium se développe à partir des bords de la plaie. En augmentant la surface exposée par la technologie de hachage, tissu haché epithelializes blessures de nombreux endroits.
La présente étude est basée sur l'hypothèse que le même principe pourrait être appliqué aux tissus sous-cutanés en plaçant épithélium hachée autour d'un moule. Les cellules épithéliales se mobiliser de greffes hachées (réorganiser), couvrent les domaines de la plaie (migration) et diviser (expansion) afin de former un neoepithelium continue qui couvre la zone de la plaie et sépare le corps étranger (le moule) du corps intérieur ( la figure 2).
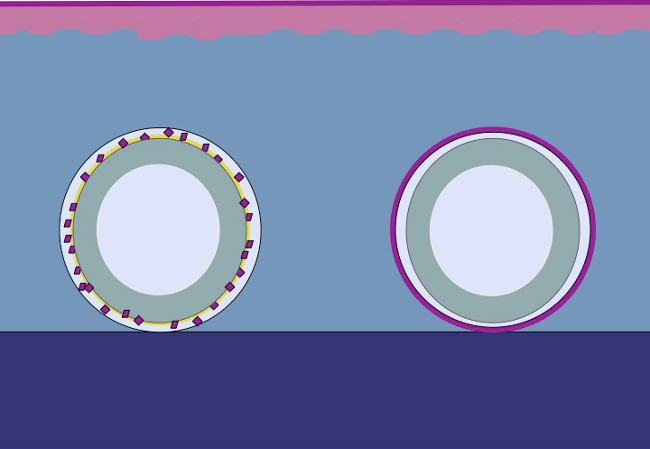
Figure 2:. Cartoon d'un moule 3D avec épithélium hachée pour vivo l'expansion des tissus caverneux en fonction de la théorie de Meek En utilisant tissu haché placé sur un moule, puis transplantées dans le tissu sous-cutané, l'hypothèse est que les cellules épithéliales migrent de la les bords du tissu haché, réorganiser, et d'élargir de manière à former un neoepithelium continu qui recouvre la surface de la plaie et qui sépare les corps étrangers (le moule) à partir du corps interne.
Bien que des études in vivo précédents montrent des résultats prometteurs, d'autres améliorations pourraient être atteints par le renforcement des autogreffes de telle sorte que l'épithélium régénéré pourrait mieux résister à 7 traumatisme mécanique. À cet effet, des conditions importantes pour un biomatériau succès ont été identifiés, tels que: simple diffusion des nutriments et des déchets, possibilité de moule d'une manière 3D et de facilité de manipulation chirurgicale. Les conclusions ont été faites que ces besoins peuvent être satisfaits par l'ajout d'un biomatériau composite du tissu haché.
La présente étude vise à développer un échafaudage composé de tissu haché dans le collagène de plastique compressé contenant un noyau de renforcement d'un tissu biodégradable. Par ces moyens, les cellules viables pourraient migrer à partir des particules de tissu et proliférer hachées avec des caractéristiques morphologiques caractéristiques de l'épithélium d'origine (ou de la peau urothélium). Utilisation de la compression en plastique, l'échafaud était de réduired de la taille moyenne de 1 cm à environ 420 um en tant que particules hachées ont été enfermé dans la couche supérieure de collagène. Le tissu de base pourrait être tout polymère mais doit être modifié avec une surface hydrophile afin de relier les couches de collagène couvrant 11.
Le procédé a fourni une intégrité d'échafaudage amélioré en incorporant un filet tricoté se composant de poly (ε-caprolactone) (PCL) dans les deux gels de collagène comprimé en plastique de l'utiliser comme un échafaudage pour la culture de muqueuse vésicale hachée ou de la peau de porc haché. Le produit d'assemblage a été maintenu dans des conditions de culture cellulaire pendant un maximum de 6 semaines in vitro, ce qui démontre la formation réussie d'un stratifié multicouche ou urothélium épithélium squameux de la peau sur le dessus d'une construction d'hybride bien consolidé. La construction est facile à manipuler et peut être suturée en place à des fins d'augmentation de la vessie ou de couverture des défauts de la peau. Toutes les pièces de l'échafaudage pour tissu sont approuvés par la FDA et la techniquepourraient être utilisés pour les procédures en une seule étape par prélèvement de tissu, émincer, compression plastique, et la transplantation au patient comme une intervention unique mis en scène. La procédure peut être effectuée à l'expansion et à la reconstruction tissulaire dans des conditions stériles dans une unité de chirurgie générale.
Protocole
Tous les protocoles d'animaux ont été approuvés au préalable par le comité du comté de Stockholm sur les animaux et toutes les procédures conformes à la réglementation pour l'utilisation des animaux, ainsi que les lois fédérales pertinentes.
1. Procédures d'animaux
- Préparation de l'animal pour la chirurgie
- Préparer la table d'opération avec tous les matériaux et les instruments nécessaires à l'opération dans des conditions stériles. Effectuer la chirurgie exclusivement dans des conditions stériles afin de réduire le risque d'infection et d'optimiser les conditions de la chirurgie de survie.
- Jeûner l'animal pendant 12 heures avant la chirurgie et de mesurer son poids. Administrer une injection intramusculaire de azaperone (2 mg / kg) pour la prémédication. Anesthésier les animaux par des injections intramusculaires de tilétamine hypochlorite (2,5 mg / kg), zolazepam hypochlorite (2,5 mg / kg), de médétomidine (25 ug / kg) et de l'atropine (25 ug / kg).
- Injecter phenobarbiturate (15 mg / kg) avant endotracheal intubation et continuer anesthésie générale avec 0,8% -2% d'isoflurane. Insérer un cathéter veineux périphérique dans une oreille et laisser infuser glucose (25 mg / ml) par voie intraveineuse pendant la procédure de maintenir le bien-être de l'animal.
- Placez les appareils sur l'oreille ou de la queue de surveillance pour vérifier la température, la pression artérielle, la saturation, et le pouls périphérique. anesthésie de contrôle par la stimulation de la douleur des oreilles ou des sabots. Appliquer une pommade pour les yeux pour prévenir la sécheresse sous anesthésie.
- Excision de la vessie biopsie
- Cathétériser la vessie au moyen d'un cathéter en silicone 10-française en introduisant un spéculum pour afficher l'urètre et insérer le cathéter dans l'urètre et dans la vessie pour vider l'urine dans des conditions semi-stériles. Remplir la vessie avec une solution saline stérile à une pression de 20 à 25 cm H 2 O, environ de 100 à 300 ml, puis vide à 20 cm H 2 O (env. 8 ml / kg de poids corporel).
- avec ee porc soigneusement tourné dans une position latérale, effectuer une stérilisation préopératoire de base de la peau avec l'application de gluconate de chlorhexidine. Appliquer une plaque de diathermie à l'épaule après avoir retiré le pelage avec des ciseaux de rasage.
- Tourner le cochon avec précaution dans une position couchée sur le dos et retirer le pelage abdominale aide de cisailles à raser et faire un stérilisation préopératoire de base de la peau de l'abdomen avec l'application de gluconate de chlorhexidine.
- Incluez les extrémités avec des vêtements doux pour minimiser le risque de dommages hyperextension des articulations des extrémités. Stériliser la peau de l'abdomen de l'animal avec des applications successives de gluconate de chlorhexidine et le placer drapage stérile autour de la zone d'opération chirurgicale.
- Avant l'incision de la peau, appliquer un analgésique de la buprénorphine par voie intraveineuse, comprenant (45 ug / kg), le carprofène (3 mg / kg) et une injection locale de lidocaïne sur la ligne médiane au-dessous de l'ombilic. Vérifiez réaction à la douleur en saisissant le skavec une pince. Faire une incision médiane inférieure à travers le fascia et du péritoine utilisant diathermie pour le contrôle du saignement. Localiser la vessie qui a une position complètement par voie intrapéritonéale chez le porc et peut être librement exposée en mobilisant à travers la plaie chirurgicale.
- Prendre la main de la vessie avec la pince et de le mesurer avec un ruban à mesurer stérilisée et marquent une biopsie forme elliptique d'environ 2 cm en largeur et 1 cm transversalement, ou moins, en utilisant un stylo stérilisé (le cochon tolère une réduction de quart de la taille de la vessie très bien). Exciser la zone marquée, à l'aide d'un scalpel, et placer l'échantillon de biopsie de la vessie dans DMEM dans des conditions stériles.
- Effectuer autotransplantation avec le BioTransplant ou de fermer la vessie par suture avec 5-0 Vicryl en deux couches. Fermez l'aponévrose abdominale soigneusement avec 2-0 ou 3-0 courir Vicryl. Fermez l'hypoderme avec 3-0 Vicryl et la peau avec 3-0 Ethilon. Placez un pansement sur la plaie et attentivementtendance à l'animal jusqu'à ce qu'il ait suffisamment récupéré de l'anesthésie et de ne pas exprimer la douleur.
- Déplacer l'animal à l'établissement de soins des animaux pour obtenir des conditions de soins post-opératoires. Mettre l'animal dans une seule cage avec une lampe de chauffage et d'assister à l'animal jusqu'au rétablissement complet de l'anesthésie, puis de laisser les animaux soient bloquées par paires.
- Fournir une récupération sans incident sur la douleur et le bien-être et d'administrer la buprénorphine (45 ug / kg) par voie intramusculaire pour l'analgésie postopératoire et trimetoprim (4 mg / kg) et sulfonamide (20 mg / kg) deux fois par jour pendant trois jours et une fois par jour pendant cinq jours à réduire les risques d'infections post-opératoires.
- L'excision de la peau biopsie
- Préparer la table d'opération avec tout le matériel nécessaire. Anesthésier l'animal comme décrit ci-dessus en 1.1. Retirez le pelage avec de la cire, laver et stériliser la zone d'incision avec de la bétadine et alcool à 70%, puis placez drapage stérile arounD la zone d'incision.
- Utilisez un dermatome de récolter un 0,3 mm d'épaisseur partielle échantillon de biopsie de la peau. Placer l'échantillon de peau dans DMEM avant le hachage, comme décrit dans 2.2. Couvrir la zone de la plaie avec de l'huile de gras et d'un dressing.
2. hachée Préparation des tissus
- muqueuse vésicale
- Laver la biopsie de la vessie deux fois dans du DMEM. Placer l'échantillon de biopsie de la vessie sur une plaque de dissection stérilisés avec la muqueuse vers le haut et fixer l'un des côtés de la plaque en utilisant les repères de dissection.
- Séparer le tissu muqueux du muscle détrusor l'aide de ciseaux fins et une pince (figure 3) et de garder la muqueuse humide en gouttes de solution saline ou DMEM dessus.
- Utilisez le dispositif de hachage en le plaçant sur la muqueuse et ensuite passer l'appareil d'un bout à l'autre verticalement et horizontalement, en appliquant une pression manuelle pour obtenir des morceaux de tissu haché de 0,8 mm x 0,8 mm (0,8 mm est la distance entre le rotating lames de coupe).
- Peau
- Si le biopsis de la peau sont épais: placer la peau sur une plaque de dissection stérile et utiliser des ciseaux chirurgicaux pour séparer l'épiderme de la graisse sous-cutanée et le derme. L'épiderme est mince et translucide (env. 0,3 mm) quand il est prêt pour hacher.
- Utilisez le dispositif de hachage en le plaçant sur l'épiderme. La pression, le dispositif passe d'un bout à l'autre verticalement et horizontalement afin d'obtenir des morceaux de tissu haché de 0,8 mm x 0,8 mm.
3. Préparation de plastique compressés PCL / collagène autogreffes
- Placez tous les ingrédients sur de la glace pour garder froid. Ustensiles nécessaires: tube de Falcon, 10x DMEM, 1x DMEM, 1 N NaOH et queue de rat de collagène de type 1.
- Mélanger 2 ml de 10x DMEM (avec soin pour éviter les bulles) avec 12 ml de collagène de type 1. Ajouter 1 N NaOH, goutte à goutte, pour amener le pH jusqu'à 7,4 à 8 (couleur dans le milieu doit indiquer le pH en passant d'intense jaune à la brochek). En outre, utiliser une bande de pH.
- Ajouter avec précaution 2 ml de DMEM 1x et mélanger la solution. Plaque d'environ 2 ml de collagène dans chaque puits du moule rectangulaire en acier (20x30x10 mm) et incuber à 37 ° C ° C dans 5% de CO2 pendant 10 min.
REMARQUE: La concentration de collagène doit être de 2,06 mg / ml dans de l'acide acétique à 0,6% et la quantité de collagène 1 ml / cm 2. - Une fois que le collagène présente dans le moule, placer le biomatériau (PCL) au-dessus du gel de collagène (20 mm x 30 mm) et verser le collagène restant (environ 6 ml) au-dessus de celui-ci. Incuber à 37 ° C dans 5% de CO2 pendant 20 min.
- Placer le tissu haché (de 1: 6 expansion) sur le dessus du gel de collagène. Presser l'eau hors du produit d'assemblage par force mécanique en utilisant la compression plastique de la manière suivante (figures 3 et 4).
- Déposer une couche épaisse de tampons de gaze sur une surface stérile. Placez une maille d'acier inoxydable (400 um d'épaisseur) sur le dessus du gauzplaquettes de e puis une feuille de nylon mesh (110 um d'épaisseur). Soigneusement transférer le gel de collagène / tissu haché sur le filet de nylon et retirer délicatement le moule en acier rectangulaire.
- Placez une nouvelle couche de filet de nylon sur le dessus du gel de collagène / tissu haché. Placer une deuxième maille d'acier au-dessus de la maille de nylon. Placez en position la plaque de pression ou le chargement d'un poids minimum de 120 g (soit une plaque de verre) pendant 5 min.
- Retirer les mailles poids, nylon et acier. Les autogreffes sont maintenant prêts à être suturée à la vessie de porc dans les plaies de pleine épaisseur peau ou de culture in vitro.
- Par culture in vitro, couper la fine construction en petits morceaux ajustés plaques à 12 puits. Ajouter 1 ml de milieu de kératinocytes. Placer les plaques dans l'incubateur à 37 ° C, 5% CO 2 et de la culture jusqu'à 6 semaines et changer le milieu 3 fois par semaine.
4. Suture des autogreffes
- Suture d'une autogreffe avechachée muqueuse vésicale à la vessie de porc
- Gardez l'autogreffe humide dans DMEM pendant le temps d'attente. Suturer l'autogreffe de fines sutures course monofilament. Utilisez non résorbable 5-0 Ethilon à des fins de recherche.
- Vérifiez si étanche par remplissage de la vessie avec une solution saline à travers la sonde urinaire à demeure. Si possible, couvrir l'autogreffe d'une couche de grand épiploon. Fermer la paroi abdominale, tissu sous-cutané, et la peau comme décrit dans 1.2.6. Appliquer un pansement.
- Suture de l'autogreffe avec épiderme de la peau hachées à une plaie de pleine épaisseur
- Gardez l'autogreffe humide dans DMEM pendant le temps d'attente.
- Suturer l'autogreffe au fond de la peau de pleine épaisseur de la plaie par des points séparés dans les coins et au milieu de l'autogreffe de garder l'autogreffe étroitement attaché à la surface sous-jacente.
- Recouvrir la plaie avec un pansement en plastique qui maintient la plaie humide.
5. La résiliation
- Calme l'animal avec une injection intramusculaire de zolazepam hypochlorite (2,5 mg / kg) et la médétomidine (25 ug / kg) avant la résiliation et appliquer des dispositifs de surveillance à l'oreille ou de queue pour vérifier le pouls et la pression artérielle.
- Euthanasier l'animal par l'administration d'une dose létale de pentobarbital sodique (60 à 140 mg / kg) par voie intraveineuse. Vérifiez le pouls et la pression artérielle jusqu'à la mort a eu lieu.
6. culture in vitro
NOTE: Pour évaluer la progression histologique du tissu haché dans les constructions PCL / de collagène in vitro, le collagène / PCL / patches hachées sont cultivées dans des plaques à 12 puits en utilisant un milieu de kératinocytes.
- Préparation du milieu de kératinocytes:
- Stériliser une bouteille en verre de 500 ml.
- Mélanger 400 ml de DMEM avec 100 ml de F12 de Ham (4: 1 de mélange). Compléter avec 10% de sérum bovin foetal, de l'insuline 5 ug / ml,0,4 ug / ml d'hydrocortisone, 21 ug / ml d'adénine, 10 -10 mol / L de la toxine cholérique, 2 x 10 -9 mol / L triiodothyronine, 5 ug / ml de transferrine, 10 ng / ml de facteur de croissance épidermique, 50 U / ml de pénicilline et 50 ug / ml de streptomycine.
- Stériliser par filtration à travers un filtre de 0,2 um et recueillir le filtrat dans la bouteille de 500 ml stérile.
7. L'immunohistochimie
NOTE: Le protocole d'immunohistochimie est généralement divisé en les étapes suivantes: (1) la fixation et inclusion dans la paraffine, (2) micro-sectionnement à 5 um tranches, le placement sur des lames, déparaffinage et réhydratation, (3) démasquage antigénique, de coloration et de montage . Avant de commencer les dernières étapes de la procédure d'immunohistochimie, préparer les tampons de lavage et la solution de démasquage de l'antigène (voir détails matériels distincts). Préparer la solution de complexe ABC au moins 30 min avant utilisation.
- Fixation
NONTE: A la fin de la culture in vitro, la fixation des taches de la manière suivante:- Préparer des tubes Eppendorf avec 1 ml de 4% de formaldéhyde tamponnée (PFA) (Attention:. Formaldéhyde est toxique S'il vous plaît lire les fiches de données de sécurité des matériaux avant de travailler avec ce produit chimique Porter des gants et des lunettes de sécurité et de préparer la solution à l'intérieur d'une hotte.).
- Transférer chacun des patchs de collagène dans un tube Eppendorf contenant 4% de PFA. Fixer pendant une nuit à température ambiante.
- Placer les échantillons dans 70% d'éthanol pour le stockage à long terme à 4 ° C. Les échantillons sont maintenant prêts pour la déshydratation et l'intégration dans des blocs de paraffine avant la coupe.
- réhydratation
- Placer les lames dans un bocal en coloration avec solv X-tra pour 15 min. Répétez l'aide d'un nouveau pot de coloration avec X-tra solv. Placer les lames dans un bocal de coloration avec de l'éthanol absolu pendant 10 min. Répétez l'aide d'un nouveau pot de coloration avec de l'éthanol absolu. Placer les lames dans un bocal de coloration avec 95% d'éthanol pour 10 minutes et par la suitedans un récipient de coloration avec 70% d'éthanol pendant 10 min. Enfin laver les lames deux fois pendant 5 min avec de l'eau distillée.
- démasquage antigénique
- Mettre les lames dans une jarre de Coplin avec TE-solution et mettre le pot dans un bain d'eau à ébullition pendant 20 minutes. Prenez le pot du bain soin de l'eau. Refroidir les lames à température ambiante pendant 30 min et laver deux fois pendant 5 min dans du tampon Tris. Placer les lames dans un bocal en coloration avec 3% de peroxyde d'hydrogène pendant 10 minutes. Laver les lames deux fois pendant 5 min dans du tampon Tris. Tracez un cercle autour des échantillons à l'aide d'un marqueur hydrofuge.
- Bloquer la liaison non spécifique de l'anticorps en utilisant 100 à 300 ul de solution de blocage. On élimine la solution de blocage et ajouter 1-300 ul d'anticorps primaire dissous à la concentration recommandée dans le tampon Tris. Incuber une nuit. Retirer la solution d'anticorps et laver sections dans un tampon Tris deux fois pendant 5 min.
- Incuber avec l'anticorps secondaire pendant 1 h à la salle temperature. Laver deux fois pendant 5 min dans du tampon Tris. Incuber 30 min à l'aide du kit ABC Elite (suivre les instructions du fabricant). Laver deux fois dans un tampon Tris.
- Développer une réaction d'anticorps en utilisant le kit VIP Vector, suivant les instructions du fabricant (1-7 minutes d'incubation produit généralement une intensité violet clair). Mettre les lames dans de l'eau distillée. Counterstain avec l'hématoxyline de Mayer pendant 30 sec.
- Laver à l'eau courante pendant 5 min. Placer les lames dans un bocal en coloration avec 70% d'éthanol pendant 1 min. Répétez l'aide d'un nouveau pot de coloration avec 70% d'éthanol. Placer les lames dans un bocal en coloration avec 95% d'éthanol pendant 1 min. Répétez l'aide d'un nouveau pot de coloration avec 95% d'éthanol.
- Placer les lames dans un bocal de coloration avec solv X-tra pendant 5 min. Supprimer, un à la fois de garder humide. Déposer une goutte de milieu de montage sur le dessus de chaque diapositive et de mettre un verre de protection sur le dessus (le faire avec soin pour éviter les bulles d'air). Laissez les diapositives sécher toute la nuit et voir les diapositives en vertu d'un microportée.
Résultats
Cette étude présente une méthode qui montre comment produire un biomatériau pour la transplantation en utilisant la compression plastique de collagène et le tissu haché.
Muqueuse vésicale et de la peau peuvent être récoltées puis hachées mécaniquement en petites particules (figure 3). Par compression en matière plastique, les particules hachées sont incorporés dans la matrice de support composite constitué d'un polymère biodégradable qui est placé en p...
Discussion
Cette étude présente une approche facile à utiliser pour produire des plaques de paroi de la vessie avec des tissus autologues pour la transplantation à la table chirurgicale. Les patchs sont formés par la combinaison d'un tricotage de polymère biodégradable dans le milieu et le collagène avec ou sans tissu haché dans les surfaces extérieures, en combinaison avec une compression plastique. Compression plastique est un procédé décrit ci-dessus par d'autres auteurs et peut être définie comme une exp...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors thank the Swedish Society for Medical Research, the Promobilia Foundation, the Crown Princess Lovisa Foundation, the Freemason Foundation for Children’s Welfare, the Swedish Society of Medicine, the Solstickan Foundation, Karolinska Institutet, and the Stockholm City Council for financial support.
matériels
| Name | Company | Catalog Number | Comments |
| Silicone catheter 10-French | Preparing the animal for surgery, Section 1 | ||
| DMEM 10x | Gibco | 31885-023 | Plastic compression section 4 |
| 24 well plates | Falcon | 08-772-1 | Plastic compression section 4 |
| 3',3',5-Triiodothyronine | Sigma-Aldrich | IRMM469 | In vitro culture; Section 5 |
| 4% PFA | Labmed Solutions | 200-001-8 | Immunocytochemistry; Section 6 |
| 70% ethanol | Histolab | Immunocytochemistry; Section 6 | |
| ABC Elite kit: Biotin-Streptavidin detection kit | Vector | PK6102 | Immunocytochemistry; Section 6 |
| Absolute ethanol | Histolab | 1399.01 | Immunocytochemistry; Section 6 |
| Adenine | Sigma-Aldrich | A8626 | In vitro culture; Section 5 |
| Atropine 25 μg/kg | Temgesic, RB Pharmaceuticals, Great Britain | Preparing the animal for surgery, Section 1 | |
| Azaperone 2 mg/kg | Stresnil, Janssen-Cilag, Pharma, Austria | Preparing the animal for surgery, Section 1 | |
| Biosafety Level 2 hood | Plastic compression; Section 4 | ||
| Blocking solution: Normal serum from the same species as the secondary secondary antibody was generated in. | Vector | The blocking solution depends of the origin of first antibody | Immunocytochemistry; Section 6 |
| Buprenorphine 45 μg/kg | Atropin, Mylan Inc, Canonsburg, PA | Preparing the animal for surgery, Section 1 | |
| Carprofen 3 mg/kg | Rimadyl, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Chlorhexidine gluconate | Hibiscrub 40 mg/mL, Regent Medical, England | Preparing the animal for surgery, Section 1 | |
| Cholera toxin | Sigma-Aldrich | C8052 | In vitro culture; Section 5 |
| Coplin jar: staining jar for boiling | Histolab | 6150 | Immunocytochemistry; Section 6 |
| Stainless mold (33 mm x 22 mm x 10 mm) custom made | Plastic compression; Section 4 | ||
| DMEM | Gibco | 3188-5023 | Plastic compression section 4. Keep on ice when using it in plastic compression |
| Epidermal growth factor | Sigma-Aldrich | E9644 | In vitro culture; Section 5 |
| Ethilon (non-absorbable monofilament for skin sutures) | Ethicon | Surgery, Section 1 | |
| Fetal bovine serum (FBS) | Gibco | 10437-036 | Plastic compression section 4 |
| Forceps (Adison with tooth) | Preparing the animal for surgery, Section 1 | ||
| Gauze (Gazin Mullkompresse) | Preparing the animal for surgery, Section 1 | ||
| Ham's F12 | Gibco | 31765-027 | Plastic compression section 4 |
| Hematoxylin | Histolab | 1820 | Immunocytochemistry; Section 6 |
| Humidity chamber | DALAB | Immunocytochemistry; Section 6 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | In vitro culture; Section 5 |
| Hydrogen peroxide Solution 30% | Sigma-Aldrich | H1009 | Immunocytochemistry; Section 6 |
| Insulin | Sigma-Aldrich | I3536 | In vitro culture; Section 5 |
| Isoflurane | Isoflurane, Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Lidocaine 5 mg/ml | Xylocaine, AstraZeneca, Sweden | Preparing the animal for surgery, Section 1 | |
| Lucose 25 mg/ml | Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Marker pen pap pen | Sigma-Aldrich | Z377821-1EA | Immunocytochemistry; Section 6 |
| Medetomidine 25 μg/kg | Domitor, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Mincing device | Applied Tissue Technologies LLC | Minced tissue preparation, section 2 | |
| Monocryl (absorbable monofilament) | Ethicon | Surgery, Section 1 | |
| NaCl | Sigma-Aldrich | S7653 | Immunocytochemistry; Section 6 |
| NaOH 1 N | Merck Millipore | 106462 | Plastic compression section 4 and cell culture |
| Nylon mesh, 110 μM thick pore size 0.04 sqmm | Plastic compression; Section 4 | ||
| Oculentum simplex APL: ointment for eye protection | APL | Vnr 336164 | Surgery, Section 1 |
| PBS | Gibco | 14190-094 | Plastic compression section 4 |
| Penicillin-Streptomycin | Gibco | 15140-122 | Plastic compression section 4 |
| Phenobarbiturate 15 mg/kg | Pentobarbital, APL, Sweden | Preparing the animal for surgery, Section 1 | |
| PCL Knitted fabric | Plastic compression; Section 4 | ||
| Rat-tail collagen | First LINK, Ltd, UK | 60-30-810 | Plastic compression section 4, keep on ice |
| Scalpel blade - 15 | Preparing the animal for surgery, Section 1 | ||
| Shaving shears | Preparing the animal for surgery, Section 1 | ||
| Stainless stell mesh, 400 μM thick pore size | Plastic compression; Section 4 | ||
| Steril gloves | Preparing the animal for surgery, Section 1 | ||
| Sterile gowns | Preparing the animal for surgery, Section 1 | ||
| Sterile drapes | |||
| Sterilium | Bode Chemie HAMBURG | Preparing the animal for surgery, Section 1 | |
| Suture Thread Ethilon | Preparing the animal for surgery, Section 1 | ||
| TE-solution (antigen unmasking solution) consist of 10 mM Tris and 1 mM EDTA, pH 9.0 | 10 mM Tris/1 mM EDTA, adjust pH to 9.0 | ||
| Tiletamine hypochloride 2.5 mg/kg | Preparing the animal for surgery, Section 1 | ||
| Transferrin | Sigma-Aldrich | T8158 | In vitro culture; Section 5 |
| Trizma Base, H2NC | Sigma-Aldrich | T6066 | Immunocytochemistry; Section 6 |
| Vector VIP kit: Enzyme peroxidase substrate kit | Vector | SK4600 | Immunocytochemistry; Section 6 |
| Vicryl (absorbable braded) | Ethicon | Surgery, Section 1 | |
| Tris buffer pH 7.6 (washing buffer) | TE solution: Make 10x (0.5 M Tris, 1.5 M NaCl) by mixing: 60.6 g Tris (Trizma Base, H2NC(CH2OH)3, M=121.14 g/mol), add 800 ml distilled water adjust the pH till 7.6, add 87.7 g NaCl and fill to 1,000 ml with distilled water. Dilute to 1x with distilled water. | ||
| X-tra solv (solvent) | DALAB | 41-5213-810 | Immunocytochemistry; Section 6. Use under fume hood |
| Zolazepam hypochloride | Zoletil, Virbac, France | Preparing the animal for surgery, Section 1 | |
| Depilatory wax strips | Veet | Preparing the animal for surgery, Section 1 | |
| Pentobarbital sodium | Lundbeck | Termination, Section 3 |
Références
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6, 331-343 (1975).
- Fossum, M., Nordenskjold, A., Kratz, G. Engineering of multilayered urinary tissue in vitro. Tissue Engineering. 10, 175-180 (2004).
- Salmikangas, P., et al. Manufacturing, characterization and control of cell-based medicinal products: challenging paradigms toward commercial use. Regen Med. 10, 65-78 (2015).
- Fossum, M., et al. Minced skin for tissue engineering of epithelialized subcutaneous tunnels. Tissue Engineering. Part A. 15, 2085-2092 (2009).
- Fossum, M., et al. Minced urothelium to create epithelialized subcutaneous conduits. The Journal of Urology. 184, 757-761 (2010).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. L., Nordenskjold, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. BioMed Research International. 2013, 212734 (2013).
- Meek, C. P. Successful microdermagrafting using the Meek-Wall microdermatome. Am J Surg. 96, 557-558 (1958).
- Tanner, J. C., Vandeput, J., Olley, J. F. The Mesh skin graft. Plastic and Reconstructive Surgery. 34, 287-292 (1964).
- Svensjo, T., et al. Autologous skin transplantation: comparison of minced skin to other techniques. The Journal of Surgical Research. 103, 19-29 (2002).
- Ajalloueian, F., Zeiai, S., Rojas, R., Fossum, M., Hilborn, J. One-stage tissue engineering of bladder wall patches for an easy-to-use approach at the surgical table. Tissue Engineering. Part C, Methods. 19, 688-696 (2013).
- Engelhardt, E. M., et al. A collagen-poly(lactic acid-co-varepsilon-caprolactone) hybrid scaffold for bladder tissue regeneration. Biomaterials. 32, 3969-3976 (2011).
- Brown, R. A., Wiseman, M., Chuo, C. B., Cheema, U., Nazhat, S. N. Ultrarapid engineering of biomimetic materials and tissues: fabrication of nano- and microstructures by plastic compression. Adv Funct Mater. 15, 1762-1770 (2005).
- Fumagalli Romario, U., Puccetti, F., Elmore, U., Massaron, S., Rosati, R. Self-gripping mesh versus staple fixation in laparoscopic inguinal hernia repair: a prospective comparison. Surg Endosc. 27, 1798-1802 (2013).
- Muangman, P., et al. Complex Wound Management Utilizing an Artificial Dermal Matrix. Annals of Plastic Surgery. 57, 199-202 (2006).
- Ajalloueian, F., Zeiai, S., Fossum, M., Hilborn, J. G. Constructs of electrospun PLGA, compressed collagen and minced urothelium for minimally manipulated autologous bladder tissue expansion. Biomaterials. 35, 5741-5748 (2014).
- Orabi, H., AbouShwareb, T., Zhang, Y., Yoo, J. J., Atala, A. Cell-seeded tubularized scaffolds for reconstruction of long urethral defects: a preclinical study. Eur Urol. 63, 531-538 (2013).
- Blais, M., Parenteau-Bareil, R., Cadau, S., Berthod, F. Concise review: tissue-engineered skin and nerve regeneration in burn treatment. Stem Cells Transl Med. 2, 545-551 (2013).
- Serpooshan, V., Muja, N., Marelli, B., Nazhat, S. N. Fibroblast contractility and growth in plastic compressed collagen gel scaffolds with microstructures correlated with hydraulic permeability. J Biomed Mater Res A. 96, 609-620 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon