このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
圧縮されたコラーゲンで細分化した組織:シングル段再建修復のための細胞含有Biotransplant
要約
組織工学は、多くの場合、組織再生のための自家移植を作成するためにインビトロで拡張に含まれます。この研究では、組織拡張、再生、およびin vivoでの再構成のための方法は、体外細胞および生体物質の処理を最小限にするために開発されました。
要約
Conventional techniques for cell expansion and transplantation of autologous cells for tissue engineering purposes can take place in specially equipped human cell culture facilities. These methods include isolation of cells in single cell suspension and several laborious and time-consuming events before transplantation back to the patient. Previous studies suggest that the body itself could be used as a bioreactor for cell expansion and regeneration of tissue in order to minimize ex vivo manipulations of tissues and cells before transplanting to the patient. The aim of this study was to demonstrate a method for tissue harvesting, isolation of continuous epithelium, mincing of the epithelium into small pieces and incorporating them into a three-layered biomaterial. The three-layered biomaterial then served as a delivery vehicle, to allow surgical handling, exchange of nutrition across the transplant, and a controlled degradation. The biomaterial consisted of two outer layers of collagen and a core of a mechanically stable and slowly degradable polymer. The minced epithelium was incorporated into one of the collagen layers before transplantation. By mincing the epithelial tissue into small pieces, the pieces could be spread and thereby the propagation of cells was stimulated. After the initial take of the transplants, cell expansion and reorganization would take place and extracellular matrix mature to allow ingrowth of capillaries and nerves and further maturation of the extracellular matrix. The technique minimizes ex vivo manipulations and allow cell harvesting, preparation of autograft, and transplantation to the patient as a simple one-stage intervention. In the future, tissue expansion could be initiated around a 3D mold inside the body itself, according to the specific needs of the patient. Additionally, the technique could be performed in an ordinary surgical setting without the need for sophisticated cell culturing facilities.
概要
皮膚と泌尿生殖器管への移植のほとんどの組織工学の研究は、特別装備し、細胞培養施設1,2における健康な組織や細胞増殖の自己細胞の収穫が含まれます。
患者は、自家移植片を受け取るように準備される場合、細胞増殖の後、細胞は、通常、後の使用のために格納されます。窒素冷凍庫は-150℃以下の低温での長期保存を可能にします。凍結のプロセスは、慎重かつ細胞を失わないために制御しなければなりません。細胞死の一つのリスクは、細胞膜の破裂につながることが融解プロセス中に細胞内の水の結晶です。細胞の凍結は、通常、細胞、ウシ胎児血清、およびジメチルスルホキシドの高い濃度を用いて、ゆっくりと制御冷却(-1°Cあたり分)によって行われます。解凍後、細胞を凍結培地を除去し、細胞培養プラスチックまたはで培養することによって再び処理される必要があります戻って患者に移植する前に生体材料。
すべての上記の手順は、時間がかかり、面倒であり、高価な3。また、患者の移植のために意図された細胞のすべてのin vitroでの処理は非常に規制されているとよく訓練されたと認定された担当者や研究室4が必要です 。すべてのすべてで、安全で信頼性の高い製造プロセスを調達するために、技術は技術的に高度なセンターの非常に少ない数で確立することができ、一般的な外科的疾患における普及は疑問です。
実験室環境での細胞培養の限界を克服するために、in vivoでの細胞増殖のために細分化した組織を移植するという概念は、バイオリアクターとしての本体自体を使用することによって導入されます。これらの目的のために、自家移植は、優先的に私の臓器の最終的な再構築のために必要とされる形状に応じて3Dモールド上に移植されることになります5-7 nterest。
もともと、みじん切り上皮を移植するという考えは、彼が上皮は、創傷の縁から成長方法を説明したときに1958年にミークによって発表されました。彼は皮膚の小片は、垂直方向( 図1)8に二回ピースを切断することにより、100%によって、その余白とそれによって細胞の拡大のためにその可能性を増大させることを実証しました。理論は、皮膚移植9用のメッシュ構造部分層皮膚移植片の使用によってサポートされており、肌にモデル10を創傷治癒されています。
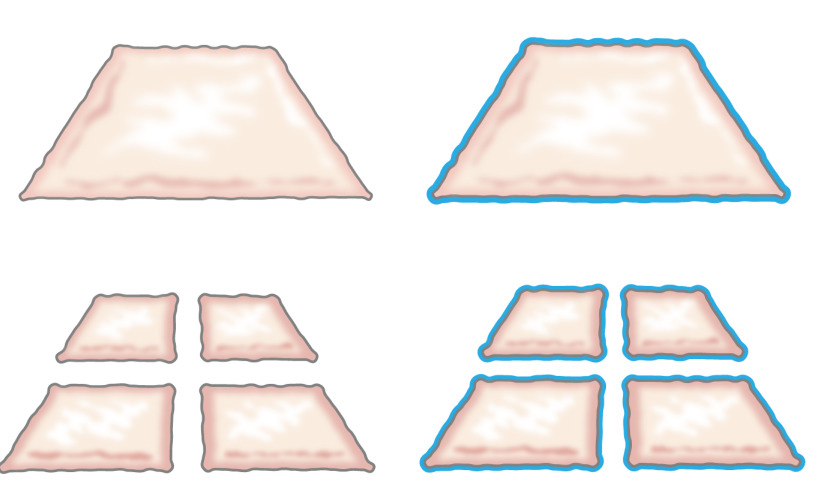
図1:ミーク理論はミークの理論によれば、上皮は、創傷の縁から成長。ミンチ技術により露出面積を大きくすることで、細分化した組織は、多くのスポットから傷をepithelializes。
本研究は、ハイポに基づいています同じ原理は、金型の周囲にミンチ上皮を配置することによって、皮下組織に適用することができる論文。 (内側本体から異物(金型)を創傷領域をカバーし、分離連続neoepitheliumを形成するために、上皮細胞は、創傷領域は(移行)をカバー、ミンチ移植(再編成)から動員だろうと除算は(拡大します) 図2)。
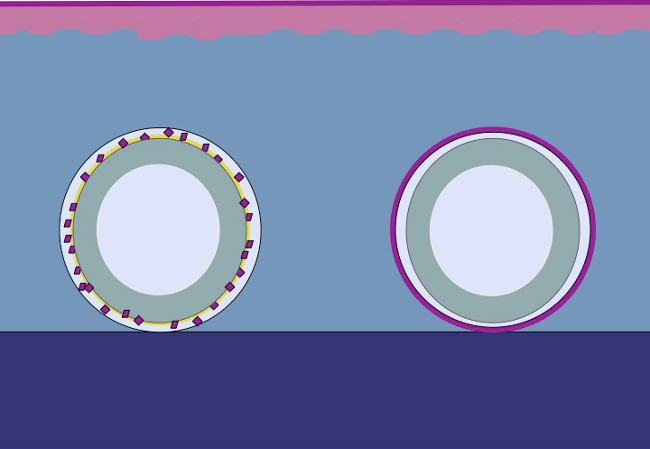
図2:ミークの理論によるin vivoでの体内組織拡大のためのみじん切り上皮と3Dモールドの漫画の皮下組織に金型に入れ、次いで移植細分化した組織を使用することにより、仮説は、上皮細胞から移行することです細分化した組織の縁は、再編成、および創傷領域をカバーし、内側本体から異物(金型)を分離連続neoepitheliumを形成するように拡張します。
インビボ研究において以前は有望な結果を示しているが、再生上皮が良い7機械的外傷に耐えることができるように、更なる改良が自家移植片を強化することによって達成することができます。簡単に栄養素や老廃物の拡散、可能性金型に3Dの方法で、手術取り扱いの容易さ:これらの目的のために、成功した生体材料のための重要な前提条件は、次のような、同定されました。結論は、これらの必要性を細分化した組織への複合生体材料を添加することによって達成することができたと判断しました。
生分解性生地の補強芯を含むプラスチック - 圧縮コラーゲンに細分化した組織で構成される足場を開発することを目的とした今回の研究。これらの手段によって、生存細胞を細分化した組織粒子から移行する可能性があり、元の上皮(皮膚や尿路上皮)の特徴的な形態学的特徴で増殖します。塑性圧縮を使用して、足場を減らすました約420μmのみじん切り粒子として、1 CMからサイズのdは上位層のコラーゲンに包まれました。コア・ファブリックは、任意のポリマーであるが、被覆コラーゲン層11とインターリンクするために、親水性表面で修飾することが必要である可能性があります。
この方法は、ブタからミンチ膀胱粘膜やみじん切り皮膚を培養するための足場としてそれを使用して、2つのプラスチック製の圧縮コラーゲンゲル内にポリ(εカプロラクトン)からなるニットメッシュ(PCL)を組み込むことによって強化された足場の整合性を提供します。構築物は、よく連結ハイブリッド構築物の上に層状、多層尿路上皮または扁平皮膚上皮の成功形成を実証し、in vitroで 6週間まで細胞培養条件下で維持しました。構築物は、取り扱いが容易であったと膀胱増強の目的や皮膚の欠陥の被覆のための場所に縫合することができました。すべての組織スキャフォールドの部分がFDA承認されており、技術組織細断収穫、プラスチック圧縮、および単一段階介入として患者に戻し移植することにより、一段階手順を使用することができます。手順は、任意の一般外科ユニット内の無菌条件下で組織拡大と再構築のために行うことができました。
プロトコル
動物ストックホルム郡委員会とすべての手続きにより事前承認された全ての動物プロトコルは、動物用の規制だけでなく、関連する連邦政府の法令に準拠しました。
1.動物の手順
- 手術のために動物を準備
- 無菌条件下での操作に必要なすべての材料と器具で手術台を準備します。感染の危険性を減少させ、生存手術における条件を最適化するために、無菌条件下で排他的に手術を行います。
- 手術前に12時間のために動物を迅速かつその重量を測定します。前投薬のためのアザペロンの筋肉内注射(2ミリグラム/キログラム)を管理します。チレタミン次亜塩素酸の筋肉内注射で動物を麻酔(2.5ミリグラム/キログラム)、ゾラゼパム次亜塩素酸(2.5ミリグラム/キログラム)、メデトミジン(25μgの/ kg)及びアトロピン(25μgの/キログラム)。
- phenobarbiturateを注入した(15mg / kg)をendotrache前にアル挿管および0.8%-2%イソフルランで全身麻酔を続けます。片方の耳に末梢静脈カテーテルを挿入し、動物の健康を維持するために静脈内処置中にグルコース(25 mg / mlで)を注入します。
- 温度、血圧、彩度、及び末梢脈拍をチェックするために、耳または尾部上のデバイスを監視配置。耳や蹄の痛み刺激による制御麻酔。麻酔下ながら乾燥を防ぐために、目に軟膏を適用します。
- 膀胱生検標本の切り出し
- 尿道を表示して半無菌条件下で尿を空に尿道を通って膀胱にカテーテルを挿入する鏡を導入することにより、10-フランスのシリコーンカテーテルを用いて膀胱カテーテルを挿入。 20-25センチH 2 O、約100〜300 mlに圧力を滅菌生理食塩水で膀胱を充填し、次に空のO 2センチH 20(約8ミリリットル/ kg体重)。
- THと電子豚は慎重にグルコン酸クロルヘキシジンのアプリケーションで皮膚の基本的な術前消毒を行い、側位置になりました。シェービングハサミで毛を除去した後、肩にジアテルミープレートを適用します。
- 仰臥位に慎重豚の電源を入れ、シェービングばさみを使用して腹部の毛を除去し、グルコン酸クロルヘキシジンのアプリケーションと腹部の皮膚の基本的な術前滅菌を行います。
- 四肢の関節の過伸展損傷のリスクを最小限にするために柔らかい衣服と四肢を埋め込みます。グルコン酸クロルヘキシジンの連続したアプリケーションと動物の腹部皮膚を殺菌し、手術野の周りに滅菌ドレープを配置します。
- 皮膚切開の前に、臍下の正中線にブプレノルフィン(45μgの/キログラム)、カルプロフェン(3mg / kg)およびリドカインの局所注射からなる静脈内鎮痛剤を適用します。 SKを把握することによって痛みの反応をチェックピンセットでインチ出血の制御のためのジアテルミーを使用して、筋膜と腹膜を介して下部正中切開を行います。豚で完全に腹腔内の位置を有しており、自由に手術創を通してそれを動員して露出させることができる膀胱をローカライズ。
- ピンセットで膀胱のホールドを取り、滅菌巻き尺でそれを測定し、滅菌したペンを使用して、縦方向に約2センチ、横方向に1センチメートル、または小さい楕円形の生検標本をマーク(豚は、膀胱サイズの四分の一の減少を許容結構)。メスを用いて、マークされた領域を切除し、滅菌条件下でDMEM中で膀胱生検標本を配置します。
- biotransplantで自家移植を実行するか、2層に5-0ビクリルでそれを縫合することによって膀胱を閉じます。 2-0または3-0ビクリルを実行して、慎重に腹部筋膜を閉じます。 3-0ビクリルと3-0 Ethilonと皮膚と皮下組織を閉じます。傷口に包帯を置き、慎重にそれは麻酔から十分に回復していると痛みを発現しないまで動物に傾向があります。
- 術後のケアのための条件を確保するために、動物のケア施設に動物を移動します。加熱ランプと、単一のケージに動物を入れて、出席動物に麻酔から完全に回復するまで、動物をペアでストールすることができます。
- 痛みと幸福に関する平穏無事回復を提供し、5日間毎日一回3日間、1日2回筋肉内に術後鎮痛とtrimetoprim(4ミリグラム/ kg)及びスルホンアミド(20 mgの/ kg)のためにブプレノルフィン(45μgの/キログラム)を管理し、術後感染症のリスクを軽減します。
- 皮膚生検標本の切り出し
- すべての必要な材料と手術台を準備します。以前1.1で説明したように動物を麻酔。 、ワックスを使用して毛を取り外し洗浄し、ベタジンおよび70%アルコールで切開領域を殺菌した後、滅菌ドレープをaroun置きます切開領域を日間。
- 0.3ミリメートル部分層皮膚生検標本を採取するデルマトームを使用してください。 2.2で説明したように、ミンチ前にDMEMで皮膚片を置きます。脂肪軟膏と包帯で創傷領域をカバーしています。
2.ミンチ組織調製
- 膀胱粘膜
- DMEMで二回膀胱生検を洗ってください。上を向い粘膜で滅菌解剖板に膀胱生検標本を置き、解剖ピンを使用してプレートに側面の1を固定します。
- ( 図3)細かいハサミやピンセットを用いて排尿筋からの粘 膜組織を分離し、その上に生理食塩水またはDMEMを滴下することにより湿った粘膜を維持します。
- 粘膜上に配置することによってミンチ装置を使用し、0.8ミリメートル×0.8mmの細分化した組織片を得るために手動圧力を加え、垂直方向と水平方向の一端から他端へのデバイスを通過する(1.3ミリメートルrotatin間の距離であります切刃G)。
- 皮膚
- 皮膚biopsis場合は厚さ:無菌解剖板上に皮膚を配置し、皮下脂肪及び真皮から表皮を分離するために、外科用はさみを使用しています。表皮は薄く、半透明である(約0.3ミリメートル)それはミンチの準備ができているとき。
- 表皮上に置くことによってミンチデバイスを使用してください。圧力0.8ミリメートル×0.8mmの細分化した組織片を得るために、水平垂直方向に一端から他端へのデバイスを通過し。
プラスチック圧縮PCL /コラーゲン自家移植片の調製
- 冷たい保つために氷の上にすべての材料を配置します。必要な道具:ファルコンチューブ、10×DMEM、1xのDMEM、1 N NaOHおよびラット尾コラーゲンタイプ1。
- (培地中の色が強いから変更することにより、pH値を示すべきである7.4から8までのpHを、一滴ずつ、1 NのNaOHを加え、コラーゲンタイプ1の12ミリリットルで10倍の2ミリリットルをDMEM(慎重に気泡を避けるために)ミックスピンに黄色K)。また、pHがストリップを使用します。
- 慎重に1×2mlのDMEMを添加し、溶液を混合。板鋼の長方形のモールド(20x30x10ミリ)の各ウェルのコラーゲンの約2ミリリットルと37でインキュベート 10分間、5%CO 2でC°。
注:コラーゲンの濃度は、0.6%酢酸およびコラーゲン1ミリリットル/ cm 2の量で2.06 mg / mlであるべきです。 - コラーゲンは、金型内にセットした後、コラーゲンゲル(×30から20mm mm)との上に生体材料(PCL)を配置し、その上に残りのコラーゲン(約6ml)に注ぎます。 20分間、5%CO 2中37℃でインキュベートします。
- コラーゲンゲルの上に:(6拡張1)みじん切り組織を置きます。次のようにプラスチック製の圧縮を使用して機械的な力によって、構築物から水を押して( 図3および 4)。
- 無菌の表面にガーゼパッドの厚い層を配置します。 gauzの上に1ステンレスメッシュ(厚さ400μm)を配置電子パッド、その後ナイロンメッシュ(110ミクロン厚)のシート。慎重にナイロンメッシュ上にコラーゲンゲル/みじん切り組織を転送し、慎重に長方形のスチール製の金型を削除します。
- コラーゲンゲル/みじん切り組織の上にナイロンメッシュの新しい層を配置します。ナイロンメッシュの上に第二のスチールメッシュを配置します。位置に5分間120グラム( すなわち 、ガラス板)の最小値を計量圧力や荷重プレートを置きます。
- 体重、ナイロン、スチールメッシュを削除します。自家移植は現在、全層皮膚創傷に豚の膀胱に縫合またはin vitroで培養される準備ができています。
- インビトロ培養のために、12ウェルプレートをフィット小片に薄い構造物を切断します。ケラチノサイト培地の1ミリリットルを追加します。 37℃、5%CO 2や文化6週間までのインキュベーターでプレートを置き、培地を週3回に変更します。
自家移植片の4縫合
- 自家移植の縫合糸で豚の膀胱へのミンチ膀胱粘膜
- 待機時間中にDMEM中で湿った自家移植片を保管してください。細かいランニングモノフィラメント縫合糸で自家移植片を縫合。研究目的のために、非吸収性5-0 Ethilonを使用してください。
- 尿道留置カテーテルを介して生理食塩水で膀胱を充填することによって水密かどうかを確認してください。可能な場合は、大網の層で自家移植をカバーしています。 1.2.6で説明したように腹壁、皮下組織、および皮膚を閉じます。創傷被覆材を適用します。
- 全層創傷にミンチ皮膚表皮と自家移植片の縫合
- 待機時間中にDMEM中で湿った自家移植片を保管してください。
- 密接に下地表面に付着した自家移植を維持するために隅にし、自家移植片の中央に結節縫合によって皮膚創傷、全層の底部に自家移植片を縫合。
- 湿潤創傷を保持プラスチックドレッシング傷をカバーしています。
5。終了
- 落ち着いた動物終了前に筋肉内ゾラゼパム次亜塩素酸(2.5ミリグラム/キログラム)の注射およびメデトミジン(25μgの/キログラム)で、パルスと血圧をチェックするために、耳や尾に監視装置を適用します。
- 静脈内ペントバルビタールナトリウム(60〜140ミリグラム/キログラム)の致死量を投与することによって動物を安楽死させます。死が発生するまでのパルスと血圧をチェックしてください。
6. in vitro培養
注:組織学的に、インビトロでの PCL /コラーゲン構築物で細分化した組織の進行を評価するために、コラーゲン/ PCL /ミンチパッチはケラチノサイト培地を用いて12ウェルプレート中で培養されます。
- ケラチノサイト培地の調製:
- 500ミリリットルのガラス瓶を滅菌します。
- (:1混合物4)ハムF12の100ミリリットルを含むDMEMの400ミリリットルを混ぜます。 10%ウシ胎児血清を補足し、5μg/ mlのインスリン、0.4 / mlのヒドロコルチゾン、21 / mlのアデニン、10 -10モル/ Lのコレラ毒素、2×10 -9モル/ Lのトリヨードチロニン、5μg/ mlのトランスフェリン、10ng / mLの上皮細胞成長因子、50 U / mlペニシリンおよび50μg/ mlストレプトマイシン。
- 0.2μmのフィルターを通して濾過して滅菌し、無菌の500ミリリットル瓶にろ液を集めます。
7.免疫組織化学
注:免疫組織化学プロトコルは、一般的に次のステップに分かれています:(1)固定し、パラフィン包埋、(2)マイクロ切片5μmの切片、スライド、脱パラフィンし、再水和上に配置するには、(3)抗原アンマスキング、染色および取り付け。免疫組織化学の手順の最後の手順を開始する前に、洗浄緩衝液および抗原脱マスキング液(別々の材料の詳細を参照してください)をご用意。使用前にABC複合体溶液に少なくとも30分を準備します。
- 固定
NOTE:in vitro培養の終わりに、次のようにパッチを修正します。- 4%緩衝ホルムアルデヒド(PFA)の1ミリリットルでエッペンドルフチューブを準備します(注意:ホルムアルデヒドは毒性があり、この化学物質を使用する前に、製品安全データシートを読んで手袋と安全メガネを着用し、ドラフト内の溶液を用意してください)。
- 4%PFAを含むエッペンドルフチューブにコラーゲンパッチのそれぞれを転送します。室温で一晩固定してください。
- 4℃での長期保存のための70%エタノールに入れサンプル。サンプルは現在、脱水のため準備ができていると切片の前にパラフィンブロックに埋め込みます。
- 水分補給
- 15分間のX-TRAのSOLVで染色ジャーにスライドを置きます。 X-TRA SOLVと新しい染色ジャーを使用して繰り返します。 10分間、無水エタノールを用いた染色ジャーにスライドを置きます。無水エタノールで新しい染色ジャーを使用して繰り返します。 95%エタノールで染色ジャーにスライド10分間、その後、配置10分間、70%エタノールで染色ジャーに。最後に蒸留水で5分間二回スライドを洗浄します。
- 抗原アンマスキング
- TE溶液でコプリンジャーにスライドを入れて、20分間沸騰する水浴中で瓶を置きます。慎重に水浴から瓶を取ります。 30分間室温にスライドを冷却し、トリス緩衝液中で5分間、二回洗浄します。 10分間、3%過酸化水素で染色ジャーにスライドを置きます。トリス緩衝液中で5分間二回スライドを洗浄します。マーキングペン撥水剤を使用して、サンプルの周りに円を描きます。
- ブロッキング溶液の100から300μLを用いて抗体の非特異的結合をブロックします。ブロッキング溶液を除去し、トリス緩衝液中の推奨濃度で溶解し、一次抗体の100から300μlを添加します。一晩インキュベートします。抗体溶液を除去し、5分間二回Tris緩衝液中でセクションを洗います。
- 部屋のtemperatで1時間、二次抗体でインキュベートURE。トリス緩衝液中で5分間二回洗浄します。 (製造元の指示に従ってください)ABCエリートキットを用いて30分間インキュベート。トリス緩衝液中で2回洗浄します。
- 製造元の指示(1-7分のインキュベーションは、一般的に明確な紫色の強度を生成)以下、ベクトルVIPキットを使用して、抗体反応を開発します。蒸留水にスライドを置きます。 30秒間マイヤーのヘマトキシリンで対比染色。
- 5分間流水で洗ってください。 1分間70%エタノールを用いた染色ジャーにスライドを置きます。 70%エタノールを使用して新しい染色ジャーを使用して繰り返します。 1分間95%エタノールで染色ジャーにスライドを置きます。 95%エタノールで新しい染色ジャーを使用して繰り返します。
- 5分間のX-TRAのSOLVで染色ジャーにスライドを置きます。しっとり保つために一度、1を削除してください。 (気泡を避けるために慎重にそう)各スライドの上に取り付け培地のドロップを置き、上にカバーガラスを置きます。スライドを一晩乾燥させますとミクロの下でスライドを見ます範囲。
結果
この研究は、コラーゲンやミンチ組織の塑性圧縮を使用して、移植のための生体材料を製造する方法を示しています方法を提示します。
膀胱粘膜や皮膚を採取した後、機械的に小さい粒子( 図3)にみじん切りすることができます。プラスチック圧縮することにより、みじん切り粒子は、コラーゲンゲル( 図4)の外側層内に機械的に強固である...
ディスカッション
この研究は、手術台での移植のための自家組織と膀胱壁のパッチを作成するための使いやすいアプローチを提示します。パッチは、プラスチック製の圧縮と組み合わせて、外面で細分化した組織とない中・コラーゲン中の生分解性ポリマー編みの組み合わせによって形成されています。プラスチックの圧縮は、以前に他の著者によって記載された方法で、コラーゲンゲル12,13からの流...
開示事項
The authors have nothing to disclose.
謝辞
The authors thank the Swedish Society for Medical Research, the Promobilia Foundation, the Crown Princess Lovisa Foundation, the Freemason Foundation for Children’s Welfare, the Swedish Society of Medicine, the Solstickan Foundation, Karolinska Institutet, and the Stockholm City Council for financial support.
資料
| Name | Company | Catalog Number | Comments |
| Silicone catheter 10-French | Preparing the animal for surgery, Section 1 | ||
| DMEM 10x | Gibco | 31885-023 | Plastic compression section 4 |
| 24 well plates | Falcon | 08-772-1 | Plastic compression section 4 |
| 3',3',5-Triiodothyronine | Sigma-Aldrich | IRMM469 | In vitro culture; Section 5 |
| 4% PFA | Labmed Solutions | 200-001-8 | Immunocytochemistry; Section 6 |
| 70% ethanol | Histolab | Immunocytochemistry; Section 6 | |
| ABC Elite kit: Biotin-Streptavidin detection kit | Vector | PK6102 | Immunocytochemistry; Section 6 |
| Absolute ethanol | Histolab | 1399.01 | Immunocytochemistry; Section 6 |
| Adenine | Sigma-Aldrich | A8626 | In vitro culture; Section 5 |
| Atropine 25 μg/kg | Temgesic, RB Pharmaceuticals, Great Britain | Preparing the animal for surgery, Section 1 | |
| Azaperone 2 mg/kg | Stresnil, Janssen-Cilag, Pharma, Austria | Preparing the animal for surgery, Section 1 | |
| Biosafety Level 2 hood | Plastic compression; Section 4 | ||
| Blocking solution: Normal serum from the same species as the secondary secondary antibody was generated in. | Vector | The blocking solution depends of the origin of first antibody | Immunocytochemistry; Section 6 |
| Buprenorphine 45 μg/kg | Atropin, Mylan Inc, Canonsburg, PA | Preparing the animal for surgery, Section 1 | |
| Carprofen 3 mg/kg | Rimadyl, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Chlorhexidine gluconate | Hibiscrub 40 mg/mL, Regent Medical, England | Preparing the animal for surgery, Section 1 | |
| Cholera toxin | Sigma-Aldrich | C8052 | In vitro culture; Section 5 |
| Coplin jar: staining jar for boiling | Histolab | 6150 | Immunocytochemistry; Section 6 |
| Stainless mold (33 mm x 22 mm x 10 mm) custom made | Plastic compression; Section 4 | ||
| DMEM | Gibco | 3188-5023 | Plastic compression section 4. Keep on ice when using it in plastic compression |
| Epidermal growth factor | Sigma-Aldrich | E9644 | In vitro culture; Section 5 |
| Ethilon (non-absorbable monofilament for skin sutures) | Ethicon | Surgery, Section 1 | |
| Fetal bovine serum (FBS) | Gibco | 10437-036 | Plastic compression section 4 |
| Forceps (Adison with tooth) | Preparing the animal for surgery, Section 1 | ||
| Gauze (Gazin Mullkompresse) | Preparing the animal for surgery, Section 1 | ||
| Ham's F12 | Gibco | 31765-027 | Plastic compression section 4 |
| Hematoxylin | Histolab | 1820 | Immunocytochemistry; Section 6 |
| Humidity chamber | DALAB | Immunocytochemistry; Section 6 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | In vitro culture; Section 5 |
| Hydrogen peroxide Solution 30% | Sigma-Aldrich | H1009 | Immunocytochemistry; Section 6 |
| Insulin | Sigma-Aldrich | I3536 | In vitro culture; Section 5 |
| Isoflurane | Isoflurane, Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Lidocaine 5 mg/ml | Xylocaine, AstraZeneca, Sweden | Preparing the animal for surgery, Section 1 | |
| Lucose 25 mg/ml | Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Marker pen pap pen | Sigma-Aldrich | Z377821-1EA | Immunocytochemistry; Section 6 |
| Medetomidine 25 μg/kg | Domitor, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Mincing device | Applied Tissue Technologies LLC | Minced tissue preparation, section 2 | |
| Monocryl (absorbable monofilament) | Ethicon | Surgery, Section 1 | |
| NaCl | Sigma-Aldrich | S7653 | Immunocytochemistry; Section 6 |
| NaOH 1 N | Merck Millipore | 106462 | Plastic compression section 4 and cell culture |
| Nylon mesh, 110 μM thick pore size 0.04 sqmm | Plastic compression; Section 4 | ||
| Oculentum simplex APL: ointment for eye protection | APL | Vnr 336164 | Surgery, Section 1 |
| PBS | Gibco | 14190-094 | Plastic compression section 4 |
| Penicillin-Streptomycin | Gibco | 15140-122 | Plastic compression section 4 |
| Phenobarbiturate 15 mg/kg | Pentobarbital, APL, Sweden | Preparing the animal for surgery, Section 1 | |
| PCL Knitted fabric | Plastic compression; Section 4 | ||
| Rat-tail collagen | First LINK, Ltd, UK | 60-30-810 | Plastic compression section 4, keep on ice |
| Scalpel blade - 15 | Preparing the animal for surgery, Section 1 | ||
| Shaving shears | Preparing the animal for surgery, Section 1 | ||
| Stainless stell mesh, 400 μM thick pore size | Plastic compression; Section 4 | ||
| Steril gloves | Preparing the animal for surgery, Section 1 | ||
| Sterile gowns | Preparing the animal for surgery, Section 1 | ||
| Sterile drapes | |||
| Sterilium | Bode Chemie HAMBURG | Preparing the animal for surgery, Section 1 | |
| Suture Thread Ethilon | Preparing the animal for surgery, Section 1 | ||
| TE-solution (antigen unmasking solution) consist of 10 mM Tris and 1 mM EDTA, pH 9.0 | 10 mM Tris/1 mM EDTA, adjust pH to 9.0 | ||
| Tiletamine hypochloride 2.5 mg/kg | Preparing the animal for surgery, Section 1 | ||
| Transferrin | Sigma-Aldrich | T8158 | In vitro culture; Section 5 |
| Trizma Base, H2NC | Sigma-Aldrich | T6066 | Immunocytochemistry; Section 6 |
| Vector VIP kit: Enzyme peroxidase substrate kit | Vector | SK4600 | Immunocytochemistry; Section 6 |
| Vicryl (absorbable braded) | Ethicon | Surgery, Section 1 | |
| Tris buffer pH 7.6 (washing buffer) | TE solution: Make 10x (0.5 M Tris, 1.5 M NaCl) by mixing: 60.6 g Tris (Trizma Base, H2NC(CH2OH)3, M=121.14 g/mol), add 800 ml distilled water adjust the pH till 7.6, add 87.7 g NaCl and fill to 1,000 ml with distilled water. Dilute to 1x with distilled water. | ||
| X-tra solv (solvent) | DALAB | 41-5213-810 | Immunocytochemistry; Section 6. Use under fume hood |
| Zolazepam hypochloride | Zoletil, Virbac, France | Preparing the animal for surgery, Section 1 | |
| Depilatory wax strips | Veet | Preparing the animal for surgery, Section 1 | |
| Pentobarbital sodium | Lundbeck | Termination, Section 3 |
参考文献
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6, 331-343 (1975).
- Fossum, M., Nordenskjold, A., Kratz, G. Engineering of multilayered urinary tissue in vitro. Tissue Engineering. 10, 175-180 (2004).
- Salmikangas, P., et al. Manufacturing, characterization and control of cell-based medicinal products: challenging paradigms toward commercial use. Regen Med. 10, 65-78 (2015).
- Fossum, M., et al. Minced skin for tissue engineering of epithelialized subcutaneous tunnels. Tissue Engineering. Part A. 15, 2085-2092 (2009).
- Fossum, M., et al. Minced urothelium to create epithelialized subcutaneous conduits. The Journal of Urology. 184, 757-761 (2010).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. L., Nordenskjold, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. BioMed Research International. 2013, 212734 (2013).
- Meek, C. P. Successful microdermagrafting using the Meek-Wall microdermatome. Am J Surg. 96, 557-558 (1958).
- Tanner, J. C., Vandeput, J., Olley, J. F. The Mesh skin graft. Plastic and Reconstructive Surgery. 34, 287-292 (1964).
- Svensjo, T., et al. Autologous skin transplantation: comparison of minced skin to other techniques. The Journal of Surgical Research. 103, 19-29 (2002).
- Ajalloueian, F., Zeiai, S., Rojas, R., Fossum, M., Hilborn, J. One-stage tissue engineering of bladder wall patches for an easy-to-use approach at the surgical table. Tissue Engineering. Part C, Methods. 19, 688-696 (2013).
- Engelhardt, E. M., et al. A collagen-poly(lactic acid-co-varepsilon-caprolactone) hybrid scaffold for bladder tissue regeneration. Biomaterials. 32, 3969-3976 (2011).
- Brown, R. A., Wiseman, M., Chuo, C. B., Cheema, U., Nazhat, S. N. Ultrarapid engineering of biomimetic materials and tissues: fabrication of nano- and microstructures by plastic compression. Adv Funct Mater. 15, 1762-1770 (2005).
- Fumagalli Romario, U., Puccetti, F., Elmore, U., Massaron, S., Rosati, R. Self-gripping mesh versus staple fixation in laparoscopic inguinal hernia repair: a prospective comparison. Surg Endosc. 27, 1798-1802 (2013).
- Muangman, P., et al. Complex Wound Management Utilizing an Artificial Dermal Matrix. Annals of Plastic Surgery. 57, 199-202 (2006).
- Ajalloueian, F., Zeiai, S., Fossum, M., Hilborn, J. G. Constructs of electrospun PLGA, compressed collagen and minced urothelium for minimally manipulated autologous bladder tissue expansion. Biomaterials. 35, 5741-5748 (2014).
- Orabi, H., AbouShwareb, T., Zhang, Y., Yoo, J. J., Atala, A. Cell-seeded tubularized scaffolds for reconstruction of long urethral defects: a preclinical study. Eur Urol. 63, 531-538 (2013).
- Blais, M., Parenteau-Bareil, R., Cadau, S., Berthod, F. Concise review: tissue-engineered skin and nerve regeneration in burn treatment. Stem Cells Transl Med. 2, 545-551 (2013).
- Serpooshan, V., Muja, N., Marelli, B., Nazhat, S. N. Fibroblast contractility and growth in plastic compressed collagen gel scaffolds with microstructures correlated with hydraulic permeability. J Biomed Mater Res A. 96, 609-620 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved