Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измельченной ткани в сжатом коллагена: Сотовый содержащих Biotransplant одноместным-ступенчатую реконструктивной Ремонт
В этой статье
Резюме
При помощи этой технологии часто включает в пробирке расширения, чтобы создать аутотрансплантатов для регенерации ткани. В этом исследовании способ расширения ткани, регенерации, и реконструкции в естественных условиях была разработана для того, чтобы свести к минимуму обработку клеток и биологических материалов вне тела.
Аннотация
Conventional techniques for cell expansion and transplantation of autologous cells for tissue engineering purposes can take place in specially equipped human cell culture facilities. These methods include isolation of cells in single cell suspension and several laborious and time-consuming events before transplantation back to the patient. Previous studies suggest that the body itself could be used as a bioreactor for cell expansion and regeneration of tissue in order to minimize ex vivo manipulations of tissues and cells before transplanting to the patient. The aim of this study was to demonstrate a method for tissue harvesting, isolation of continuous epithelium, mincing of the epithelium into small pieces and incorporating them into a three-layered biomaterial. The three-layered biomaterial then served as a delivery vehicle, to allow surgical handling, exchange of nutrition across the transplant, and a controlled degradation. The biomaterial consisted of two outer layers of collagen and a core of a mechanically stable and slowly degradable polymer. The minced epithelium was incorporated into one of the collagen layers before transplantation. By mincing the epithelial tissue into small pieces, the pieces could be spread and thereby the propagation of cells was stimulated. After the initial take of the transplants, cell expansion and reorganization would take place and extracellular matrix mature to allow ingrowth of capillaries and nerves and further maturation of the extracellular matrix. The technique minimizes ex vivo manipulations and allow cell harvesting, preparation of autograft, and transplantation to the patient as a simple one-stage intervention. In the future, tissue expansion could be initiated around a 3D mold inside the body itself, according to the specific needs of the patient. Additionally, the technique could be performed in an ordinary surgical setting without the need for sophisticated cell culturing facilities.
Введение
Большинство тканевой инженерии исследования по трансплантации кожи и мочеполового тракта включают аутологичных урожаи клеток из здоровых тканей и расширение клеток в специально оборудованных клеточных культивирования объектов 1,2.
После расширения клеток, клетки обычно сохраняется для последующего использования, когда пациент готов получить аутотрансплантата. морозильники азота позволяют длительное хранение при низких температурах -150 ° С или ниже. Процесс замораживания должен быть осторожным и контролировать, чтобы не потерять клетки. Один из рисков гибели клеток вне кристаллизация внутриклеточной воды в процессе оттаивания, которое может привести к разрыву клеточных мембран. Сотовый замораживания обычно выполняется путем медленного и регулируемого охлаждения (-1 ° С в мин), используя высокую концентрацию клеток, фетальной бычьей сыворотки и диметилсульфоксида. После оттаивания эти клетки должны быть обработаны снова удаления среды замерзания и культивирование клеток на пластике культуры или егобиоматериала перед трансплантацией обратно пациенту.
Все вышеупомянутые шаги трудоемким, трудоемким и дорогостоящим 3. Кроме того, все в пробирке обработка клеток, предназначенных для трансплантации пациенту тщательно регулируются и требует хорошо подготовленных и аккредитованных персонала и лабораторий 4. В общем, чтобы обеспечить безопасную и надежную производственный процесс, технология может быть установлена только в очень небольшом количестве технически передовых центров и более широкое использование в распространенных хирургических заболеваний сомнительна.
Для того чтобы преодолеть ограниченность культивирования клеток в лабораторных условиях, понятие пересадки измельченной ткани для расширения клеток в естественных условиях вводят с помощью самого тела как биореактор. Для этих целей, как аутографты преимущественно будут пересажены на 3D плесени в соответствии с формой, которая необходима для окончательного восстановления органа Iпроценты 5-7.
Первоначально, идея пересадки фарш эпителий был представлен Миком в 1958 году, когда он описал, как эпителий растет от краев раны. Он показал, что маленький кусочек кожи приведет к увеличению рентабельности и тем самым его потенциал для расширения клеток на 100% за счет сокращения кусок дважды в перпендикулярных направлениях (рисунок 1) 8. Эта теория была поддержана использования отверстиями частичных протезов толщина кожи для трансплантации кожи 9 и в коже ранозаживляющие модели 10.
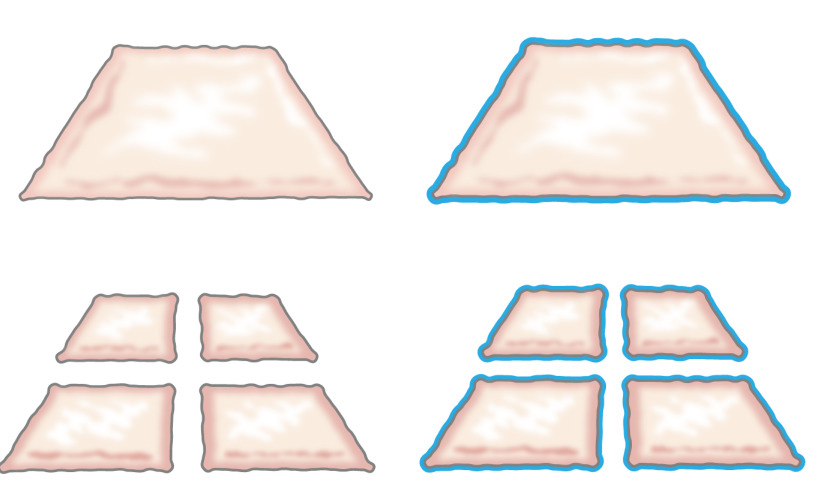
Рисунок 1:. Мик теория Согласно теории кроток, в эпителий растет от краев раны. Увеличивая площадь воздействия по технологии мясорубки, измельченной ткани epithelializes раны от многих местах.
Настоящее исследование основано на гипо-тезис, что тот же принцип может быть применен к подкожной клетчатке, помещая измельченный эпителий вокруг формы. Эпителиальные клетки мобилизует из рубленого трансплантатов (реорганизовать), охватывают участки раневые (миграцию) и деления (развернуть) для того, чтобы сформировать непрерывную neoepithelium который покрывает область раны и отделяет постороннее тело (пресс-формы) с внутренним корпусом ( Рисунок 2).
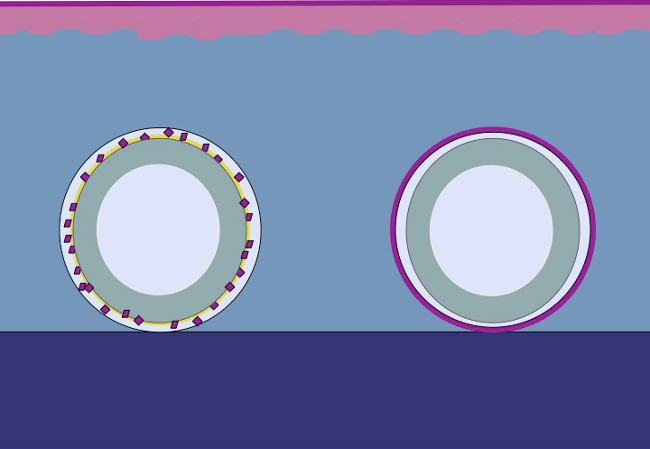
Рисунок 2:. Мультфильм 3D формы с рубленым эпителия для расширения в естественных интракорпоральной ткани в соответствии с теорией Меек При использовании измельченной ткани, размещенный на форме и затем пересаживают в подкожной клетчатке, гипотеза о том, что эпителиальные клетки мигрируют из края фарша ткани, реорганизовать и расширить таким образом, чтобы образовывать непрерывную neoepithelium который покрывает область раны и отделяет постороннее тело (пресс-формы) с внутренним корпусом.
Хотя предыдущие исследования в естественных условиях показывают многообещающие результаты, дальнейшие улучшения могут быть достигнуты путем укрепления аутотрансплантатов, так что регенерированный эпителий может выдерживать механическую травму лучше 7. Для этих целей, были определены важные предпосылки для успешного биоматериала, такие как: легкий диффузии питательных веществ и отходов, возможность плесени в 3D образом и легкости хирургического обработки. Выводы были сделаны, что эти потребности могут быть удовлетворены путем добавления композитный биоматериал для фарша ткани.
Данное исследование направлено на развитие леску, состоящую из измельченной ткани в пластиковый сжатые коллаген, содержащий армирующий стержень биоразлагаемого материала. С помощью этих средств, жизнеспособные клетки могут мигрировать из рубленого частиц тканей и размножаются с морфологические черты, характерные для оригинальной эпителия (кожи или уротелии). Используя пластиковую сжатие, подмости был снизитьд в размере от 1 см до примерно 420 мкм, как из рубленого частиц были помещены в коллагене верхнего уровня. Ядро ткани может быть любой полимер, но должна быть изменена с гидрофильной поверхностью, с тем чтобы соединяются друг с другом с покрывающими коллагеновых слоев 11.
Способ обеспечил повышенную целостность эшафот путем включения вязаную сетку, состоящую из поли (-капролактон) (PCL) в течение двух пластиковых сжатый коллагеновых гелей с использованием его в качестве каркаса для культивирования фарш слизистая оболочка мочевого пузыря или фарш кожу от свиней. Конструкция поддерживалась в условиях культуры клеток до 6 недель в пробирке, демонстрируя успешное формирование слоистой, многослойной уротелии или плоского эпителия кожи на верхней части сплоченный гибридной конструкции. Конструкт был прост в обращении и может быть зашивается в месте для целей дополнения пузыря или покрытия дефектов кожи. Все части эшафот тканевой FDA одобрен и техникаможет быть использован для процедур одноступенчатых путем сбора ткани, мясорубки, пластической сжатия, и трансплантировать обратно пациенту в виде одной-ступенчатую вмешательства. Процедура может быть выполнена для расширения тканей и реконструкции в стерильных условиях в любом общем блоке хирургии.
протокол
Все протоколы животных были предварительно одобрены графства комитета Стокгольме животных и все процедуры соответствовали нормативам по использованию животных, а также соответствующими федеральными законами.
1. Процедуры животных
- Подготовка животных для хирургии
- Подготовьте операционный стол со всеми материалами и инструментами, необходимыми для работы в стерильных условиях. Выполните операцию исключительно в стерильных условиях, чтобы снизить риск инфекции и оптимизировать условия в хирургии выживания.
- Быстрое животное в течение 12 ч до операции и измерить свой вес. Администрирование внутримышечную инъекцию azaperone (2 мг / кг) в течение премедикации. Обезболить животное с внутримышечных инъекций tiletamine гипохлорида (2,5 мг / кг), zolazepam гипохлорида (2,5 мг / кг), медетомидин (25 мкг / кг) и атропин (25 мкг / кг).
- Вводят phenobarbiturate (15 мг / кг) до endotracheаль интубации и продолжить общий наркоз с 0,8% -2% изофлуран. Вставьте периферийную катетер вены в одно ухо и влить глюкозу (25 мг / мл) внутривенно во время процедуры для поддержания благосостояния животного.
- Поместите устройства на уху или хвоста контроля для проверки температуры, артериального давления, насыщенности и периферическую пульс. анестезия управления болью стимуляции ушах или копыт. Применять мазь для глаз, чтобы предотвратить сухость под наркозом.
- Удаление мочевого биопсии
- Катетеризировать мочевой пузырь с использованием 10-французский силиконовый катетер с помощью введения расширитель для просмотра уретры и вставить катетер через уретру и в мочевой пузырь, чтобы опорожнить мочу под полу-стерильных условиях. Заполните пузырь с стерильным физиологическим раствором до давления 20-25 см H 2 O, примерно 100-300 мл, а затем пустой до 20 см Н2О (прибл. 8 мл / кг массы тела).
- С гое свиньи тщательно повернулся к боковой позиции, выполнить основную предоперационной стерилизацию кожи с применением хлоргексидина глюконата. Нанесите диатермия пластину к плечу после удаления шерсть с бритвенными ножниц.
- Включите свинью тщательно в положении лежа на спине и снять брюшной волосяной покров с использованием бритья ножницы и сделать основной предоперационной стерилизацию кожи живота с применением хлоргексидина глюконата.
- Встраивание конечностей с мягкой одежды, чтобы свести к минимуму риск повреждения гиперэкстензии суставов в конечностях. Стерилизовать кожу с брюшка животного с последовательным применением глюконата хлоргексидина и поместите стерильный драпировке вокруг операционного поля.
- До кожного разреза, применяются внутривенные анальгетик, состоящую из бупренорфина (45 мкг / кг), Carprofen (3 мг / кг) и местной инъекции лидокаина в средней линии ниже пупка. Проверьте болевой реакции, взявшись за SKв щипцами. Сделать более низкую срединный разрез через фасции и брюшины с помощью диатермии для остановки кровотечений. Локализация в мочевой пузырь, который имеет полностью внутрибрюшинную положение в свинью и может быть свободно предоставляемый мобилизации его через операционную рану.
- Возьмитесь мочевого пузыря с помощью пинцета и измерить его стерилизованной рулетка и пометить биопсии эллиптической формы около 2 см в продольном направлении и 1 см в поперечном направлении, или меньше, используя стерилизованный ручку (свинья терпит сокращение четверти размера пузыря очень хорошо). Вырежьте отмеченную область, используя скальпель, и поместите биопсии мочевого пузыря в DMEM в стерильных условиях.
- Выполните аутотрансплантации с biotransplant или закрыть мочевой пузырь путем наложения швов его 5-0 Викрил в два слоя. Закройте брюшной фасции осторожно 2-0 или 3-0 работает викрил. Закройте подкожного с 3-0 Викрил и кожу 3-0 Ethilon. Поместите повязку на рану и осторожно накак правило, животного, пока она не придет в себя достаточно от наркоза и не выражает боль.
- Перемещение животное объекте по уходу за животными, чтобы обеспечить условия для послеоперационного ухода. Положите животное в одном клетке с нагревательным лампы и посещать животному до полного восстановления от наркоза, а затем пусть животные застопорился в парах.
- Обеспечить беспрецедентный восстановление отношении боли и благополучия и администрировать бупренорфин (45 мкг / кг) внутримышечно для послеоперационного обезболивания и trimetoprim (4 мг / кг) и сульфонамида (20 мг / кг) два раза в день в течение трех дней и один раз в день в течение пяти дней чтобы снизить риск послеоперационных инфекций.
- Удаление кожи биопсии
- Подготовьте операционный стол со всеми необходимыми материалами. Обезболить животное, как описано выше в пункте 1.1. Снимите шерсть с помощью воска, мыть и стерилизовать области разреза бетадин и 70% -ным спиртом, а затем поместить стерильный драпировки arounD области разреза.
- Используйте дерматома собрать биопсии кожи частичная толщиной 0,3 мм. Поместите образец кожи в DMEM, прежде мясорубки, как описано в пункте 2.2. Обложка области раны с жирной мази и повязки.
2. Фарш Подготовка ткани
- Мочевой пузырь Слизистая
- Промыть биопсию мочевого пузыря в два раза в DMEM. Поместите биопсии мочевого пузыря на стерилизованной рассекает пластины со слизистой оболочкой вверх и зафиксировать одну из сторон к плите с помощью рассечение булавки.
- Отделить ткани слизистой от детрузора с использованием тонких ножниц и щипцов (Рисунок 3) и держать слизистую влажной путем капает физиологический раствор или DMEM над ним.
- Используйте устройство мясорубки, поместив его на слизистую оболочку, а затем передать устройство одного конца до другого по вертикали и горизонтали, применяя ручной давление, чтобы получить кусочки фарша ткани 0,8 мм х 0,8 мм (0,8 мм расстояние между rotatinг режущие лезвия).
- кожа
- Если biopsis кожи толщиной: поместите кожу помещается в стерильный рассекает пластины и использовать хирургические ножницы, чтобы отделить эпидермис от подкожного жира и дермы. Эпидермис тонкий и полупрозрачный (ок. 0,3 мм), когда он готов к мясорубки.
- Используйте мясорубки устройство, поместив его на эпидермис. С давлением, проходить устройство от одного конца до другого по вертикали и горизонтали, чтобы получить кусочки фарша ткани 0,8 мм х 0,8 мм.
3. Подготовка пластических сжатых PCL / Коллаген аутотрансплантатов
- Поместите все ингредиенты на льду держать холод. Посуда, необходимые: трубки сокола, 10x DMEM, 1x DMEM, 1 N NaOH и крысиный хвост коллагена типа 1.
- Смешайте 2 мл 10х DMEM (осторожно, чтобы избежать пузырей) с 12 мл коллагена типа 1. Добавьте 1 N NaOH, капля за каплей, чтобы принести рН до 7.4-8 (цвета в среде следует указать рН путем перехода от интенсивной желтый к контактук). Кроме того, использование рН полоску.
- Осторожно добавьте 2 мл 1x DMEM и перемешать раствор. Пластина примерно 2 мл коллагена в каждую лунку стального прямоугольного формы (20x30x10 мм) и инкубируют при 37 ° C в 5% CO 2 в течение 10 мин.
Примечание: Концентрация коллагена должно быть 2,06 мг / мл в 0,6% -ной уксусной кислотой и количество коллагена 1 мл / см 2. - После того, как коллаген устанавливает в форму, поставить биоматериал (PCL) на верхней части коллагеновый гель (20 мм х 30 мм) и залить оставшейся коллаген (около 6 мл) поверх него. Инкубировать при 37 ° С в 5% CO 2 в течение 20 мин.
- Поместите фарш ткани (за 1: 6 расширение) на верхней части коллагеновым гелем. Нажмите воду из конструкции механической силы с использованием пластиковой сжатие следующим образом (Рисунки 3 и 4).
- Поместите толстый слой марли колодки на стерильной поверхности. Поместите один сетка из нержавеющей стали (400 мкм) на верхней части gauzе колодки и затем лист нейлоновую сетку (110 мкм толщиной). Тщательно передачи коллаген гель / фарш ткани на нейлоновую сетку и осторожно удалите прямоугольный стальной формы.
- Поместите новый слой нейлоновую сетку на верхней части коллагена гель / фарша ткани. Поместите вторую металлическая сетка на верхней части нейлоновую сетку. Поместите в положении давлений или загрузки пластины весом минимум 120 г (т.е. стеклянной пластины) в течение 5 мин.
- Удалите вес, нейлоновые и стальные сетки. В аутографты теперь готовы быть пришит к свиньи пузыря в полную толщину кожных ран или культивировали в пробирке.
- Для культивирования в пробирке, разрезать тонкую конструкцию на мелкие кусочки, установленных 12-луночных планшетах. Добавьте 1 мл кератиноцитов среды. Место пластин в инкубаторе при 37 ° С, 5% СО 2 и культуры до 6 недель и изменения носителя 3 раза в неделю.
4. Шов аутотрансплантатов
- Шов из аутотрансплантата сфарш слизистой оболочки мочевого пузыря, чтобы свиньи пузыря
- Держите аутотрансплантатом влажный в DMEM в течение времени ожидания. Шовный аутотрансплантата с мелкими пробег мононити швов. Используйте нерассасывающегося 5-0 Ethilon для исследовательских целей.
- Проверьте водонепроницаемыми путем заполнения мочевого пузыря физиологическим раствором через рентгеноконтрастных мочевого катетера. Если это возможно, покрывают аутотрансплантата со слоем большого сальника. Закройте брюшной стенки, подкожную клетчатку и кожу, как описано в 1.2.6. Применить для перевязки ран.
- Шов из аутотрансплантата с мясным эпидермиса кожи до полного толщины рану
- Держите аутотрансплантатом влажный в DMEM в течение времени ожидания.
- Шовный аутотрансплантата к нижней части кожи на полную толщину раневой по узловыми швами по углам и в середине аутотрансплантата держать аутотрансплантата тесно прикрепленный к подстилающей поверхности.
- Накройте рану пластиковой повязки, которая держит рана влажная.
5. прекращение
- Седативный животное с внутримышечной инъекцией zolazepam гипохлорида (2,5 мг / кг) и медетомидина (25 мкг / кг) до прекращения и применять контрольные устройства к уху или хвоста для проверки пульса и артериального давления.
- Эвтаназии животное путем введения смертельной дозы пентобарбитала натрия (60-140 мг / кг) внутривенно. Проверьте пульс и артериальное давление, пока смерть не произошло.
6. In Vitro Культура
Примечание: Чтобы оценить гистологически прогрессирование фарша ткани в PCL / коллагеновых конструктов в пробирке, коллагеновые / PCL / фарш пластыри культивируют в 12-луночных планшетах с использованием кератиноцитов среды.
- Получение кератиноцитов среды:
- Стерилизовать стеклянную бутылку емкостью 500 мл.
- Смешайте 400 мл DMEM с 100 мл F12 Хэма (смесь 4: 1). Дополнение с 10% фетальной телячьей сыворотки, 5 мкг / мл инсулина,0,4 мкг / мл гидрокортизона, 21 мкг / мл аденина, 10 -10 моль / л холерный токсин, 2 х 10 -9 моль / л трийодтиронин, 5 мкг / мл трансферрина, 10 нг / мл эпидермального фактора роста, 50 ед / мл пенициллина и 50 мкг / мл стрептомицина.
- Стерилизовать фильтрованием через фильтр с размером пор 0,2 мкм и собирать фильтрат в стерильный 500 мл флакон.
7. Иммуногистохимия
Примечание: Протокол иммуногистохимии, как правило, делится на следующие этапы: (1) фиксация и парафин, (2) микро-секционирования до 5 мкм ломтиками, размещения на слайдах, депарафинизации и повторной гидратации, (3) антиген разоблачения, окрашивания и монтажа , Перед началом последние шаги в процедуре иммуногистохимии, подготовить стиральные буферов и разоблачающий раствора антигена (см отдельные детали материала). Подготовьте комплексное решение ABC, по крайней мере за 30 минут до использования.
- фиксация
НЕТТЕ: В конце культуре в пробирке, устранить пятна следующим образом:- Подготовьте пробирки Эппендорф 1 мл 4% буферном растворе формальдегида (PFA) (Внимание:. Формальдегид токсичен ознакомьтесь паспорт по технике, прежде чем работать с этим химикатом Надевайте перчатки и защитные очки и приготовления раствора внутри вытяжного шкафа.).
- Передача каждого из коллагеновых пластырей в пробирку Эппендорф, содержащего 4% PFA. Устранить в течение ночи при комнатной температуре.
- Место образцы в 70% этаноле в течение длительного хранения при температуре 4 ° С. Образцы теперь готовы для обезвоживания и вложение в парафиновые блоки, прежде чем секционирования.
- Регидратация
- Поместите слайды в окрашивания банку с X-TRA SOLV в течение 15 мин. Повторите с помощью нового окрашивания банку с X-тра SOLV. Поместите слайды в окрашивания банку с абсолютным этанолом в течение 10 мин. Повторите с помощью нового окрашивания банку с абсолютным этанолом. Поместите слайды в окрашивания банку с 95% -ным этанолом в течение 10 мин, а после этогов сосуд для окрашивания с 70% этанола в течение 10 мин. Наконец мыть слайды дважды в течение 5 мин с дистиллированной водой.
- Антиген Разоблачение
- Поместите слайды в баночке Коплин с ТЕ-растворе и положить банку в водяной бане до кипения в течение 20 мин. Возьмем баночку из водяной бане тщательно. Охладить слайды до комнатной температуры в течение 30 мин и мыть дважды в течение 5 мин в буфере Трис. Поместите слайды в окрашивания банку с 3% -ной перекиси водорода в течение 10 мин. Промыть слайды дважды в течение 5 мин в буфере Трис. Нарисуйте круг вокруг образцов с использованием водоотталкивающими маркером.
- Блок неспецифическое связывание антитела с использованием 100-300 мкл блокирующего раствора. Удалите блокирующий раствор и добавьте 100-300 мкл первичного антитела, растворенного в рекомендуемой концентрации в Трис-буфере. Выдержите в течение ночи. Удалить раствор антител и мыть секций в трис-буфере в два раза в течение 5 мин.
- Инкубируйте с вторичными антителами в течение 1 ч при комнатной TEMPERATЮр. Промыть два раза в течение 5 мин в буфере Трис. Выдержите 30 минут с использованием набора ABC Elite (следовать инструкциям производителя). Промыть два раза в Трис-буфере.
- Разработка антитела реакцию с помощью VIP Kit вектор, следуя инструкциям производителя (1-7 мин инкубации обычно производит четкое интенсивность фиолетового). Поместите слайды в дистиллированной воде. Контрастное гематоксилином Майера в течение 30 сек.
- Промыть в проточной воде в течение 5 мин. Поместите слайды в окрашивания банку с 70% этанола в течение 1 мин. Повторите с помощью нового окрашивания банку с 70% этанола. Поместите слайды в окрашивания банку с 95% этанола в течение 1 мин. Повторите с помощью нового окрашивания банку с 95% этанола.
- Поместите слайды в окрашивания банку с X-TRA SOLV в течение 5 мин. Удалить, по одному за раз, чтобы сохранить влажный. Поместите каплю монтажа среды на верхней части каждого слайда и положить покровное стекло сверху (сделать это осторожно, чтобы избежать воздушных пузырей). Пусть слайды высохнуть в течение ночи и просматривать слайды под микрообъем.
Результаты
Это исследование представляет собой метод, который показывает, как производить биоматериал для трансплантации с использованием пластиковой сжатие коллагена и измельченной ткани.
Слизистой оболочки мочевого пузыря и кожи могут быть собраны, а затем механически измель...
Обсуждение
Это исследование представляет собой простой в использовании подход к производству стенки мочевого пузыря пластырей с аутологичной ткани для трансплантации в хирургическом столе. Пластыри образованы комбинацией биоразлагаемого полимера вязания в середине и коллагена с и без фарша т...
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The authors thank the Swedish Society for Medical Research, the Promobilia Foundation, the Crown Princess Lovisa Foundation, the Freemason Foundation for Children’s Welfare, the Swedish Society of Medicine, the Solstickan Foundation, Karolinska Institutet, and the Stockholm City Council for financial support.
Материалы
| Name | Company | Catalog Number | Comments |
| Silicone catheter 10-French | Preparing the animal for surgery, Section 1 | ||
| DMEM 10x | Gibco | 31885-023 | Plastic compression section 4 |
| 24 well plates | Falcon | 08-772-1 | Plastic compression section 4 |
| 3',3',5-Triiodothyronine | Sigma-Aldrich | IRMM469 | In vitro culture; Section 5 |
| 4% PFA | Labmed Solutions | 200-001-8 | Immunocytochemistry; Section 6 |
| 70% ethanol | Histolab | Immunocytochemistry; Section 6 | |
| ABC Elite kit: Biotin-Streptavidin detection kit | Vector | PK6102 | Immunocytochemistry; Section 6 |
| Absolute ethanol | Histolab | 1399.01 | Immunocytochemistry; Section 6 |
| Adenine | Sigma-Aldrich | A8626 | In vitro culture; Section 5 |
| Atropine 25 μg/kg | Temgesic, RB Pharmaceuticals, Great Britain | Preparing the animal for surgery, Section 1 | |
| Azaperone 2 mg/kg | Stresnil, Janssen-Cilag, Pharma, Austria | Preparing the animal for surgery, Section 1 | |
| Biosafety Level 2 hood | Plastic compression; Section 4 | ||
| Blocking solution: Normal serum from the same species as the secondary secondary antibody was generated in. | Vector | The blocking solution depends of the origin of first antibody | Immunocytochemistry; Section 6 |
| Buprenorphine 45 μg/kg | Atropin, Mylan Inc, Canonsburg, PA | Preparing the animal for surgery, Section 1 | |
| Carprofen 3 mg/kg | Rimadyl, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Chlorhexidine gluconate | Hibiscrub 40 mg/mL, Regent Medical, England | Preparing the animal for surgery, Section 1 | |
| Cholera toxin | Sigma-Aldrich | C8052 | In vitro culture; Section 5 |
| Coplin jar: staining jar for boiling | Histolab | 6150 | Immunocytochemistry; Section 6 |
| Stainless mold (33 mm x 22 mm x 10 mm) custom made | Plastic compression; Section 4 | ||
| DMEM | Gibco | 3188-5023 | Plastic compression section 4. Keep on ice when using it in plastic compression |
| Epidermal growth factor | Sigma-Aldrich | E9644 | In vitro culture; Section 5 |
| Ethilon (non-absorbable monofilament for skin sutures) | Ethicon | Surgery, Section 1 | |
| Fetal bovine serum (FBS) | Gibco | 10437-036 | Plastic compression section 4 |
| Forceps (Adison with tooth) | Preparing the animal for surgery, Section 1 | ||
| Gauze (Gazin Mullkompresse) | Preparing the animal for surgery, Section 1 | ||
| Ham's F12 | Gibco | 31765-027 | Plastic compression section 4 |
| Hematoxylin | Histolab | 1820 | Immunocytochemistry; Section 6 |
| Humidity chamber | DALAB | Immunocytochemistry; Section 6 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | In vitro culture; Section 5 |
| Hydrogen peroxide Solution 30% | Sigma-Aldrich | H1009 | Immunocytochemistry; Section 6 |
| Insulin | Sigma-Aldrich | I3536 | In vitro culture; Section 5 |
| Isoflurane | Isoflurane, Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Lidocaine 5 mg/ml | Xylocaine, AstraZeneca, Sweden | Preparing the animal for surgery, Section 1 | |
| Lucose 25 mg/ml | Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Marker pen pap pen | Sigma-Aldrich | Z377821-1EA | Immunocytochemistry; Section 6 |
| Medetomidine 25 μg/kg | Domitor, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Mincing device | Applied Tissue Technologies LLC | Minced tissue preparation, section 2 | |
| Monocryl (absorbable monofilament) | Ethicon | Surgery, Section 1 | |
| NaCl | Sigma-Aldrich | S7653 | Immunocytochemistry; Section 6 |
| NaOH 1 N | Merck Millipore | 106462 | Plastic compression section 4 and cell culture |
| Nylon mesh, 110 μM thick pore size 0.04 sqmm | Plastic compression; Section 4 | ||
| Oculentum simplex APL: ointment for eye protection | APL | Vnr 336164 | Surgery, Section 1 |
| PBS | Gibco | 14190-094 | Plastic compression section 4 |
| Penicillin-Streptomycin | Gibco | 15140-122 | Plastic compression section 4 |
| Phenobarbiturate 15 mg/kg | Pentobarbital, APL, Sweden | Preparing the animal for surgery, Section 1 | |
| PCL Knitted fabric | Plastic compression; Section 4 | ||
| Rat-tail collagen | First LINK, Ltd, UK | 60-30-810 | Plastic compression section 4, keep on ice |
| Scalpel blade - 15 | Preparing the animal for surgery, Section 1 | ||
| Shaving shears | Preparing the animal for surgery, Section 1 | ||
| Stainless stell mesh, 400 μM thick pore size | Plastic compression; Section 4 | ||
| Steril gloves | Preparing the animal for surgery, Section 1 | ||
| Sterile gowns | Preparing the animal for surgery, Section 1 | ||
| Sterile drapes | |||
| Sterilium | Bode Chemie HAMBURG | Preparing the animal for surgery, Section 1 | |
| Suture Thread Ethilon | Preparing the animal for surgery, Section 1 | ||
| TE-solution (antigen unmasking solution) consist of 10 mM Tris and 1 mM EDTA, pH 9.0 | 10 mM Tris/1 mM EDTA, adjust pH to 9.0 | ||
| Tiletamine hypochloride 2.5 mg/kg | Preparing the animal for surgery, Section 1 | ||
| Transferrin | Sigma-Aldrich | T8158 | In vitro culture; Section 5 |
| Trizma Base, H2NC | Sigma-Aldrich | T6066 | Immunocytochemistry; Section 6 |
| Vector VIP kit: Enzyme peroxidase substrate kit | Vector | SK4600 | Immunocytochemistry; Section 6 |
| Vicryl (absorbable braded) | Ethicon | Surgery, Section 1 | |
| Tris buffer pH 7.6 (washing buffer) | TE solution: Make 10x (0.5 M Tris, 1.5 M NaCl) by mixing: 60.6 g Tris (Trizma Base, H2NC(CH2OH)3, M=121.14 g/mol), add 800 ml distilled water adjust the pH till 7.6, add 87.7 g NaCl and fill to 1,000 ml with distilled water. Dilute to 1x with distilled water. | ||
| X-tra solv (solvent) | DALAB | 41-5213-810 | Immunocytochemistry; Section 6. Use under fume hood |
| Zolazepam hypochloride | Zoletil, Virbac, France | Preparing the animal for surgery, Section 1 | |
| Depilatory wax strips | Veet | Preparing the animal for surgery, Section 1 | |
| Pentobarbital sodium | Lundbeck | Termination, Section 3 |
Ссылки
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6, 331-343 (1975).
- Fossum, M., Nordenskjold, A., Kratz, G. Engineering of multilayered urinary tissue in vitro. Tissue Engineering. 10, 175-180 (2004).
- Salmikangas, P., et al. Manufacturing, characterization and control of cell-based medicinal products: challenging paradigms toward commercial use. Regen Med. 10, 65-78 (2015).
- Fossum, M., et al. Minced skin for tissue engineering of epithelialized subcutaneous tunnels. Tissue Engineering. Part A. 15, 2085-2092 (2009).
- Fossum, M., et al. Minced urothelium to create epithelialized subcutaneous conduits. The Journal of Urology. 184, 757-761 (2010).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. L., Nordenskjold, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. BioMed Research International. 2013, 212734 (2013).
- Meek, C. P. Successful microdermagrafting using the Meek-Wall microdermatome. Am J Surg. 96, 557-558 (1958).
- Tanner, J. C., Vandeput, J., Olley, J. F. The Mesh skin graft. Plastic and Reconstructive Surgery. 34, 287-292 (1964).
- Svensjo, T., et al. Autologous skin transplantation: comparison of minced skin to other techniques. The Journal of Surgical Research. 103, 19-29 (2002).
- Ajalloueian, F., Zeiai, S., Rojas, R., Fossum, M., Hilborn, J. One-stage tissue engineering of bladder wall patches for an easy-to-use approach at the surgical table. Tissue Engineering. Part C, Methods. 19, 688-696 (2013).
- Engelhardt, E. M., et al. A collagen-poly(lactic acid-co-varepsilon-caprolactone) hybrid scaffold for bladder tissue regeneration. Biomaterials. 32, 3969-3976 (2011).
- Brown, R. A., Wiseman, M., Chuo, C. B., Cheema, U., Nazhat, S. N. Ultrarapid engineering of biomimetic materials and tissues: fabrication of nano- and microstructures by plastic compression. Adv Funct Mater. 15, 1762-1770 (2005).
- Fumagalli Romario, U., Puccetti, F., Elmore, U., Massaron, S., Rosati, R. Self-gripping mesh versus staple fixation in laparoscopic inguinal hernia repair: a prospective comparison. Surg Endosc. 27, 1798-1802 (2013).
- Muangman, P., et al. Complex Wound Management Utilizing an Artificial Dermal Matrix. Annals of Plastic Surgery. 57, 199-202 (2006).
- Ajalloueian, F., Zeiai, S., Fossum, M., Hilborn, J. G. Constructs of electrospun PLGA, compressed collagen and minced urothelium for minimally manipulated autologous bladder tissue expansion. Biomaterials. 35, 5741-5748 (2014).
- Orabi, H., AbouShwareb, T., Zhang, Y., Yoo, J. J., Atala, A. Cell-seeded tubularized scaffolds for reconstruction of long urethral defects: a preclinical study. Eur Urol. 63, 531-538 (2013).
- Blais, M., Parenteau-Bareil, R., Cadau, S., Berthod, F. Concise review: tissue-engineered skin and nerve regeneration in burn treatment. Stem Cells Transl Med. 2, 545-551 (2013).
- Serpooshan, V., Muja, N., Marelli, B., Nazhat, S. N. Fibroblast contractility and growth in plastic compressed collagen gel scaffolds with microstructures correlated with hydraulic permeability. J Biomed Mater Res A. 96, 609-620 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены