Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zerkleinerte Gewebe in komprimierter Collagen: Ein zellhaltigen Biotransplant für einstufige rekonstruktive Reparatur
In diesem Artikel
Zusammenfassung
Tissue Engineering umfasst oft in vitro-Expansion um Autotransplantate für die Geweberegeneration zu erstellen. In dieser Studie wurde ein Verfahren zur Gewebeexpansion, Regeneration, Rekonstruktion und in vivo wurde entwickelt, um die Verarbeitung von Zellen und biologischen Materialien außerhalb des Körpers zu minimieren.
Zusammenfassung
Conventional techniques for cell expansion and transplantation of autologous cells for tissue engineering purposes can take place in specially equipped human cell culture facilities. These methods include isolation of cells in single cell suspension and several laborious and time-consuming events before transplantation back to the patient. Previous studies suggest that the body itself could be used as a bioreactor for cell expansion and regeneration of tissue in order to minimize ex vivo manipulations of tissues and cells before transplanting to the patient. The aim of this study was to demonstrate a method for tissue harvesting, isolation of continuous epithelium, mincing of the epithelium into small pieces and incorporating them into a three-layered biomaterial. The three-layered biomaterial then served as a delivery vehicle, to allow surgical handling, exchange of nutrition across the transplant, and a controlled degradation. The biomaterial consisted of two outer layers of collagen and a core of a mechanically stable and slowly degradable polymer. The minced epithelium was incorporated into one of the collagen layers before transplantation. By mincing the epithelial tissue into small pieces, the pieces could be spread and thereby the propagation of cells was stimulated. After the initial take of the transplants, cell expansion and reorganization would take place and extracellular matrix mature to allow ingrowth of capillaries and nerves and further maturation of the extracellular matrix. The technique minimizes ex vivo manipulations and allow cell harvesting, preparation of autograft, and transplantation to the patient as a simple one-stage intervention. In the future, tissue expansion could be initiated around a 3D mold inside the body itself, according to the specific needs of the patient. Additionally, the technique could be performed in an ordinary surgical setting without the need for sophisticated cell culturing facilities.
Einleitung
Die meisten Tissue Engineering Studien über Transplantation auf die Haut und Urogenitaltrakt umfassen autologe Zell Ernten von gesundem Gewebe und Zellexpansion in speziell ausgestatteten Zellkultivieranlagen 1,2.
Nach Zellexpansion werden die Zellen in der Regel für die spätere Verwendung gespeichert, wenn der Patient wird nach dem Autotransplantat zu erhalten. Stickstoffgefriergeräte erlauben die langfristige Lagerung bei niedrigen Temperaturen von -150 ° C oder niedriger. Der Prozess des Einfrierens muss, um vorsichtig und kontrolliert werden die Zellen nicht zu verlieren. Ein Risiko von Zelltod ist die Kristallisation des intrazellulären Wassers während des Auftauens Verfahren, die zum Bruch der Zellmembranen führen kann. Zelle Einfrieren wird üblicherweise durch langsame und kontrollierte Kühlung (-1 ° C pro min) unter Verwendung einer hohen Konzentration an Zellen, fötales Rinderserum und Dimethylsulfoxid durchgeführt. Nach dem Auftauen müssen die Zellen erneut verarbeitet werden, indem das Einfriermedium entfernt und das Kultivieren auf Zellkultur-Kunststoff oder einemBiomaterial vor der Transplantation zurück zum Patienten.
All die oben genannten Schritte sind zeitaufwendig, mühsam und teuer 3. Darüber hinaus sind alle in vitro-Verarbeitung von Zellen für Patienten Transplantation bestimmte sind hoch reguliert und erfordert gut ausgebildete und akkreditierte Personal und Labors 4. Alles in allem eine sichere und zuverlässige Fertigungsprozess zu beschaffen, könnte die Technik nur in einer sehr kleinen Zahl von technisch fortschrittlichen Zentren und eine breitere Nutzung gemeinsam chirurgischen Erkrankungen festgestellt werden, ist zweifelhaft.
Um die Grenzen der Zellkultivierung in der Laborumgebung zu überwinden, das Konzept der zerkleinerte Gewebe für Zellexpansion Transplantation in vivo wird unter Verwendung der Körper selbst als Bioreaktor eingeführt. Zu diesem Zweck würde die Autotransplantate vorzugsweise auf einem 3D-Form transplantiert werden entsprechend der Form, die für die endgültige Rekonstruktion der Organ i benötigt wird,nterest 5-7.
Ursprünglich wurde 1958 von Meek präsentierte die Idee gehackt Epithel der Transplantation, als er beschrieb, wie Epithel von den Rändern der Wunde wächst. Er zeigte, dass ein kleines Stück Haut ihre Margen erhöhen und damit ihr Potenzial für die Zellexpansion von 100% durch das Stück zweimal in senkrechten Richtungen Schneiden (Abbildung 1) 8. Die Theorie wurde durch die Verwendung von vermaschten Teilhauttransplantate für die Hauttransplantation 9 und in der Haut unterstützt gewickelt Modelle 10 zu heilen.
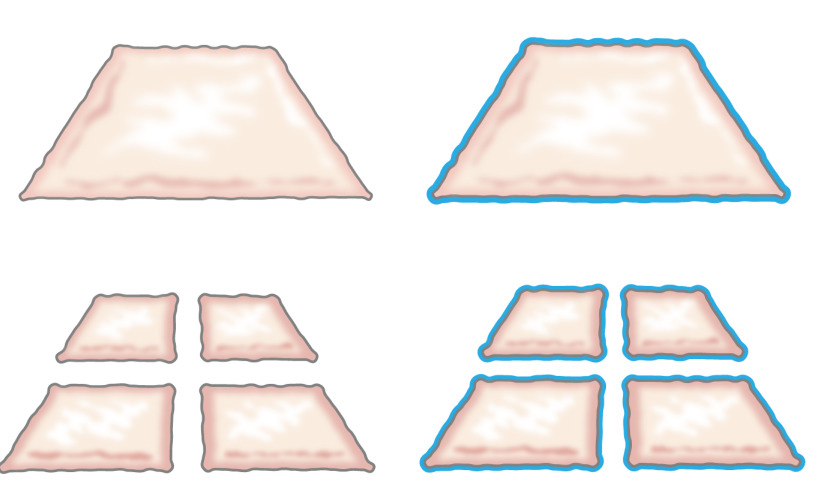
Abb. 1: Meek Theorie, nach Meek Theorie wächst Epithel von den Kanten einer Wunde. Durch das Gebiet zu erhöhen, indem die Hacken Technik ausgesetzt, zerkleinerte Gewebe epithelializes Wunden von vielen Stellen.
Die vorliegende Studie ist auf der hypo BasisThese, dass das gleiche Prinzip, indem fein zerkleinert Epithel um eine Form zu dem subkutanen Gewebe angewendet werden kann. Die Epithelzellen würde aus gehacktem Transplantationen mobilisieren (reorganisieren) decken die Wundflächen (migrieren) und teilen (expand), um eine kontinuierliche neoepithelium zu bilden, die den Wundbereich abdeckt und trennt den Fremdkörper (die Form) von der Innenkörper ( Abbildung 2).
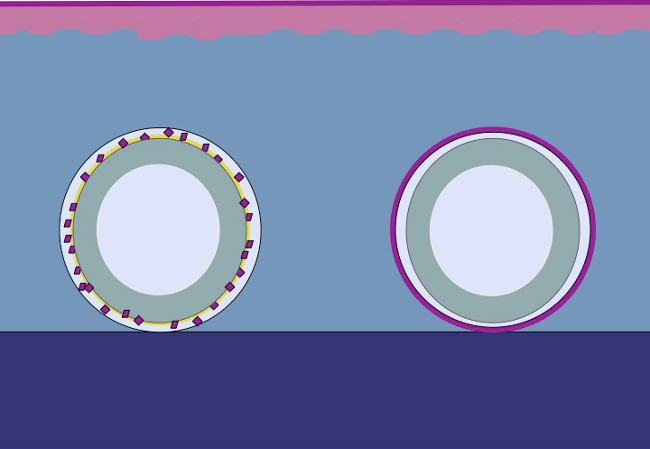
Abb. 2: Karikatur eines 3D-Form mit gehacktem Epithel für in vivo intrakorporalen Gewebeexpansion nach der Theorie von Meek von zerkleinerten Gewebes auf eine Form gebracht und anschließend auf das Unterhautgewebe transplantiert, ist die Hypothese, dass die Epithelzellen aus der Migration Kanten des Gewebes fein zerkleinert, reorganisieren und zu erweitern, um einen kontinuierlichen neoepithelium zu bilden, die den Fremdkörper (die Form) aus dem Innenkörper den Wundbereich und trennt abdeckt.
Obwohl frühere Studien in vivo viel versprechende Ergebnisse zeigen, konnte eine weitere Verbesserung, indem die Autotransplantate Verstärkung erreicht werden, so dass das regenerierte Epithel bessere mechanische Trauma 7 widerstehen konnte. einfache Diffusion von Nährstoffen und Abfallprodukten, die Möglichkeit zu Schimmel in einer 3D-Form und Einfachheit der chirurgischen Behandlung: Für diese Zwecke wurden wichtige Voraussetzungen für eine erfolgreiche Biomaterial, wie identifiziert. Schlussfolgerungen wurden gemacht, daß dieser Bedarf durch Zugabe eines zusammengesetzten Biomaterial Das zerkleinerte Gewebe erfüllt werden konnten.
Die aktuelle Studie zur Entwicklung eines Gerüsts an zerkleinertem Gewebe in Kunststoff-Druck Kollagen enthält einen Verstärkungskern aus einem biologisch abbaubaren Stoff zusammengesetzt ausgerichtet. Durch diese Mittel können lebensfähige Zellen von den zerkleinerten Gewebeteilchen migrieren und mit morphologischen charakteristischen Merkmale des Original Epithel (Haut oder Urothel) vermehren. Mit Kunststoff-Kompression, war das Gerüst reduzierend in der Größe von 1 cm bis etwa 420 & mgr; m als den zerkleinerten Teilchen wurden in der oberen Schicht Kollagen eingeschlossen. Die Kerngewebe könnte irgendein Polymer sein, muss aber mit einer hydrophilen Oberfläche, um mit der Abdeckung Kollagenschichten 11 miteinander zu verbinden modifiziert werden.
Das Verfahren vorgesehen, eine verbesserte Gerüst Integrität durch ein gestricktes Netz, bestehend aus Poly Einbeziehung (ε-caprolacton) (PCL) innerhalb von zwei Kunststoffdruck Collagengele es als Gerüst verwendet für die Kultivierung von gehackten Blasenschleimhaut oder gehackt Haut von Schweinen. Das Konstrukt wurde in Zellkulturbedingungen gehalten bis zu 6 Wochen in vitro, erfolgreiche Bildung einer geschichteten, mehrlagigen Urothel oder Plattenepithelkarzinom Hautepithel auf der Oberseite eines gut konsolidiert Hybridkonstrukt zu demonstrieren. Das Konstrukt war leicht zu handhaben und kann an Ort und Stelle für Blasenaugmentation Zwecke oder Abdeckung von Hautdefekten genäht werden. Alle Teile der Gewebegerüst sind FDA genehmigt und die Technikkönnte für einstufige Verfahren von Gewebe Ernte, Zerkleinern, Kunststoff-Komprimierung und Transplantation zurück in den Patienten als eine einstufige Eingriff eingesetzt. Das Verfahren könnte für Gewebeexpansion und des Wiederaufbaus unter sterilen Bedingungen in jeder der allgemeinen Chirurgie Einheit durchgeführt werden.
Protokoll
Alle Tierprotokolle wurden von der Stockholm Ausschusses für Tiere im Voraus genehmigt und alle Verfahren entsprach den Vorschriften für Tiernutzung, sowie die einschlägigen Bundesgesetzen.
1. Tierversuchen
- Vorbereitung der Tiere für Chirurgie
- Bereiten Sie den OP-Tisch mit allen Materialien und Instrumente für den Betrieb erforderlich unter sterilen Bedingungen. Führen Sie die Operation ausschließlich unter sterilen Bedingungen das Risiko einer Infektion zu reduzieren und die Bedingungen der Überlebensrate der Operation zu optimieren.
- Schnell das Tier für 12 Stunden vor der Operation und messen ihr Gewicht. Verwalten eine intramuskuläre Injektion von Azaperon (2 mg / kg) für Prämedikation. Betäuben das Tier mit intramuskulären Injektionen von Tiletamin Hypochlorid (2,5 mg / kg), Zolazepam Hypochlorid (2,5 mg / kg), Medetomidin (25 ug / kg) und Atropin (25 & mgr; g / kg).
- Injizieren phenobarbiturate (15 mg / kg) vor endotracheal Intubation und weiterhin eine Vollnarkose mit 0,8% bis 2% Isofluran. Legen Sie eine periphere Venenkatheter in einem Ohr und Infusion Glukose (25 mg / ml) intravenös während des Verfahrens, das Wohlbefinden des Tieres zu halten.
- Zeigen Überwachungseinrichtungen auf dem Ohr oder Schwanz zu überprüfen, Temperatur, Blutdruck, Sättigung und peripheren Puls. Steuer Betäubung von Schmerzen Stimulation der Ohren oder Hufe. Bewerben Salbe Augen Trockenheit während der Narkose zu verhindern.
- Exzision von Blasenbiopsie
- Katheterisierung der Blase 10-Französisch Silikonkatheter durch ein Spekulum Einführen der Harnröhre zu sehen und der Katheter durch die Harnröhre einsetzen und in die Harnblase, den Urin zu entleeren unter semi-sterilen Bedingungen. Füllen der Blase mit steriler Kochsalzlösung auf einen Druck von 20-25 cm H 2 O, etwa 100-300 ml und dann leer zu 20 cm H 2 O (ca.. 8 ml / kg Körpergewicht).
- Mit The Schwein gedreht vorsichtig zu einer Seitenlage, einen Grund präoperativen Sterilisation der Haut unter Anwendung von Chlorhexidingluconat zuführen. Tragen Sie eine Diathermie Platte an der Schulter nach dem Fell mit der Rasur Schere entfernen.
- Schalten Sie das Schwein vorsichtig in Rückenlage und entfernen Sie die Bauchfell mit Rasieren Schere und machen einen grundlegenden präoperativen Sterilisation der Bauchhaut mit Anwendung von Chlorhexidingluconat.
- die Extremitäten mit weichen Kleidung Einbetten das Risiko einer Überdehnung Schäden an den Gelenken der Extremitäten zu minimieren. Sterilisieren Sie die Bauchhaut des Tieres mit aufeinanderfolgenden Anwendungen von Chlorhexidingluconat und legen sterilen Abdeckung um das Operationsfeld.
- Vor Hautinzision gelten eine intravenöse Analgetikum Buprenorphin bestehend aus (45 & mgr; g / kg), Carprofen (3 mg / kg) und lokale Injektion von Lidocain in der Mittellinie unter dem Nabel. Überprüfen Sie für die Schmerzreaktion durch den sk Greifenin mit einer Pinzette. mit Diathermie zur Blutstillung machen einen niedrigeren Mittelschnitt durch die Faszie und Bauchfell. Lokalisieren der Blase, die eine vollständig intraperitoneal Position im Schwein hat und durch die Operationswunde durch Mobilisierung frei ausgesetzt werden kann.
- Fassen Sie die Blase mit der Zange und messen Sie es mit einem sterilisierten Maßband und markieren eine elliptische förmigen Biopsie etwa 2 cm in Längsrichtung und 1 cm quer, oder kleiner, eine sterilisierte Stift (das Schwein verträgt ein Viertel Reduktion der Blasengröße sehr gut). Excise den markierten Bereich, mit einem Skalpell, und legen Sie die Blase Biopsie in DMEM unter sterilen Bedingungen.
- Führen Sie Autotransplantation mit dem biotransplant oder die Blase schließen, indem es mit 5-0 Vicryl in zwei Schichten Nähen. Schließen Sie die Bauchbinde sorgfältig mit 2-0 oder 3-0 Vicryl läuft. Schließen Sie die Unterhaut mit 3-0 Vicryl und die Haut mit 3-0 Ethilon. Legen Sie einen Verband auf die Wunde und vorsichtig anfür das Tier sind in der Regel, bis sie ausreichend von der Anästhesie und nicht ausdrücken Schmerz erholt hat.
- Fahren Sie mit dem Tier in die Tierstation zu Bedingungen für die postoperative Versorgung sichern. Legen Sie das Tier in einem Käfig mit einer Wärmelampe und kümmern sich um das Tier bis zur vollständigen Erholung von der Anästhesie und dann lassen die Tiere paarweise ins Stocken geraten.
- Buprenorphin (45 ug / kg) intramuskulär zur postoperativen Analgesie und Trimethoprim (4 mg / kg) und Sulfonamid (20 mg / kg) zweimal täglich für drei Tage und einmal täglich für fünf Tage bieten eine erholte hinsichtlich Schmerz und Wohlbefinden und zu verwalten das Risiko von postoperativen Infektionen zu reduzieren.
- Exzision von Hautbiopsie
- Bereiten Sie den OP-Tisch mit allen notwendigen Materialien. Betäuben das Tier, wie zuvor in 1.1 beschrieben. Entfernen Sie das Fell mit Wachs, waschen und sterilisieren den Schnittbereich mit Betadin und 70% Alkohol und dann sterilen Abdeckung platzieren around den Schnittbereich.
- Verwenden Sie ein Dermatom ein 0,3 mm Teilhaut Biopsie zu ernten. Legen Sie die Hautprobe in DMEM vor dem Hacken, wie in 2.2 beschrieben. Bedecken Sie den Wundbereich mit Fettsalbe und einem Dressing.
2. Hackfleisch Gewebepräparation
- Blasenschleimhaut
- Waschen Sie die Blase Biopsie zweimal in DMEM. Legen Sie die Blase Biopsie auf einem sterilisierten Sezieren Platte mit der Schleimhaut nach oben und fixieren eine der Seiten auf die Platte Dissektion Stifte verwenden.
- Trennen Sie die Schleimhautgewebe aus der Detrusor mit einer feinen Schere und Pinzette (Abbildung 3) und halten die Schleimhaut feucht von Kochsalzlösung oder DMEM darüber tropft.
- Verwenden Sie die Zerkleinerungsvorrichtung, indem sie auf der Schleimhaut platziert und dann das Gerät gelangen von einem Ende zum anderen vertikal und horizontal, Aufbringen manuellen Druck zu erhalten Stücke zerkleinerte Gewebe von 0,8 mm x 0,8 mm (0,8 mm ist der Abstand zwischen dem rotating Schneidklingen).
- Haut
- Wenn die Haut Biopsie sind dick: Legen Sie die Haut auf eine sterile Sezieren Platte und chirurgische Schere verwenden, um die Epidermis von subkutanem Fett und Dermis zu trennen. Die Oberhaut ist dünn und durchscheinend (ca.. 0,3 mm), wenn sie bereit ist, zum Hacken.
- Verwenden Sie den Hacken Gerät, indem es auf die Epidermis platzieren. Mit Druck, übergeben Sie das Gerät von einem Ende zum anderen vertikal und horizontal Stücke zerkleinerte Gewebe von 0,8 mm zu erhalten x 0,8 mm.
3. Herstellung von Kunststoff-Druck PCL / Collagen Autografts
- Alle Zutaten auf Eis kalt zu halten. Utensilien benötigt: Falcon-Röhrchen, 10x DMEM, 1x DMEM, 1 N NaOH und Rattenschwanz Kollagen Typ 1.
- Mix 2 ml 10x DMEM (sorgfältig Blasen zu vermeiden) mit 12 ml Kollagen Typ 1. 1 N NaOH tropfen, pH bis zu 7,4-8 (Farbe in dem Medium zu bringen, sollte der pH-Wert anzuzeigen, durch Ändern von intensiven gelb Pink). Darüber hinaus verwenden einen pH-Streifen.
- Vorsichtig 2 ml 1x DMEM und die Lösung mischen. Platte ca. 2 ml Kollagen in jede Vertiefung der Stahl rechteckigen Form (20x30x10 mm) und Inkubation bei 37 ° C in 5% CO 2 für 10 min.
HINWEIS: Die Konzentration an Kollagen sollte 2,06 mg / ml in 0,6% Essigsäure und die Menge an Kollagen 1 ml / cm 2 betragen. - Sobald das Kollagen in die Form legt, legen das Biomaterial (PCL) auf der Oberseite des Kollagen-Gel (20 mm x 30 mm) und die restlichen Kollagen (etwa 6 ml) auf es gießen. Inkubieren bei 37 ° C in 5% CO 2 für 20 min.
- Platzieren des zerkleinerten Gewebes (1: 6 Expansion) auf der Oberseite des Kollagengel. Drücken Sie das Wasser aus dem Konstrukt durch mechanische Kraft unter Verwendung von Kunststoff-Kompression wie folgt (3 und 4).
- Legen Sie eine dicke Schicht aus Gaze-Pads auf eine sterile Oberfläche. Legen Sie ein Edelstahlgewebe (400 & mgr; m dick) auf der Oberseite des gauzE-Pads und dann eine Folie aus Nylon-Mesh (110 & mgr; m dick). übertragen Sie vorsichtig die Kollagen-Gel / zerkleinerten Gewebes auf die Nylon-Mesh und entfernen Sie vorsichtig die rechteckige Stahlform.
- Legen Sie eine neue Schicht von Nylon-Mesh auf der Oberseite des Kollagen-Gel / zerkleinerte Gewebe. Legen Sie eine zweite Stahlgitter an der Oberseite des Nylon-Mesh. Legen Sie in der Lage, den Druck oder Ladeplatte ein Minimum von 120 g (dh eine Glasplatte) für 5 Minuten mit einem Gewicht.
- Entfernen Sie das Gewicht, Nylon und Stahl Maschen. Die Autotransplantate sind nun bereit, auf die Schweineblase in den Vollhautwunden oder in vitro kultiviert vernäht werden.
- Für In-vitro-Kultivierung, schnitt die dünne Konstrukt in kleine Stücke passend 12-Well-Platten. 1 ml der Keratinozyten-Medium. Legen Sie die Platten im Brutschrank bei 37 ° C, 5% CO 2 und Kultur bis zu 6 Wochen und ändern Sie das Medium 3-mal pro Woche.
4. Naht von Autografts
- Naht der Autograft mitgehackten Blasenschleimhaut auf die Schweineblase
- Halten Sie das Autotransplantat feucht in DMEM während der Wartezeit. Naht das Autotransplantat mit feinen Lauf Monofilamentnahtmaterialien. Verwenden Sie nicht resorbierbaren 5-0 Ethilon für Forschungszwecke.
- wenn wasserdicht überprüfen, indem Sie die Blase mit Kochsalzlösung durch den innewohnenden Blasenkatheter zu füllen. Wenn möglich, decken Sie die Autograft mit einer Schicht aus großen Netzes. Schließen Sie die Bauchdecke, Unterhaut und Haut wie in 1.2.6 beschrieben. Tragen Sie eine Wundauflage.
- Naht der Autograft mit gehacktem Haut Epidermis zu einem Full-Dicke Wound
- Halten Sie das Autotransplantat feucht in DMEM während der Wartezeit.
- Nähen Sie die Autograft an der Unterseite der Haut mit voller Dicke gewickelt durch Knopfnähten in den Ecken und in der Mitte des Autograft das Autotransplantat zu halten eng mit dem Untergrund befestigt.
- Bedecken Sie die Wunde mit einer Kunststoffverband, der die Wunde feucht hält.
5. Beendigung
- Sedate das Tier mit intramuskuläre Injektion von Zolazepam Hypochlorid (2,5 mg / kg) und Medetomidin (25 ug / kg) vor der Kündigung und Überwachungsgeräte an das Ohr oder Schwanz für Puls und Blutdruck zu überprüfen gilt.
- Euthanize das Tier durch eine letale Dosis von Pentobarbital-Natrium verabreicht (60-140 mg / kg) intravenös. Prüfen Puls und Blutdruck, bis der Tod eingetreten ist.
6. In-vitro-Kultur
ANMERKUNG: Um histologisch das Fortschreiten der zerkleinerte Gewebe in den PCL / Kollagen-Konstrukte in vitro, die Kollagen / PCL / Hackfleisch Patches sind auszuwerten kultiviert in Platten mit 12 Vertiefungen Keratinozyten-Medium.
- Herstellung von Keratinozyten-Medium:
- Sterilisieren eine 500 ml-Glasflasche.
- Mischen 400 ml DMEM mit 100 ml Hams F12 (4: 1-Gemisch). Ergänzt mit 10% fötalem Rinderserum, 5 ug / ml Insulin,0,4 & mgr; g / ml Hydrocortison, 21 & mgr; g / ml Adenin, 10 -10 mol / L Choleratoxin, 2 x 10 -9 mol / L Trijodthyronin, 5 ug / ml Transferrin, 10 ng / ml epidermalen Wachstumsfaktor, 50 U / ml Penicillin und 50 ug / ml Streptomycin.
- Sterilisieren durch Filtrieren durch einen 0,2-um-Filter und das Filtrat in die sterile 500 ml-Flasche.
7. Immunhistochemie
HINWEIS: Die Immunhistochemie Protokoll wird in der Regel in die folgenden Schritte unterteilt: (1) Fixierung und Paraffineinbettung, (2) Mikro-Schneiden bis 5 um Scheiben, Platzierung auf Rutschen, Entparaffinierung und Rehydrierung, (3) Antigen Demaskierung, Färbung und Montage . Bevor die letzten Schritte in der Immunhistochemie Verfahren beginnen, bereiten Sie die Waschpuffer und die Antigen-Demaskierung Lösung (siehe separate Material Details). Vorbereiten des ABC-Komplex-Lösung mindestens 30 Minuten vor dem Gebrauch.
- Fixierung
NEINTE: Am Ende des in-vitro-Kultur, beheben die Patches wie folgt:- Bereiten Eppendorf-Röhrchen mit 1 ml 4% gepuffertem Formaldehyd (PFA) (Achtung:. Formaldehyd ist giftig Bitte lesen Blätter Sicherheitsdaten bevor mit dieser chemischen Arbeits Handschuhe und eine Schutzbrille und bereiten die Lösung innerhalb einer Abzugshaube.).
- Übertragen jedes der Kollagen-Patches in ein Eppendorf-Röhrchen mit 4% PFA. Fix über Nacht bei Raumtemperatur.
- Prüfmuster in 70% Ethanol für langfristige Lagerung bei 4 ° C. Die Proben sind nun bereit für die Dehydratisierung und in Paraffinblöcke Einbettung vor Schneiden.
- Rehydrierung
- Legen Sie die Folien in einer Küvette mit X-tra solv für 15 min. Wiederholen Sie nach einer neuen Küvette mit X-tra solv verwenden. Legen Sie die Folien in einer Küvette mit absolutem Ethanol für 10 min. Wiederholen Sie nach einer neuen Küvette mit absolutem Ethanol verwendet wird. Legen Sie die Folien in einer Küvette mit 95% Ethanol für 10 Minuten und danachin Küvette mit 70% Ethanol für 10 min. Schließlich waschen Sie die Folien zweimal 5 min mit destilliertem Wasser.
- Antigen Demaskierung
- Legen Sie Folien in einer Glasküvette mit TE-Lösung und setzte das Glas in einem Wasserbad für 20 Minuten kochen lassen. Nehmen Sie das Glas vorsichtig aus dem Wasserbad heraus. Kühlen Sie die Folien auf Raumtemperatur für 30 Minuten und waschen zweimal für 5 min in Tris-Puffer. Legen Sie die Folien in einer Küvette mit 3% Wasserstoffperoxid für 10 Minuten. Waschen Sie die Objektträger zweimal für 5 min in Tris-Puffer. Zeichnen Sie einen Kreis um die Proben mit einem wasserabstoßenden Markierungsstift.
- Blockieren unspezifische Bindung des Antikörpers unter Verwendung von 100-300 & mgr; l Blockierungslösung. Entfernen Sie die Blockierungslösung und fügen 100-300 ul des primären Antikörpers in der empfohlenen Konzentration in Tris-Puffer gelöst. Inkubieren über Nacht. Entfernen Sie die Antikörperlösung und waschen Abschnitte in Tris-Puffer zweimal für 5 min.
- Inkubieren mit dem sekundären Antikörper für 1 h bei Raum temperature. Waschen zweimal für 5 min in Tris-Puffer. Man inkubiert 30 Minuten die ABC Elite Kit (den Anweisungen des Herstellers folgen). Wasche zweimal in Tris-Puffer.
- Entwickeln Antikörper-Reaktion durch den Vektor VIP Kit nach den Anweisungen des Herstellers (1-7 min Inkubation erzeugt im Allgemeinen eine klare violette Intensität). Legen Sie die Folien in destilliertem Wasser. Gegenfärbung mit Hämatoxylin Mayers für 30 Sekunden.
- Waschen in Wasser für 5 Minuten ausgeführt wird. Legen Sie die Folien in einer Küvette mit 70% Ethanol für 1 min. Wiederholen Sie nach einer neuen Küvette mit 70% Ethanol. Legen Sie die Folien in einer Küvette mit 95% Ethanol für 1 min. Wiederholen Sie nach einer neuen Küvette mit 95% Ethanol.
- Legen Sie die Folien in einer Küvette mit X-tra solv für 5 min. Entfernen, ein zu einer Zeit feucht zu halten. Geben Sie einen Tropfen Eindeckmittel oben auf jeder Folie und legte ein Deckglas auf der Oberseite (tun so sorgfältig um Luftblasen zu vermeiden). Lassen Sie die Objektträger über Nacht trocknen und sehen gleitet unter einem MikroUmfang.
Ergebnisse
Diese Studie stellt eine Methode, die zeigt, wie ein Biomaterial für die Transplantation mit Kunststoff-Kompression von Kollagen und zerkleinerte Gewebe zu erzeugen.
Blasenschleimhaut und die Haut und dann mechanisch zerhackt in kleine Partikel (Abbildung 3) geerntet werden. Durch plastische Kompression werden die gehackten Teilchen innerhalb des Verbundgerüst eines zentral angeordneten biologisch abbaubare Polymer eingearbeitet, die innerhalb der äußeren Schichten aus e...
Diskussion
Diese Studie stellt eine einfach zu bedienende Ansatz zur Blasenwand Patches mit Eigengewebe für die Transplantation am OP-Tisch erzeugen. Die Flecken werden durch die Kombination eines biologisch abbaubaren Polymers Stricken in der Mitte und Kollagen mit und ohne zerkleinerte Gewebe in den Außenflächen in Kombination mit Kunststoff Kompression gebildet. Kunststoff-Komprimierung ist ein Verfahren bereits von anderen Autoren beschrieben und kann als eine schnelle Rückführung von Flüssigkeit aus Kollagengelen 1...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors thank the Swedish Society for Medical Research, the Promobilia Foundation, the Crown Princess Lovisa Foundation, the Freemason Foundation for Children’s Welfare, the Swedish Society of Medicine, the Solstickan Foundation, Karolinska Institutet, and the Stockholm City Council for financial support.
Materialien
| Name | Company | Catalog Number | Comments |
| Silicone catheter 10-French | Preparing the animal for surgery, Section 1 | ||
| DMEM 10x | Gibco | 31885-023 | Plastic compression section 4 |
| 24 well plates | Falcon | 08-772-1 | Plastic compression section 4 |
| 3',3',5-Triiodothyronine | Sigma-Aldrich | IRMM469 | In vitro culture; Section 5 |
| 4% PFA | Labmed Solutions | 200-001-8 | Immunocytochemistry; Section 6 |
| 70% ethanol | Histolab | Immunocytochemistry; Section 6 | |
| ABC Elite kit: Biotin-Streptavidin detection kit | Vector | PK6102 | Immunocytochemistry; Section 6 |
| Absolute ethanol | Histolab | 1399.01 | Immunocytochemistry; Section 6 |
| Adenine | Sigma-Aldrich | A8626 | In vitro culture; Section 5 |
| Atropine 25 μg/kg | Temgesic, RB Pharmaceuticals, Great Britain | Preparing the animal for surgery, Section 1 | |
| Azaperone 2 mg/kg | Stresnil, Janssen-Cilag, Pharma, Austria | Preparing the animal for surgery, Section 1 | |
| Biosafety Level 2 hood | Plastic compression; Section 4 | ||
| Blocking solution: Normal serum from the same species as the secondary secondary antibody was generated in. | Vector | The blocking solution depends of the origin of first antibody | Immunocytochemistry; Section 6 |
| Buprenorphine 45 μg/kg | Atropin, Mylan Inc, Canonsburg, PA | Preparing the animal for surgery, Section 1 | |
| Carprofen 3 mg/kg | Rimadyl, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Chlorhexidine gluconate | Hibiscrub 40 mg/mL, Regent Medical, England | Preparing the animal for surgery, Section 1 | |
| Cholera toxin | Sigma-Aldrich | C8052 | In vitro culture; Section 5 |
| Coplin jar: staining jar for boiling | Histolab | 6150 | Immunocytochemistry; Section 6 |
| Stainless mold (33 mm x 22 mm x 10 mm) custom made | Plastic compression; Section 4 | ||
| DMEM | Gibco | 3188-5023 | Plastic compression section 4. Keep on ice when using it in plastic compression |
| Epidermal growth factor | Sigma-Aldrich | E9644 | In vitro culture; Section 5 |
| Ethilon (non-absorbable monofilament for skin sutures) | Ethicon | Surgery, Section 1 | |
| Fetal bovine serum (FBS) | Gibco | 10437-036 | Plastic compression section 4 |
| Forceps (Adison with tooth) | Preparing the animal for surgery, Section 1 | ||
| Gauze (Gazin Mullkompresse) | Preparing the animal for surgery, Section 1 | ||
| Ham's F12 | Gibco | 31765-027 | Plastic compression section 4 |
| Hematoxylin | Histolab | 1820 | Immunocytochemistry; Section 6 |
| Humidity chamber | DALAB | Immunocytochemistry; Section 6 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | In vitro culture; Section 5 |
| Hydrogen peroxide Solution 30% | Sigma-Aldrich | H1009 | Immunocytochemistry; Section 6 |
| Insulin | Sigma-Aldrich | I3536 | In vitro culture; Section 5 |
| Isoflurane | Isoflurane, Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Lidocaine 5 mg/ml | Xylocaine, AstraZeneca, Sweden | Preparing the animal for surgery, Section 1 | |
| Lucose 25 mg/ml | Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Marker pen pap pen | Sigma-Aldrich | Z377821-1EA | Immunocytochemistry; Section 6 |
| Medetomidine 25 μg/kg | Domitor, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Mincing device | Applied Tissue Technologies LLC | Minced tissue preparation, section 2 | |
| Monocryl (absorbable monofilament) | Ethicon | Surgery, Section 1 | |
| NaCl | Sigma-Aldrich | S7653 | Immunocytochemistry; Section 6 |
| NaOH 1 N | Merck Millipore | 106462 | Plastic compression section 4 and cell culture |
| Nylon mesh, 110 μM thick pore size 0.04 sqmm | Plastic compression; Section 4 | ||
| Oculentum simplex APL: ointment for eye protection | APL | Vnr 336164 | Surgery, Section 1 |
| PBS | Gibco | 14190-094 | Plastic compression section 4 |
| Penicillin-Streptomycin | Gibco | 15140-122 | Plastic compression section 4 |
| Phenobarbiturate 15 mg/kg | Pentobarbital, APL, Sweden | Preparing the animal for surgery, Section 1 | |
| PCL Knitted fabric | Plastic compression; Section 4 | ||
| Rat-tail collagen | First LINK, Ltd, UK | 60-30-810 | Plastic compression section 4, keep on ice |
| Scalpel blade - 15 | Preparing the animal for surgery, Section 1 | ||
| Shaving shears | Preparing the animal for surgery, Section 1 | ||
| Stainless stell mesh, 400 μM thick pore size | Plastic compression; Section 4 | ||
| Steril gloves | Preparing the animal for surgery, Section 1 | ||
| Sterile gowns | Preparing the animal for surgery, Section 1 | ||
| Sterile drapes | |||
| Sterilium | Bode Chemie HAMBURG | Preparing the animal for surgery, Section 1 | |
| Suture Thread Ethilon | Preparing the animal for surgery, Section 1 | ||
| TE-solution (antigen unmasking solution) consist of 10 mM Tris and 1 mM EDTA, pH 9.0 | 10 mM Tris/1 mM EDTA, adjust pH to 9.0 | ||
| Tiletamine hypochloride 2.5 mg/kg | Preparing the animal for surgery, Section 1 | ||
| Transferrin | Sigma-Aldrich | T8158 | In vitro culture; Section 5 |
| Trizma Base, H2NC | Sigma-Aldrich | T6066 | Immunocytochemistry; Section 6 |
| Vector VIP kit: Enzyme peroxidase substrate kit | Vector | SK4600 | Immunocytochemistry; Section 6 |
| Vicryl (absorbable braded) | Ethicon | Surgery, Section 1 | |
| Tris buffer pH 7.6 (washing buffer) | TE solution: Make 10x (0.5 M Tris, 1.5 M NaCl) by mixing: 60.6 g Tris (Trizma Base, H2NC(CH2OH)3, M=121.14 g/mol), add 800 ml distilled water adjust the pH till 7.6, add 87.7 g NaCl and fill to 1,000 ml with distilled water. Dilute to 1x with distilled water. | ||
| X-tra solv (solvent) | DALAB | 41-5213-810 | Immunocytochemistry; Section 6. Use under fume hood |
| Zolazepam hypochloride | Zoletil, Virbac, France | Preparing the animal for surgery, Section 1 | |
| Depilatory wax strips | Veet | Preparing the animal for surgery, Section 1 | |
| Pentobarbital sodium | Lundbeck | Termination, Section 3 |
Referenzen
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6, 331-343 (1975).
- Fossum, M., Nordenskjold, A., Kratz, G. Engineering of multilayered urinary tissue in vitro. Tissue Engineering. 10, 175-180 (2004).
- Salmikangas, P., et al. Manufacturing, characterization and control of cell-based medicinal products: challenging paradigms toward commercial use. Regen Med. 10, 65-78 (2015).
- Fossum, M., et al. Minced skin for tissue engineering of epithelialized subcutaneous tunnels. Tissue Engineering. Part A. 15, 2085-2092 (2009).
- Fossum, M., et al. Minced urothelium to create epithelialized subcutaneous conduits. The Journal of Urology. 184, 757-761 (2010).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. L., Nordenskjold, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. BioMed Research International. 2013, 212734 (2013).
- Meek, C. P. Successful microdermagrafting using the Meek-Wall microdermatome. Am J Surg. 96, 557-558 (1958).
- Tanner, J. C., Vandeput, J., Olley, J. F. The Mesh skin graft. Plastic and Reconstructive Surgery. 34, 287-292 (1964).
- Svensjo, T., et al. Autologous skin transplantation: comparison of minced skin to other techniques. The Journal of Surgical Research. 103, 19-29 (2002).
- Ajalloueian, F., Zeiai, S., Rojas, R., Fossum, M., Hilborn, J. One-stage tissue engineering of bladder wall patches for an easy-to-use approach at the surgical table. Tissue Engineering. Part C, Methods. 19, 688-696 (2013).
- Engelhardt, E. M., et al. A collagen-poly(lactic acid-co-varepsilon-caprolactone) hybrid scaffold for bladder tissue regeneration. Biomaterials. 32, 3969-3976 (2011).
- Brown, R. A., Wiseman, M., Chuo, C. B., Cheema, U., Nazhat, S. N. Ultrarapid engineering of biomimetic materials and tissues: fabrication of nano- and microstructures by plastic compression. Adv Funct Mater. 15, 1762-1770 (2005).
- Fumagalli Romario, U., Puccetti, F., Elmore, U., Massaron, S., Rosati, R. Self-gripping mesh versus staple fixation in laparoscopic inguinal hernia repair: a prospective comparison. Surg Endosc. 27, 1798-1802 (2013).
- Muangman, P., et al. Complex Wound Management Utilizing an Artificial Dermal Matrix. Annals of Plastic Surgery. 57, 199-202 (2006).
- Ajalloueian, F., Zeiai, S., Fossum, M., Hilborn, J. G. Constructs of electrospun PLGA, compressed collagen and minced urothelium for minimally manipulated autologous bladder tissue expansion. Biomaterials. 35, 5741-5748 (2014).
- Orabi, H., AbouShwareb, T., Zhang, Y., Yoo, J. J., Atala, A. Cell-seeded tubularized scaffolds for reconstruction of long urethral defects: a preclinical study. Eur Urol. 63, 531-538 (2013).
- Blais, M., Parenteau-Bareil, R., Cadau, S., Berthod, F. Concise review: tissue-engineered skin and nerve regeneration in burn treatment. Stem Cells Transl Med. 2, 545-551 (2013).
- Serpooshan, V., Muja, N., Marelli, B., Nazhat, S. N. Fibroblast contractility and growth in plastic compressed collagen gel scaffolds with microstructures correlated with hydraulic permeability. J Biomed Mater Res A. 96, 609-620 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten