È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Tissue tritata in Compressed Collagene: A Biotransplant cellulare contenente per la riparazione singolo-messa in scena Ricostruttiva
In questo articolo
Riepilogo
L'ingegneria dei tessuti include spesso espansione in vitro per creare autologhi per la rigenerazione tissutale. In questo studio un metodo per l'espansione del tessuto, rigenerazione e ricostruzione in vivo è stata sviluppata al fine di minimizzare la trasformazione di cellule e materiali biologici di fuori del corpo.
Abstract
Conventional techniques for cell expansion and transplantation of autologous cells for tissue engineering purposes can take place in specially equipped human cell culture facilities. These methods include isolation of cells in single cell suspension and several laborious and time-consuming events before transplantation back to the patient. Previous studies suggest that the body itself could be used as a bioreactor for cell expansion and regeneration of tissue in order to minimize ex vivo manipulations of tissues and cells before transplanting to the patient. The aim of this study was to demonstrate a method for tissue harvesting, isolation of continuous epithelium, mincing of the epithelium into small pieces and incorporating them into a three-layered biomaterial. The three-layered biomaterial then served as a delivery vehicle, to allow surgical handling, exchange of nutrition across the transplant, and a controlled degradation. The biomaterial consisted of two outer layers of collagen and a core of a mechanically stable and slowly degradable polymer. The minced epithelium was incorporated into one of the collagen layers before transplantation. By mincing the epithelial tissue into small pieces, the pieces could be spread and thereby the propagation of cells was stimulated. After the initial take of the transplants, cell expansion and reorganization would take place and extracellular matrix mature to allow ingrowth of capillaries and nerves and further maturation of the extracellular matrix. The technique minimizes ex vivo manipulations and allow cell harvesting, preparation of autograft, and transplantation to the patient as a simple one-stage intervention. In the future, tissue expansion could be initiated around a 3D mold inside the body itself, according to the specific needs of the patient. Additionally, the technique could be performed in an ordinary surgical setting without the need for sophisticated cell culturing facilities.
Introduzione
La maggior parte degli studi di ingegneria tissutale su trapianti di pelle e del tratto urogenitale includono i raccolti di cellule autologhe da tessuto sano e l'espansione delle cellule in strutture cellulari-coltura appositamente attrezzati 1,2.
Dopo l'espansione delle cellule, le cellule sono in genere memorizzati per un uso successivo quando il paziente viene preparato a ricevere la autologo. congelatori azoto permettono la conservazione a lungo termine a bassa temperatura di -150 ° C o inferiore. Il processo di congelamento devono fare attenzione e controllato in modo da non perdere le cellule. Un rischio di morte cellulare è la cristallizzazione di acqua intracellulare durante il processo di scongelamento, che può portare alla rottura delle membrane cellulari. Cella di congelamento è di solito eseguita da lento e controllato raffreddamento (-1 ° C per min), con un'alta concentrazione di cellule, siero fetale bovino, e dimetilsolfossido. Dopo lo scongelamento, le celle devono essere nuovamente elaborate rimuovendo il mezzo congelamento e coltura su colture cellulari di plastica o unabiomateriale prima del trapianto di nuovo al paziente.
Tutti i passi di cui sopra sono in termini di tempo, laboriosa e costosa 3. Inoltre, tutta l'elaborazione in vitro delle cellule destinati ai trapianti dei pazienti sono altamente regolamentato e richiede personale e laboratori 4 ben addestrati e accreditati. Nel complesso, per procurare un processo di produzione sicuro ed affidabile, la tecnica potrebbe essere stabilito solo in un piccolo numero di centri tecnicamente avanzati e un uso più ampio nei disturbi chirurgiche comuni è dubbia.
Per superare le limitazioni di coltura cellulare in ambiente di laboratorio, il concetto di trapianto di tessuto macinate per l'espansione delle cellule in vivo è introdotto utilizzando il corpo stesso come un bioreattore. Per questi scopi, i autoinnesti sarebbero preferenzialmente da trapiantare su uno stampo 3D in base alla forma che è necessario per la ricostruzione finale dell'organo di interest 5-7.
In origine, l'idea di trapiantare l'epitelio tritata è stato presentato da Meek nel 1958, quando ha descritto come epitelio cresce dai margini di una ferita. Egli ha dimostrato che un piccolo pezzo di pelle sarebbe aumentare i margini e così il suo potenziale di espansione delle cellule del 100% tagliando il pezzo due volte in direzioni perpendicolari (Figura 1) 8. La teoria è stata sostenuta con l'uso di maglie innesti cutanei parziali spessore per il trapianto di pelle 9 e in pelle ferite modelli 10 guarigione.
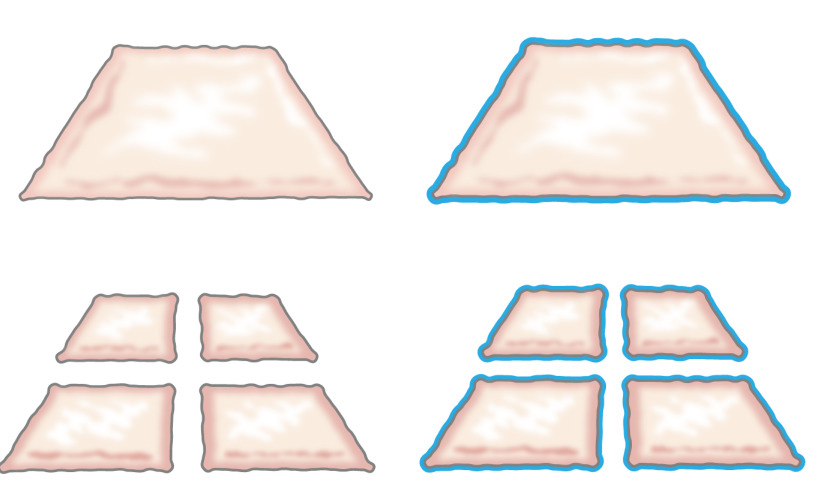
Figura 1:. Teoria Meek Secondo la teoria di Meek, epitelio cresce dai bordi di una ferita. Aumentando l'area esposta dalla tecnologia di macinazione, tessuto tritato epithelializes ferite da molti punti.
Il presente studio si basa sulla ipotesi che lo stesso principio può essere applicato al tessuto sottocutaneo posizionando dell'epitelio macinata intorno uno stampo. Le cellule epiteliali mobilitavano da trapianto macinate (riorganizzare), coprono le aree ferita (migrare) e dividere (espansione) per formare un neoepithelium continuo che copre l'area della ferita e separa il corpo estraneo (stampo) dal corpo interno ( Figura 2).
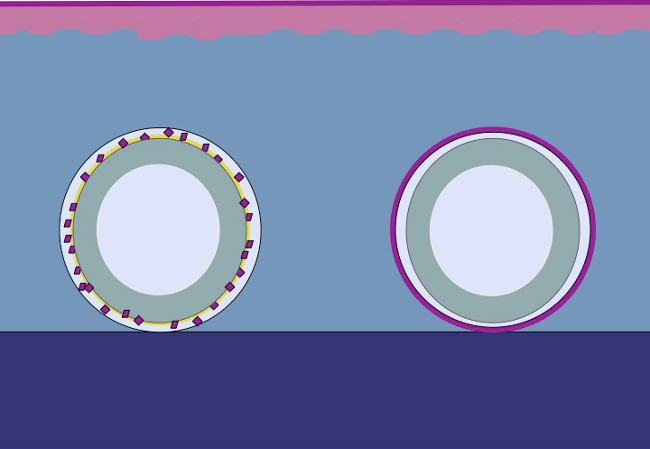
Figura 2:. Fumetto di uno stampo 3D con epitelio macinate per vivo espansione tissutale intracorporal in base alla teoria di Meek Utilizzando tessuto tritato posto su uno stampo e poi trapiantato al tessuto sottocutaneo, l'ipotesi è che le cellule epiteliali migrano dal bordi del tessuto tritato, riorganizzano e si espandono in modo da formare un neoepithelium continuo che copre l'area della ferita e separa il corpo estraneo (stampo) dal corpo interno.
Sebbene precedenti studi in vivo mostrano risultati promettenti, ulteriori miglioramenti potrebbero essere realizzati rafforzando i autologhi in modo che l'epitelio rigenerato potrebbe resistere a traumi meccanici meglio 7. A tal fine, sono stati individuati requisiti importanti per un biomateriale successo, come ad esempio: facile diffusione di nutrienti e scarti, possibilità di stampo in una maniera 3D e facilità di manipolazione chirurgica. Le conclusioni sono state fatte che queste esigenze possono essere soddisfatte con l'aggiunta di un biomateriale composito al tessuto tritato.
L'attuale studio volto a sviluppare un'impalcatura composta di tessuto tritato in collagene plastica compresso contenente un'anima di rinforzo di un tessuto biodegradabile. Con questi mezzi, cellule vitali potrebbero migrare dalle particelle di tessuto tritate e proliferare con caratteristiche morfologiche caratteristiche dell'epitelio originale (pelle o urotelio). Utilizzando la compressione di plastica, l'impalcatura era ridurred nel formato da 1 cm a circa 420 micron come le particelle macinate sono stati racchiusi in collagene strato superiore. Il tessuto di base potrebbe essere qualsiasi polimero, ma ha bisogno di essere modificato con una superficie idrofila al fine di interconnettere con il rivestimento strati di collagene 11.
Il metodo ha fornito una integrità impalcatura migliorata incorporando una maglia a maglia costituito da poli (ε-caprolattone) (PCL) entro due gel di collagene di plastica compressa usando come impalcatura per la coltura di mucosa vescicale macinate o pelle tritata di maiale. Il costrutto è stato mantenuto in condizioni di coltura cellulare, per 6 settimane vitro, dimostrando formazione di successo di una stratificata, urotelio multistrato o squamose dell'epitelio pelle sulla parte superiore di un costrutto ibrido ben consolidata. Il costrutto era facile da gestire e potrebbe essere suturato in atto ai fini della vescica di aumento o la copertura dei difetti della pelle. Tutte le parti del patibolo tessuti sono approvati dalla FDA e la tecnicapotrebbe essere utilizzato per le procedure a singolo stadio per la raccolta dei tessuti, macinazione, la compressione di plastica, e il trapianto di nuovo al paziente come un intervento singolo-messa in scena. La procedura può essere eseguita per espansione tissutale e ricostruzione in condizioni sterili in qualsiasi unità chirurgia generale.
Protocollo
Tutti i protocolli degli animali sono stati pre-approvati dal Comitato della contea di Stoccolma sugli animali e tutte le procedure conformi alle norme per uso animale, nonché relative leggi federali.
1. Procedure animali
- Preparare l'animale per Chirurgia
- Preparare il tavolo operatorio con tutti i materiali e gli strumenti necessari per il funzionamento in condizioni sterili. Effettuare l'intervento esclusivamente in condizioni sterili per ridurre il rischio di infezione e di ottimizzare le condizioni in chirurgia sopravvivenza.
- Digiunare l'animale per 12 ore prima di un intervento chirurgico e misurare il suo peso. Somministrare una iniezione intramuscolare di azaperone (2 mg / kg) per premedicazione. Anestetizzare l'animale con iniezioni intramuscolari di tiletamina ipoclorito (2,5 mg / kg), zolazepam ipoclorito (2,5 mg / kg), medetomidina (25 mg / kg) e atropina (25 mg / kg).
- Iniettare phenobarbiturate (15 mg / kg) prima endotracheal intubazione e continuare anestesia generale con 0,8% -2% isoflurano. Inserire una periferica catetere venoso in un orecchio e infondere glucosio (25 mg / ml) per via endovenosa nel corso della procedura di mantenere il benessere dell'animale.
- Posizionare dispositivi di monitoraggio sull'orecchio o la coda per controllare la temperatura, la pressione sanguigna, la saturazione e polso periferico. anestesia controllo dalla stimolazione dolore delle orecchie o zoccoli. Applicare una pomata per gli occhi per prevenire la secchezza mentre sotto anestesia.
- L'asportazione della vescica campione bioptico
- Cateterizzarla vescica utilizzando un catetere di silicone 10-Francese introducendo uno speculum per visualizzare l'uretra e inserire il catetere attraverso l'uretra e nella vescica urinaria per svuotare l'urina in condizioni semi-sterili. Riempire la vescica con soluzione salina sterile ad una pressione di 20-25 cm H 2 O, circa 100-300 ml, e poi vuoto a 20 cm H 2 O (circa. 8 ml / kg di peso corporeo).
- con esimoe suino accuratamente trasformato ad una posizione laterale, eseguire una sterilizzazione preoperatoria base della pelle con applicazione di clorexidina gluconato. Applicare un piatto di diatermia alla spalla dopo aver rimosso il pelame con cesoie da barba.
- Girare il maiale con cura in una posizione supina e rimuovere il pelage addominale utilizzando cesoie da trucco e fare una sterilizzazione preoperatoria di base della pelle addominale con applicazione di clorexidina gluconato.
- Incorporare le estremità con vestiti morbido per ridurre al minimo il rischio di danni iperestensione alle articolazioni degli arti. Sterilizzare la pelle addominale dell'animale con le applicazioni successive di clorexidina gluconato e posizionare drappeggio sterili intorno al campo operatorio.
- Prima incisione cutanea, applicare un analgesico endovenosa comprensivi di buprenorfina (45 mg / kg), carprofen (3 mg / kg) e iniezione locale di lidocaina sulla linea mediana di sotto dell'ombelico. Verificare la reazione del dolore afferrando la skin con una pinza. Effettuare una incisione mediana inferiore attraverso la fascia e del peritoneo usando la diatermia per il controllo del sanguinamento. Localizzare vescica che ha una posizione completamente intraperitoneale nel maiale e può essere liberamente esposta dalla mobilitazione attraverso la ferita chirurgica.
- Afferrare la vescica con le pinze e misurare con un nastro di misurazione sterilizzato e segnano un a forma ellittica campione bioptico di circa 2 cm nel senso longitudinale e 1 cm nel senso trasversale, o più piccolo, con una penna sterilizzato (il maiale tollera una riduzione quarto delle dimensioni della vescica ottimo). Accise L'area contrassegnata, utilizzando un bisturi, e posizionare il campione della vescica biopsia in DMEM in condizioni sterili.
- Eseguire autotrapianto con il biotransplant o chiudere la vescica sutura con 5-0 Vicryl in due strati. Chiudere con cura la fascia addominale con 2-0 o 3-0 in esecuzione Vicryl. Chiudere il sottocute con 3-0 Vicryl e la pelle con 3-0 Ethilon. Inserire una medicazione sulla ferita e attentamentetendono a l'animale fino a che non ha recuperato a sufficienza dal anestesia e non esprimere il dolore.
- Spostare l'animale per la casa di cura degli animali per garantire le condizioni per la cura post-operatoria. Mettere l'animale in una sola gabbia con una lampada riscaldante e partecipare per l'animale fino al completo recupero dall'anestesia e poi lasciare che gli animali sono in fase di stallo a coppie.
- Fornire un recupero tranquillo per quanto riguarda il dolore e il benessere e amministrare buprenorfina (45 mg / kg) per via intramuscolare per l'analgesia postoperatoria e trimetoprim (4 mg / kg) e sulfamidici (20 mg / kg) due volte al giorno per tre giorni e una volta al giorno per cinque giorni per ridurre il rischio di infezioni post-operatorie.
- L'asportazione della pelle campione bioptico
- Preparare il tavolo operatorio con tutti i materiali necessari. Anestetizzare l'animale come precedentemente descritto in 1.1. Rimuovere il pelage con cera, lavare e sterilizzare l'area incisione con Betadine e il 70% di alcol e poi posto drappeggio sterili around l'area di incisione.
- Utilizzare un dermatomo di raccogliere un 0,3 mm di spessore parziale campione bioptico pelle. Posizionare il campione di pelle in DMEM prima della macinazione, come descritto al punto 2.2. Coprire l'area ferita con pomata grassa e una medicazione.
2. tritato Preparazione del tessuto
- vescica mucosa
- Lavare la biopsia della vescica due volte in DMEM. Posizionare il campione bioptico vescica su un piatto dissezione sterilizzati con la mucosa rivolta verso l'alto e fissare uno dei lati della piastra con perni dissezione.
- Separare tessuto mucoso dal muscolo detrusore usando forbici sottili e pinze (Figura 3) e mantenere la mucosa umido gocciolando salina o DMEM sopra.
- Utilizzare il dispositivo di macinazione ponendolo sulla mucosa e quindi passare il dispositivo da un capo all'altro verticalmente ed orizzontalmente, applicando pressione manuale per ottenere pezzi di tessuto tritato di 0,8 mm x 0,8 (0,8 mm è la distanza tra la rotating lame da taglio).
- Pelle
- Se il biopsis pelle sono di spessore: posizionare la pelle su un piatto dissezione sterile e usare le forbici chirurgiche per separare l'epidermide dal grasso sottocutaneo e derma. L'epidermide è sottile e traslucida (circa. 0,3 millimetri) quando è pronto per la macinazione.
- Utilizzare il dispositivo di macinazione ponendolo sull'epidermide. Con pressione, passare il dispositivo da un capo all'altro verticalmente e orizzontalmente per ottenere pezzi di tessuto tritato di 0,8 mm x 0,8 mm.
3. Preparazione di plastica compressa PCL / collagene Autoinnesti
- Mettere tutti gli ingredienti su ghiaccio per mantenere freddo. Utensili necessari: tubo Falcon, 10x DMEM, 1x DMEM, 1 N NaOH e coda di topo collagene di tipo 1.
- Mescolare 2 ml di DMEM 10x (con attenzione per evitare bolle) con 12 ml di collagene di tipo 1. Aggiungere 1 N NaOH, goccia a goccia, per portare il pH fino a 7,4-8 (colore nel mezzo deve indicare il pH cambiando da un intenso giallo al pinK). Inoltre, utilizzare una striscia di pH.
- Aggiungere con cautela 2 ml di 1x DMEM e mescolare la soluzione. Piatto circa 2 ml di collagene in ciascun pozzetto della stampo rettangolare di acciaio (20x30x10 mm) e incubare a 37 ° C in 5% di CO 2 per 10 min.
NOTA: La concentrazione di collagene dovrebbe essere 2,06 mg / ml in acido acetico 0,6% e la quantità di collagene 1 ml / cm 2. - Una volta che il collagene imposta nello stampo, posizionare il biomateriale (PCL) sulla parte superiore del gel di collagene (20 mm x 30 mm) e versare il collagene rimanente (circa 6 ml) su di esso. Incubare a 37 ° C in 5% CO 2 per 20 min.
- Posizionare il tessuto tritato (per 1: espansione 6) sulla sommità del gel di collagene. Premere l'acqua del costrutto dalla forza meccanica utilizzando la compressione plastica come segue (figure 3 e 4).
- Posizionare uno spesso strato di garza su una superficie sterile. Mettere una maglia di acciaio inossidabile (400 micron di spessore) in cima alla gauze pastiglie e poi un foglio di nylon mesh (110 micron di spessore). Trasferire accuratamente il tessuto gel di collagene / tritato sulla rete di nylon e rimuovere con attenzione lo stampo rettangolare in acciaio.
- Inserire un nuovo strato di rete di nylon sulla parte superiore del tessuto gel di collagene / macinate. Inserire una seconda maglia di acciaio sulla parte superiore della maglia di nylon. Mettere in posizione la piastra di pressione o di carico per un peso minimo di 120 g (cioè, una lastra di vetro) per 5 min.
- Rimuovere le maglie di peso, nylon e acciaio. I autografts sono ora pronti per essere suturato alla vescica maiale nelle ferite a tutto spessore della pelle o coltivate in vitro.
- Per la coltura in vitro, tagliare il costrutto sottile in piccoli pezzi montaggio piastre da 12 pozzetti. Aggiungere 1 ml di terreno cheratinociti. Posizionare le piastre in incubatore a 37 ° C, 5% di CO 2 e cultura fino a 6 settimane e cambiare il mezzo 3 volte a settimana.
4. Sutura di Autoinnesti
- Sutura di autotrapianto conmucosa vescicale macinata alla vescica maiale
- Mantenere l'autotrapianto umido in DMEM durante il tempo di attesa. Suturare la autologo con sottili punti di sutura in esecuzione monofilamento. Utilizzare non assorbibile 5-0 Ethilon per scopi di ricerca.
- Controllare se stagna riempiendo la vescica con soluzione salina attraverso il catetere urinario a permanenza. Se possibile, coprire il autologo con uno strato di omento. Chiudere la parete addominale, tessuto sottocutaneo, e la pelle come descritto in 1.2.6. Applicare una medicazione della ferita.
- Sutura della Autograft con tritato epidermide della pelle per una ferita a tutto spessore
- Mantenere l'autotrapianto umido in DMEM durante il tempo di attesa.
- Suturare la autograft al fondo della cute a tutto spessore avvolto da punti staccati negli angoli e al centro del autograft per mantenere il autograft strettamente collegato alla superficie sottostante.
- Coprire la ferita con una medicazione in plastica che mantiene la ferita umida.
5. fine
- Sedare l'animale con l'iniezione intramuscolare di zolazepam ipoclorito (2,5 mg / kg) e medetomidina (25 ug / kg) prima della risoluzione e applicare dispositivi di monitoraggio per l'orecchio o coda per controllare polso e la pressione sanguigna.
- Euthanize l'animale somministrando una dose letale di sodio pentobarbital (60-140 mg / kg) per via endovenosa. Controllare polso e la pressione sanguigna fino a quando si è verificata la morte.
6. In Vitro Culture
NOTA: Per valutare istologicamente la progressione del tessuto tritato in costrutti PCL / collagene in vitro, il collagene / PCL / patches macinate sono coltivate in 12 pozzetti utilizzando medie cheratinociti.
- Preparazione del mezzo cheratinociti:
- Sterilizzare una bottiglia di vetro da 500 ml.
- Miscelare 400 ml di DMEM con 100 ml di F12 di Ham (4: 1 miscela). Supplemento con 10% di siero fetale bovino, insulina 5 ug / ml,0,4 mg / ml di idrocortisone, 21 ug / ml di adenina, 10 -10 mol / L tossina colerica, 2 x 10 -9 mol / L triiodotironina, 5 ug / ml transferrina, 10 ng / ml fattore di crescita epidermico, 50 U / ml di penicillina e 50 ug / ml di streptomicina.
- Sterilizzare filtrante attraverso un filtro da 0,2 micron e raccogliere il filtrato nella sterile bottiglia da 500 ml.
7. immunoistochimica
NOTA: Il protocollo immunoistochimica è generalmente suddiviso nelle seguenti fasi: (1) fissazione e paraffina, (2) micro-sezionamento a 5 micron fette, il posizionamento su slitte, deparaffinazione, e reidratazione, (3) l'antigene smascheramento, colorazione e montaggio . Prima di iniziare gli ultimi passi nella procedura di immunoistochimica, preparare i buffer di lavaggio e la soluzione di smascheramento dell'antigene (vedi dettagli materiali separati). Preparare la soluzione complessa ABC almeno 30 minuti prima dell'uso.
- Fissazione
NOTE: Al termine della coltura in vitro, fissare le zone come segue:- Preparare le provette Eppendorf con 1 ml di 4% di formaldeide tamponata (PFA) (Attenzione:. Formaldeide è tossica Si prega di leggere le schede di sicurezza del materiale prima di lavorare con questa sostanza chimica indossare guanti e occhiali di protezione e preparare la soluzione all'interno di una cappa aspirante.).
- Trasferire ciascuna delle patch collagene in una provetta Eppendorf contenente 4% PFA. Fix per una notte a temperatura ambiente.
- I campioni in etanolo al 70% per la conservazione a lungo termine a 4 ° C. I campioni sono ora pronti per la disidratazione e l'inclusione in blocchi di paraffina prima di sezionamento.
- reidratazione
- Porre i vetrini in una vaschetta di colorazione con solv X-tra per 15 min. Ripetere utilizzando una nuova vaschetta di colorazione con X-tra solv. Porre i vetrini in una vaschetta di colorazione con etanolo assoluto per 10 minuti. Ripetere utilizzando un nuovo barattolo colorazione con etanolo assoluto. Porre i vetrini in una vaschetta di colorazione con il 95% di etanolo per 10 minuti e successivamentein una vaschetta di colorazione con etanolo al 70% per 10 min. Infine lavare i vetrini due volte per 5 minuti con acqua distillata.
- Antigen Unmasking
- Mettere i vetrini in una vaschetta Coplin con TE-soluzione e mettere il vaso in un bagno d'acqua a bollire per 20 minuti. Prendere il vaso dal bagno di acqua con attenzione. Raffreddare i vetrini a temperatura ambiente per 30 minuti e lavare due volte per 5 min in tampone Tris. Porre i vetrini in una vaschetta di colorazione con perossido di idrogeno al 3% per 10 min. Lavare i vetrini due volte per 5 min in tampone Tris. Disegnare un cerchio attorno ai campioni utilizzando un pennarello idrorepellente.
- Blocca legame non specifico dell'anticorpo con 100-300 ml di soluzione bloccante. Rimuovere la soluzione di saturazione e aggiungere 100-300 ml di anticorpo primario disciolto alla concentrazione raccomandata in tampone Tris. Incubare una notte. Rimuovere la soluzione di anticorpi e lavare sezioni in tampone Tris due volte per 5 min.
- Incubare con l'anticorpo secondario per 1 ora a camera temperature. Lavare due volte per 5 min in tampone Tris. Incubare 30 min utilizzando il kit ABC Elite (seguire le istruzioni del produttore). Lavare due volte in tampone Tris.
- Sviluppare reazione anticorpale utilizzando il VIP Kit vettore, seguendo le istruzioni del produttore (1-7 min di incubazione produce generalmente una intensità viola chiaro). Mettere i vetrini in acqua distillata. Controcolorare con ematossilina di Mayer per 30 sec.
- Lavare in acqua corrente per 5 minuti. Porre i vetrini in una vaschetta di colorazione con il 70% di etanolo per 1 min. Ripetere utilizzando un nuovo barattolo colorazione con etanolo al 70%. Porre i vetrini in una vaschetta di colorazione con il 95% di etanolo per 1 min. Ripetere utilizzando un nuovo barattolo colorazione con etanolo al 95%.
- Porre i vetrini in una vaschetta di colorazione con solv X-tra per 5 min. Rimuovere, uno alla volta per mantenere umido. Mettere una goccia di mezzo di montaggio sulla parte superiore di ogni diapositiva e mettere un vetro di copertura sulla parte superiore (farlo con attenzione per evitare bolle d'aria). Lasciate che le diapositive asciugare durante la notte e visualizzare diapositive sotto un microambito.
Risultati
Questo studio presenta un metodo che mostra come produrre un biomateriale per il trapianto utilizzando la compressione di plastica di collagene e del tessuto tritato.
Vescica mucosa e della pelle possono essere raccolte e poi macinate meccanicamente in piccole particelle (Figura 3). Per la compressione di plastica, le particelle macinate sono incorporati nello stesso scaffold composito costituito da un polimero biodegradabile posizionato centralmente che è meccanicamente fo...
Discussione
Questo studio presenta un approccio facile da usare per la produzione di cerotti parete vescicale con tessuto autologo per il trapianto al tavolo operatorio. I cerotti sono formati dalla combinazione di una maglia polimero biodegradabile in mezzo e collagene con e senza il tessuto macinate nelle superfici esterne in combinazione con compressione di plastica. Compressione plastica è un metodo precedentemente descritto da altri autori e può essere definito come una rapida espulsione di liquido dal gel di collagene ...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors thank the Swedish Society for Medical Research, the Promobilia Foundation, the Crown Princess Lovisa Foundation, the Freemason Foundation for Children’s Welfare, the Swedish Society of Medicine, the Solstickan Foundation, Karolinska Institutet, and the Stockholm City Council for financial support.
Materiali
| Name | Company | Catalog Number | Comments |
| Silicone catheter 10-French | Preparing the animal for surgery, Section 1 | ||
| DMEM 10x | Gibco | 31885-023 | Plastic compression section 4 |
| 24 well plates | Falcon | 08-772-1 | Plastic compression section 4 |
| 3',3',5-Triiodothyronine | Sigma-Aldrich | IRMM469 | In vitro culture; Section 5 |
| 4% PFA | Labmed Solutions | 200-001-8 | Immunocytochemistry; Section 6 |
| 70% ethanol | Histolab | Immunocytochemistry; Section 6 | |
| ABC Elite kit: Biotin-Streptavidin detection kit | Vector | PK6102 | Immunocytochemistry; Section 6 |
| Absolute ethanol | Histolab | 1399.01 | Immunocytochemistry; Section 6 |
| Adenine | Sigma-Aldrich | A8626 | In vitro culture; Section 5 |
| Atropine 25 μg/kg | Temgesic, RB Pharmaceuticals, Great Britain | Preparing the animal for surgery, Section 1 | |
| Azaperone 2 mg/kg | Stresnil, Janssen-Cilag, Pharma, Austria | Preparing the animal for surgery, Section 1 | |
| Biosafety Level 2 hood | Plastic compression; Section 4 | ||
| Blocking solution: Normal serum from the same species as the secondary secondary antibody was generated in. | Vector | The blocking solution depends of the origin of first antibody | Immunocytochemistry; Section 6 |
| Buprenorphine 45 μg/kg | Atropin, Mylan Inc, Canonsburg, PA | Preparing the animal for surgery, Section 1 | |
| Carprofen 3 mg/kg | Rimadyl, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Chlorhexidine gluconate | Hibiscrub 40 mg/mL, Regent Medical, England | Preparing the animal for surgery, Section 1 | |
| Cholera toxin | Sigma-Aldrich | C8052 | In vitro culture; Section 5 |
| Coplin jar: staining jar for boiling | Histolab | 6150 | Immunocytochemistry; Section 6 |
| Stainless mold (33 mm x 22 mm x 10 mm) custom made | Plastic compression; Section 4 | ||
| DMEM | Gibco | 3188-5023 | Plastic compression section 4. Keep on ice when using it in plastic compression |
| Epidermal growth factor | Sigma-Aldrich | E9644 | In vitro culture; Section 5 |
| Ethilon (non-absorbable monofilament for skin sutures) | Ethicon | Surgery, Section 1 | |
| Fetal bovine serum (FBS) | Gibco | 10437-036 | Plastic compression section 4 |
| Forceps (Adison with tooth) | Preparing the animal for surgery, Section 1 | ||
| Gauze (Gazin Mullkompresse) | Preparing the animal for surgery, Section 1 | ||
| Ham's F12 | Gibco | 31765-027 | Plastic compression section 4 |
| Hematoxylin | Histolab | 1820 | Immunocytochemistry; Section 6 |
| Humidity chamber | DALAB | Immunocytochemistry; Section 6 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | In vitro culture; Section 5 |
| Hydrogen peroxide Solution 30% | Sigma-Aldrich | H1009 | Immunocytochemistry; Section 6 |
| Insulin | Sigma-Aldrich | I3536 | In vitro culture; Section 5 |
| Isoflurane | Isoflurane, Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Lidocaine 5 mg/ml | Xylocaine, AstraZeneca, Sweden | Preparing the animal for surgery, Section 1 | |
| Lucose 25 mg/ml | Baxter, Deerfield, IL | Preparing the animal for surgery, Section 1 | |
| Marker pen pap pen | Sigma-Aldrich | Z377821-1EA | Immunocytochemistry; Section 6 |
| Medetomidine 25 μg/kg | Domitor, Orion Pharma, Sweden | Preparing the animal for surgery, Section 1 | |
| Mincing device | Applied Tissue Technologies LLC | Minced tissue preparation, section 2 | |
| Monocryl (absorbable monofilament) | Ethicon | Surgery, Section 1 | |
| NaCl | Sigma-Aldrich | S7653 | Immunocytochemistry; Section 6 |
| NaOH 1 N | Merck Millipore | 106462 | Plastic compression section 4 and cell culture |
| Nylon mesh, 110 μM thick pore size 0.04 sqmm | Plastic compression; Section 4 | ||
| Oculentum simplex APL: ointment for eye protection | APL | Vnr 336164 | Surgery, Section 1 |
| PBS | Gibco | 14190-094 | Plastic compression section 4 |
| Penicillin-Streptomycin | Gibco | 15140-122 | Plastic compression section 4 |
| Phenobarbiturate 15 mg/kg | Pentobarbital, APL, Sweden | Preparing the animal for surgery, Section 1 | |
| PCL Knitted fabric | Plastic compression; Section 4 | ||
| Rat-tail collagen | First LINK, Ltd, UK | 60-30-810 | Plastic compression section 4, keep on ice |
| Scalpel blade - 15 | Preparing the animal for surgery, Section 1 | ||
| Shaving shears | Preparing the animal for surgery, Section 1 | ||
| Stainless stell mesh, 400 μM thick pore size | Plastic compression; Section 4 | ||
| Steril gloves | Preparing the animal for surgery, Section 1 | ||
| Sterile gowns | Preparing the animal for surgery, Section 1 | ||
| Sterile drapes | |||
| Sterilium | Bode Chemie HAMBURG | Preparing the animal for surgery, Section 1 | |
| Suture Thread Ethilon | Preparing the animal for surgery, Section 1 | ||
| TE-solution (antigen unmasking solution) consist of 10 mM Tris and 1 mM EDTA, pH 9.0 | 10 mM Tris/1 mM EDTA, adjust pH to 9.0 | ||
| Tiletamine hypochloride 2.5 mg/kg | Preparing the animal for surgery, Section 1 | ||
| Transferrin | Sigma-Aldrich | T8158 | In vitro culture; Section 5 |
| Trizma Base, H2NC | Sigma-Aldrich | T6066 | Immunocytochemistry; Section 6 |
| Vector VIP kit: Enzyme peroxidase substrate kit | Vector | SK4600 | Immunocytochemistry; Section 6 |
| Vicryl (absorbable braded) | Ethicon | Surgery, Section 1 | |
| Tris buffer pH 7.6 (washing buffer) | TE solution: Make 10x (0.5 M Tris, 1.5 M NaCl) by mixing: 60.6 g Tris (Trizma Base, H2NC(CH2OH)3, M=121.14 g/mol), add 800 ml distilled water adjust the pH till 7.6, add 87.7 g NaCl and fill to 1,000 ml with distilled water. Dilute to 1x with distilled water. | ||
| X-tra solv (solvent) | DALAB | 41-5213-810 | Immunocytochemistry; Section 6. Use under fume hood |
| Zolazepam hypochloride | Zoletil, Virbac, France | Preparing the animal for surgery, Section 1 | |
| Depilatory wax strips | Veet | Preparing the animal for surgery, Section 1 | |
| Pentobarbital sodium | Lundbeck | Termination, Section 3 |
Riferimenti
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6, 331-343 (1975).
- Fossum, M., Nordenskjold, A., Kratz, G. Engineering of multilayered urinary tissue in vitro. Tissue Engineering. 10, 175-180 (2004).
- Salmikangas, P., et al. Manufacturing, characterization and control of cell-based medicinal products: challenging paradigms toward commercial use. Regen Med. 10, 65-78 (2015).
- Fossum, M., et al. Minced skin for tissue engineering of epithelialized subcutaneous tunnels. Tissue Engineering. Part A. 15, 2085-2092 (2009).
- Fossum, M., et al. Minced urothelium to create epithelialized subcutaneous conduits. The Journal of Urology. 184, 757-761 (2010).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. L., Nordenskjold, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. BioMed Research International. 2013, 212734 (2013).
- Meek, C. P. Successful microdermagrafting using the Meek-Wall microdermatome. Am J Surg. 96, 557-558 (1958).
- Tanner, J. C., Vandeput, J., Olley, J. F. The Mesh skin graft. Plastic and Reconstructive Surgery. 34, 287-292 (1964).
- Svensjo, T., et al. Autologous skin transplantation: comparison of minced skin to other techniques. The Journal of Surgical Research. 103, 19-29 (2002).
- Ajalloueian, F., Zeiai, S., Rojas, R., Fossum, M., Hilborn, J. One-stage tissue engineering of bladder wall patches for an easy-to-use approach at the surgical table. Tissue Engineering. Part C, Methods. 19, 688-696 (2013).
- Engelhardt, E. M., et al. A collagen-poly(lactic acid-co-varepsilon-caprolactone) hybrid scaffold for bladder tissue regeneration. Biomaterials. 32, 3969-3976 (2011).
- Brown, R. A., Wiseman, M., Chuo, C. B., Cheema, U., Nazhat, S. N. Ultrarapid engineering of biomimetic materials and tissues: fabrication of nano- and microstructures by plastic compression. Adv Funct Mater. 15, 1762-1770 (2005).
- Fumagalli Romario, U., Puccetti, F., Elmore, U., Massaron, S., Rosati, R. Self-gripping mesh versus staple fixation in laparoscopic inguinal hernia repair: a prospective comparison. Surg Endosc. 27, 1798-1802 (2013).
- Muangman, P., et al. Complex Wound Management Utilizing an Artificial Dermal Matrix. Annals of Plastic Surgery. 57, 199-202 (2006).
- Ajalloueian, F., Zeiai, S., Fossum, M., Hilborn, J. G. Constructs of electrospun PLGA, compressed collagen and minced urothelium for minimally manipulated autologous bladder tissue expansion. Biomaterials. 35, 5741-5748 (2014).
- Orabi, H., AbouShwareb, T., Zhang, Y., Yoo, J. J., Atala, A. Cell-seeded tubularized scaffolds for reconstruction of long urethral defects: a preclinical study. Eur Urol. 63, 531-538 (2013).
- Blais, M., Parenteau-Bareil, R., Cadau, S., Berthod, F. Concise review: tissue-engineered skin and nerve regeneration in burn treatment. Stem Cells Transl Med. 2, 545-551 (2013).
- Serpooshan, V., Muja, N., Marelli, B., Nazhat, S. N. Fibroblast contractility and growth in plastic compressed collagen gel scaffolds with microstructures correlated with hydraulic permeability. J Biomed Mater Res A. 96, 609-620 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon