Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento y caracterización de los ligamentos uterosacros murinos y órganos del suelo pélvico
En este artículo
Resumen
Este artículo presenta un protocolo detallado para diseccionar ligamentos uterosacros y otros tejidos del piso pélvico, incluyendo el cuello uterino, el recto y la vejiga en ratones, para ampliar el estudio de los tejidos reproductivos femeninos.
Resumen
El prolapso de órganos pélvicos (POP) es una afección que afecta la integridad, la estructura y el soporte mecánico del suelo pélvico. Los órganos en el piso pélvico están soportados por diferentes estructuras anatómicas, incluidos músculos, ligamentos y fascia pélvica. El ligamento uterosacro (USL) es una estructura crítica de carga, y la lesión del USL resulta en un mayor riesgo de desarrollar POP. El presente protocolo describe la disección de USL murinas y los órganos del suelo pélvico junto con la adquisición de datos únicos sobre la composición y función bioquímica de USL utilizando espectroscopia Raman y la evaluación del comportamiento mecánico. Los ratones son un modelo invaluable para la investigación preclínica, pero diseccionar el USL murino es un proceso difícil e intrincado. Este procedimiento presenta un enfoque para guiar la disección de los tejidos murinos del suelo pélvico, incluida la USL, para permitir múltiples evaluaciones y caracterización. Este trabajo tiene como objetivo ayudar a la disección de los tejidos del suelo pélvico por científicos e ingenieros básicos, ampliando así la accesibilidad de la investigación sobre el USL y las condiciones del suelo pélvico y el estudio preclínico de la salud de la mujer utilizando modelos de ratón.
Introducción
Aproximadamente 50% de las mujeres están afectadas por el prolapso de órganos pélvicos (POP)1,2. Alrededor del 11% de estas mujeres cumplen con los criterios para someterse a una reparación quirúrgica, que tiene una baja tasa de éxito (~ 30%)3,4. El POP se caracteriza por el descenso de cualquiera o todos los órganos pélvicos (es decir, vejiga, útero, cuello uterino y recto) de su posición natural debido a la falla de los músculos del USL y del piso pélvico para proporcionar un soporte adecuado5. Esta condición implica disfunción anatómica y alteración del tejido conectivo, así como lesión neuromuscular, además de factores predisponentes 3,6. El POP se asocia con múltiples factores como la edad, el peso, la paridad y el tipo de parto (es decir, partos vaginales o cesáreas). Se cree que estos factores afectan la integridad mecánica de todos los tejidos del suelo pélvico, y se cree que el embarazo y la paridad son los principales impulsores de la POP 5,7,8.
Los ligamentos uterosacros (USL) son estructuras de soporte importantes para el útero, el cuello uterino y la vagina y atan el cuello uterino al sacro4. El daño a los USL pone a las mujeres en mayor riesgo de desarrollar POP. Se cree que el embarazo y el parto imponen una presión adicional sobre el USL, lo que potencialmente induce lesiones y aumenta las posibilidades de POP. La USL es un tejido complejo compuesto de células musculares lisas, vasos sanguíneos y linfáticos distribuidos heterogéneamente a lo largo del ligamento, que se puede dividir en tres secciones distintas: cervical, intermedia y región sacra9. La integridad mecánica de la USL se deriva de componentes de la matriz extracelular (ECM) como colágenos, elastina y proteoglicanos 5,9,10. Se sabe que las fibras de colágeno tipo I son un componente de tracción importante que soporta la carga de los tejidos ligamentosos y, por lo tanto, es probable que estén involucradas en la falla de USL y POP11.
Hay una falta de conocimiento con respecto a las causas, la prevalencia y los efectos del POP en las mujeres. El desarrollo de un modelo animal apropiado de COP es necesario para avanzar en nuestra comprensión del suelo pélvico femenino. Los ratones y los humanos tienen puntos de referencia anatómicos similares dentro de la pelvis, como los uréteres, el recto, la vejiga, los ovarios y los ligamentos redondos9, así como puntos de intersección similares de la USL con el útero, el cuello uterino y el sacro. Además, los ratones ofrecen facilidad de manipulación genética y tienen el potencial de ser un modelo rentable y de fácil acceso para el estudio de POP9.
Este estudio desarrolló un método para acceder y aislar el USL y los diferentes tejidos del suelo pélvico de ratones nulíparos (es decir, nunca embarazadas). Las USL extraídas se sometieron a digestión enzimática (es decir, para eliminar colágenos y glicosaminoglicanos), se probaron para determinar la respuesta mecánica bajo carga de tracción y se evaluó su composición bioquímica en un estudio de prueba de concepto. La capacidad de aislar tejidos intactos facilitará más caracterizaciones mecánicas y bioquímicas de los componentes del suelo pélvico, que es un primer paso crucial para mejorar nuestra comprensión de los riesgos de lesiones relacionados con el parto, el embarazo y el POP.
Protocolo
Todos los experimentos y procedimientos con animales se realizaron de acuerdo con el protocolo #2705, aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Colorado Boulder. Se utilizaron ratones hembra C57BL / 6J de seis semanas de edad para el presente estudio. Los animales fueron obtenidos de una fuente comercial (ver Tabla de Materiales).
1. Preparación de animales
- Eutanasia al animal siguiendo el método aprobado institucionalmente.
NOTA: El presente estudio utilizó la inhalación deCO2 en alineación con las pautas de la Asociación Americana de Medicina Veterinaria (una tasa de desplazamiento del 30% al 70% del volumen de la cámara con CO2 por minuto), seguida de la dislocación cervical, para garantizar una eutanasia exitosa.- Trabaje bajo una capucha, si es posible, para minimizar la propagación de alérgenos en ratones. Una vez que el ratón deje de moverse y respirar, espere 2 minutos o más para verificar la falta de respuesta.
NOTA: Si el ratón está embarazada o después del parto, los cachorros deben ser sacrificados individualmente. Los cachorros E15.5 y mayores deben ser decapitados durante la disección.
- Trabaje bajo una capucha, si es posible, para minimizar la propagación de alérgenos en ratones. Una vez que el ratón deje de moverse y respirar, espere 2 minutos o más para verificar la falta de respuesta.
- Prepare la configuración de disección con una almohadilla de disección, un bisturí de 11 hojas, tijeras delgadas y afiladas curvas, dos pares de fórceps, pinzas curvas, sutura de poliglactina 5-0, un microscopio de disección y seis alfileres (Figura 1, consulte la Tabla de materiales).
- Coloque el ratón sobre la almohadilla y fije las extremidades anteriores hacia abajo (Figura 2A). Hacer una incisión de aproximadamente 1-1,5 cm en el abdomen con tijeras (Figura 2B). Use suavemente las tijeras para separar la piel en los lados craneal, caudal y lateral de la incisión (Figura 2C, D).
- Gire el ratón hacia su lado dorsal y retire suavemente la piel hacia las extremidades posteriores para alejar la piel del sitio de disección (Figura 2E-H).
- Fije el ratón en las extremidades (Figura 2I) y haga una incisión de aproximadamente 1 cm en el abdomen desde el tórax hasta la pelvis (Figura 2J).
NOTA: Asegúrese de no dañar los órganos subyacentes. - Empuje suavemente los órganos hacia el tórax para despejar el campo de visión (Figura 2K).
NOTA: Irrigar los tejidos con 1x PBS para mantener la hidratación. - Limpie todo el tejido graso del piso pélvico (Figura 2L-N).
NOTA: Use fórceps para extraer suavemente y eliminar la grasa de los órganos y tejidos de interés.

Figura 1: Un espacio de trabajo limpio con todas las herramientas necesarias para realizar las disecciones. Haga clic aquí para ver una versión más grande de esta figura.
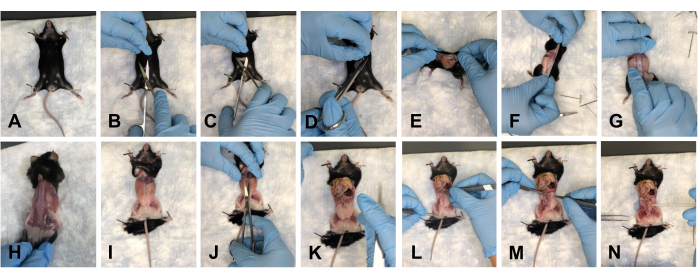
Figura 2: Eliminación de la piel y apertura de las cavidades pélvica y torácica del ratón. (A) Fijación de todas las extremidades. (B) Incisión inicial. (C) Separar la piel de la fascia subyacente con tijeras. (D) Corte de la piel y preparación para la extracción. (E-G) Arrancar la piel dando vueltas alrededor del ratón. (H) Eliminar completamente la piel del lado dorsal. (I) Eliminación completa de la piel del torso y recolocación de las extremidades del ratón. (J) Abertura del abdomen. (K) Vista del abdomen abierto. (L) Mover los órganos fuera del campo de visión. (M) Eliminación de la grasa. (N) Vista del suelo pélvico despejado. Haga clic aquí para ver una versión más grande de esta figura.
2. Cosecha USL
- Corte los cuernos uterinos de los ovarios (Figura 3B), retírese del campo de visión y corte en la conexión cervical (Figura 3C).
NOTA: Los cuernos uterinos se pueden identificar siguiendo el esquema de la Figura 3A. Irrigar los tejidos con 1x PBS para mantener la hidratación. - Corte los uréteres lejos de la conexión de la vejiga (Figura 3D).
NOTA: Esto es para evitar confusiones con la USL. - Corte el colon lo más cerca posible del cuello uterino (Figura 3E, F).
NOTA: Irrigar los tejidos con 1x PBS para mantener la hidratación. - Coloque el ratón junto con la almohadilla de disección debajo del ámbito de disección para visualizar los USL (Figura 3G).
- Use suavemente los fórceps para limpiar la grasa circundante de las USL.
NOTA: Use un segundo par de fórceps para sostener el cuello uterino en un ángulo pequeño para mejorar la visualización de dónde se cruza el USL con el cuello uterino. Irrigar los tejidos con 1x PBS para mantener la hidratación. - Ate una sutura de poliglactina 5-0 alrededor del extremo cervical de ambas USL (Figura 4B, C).
NOTA: Los USL se pueden identificar utilizando las imágenes esquemáticas y de ampliación (Figura 4I-K) - En este estudio, se utiliza una USL para análisis morfológicos o bioquímicos (es decir, microscopía Raman, inmunohistoquímica, histología). Corte el extremo cervical de la USL, dejando un pedazo del cuello uterino unido, y corte un pedazo de músculo de la parte inferior de la USL (Figura 4D). Coloque el tejido disecado en un baño con 1x PBS para mantener el tejido hidratado (Figura 4G, H).
- Utilice el USL restante para pruebas mecánicas e imágenes. Corte el extremo cervical de la USL, dejando un pedazo de cuello uterino unido, para facilitar la configuración mecánica (Figura 4D).
NOTA: El tejido cervical actuará como un anclaje para asegurar el USL durante la prueba mecánica. - Una vez recolectados todos los tejidos de interés (pasos 3-5), dislocar los fémures de la pelvis (Figura 4E).
NOTA: Uno debe escuchar un leve chasquido cuando la cabeza femoral se desarticula de la copa acetabular. - Cortar el hueso pélvico de los extremos distal y proximal del hueso pélvico, dejando aproximadamente 10 mm de tejido total (Figura 4F). Coloque el tejido disecado en 1x PBS.

Figura 3: Suelo pélvico despejado para disección de USL . (A) Esquema de la anatomía. (B) Cortar los cuernos uterinos en la conexión ovárica. (C) Cortar cuernos uterinos. (D) Corte de los uréteres. (E) Corte del colon. (F) Una visión clara del recto y los USL. (G) Colocar el mouse y la almohadilla de disección debajo del alcance de disección. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Vista del USL y los tejidos circundantes y disección de los USL. (A) Esquema de puntos de referencia anatómicos que rodean el USL. (B) Atar una sutura alrededor de los extremos cervicales. (C) Cortar los extremos cervicales de la USL. (D) Corte del USL para ser utilizado para los análisis bioquímicos en la conexión sacra. (E) Corte de los fémures del hueso pélvico. (F) Cortar el extremo proximal de la pelvis. (G) Disección del USL en una placa de Petri de 35 mm. (H) El USL con la pelvis unida en una placa de Petri de 35 mm. (I) El USL y el recto con un aumento de 0,75x. (J) Eliminación de grasa de la USL. (K) Limpieza de los USL con un aumento de 1,0x. Barra de escala = 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
3. Recolección de vejiga
- Después de eliminar la grasa, sostenga la vejiga con los fórceps y levántela suavemente en un ángulo de aproximadamente 40° (Figura 5A).
- Con las tijeras, corte la vejiga desde el lado distal, justo encima del cuello uterino (Figura 5B).
- Coloque el tejido en un baño con 1x PBS para mantener el tejido hidratado (Figura 5H).
4. Recolección del recto
- Una vez que las USL se desconectan del cuello uterino y se disecciona la vejiga, levante el cuello uterino en un ángulo de aproximadamente 40 ° con los fórceps. Existe la fascia rectovaginal que conecta el recto y el cuello uterino. Con el bisturí, corte suavemente esta conexión (Figura 5C, D).
- Cortar el hueso púbico en la sínfisis púbica con tijeras. Amplíe suavemente el espacio de trabajo para aumentar el acceso visual a las inserciones de tejido.
- Con los fórceps, tire suavemente del recto hacia el tórax y use las tijeras para seguir el recto desde su lado posterior hasta el ano. Cortar el recto en el ano (Figura 5E).
- Coloque el tejido en 1x PBS para mantener el tejido hidratado (Figura 5I).
5. Recolección del complejo cérvix-vagina
- Después de extraer las USL del cuello uterino, use los fórceps para sostener el cuello uterino. Corte el cuello uterino lo más cerca posible de la vulva con tijeras (Figura 5F, G).
NOTA: Asegúrese de cortar la sínfisis púbica para ver visualmente el extremo distal de la vagina. - Coloque el tejido en 1x PBS para mantener el tejido hidratado (Figura 5J).
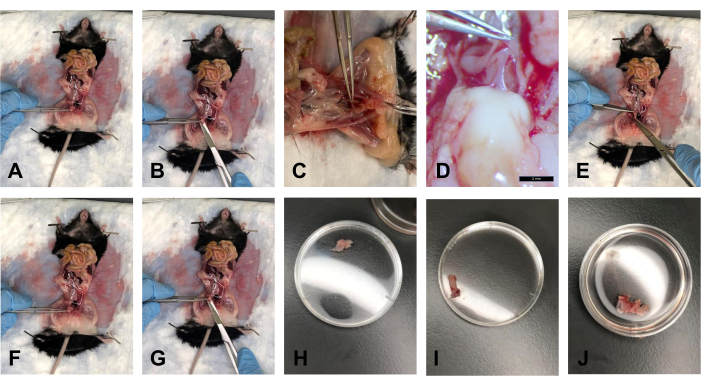
Figura 5: Disecciones de vejiga, recto y cuello uterino/vagina . (A) Sostener la vejiga en ángulo. (B) Cortar la vejiga. (C) Cortar el tendón que conecta el cuello uterino y el recto. (D) El tendón con un aumento de 1.0x. (E) Corte del recto. (F) Agarrar el cuello uterino con fórceps. (G) Corte en el extremo distal de la vagina. (H) La vejiga en una placa de Petri de 35 mm. (I) El recto en una placa de Petri de 35 mm. (J) El complejo tejido cérvix-vagina en una placa de Petri de 35 mm. Haga clic aquí para ver una versión más grande de esta figura.
6. Preparación de la muestra para la caracterización tisular
- Análisis mecánicos y visuales de la USL
- Coloque el USL con el accesorio pélvico sobre una pared en forma de T dentro de un pocillo de tinción personalizado para garantizar una inmersión total en la solución de tinción (los dibujos CAD del pozo se pueden encontrar en el Archivo de codificación suplementario 1 y en el Archivo de codificación complementaria 2).
NOTA: Use sutura y fórceps para ayudar con la colocación. - Diluir un colorante disponible comercialmente que tiñe grupos amina libres (5 μL, ver Tabla de materiales) en 2.5 ml de 1x PBS, agregar la solución al pozo de tinción personalizado y teñir el tejido durante 2 h en un balancín a 4 ° C.
NOTA: Vortex la solución antes de agregarla al pozo de tinción. - Durante los últimos 15 minutos de tinción, agregue 2.5 μL de una tinción de núcleos de células muertas disponible comercialmente (consulte la Tabla de materiales) a la solución.
NOTA: Vortex la solución antes de agregarla al pozo de tinción.
- Coloque el USL con el accesorio pélvico sobre una pared en forma de T dentro de un pocillo de tinción personalizado para garantizar una inmersión total en la solución de tinción (los dibujos CAD del pozo se pueden encontrar en el Archivo de codificación suplementario 1 y en el Archivo de codificación complementaria 2).
- Análisis Raman de los USL
- Fije el USL en línea recta en un bloque de polidimetilsiloxano (PDMS) que está contenido en un pocillo personalizado.
NOTA: El PDMS se utiliza como sustrato blando para permitir la fijación de la muestra en la configuración deseada. Se pueden hacer bloques de diferentes dimensiones mezclando los dos componentes siguiendo las instrucciones del fabricante (consulte la Tabla de materiales), fundiendo en una placa de Petri y, después de la polimerización, cortando el PDMS en la geometría requerida con una cuchilla de bisturí. - Pin con alfileres de insectos en el asa de sutura y en el músculo pélvico. Hidratar el tejido con 1x PBS.
- Fije el USL en línea recta en un bloque de polidimetilsiloxano (PDMS) que está contenido en un pocillo personalizado.
- Tejidos restantes
- Congele rápidamente los tejidos restantes con nitrógeno líquido o en un compuesto de incrustación apropiado, dependiendo de los análisis deseados.
- Guardar los tejidos a -80 °C hasta análisis posteriores (p. ej., ensayos inmunohistoquímicos o bioquímicos).
Resultados
Cada paso de la disección de un ratón de tipo salvaje se detalla en el vídeo asociado y las figuras relacionadas con el protocolo. Para este estudio, se utilizaron ratones hembra C57BL/6J de 6 semanas de edad (Tabla suplementaria 1). Se analizaron tres grupos de muestra con USL tratados con diferentes enzimas: control (ningún tratamiento), tratados con colagenasa y grupos tratados con condroitinasa. El músculo liso, los nervios y los linfáticos en la USL están rodeados por una ECM rica en colágen...
Discusión
El efecto del daño estructural en los tejidos reproductivos femeninos está poco estudiado, y se necesita un modelo animal de fácil acceso para la investigación de COP. El ratón es un modelo rentable que puede imitar los estudios reproductivos humanos16. Debido al creciente interés en el estudio del sistema reproductor femenino, existe la necesidad de métodos que ayuden al estudio de estos tejidos. Para abordar esta necesidad, en este trabajo, se establece un método para diseccionar y prepa...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la subvención del Programa de Oportunidades de Investigación Subterránea de Verano (UROP) de CU Boulder (CB), la Beca de Investigación de Posgrado de NSF (L.S.), la Beca de Ciencias Schmidt (CL), el Programa de Subvenciones de Semillas de Investigación e Innovación de la Universidad de Colorado (premio 2020 a V.F., S.C. y K.C.) y la Beca Anschutz Boulder Nexus Seed en la Universidad de Colorado (a V.F. y K.C.). Un reconocimiento especial para el Dr. Tyler Tuttle por su ayuda con el diseño de la cámara de carga, así como para los miembros del laboratorio Calve por sus útiles discusiones.
Materiales
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
Referencias
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados