Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение и характеристика маточно-крестцовых связок и органов тазового дна у мышей
В этой статье
Резюме
В этой статье представлен подробный протокол рассечения маточно-крестцовых связок и других тканей тазового дна, включая шейку матки, прямую кишку и мочевой пузырь у мышей, для расширения изучения женских репродуктивных тканей.
Аннотация
Пролапс тазовых органов (POP) — это состояние, которое влияет на целостность, структуру и механическую поддержку тазового дна. Органы тазового дна поддерживаются различными анатомическими структурами, включая мышцы, связки и тазовые фасции. Маточно-крестцовая связка (УЗЛ) является критической несущей конструкцией, и повреждение УЗЛ приводит к более высокому риску развития СОЗ. В настоящем протоколе описывается вскрытие УЗЛ мышей и органов тазового дна, а также получение уникальных данных о биохимическом составе и функции УЗЛ с использованием рамановской спектроскопии и оценки механического поведения. Мыши являются бесценной моделью для доклинических исследований, но препарирование мышиного USL является трудным и запутанным процессом. Эта процедура представляет собой подход, направленный на диссекцию тканей тазового дна мышей, включая USL, для проведения множественных оценок и характеристик. Эта работа направлена на то, чтобы помочь фундаментальным ученым и инженерам в рассечении тканей тазового дна, тем самым расширяя доступность исследований USL и состояний тазового дна, а также доклинических исследований женского здоровья с использованием мышиных моделей.
Введение
Примерно 50% женщин страдают пролапсом тазовых органов (СОЗ)1,2. Около 11% этих женщин соответствуют критериям хирургического вмешательства, которое имеет низкий уровень успеха (~ 30%)3,4. СОЗ характеризуется опущением любого или всех органов малого таза (т.е. мочевого пузыря, матки, шейки матки и прямой кишки) из их естественного положения из-за неспособности USL и мышц тазового дна обеспечить адекватную поддержку5. Это состояние включает анатомическую дисфункцию и разрушение соединительной ткани, а также нервно-мышечное повреждение, в дополнение к предрасполагающим факторам 3,6. СОЗ связан с множеством факторов, таких как возраст, вес, паритет и тип родов (например, вагинальные или кесарево сечение). Считается, что эти факторы влияют на механическую целостность всех тканей тазового дна, при этом беременность и паритет считаются основными факторами POP 5,7,8.
Маточно-крестцовые связки (USL) являются важными поддерживающими структурами для матки, шейки матки и влагалища и связывают шейку матки с крестцом4. Повреждение USL подвергает женщин повышенному риску развития СОЗ. Считается, что беременность и роды накладывают дополнительную нагрузку на USL, что потенциально вызывает травму и увеличивает вероятность СОЗ. USL представляет собой сложную ткань, состоящую из гладкомышечных клеток, кровеносных сосудов и лимфатических сосудов, неоднородно распределенных вдоль связки, которые можно разделить на три отдельных отдела: шейный, промежуточный и крестцовый регион9. Механическая целостность USL обусловлена компонентами внеклеточного матрикса (ECM), такими как коллагены, эластин и протеогликаны 5,9,10. Известно, что коллагеновые волокна типа I являются основным несущим растягивающим компонентом связочных тканей и, следовательно, вероятно, участвуют в разрушении USL и POP11.
Существует недостаток знаний о причинах, распространенности и последствиях СОЗ у женщин. Разработка соответствующей модели СОЗ на животных необходима для углубления нашего понимания женского тазового дна. Мыши и люди имеют сходные анатомические ориентиры в тазу, такие как мочеточники, прямая кишка, мочевой пузырь, яичники и круглые связки9, а также сходные точки пересечения USL с маткой, шейкой матки и крестцом. Кроме того, мыши обеспечивают простоту генетических манипуляций и могут стать легкодоступной и экономически эффективной моделью для изучения СОЗ9.
В этом исследовании был разработан метод доступа и изоляции USL и различных тканей тазового дна у нерожавших (т.е. никогда не беременных) мышей. Экстрагированные USL подвергали ферментативному расщеплению (т.е. удалению коллагенов и гликозаминогликанов), тестировали для определения механической реакции при растягивающей нагрузке и оценивали биохимический состав в экспериментальном исследовании. Способность изолировать неповрежденные ткани будет способствовать дальнейшим механическим и биохимическим характеристикам компонентов тазового дна, что является важным первым шагом на пути к улучшению нашего понимания рисков травм, связанных с родами, беременностью и СОЗ.
протокол
Все эксперименты и процедуры на животных проводились в соответствии с протоколом #2705, одобренным Комитетом по уходу за животными и их использованию Университета Колорадо в Боулдере. Для настоящего исследования были использованы шестинедельные самки мышей C57BL / 6J. Животные были получены из коммерческого источника (см. Таблицу материалов).
1. Подготовка животных
- Усыпьте животное в соответствии с официально утвержденным методом.
ПРИМЕЧАНИЕ: В настоящем исследовании использовалась ингаляция CO 2 в соответствии с рекомендациями Американской ветеринарной медицинской ассоциации (скорость смещения от 30% до 70% объема камеры с CO2 в минуту) с последующим вывихом шейки матки для обеспечения успешной эвтаназии.- Работайте под капотом, если это возможно, чтобы свести к минимуму распространение мышей аллергенов. Как только мышь перестанет двигаться и дышать, подождите 2 минуты или более, чтобы убедиться в отсутствии ответа.
ПРИМЕЧАНИЕ: Если мышь беременна или находится в послеродовом периоде, щенки должны быть индивидуально усыплены. Щенки E15.5 и старше должны быть обезглавлены во время вскрытия.
- Работайте под капотом, если это возможно, чтобы свести к минимуму распространение мышей аллергенов. Как только мышь перестанет двигаться и дышать, подождите 2 минуты или более, чтобы убедиться в отсутствии ответа.
- Подготовьте установку для вскрытия с помощью диссекционной подушечки, скальпеля с 11 лезвиями, изогнутых тонких острых ножниц, двух пар щипцов, изогнутых щипцов, полиглактинового шва 5-0, препарирующего микроскопа и шести штифтов (рис. 1, см. Таблицу материалов).
- Поместите мышь на коврик и прижмите передние конечности (рисунок 2A). Сделайте разрез примерно 1-1,5 см в области живота ножницами (рис. 2Б). Аккуратно используйте ножницы, чтобы отделить кожу на краниальной, каудальной и боковой сторонах разреза (рис. 2C, D).
- Переверните мышь на спинную сторону и осторожно оттяните кожу к задним конечностям, чтобы удалить кожу с места рассечения (рис. 2E-H).
- Прижмите мышь к конечностям (рис. 2I) и сделайте разрез примерно на 1 см в брюшной полости от грудной клетки до таза (рис. 2J).
ПРИМЕЧАНИЕ: Следите за тем, чтобы не повредить нижележащие органы. - Осторожно подтолкните органы к грудной клетке, чтобы очистить поле зрения (рис. 2K).
ПРИМЕЧАНИЕ: Орошите ткани 1x PBS для поддержания гидратации. - Очистите тазовое дно от всей жировой ткани (рис. 2L-N).
ПРИМЕЧАНИЕ: Используйте щипцы, чтобы аккуратно вытянуть и очистить от жира интересующие органы и ткани.

Рисунок 1: Чистое рабочее пространство со всеми инструментами, необходимыми для выполнения вскрытия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
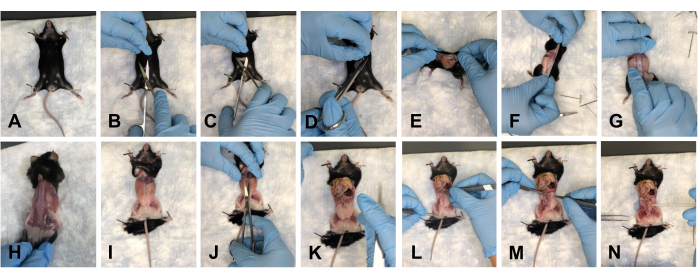
Рисунок 2: Удаление кожи и вскрытие тазовой и грудной полостей мыши. (А) Придавливание всех конечностей. (B) Начальный разрез. (C) Отделение кожи от нижележащей фасции с помощью ножниц. (D) Срезание кожи и подготовка к удалению. (Э-Г) Стягивание кожи, обходя мышь. (H) Полное удаление кожи со спинной стороны. (I) Полное снятие кожи с туловища и повторное закрепление конечностей мыши. (J) Вскрытие брюшной полости. (K) Вид на открытую брюшную полость. (L) Выведение органов из поля зрения. (М) Удаление жира. (N) Вид очищенного тазового дна. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Сбор урожая USL
- Отрежьте рога матки от яичников (рис. 3В), отодвиньте от поля зрения и отрежьте в месте шейного соединения (рис. 3В).
ПРИМЕЧАНИЕ: Рога матки можно идентифицировать по схеме на рисунке 3А. Орошите ткани 1x PBS для поддержания гидратации. - Отрежьте мочеточники от соединения мочевого пузыря (рис. 3D).
ПРИМЕЧАНИЕ: Это сделано для того, чтобы избежать путаницы с USL. - Разрежьте толстую кишку как можно ближе к шейке матки (рис. 3E, F).
ПРИМЕЧАНИЕ: Орошите ткани 1x PBS для поддержания гидратации. - Поместите мышь вместе с диссекционной площадкой под препарирующий прицел, чтобы визуализировать USL (рис. 3G).
- Аккуратно используйте щипцы, чтобы очистить окружающий жир от USL.
ПРИМЕЧАНИЕ: Используйте вторую пару щипцов, чтобы удерживать шейку матки под небольшим углом, чтобы улучшить визуализацию места пересечения USL с шейкой матки. Орошите ткани 1x PBS для поддержания гидратации. - Завяжите полиглактиновый шов 5-0 вокруг шейного конца обоих USL (рис. 4B, C).
ПРИМЕЧАНИЕ: USL можно идентифицировать по схематическим изображениям и изображениям увеличения (рис. 4I-K) - В этом исследовании один USL используется для морфологических или биохимических анализов (т.е. рамановской микроскопии, иммуногистохимии, гистологии). Отрежьте шейный конец USL, оставив прикрепленным кусочек шейки матки, и отрежьте кусочек мышцы от нижней части USL (рис. 4D). Поместите рассеченную ткань в ванну с 1x PBS, чтобы сохранить ткань увлажненной (рис. 4G, H).
- Используйте оставшийся USL для механических испытаний и визуализации. Отрежьте шейный конец USL, оставив прикрепленным кусок шейки матки, чтобы облегчить механическую настройку (рис. 4D).
ПРИМЕЧАНИЕ: Ткань шейки матки будет действовать как якорь для закрепления USL во время механического испытания. - После того, как все интересующие ткани будут собраны (этапы 3-5), вывихните бедренные кости из таза (рис. 4E).
ПРИМЕЧАНИЕ: Следует услышать слабый щелкающий звук, когда головка бедренной кости отделена от вертлужной впадины. - Отрежьте тазовую кость от дистального и проксимального концов тазовой кости, оставив около 10 мм общей ткани (рис. 4F). Поместите рассеченную ткань в 1x PBS.

Рисунок 3: Очищенное тазовое дно для рассечения USL . (А) Схема анатомии. (Б) Обрезание рогов матки в месте соединения яичников. (С) Отсечение рогов матки. (D) Сокращение мочеточников. (E) Разрезание толстой кишки. (F) Четкое представление о прямой кишке и USL. (G) Размещение мыши и вскрытия под препарирующей областью. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Вид USL и окружающих тканей и вскрытие USL. (A) Схема анатомических ориентиров, окружающих USL. (B) Наложение шва на кончики шейки матки. (C) Отрезание шейных концов USL. (D) Отрезание USL для использования для биохимических анализов в сакральной связи. (E) Отрезание бедренной кости от тазовой кости. (F) Отсечение проксимального конца таза. (G) Препарирование USL в чашке Петри диаметром 35 мм. (H) USL с прикрепленным тазом в чашке Петри диаметром 35 мм. (I) USL и прямая кишка при 0,75-кратном увеличении. (J) Удаление жира из USL. (K) Очистка USL при 1,0-кратном увеличении. Масштабная линейка = 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Забор мочевого пузыря
- После того, как жир очистится, возьмитесь за мочевой пузырь щипцами и осторожно поднимите его под углом примерно 40° (рис. 5A).
- Ножницами отрежьте мочевой пузырь с дистальной стороны, прямо над шейкой матки (рис. 5B).
- Поместите салфетку в ванну с 1x PBS, чтобы ткань оставалась увлажненной (рис. 5H).
4. Забор прямой кишки
- После того, как USL отсоединены от шейки матки и мочевой пузырь рассечен, поднимите шейку матки под углом примерно 40° щипцами. Существует ректовагинальная фасция, которая соединяет прямую кишку и шейку матки. Скальпелем аккуратно разрежьте это соединение (рис. 5В, Г).
- Разрежьте лобковую кость в месте лобкового симфиза с помощью ножниц. Аккуратно расширьте рабочее пространство, чтобы увеличить визуальный доступ к тканям.
- С помощью щипцов осторожно потяните прямую кишку к грудной клетке и используйте ножницы, чтобы проследить прямую кишку от задней стороны до ануса. Разрежьте прямую кишку в области заднего прохода (рис. 5Е).
- Поместите салфетку в 1x PBS, чтобы ткань оставалась увлажненной (рис. 5I).
5. Комплексный забор шейки матки и влагалища
- После того, как USL будут удалены из шейки матки, используйте щипцы, чтобы удерживать шейку матки. Разрежьте шейку матки как можно ближе к вульве с помощью ножниц (рис. 5F, G).
ПРИМЕЧАНИЕ: Обязательно разрезайте лобковый симфиз, чтобы визуально увидеть дистальный конец влагалища. - Поместите салфетку в 1x PBS, чтобы ткань оставалась увлажненной (рис. 5J).
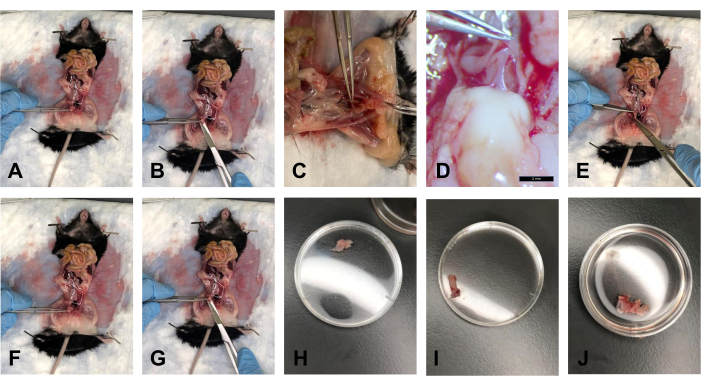
Рисунок 5: Расслоения мочевого пузыря, прямой кишки и шейки матки / влагалища . (А) Удержание мочевого пузыря под углом. (Б) Отсечение мочевого пузыря. (C) Разрезание сухожилия, соединяющего шейку матки и прямую кишку. (D) Сухожилие при 1,0-кратном увеличении. (E) Разрезание прямой кишки. (F) Держание за шейку матки щипцами. (G) Разрез в дистальном конце влагалища. (H) Мочевой пузырь в чашке Петри диаметром 35 мм. (I) Прямая кишка в чашке Петри диаметром 35 мм. (J) Комплекс тканей шейки матки и влагалища в чашке Петри диаметром 35 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Пробоподготовка для характеристики тканей
- Механический и визуальный анализ USL
- Поместите USL с тазовым креплением на Т-образную стенку в специальном окрашивающем колодце, чтобы обеспечить полное погружение в окрашивающий раствор (чертежи САПР лунки можно найти в файле дополнительного кодирования 1 и файле дополнительного кодирования 2).
ПРИМЕЧАНИЕ: Используйте швы и щипцы, чтобы помочь с размещением. - Разбавьте имеющийся в продаже краситель, окрашивающий свободные аминогруппы (5 мкл, см. Таблицу материалов), в 2,5 мл 1x PBS, добавьте раствор в специальное окрашивание и окрашивайте ткань в течение 2 ч на коромысле при 4 ° C.
ПРИМЕЧАНИЕ: Перемешайте раствор перед добавлением его в лунку для окрашивания. - В течение последних 15 мин окрашивания добавьте в раствор 2,5 мкл коммерчески доступного окрашивания ядер мертвых клеток (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Перемешайте раствор перед добавлением в окрашивающую лунку.
- Поместите USL с тазовым креплением на Т-образную стенку в специальном окрашивающем колодце, чтобы обеспечить полное погружение в окрашивающий раствор (чертежи САПР лунки можно найти в файле дополнительного кодирования 1 и файле дополнительного кодирования 2).
- Рамановский анализ USL
- Закрепите USL по прямой линии на блоке полидиметилсилоксана (PDMS), который содержится в специальной скважине.
ПРИМЕЧАНИЕ: PDMS используется в качестве мягкой подложки для закрепления образца в желаемой конфигурации. Блоки различных размеров могут быть изготовлены путем смешивания двух компонентов в соответствии с инструкциями производителя (см. Таблицу материалов), литья в чашке Петри и, после полимеризации, резки PDMS до требуемой геометрии с помощью лезвия скальпеля. - Приколите булавками от насекомых на шовной петле и на мышце таза. Увлажните ткань с помощью 1x PBS.
- Закрепите USL по прямой линии на блоке полидиметилсилоксана (PDMS), который содержится в специальной скважине.
- Остальные ткани
- Заморозьте оставшиеся ткани жидким азотом или в соответствующем составе, в зависимости от желаемого анализа.
- Сохраняют ткани при температуре -80 °C до последующих анализов (например, иммуногистохимических или биохимических анализов).
Результаты
Каждый шаг вскрытия мыши дикого типа подробно описан в соответствующем видео и рисунках, связанных с протоколом. Для этого исследования были использованы 6-недельные самки мышей C57BL/6J (Дополнительная таблица 1). Были проанализированы три группы образцов с USL, обработанные разли?...
Обсуждение
Влияние структурных повреждений на женские репродуктивные ткани недостаточно изучено, и для исследований СОЗ необходима легкодоступная модель на животных. Мышь является экономически эффективной моделью, которая может имитировать репродуктивные исследования человека16....
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана грантом CU Boulder Summer Underground Research Opportunities Program (UROP) (CB), стипендией NSF Graduate Research Fellowship (LS), научной стипендией Шмидта (CL), Программой грантов Университета Колорадо на исследования и инновации (награда 2020 года для V.F., S.C. и K.C.) и грантом Anschutz Boulder Nexus Seed в Университете Колорадо (для V.F. и K.C.). Особая благодарность доктору Тайлеру Таттлу за помощь в разработке загрузочной камеры, а также членам лаборатории Calve за полезные обсуждения.
Материалы
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
Ссылки
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены