A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד ואפיון רצועות הרחם ואיברי רצפת האגן
In This Article
Summary
מאמר זה מציג פרוטוקול מפורט לניתוח רצועות הרחם ורקמות אחרות של רצפת האגן, כולל צוואר הרחם, פי הטבעת ושלפוחית השתן בעכברים, כדי להרחיב את המחקר של רקמות הרבייה הנשיות.
Abstract
צניחת איברי האגן (POP) היא מצב המשפיע על שלמות, מבנה ותמיכה מכנית של רצפת האגן. האיברים ברצפת האגן נתמכים על ידי מבנים אנטומיים שונים, כולל שרירים, רצועות ופאשיה של האגן. הרצועה הרחם (USL) היא מבנה קריטי הנושא עומס, ופגיעה ב-USL גורמת לסיכון גבוה יותר לפתח POP. הפרוטוקול הנוכחי מתאר את הדיסקציה של USL מורין ואיברי רצפת האגן, לצד קבלת נתונים ייחודיים על ההרכב והתפקוד הביוכימי של USL באמצעות ספקטרוסקופיית ראמאן והערכת התנהגות מכנית. עכברים הם מודל רב ערך למחקר פרה-קליני, אך ניתוח USL הוא תהליך קשה ומורכב. הליך זה מציג גישה להנחיית דיסקציה של רקמות רצפת האגן, כולל USL, כדי לאפשר הערכות ואפיון מרובים. עבודה זו נועדה לסייע בנתיחת רקמות רצפת האגן על ידי מדענים ומהנדסים בסיסיים, ובכך להרחיב את הנגישות של מחקר על תנאי USL ורצפת האגן ואת המחקר הפרה-קליני של בריאות האישה באמצעות מודלים עכבריים.
Introduction
כ-50% מהנשים סובלות מצניחת איברי האגן (POP)1,2. כ -11% מנשים אלה מתאימות לקריטריונים לעבור תיקון כירורגי, שיש לו שיעור הצלחה נמוך (~ 30%)3,4. POP מאופיין בירידה של כל או כל איברי האגן (כלומר, שלפוחית השתן, הרחם, צוואר הרחם ופי הטבעת) ממקומם הטבעי עקב כישלון של USL ושרירי רצפת האגן לספק תמיכה נאותה5. מצב זה כרוך בתפקוד אנטומי ושיבוש של רקמת החיבור, כמו גם פגיעה עצבית-שרירית, בנוסףלגורמים 3,6. POP קשור למספר גורמים כגון גיל, משקל, זוגיות וסוג הלידה (כלומר, לידות נרתיקיות או קיסריות). גורמים אלה נחשבים כמשפיעים על השלמות המכנית של כל רקמות רצפת האגן, כאשר הריון וזוגיות נחשבים למניעים העיקריים של POP 5,7,8.
רצועות הרחם (USLs) הן מבנים תומכים חשובים לרחם, לצוואר הרחם ולנרתיק וקושרות את צוואר הרחם לעצה4. נזק ל-USLs מציב נשים בסיכון מוגבר לפתח POP. הוא האמין כי הריון ולידה להטיל עומס נוסף על USL, אשר עלול לגרום לפציעה ומגדיל את הסיכויים של POP. USL היא רקמה מורכבת המורכבת מתאי שריר חלקים, כלי דם ולימפה המפוזרים באופן הטרוגני לאורך הרצועה, אותם ניתן לחלק לשלושה חלקים נפרדים: צוואר הרחם, אזור הביניים ואזור העצה9. השלמות המכנית של USL נגזרת מרכיבי מטריצה חוץ-תאיים (ECM) כמו קולגן, אלסטין ופרוטאוגליקנים 5,9,10. סיבי קולגן מסוג I ידועים כמרכיב מתיחה עיקרי נושא עומס ברקמות רצועתיות, ולכן סביר להניח שהם מעורבים בכשל USL וב-POP11.
קיים חוסר ידע לגבי הסיבות, השכיחות וההשפעות של POP אצל נשים. פיתוח מודל חייתי מתאים של POP נחוץ כדי לקדם את הבנתנו את רצפת האגן הנשית. לעכברים ולבני אדם יש ציוני דרך אנטומיים דומים בתוך האגן, כגון השופכנים, פי הטבעת, שלפוחית השתן, השחלות והרצועות העגולות9, כמו גם נקודות הצטלבות דומות של USL עם הרחם, צוואר הרחם והעצה. יתר על כן, עכברים מציעים קלות של מניפולציה גנטית ויש להם פוטנציאל להיות מודל נגיש וחסכוני לחקר POP9.
מחקר זה פיתח שיטה לגשת ולבודד את USL ואת רקמות רצפת האגן השונות מעכברות Nulliparous (כלומר, מעולם לא בהריון). ה-USL שחולצו עברו עיכול אנזימטי (כלומר, כדי להסיר קולגן וגליקוזאמינוגליקנים), נבדקו כדי לקבוע את התגובה המכנית תחת עומס מתיחה, והוערכו להרכב ביוכימי במחקר הוכחת היתכנות. היכולת לבודד רקמות שלמות תאפשר אפיונים מכניים וביוכימיים נוספים של מרכיבי רצפת האגן, המהווה צעד ראשון חיוני לשיפור הבנתנו את סיכוני הפגיעה הקשורים ללידה, הריון ו- POP.
Protocol
כל הניסויים וההליכים בבעלי חיים בוצעו על פי פרוטוקול #2705, שאושר על ידי הוועדה לטיפול ושימוש בבעלי חיים של אוניברסיטת קולורדו בולדר. נקבות עכברי C57BL/6J בנות שישה שבועות שימשו במחקר הנוכחי. בעלי החיים התקבלו ממקור מסחרי (ראו טבלת חומרים).
1. הכנת בעלי חיים
- יש להרדים את בעל החיים בשיטה שאושרה במוסד.
הערה: המחקר הנוכחי השתמש בשאיפת CO 2 בהתאם להנחיות האגודה האמריקאית לרפואה וטרינרית (שיעור תזוזה של 30% עד 70% מנפח החדר עם CO2 לדקה), ואחריו פריקת צוואר הרחם, כדי להבטיח המתת חסד מוצלחת.- עבדו מתחת למכסה המנוע, במידת האפשר, כדי למזער את התפשטות האלרגנים של עכברים. ברגע שהעכבר מפסיק לזוז ולנשום, המתן 2 דקות או יותר כדי לוודא את חוסר התגובה.
הערה: אם העכבר בהריון או לאחר לידה, יש להרדים את הגורים בנפרד. יש לערוף את ראשיהם של גורים E15.5 ומעלה במהלך הנתיחה.
- עבדו מתחת למכסה המנוע, במידת האפשר, כדי למזער את התפשטות האלרגנים של עכברים. ברגע שהעכבר מפסיק לזוז ולנשום, המתן 2 דקות או יותר כדי לוודא את חוסר התגובה.
- הכינו את מערך הדיסקציה בעזרת כרית דיסקציה, אזמל בעל 11 להבים, מספריים חדים דקים ומעוקלים, שני זוגות מלקחיים, מלקחיים מעוקלים, תפר פוליגלקטין 5-0, מיקרוסקופ מנתח ושישה פינים (איור 1, ראו טבלת חומרים).
- הניחו את העכבר על הפד ונעצו את הגפיים הקדמיות כלפי מטה (איור 2A). בצעו חתך של כ-1-1.5 ס"מ בבטן בעזרת מספריים (איור 2B). השתמשו בעדינות במספריים כדי להפריד את העור בצד הגולגולתי, הקאודלי והצידי של החתך (איור 2C, D).
- הפכו את העכבר לצד הגבי שלו, וקילפו בעדינות את העור לכיוון הגפיים האחוריות כדי להסיר את העור מאתר הדיסקציה (איור 2E-H).
- הצמידו את העכבר לגפיים (איור 2I), ובצעו חתך של כ-1 ס"מ לתוך הבטן מבית החזה ועד האגן (איור 2J).
הערה: הקפד לא לפגוע באיברים הבסיסיים. - דחפו בעדינות את האיברים לכיוון בית החזה כדי לנקות את שדה הראייה (איור 2K).
הערה: השקו את הרקמות עם PBS אחד כדי לשמור על הידרציה. - נקו את כל רקמת השומן מרצפת האגן (איור 2L-N).
הערה: השתמש במלקחיים כדי למשוך בעדינות ולנקות שומן מהאיברים והרקמות המעניינים.

איור 1: סביבת עבודה נקייה עם כל הכלים הדרושים לביצוע הנתיחות. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
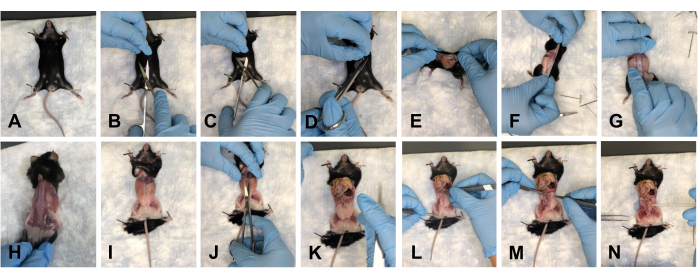
איור 2: הסרת העור ופתיחת חללי האגן ובית החזה של העכבר. (A) הצמדת כל הגפיים. (B) חתך ראשוני. (C) הפרדת העור מהפאשיה שמתחתיו באמצעות מספריים. (ד) חיתוך העור והכנה להסרה. (ה-ג) משיכת העור על ידי סיבוב העכבר. (H) הסרה מלאה של העור מהצד הגבי. (I) הסרה מלאה של העור מפלג הגוף העליון, והצמדה מחדש של גפי העכבר. (י) פתיחת הבטן. (K) מבט על הבטן הפתוחה. (L) הזזת האיברים משדה הראייה. (יג) הסרת השומן. (N) מבט על רצפת האגן הפנויה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. קציר USL
- חתכו את קרני הרחם מהשחלות (איור 3B), התרחקו משדה הראייה וחתכו בחיבור הצווארי (איור 3C).
הערה: ניתן לזהות את קרני הרחם לפי הסכמה באיור 3A. השקו את הרקמות עם PBS 1x כדי לשמור על הידרציה. - חתכו את השופכנים מחיבור שלפוחית השתן (איור 3D).
הערה: זאת כדי למנוע בלבול עם USL. - חתכו את המעי הגס קרוב ככל האפשר לצוואר הרחם (איור 3E,F).
הערה: השקו את הרקמות עם PBS אחד כדי לשמור על הידרציה. - מקם את העכבר יחד עם משטח הנתיחה מתחת לטווח הניתוח כדי להמחיש את ה-USL (איור 3G).
- השתמשו בעדינות במלקחיים כדי לנקות את השומן שמסביב מה-USL.
הערה: השתמש בזוג מלקחיים שני כדי להחזיק את צוואר הרחם למעלה בזווית קטנה כדי לשפר את ההדמיה של המקום שבו USL מצטלב עם צוואר הרחם. השקו את הרקמות עם PBS 1x כדי לשמור על הידרציה. - קשרו תפר פוליגלקטין 5-0 סביב הקצה הצווארי של שני USL (איור 4B, C).
הערה: ניתן לזהות את ה-USL באמצעות תמונות סכמות והגדלה (איור 4I-K) - במחקר זה, USL אחד משמש לניתוחים מורפולוגיים או ביוכימיים (כלומר, מיקרוסקופ ראמאן, אימונוהיסטוכימיה, היסטולוגיה). חתכו את הקצה הצווארי של ה-USL, השאירו חתיכה מצוואר הרחם מחוברת, וחתכו חתיכת שריר מתחתית ה-USL (איור 4D). הניחו את הרקמה המנותחת באמבטיה עם PBS 1x כדי לשמור על לחות הרקמה (איור 4G, H).
- השתמש ב-USL הנותר לצורך בדיקות מכניות והדמיה. חתכו את הקצה הצווארי של USL, השאירו פיסת צוואר הרחם מחוברת, כדי להקל על ההתקנה המכנית (איור 4D).
הערה: רקמת צוואר הרחם תשמש כעוגן לאבטחת USL במהלך הבדיקה המכנית. - לאחר שכל הרקמות המעניינות נקצרות (שלבים 3-5), עקרו את עצם הירך מהאגן (איור 4E).
הערה: יש לשמוע צליל נקישה קלוש כאשר ראש עצם הירך מנותק מהכוס האצטבולרית. - חתכו את עצם האגן מהקצוות הדיסטליים והפרוקסימליים של עצם האגן, והותירו כ-10 מ"מ של רקמה כוללת (איור 4F). מניחים את הרקמה המנותחת ב-1x PBS.

איור 3: רצפת אגן פנויה לדיסקציה USL . (A) סכמה של האנטומיה. (B) חיתוך קרני הרחם בחיבור השחלות. (ג) כריתת קרני הרחם. (ד) חיתוך השופכנים. (E) חיתוך המעי הגס. (F) מבט ברור על פי הטבעת ושל USLs. (ז) הנחת העכבר ומשטח הנתיחה מתחת לטווח הניתוח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: מבט על ה-USL והרקמות הסובבות אותו ודיסקציה של ה-USLs . (A) סכמה של ציוני דרך אנטומיים סביב ה-USL. (B) קשירת תפר סביב קצות צוואר הרחם. (C) חיתוך הקצוות הצוואריים של USL. (D) חיתוך USL שישמש לניתוחים ביוכימיים בחיבור העצה. (E) חיתוך עצם הירך מעצם האגן. (F) חיתוך הקצה הפרוקסימלי של האגן. (G) ניתוח USL בצלחת פטרי 35 מ"מ. (H) USL עם האגן המחובר בצלחת פטרי 35 מ"מ. (I) USL ופי הטבעת בהגדלה של 0.75x. (J) הסרת שומן מה-USL. (K) ניקוי של USL בהגדלה של פי 1.0. סרגל קנה מידה = 2 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. קצירת שלפוחית השתן
- לאחר פינוי השומן, החזיקו את שלפוחית השתן עם המלקחיים, והרימו אותה בעדינות בזווית של כ-40° (איור 5A).
- בעזרת המספריים, חתכו את שלפוחית השתן מהצד הדיסטלי, ממש מעל צוואר הרחם (איור 5B).
- הניחו את הרקמה באמבטיה עם PBS 1x כדי לשמור על הרקמה רוויה בלחות (איור 5H).
4. קציר פי הטבעת
- לאחר ניתוק צוואר הרחם וכריתת שלפוחית השתן, הרימו את צוואר הרחם בזווית של כ-40 מעלות בעזרת המלקחיים. יש את הפאשיה הרקטובגינלית המחברת בין פי הטבעת לצוואר הרחם. בעזרת האזמל, חתכו בעדינות את החיבור הזה (איור 5C, D).
- חותכים את עצם הערווה בסימפיזת הערווה באמצעות מספריים. הרחב בעדינות את סביבת העבודה כדי להגביר את הגישה החזותית להחדרות הרקמות.
- בעזרת המלקחיים, משכו בעדינות את פי הטבעת לכיוון בית החזה, והשתמשו במספריים כדי לעקוב אחר פי הטבעת מצידו האחורי ועד לפי הטבעת. חתכו את פי הטבעת בפי הטבעת (איור 5E).
- הניחו את הרקמה ב-PBS 1x כדי לשמור על הרקמה רוויה בלחות (איור 5I).
5. קצירת קומפלקס צוואר הרחם-נרתיק
- לאחר הסרת USL מצוואר הרחם, השתמש במלקחיים כדי להחזיק את צוואר הרחם. גזרו את צוואר הרחם קרוב ככל האפשר לפות בעזרת מספריים (איור 5F, G).
הערה: הקפד לחתוך את סימפיזיס הערווה כדי לראות את הקצה הדיסטלי של הנרתיק חזותית. - הניחו את הרקמה ב-PBS 1x כדי לשמור על הרקמה רוויה בלחות (איור 5J).
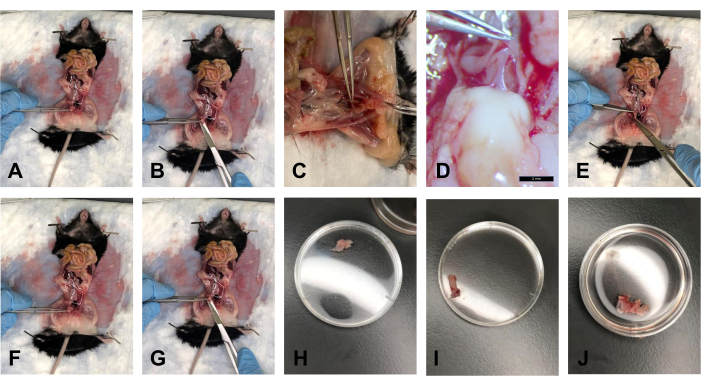
איור 5: דיסקציות שלפוחית השתן, פי הטבעת וצוואר הרחם/הנרתיק. (A) החזקת שלפוחית השתן בזווית. (B) חיתוך שלפוחית השתן. (C) חיתוך הגיד המחבר בין צוואר הרחם ופי הטבעת. (D) הגיד בהגדלה של פי 1.0. (E) חיתוך פי הטבעת. (F) החזקת צוואר הרחם במלקחיים. (G) חיתוך בקצה הדיסטלי של הנרתיק. (H) שלפוחית השתן בצלחת פטרי בקוטר 35 מ"מ. (I) פי הטבעת בכלי פטרי בקוטר 35 מ"מ. (J) קומפלקס רקמת צוואר הרחם-נרתיק בצלחת פטרי 35 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. הכנת דגימה לאפיון רקמות
- ניתוחים מכניים וחזותיים של USL
- הניחו את ה-USL עם חיבור האגן מעל קיר בצורת T בתוך באר צביעה מותאמת אישית כדי להבטיח טבילה מלאה בתמיסת הצביעה (שרטוטי CAD של הבאר ניתן למצוא בקובץ קידוד משלים 1 ובקובץ קידוד משלים 2).
הערה: השתמש בתפר ומלקחיים כדי לעזור עם המיקום. - לדלל צבע זמין מסחרית שמכתים קבוצות אמין חופשיות (5 μL, ראה טבלת חומרים) ב 2.5 מ"ל של 1x PBS, להוסיף את התמיסה לצביעה מותאמת אישית היטב, ולהכתים את הרקמה במשך 2 שעות על נדנדה ב 4 ° C.
הערה: מערבבים את התמיסה לפני הוספתה לבאר הצביעה. - במהלך 15 הדקות האחרונות של הצביעה, הוסף 2.5 μL של כתם גרעיני תאים מתים זמין מסחרית (ראה טבלת חומרים) לתמיסה.
הערה: מערבלים את התמיסה לפני הוספה לבאר הצביעה.
- הניחו את ה-USL עם חיבור האגן מעל קיר בצורת T בתוך באר צביעה מותאמת אישית כדי להבטיח טבילה מלאה בתמיסת הצביעה (שרטוטי CAD של הבאר ניתן למצוא בקובץ קידוד משלים 1 ובקובץ קידוד משלים 2).
- ניתוח ראמאן של USLs
- הצמד את USL בקו ישר על בלוק polydimethylsiloxane (PDMS) הכלול בבאר מותאמת אישית.
הערה: PDMS משמש כמצע רך כדי לאפשר את הצמדת הדגימה בתצורה הרצויה. ניתן ליצור בלוקים בממדים שונים על ידי ערבוב שני הרכיבים בהתאם להוראות היצרן (ראה טבלת חומרים), יציקה בצלחת פטרי, ולאחר פילמור, חיתוך PDMS לגיאומטריה הנדרשת עם להב אזמל. - סיכה עם סיכות חרקים בלולאת התפר ובשריר האגן. לחות את הרקמה עם 1x PBS.
- הצמד את USL בקו ישר על בלוק polydimethylsiloxane (PDMS) הכלול בבאר מותאמת אישית.
- רקמות נותרות
- יש להקפיא את הרקמות הנותרות בחנקן נוזלי או בתרכובת הטבעה מתאימה, בהתאם לניתוחים הרצויים.
- שמור את הרקמות ב -80 מעלות צלזיוס עד לניתוחים הבאים (למשל, בדיקות אימונוהיסטוכימיות או ביוכימיות).
תוצאות
כל שלב בדיסקציה של עכבר מסוג פרא מפורט בסרטון ובדמויות הקשורות לפרוטוקול. במחקר זה נעשה שימוש בנקבות עכברי C57BL/6J בנות 6 שבועות (טבלה משלימה 1). שלוש קבוצות מדגם עם USL שטופלו באנזימים שונים נותחו: קבוצת ביקורת (ללא טיפול), קבוצות שטופלו בקולגנאז וקבוצות שטופלו בכונדרויטינאז. השריר החל...
Discussion
ההשפעה של נזק מבני על רקמות הרבייה הנשיות אינה נחקרת, ויש צורך במודל נגיש של בעלי חיים למחקר POP. העכבר הוא מודל חסכוני שיכול לחקות מחקרי רבייה אנושיים16. בשל העניין הגובר בחקר מערכת הרבייה הנשית, יש צורך בשיטות המסייעות לחקר רקמות אלה. כדי לענות על צורך זה, בעבודה זו, נקבעה שיטה ל?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק CU Boulder Summer Underground Research Opportunities Program (UROP) (C.B.), מלגת המחקר לתארים מתקדמים של NSF (L.S.), מלגת המדע של שמידט (C.L.), תוכנית מענקי זרעי המחקר והחדשנות של אוניברסיטת קולורדו (פרס 2020 ל- V.F., S.C. ו- K.C.), ומענק זרעי Anschutz Boulder Nexus באוניברסיטת קולורדו (ל- V.F. ו- K.C). תודה מיוחדת מגיעה לד"ר טיילר טאטל על עזרתו בעיצוב תא ההעמסה, כמו גם לחברי מעבדת Calve על דיונים מועילים.
Materials
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
References
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved