Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung und Charakterisierung der uterosakralen Bänder und Beckenbodenorgane der Maus
In diesem Artikel
Zusammenfassung
In diesem Artikel wird ein detailliertes Protokoll für die Präparation von uterosakralen Bändern und anderen Beckenbodengeweben, einschließlich des Gebärmutterhalses, des Rektums und der Blase bei Mäusen, vorgestellt, um die Untersuchung des weiblichen Fortpflanzungsgewebes zu erweitern.
Zusammenfassung
Der Beckenorganprolaps (POP) ist eine Erkrankung, die die Integrität, Struktur und mechanische Unterstützung des Beckenbodens beeinträchtigt. Die Organe im Beckenboden werden von verschiedenen anatomischen Strukturen gestützt, darunter Muskeln, Bänder und Beckenfaszien. Das uterosakrale Ligamentum (USL) ist eine kritische tragende Struktur, und eine Verletzung des USL führt zu einem höheren Risiko, an POP zu erkranken. Das vorliegende Protokoll beschreibt die Präparation von murinen USLs und der Beckenbodenorgane sowie die Gewinnung einzigartiger Daten über die biochemische Zusammensetzung und Funktion der USL mittels Raman-Spektroskopie und der Auswertung des mechanischen Verhaltens. Mäuse sind ein unschätzbares Modell für die präklinische Forschung, aber die Präparation der murinen USL ist ein schwieriger und komplizierter Prozess. Dieses Verfahren stellt einen Ansatz dar, um die Dissektion von murinem Beckenbodengewebe, einschließlich der USL, zu steuern, um eine mehrfache Beurteilung und Charakterisierung zu ermöglichen. Diese Arbeit zielt darauf ab, die Präparation von Beckenbodengewebe durch Grundlagenwissenschaftler und Ingenieure zu unterstützen und so die Zugänglichkeit der Forschung zu USL und Beckenbodenzuständen sowie der präklinischen Studie zur Frauengesundheit mit Mausmodellen zu erweitern.
Einleitung
Etwa 50 % der Frauen sind von einem Beckenorganprolaps (POP) betroffen1,2. Etwa 11 % dieser Frauen erfüllen die Kriterien für eine chirurgische Reparatur, die eine schlechte Erfolgsquote (~30 %) aufweist3,4. Die POP ist gekennzeichnet durch das Absinken eines oder aller Beckenorgane (d. h. Blase, Gebärmutter, Gebärmutterhals und Rektum) aus ihrer natürlichen Position, da die USL und die Beckenbodenmuskulatur nicht in der Lage sind, eine angemessene Unterstützung zu bieten5. Bei dieser Erkrankung handelt es sich um eine anatomische Dysfunktion und eine Störung des Bindegewebes sowie um neuromuskuläre Verletzungen, zusätzlich zu prädisponierenden Faktoren 3,6. POP ist mit mehreren Faktoren wie Alter, Gewicht, Parität und Entbindungsart (z. B. vaginale oder Kaiserschnittgeburten) verbunden. Es wird angenommen, dass diese Faktoren die mechanische Integrität des gesamten Beckenbodengewebes beeinflussen, wobei Schwangerschaft und Parität die Hauptursachen für POP 5,7,8 sind.
Die uterosakralen Bänder (USLs) sind wichtige Stützstrukturen für Gebärmutter, Gebärmutterhals und Vagina und verbinden den Gebärmutterhals mit dem Kreuzbein4. Eine Schädigung der USLs erhöht das Risiko, an POP zu erkranken. Es wird angenommen, dass Schwangerschaft und Geburt eine zusätzliche Belastung für die USL darstellen, was möglicherweise zu Verletzungen führt und die Wahrscheinlichkeit einer POP erhöht. Das USL ist ein komplexes Gewebe, das aus glatten Muskelzellen, Blutgefäßen und Lymphgefäßen besteht, die heterogen entlang des Bandes verteilt sind und in drei verschiedene Abschnitte unterteilt werden können: Hals-, Zwischen- und Sakralregion9. Die mechanische Integrität des USL wird von Komponenten der extrazellulären Matrix (EZM) wie Kollagenen, Elastin und Proteoglykanenabgeleitet 5,9,10. Es ist bekannt, dass Kollagenfasern vom Typ I eine wichtige tragende Zugkomponente des Bandgewebes sind und daher wahrscheinlich am USL-Versagen und an POP11 beteiligt sind.
Es fehlt an Wissen über die Ursachen, Prävalenz und Auswirkungen von POP bei Frauen. Die Entwicklung eines geeigneten Tiermodells von POP ist notwendig, um unser Verständnis des weiblichen Beckenbodens zu verbessern. Mäuse und Menschen haben ähnliche anatomische Orientierungspunkte innerhalb des Beckens, wie z. B. die Harnleiter, das Rektum, die Blase, die Eierstöcke und die runden Bänder9, sowie ähnliche Schnittpunkte der USL mit der Gebärmutter, dem Gebärmutterhals und dem Kreuzbein. Darüber hinaus bieten Mäuse eine einfache genetische Manipulation und haben das Potenzial, ein leicht zugängliches, kostengünstiges Modell für die Untersuchung von POP9 zu sein.
In dieser Studie wurde eine Methode entwickelt, um auf die USL und die verschiedenen Beckenbodengewebe von nulliparen (d.h. nie schwangeren) Mäusen zuzugreifen und diese zu isolieren. Die extrahierten USLs wurden einem enzymatischen Verdau unterzogen (d. h. um Kollagene und Glykosaminoglykane zu entfernen), getestet, um die mechanische Reaktion unter Zugbelastung zu bestimmen, und in einer Proof-of-Concept-Studie auf ihre biochemische Zusammensetzung hin bewertet. Die Fähigkeit, intaktes Gewebe zu isolieren, wird weitere mechanische und biochemische Charakterisierungen der Beckenbodenkomponenten ermöglichen, was ein entscheidender erster Schritt zur Verbesserung unseres Verständnisses der Verletzungsrisiken im Zusammenhang mit Geburt, Schwangerschaft und POP ist.
Protokoll
Alle Tierversuche und -verfahren wurden gemäß dem Protokoll #2705 durchgeführt, das vom Animal Care and Use Committee der University of Colorado Boulder genehmigt wurde. Für die vorliegende Studie wurden sechs Wochen alte weibliche C57BL/6J-Mäuse verwendet. Die Tiere stammen aus einer kommerziellen Quelle (siehe Materialtabelle).
1. Vorbereitung der Tiere
- Schläfern Sie das Tier nach der institutionell anerkannten Methode ein.
HINWEIS: In der vorliegenden Studie wurde die CO 2 -Inhalation in Übereinstimmung mit den Richtlinien der American Veterinary Medical Association (eine Verdrängungsrate von 30 % bis 70 % des Kammervolumens mit CO2 pro Minute) verwendet, gefolgt von einer zervikalen Luxation, um eine erfolgreiche Euthanasie zu gewährleisten.- Arbeiten Sie, wenn möglich, unter einer Haube, um die Ausbreitung von Mäuseallergenen zu minimieren. Sobald sich die Maus nicht mehr bewegt und nicht mehr atmet, warten Sie mindestens 2 Minuten, um die fehlende Reaktion zu überprüfen.
HINWEIS: Wenn die Maus trächtig oder nach der Geburt ist, müssen die Welpen einzeln eingeschläfert werden. Welpen E15.5 und älter müssen während der Sektion enthauptet werden.
- Arbeiten Sie, wenn möglich, unter einer Haube, um die Ausbreitung von Mäuseallergenen zu minimieren. Sobald sich die Maus nicht mehr bewegt und nicht mehr atmet, warten Sie mindestens 2 Minuten, um die fehlende Reaktion zu überprüfen.
- Bereiten Sie den Sezieraufbau mit einem Sezierpad, einem Skalpell mit 11 Klingen, einer gebogenen dünnen, scharfen Schere, zwei Zangenpaaren, einer gebogenen Pinzette, einer 5-0-Polyglactin-Naht, einem Präpariermikroskop und sechs Stiften vor (Abbildung 1, siehe Materialtabelle).
- Legen Sie die Maus auf das Pad und fixieren Sie die Vordergliedmaßen nach unten (Abbildung 2A). Machen Sie mit einer Schere einen Schnitt von ca. 1-1,5 cm im Bauch (Abbildung 2B). Verwenden Sie vorsichtig die Schere, um die Haut an der kranialen, kaudalen und lateralen Seite des Schnitts zu trennen (Abbildung 2C, D).
- Drehen Sie die Maus auf die dorsale Seite und ziehen Sie die Haut vorsichtig in Richtung der Hintergliedmaßen ab, um die Haut von der Dissektionsstelle weg zu entfernen (Abbildung 2E-H).
- Stecken Sie die Maus an den Gliedmaßen fest (Abbildung 2I) und machen Sie einen Schnitt von ca. 1 cm in den Bauch vom Brustkorb bis zum Becken (Abbildung 2J).
Anmerkungen: Achten Sie darauf, die darunter liegenden Organe nicht zu beschädigen. - Schieben Sie die Organe sanft in Richtung Brustkorb, um das Sichtfeld frei zu machen (Abbildung 2K).
Anmerkungen: Spülen Sie das Gewebe mit 1x PBS, um die Hydratation aufrechtzuerhalten. - Entfernen Sie das gesamte Fettgewebe vom Beckenboden (Abbildung 2L-N).
Anmerkungen: Verwenden Sie eine Pinzette, um vorsichtig Fett von den interessierenden Organen und Geweben zu ziehen und zu entfernen.

Abbildung 1: Ein sauberer Arbeitsbereich mit allen Werkzeugen, die für die Durchführung der Sektionen benötigt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
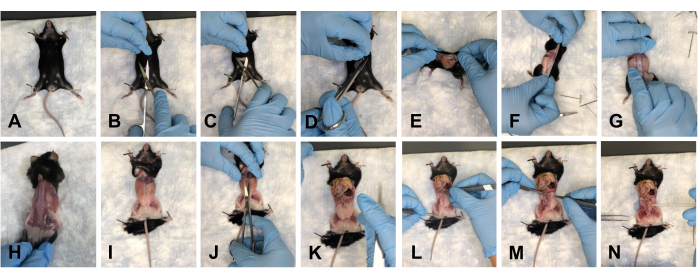
Abbildung 2: Entfernung der Haut und Öffnung der Becken- und Brusthöhle der Maus. (A) Festhalten aller Gliedmaßen. (B) Erster Einschnitt. (C) Trennen der Haut von den darunter liegenden Faszien mit einer Schere. (D) Schneiden der Haut und Vorbereiten der Entfernung. (E-G) Ziehen Sie die Haut ab, indem Sie um die Maus herumgehen. (H) Vollständige Entfernung der Haut von der dorsalen Seite. (I) Vollständige Entfernung der Haut vom Rumpf und erneutes Anheften der Mausgliedmaßen. (J) Öffnung des Bauches. (K) Blick auf den offenen Bauch. (L) Verschieben der Organe aus dem Sichtfeld. (M) Entfernen des Fettes. (N) Blick auf den freigewordenen Beckenboden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. USL-Ernte
- Schneiden Sie die Gebärmutterhörner von den Eierstöcken ab (Abbildung 3B), ziehen Sie sie aus dem Sichtfeld heraus und schneiden Sie an der Halsverbindung ab (Abbildung 3C).
HINWEIS: Die Gebärmutterhörner können anhand des Schemas in Abbildung 3A identifiziert werden. Spülen Sie das Gewebe mit 1x PBS, um die Hydratation aufrechtzuerhalten. - Schneiden Sie die Harnleiter von der Blasenverbindung weg (Abbildung 3D).
HINWEIS: Dies dient dazu, Verwechslungen mit der USL zu vermeiden. - Schneiden Sie den Dickdarm so nah wie möglich am Gebärmutterhals ab (Abbildung 3E,F).
Anmerkungen: Spülen Sie das Gewebe mit 1x PBS, um die Hydratation aufrechtzuerhalten. - Platzieren Sie die Maus zusammen mit dem Sezierblock unter dem Präparierfernrohr, um die USLs zu visualisieren (Abbildung 3G).
- Verwenden Sie vorsichtig die Pinzette, um das umgebende Fett von den USLs zu entfernen.
Anmerkungen: Verwenden Sie eine zweite Pinzette, um den Gebärmutterhals in einem kleinen Winkel zu halten, um die Visualisierung der Schnittmenge zwischen USL und Gebärmutterhals zu verbessern. Spülen Sie das Gewebe mit 1x PBS, um die Hydratation aufrechtzuerhalten. - Binden Sie eine 5-0-Polyglactin-Naht um das zervikale Ende beider USLs (Abbildung 4B, C).
HINWEIS: Die USLs können anhand des Schaltplans und der Vergrößerungsbilder identifiziert werden (Abbildung 4I-K) - In dieser Studie wird ein USL für morphologische oder biochemische Analysen (z.B. Raman-Mikroskopie, Immunhistochemie, Histologie) verwendet. Schneiden Sie das zervikale Ende der USL ab, wobei ein Stück des Gebärmutterhalses befestigt bleibt, und schneiden Sie ein Stück Muskel von der Unterseite der USL ab (Abbildung 4D). Legen Sie das präparierte Gewebe in ein Bad mit 1x PBS, um das Gewebe mit Feuchtigkeit zu versorgen (Abbildung 4G, H).
- Verwenden Sie die verbleibende USL für mechanische Tests und Bildgebung. Schneiden Sie das zervikale Ende der USL ab und lassen Sie ein Stück Gebärmutterhals hängen, um die mechanische Einrichtung zu erleichtern (Abbildung 4D).
HINWEIS: Das Zervixgewebe dient als Anker, um den USL während des mechanischen Tests zu sichern. - Sobald alle interessierenden Gewebe entnommen sind (Schritte 3-5), verlagern Sie die Oberschenkelknochen aus dem Becken (Abbildung 4E).
Anmerkungen: Man sollte ein leises Klickgeräusch hören, wenn der Hüftkopf von der Hüftpfanne abgelenkt ist. - Schneiden Sie den Beckenknochen von den distalen und proximalen Enden des Beckenknochens ab, so dass etwa 10 mm Gesamtgewebe übrig bleiben (Abbildung 4F). Legen Sie das präparierte Gewebe in 1x PBS.

Abbildung 3: Geräumter Beckenboden für die USL-Dissektion . (A) Schematische Darstellung der Anatomie. (B) Durchtrennen der Gebärmutterhörner an der Verbindung der Eierstöcke. (C) Abschneiden der Gebärmutterhörner. (D) Durchtrennen der Harnleiter. (E) Durchtrennen des Dickdarms. (F) Eine klare Sicht auf das Rektum und die USLs. (G) Platzieren der Maus und des Sezierpads unter dem Präparierfernrohr. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Ansicht der USL und des umgebenden Gewebes und Präparation der USLs. (A) Schematische Darstellung der anatomischen Orientierungspunkte rund um die USL. (B) Binden einer Naht um die zervikalen Enden. (C) Abschneiden der zervikalen Enden der USL. (D) Abschneiden der USL, die für die biochemischen Analysen an der sakralen Verbindung verwendet werden soll. (E) Durchtrennen der Oberschenkelknochen aus dem Beckenknochen. (F) Abschneiden des proximalen Endes des Beckens. (G) Präparieren der USL in einer 35-mm-Petrischale. (H) Die USL mit dem angehängten Becken in einer 35 mm Petrischale. (I) Die USL und das Rektum bei 0,75-facher Vergrößerung. (J) Entfernen von Fett aus der USL. (K) Reinigung der USLs bei 1,0-facher Vergrößerung. Maßstabsleiste = 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Blasenentnahme
- Nachdem das Fett entfernt wurde, halten Sie die Blase mit der Pinzette fest und heben Sie sie vorsichtig in einem Winkel von ca. 40° an (Abbildung 5A).
- Schneiden Sie mit der Schere die Blase von der distalen Seite direkt über dem Gebärmutterhals ab (Abbildung 5B).
- Legen Sie das Gewebe in ein Bad mit 1x PBS, um das Gewebe mit Feuchtigkeit zu versorgen (Abbildung 5H).
4. Rektum-Ernte
- Sobald die USLs vom Gebärmutterhals getrennt und die Blase präpariert sind, heben Sie den Gebärmutterhals mit der Pinzette in einem Winkel von ca. 40° an. Es gibt die rektovaginale Faszie, die das Rektum und den Gebärmutterhals verbindet. Trennen Sie diese Verbindung vorsichtig mit dem Skalpell (Abbildung 5C, D).
- Schneiden Sie das Schambein an der Schambeinfuge mit einer Schere durch. Erweitern Sie den Arbeitsbereich vorsichtig, um den visuellen Zugang zu den Gewebeeinsätzen zu verbessern.
- Ziehen Sie das Rektum mit der Pinzette sanft in Richtung Brustkorb und folgen Sie mit der Schere dem Rektum von der hinteren Seite bis zum Anus. Schneiden Sie das Rektum am Anus auf (Abbildung 5E).
- Legen Sie das Gewebe in 1x PBS, um das Gewebe mit Feuchtigkeit zu versorgen (Abbildung 5I).
5. Entnahme des Gebärmutterhals-Vagina-Komplexes
- Nachdem die USLs aus dem Gebärmutterhals entfernt wurden, verwenden Sie die Pinzette, um den Gebärmutterhals zu halten. Schneiden Sie den Gebärmutterhals mit einer Schere so nah wie möglich an der Vulva ab (Abbildung 5F, G).
Anmerkungen: Stellen Sie sicher, dass Sie die Schambeinfuge durchtrennen, um das distale Ende der Vagina visuell zu sehen. - Legen Sie das Gewebe in 1x PBS, um das Gewebe mit Feuchtigkeit zu versorgen (Abbildung 5J).
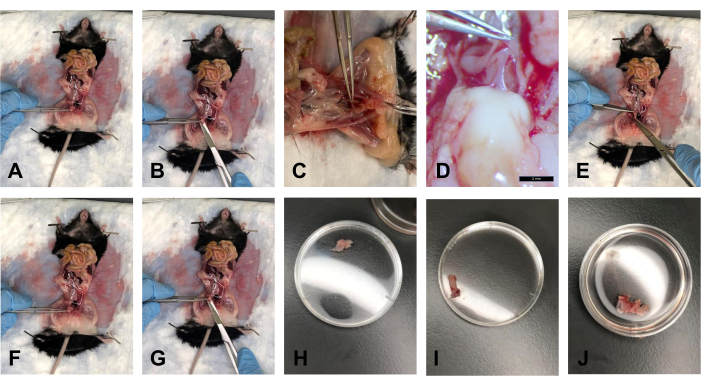
Abbildung 5: Blasen-, Rektum- und Gebärmutterhals-/Vaginadissektionen . (A) Halten Sie die Blase in einem Winkel. (B) Abschneiden der Blase. (C) Durchtrennen der Sehne, die den Gebärmutterhals und das Rektum verbindet. (D) Die Sehne bei 1,0-facher Vergrößerung. (E) Durchtrennen des Rektums. (F) Festhalten des Gebärmutterhalses mit einer Pinzette. (G) Schnitt am distalen Ende der Vagina. (H) Die Blase in einer 35-mm-Petrischale. (I) Das Rektum in einer 35 mm Petrischale. (J) Der Zervix-Vagina-Gewebekomplex in einer 35 mm Petrischale. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Probenvorbereitung für die Gewebecharakterisierung
- Mechanische und visuelle Analysen der USL
- Platzieren Sie die USL mit dem Beckenaufsatz über einer T-förmigen Wand in einer benutzerdefinierten Färbevertiefung, um ein vollständiges Eintauchen in die Färbelösung zu gewährleisten (CAD-Zeichnungen der Vertiefung finden Sie in Supplementary Coding File 1 und Supplementary Coding File 2).
Anmerkungen: Verwenden Sie Naht und Pinzette, um die Platzierung zu erleichtern. - Verdünnen Sie einen handelsüblichen Farbstoff, der freie Amingruppen (5 μl, siehe Materialtabelle) färbt, in 2,5 ml 1x PBS, geben Sie die Lösung in die benutzerdefinierte Färbevertiefung und färben Sie das Gewebe 2 h lang auf einer Wippe bei 4 °C.
Anmerkungen: Wirbeln Sie die Lösung vor, bevor Sie sie in die Färbevertiefung geben. - Während der letzten 15 Minuten der Färbung fügen Sie der Lösung 2,5 μl einer handelsüblichen Färbung toter Zellkerne (siehe Materialtabelle) hinzu.
Anmerkungen: Wirbeln Sie die Lösung vor, bevor Sie sie in die Färbevertiefung geben.
- Platzieren Sie die USL mit dem Beckenaufsatz über einer T-förmigen Wand in einer benutzerdefinierten Färbevertiefung, um ein vollständiges Eintauchen in die Färbelösung zu gewährleisten (CAD-Zeichnungen der Vertiefung finden Sie in Supplementary Coding File 1 und Supplementary Coding File 2).
- Raman-Analyse der USLs
- Heften Sie die USL in einer geraden Linie an einen Polydimethylsiloxan-Block (PDMS), der sich in einer benutzerdefinierten Vertiefung befindet.
HINWEIS: Das PDMS wird als weiches Substrat verwendet, um das Anheften der Probe in der gewünschten Konfiguration zu ermöglichen. Blöcke mit unterschiedlichen Abmessungen können hergestellt werden, indem die beiden Komponenten gemäß den Anweisungen des Herstellers (siehe Materialtabelle) gemischt, in einer Petrischale gegossen und das PDMS nach der Polymerisation mit einer Skalpellklinge in die gewünschte Geometrie geschnitten wird. - Stift mit Insektennadeln an der Nahtschlaufe und am Beckenmuskel. Hydratisieren Sie das Gewebe mit 1x PBS.
- Heften Sie die USL in einer geraden Linie an einen Polydimethylsiloxan-Block (PDMS), der sich in einer benutzerdefinierten Vertiefung befindet.
- Verbleibendes Gewebe
- Frieren Sie das verbleibende Gewebe mit flüssigem Stickstoff oder in einer geeigneten Einbettmasse ein, je nach gewünschter Analyse.
- Bewahren Sie das Gewebe bei −80 °C bis zu nachfolgenden Analysen (z. B. immunhistochemische oder biochemische Assays) auf.
Ergebnisse
Jeder Schritt der Präparation einer Wildtyp-Maus wird im zugehörigen Video und in Abbildungen zum Protokoll detailliert beschrieben. Für diese Studie wurden 6 Wochen alte weibliche C57BL/6J-Mäuse verwendet (Ergänzende Tabelle 1). Es wurden drei Probengruppen mit USLs analysiert, die mit verschiedenen Enzymen behandelt wurden: Kontrollgruppen (keine Behandlung), Kollagenase-behandelte und Chondroitinase-behandelte Gruppen. Die glatte Muskulatur, die Nerven und die Lymphgefäße in der USL sind von ei...
Diskussion
Die Auswirkungen struktureller Schäden auf weibliches Fortpflanzungsgewebe sind nur unzureichend untersucht, und es wird ein leicht zugängliches Tiermodell für die POP-Forschung benötigt. Die Maus ist ein kostengünstiges Modell, das menschliche Fortpflanzungsstudien nachahmen kann16. Aufgrund des wachsenden Interesses an der Erforschung des weiblichen Fortpflanzungssystems besteht ein Bedarf an Methoden, die die Untersuchung dieser Gewebe unterstützen. Um diesem Bedarf gerecht zu werden, wir...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch das Stipendium des CU Boulder Summer Underground Research Opportunities Program (UROP) (C.B.), das NSF Graduate Research Fellowship (L.S.), das Schmidt Science Fellowship (C.L.), das University of Colorado Research &; Innovation Seed Grant Program (2020 Auszeichnung an V.F., S.C. und K.C.) und das Anschutz Boulder Nexus Seed Grant an der University of Colorado (an V.F. und K.C.) unterstützt. Ein besonderer Dank geht an Dr. Tyler Tuttle für die Hilfe bei der Konstruktion der Ladekammer sowie an die Mitglieder des Calve-Labors für hilfreiche Diskussionen.
Materialien
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
Referenzen
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten