È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento e caratterizzazione dei legamenti uterosacrali murini e degli organi del pavimento pelvico
In questo articolo
Riepilogo
Questo articolo presenta un protocollo dettagliato per la dissezione dei legamenti uterosacrali e di altri tessuti del pavimento pelvico, tra cui la cervice, il retto e la vescica nei topi, per espandere lo studio dei tessuti riproduttivi femminili.
Abstract
Il prolasso degli organi pelvici (POP) è una condizione che colpisce l'integrità, la struttura e il supporto meccanico del pavimento pelvico. Gli organi del pavimento pelvico sono supportati da diverse strutture anatomiche, tra cui muscoli, legamenti e fascia pelvica. Il legamento uterosacrale (USL) è una struttura portante critica e la lesione dell'USL comporta un rischio maggiore di sviluppare POP. Il presente protocollo descrive la dissezione delle USL murine e degli organi del pavimento pelvico insieme all'acquisizione di dati unici sulla composizione e la funzione biochimica dell'USL utilizzando la spettroscopia Raman e la valutazione del comportamento meccanico. I topi sono un modello inestimabile per la ricerca preclinica, ma sezionare l'USL murino è un processo difficile e complesso. Questa procedura presenta un approccio per guidare la dissezione dei tessuti del pavimento pelvico murino, incluso l'USL, per consentire valutazioni e caratterizzazioni multiple. Questo lavoro mira ad aiutare la dissezione dei tessuti del pavimento pelvico da parte di scienziati e ingegneri di base, ampliando così l'accessibilità della ricerca sulle condizioni dell'USL e del pavimento pelvico e lo studio preclinico della salute delle donne utilizzando modelli murini.
Introduzione
Circa il 50% delle donne è affetto da prolasso degli organi pelvici (POP)1,2. Circa l'11% di queste donne soddisfa i criteri per sottoporsi a riparazione chirurgica, che ha uno scarso tasso di successo (~ 30%)3,4. La POP è caratterizzata dalla discesa di uno o tutti gli organi pelvici (cioè vescica, utero, cervice e retto) dalla loro posizione naturale a causa del fallimento dell'USL e dei muscoli del pavimento pelvico per fornire un supporto adeguato5. Questa condizione comporta disfunzione anatomica e rottura del tessuto connettivo, nonché lesioni neuromuscolari, oltre ai fattori predisponenti 3,6. Il POP è associato a molteplici fattori come età, peso, parità e tipo di parto (cioè nascite vaginali o cesare). Si ritiene che questi fattori influenzino l'integrità meccanica di tutti i tessuti del pavimento pelvico, con la gravidanza e la parità ritenute i principali driver di POP 5,7,8.
I legamenti uterosacrali (USL) sono importanti strutture di supporto per l'utero, la cervice e la vagina e legano la cervice all'osso sacro4. Il danno alle USL mette le donne ad aumentato rischio di sviluppare POP. Si ritiene che la gravidanza e il parto impongano un ulteriore sforzo sull'USL, che potenzialmente induce lesioni e aumenta le possibilità di POP. L'USL è un tessuto complesso composto da cellule muscolari lisce, vasi sanguigni e linfatici distribuiti eterogeneamente lungo il legamento, che può essere diviso in tre sezioni distinte: cervicale, intermedia e sacrale9. L'integrità meccanica dell'USL deriva da componenti della matrice extracellulare (ECM) come collageni, elastina e proteoglicani 5,9,10. Le fibre di collagene di tipo I sono note per essere un importante componente portante dei tessuti legamentosi e sono, quindi, probabilmente coinvolte nel fallimento dell'USL e nel POP11.
C'è una mancanza di conoscenza per quanto riguarda le cause, la prevalenza e gli effetti del POP nelle donne. Lo sviluppo di un modello animale appropriato di POP è necessario per far progredire la nostra comprensione del pavimento pelvico femminile. I topi e gli esseri umani hanno punti di riferimento anatomici simili all'interno del bacino, come gli ureteri, il retto, la vescica, le ovaie e i legamenti rotondi9, nonché punti di intersezione simili dell'USL con l'utero, la cervice e l'osso sacro. Inoltre, i topi offrono facilità di manipolazione genetica e hanno il potenziale per essere un modello facilmente accessibile ed economico per lo studio di POP9.
Questo studio ha sviluppato un metodo per accedere e isolare l'USL e i diversi tessuti del pavimento pelvico da topi nullipari (cioè mai gravidi). Le USL estratte sono state sottoposte a digestione enzimatica (cioè per rimuovere collageni e glicosaminoglicani), testate per determinare la risposta meccanica sotto carico di trazione e valutate per la composizione biochimica in uno studio proof-of-concept. La capacità di isolare i tessuti intatti faciliterà ulteriori caratterizzazioni meccaniche e biochimiche dei componenti del pavimento pelvico, che è un primo passo cruciale verso il miglioramento della nostra comprensione dei rischi di lesioni legati al parto, alla gravidanza e al POP.
Protocollo
Tutti gli esperimenti e le procedure sugli animali sono stati eseguiti secondo il protocollo # 2705, approvato dal Comitato per la cura e l'uso degli animali dell'Università del Colorado Boulder. Per il presente studio sono stati utilizzati topi femmina C57BL / 6J di sei settimane. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali).
1. Preparazione degli animali
- Eutanasia dell'animale seguendo il metodo approvato istituzionalmente.
NOTA: Il presente studio ha utilizzato l'inalazione di CO 2 in linea con le linee guida dell'American Veterinary Medical Association (un tasso di spostamento dal 30% al 70% del volume della camera con CO2 al minuto), seguita da dislocazione cervicale, per garantire il successo dell'eutanasia.- Lavorare sotto un cappuccio, se possibile, per ridurre al minimo la diffusione degli allergeni dei topi. Una volta che il mouse smette di muoversi e respirare, attendere 2 minuti o più per verificare la mancanza di risposta.
NOTA: Se il topo è incinta o post-partum, i cuccioli devono essere eutanasizzati individualmente. I cuccioli E15.5 e più anziani devono essere decapitati durante la dissezione.
- Lavorare sotto un cappuccio, se possibile, per ridurre al minimo la diffusione degli allergeni dei topi. Una volta che il mouse smette di muoversi e respirare, attendere 2 minuti o più per verificare la mancanza di risposta.
- Preparare la configurazione della dissezione con un tampone di dissezione, un bisturi a 11 lame, forbici sottili e affilate curve, due paia di pinze, pinze curve, sutura in poliglactina 5-0, un microscopio da dissezione e sei perni (Figura 1, vedere Tabella dei materiali).
- Posizionare il mouse sul pad e fissare gli arti anteriori verso il basso (Figura 2A). Fare un'incisione di circa 1-1,5 cm nell'addome con le forbici (Figura 2B). Utilizzare delicatamente le forbici per separare la pelle sui lati cranico, caudale e laterale dell'incisione (Figura 2C, D).
- Capovolgere il mouse sul lato dorsale e staccare delicatamente la pelle verso gli arti posteriori per rimuovere la pelle dal sito di dissezione (Figura 2E-H).
- Appuntare il topo agli arti (Figura 2I) e praticare un'incisione di circa 1 cm nell'addome dal torace al bacino (Figura 2J).
NOTA: Assicurarsi di non danneggiare gli organi sottostanti. - Spingere delicatamente gli organi verso il torace per liberare il campo visivo (Figura 2K).
NOTA: Irrigare i tessuti con 1x PBS per mantenere l'idratazione. - Eliminare tutto il tessuto adiposo dal pavimento pelvico (Figura 2L-N).
NOTA: Utilizzare una pinza per estrarre delicatamente e eliminare il grasso dagli organi e dai tessuti di interesse.

Figura 1: Un'area di lavoro pulita con tutti gli strumenti necessari per eseguire le dissezioni. Fare clic qui per visualizzare una versione ingrandita di questa figura.
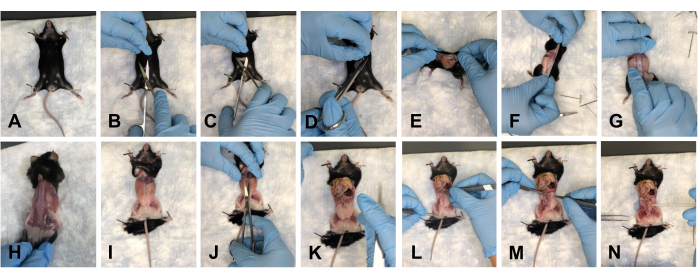
Figura 2: Rimozione della pelle e apertura delle cavità pelvica e toracica del topo. (A) Appuntando tutti gli arti. (B) Incisione iniziale. (C) Separare la pelle dalla fascia sottostante usando le forbici. D) Sezionamento della pelle e preparazione per la rimozione. (E-G) Tirare via la pelle girando intorno al mouse. (H) Rimuovere completamente la pelle dal lato dorsale. (I) Rimozione completa della pelle dal tronco e ri-bloccaggio degli arti del topo. J) Apertura dell'addome. (K) Vista dell'addome aperto. (L) Spostare gli organi fuori dal campo visivo. (M) Rimozione del grasso. (N) Vista del pavimento pelvico sgombro. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Raccolta USL
- Tagliare le corna uterine dalle ovaie (Figura 3B), allontanarsi dal campo visivo e tagliare la connessione cervicale (Figura 3C).
NOTA: Le corna uterine possono essere identificate seguendo lo schema in Figura 3A. Irrigare i tessuti con 1x PBS per mantenere l'idratazione. - Tagliare gli ureteri lontano dalla connessione della vescica (Figura 3D).
NOTA: Questo per evitare confusione con l'USL. - Tagliare il colon il più vicino possibile alla cervice (Figura 3E,F).
NOTA: Irrigare i tessuti con 1x PBS per mantenere l'idratazione. - Posizionare il mouse insieme al pad di dissezione sotto l'oscilloscopio di dissezione per visualizzare le USL (Figura 3G).
- Utilizzare delicatamente la pinza per pulire il grasso circostante dalle USL.
NOTA: Utilizzare un secondo paio di pinze per tenere la cervice con una piccola angolazione per migliorare la visualizzazione di dove l'USL si interseca con la cervice. Irrigare i tessuti con 1x PBS per mantenere l'idratazione. - Legare una sutura di poliglactina 5-0 attorno all'estremità cervicale di entrambe le USL (Figura 4B, C).
NOTA: Le USL possono essere identificate utilizzando le immagini schematiche e di ingrandimento (Figura 4I-K) - In questo studio, un USL viene utilizzato per analisi morfologiche o biochimiche (ad esempio, microscopia Raman, immunoistochimica, istologia). Tagliare l'estremità cervicale dell'USL, lasciando un pezzo della cervice attaccato, e tagliare un pezzo di muscolo dal fondo dell'USL (Figura 4D). Posizionare il tessuto sezionato in un bagno con 1x PBS per mantenere il tessuto idratato (Figura 4G, H).
- Utilizzare l'USL rimanente per test meccanici e imaging. Tagliare l'estremità cervicale dell'USL, lasciando attaccato un pezzo di cervice, per facilitare l'impostazione meccanica (Figura 4D).
NOTA: Il tessuto cervicale fungerà da ancoraggio per fissare l'USL durante il test meccanico. - Una volta raccolti tutti i tessuti di interesse (fasi 3-5), slogare i femori dal bacino (Figura 4E).
NOTA: Si dovrebbe sentire un debole ticchettio quando la testa del femore è disarticolata dalla coppa acetabolare. - Tagliare l'osso pelvico dalle estremità distali e prossimali dell'osso pelvico, lasciando circa 10 mm di tessuto totale (Figura 4F). Posizionare il tessuto sezionato in 1x PBS.

Figura 3: Pavimento pelvico liberato per la dissezione USL . (A) Schema dell'anatomia. (B) Taglio delle corna uterine alla connessione ovarica. (C) Taglio delle corna uterine. (D) Taglio degli ureteri. (E) Taglio del colon. (F) Una visione chiara del retto e delle USL. (G) Posizionare il mouse e il pad di dissezione sotto il cannocchiale di dissezione. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Vista dell'USL e dei tessuti circostanti e dissezione delle USL. (A) Schema dei punti di riferimento anatomici che circondano l'USL. (B) Legare una sutura attorno alle estremità cervicali. (C) Tagliare le estremità cervicali dell'USL. (D) Tagliare l'USL da utilizzare per le analisi biochimiche alla connessione sacrale. (E) Taglio dei femori dall'osso pelvico. (F) Taglio dell'estremità prossimale del bacino. (G) Sezionare l'USL in una capsula di Petri da 35 mm. (H) L'USL con il bacino attaccato in una capsula di Petri da 35 mm. (I) L'USL e il retto con ingrandimento 0,75x. (J) Rimozione del grasso dalla USL. (K) Pulizia delle USL con ingrandimento 1,0x. Barra della scala = 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Raccolta della vescica
- Dopo che il grasso è stato eliminato, tenere la vescica con la pinza e sollevarla delicatamente con un angolo di circa 40° (Figura 5A).
- Con le forbici, tagliare la vescica dal lato distale, proprio sopra la cervice (Figura 5B).
- Posizionare il fazzoletto in un bagno con 1x PBS per mantenere il tessuto idratato (Figura 5H).
4. Raccolta del retto
- Una volta che le USL sono scollegate dalla cervice e la vescica è sezionata, sollevare la cervice con un angolo di circa 40 ° con la pinza. C'è la fascia rettovaginale che collega il retto e la cervice. Con il bisturi, tagliare delicatamente questa connessione (Figura 5C, D).
- Tagliare l'osso pubico alla sinfisi pubica usando le forbici. Allargare delicatamente lo spazio di lavoro per aumentare l'accesso visivo alle inserzioni di tessuto.
- Con la pinza, tirare delicatamente il retto verso il torace e utilizzare le forbici per seguire il retto dal lato posteriore all'ano. Tagliare il retto all'ano (Figura 5E).
- Posizionare il tessuto in 1x PBS per mantenere il tessuto idratato (Figura 5I).
5. Raccolta del complesso cervice-vagina
- Dopo che le USL sono state rimosse dalla cervice, utilizzare la pinza per tenere la cervice. Tagliare la cervice il più vicino possibile alla vulva usando le forbici (Figura 5F, G).
NOTA: Assicurarsi di tagliare la sinfisi pubica per vedere visivamente l'estremità distale della vagina. - Posizionare il tessuto in 1x PBS per mantenere il tessuto idratato (Figura 5J).
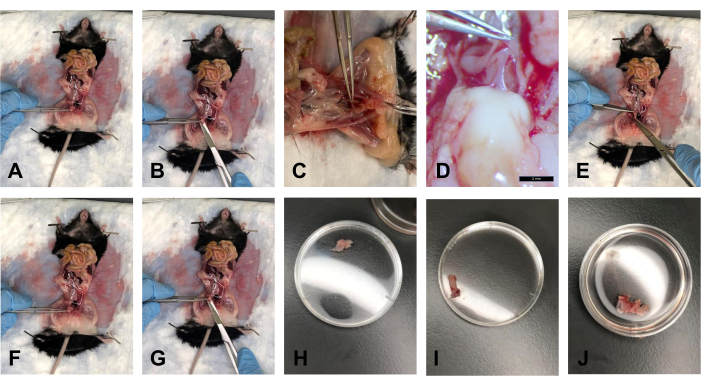
Figura 5: Dissezioni della vescica, del retto e della cervice/vagina . (A) Tenere la vescica ad angolo. (B) Taglio della vescica. (C) Taglio del tendine che collega la cervice e il retto. (D) Il tendine con ingrandimento 1,0x. (E) Taglio del retto. (F) Trattenere la cervice con una pinza. (G) Taglio all'estremità distale della vagina. (H) La vescica in una capsula di Petri di 35 mm. (I) Il retto in una capsula di Petri di 35 mm. (J) Il complesso del tessuto cervice-vagina in una capsula di Petri di 35 mm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
6. Preparazione del campione per la caratterizzazione tissutale
- Analisi meccaniche e visive della USL
- Posizionare l'USL con l'attacco pelvico su una parete a forma di T all'interno di un pozzetto di colorazione personalizzato per garantire la piena immersione nella soluzione di colorazione (i disegni CAD del pozzo sono disponibili nel file di codifica supplementare 1 e nel file di codifica supplementare 2).
NOTA: Utilizzare sutura e pinza per aiutare con il posizionamento. - Diluire un colorante disponibile in commercio che colora i gruppi amminici liberi (5 μL, vedere Tabella dei materiali) in 2,5 ml di 1x PBS, aggiungere la soluzione al pozzetto di colorazione personalizzato e colorare il tessuto per 2 ore su un bilanciere a 4 °C.
NOTA: Vortice la soluzione prima di aggiungerla al pozzetto di colorazione. - Durante gli ultimi 15 minuti di colorazione, aggiungere 2,5 μL di una colorazione di nuclei di cellule morte disponibile in commercio (vedere Tabella dei materiali) alla soluzione.
NOTA: Vortice la soluzione prima di aggiungere al pozzetto di colorazione.
- Posizionare l'USL con l'attacco pelvico su una parete a forma di T all'interno di un pozzetto di colorazione personalizzato per garantire la piena immersione nella soluzione di colorazione (i disegni CAD del pozzo sono disponibili nel file di codifica supplementare 1 e nel file di codifica supplementare 2).
- Analisi Raman delle USL
- Appuntare l'USL in linea retta su un blocco di polidimetilsilossano (PDMS) contenuto in un pozzetto personalizzato.
NOTA: Il PDMS viene utilizzato come substrato morbido per consentire il bloccaggio del campione nella configurazione desiderata. Blocchi di varie dimensioni possono essere realizzati mescolando i due componenti seguendo le istruzioni del produttore (vedi Tabella dei materiali), colando in una piastra di Petri e, dopo la polimerizzazione, tagliando il PDMS nella geometria richiesta con una lama di bisturi. - Perno con perni di insetto sul capello di sutura e sul muscolo pelvico. Idratare il tessuto con 1x PBS.
- Appuntare l'USL in linea retta su un blocco di polidimetilsilossano (PDMS) contenuto in un pozzetto personalizzato.
- Tessuti rimanenti
- Congelare a scatto i tessuti rimanenti con azoto liquido o in un composto di incorporamento appropriato, a seconda delle analisi desiderate.
- Conservare i tessuti a -80 °C fino alle successive analisi (ad es. saggi immunoistochimici o biochimici).
Risultati
Ogni passaggio della dissezione di un mouse wild-type è dettagliato nel video associato e nelle figure relative al protocollo. Per questo studio, sono stati utilizzati topi femmina C57BL / 6J di 6 settimane (Tabella supplementare 1). Sono stati analizzati tre gruppi campione con USL trattati con diversi enzimi: gruppi trattati con controllo (nessun trattamento), trattati con collagenasi e condroitinasi. La muscolatura liscia, i nervi e i linfatici dell'USL sono circondati da una ECM ricca di collageni f...
Discussione
L'effetto del danno strutturale sui tessuti riproduttivi femminili è poco studiato ed è necessario un modello animale facilmente accessibile per la ricerca POP. Il topo è un modello economico che può imitare gli studi riproduttivi umani16. A causa del crescente interesse per lo studio del sistema riproduttivo femminile, vi è la necessità di metodi che aiutino lo studio di questi tessuti. Per rispondere a questa esigenza, in questo lavoro, viene stabilito un metodo per sezionare e preparare t...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalla sovvenzione CU Boulder Summer Underground Research Opportunities Program (UROP) (CB), dalla NSF Graduate Research Fellowship (L.S.), dalla Schmidt Science Fellowship (CL), dall'University of Colorado Research & Innovation Seed Grant Program (premio 2020 a V.F., S.C. e K.C.) e dall'Anschutz Boulder Nexus Seed Grant presso l'Università del Colorado (a V.F. e K.C.). Un riconoscimento speciale va al Dr. Tyler Tuttle per l'aiuto con la progettazione della camera di carico e ai membri del laboratorio Calve per utili discussioni.
Materiali
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
Riferimenti
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon