É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento e caracterização dos ligamentos uterossacrais murinos e órgãos do assoalho pélvico
Neste Artigo
Resumo
Este artigo apresenta um protocolo detalhado para dissecar ligamentos uterossacrais e outros tecidos do assoalho pélvico, incluindo colo uterino, reto e bexiga em camundongos, para expandir o estudo dos tecidos reprodutivos femininos.
Resumo
O prolapso de órgãos pélvicos (DPO) é uma condição que afeta a integridade, a estrutura e o suporte mecânico do assoalho pélvico. Os órgãos do assoalho pélvico são sustentados por diferentes estruturas anatômicas, incluindo músculos, ligamentos e fáscia pélvica. O ligamento uterossacro (USL) é uma estrutura crítica de suporte de carga, e a lesão da USL resulta em um risco maior de desenvolver POP. O presente protocolo descreve a dissecção de USLs murinos e dos órgãos do assoalho pélvico, juntamente com a aquisição de dados únicos sobre a composição bioquímica e função da USL usando espectroscopia Raman e a avaliação do comportamento mecânico. Camundongos são um modelo inestimável para pesquisa pré-clínica, mas dissecar a USL murina é um processo difícil e intrincado. Este procedimento apresenta uma abordagem para guiar a dissecção dos tecidos murinos do assoalho pélvico, incluindo o USL, para possibilitar múltiplas avaliações e caracterização. Este trabalho visa auxiliar a dissecção de tecidos do assoalho pélvico por cientistas e engenheiros básicos, ampliando assim a acessibilidade da pesquisa sobre as condições do USL e do assoalho pélvico e o estudo pré-clínico da saúde da mulher utilizando modelos de camundongos.
Introdução
Aproximadamente 50% das mulheres são acometidas pelo prolapso de órgãos pélvicos (POP)1,2. Cerca de 11% dessas mulheres enquadram-se nos critérios para serem submetidas ao reparo cirúrgico, que apresenta baixa taxa de sucesso (~30%)3,4. A DPO é caracterizada pela descida de algum ou de todos os órgãos pélvicos (bexiga, útero, colo uterino e reto) de sua posição natural devido à falha da USL e dos músculos do assoalho pélvico em fornecer suporte adequado5. Essa condição envolve disfunção anatômica e ruptura do tecido conjuntivo, bem como lesão neuromuscular, além de fatores predisponentes 3,6. A DPO está associada a múltiplos fatores, como idade, peso, paridade e tipo de parto (i.e., partos vaginais ou cesáreos). Acredita-se que esses fatores afetem a integridade mecânica de todos os tecidos do assoalho pélvico, sendo a gravidez e a paridade os principais causadores daDPO5,7,8.
Os ligamentos uterossacrais (USLs) são importantes estruturas de suporte para o útero, colo uterino e vagina e ligam o colo ao sacro4. Danos às USLs colocam as mulheres em maior risco de desenvolver POP. Acredita-se que a gravidez e o parto imponham tensão adicional à USL, o que potencialmente induz lesões e aumenta as chances de DPO. A USL é um tecido complexo composto por células musculares lisas, vasos sanguíneos e linfáticos distribuídos heterogeneamente ao longo do ligamento, que pode ser dividido em três cortes distintos: cervical, intermediário e sacral9. A integridade mecânica da USL é derivada de componentes da matriz extracelular (MEC) como colágenos, elastina e proteoglicanos 5,9,10. Sabe-se que as fibras colágenas tipo I são um importante componente de tração dos tecidos ligamentares e, portanto, provavelmente estão envolvidas na falência da USL e naDPO11.
Há falta de conhecimento sobre as causas, prevalência e efeitos da DPO em mulheres. O desenvolvimento de um modelo animal apropriado de DPO é necessário para avançar no entendimento do assoalho pélvico feminino. Camundongos e humanos têm pontos anatômicos semelhantes dentro da pelve, como ureteres, reto, bexiga, ovários e ligamentos redondos9, bem como pontos de intersecção semelhantes da USL com o útero, colo do útero e sacro. Além disso, camundongos oferecem facilidade de manipulação genética e têm o potencial de ser um modelo facilmente acessível e custo-efetivo para o estudo da POP9.
Este estudo desenvolveu um método para acessar e isolar a USL e os diferentes tecidos do assoalho pélvico de camundongos nulíparas (ou seja, nunca grávidas). As USLs extraídas foram submetidas à digestão enzimática (isto é, para remover colágenos e glicosaminoglicanos), testadas para determinar a resposta mecânica sob carga de tração e avaliadas quanto à composição bioquímica em um estudo de prova de conceito. A capacidade de isolar tecidos intactos facilitará futuras caracterizações mecânicas e bioquímicas dos componentes do assoalho pélvico, o que é um primeiro passo crucial para melhorar nossa compreensão dos riscos de lesão relacionados ao parto, gravidez e DPO.
Protocolo
Todos os experimentos e procedimentos com animais foram realizados de acordo com o protocolo #2705, aprovado pelo Comitê de Cuidados e Uso de Animais da Universidade do Colorado em Boulder. Camundongos C57BL/6J fêmeas com seis semanas de idade foram utilizados para o presente estudo. Os animais foram obtidos de fonte comercial (ver Tabela de Materiais).
1. Preparo dos animais
- Eutanásia do animal seguindo o método aprovado institucionalmente.
NOTA: O presente estudo utilizou a inalação de CO 2 em alinhamento com as diretrizes da American Veterinary Medical Association (taxa de deslocamento de 30% a 70% do volume da câmara com CO2 por minuto), seguida de luxação cervical, para garantir o sucesso da eutanásia.- Trabalhe sob um capô, se possível, para minimizar a propagação de alérgenos de ratos. Quando o mouse parar de se mover e respirar, aguarde 2 min ou mais para verificar a falta de resposta.
OBS: Se a rata estiver grávida ou no pós-parto, os filhotes devem ser eutanasiados individualmente. Filhotes E15.5 e mais velhos devem ser decapitados durante a dissecção.
- Trabalhe sob um capô, se possível, para minimizar a propagação de alérgenos de ratos. Quando o mouse parar de se mover e respirar, aguarde 2 min ou mais para verificar a falta de resposta.
- Preparar o arranjo da dissecção com uma almofada de dissecção, bisturi de 11 lâminas, tesoura fina curva afiada, dois pares de pinças, pinça curva, fio de poliglactina 5-0, microscópio dissecante e seis pinos (Figura 1, ver Tabela de Materiais).
- Coloque o mouse sobre a almofada e fixe os membros anteriores para baixo (Figura 2A). Fazer uma incisão de aproximadamente 1-1,5 cm no abdome com tesoura (Figura 2B). Utilizar suavemente a tesoura para separar a pele nas faces cranial, caudal e lateral da incisão (Figura 2C, D).
- Vire o mouse para o seu lado dorsal e descasque suavemente a pele em direção aos membros posteriores para remover a pele para longe do local da dissecção (Figura 2E-H).
- Fixe o camundongo nos membros (Figura 2I) e faça uma incisão de aproximadamente 1 cm no abdome, do tórax à pelve (Figura 2J).
NOTA: Certifique-se de não danificar os órgãos subjacentes. - Empurre suavemente os órgãos em direção ao tórax para limpar o campo de visão (Figura 2K).
OBS: Irrigar os tecidos com 1x PBS para manter a hidratação. - Limpar todo o tecido adiposo do assoalho pélvico (Figura 2L-N).
NOTA: Use fórceps para puxar e limpar suavemente a gordura dos órgãos e tecidos de interesse.

Figura 1: Um espaço de trabalho limpo com todas as ferramentas necessárias para realizar as dissecações. Clique aqui para ver uma versão maior desta figura.
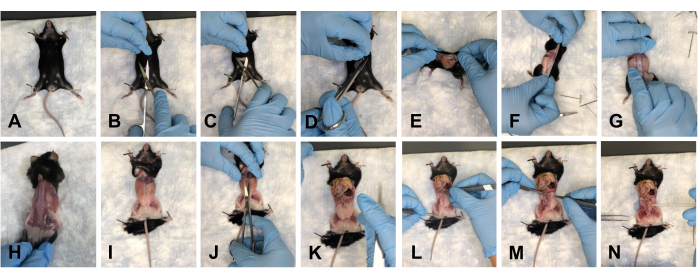
Figura 2: Retirada da pele e abertura das cavidades pélvica e torácica do camundongo. (A) Fixação de todos os membros. (B) Incisão inicial. (C) Separar a pele da fáscia subjacente com tesoura. (D) Corte da pele e preparação para a remoção. (E-G) Puxando a pele dando a volta no mouse. (H) Remoção completa da pele do lado dorsal. (I) Remoção completa da pele do tronco e refixação dos membros do rato. (J) Abertura do abdome. (K) Vista do abdome aberto. (L) Mover os órgãos para fora do campo de visão. (M) Retirar a gordura. (N) Vista do assoalho pélvico desobstruído. Clique aqui para ver uma versão maior desta figura.
2. Colheita USL
- Cortar os cornos uterinos dos ovários (Figura 3B), afastar-se do campo de visão e cortar na conexão cervical (Figura 3C).
NOTA: Os cornos uterinos podem ser identificados seguindo o esquema da Figura 3A. Irrigar os tecidos com 1x PBS para manter a hidratação. - Cortar os ureteres para longe da conexão vesical (Figura 3D).
Observação : isso é para evitar confusão com a USL. - Cortar o cólon o mais próximo possível do colo do útero (Figura 3E,F).
OBS: Irrigar os tecidos com 1x PBS para manter a hidratação. - Coloque o mouse junto com a almofada de dissecção sob o escopo dissecante para visualizar as USLs (Figura 3G).
- Use suavemente a pinça para limpar a gordura circundante das USLs.
NOTA: Use um segundo par de pinças para segurar o colo do útero em um pequeno ângulo para melhorar a visualização de onde o USL se cruza com o colo do útero. Irrigar os tecidos com 1x PBS para manter a hidratação. - Amarrar uma sutura de poliglactina 5-0 ao redor da extremidade cervical de ambas as USLs (Figura 4B, C).
NOTA: As USLs podem ser identificadas usando as imagens esquemáticas e de ampliação (Figura 4I-K) - Neste estudo, uma USL é usada para análises morfológicas ou bioquímicas (i.e., microscopia Raman, imunohistoquímica, histologia). Cortar a extremidade cervical do USL, deixando um pedaço do colo do útero preso, e cortar um pedaço de músculo do fundo do USL (Figura 4D). Colocar o tecido dissecado em banho com 1x PBS para manter o tecido hidratado (Figura 4G, H).
- Use a USL restante para testes mecânicos e geração de imagens. Cortar a extremidade cervical do USL, deixando um pedaço do colo do útero preso, para facilitar o arranjo mecânico (Figura 4D).
OBS: O tecido cervical atuará como âncora para fixar a USL durante o ensaio mecânico. - Uma vez colhidos todos os tecidos de interesse (passos 3 a 5), deslocar os fêmures da pelve (Figura 4E).
OBS: Deve-se ouvir um leve estalido quando a cabeça femoral está desarticulada da taça acetabular. - Cortar o osso pélvico das extremidades distal e proximal do osso pélvico, deixando cerca de 10 mm de tecido total (Figura 4F). Colocar o tecido dissecado em 1x PBS.

Figura 3: Assoalho pélvico desobstruído para dissecção da USL . (A) Esquema da anatomia. (B) Cortar os cornos uterinos na conexão ovariana. (C) Corte dos cornos uterinos. (D) Corte dos ureteres. (E) Corte do cólon. (F) Uma visão clara do reto e das USLs. (G) Colocação do mouse e da mesa de dissecção sob o escopo de dissecação. Clique aqui para ver uma versão maior desta figura.

Figura 4: Vista da USL e tecidos circunvizinhos e dissecção das USLs . (A) Esquema dos pontos anatômicos ao redor da USL. (B) Amarrar uma sutura ao redor das extremidades cervicais. (C) Corte das extremidades cervicais da USL. (D) Fatiamento da USL a ser utilizada para as análises bioquímicas na conexão sacral. (E) Corte dos fêmures do osso pélvico. (F) Corte da extremidade proximal da pelve. (G) Dissecar o USL em uma placa de Petri de 35 mm. (H) O LUS com a pelve aderida em uma placa de Petri de 35 mm. (I) USL e reto em aumento de 0,75x. (J) Remoção de gordura da USL. (K) Limpeza das USLs em aumento de 1,0x. Barra de escala = 2 mm. Clique aqui para ver uma versão maior desta figura.
3. Colheita da bexiga
- Após a eliminação da gordura, segure a bexiga com a pinça e levante-a suavemente em um ângulo de aproximadamente 40° (Figura 5A).
- Com a tesoura, cortar a bexiga do lado distal, logo acima do colo do útero (Figura 5B).
- Colocar o tecido em banho com 1x PBS para manter o tecido hidratado (Figura 5H).
4. Colheita do reto
- Uma vez que as USLs são desconectadas do colo do útero e a bexiga é dissecada, levante o colo do útero em um ângulo de aproximadamente 40° com a pinça. Há a fáscia retovaginal que conecta o reto e o colo do útero. Com o bisturi, corte suavemente essa conexão (Figura 5C, D).
- Cortar o osso púbico na sínfise púbica com tesoura. Amplie suavemente o espaço de trabalho para aumentar o acesso visual às inserções de tecido.
- Com a pinça, puxe suavemente o reto em direção ao tórax e use a tesoura para seguir o reto de sua face posterior até o ânus. Corte o reto no ânus (Figura 5E).
- Colocar o tecido em PBS 1x para manter o tecido hidratado (Figura 5I).
5. Colheita do complexo colo do útero-vagina
- Depois que as USLs forem removidas do colo do útero, use a pinça para segurar o colo do útero. Cortar o colo do útero o mais próximo possível da vulva com tesoura (Figura 5F, G).
NOTA: Certifique-se de cortar a sínfise púbica para ver visualmente a extremidade distal da vagina. - Colocar o tecido em PBS 1x para manter o tecido hidratado (Figura 5J).
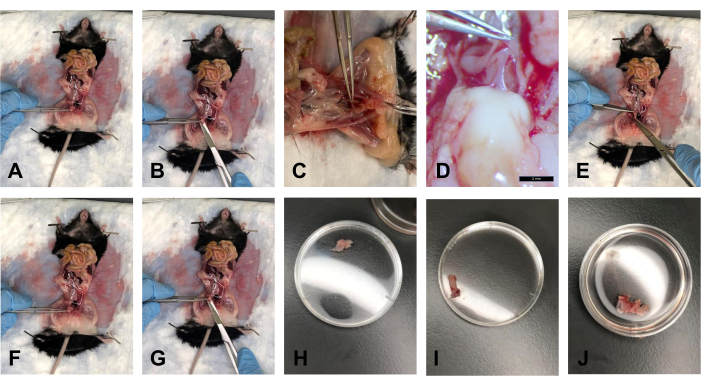
Figura 5: Dissecções da bexiga, do reto e do colo uterino/vagina . (A) Segurar a bexiga em um ângulo. (B) Cortar a bexiga. (C) Corte do tendão que liga o colo uterino e o reto. (D) O tendão em aumento de 1,0x. (E) Corte do reto. (F) Segurar o colo do útero com pinças. (G) Corte na extremidade distal da vagina. (H) A bexiga em uma placa de Petri de 35 mm. (I) O reto em uma placa de Petri de 35 mm. (J) O complexo tecido colo do útero-vagina em uma placa de Petri de 35 mm. Clique aqui para ver uma versão maior desta figura.
6. Preparo da amostra para caracterização tecidual
- Análise mecânica e visual da USL
- Coloque o USL com o acessório pélvico sobre uma parede em forma de T dentro de um poço de coloração personalizado para garantir a imersão total na solução de coloração (desenhos CAD do poço podem ser encontrados em Arquivo de Codificação Suplementar 1 e Arquivo de Codificação Suplementar 2).
OBS: Use sutura e pinça para auxiliar na colocação. - Diluir um corante comercialmente disponível que cora grupos amina livres (5 μL, ver Tabela de Materiais) em 2,5 mL de 1x PBS, adicionar bem a solução à coloração personalizada e manchar o tecido por 2 h em um balancim a 4 °C.
NOTA: Vórtice a solução antes de adicioná-la ao poço de coloração. - Durante os últimos 15 minutos de coloração, adicionar 2,5 μL de uma coloração de núcleos de células mortas disponível comercialmente (ver Tabela de Materiais) à solução.
NOTA: Vórtice a solução antes de adicionar ao poço de coloração.
- Coloque o USL com o acessório pélvico sobre uma parede em forma de T dentro de um poço de coloração personalizado para garantir a imersão total na solução de coloração (desenhos CAD do poço podem ser encontrados em Arquivo de Codificação Suplementar 1 e Arquivo de Codificação Suplementar 2).
- Análise Raman das USLs
- Fixe a USL em uma linha reta em um bloco de polidimetilsiloxano (PDMS) que está contido em um poço personalizado.
NOTA: O PDMS é usado como um substrato macio para permitir a fixação da amostra na configuração desejada. Blocos de dimensões variadas podem ser feitos misturando os dois componentes seguindo as instruções do fabricante (ver Tabela de Materiais), fundição em uma placa de Petri e, após a polimerização, corte do PDMS na geometria necessária com uma lâmina de bisturi. - Pino com pinos de insetos na alça de sutura e no músculo pélvico. Hidrate o tecido com 1x PBS.
- Fixe a USL em uma linha reta em um bloco de polidimetilsiloxano (PDMS) que está contido em um poço personalizado.
- Tecidos remanescentes
- Congelar rapidamente os tecidos restantes com nitrogênio líquido ou em um composto de incorporação apropriado, dependendo das análises desejadas.
- Guarde os tecidos a -80 °C até análises subsequentes (por exemplo, ensaios imuno-histoquímicos ou bioquímicos).
Resultados
Cada passo da dissecção de um mouse selvagem é detalhado no vídeo associado e nas figuras relacionadas ao protocolo. Para este estudo, foram utilizados camundongos fêmeas C57BL/6J com 6 semanas de idade (Tabela Suplementar 1). Três grupos amostrais com USLs tratados com diferentes enzimas foram analisados: grupo controle (sem tratamento), grupo tratado com colagenase e tratado com condroitinase. O músculo liso, os nervos e os linfáticos da USL são circundados por uma MEC rica em colágenos fibri...
Discussão
O efeito de danos estruturais nos tecidos reprodutivos femininos é pouco estudado, e um modelo animal de fácil acesso para pesquisa de POP é necessário. O camundongo é um modelo custo-efetivo que pode mimetizar estudos reprodutivos humanos16. Devido ao crescente interesse no estudo do aparelho reprodutor feminino, há necessidade de métodos que auxiliem o estudo desses tecidos. Para suprir essa necessidade, neste trabalho, estabeleceu-se um método para dissecar e preparar tecidos murinos do...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela concessão Boulder Summer Underground Research Opportunities Program (UROP) (C.B.), pela NSF Graduate Research Fellowship (L.S.), pela Schmidt Science Fellowship (C.L.), pela University of Colorado Research and Innovation Seed Grant Program (prêmio de 2020 para V.F., S.C. e K.C.), e pela Anschutz Boulder Nexus Seed Grant da Universidade do Colorado (para V.F. e K.C.). Agradecimento especial vai para o Dr. Tyler Tuttle para ajudar com o projeto da câmara de carregamento, bem como para os membros do laboratório Calve para discussões úteis.
Materiais
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
Referências
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados