Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Murin uterosakral ligamentlerin ve pelvik taban organlarının izolasyonu ve karakterizasyonu
Bu Makalede
Özet
Bu makalede, kadın üreme dokularının çalışmasını genişletmek için farelerde uterosakral ligamentlerin ve serviks, rektum ve mesane dahil olmak üzere diğer pelvik taban dokularının diseksiyonu için ayrıntılı bir protokol sunulmaktadır.
Özet
Pelvik organ prolapsusu (POP), pelvik tabanın bütünlüğünü, yapısını ve mekanik desteğini etkileyen bir durumdur. Pelvik tabandaki organlar kaslar, bağlar ve pelvik fasyalar dahil olmak üzere farklı anatomik yapılar tarafından desteklenir. Uterosakral ligament (USL) kritik bir yük taşıyıcı yapıdır ve USL'nin yaralanması POP gelişme riski daha yüksektir. Bu protokol, murin USL'lerinin ve pelvik taban organlarının diseksiyonunun yanı sıra, Raman spektroskopisi kullanılarak USL biyokimyasal bileşimi ve fonksiyonu hakkında benzersiz verilerin elde edilmesini ve mekanik davranışın değerlendirilmesini açıklamaktadır. Fareler klinik öncesi araştırmalar için paha biçilmez bir modeldir, ancak murin USL'yi diseksiyonu zor ve karmaşık bir süreçtir. Bu prosedür, USL de dahil olmak üzere murin pelvik taban dokularının diseksiyonuna rehberlik etmek için çoklu değerlendirme ve karakterizasyona olanak tanıyan bir yaklaşım sunmaktadır. Bu çalışma, pelvik taban dokularının temel bilim adamları ve mühendisler tarafından diseksiyonuna yardımcı olmayı, böylece USL ve pelvik taban koşulları üzerine yapılan araştırmaların erişilebilirliğini ve fare modellerini kullanarak kadın sağlığının klinik öncesi çalışmasını genişletmeyi amaçlamaktadır.
Giriş
Kadınların yaklaşık %50'si pelvik organ prolapsusundan (POP) etkilenir1,2. Bu kadınların yaklaşık %11'i, düşük bir başarı oranına (~%30) sahip olan cerrahi onarım kriterlerine uymaktadır 3,4. POP, USL ve pelvik taban kaslarının yeterli desteği sağlayamaması nedeniyle pelvik organların (yani mesane, uterus, serviks ve rektum) herhangi birinin veya tamamının doğal pozisyonlarından inmesi ile karakterizedir5. Bu durum, predispozan faktörlere ek olarak anatomik disfonksiyon ve bağ dokusunun bozulmasının yanı sıra nöromüsküler hasarı da içerir 3,6. POP, yaş, kilo, parite ve doğum şekli (yani vajinal veya sezaryen doğumlar) gibi birçok faktörle ilişkilidir. Bu faktörlerin tüm pelvik taban dokularının mekanik bütünlüğünü etkilediği düşünülmektedir, gebelik ve paritenin POP 5,7,8'in ana itici güçleri olduğu düşünülmektedir.
Uterosakral ligamentler (USL'ler) uterus, serviks ve vajina için önemli destekleyici yapılardır ve serviksi sakrum4'e bağlar. USL'lere verilen hasar, kadınları POP geliştirme riskine sokar. Hamilelik ve doğumun, USL'ye potansiyel olarak yaralanmaya neden olan ve POP şansını artıran ek bir baskı oluşturduğuna inanılmaktadır. USL, ligament boyunca heterojen olarak dağılmış düz kas hücreleri, kan damarları ve lenfatiklerden oluşan karmaşık bir dokudur ve üç ayrı bölüme ayrılabilir: servikal, orta ve sakral bölge9. USL'nin mekanik bütünlüğü, kollajenler, elastin ve proteoglikanlar gibi hücre dışı matriks (ECM) bileşenlerinden türetilir 5,9,10. Tip I kollajen liflerinin, ligamentöz dokuların önemli bir yük taşıyan gerilme bileşeni olduğu bilinmektedir ve bu nedenle muhtemelen USL yetmezliği ve POP11 ile ilgilidir.
Kadınlarda POP'un nedenleri, prevalansı ve etkileri hakkında bilgi eksikliği vardır. Uygun bir POP hayvan modelinin geliştirilmesi, kadın pelvik tabanı hakkındaki anlayışımızı ilerletmek için gereklidir. Fareler ve insanlar, pelvis içinde üreterler, rektum, mesane, yumurtalıklar ve yuvarlak bağlar9 gibi benzer anatomik işaretlere ve USL'nin uterus, serviks ve sakrum ile benzer kesişme noktalarına sahiptir. Ayrıca, fareler genetik manipülasyon kolaylığı sunar ve POP9 çalışması için kolayca erişilebilir, uygun maliyetli bir model olma potansiyeline sahiptir.
Bu çalışma, USL'ye ve farklı pelvik taban dokularına nullipar (yani asla hamile olmayan) farelerden erişmek ve izole etmek için bir yöntem geliştirdi. Ekstrakte edilen USL'ler enzimatik sindirime tabi tutuldu (yani, kollajenleri ve glikozaminoglikanları çıkarmak için), çekme yükü altında mekanik tepkiyi belirlemek için test edildi ve bir kavram kanıtı çalışmasında biyokimyasal bileşim için değerlendirildi. Bozulmamış dokuları izole etme yeteneği, pelvik taban bileşenlerinin daha fazla mekanik ve biyokimyasal karakterizasyonunu kolaylaştıracaktır, bu da doğum, hamilelik ve POP ile ilgili yaralanma riskleri hakkındaki anlayışımızı geliştirmeye yönelik çok önemli bir ilk adımdır.
Protokol
Tüm hayvan deneyleri ve prosedürleri, Colorado Boulder Üniversitesi Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanan protokol # 2705'e göre gerçekleştirildi. Bu çalışmada altı haftalık dişi C57BL/6J fareler kullanıldı. Hayvanlar ticari bir kaynaktan elde edilmiştir (bakınız Malzeme Tablosu).
1. Hayvan hazırlama
- Kurumsal olarak onaylanmış yöntemi izleyerek hayvanı ötenazi yapın.
NOT: Bu çalışma, başarılı ötenaziyi sağlamak için Amerikan Veteriner Hekimleri Birliği'nin kılavuzlarına (dakikada CO2 ile oda hacminin% 30 ila% 70'lik bir yer değiştirme oranı) uygun olarak CO2 inhalasyonunu ve ardından servikal çıkığı kullanmıştır.- Mümkünse, fare alerjenlerinin yayılmasını en aza indirmek için bir başlık altında çalışın. Fare hareket etmeyi ve nefes almayı bıraktığında, yanıt eksikliğini doğrulamak için 2 dakika veya daha fazla bekleyin.
NOT: Fare hamileyse veya doğum sonrasıysa, yavrular ayrı ayrı ötenazi yapılmalıdır. E15.5 ve daha yaşlı yavruların diseksiyon sırasında başları kesilmelidir.
- Mümkünse, fare alerjenlerinin yayılmasını en aza indirmek için bir başlık altında çalışın. Fare hareket etmeyi ve nefes almayı bıraktığında, yanıt eksikliğini doğrulamak için 2 dakika veya daha fazla bekleyin.
- Diseksiyon düzeneğini bir diseksiyon pedi, 11 bıçaklı bir neşter, kavisli ince keskin makas, iki çift forseps, kavisli forseps, 5-0 poliglactin sütürü, bir diseksiyon mikroskobu ve altı pim ile hazırlayın (Şekil 1, bkz.
- Fareyi pedin üzerine getirin ve ön ayakları aşağı doğru sabitleyin (Şekil 2A). Makasla karın içinde yaklaşık 1-1,5 cm'lik bir kesi yapın (Şekil 2B). Kesinin kraniyal, kaudal ve lateral taraflarındaki cildi ayırmak için makası nazikçe kullanın (Şekil 2C, D).
- Fareyi sırt tarafına çevirin ve cildi diseksiyon bölgesinden uzaklaştırmak için cildi arka bacaklara doğru yavaşça soyun (Şekil 2E-H).
- Fareyi uzuvlara sabitleyin (Şekil 2I) ve göğüs kafesinden pelvise kadar karın içine yaklaşık 1 cm'lik bir kesi yapın (Şekil 2J).
NOT: Altta yatan organlara zarar vermediğinizden emin olun. - Görüş alanını temizlemek için organları yavaşça göğüs kafesine doğru itin (Şekil 2K).
NOT: Hidrasyonu korumak için dokuları 1x PBS ile sulayın. - Pelvik tabandaki tüm yağ dokusunu temizleyin (Şekil 2L-N).
NOT: İlgili organ ve dokulardaki yağları nazikçe çekmek ve temizlemek için forseps kullanın.

Şekil 1: Diseksiyonları gerçekleştirmek için gereken tüm araçlara sahip temiz bir çalışma alanı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
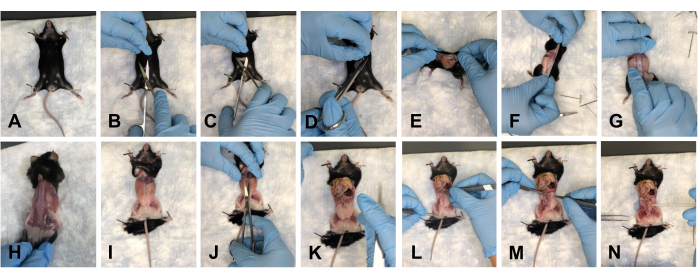
Şekil 2: Cildin çıkarılması ve farenin pelvik ve torasik boşluklarının açılması. (A) Tüm uzuvları sabitlemek. (B) İlk insizyon. (C) Makas kullanarak derinin altta yatan fasyadan ayrılması. (D) Cildin kesilmesi ve çıkarılmaya hazırlanması. (E-G) Farenin etrafında dolaşarak cildi çekmek. (H) Cildin sırt tarafından tamamen çıkarılması. (I) Cildin gövdeden tamamen çıkarılması ve fare uzuvlarının yeniden sabitlenmesi. (J) Karnın açılması. (K) Açık karın görünümü. (L) Organları görüş alanı dışına taşımak. (M) Yağın uzaklaştırılması. (N) Temizlenmiş pelvik tabanın görünümü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. USL hasadı
- Rahim boynuzlarını yumurtalıklardan kesin (Şekil 3B), görüş alanından uzaklaştırın ve servikal bağlantıdan kesin (Şekil 3C).
NOT: Rahim boynuzları Şekil 3A'daki şematik izlenerek tanımlanabilir. Hidrasyonu korumak için dokuları 1x PBS ile sulayın. - Üreterleri mesane bağlantısından uzaklaştırın (Şekil 3D).
NOT: Bu, USL ile karışıklığı önlemek içindir. - Kolonu servikse mümkün olduğunca yakın kesin (Şekil 3E, F).
NOT: Hidrasyonu korumak için dokuları 1x PBS ile sulayın. - USL'leri görselleştirmek için fareyi diseksiyon pedi ile birlikte diseksiyon kapsamının altına yerleştirin (Şekil 3G).
- Çevredeki yağları USL'lerden temizlemek için forsepsleri yavaşça kullanın.
NOT: USL'nin serviks ile kesiştiği yerin görselleştirilmesini geliştirmek için serviksi küçük bir açıyla tutmak için ikinci bir forseps çifti kullanın. Hidrasyonu korumak için dokuları 1x PBS ile sulayın. - Her iki USL'nin servikal ucunun etrafına 5-0 poliglactin sütürü bağlayın (Şekil 4B, C).
NOT: USL'ler şematik ve büyütme görüntüleri kullanılarak tanımlanabilir (Şekil 4I-K) - Bu çalışmada, morfolojik veya biyokimyasal analizler (yani Raman mikroskobu, immünohistokimya, histoloji) için bir USL kullanılmıştır. USL'nin servikal ucunu kesin, serviksin bir parçasını bağlı bırakın ve USL'nin altından bir kas parçası kesin (Şekil 4D). Disseke edilmiş dokuyu, dokuyu nemli tutmak için 1x PBS içeren bir banyoya yerleştirin (Şekil 4G, H).
- Mekanik test ve görüntüleme için kalan USL'yi kullanın. Mekanik kurulumu kolaylaştırmak için USL'nin servikal ucunu kesin, bir serviks parçasını bağlı bırakın (Şekil 4D).
NOT: Servikal doku, mekanik test sırasında USL'yi sabitlemek için bir çapa görevi görecektir. - İlgilenilen tüm dokular toplandıktan sonra (adım 3-5), femurları pelvisten çıkarın (Şekil 4E).
NOT: Femur başı asetabuler kaptan ayrıldığında hafif bir tıklama sesi duyulmalıdır. - Pelvik kemiği pelvik kemiğin distal ve proksimal uçlarından keserek yaklaşık 10 mm toplam doku bırakın (Şekil 4F). Disseke edilmiş dokuyu 1x PBS'ye yerleştirin.

Şekil 3: USL diseksiyonu için temizlenmiş pelvik taban . (A) Anatominin şeması. (B) Yumurtalık bağlantısında uterus boynuzlarının kesilmesi. (C) Rahim boynuzlarının kesilmesi. (D) Üreterlerin kesilmesi. (E) Kolonun kesilmesi. (F) Rektum ve USL'lerin net bir görünümü. (G) Fare ve diseksiyon pedinin diseksiyon kapsamının altına yerleştirilmesi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 4: USL ve çevresindeki dokuların görünümü ve USL'lerin diseksiyonu. (A) USL'yi çevreleyen anatomik işaretlerin şeması. (B) Servikal uçların etrafına bir dikiş bağlamak. (C) USL'nin servikal uçlarının kesilmesi. (D) Sakral bağlantıdaki biyokimyasal analizler için kullanılmak üzere USL'nin kesilmesi. (E) Femurların pelvik kemikten kesilmesi. (F) Pelvisin proksimal ucunun kesilmesi. (G) USL'nin 35 mm'lik bir Petri kabında diseke edilmesi. (H) 35 mm'lik bir petri kabında pelvisi takılı USL. (I) USL ve rektum 0.75x büyütmede. (J) USL'den yağ alınması. (K) USL'lerin 1,0x büyütmede temizlenmesi. Ölçek çubuğu = 2 mm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Mesane hasadı
- Yağ temizlendikten sonra, mesaneyi forseps ile tutun ve yaklaşık 40 ° 'lik bir açıyla yavaşça kaldırın (Şekil 5A).
- Makasla, mesaneyi distal taraftan, rahim ağzının hemen üstünden dilimleyin (Şekil 5B).
- Dokuyu nemli tutmak için dokuyu 1x PBS ile bir banyoya yerleştirin (Şekil 5H).
4. Rektum hasadı
- USL'lerin serviksle bağlantısı kesildikten ve mesane diseke edildikten sonra, serviksi forseps ile yaklaşık 40 ° 'lik bir açıyla kaldırın. Rektum ve serviksi birbirine bağlayan rektovajinal fasya vardır. Neşterle bu bağlantıyı yavaşça kesin (Şekil 5C, D).
- Kasık kemiğini kasık simfizinde makas kullanarak kesin. Doku yerleştirmelerine görsel erişimi artırmak için çalışma alanını yavaşça genişletin.
- Forsepsle, rektumu yavaşça toraksa doğru çekin ve rektumu arka tarafından anüse kadar takip etmek için makası kullanın. Rektumu anüste kesin (Şekil 5E).
- Dokuyu nemli tutmak için dokuyu 1x PBS'ye yerleştirin (Şekil 5I).
5. Serviks-vajina kompleksi hasadı
- USL'ler serviksten çıkarıldıktan sonra, serviksi tutmak için forsepsleri kullanın. Serviksi makas kullanarak vulvaya mümkün olduğunca yakın kesin (Şekil 5F, G).
NOT: Vajinanın distal ucunu görsel olarak görmek için kasık simfizini kestiğinizden emin olun. - Dokuyu nemli tutmak için dokuyu 1x PBS'ye yerleştirin (Şekil 5J).
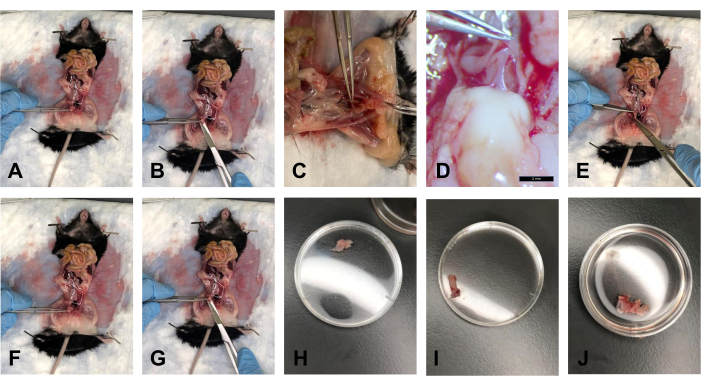
Şekil 5: Mesane, rektum ve serviks/vajina diseksiyonları . (A) Mesanenin bir açıyla tutulması. (B) Mesanenin kesilmesi. (C) Serviks ve rektumu birbirine bağlayan tendonun kesilmesi. (D) Tendon 1.0x büyütmede. (E) Rektumun kesilmesi. (F) Forseps ile servikse tutunmak. (G) Vajinanın distal ucunda kesme. (H) 35 mm'lik Petri kabındaki mesane. (I) 35 mm'lik Petri kabındaki rektum. (J) 35 mm'lik Petri kabındaki serviks-vajina doku kompleksi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
6. Doku karakterizasyonu için numune hazırlama
- USL'nin mekanik ve görsel analizleri
- Boyama çözeltisine tam daldırma sağlamak için USL'yi pelvik ataşman ile özel bir boyama kuyusu içinde T şeklinde bir duvarın üzerine yerleştirin (kuyunun CAD çizimleri Ek Kodlama Dosyası 1 ve Ek Kodlama Dosyası 2'de bulunabilir).
NOT: Yerleştirmeye yardımcı olması için dikiş ve forseps kullanın. - Serbest amin gruplarını (5 μL, Malzeme Tablosuna bakınız) 2,5 mL 1x PBS'de boyayan ticari olarak temin edilebilen bir boyayı seyreltin, çözeltiyi özel boyama kuyusuna ekleyin ve dokuyu 4 ° C'de bir rocker üzerinde 2 saat boyunca lekeleyin.
NOT: Boyama kuyusuna eklemeden önce çözeltiyi vorteks. - Son 15 dakikalık boyama sırasında, çözeltiye ticari olarak temin edilebilen 2.5 μL ölü hücre çekirdeği boyası ekleyin ( Malzeme Tablosuna bakınız).
NOT: Boyama kuyucuğuna eklemeden önce çözeltiyi vorteks.
- Boyama çözeltisine tam daldırma sağlamak için USL'yi pelvik ataşman ile özel bir boyama kuyusu içinde T şeklinde bir duvarın üzerine yerleştirin (kuyunun CAD çizimleri Ek Kodlama Dosyası 1 ve Ek Kodlama Dosyası 2'de bulunabilir).
- USL'lerin Raman analizi
- USL'yi, özel bir kuyucukta bulunan bir polidimetilsiloksan (PDMS) bloğu üzerinde düz bir çizgide sabitleyin.
NOT: PDMS, numunenin istenen konfigürasyonda sabitlenmesini sağlamak için yumuşak bir substrat olarak kullanılır. Farklı boyutlardaki bloklar, üreticinin talimatlarını izleyerek iki bileşenin karıştırılmasıyla (bakınız Malzeme Tablosu), bir Petri kabına dökülerek ve polimerizasyondan sonra PDMS'yi bir neşter bıçağı ile gerekli geometriye keserek yapılabilir. - Dikiş halkasında ve pelvik kasta böcek pimleri ile iğneleyin. Dokuyu 1x PBS ile nemlendirin.
- USL'yi, özel bir kuyucukta bulunan bir polidimetilsiloksan (PDMS) bloğu üzerinde düz bir çizgide sabitleyin.
- Kalan dokular
- İstenilen analizlere bağlı olarak, kalan dokuları sıvı azotla veya uygun bir gömme bileşiğinde dondurun.
- Sonraki analizlere kadar dokuları -80 ° C'de saklayın (örneğin, immünohistokimyasal veya biyokimyasal tahliller).
Sonuçlar
Vahşi tipte bir farenin diseksiyonunun her adımı, ilişkili videoda ve protokolle ilgili şekillerde ayrıntılı olarak açıklanmaktadır. Bu çalışmada 6 haftalık dişi C57BL/6J fareler kullanıldı (Ek Tablo 1). Farklı enzimlerle tedavi edilen USL'lere sahip üç örnek grubu analiz edildi: kontrol (tedavi yok), kollajenaz ile tedavi edilen ve kondroitinaz ile tedavi edilen gruplar. USL'deki düz kas, sinirler ve lenfatikler, dokuya mekanik bütünlük sağladığı düşünülen fibriller kol...
Tartışmalar
Yapısal hasarın kadın üreme dokuları üzerindeki etkisi yeterince çalışılmamıştır ve POP araştırması için kolay erişilebilir bir hayvan modeline ihtiyaç vardır. Fare, insan üreme çalışmalarını taklit edebilen uygun maliyetli bir modeldir16. Kadın üreme sisteminin çalışmasına artan ilgi nedeniyle, bu dokuların çalışmasına yardımcı olacak yöntemlere ihtiyaç vardır. Bu ihtiyacı karşılamak için, bu çalışmada, murin pelvik taban dokularının yapısal ve ...
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma, CU Boulder Yaz Yeraltı Araştırma Fırsatları Programı (UROP) hibesi (C.B.), NSF Lisansüstü Araştırma Bursu (L.S.), Schmidt Bilim Bursu (CL), Colorado Üniversitesi Araştırma ve İnovasyon Tohum Hibe Programı (2020 ödülü V.F., S.C. ve KC) ve Colorado Üniversitesi'ndeki Anschutz Boulder Nexus Tohum Bursu (VF ve K.C.'ye) tarafından desteklenmiştir. Özel teşekkür, yükleme odası tasarımıyla ilgili yardım için Dr. Tyler Tuttle'a ve yararlı tartışmalar için Calve laboratuvarı üyelerine gider.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
Referanslar
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır