このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス子宮仙靭帯と骨盤底器官の分離と特性評価
要約
この記事では、女性の生殖組織の研究を拡大するために、マウスの子宮頸部、直腸、膀胱を含む子宮仙靭帯およびその他の骨盤底組織を解剖するための詳細なプロトコルを紹介します。
要約
骨盤臓器脱(POP)は、骨盤底の完全性、構造、および機械的サポートに影響を与える状態です。骨盤底の臓器は、筋肉、靭帯、骨盤筋膜など、さまざまな解剖学的構造によって支えられています。子宮仙靭帯(USL)は重要な耐荷重構造であり、USLの損傷によりPOPを発症するリスクが高くなります。本プロトコルでは、ラマン分光法を用いたUSL生化学的組成と機能に関する独自のデータの取得、および機械的挙動の評価とともに、マウスUSLと骨盤底器官の解剖について説明します。マウスは前臨床研究にとって非常に貴重なモデルですが、マウスUSLの解剖は困難で複雑なプロセスです。この手順は、USLを含むマウス骨盤底組織の解剖をガイドし、複数の評価と特性評価を可能にするアプローチを提示します。この研究は、基礎科学者やエンジニアによる骨盤底組織の解剖を支援し、USLおよび骨盤底の状態に関する研究や、マウスモデルを使用した女性の健康の前臨床試験へのアクセスを拡大することを目的としています。
概要
女性の約50%が骨盤臓器脱(POP)の影響を受けています1,2。これらの女性の約11%は、成功率が低い外科的修復を受けるための基準を満たしています(~30%)3,4。POPは、USLと骨盤底筋が適切なサポートを提供できないために、骨盤内臓器(すなわち、膀胱、子宮、子宮頸部、および直腸)のいずれかまたはすべてが自然な位置から降下することを特徴としています5。この状態は、素因3,6に加えて、解剖学的機能障害および結合組織の破壊、ならびに神経筋損傷を伴う。POPは、年齢、体重、パリティ、分娩タイプ(すなわち、経腟分娩または帝王切開出産)などの複数の要因に関連しています。これらの要因は、すべての骨盤底組織の機械的完全性に影響を与えると考えられており、妊娠と同等性がPOP5,7,8の主な推進力であると考えられています。
子宮仙骨靭帯(USL)は、子宮、子宮頸部、膣の重要な支持構造であり、子宮頸部を仙骨につなぎます4。USLの損傷により、女性はPOPを発症するリスクが高くなります。妊娠と出産はUSLに追加の負担をかけ、怪我を誘発し、POPの可能性を高める可能性があると考えられています。USLは、靭帯に沿って不均一に分布する平滑筋細胞、血管、リンパ管で構成される複雑な組織であり、頸部、中間部、仙骨部の9つの異なるセクションに分けることができます。USLの機械的完全性は、コラーゲン、エラスチン、プロテオグリカンなどの細胞外マトリックス(ECM)成分に由来します5、9、10。I型コラーゲン線維は、靭帯組織の主要な耐荷重引張成分であることが知られているため、USL障害およびPOP11に関与している可能性があります。
女性におけるPOPの原因、有病率、および影響に関する知識が不足しています。POPの適切な動物モデルの開発は、女性の骨盤底の理解を深めるために必要です。マウスとヒトは、尿管、直腸、膀胱、卵巣、丸い靭帯など、骨盤内に同様の解剖学的ランドマークを持っています9、およびUSLと子宮、子宮頸部、仙骨との同様の交点。さらに、マウスは遺伝子操作が容易であり、POP9の研究のための容易にアクセスでき、費用効果の高いモデルになる可能性があります。
この研究では、未経産(つまり、妊娠していない)マウスからUSLとさまざまな骨盤底組織にアクセスして分離する方法を開発しました。抽出したUSLを酵素消化(すなわち、コラーゲンおよびグリコサミノグリカンを除去する)にかけ、引張荷重下での機械的応答を決定するために試験し、概念実証研究において生化学的組成を評価した。無傷の組織を分離する能力は、骨盤底コンポーネントのさらなる機械的および生化学的特性評価を容易にし、これは出産、妊娠、およびPOPに関連する傷害リスクの理解を深めるための重要な第一歩です。
プロトコル
すべての動物実験および手順は、コロラド大学ボルダー校の動物管理および使用委員会によって承認されたプロトコル#2705に従って実施されました。本研究では、6週齢の雌C57BL / 6Jマウスを使用しました。動物は商業的な供給源から入手した( 材料表を参照)。
1.動物の準備
- 制度的に承認された方法に従って動物を安楽死させる。
注:本研究では、米国獣医師会のガイドラインに沿ってCO 2吸入を使用しました(チャンバー容積の30%から70%の変位率 CO2 /分)、続いて頸部脱臼、成功した安楽死を確実にするために。- 可能であれば、マウスアレルゲンの拡散を最小限に抑えるためにフードの下で作業してください。マウスの動きと呼吸が止まったら、2分以上待って応答がないことを確認します。
注意: マウスが妊娠中または産後の場合、子犬は個別に安楽死させる必要があります。子犬E15.5以上は、解剖中に斬首する必要があります。
- 可能であれば、マウスアレルゲンの拡散を最小限に抑えるためにフードの下で作業してください。マウスの動きと呼吸が止まったら、2分以上待って応答がないことを確認します。
- 解剖パッド、11枚羽根メス、湾曲した細い鋭利なハサミ、2対の鉗子、湾曲した鉗子、5-0ポリグラクチン縫合糸、解剖顕微鏡、および6本のピンを使用して解剖セットアップを準備します(図1、 材料表を参照)。
- パッドの上にマウスを置き、前肢を下に固定します(図2A)。ハサミで腹部を約1〜1.5 cm切開します(図2B)。はさみをそっと使用して、切開部の頭蓋側、尾側、および外側の皮膚を分離します(図2C、D)。
- マウスを背側にひっくり返し、後肢に向かって皮膚をそっと剥がして、解剖部位から皮膚を取り除きます(図2E-H)。
- マウスを四肢に固定し(図2I)、胸部から骨盤まで腹部を約1cm切開します(図2J)。
注意: 下にある臓器を傷つけないように注意してください。 - 臓器を胸部に向かってそっと押して、視野をクリアします(図2K)。
注意: 水分補給を維持するために、1x PBSで組織を洗浄します。 - 骨盤底からすべての脂肪組織を取り除きます(図2L-N)。
注意: 鉗子を使用して、目的の臓器や組織から脂肪をそっと引き抜き、取り除きます。

図1:解剖を実行するために必要なすべてのツールを備えたクリーンなワークスペース。 この図の拡大版を表示するには、ここをクリックしてください。
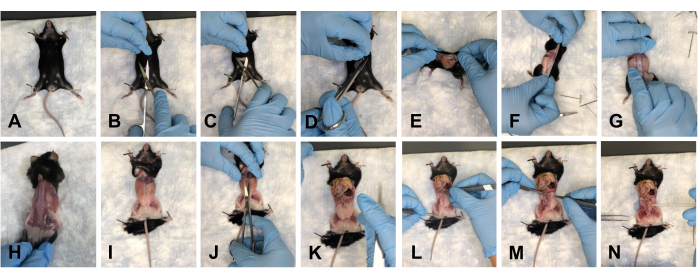
図2:マウスの骨盤腔と胸腔の皮膚の除去と開口部。 (A)すべての手足を固定します。(B)初期切開。(C)はさみを使用して下にある筋膜から皮膚を分離します。(D)皮膚を切断し、除去の準備をします。(E-G)マウスの周りを回って皮膚を引き剥がします。(H)背側から皮膚を完全に除去する。(I)胴体から皮膚を完全に除去し、マウスの手足を再び固定します。(J)腹部の開口部。(K)開いた腹部のビュー。(L)臓器を視野外に移動する。(m)脂肪を除去する。(N)クリアされた骨盤底のビュー。この図の拡大版を表示するには、ここをクリックしてください。
2. USLハーベスティング
- 卵巣から子宮角を切り取り(図3B)、視野から引き離し、頸部接続部で切断します(図3C)。
注意: 子宮角は、 図3Aの回路図に従って識別できます。水分補給を維持するために1x PBSで組織を洗浄します。 - 尿管を膀胱接続部から切り離します(図3D)。
注:これは、USLとの混同を避けるためです。 - 結腸を子宮頸部のできるだけ近くで切ります(図3E、F)。
注意: 水分補給を維持するために、1x PBSで組織を洗浄します。 - マウスと解剖パッドを解剖スコープの下に置き、USLを視覚化します(図3G)。
- 鉗子をそっと使用して、USLから周囲の脂肪を取り除きます。
注意: 2番目の鉗子のペアを使用して子宮頸部を小さな角度で持ち上げ、USLが子宮頸部と交差する場所の視覚化を強化します。水分補給を維持するために1x PBSで組織を洗浄します。 - 両方のUSLの頸部端の周りに5-0ポリグラクチン縫合糸を結びます(図4B、C)。
注意: USLは、回路図と倍率画像を使用して識別できます(図4I-K) - この研究では、1つのUSLを形態学的または生化学的分析(すなわち、ラマン顕微鏡、免疫組織化学、組織学)に使用します。USLの頸部の端を切り取り、子宮頸部の一部を取り付けたままにし、USLの底から筋肉の一部を切り取ります(図4D)。解剖した組織を1x PBSの浴に入れて、組織を水和状態に保ちます(図4G、H)。
- 残りのUSLは、機械的テストとイメージングに使用します。機械的セットアップを容易にするために、子宮頸部を取り付けたまま、USLの頸部端を切断します(図4D)。
注意: 子宮頸部組織は、機械的テスト中にUSLを固定するためのアンカーとして機能します。 - 関心のあるすべての組織が採取されたら(ステップ3〜5)、大腿骨を骨盤から脱臼させます(図4E)。
注意: 大腿骨頭が寛骨臼カップから関節を離すと、かすかなカチッという音が聞こえるはずです。 - 骨盤骨の遠位端と近位端から骨盤骨を切り取り、約10 mmの全組織を残します(図4F)。解剖した組織を1x PBSに入れます。

図3:USL解剖のための骨盤底のクリア 。 (A)解剖学の概略図。(B)卵巣接続部で子宮角を切断する。(C)子宮角を切り落とす。(D)尿管の切断。(E)結腸の切断。(F)直腸とUSLの明確なビュー。(G)マウスと解剖パッドを解剖スコープの下に置きます。 この図の拡大版を表示するには、ここをクリックしてください。

図4:USLとその周辺組織の図とUSLの解剖。 (A)USLを取り巻く解剖学的ランドマークの概略図。(B)頸部の端に縫合糸を結ぶ。(C)USLの頸部端を切り取る。(D)仙骨接続部での生化学的分析に使用するUSLを切り取る。(E)骨盤骨からの大腿骨の切断。(F)骨盤の近位端を切断する。(G)USLを35mmのペトリ皿で解剖する。(H)35mmのペトリ皿に骨盤が取り付けられたUSL。(I)0.75倍の倍率でのUSLと直腸。(J)USLから脂肪を除去する。(K)1.0倍の倍率でのUSLのクリーニング。スケールバー = 2 mm. この図の拡大版を表示するには、ここをクリックしてください。
3.膀胱摘出
- 脂肪が取り除かれたら、鉗子で膀胱を持ち、約40°の角度でゆっくりと持ち上げます(図5A)。
- はさみで、子宮頸部の真上の遠位側から膀胱を切り取ります(図5B)。
- 組織を1x PBSの入った浴に入れて、組織を水和状態に保ちます(図5H)。
4.直腸収穫
- USLが子宮頸部から切り離され、膀胱が解剖されたら、鉗子で子宮頸部を約40°の角度で持ち上げます。直腸と子宮頸部をつなぐ直腸膣筋膜があります。メスで、この接続をそっと切断します(図5C、D)。
- ハサミを使用して恥骨結合で恥骨を切ります。ワークスペースをゆっくりと広げて、組織の挿入物への視覚的なアクセスを増やします。
- 鉗子で直腸を胸部に向かってそっと引っ張り、ハサミを使って直腸を後側から肛門までたどります。肛門で直腸を切断します(図5E)。
- 組織を1x PBSに入れて、組織を水和状態に保ちます(図5I)。
5.子宮頸部 - 膣複合体収穫
- USLが子宮頸部から取り外された後、鉗子を使用して子宮頸部を保持します。ハサミを使用して子宮頸部を外陰部のできるだけ近くで切ります(図5F、G)。
注意: 膣の遠位端を視覚的に見るために、恥骨結合を必ず切断してください。 - 組織を1x PBSに入れて、組織を水和状態に保ちます(図5J)。
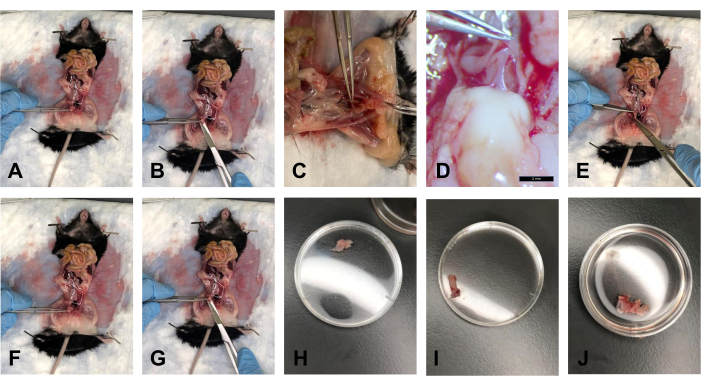
図5:膀胱、直腸、および子宮頸部/膣の解剖。 (A)膀胱を斜めに保持します。(B)膀胱を切断する。(C)子宮頸部と直腸をつなぐ腱を切断する。(D)1.0倍の倍率での腱。(E)直腸を切断する。(F)鉗子で子宮頸部をつかむ。(G)膣の遠位端での切断。(H)35mmのペトリ皿に入った膀胱。(I)35mmのペトリ皿に入った直腸。(J)35mmのペトリ皿に入った子宮頸部-膣組織複合体。この図の拡大版を表示するには、ここをクリックしてください。
6.組織特性評価のためのサンプル調製
- USLの機械的および視覚的分析
- 骨盤アタッチメント付きのUSLをカスタム染色ウェル内のT字型壁に配置して、染色溶液に完全に浸るようにします(ウェルのCAD図面は、補足コーディングファイル1および補足コーディングファイル2にあります)。
注意: 縫合糸と鉗子を使用して、配置に役立ててください。 - 遊離アミン基を染色する市販の色素(5 μL、 材料表を参照)を2.5 mLの1x PBSで希釈し、溶液をカスタム染色ウェルに加え、4°Cのロッカーで組織を2時間染色します。
注:染色ウェルに加える前に、溶液をボルテックスしてください。 - 染色の最後の15分間に、市販の死細胞核染色剤2.5 μL( 材料表を参照)を溶液に加えます。
注:染色ウェルに加える前に溶液をボルテックスします。
- 骨盤アタッチメント付きのUSLをカスタム染色ウェル内のT字型壁に配置して、染色溶液に完全に浸るようにします(ウェルのCAD図面は、補足コーディングファイル1および補足コーディングファイル2にあります)。
- USLのラマン分析
- カスタムウェルに含まれるポリジメチルシロキサン(PDMS)ブロックにUSLを直線で固定します。
注:PDMSは、サンプルを目的の構成にピン留めできるように、ソフト基板として使用されます。さまざまな寸法のブロックは、製造元の指示に従って2つの成分を混合し( 材料表を参照)、ペトリ皿に鋳造し、重合後、メスの刃でPDMSを必要な形状に切断することによって作成できます。 - 縫合ループと骨盤筋に昆虫ピンでピン留めします。1x PBSで組織を水和します。
- カスタムウェルに含まれるポリジメチルシロキサン(PDMS)ブロックにUSLを直線で固定します。
- 残りの組織
- 残りの組織を液体窒素または適切な包埋化合物でスナップ凍結します, 目的の分析に応じて.
- その後の分析(免疫組織化学的または生化学的アッセイなど)まで、組織を-80°Cで保存します。
結果
野生型マウスの解剖の各ステップは、プロトコルに関連する関連ビデオおよび図に詳述されている。この研究では、6週齢の雌C57BL / 6Jマウスを使用しました(補足表1)。異なる酵素で処理されたUSLを含む3つのサンプルグループ、対照(無処理)、コラゲナーゼ処理群、およびコンドロイチナーゼ処理群を分析しました。USLの平滑筋、神経、リンパ管は、原線維性コラーゲンとグリコサ...
ディスカッション
女性の生殖組織に対する構造的損傷の影響は十分に研究されておらず、POP研究のために簡単にアクセスできる動物モデルが必要です。マウスは、ヒトの生殖研究を模倣できる費用対効果の高いモデルです16。女性の生殖器系の研究への関心が高まっているため、これらの組織の研究を支援する方法が必要です。このニーズに対処するために、この研究では、構造的および機?...
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、CUボルダーサマーアンダーグラウンドリサーチオポチュニティプログラム(UROP)助成金(CB)、NSF大学院研究フェローシップ(LS)、シュミットサイエンスフェローシップ(C.L.)、コロラド大学リサーチ&イノベーションシードグラントプログラム(V.F.、S.C.、およびK.C.への2020年賞)、およびコロラド大学のアンシュッツボルダーネクサスシードグラント(VFおよびK.C.に)によってサポートされました。ローディングチャンバーの設計を手伝ってくれたタイラー・タトル博士と、有益な議論をしてくれたCalveラボのメンバーに特別な謝辞を送ります。
資料
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
参考文献
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved