JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 자궁천골 인대와 골반저 장기의 분리 및 특성화
요약
이 기사는 여성 생식 조직에 대한 연구를 확장하기 위해 생쥐의 자궁경부, 직장 및 방광을 포함한 자궁천골 인대 및 기타 골반저 조직을 해부하기 위한 자세한 프로토콜을 제시합니다.
초록
골반 장기 탈출증(POP)은 골반저의 무결성, 구조 및 기계적 지지에 영향을 미치는 상태입니다. 골반저의 장기는 근육, 인대 및 골반 근막을 포함한 다양한 해부학적 구조에 의해 지지됩니다. 자궁천골 인대(uterosacral ligament, USL)는 하중을 지탱하는 중요한 구조이며, USL의 손상은 POP 발병 위험을 높입니다. 현재 프로토콜은 라만 분광법을 사용한 USL 생화학적 구성 및 기능에 대한 고유한 데이터 수집 및 기계적 거동 평가와 함께 쥐 USL 및 골반저 장기의 해부에 대해 설명합니다. 마우스는 전임상 연구를 위한 매우 중요한 모델이지만, 쥐 USL을 해부하는 것은 어렵고 복잡한 과정입니다. 이 절차는 USL을 포함한 쥐 골반저 조직의 해부를 안내하여 여러 평가 및 특성화를 가능하게 하는 접근 방식을 제시합니다. 이 작업은 기초 과학자와 엔지니어가 골반저 조직의 해부를 지원하여 USL 및 골반저 상태에 대한 연구와 마우스 모델을 사용한 여성 건강에 대한 전임상 연구의 접근성을 확대하는 것을 목표로 합니다.
서문
여성의 약 50%가 골반 장기 탈출증(POP)의 영향을 받습니다1,2. 이 여성의 약 11%는 성공률이 낮은 외과적 치료를 받기 위한 기준에 부합합니다(~30%)3,4. POP는 USL과 골반저 근육이 적절한 지지력을 제공하지 못하여 골반 장기(방광, 자궁, 자궁경부, 직장)의 일부 또는 전부가 자연적인 위치에서 하강하는 것을 특징으로 한다5. 이 상태는 해부학 적 기능 장애와 결합 조직의 파괴, 신경근 손상뿐만 아니라 predisposing 요인 3,6을 포함합니다. POP는 연령, 체중, 출산 및 분만 유형(예: 질 분만 또는 제왕절개)과 같은 여러 요인과 관련이 있습니다. 이러한 요인은 모든 골반저 조직의 기계적 무결성에 영향을 미치는 것으로 생각되며, 임신과 출산율이 POP 5,7,8의 주요 동인으로 생각됩니다.
자궁천골 인대(uterosacral ligaments, USL)는 자궁, 자궁경부, 질을 지지하는 중요한 구조이며, 자궁경부를 천골에 묶어 준다4. USL이 손상되면 여성은 POP 발병 위험이 높아집니다. 임신과 출산은 USL에 추가적인 부담을 주어 잠재적으로 부상을 유발하고 POP의 가능성을 높이는 것으로 믿어집니다. USL은 평활근 세포, 혈관 및 림프관이 인대를 따라 이질적으로 분포되어 있는 복합 조직으로, 경추, 중간, 천골 부위의 세 부분으로 나눌 수 있다9. USL의 기계적 무결성은 콜라겐, 엘라스틴 및 프로테오글리칸과 같은 세포외 기질(ECM) 성분에서 파생됩니다 5,9,10. 유형 I 콜라겐 섬유는 인대 조직의 주요 하중 지지 인장 성분으로 알려져 있으므로 USL 실패 및 POP11에 관여할 가능성이 높습니다.
여성에서 POP의 원인, 유병률 및 영향에 대한 지식이 부족합니다. 여성의 골반저에 대한 이해를 높이기 위해서는 적절한 POP 동물 모델의 개발이 필요합니다. 생쥐와 인간은 골반 내에서 요관, 직장, 방광, 난소, 원형 인대9와 같은 유사한 해부학적 랜드마크를 가지고 있을 뿐만 아니라 자궁, 자궁경부, 천골과 USL의 유사한 교차점을 가지고 있다. 또한, 마우스는 유전자 조작이 용이하며 POP9 연구를 위해 쉽게 접근할 수 있고 비용 효율적인 모델이 될 가능성이 있습니다.
이 연구는 미산(즉, 임신한 적이 없는) 마우스에서 USL과 다양한 골반저 조직에 접근하고 분리하는 방법을 개발했습니다. 추출된 USL은 효소 분해(즉, 콜라겐 및 글리코사미노글리칸 제거)를 거쳤고, 인장 하중 하에서 기계적 반응을 결정하기 위해 테스트했으며, 개념 증명 연구에서 생화학적 구성에 대해 평가했습니다. 온전한 조직을 분리하는 능력은 골반저 구성 요소의 기계적 및 생화학적 특성화를 용이하게 하며, 이는 출산, 임신 및 POP와 관련된 부상 위험에 대한 이해를 향상시키는 중요한 첫 번째 단계입니다.
프로토콜
모든 동물 실험 및 절차는 콜로라도 볼더 대학의 동물 관리 및 사용 위원회에서 승인한 프로토콜 #2705에 따라 수행되었습니다. 6주령의 암컷 C57BL/6J 마우스를 본 연구에 사용하였다. 동물들은 상업적 공급원으로부터 입수하였다 ( 재료의 표 참조).
1. 동물 준비
- 제도적으로 승인된 방법에 따라 동물을 안락사시킵니다.
참고: 본 연구는 성공적인 안락사를 보장하기 위해 미국 수의학 협회(American Veterinary Medical Association)의 지침(분당 CO2로 챔버 부피의 30% 내지 70%의 변위율)에 따라 CO2 흡입을 사용한 후 자궁경부 탈구를 사용했습니다.- 가능하면 쥐 알레르겐의 확산을 최소화하기 위해 후드 아래에서 작업하십시오. 마우스가 움직이고 호흡을 멈추면 2분 이상 기다렸다가 반응이 없는지 확인합니다.
참고: 마우스가 임신 중이거나 산후인 경우 새끼를 개별적으로 안락사시켜야 합니다. E15.5 이상의 새끼는 해부 중에 참수해야 합니다.
- 가능하면 쥐 알레르겐의 확산을 최소화하기 위해 후드 아래에서 작업하십시오. 마우스가 움직이고 호흡을 멈추면 2분 이상 기다렸다가 반응이 없는지 확인합니다.
- 해부 패드, 11날 메스, 구부러진 얇은 날카로운 가위, 두 쌍의 집게, 구부러진 집게, 5-0 폴리글락틴 봉합사, 해부 현미경 및 6개의 핀으로 해부 설정을 준비합니다(그림 1, 재료 표 참조).
- 마우스를 패드에 놓고 앞다리를 아래로 고정합니다(그림 2A). 가위로 복부에 약 1-1.5cm를 절개하십시오 (그림 2B). 가위를 사용하여 절개 부위의 두개골, 꼬리 및 측면 피부를 부드럽게 분리합니다(그림 2C, D).
- 마우스를 등쪽으로 뒤집고 피부를 뒷다리 쪽으로 부드럽게 벗겨내어 해부 부위에서 피부를 제거합니다(그림 2E-H).
- 마우스를 팔다리에 고정하고(그림 2I) 흉부에서 골반까지 복부에 약 1cm를 절개합니다(그림 2J).
알림: 기본 장기가 손상되지 않도록 하십시오. - 장기를 흉부 쪽으로 부드럽게 밀어 시야를 확보합니다(그림 2K).
알림: 수분 공급을 유지하기 위해 1x PBS로 조직을 관개합니다. - 골반저에서 모든 지방 조직을 제거합니다(그림 2L-N).
알림: 집게를 사용하여 관심 있는 장기와 조직에서 지방을 부드럽게 잡아당기고 제거합니다.

그림 1: 해부를 수행하는 데 필요한 모든 도구가 있는 깨끗한 작업 공간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
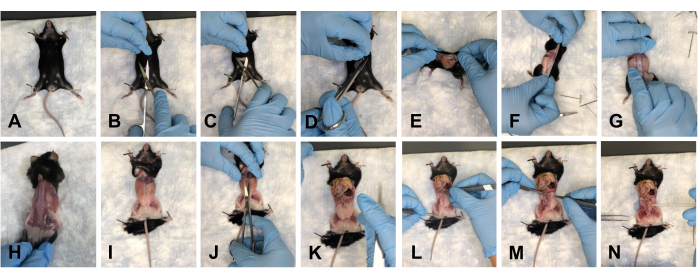
그림 2 : 마우스의 피부 제거 및 골반 및 흉강 개방. (A) 모든 팔다리를 고정합니다. (B) 초기 절개. (C) 가위를 사용하여 밑에 있는 근막에서 피부를 분리합니다. (D) 피부 절단 및 제거 준비. (예) 마우스 주위를 돌아다니며 피부를 떼어냅니다. (H) 등쪽에서 피부를 완전히 제거합니다. (I) 몸통에서 피부를 완전히 제거하고 마우스 사지를 다시 고정합니다. (J) 복부의 개방. (K) 열린 복부의 모습. (L) 장기를 시야 밖으로 이동. (M) 지방을 제거한다. (N) 깨끗해진 골반저의 모습. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. USL 수확
- 난소에서 자궁 뿔을 잘라내고(그림 3B), 시야에서 떼어내고, 자궁경부 연결부에서 잘라냅니다(그림 3C).
알림: 자궁 뿔은 그림 3A의 회로도에 따라 식별할 수 있습니다. 수분을 유지하기 위해 1x PBS로 조직을 관개하십시오. - 방광 연결부에서 요관을 잘라냅니다(그림 3D).
참고: 이는 USL과의 혼동을 피하기 위한 것입니다. - 결장을 자궁경부에 최대한 가깝게 자릅니다(그림 3E,F).
알림: 수분 공급을 유지하기 위해 1x PBS로 조직을 관개합니다. - 해부 범위 아래에 해부 패드와 함께 마우스를 놓아 USL을 시각화합니다(그림 3G).
- 집게를 사용하여 USL에서 주변 지방을 부드럽게 청소합니다.
참고: 두 번째 집게를 사용하여 자궁경부를 작은 각도로 들어 올려 USL이 자궁경부와 교차하는 위치의 시각화를 향상시킵니다. 수분을 유지하기 위해 1x PBS로 조직을 관개하십시오. - 두 USL의 자궁경부 말단 주위에 5-0 폴리글락틴 봉합사를 묶습니다(그림 4B, C).
참고: USL은 회로도 및 배율 이미지를 사용하여 식별할 수 있습니다(그림 4I-K) - 이 연구에서는 하나의 USL이 형태학적 또는 생화학적 분석(즉, 라만 현미경, 면역조직화학, 조직학)에 사용됩니다. 자궁경부 일부를 부착한 채로 USL의 자궁경부 끝을 절단하고 USL의 바닥에서 근육 조각을 절단합니다(그림 4D). 해부된 조직을 1x PBS가 있는 수조에 넣어 조직을 수화된 상태로 유지한다(도 4G, H).
- 나머지 USL은 기계적 테스트 및 이미징에 사용합니다. 기계적 설정을 용이하게 하기 위해 자궁경부 조각을 부착한 채로 USL의 자궁경부 끝을 절단합니다(그림 4D).
참고: 경추 조직은 기계적 테스트 중에 USL을 고정하는 앵커 역할을 합니다. - 관심 있는 모든 조직을 채취한 후(3-5단계) 골반에서 대퇴골을 탈구합니다(그림 4E).
참고: 대퇴골두가 비구 컵에서 분리될 때 희미한 딸깍 소리가 들려야 합니다. - 골반 뼈의 원위 및 근위 끝에서 골반 뼈를 잘라내어 약 10mm의 전체 조직을 남깁니다(그림 4F). 해부된 조직을 1x PBS에 넣습니다.

그림 3: USL 해부를 위해 치워진 골반저 . (A) 해부학의 개략도. (B) 난소 연결부에서 자궁 뿔을 절단합니다. (C) 자궁 뿔 절단. (D) 요관 절단. (E) 결장 절단. (F) 직장 및 USL의 명확한 시야. (G) 마우스와 해부 패드를 해부 범위 아래에 놓습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: USL과 주변 조직 및 USL의 해부. (A) USL을 둘러싼 해부학적 랜드마크의 개략도. (B) 자궁 경부 주위에 봉합사를 묶습니다. (C) USL의 경추 끝을 잘라냅니다. (D) 천골 연결부에서 생화학적 분석에 사용할 USL을 잘라냅니다. (E) 골반 뼈에서 대퇴골 절단. (F) 골반의 근위 끝을 잘라냅니다. (G) 35mm 페트리 접시에서 USL을 해부합니다. (H) 35mm 페트리 접시에 골반이 부착된 USL. (I) 0.75x 배율의 USL 및 직장. (J) USL에서 지방 제거. (K) 1.0x 배율에서 USL 세척. 스케일 바 = 2mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 방광 채취
- 지방이 제거된 후 집게로 방광을 잡고 약 40° 각도로 부드럽게 들어 올립니다(그림 5A).
- 가위로 자궁경부 바로 위의 말단부에서 방광을 잘라냅니다(그림 5B).
- 조직을 1x PBS가 있는 욕조에 넣어 조직을 수화 상태로 유지합니다(그림 5H).
4. 직장 적출
- USL이 자궁경부에서 분리되고 방광이 해부되면 집게로 자궁경부를 약 40° 각도로 들어 올립니다. 직장과 자궁 경부를 연결하는 직장질 근막이 있습니다. 메스로 이 연결부를 부드럽게 자릅니다(그림 5C, D).
- 가위를 사용하여 치골 symphysis에서 치골을 자릅니다. 작업 공간을 부드럽게 넓혀 조직 삽입물에 대한 시각적 접근성을 높입니다.
- 집게로 직장을 흉부 쪽으로 부드럽게 당기고 가위를 사용하여 직장을 뒤쪽에서 항문까지 따라갑니다. 항문에서 직장을 자릅니다 (그림 5E).
- 조직을 1x PBS에 넣어 조직을 수화 상태로 유지한다(도 5I).
5. 자궁경부-질 복합 수확
- 자궁경부에서 USL을 제거한 후 집게를 사용하여 자궁경부를 고정합니다. 가위를 사용하여 자궁 경부를 가능한 한 외음부에 가깝게 자릅니다 (그림 5F, G).
참고: 질의 말단부를 시각적으로 볼 수 있도록 치골 결합을 절단해야 합니다. - 조직을 1x PBS에 넣어 조직을 수화된 상태로 유지한다(도 5J).
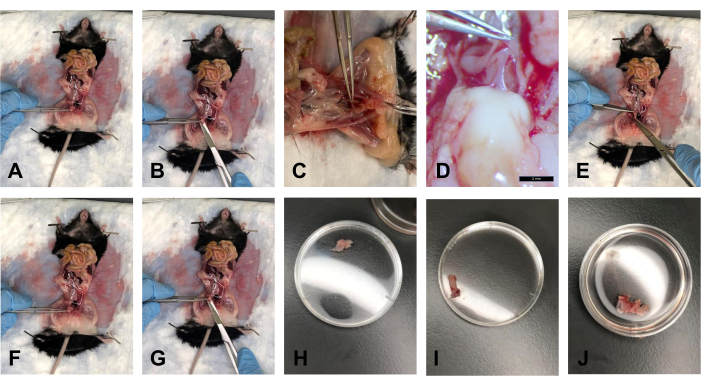
그림 5: 방광, 직장 및 자궁경부/질 박리. (A) 방광을 비스듬히 잡습니다. (B) 방광을 절단합니다. (C) 자궁 경부와 직장을 연결하는 힘줄을 절단합니다. (D) 1.0x 배율의 힘줄. (E) 직장 절단. (F) 집게로 자궁 경부를 잡습니다. (G) 질의 말단부 절단. (H) 35mm 페트리 접시의 방광. (I) 35mm 페트리 접시의 직장. (J) 35mm 페트리 접시에 담긴 자궁경부-질 조직 복합체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 조직 특성 분석을 위한 시료 전처리
- USL의 기계적 및 시각적 분석
- 골반 부착물이 있는 USL을 맞춤형 염색 웰 내의 T자형 벽 위에 놓아 염색 용액에 완전히 잠길 수 있도록 합니다(웰의 CAD 도면은 보충 코딩 파일 1 및 보충 코딩 파일 2).
알림: 배치를 돕기 위해 봉합사와 집게를 사용하십시오. - 유리 아민기를 염색하는 시판되는 염료(5 μL, 재료 표 참조)를 1x PBS 2.5mL에 희석하고, 용액을 맞춤형 염색 웰에 추가하고, 4°C에서 로커에서 2시간 동안 조직을 염색합니다.
알림: 용액을 염색 웰에 추가하기 전에 소용돌이칩니다. - 염색의 마지막 15분 동안 시중에서 판매되는 죽은 세포 핵 염색( 재료 표 참조) 2.5μL를 용액에 추가합니다.
알림: 염색 웰에 추가하기 전에 용액을 소용돌이칩니다.
- 골반 부착물이 있는 USL을 맞춤형 염색 웰 내의 T자형 벽 위에 놓아 염색 용액에 완전히 잠길 수 있도록 합니다(웰의 CAD 도면은 보충 코딩 파일 1 및 보충 코딩 파일 2).
- USL의 라만 분석
- 맞춤형 웰에 포함된 폴리디메틸실록산(PDMS) 블록에 USL을 직선으로 고정합니다.
참고: PDMS는 원하는 구성으로 샘플을 고정할 수 있는 소프트 기판으로 사용됩니다. 다양한 치수의 블록은 제조업체의 지침( 재료 표 참조)에 따라 두 구성 요소를 혼합하고, 페트리 접시에서 주조하고, 중합 후 메스 블레이드를 사용하여 PDMS를 필요한 형상으로 절단하여 만들 수 있습니다. - 봉합 루프와 골반 근육에 곤충 핀으로 고정하십시오. 1x PBS로 조직을 수화시킵니다.
- 맞춤형 웰에 포함된 폴리디메틸실록산(PDMS) 블록에 USL을 직선으로 고정합니다.
- 남은 조직
- 원하는 분석에 따라 액체 질소 또는 적절한 포매 화합물로 나머지 조직을 급속 동결합니다.
- 후속 분석(예: 면역조직화학적 또는 생화학적 분석)이 수행될 때까지 조직을 -80°C에서 보관합니다.
결과
야생형 마우스의 해부의 각 단계는 프로토콜과 관련된 관련 비디오 및 그림에 자세히 설명되어 있습니다. 본 연구에서는 6주령의 암컷 C57BL/6J 마우스를 사용하였다(보충표 1). 서로 다른 효소로 처리된 USL을 사용한 3개의 샘플 그룹, 즉 대조군(무처리), 콜라게나제 처리 및 콘드로이티나제 처리 그룹을 분석했습니다. USL의 평활근, 신경 및 림프관은 섬유소 콜라겐과 글리코사미노글리칸...
토론
구조적 손상이 여성 생식 조직에 미치는 영향은 충분히 연구되지 않았으며 POP 연구를 위해 쉽게 접근할 수 있는 동물 모델이 필요합니다. 마우스는 인간의 생식 연구를 모방할 수 있는 비용 효율적인 모델이다16. 여성 생식 기관 연구에 대한 관심이 높아짐에 따라 이러한 조직의 연구를 돕는 방법이 필요합니다. 이러한 요구를 해결하기 위해 이 작업에서는 구조 및 기능 분석을 ?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 CU Boulder Summer Underground Research Opportunities Program (UROP) 보조금 (CB), NSF 대학원 연구 펠로우쉽 (LS), 슈미트 과학 펠로우쉽 (CL), 콜로라도 대학교 연구 및 혁신 종자 보조금 프로그램 (2020 년 V.F., S.C. 및 KC) 및 콜로라도 대학의 Anschutz Boulder Nexus Seed Grant (VF 및 KC). 로딩 챔버 설계에 도움을 주신 Tyler Tuttle 박사와 유용한 토론을 해주신 Calve 연구실 구성원에게 특별한 감사를 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| 11 Blade | Fisher | 3120030 | Removable blade |
| 1x PBS | Fisher | BP399-1 | Diluted from 10x concentration |
| Chondroitinase ABC | Sigma | C3667-10UN | Enzyme |
| Collagenase Type I | Worthington Biochemical | LS004194 | Enzyme |
| Confocal Microscope | Leica | STELLARIS 5 | Upright configuration |
| Dissection Microscope | Leica | S9E | With camera |
| Dumont #5 Forceps | Fisher | NC9626652 | Thin tip |
| Female C57BL/6J mice | Jackson Laboratory | strain #: 000664 | |
| FemtoTools Micromanipulator | FemtoTools | FT-RS1002 | 100 mN load cell |
| FST Curved Forceps | Fisher | NC9639443 | Curved tip |
| FST Sharp 9 mm Scissors | Fisher | NC9639443 | Dissection scissors |
| Ghost Dye 780 | Tonbo | 13-0865-T500 | Free amine stain |
| Kimwipes | Fisher | 06-666 | Box of 50 wipes |
| OCT | Tissue Tek | 4583 | Used for tissue preservation |
| PDMS | Thermo Fisher | 044764.AK | Follow manufacturer's instructions |
| Petri Dishes 35 mm | Fisher | FB0875711A | Used for dissected tissue |
| Polyglactin 5-0 Suture | Veter.Sut | VS385VL | With needle |
| Renishaw InVia Raman Microscope | Renishaw | PN192(EN)-02-A | With confocal objectives |
| Rocking Platform | VWR | 10127-876 | 2 tier platform |
| Surgical Gloves | Fisher | 52818 | For dissection |
| Sytox | Thermo Fisher | S11381 | Nuclear stain |
| T-pins | Fisher | S99385 | For dissection |
| Transfer Pipets | Fisher | 13-711-7M | For dissection |
| Underpads | Fisher | 22037950 | To cover dissection pad |
참고문헌
- Maldonado, P. A., Wai, C. Y. Pelvic organ prolapse. Obstetrics and Gynecology Clinics of North America. 43 (1), 15-26 (2016).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice: Pregnancy-induced changes in elastic fiber homeostasis in mouse vagina. American Journal of Pathology. 170 (2), 578-589 (2007).
- Barber, M. D., Maher, C. Epidemiology and outcome assessment of pelvic organ prolapse. International Urogynecology Journal and Pelvic Floor Dysfunction. 24 (11), 1783-1790 (2013).
- Becker, W. R., De Vita, R. Biaxial mechanical properties of swine uterosacral and cardinal ligaments. Biomechanics and Modeling in Mechanobiology. 14 (3), 549-560 (2015).
- Donaldson, K., Huntington, A., De Vita, R. Mechanics of uterosacral ligaments: Current knowledge, existing gaps, and future directions. Annals of Biomedical Engineering. 49 (8), 1788-1804 (2021).
- Amundsen, C. L., Flynn, B. J., Webster, G. D. Anatomical correction of vaginal vault prolapse by uterosacral ligament fixation in women who also require a pubovaginal sling. Journal of Urology. 169 (5), 1770-1774 (2003).
- Jelovsek, J. E., Maher, C., Barber, M. D. Pelvic organ prolapse. The Lancet. 396 (9566), 1027-1038 (2007).
- Blomquist, J. L., Muñoz, A., Carroll, M., Handa, V. L. Association of delivery mode with pelvic floor disorders after childbirth. Journal of the American Medical Association. 320 (23), 2438-2447 (2018).
- Iwanaga, R., et al. Comparative histology of mouse, rat, and human pelvic ligaments. International Urogynecology Journal. 27 (11), 1697-1704 (2016).
- Zhu, Y. P., et al. Evaluation of extracellular matrix protein expression and apoptosis in the uterosacral ligaments of patients with or without pelvic organ prolapse. International Urogynecology Journal. 32 (8), 2273-2281 (2021).
- Jimenez, J. M., et al. Multiscale mechanical characterization and computational modeling of fibrin gels. bioRxiv. , (2022).
- Fischenich, K. M., et al. Human articular cartilage is orthotropic where microstructure, micromechanics, and chemistry vary with depth and split-line orientation. Osteoarthritis and Cartilage. 28 (10), 1362-1372 (2020).
- Luetkemeyer, C. M., Neu, C. P., Calve, S. A method for defining tissue injury criteria reveals ligament deformation thresholds are multimodal. bioRxiv. , (2023).
- O'Brien, C. M., et al. In vivo Raman spectroscopy for biochemical monitoring of the human cervix throughout pregnancy. American Journal of Obstetrics and Gynecology. 218 (5), 1-18 (2018).
- Louwagie, E. M., et al. et al. ultrasonic dimensions and parametric solid models of the gravid uterus and cervix. PLoS One. 16 (1), 0242118 (2021).
- Drewes, P. G., et al. Pelvic organ prolapse in fibulin-5 knockout mice. The American Journal of Pathology. 170 (2), 578-589 (2007).
- Rahn, D. D., Ruff, M. D., Brown, S. A., Tibbals, H. F., Word, R. A. Biomechanical properties of the vaginal wall: Effect of pregnancy, elastic fiber deficiency, and pelvic organ prolapse. American Journal of Obstetrics and Gynecology. 198 (5), 1-6 (2008).
- Roman, S., et al. Evaluating alternative materials for the treatment of stress urinary incontinence and pelvic organ prolapse: A comparison of the in vivo response to meshes implanted in rabbits. Journal of Urology. 196 (1), 261-269 (2016).
- Couri, B. M., Lenis, A. T., Borazjani, A., Paraiso, M. F., Damaser, M. S. Animal models of female pelvic organ prolapse: Lessons learned. Expert Review of Obstetrics & Gynecology. 7 (3), 49 (2012).
- Abramowitch, S. D., Feola, A., Jallah, Z., Moalli, P. A. Tissue mechanics, animal models, and pelvic organ prolapse: A review. European Journal of Obstetrics & Gynecologyand Reproductive Biology. 144, S146-S158 (2009).
- Tan, T., Cholewa, N. M., Case, S. W., De Vita, R. Micro-structural and biaxial creep properties of the swine uterosacral-cardinal ligament complex. Annals of Biomedical Engineering. 44 (11), 3225-3237 (2016).
- Tan, T., et al. Histo-mechanical properties of the swine cardinal and uterosacral ligaments. Journal of the Mechanical Behavior of Biomedical Materials. 42, 129-137 (2015).
- Baah-Dwomoh, A., Alperin, M., Cook, M., De Vita, R. Mechanical analysis of the uterosacral ligament: Swine vs. human. Annals of Biomedical Engineering. 46 (12), 2036-2047 (2018).
- Vardy, M. D., et al. The effects of hormone replacement on the biomechanical properties of the uterosacral and round ligaments in the monkey model. American Journal of Obstetrics and Gynecology. 192 (5), 1741-1751 (2005).
- Shahryarinejad, A., Vardy, M. D. Comparison of human to macaque uterosacral-cardinal ligament complex and its relationship to pelvic organ prolapse. Toxicological Pathology. 36 (7), 101 (2008).
- Smith, T. M., Luo, J., Hsu, Y., Ashton-Miller, J., DeLancey, O. L. A novel technique to measure in vivo uterine suspensory ligament stiffness. American Journal of Obstetrics and Gynecology. 209 (5), 1-7 (2013).
- Vandamme, T. F. Use of rodents as models for human diseases. Journal of Pharmacy and Bioallied Sciences. 6 (1), 2-9 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유