A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מעקב זמני של התקדמות תא מחזור שימוש cytometry הזרימה ללא הצורך בסנכרון
In This Article
Summary
פרוטוקול זה מתאר את השימוש בbromodeoxyuridine ספיגה (BrdU) כדי לאפשר המעקב הזמני של תאים שהיו בשלב S בנקודה מסוימת בזמן. תוספת של צבעי DNA ותיוג נוגדן מאפשרת ניתוח מפורט של גורלם של התאים בשלב S בתקופות מאוחרות יותר.
Abstract
This protocol describes a method to permit the tracking of cells through the cell cycle without requiring the cells to be synchronized. Achieving cell synchronization can be difficult for many cell systems. Standard practice is to block cell cycle progression at a specific stage and then release the accumulated cells producing a wave of cells progressing through the cycle in unison. However, some cell types find this block toxic resulting in abnormal cell cycling, or even mass death. Bromodeoxyuridine (BrdU) uptake can be used to track the cell cycle stage of individual cells. Cells incorporate this synthetic thymidine analog, while synthesizing new DNA during S phase. By providing BrdU for a brief period it is possible to mark a pool of cells that were in S phase while the BrdU was present. These cells can then be tracked through the remainder of the cell cycle and into the next round of replication, permitting the duration of the cell cycle phases to be determined without the need to induce a potentially toxic cell cycle block. It is also possible to determine and correlate the expression of both internal and external proteins during subsequent stages of the cell cycle. These can be used to further refine the assignment of cell cycle stage or assess effects on other cellular functions such as checkpoint activation or cell death.
Introduction
ההערכה של תכונות מחזור תא ושינויים המתרחשים בתאים במהלך התקדמות מחזור התא היא יסוד להבנת היבטים רבים של ביולוגיה, במיוחד ביולוגיה של הסרטן. יש סוכנים רבים בפיתוח לטיפול בגידולים ממאירים השפעות עמוקות על התקדמות מחזור תא או לגרום למוות של תאים באמצעות תלויים-מנגנוני מחזור התא. כדי ללמוד דינמיקת מחזור תא או תאים בשלב מסוים של מחזור התא, זה רגיל לסנכרן תאים. עם זאת שיטות סנכרון יכולות להיות השפעה מזיקה על התאים הנלמדים, שעלול להיות בלבול התוצאות שהתקבלו. 1 ניתוח לאחרונה את השימוש בחלבונים מתויגים fluorescently שנמצאים רק בשלבים מסוימים של מחזור התאים התיר להתקדמות מחזור התא בתאים בודדים לאורך זמן 2, לעומת זאת תאים להיחקר צורך לטפל גנטי כדי לבטא חלבונים מתויגים אלה, להגביל את השימוש שלהם למערכות שבן ניתן לקרוא את זההשיג ily.
מחזור התא מורכב משני שלבים פעילים: שלב הסינתזה (S), שבו ה- DNA משוכפל ומיטוזה חלוקת תא שבו (M) מתקיימת. שלבים אלה מופרדים על ידי שלושה שלבי פער, G 0, 1 G ו- G 2. G 0 או קפאון, הוא שלב מנוחה שבו התא עזב את המחזור, 1 G הוא שבו תאי גידול בגודל לפני שכפול ה- DNA וG 2 שבו צמיחת תאים ממשיך בין השלמת שכפול הדנ"א אבל לפני חלוקת תא. ההתקדמות דרך מחזור התא נשלטת על ידי מספר המחסומים. מחסום 1 G מופעל כאשר תנאי סביבה אינם תומכים של סינתזת DNA ומונעים כניסה לשלב S. מחסום שלב התוך-S או העיכוב יכול להיות מופעל על ידי נזק לדנ"א שעלולה לגרום למזלגות שכפול נתקע. במהלך G 2 הנאמנות של ה- DNA המשוכפל הוא אישרה ואם הנזק הוא זוהה לאחר מכן G 2 מחסום מופעל מתיר תיקון DNA לפני חלוקת התא. מחסום אחרון במיטוזה מבטיח כי chromatids כבר מיושר כהלכה בצלחת mitotic כך שחלוקת התא יכולה להסתיים בהצלחה. 3 הפעלה של מחסומים אלה משמשת בדרך כלל כדי לסנכרן אוכלוסיות תאים. יכולים להיות מופעלים על מחסומי מחזור תא על ידי מספר הגורמים, אך בביולוגיה של הסרטן הנפוץ ביותר היא גילוי של נזק לדנ"א. תגובת הנזק ל- DNA היא ביוזמת telangiectasia כמו-PI3-kinase אטקסיה קינאזות וRad3 קשור (ATR) וtelangiectasia אטקסיה מוטציה (כספומט) המפעיל את קינאזות מפעיל במורד הזרם Chk1 וChk2, בהתאמה. 3 מגוון של אירועים מפעיל Chk1 לרבות נתקע מזלגות שכפול, crosslinks DNA, ונזקי קרינת האולטרה סגולות ואילו Chk2 מופעל בעיקר על ידי הפסקות גדיל פעמיים.
השיטה הרגילה ללימוד ההשפעה של תנאים שהשתנו באורך של i מחזור התאים כדי לסנכרן את התאים בשלב מסוים של מחזור התא. 1 זה יכול להיות מושגים באמצעות מספר שיטות. תאים יכולים להיות פיזי מפרידים על בסיס גודל, צפיפות, פיזור צד (גרעיניות), וסמני ביטוי פני תא. יותר כמעט, תאים עשויים להיות מסונכרנים באמצעים כימיים. כמה סוכנים כגון תימידין, hydroxyurea וarabinoside ציטוזין יכולים לשמש כדי לעכב סינתזת DNA בשלב S של מחזור התא וכתוצאה מכך הצטברות של תאים בשלב S שימשיכו רכיבה על אופניים לאחר הסוכנים יוסרו. תאים שטופלו nocodazole, אשר מונע היווצרות של ציר mitotic, מעצר עם G 2 - תוכן DNA או M-שלב. ביעור סרום מהתוצאות בינוני התרבות בהצטברות של תאים בשלב G 0. מחדש התוספת של החומרים המזינים בסרום התרבות מחדש מתחילה רכיבה על אופניים הרגילים של התאים. עם זאת, כל שיטות סנכרון אלה מפריעים לרכיבה על אופניים וצמיחה נורמלים של תאים ויכולים Resulלא במוות של תאים משמעותיים.
הסנכרון של תאי לוקמיה לימפובלסטית חריפים הוא מאתגר במיוחד ותאים אלה אינם ניתנים למניפולציה גנטית. השיטה המתוארת כאן מאפשרת הערכה של דינמיקת מחזור התא והמחקר של תאים בשלבים מסוימים של מחזור התא ללא סנכרון מסורתי או שינוי גנטי. שיטה זו עשויה להיות שימושית גם עבור סוגי תאים אחרים שבם הנדסה גנטית ונהלי סנכרון מסורתיים אינן מושגות בקלות. השיטה מבוססת על השימוש הוותיק של bromodeoxyuridine התאגדות (BrdU), שבו יש השפעה קטנה מאוד על הצמיחה בטווח הקצר והתפשטות של תאים. 4 פרוטוקולי BrdU הוקם לנצל את השילוב של BrdU לתוך ה- DNA מסונתז חדש בשלב S . זה באופן קבוע מסמן תאים כמי שהיה בשלב S במהלך חשיפת BrdU. אוכלוסייה זו ניתן לזהות בנקודות זמן מאוחר יותר על ידי הצביעה לincorpor BrdUני ובכך לפעול כאוכלוסייה מסונכרנת שניתן בעקבות והעריך לאורך הזמן מאפשר המחקר של שפעות תרופה על מעבר מחזור התא. BrdU צריך להיות חשוף לפני מכתים נוגדן, בדרך כלל מושגת הבאה DNase או טיפול בחומצה. 6,7 באמצעות cytometry זרימה לזהות BrdU המשולב מאפשר ההכללה של סמנים נוספים. החשוב ביותר הוא השימוש בצבעים למדוד תוכן DNA, המאפשר ההערכה של הפצת שלב מחזור התא של התאים שהיו בשלב S בתחילת המחקר. יכולים להיות גם למדו 8 אנטיגנים משטח או תאיים יתר נוסף. 9 אלה עשוי להתייחס לאירועי מחזור התא כגון Ki67 או תכונות תא שאינה קשורה לכאורה כגון סמני אפופטוזיס כמו caspase-3 ביקע. היישומים הפוטנציאליים מוגבלים על ידי הדמיון של החוקר.
Access restricted. Please log in or start a trial to view this content.
Protocol
הפרוטוקול המתואר כאן משתמש בקו תא לוקמיה לימפובלסטית החריף NALM6 אבל יכול להיות מיושם על סוגי תאים אחרים.
1. פתרונות וריאגנטים
- RPMI מלא
- להוסיף 56 מיליליטר סרום עגל עוברי (FCS) ו -5.5 מיליליטר של 200 מ"מ L- גלוטמין לבקבוק 500 מיליליטר של מדיום RPMI-1640.
- BrdU פתרון במלאי
- הכן 32.5 מ"מ BrdU (10 מ"ג / מיליליטר) בבופר פוספט של Dulbecco (DPBS).
- RPMI המלא BrdU
- להוסיף 6.2 μl של פתרון מניות BrdU 10 מיליליטר של RPMI השלם.
- פתרון DNase
- הכן DNase 1 מ"ג / מיליליטר בDPBS.
- מכתים מאגר
- הכן 3% FCS מומת חום ושל 0.09% אזיד הנתרן בDPBS.
- עיין בחומרי רשימה להגדרות של קיבוע מאגר, permeabilization הצפת והצפה לשטוף.
2. תאים
לאטה: תאים לא היו בתרבית ליותר מ -6 חודשים. שיטה זו היא באופן ישיר וישימה לכל שורת תאים שאינם חסיד עם התאמות לצפיפות תאים ותקשורת ותרבות. להשתמש בתאים שגדלים באופן אקספוננציאלי בייזום של הניסוי.
- שמור על תאי NALM6 בצלוחיות תרבות T-75 בRPMI השלם. לבצע את כל הפעולות בתנאים סטריליים באמצעות Class II בטיחות ביולוגית קבינט.
- שמור על תאי NALM6 בין 1-2 x 10 6 תאים לכל מיליליטר ידי פיצול התרבות שלוש פעמים בשבוע.
- לדגור על 37 מעלות צלזיוס ב 5% CO 2 באוויר.
3. תיוג דופק של תאים עם BrdU
זהירות: ידית BrdU בזהירות כפי שהוא mutagen וטךטוגן פוטנציאליים.
- תאי צנטריפוגה ב XG 150 במשך 5 דקות. שים לב: העברת תאים לתקשורת טריות משפרת את שחזור של התוצאות.
- לבצע ספירת תאים ותאים גלולים בRPMI המלא ב 2 x 10 6 ג/ אמות מיליליטר.
- לדלל תאים 1 ב 2 עם RPMI השלם BrdU ייצור ריכוז תא סופי של 1 x 10 6 תאים / מיליליטר.
- לדגור על 37 מעלות צלזיוס עם 5% CO 2 במשך 45 דקות, ואז לדלל תאים 1 ב 10 עם RPMI השלם. תאי צנטריפוגה ב XG 150 במשך 5 דקות ובזהירות להשליך את כל supernatant.
- תאים גלולים בנפח קטן (~ 100 μl) של RPMI השלם, לבצע ספירת תאים ולהתאים ל1 x 10 6 תאים / מיליליטר.
- פיפטה 1 מיליליטר של תאים לתוך הבארות של צלחת גם 48. מיליליטר פיפטה 1 של DPBS לתוך כל בארות פנויות כדי להשיג תוצאות לשחזור יותר.
- לדגור על 37 מעלות צלזיוס ב 5% CO 2 באוויר לנקודות זמן רצוי, כאן 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 , 18, 19, 20, 21, 22, 23, ו -24 שעות. הערה: משך הזמן יהיה תלוי במה העיצוב הניסיוני שמטרתו למדוד.
- העבר את כל התאים לתוך צינורות FACS באמצעות פיפטה. יש לשטוף את הרצף גם עם 1 מיליליטר voluMES של PBS להיקף כולל סופי של 5 מיליליטר.
- צנטריפוגה ב XG 150 במשך 5 דקות ולהסיר את כל supernatant בזהירות. תאים מוכנים לצביעה, לבצע את זה (סעיף 4) באופן מיידי.
מכתים 4. סלולארי
הערה: אם נדרש צביעת תאי שטח לבצע אותו לפני הקיבוע, על מנת להבטיח כי התאים נשמרים על 4 מעלות צלזיוס לאורך כל דרך.
- תאים גלולים במאגר של הכתמת 100 μl (מכתים משטח אופציונאלי, להוסיף הנפח המומלץ של נוגדן על פני השטח אנטיגנים דגירה במשך 30 דקות ב 4 ° C).
- הוסף 1 מיליליטר של חיץ מכתים, צנטריפוגות במשך 5 דקות ב 150 XG וזורקים supernatant.
הערה: נוגדן ספציפי, ריכוז, זמן דגירה וכו 'ישתנה בהתאם למטרות ניסוי ספציפיות. - קיבעון וpermeabilization
- Resuspend תאים במאגר של קיבעון 100 μl ודגירה במשך 15 דקות בטמפרטורת חדר.
- הוסף 1 מיליליטר oחיץ F לשטוף, צנטריפוגות במשך 5 דקות ב 150 XG וזורקים supernatant.
- Resuspend תאים במאגר של permeabilization 100 μl דגירה התאים במשך 10 דקות על קרח.
- הוסף 1 מיליליטר של חיץ לשטוף, צנטריפוגות במשך 5 דקות ב 150 XG, וזורקים supernatant.
- Resuspend תאים במאגר של קיבוע לכל צינור 100 μl ודגירה של 5 דקות בטמפרטורת חדר.
- הוסף 1 מיליליטר של חיץ לשטוף, צנטריפוגות במשך 5 דקות ב 150 XG, וזורקים supernatant.
הערה: הפרוטוקול יכול להיות מושהה כאן אם נדרש. התאים הקבועים יציבים במשך כמה ימים על 4 מעלות צלזיוס אם resuspended במאגר מכתים. הסר את החיץ מכתים הבא צנטריפוגה לפני שימשיך.
- DNase טיפול
- תאי Resuspend בפתרון DNase 100 μl (30 מיקרוגרם של DNase / 10 6 תאים) ותאי דגירה עבור שעה 1 על 37 מעלות צלזיוס.
- הוסף 1 מיליליטר של חיץ לשטוף, צנטריפוגות ב XG 150 במשך 5 דקות וזורקי supernatant.
- נוגדן מכתים
הערה: מכתים עבור סמנים תאיים אחרים מאשר BrdU ניתן לבצע בו זמנית עם מכתים BrdU.- חשוב: הכן בקרות פיצוי בהיקף של תאים בלא כתם ותאים שכותרתו עם כל fluorochrome יחיד. באופן אידיאלי, להשתמש באותו נוגדנים עבור פקדי פיצויים אלו המשמשים בצינורות הניסיוניים. עם זאת, אם זה לא ריאלי, נוגדני תחליף לאנטיגנים הביעו מאוד מצומדות לאותו fluorochrome.
- Resuspend התאים 50 μl של חיץ לשטוף ולהוסיף μl 1/10 6 תאים של נוגדן BrdU. הערה: ניתן גם להוסיף נוגדנים מצומדות ישירות לאנטיגנים ספציפיים תאיים אחרים.
הערה:. נוגדנים להיסטון H3 phosphorylated על Ser10 יכולים לשמש כדי להבחין בין התאים בG2 וM, היסטון H3 הוא phosphorylated בSer10 במהלך מיטוזה 10 נוגדנים לcdc2 phosphorylated על Tyr15 יכול לשמש כדי לזהות תאים שhavדואר מחויב למיטוזה. 11 - דגירה התאים במשך 20 דקות בטמפרטורת חדר.
- הוסף 1 מיליליטר של חיץ לשטוף, תאי צנטריפוגות ב XG 150 במשך 5 דקות וזורקי supernatant.
- ה- DNA כתם לניתוח תא מחזור
- שחרר גלולה ולהוסיף 20 μl של פתרון 7-AAD (0.25 מיקרוגרם). הערה: זה קריטי כדי להשתמש בכמות קבועה של 7-AAD / תא.
- Resuspend תאי 1 מיליליטר של חיץ מכתים.
5. אוסף של cytometry זרימת נתונים
הערה: המכונה הנדרשת יהיו תלוי במספר והאופי של fluorochromes בשימוש.
- לאסוף את הפרמטרים הבאים: FSC-, SSC-, FSC-H (FSC-W יכול לשמש במקום FSC-H) וקרינה 7-AAD בקנה מידה ליניארי. לאסוף את ערוץ APC בקנה מידת יומן. לאסוף כל ערוצים נוספים הנדרשים להערכת תוויות משטח או פנימי באמצעות סולם יומן.
- בצע compensation של חופף אותות בספקטרום פליטה נצפה בין fluorochromes שונה לפני ניתוח הדגימות. הערה: רוב הזרימה cytometers יבצע זאת באופן אוטומטי.
- לאסוף לפחות 10,000 אירועים לכל דגימה.
6. ניתוח cytometry זרימת נתונים
הערה: FlowJo שימש במחקר זה לזרימה גם cytometry יכול לשמש לניתוח נתונים, אך חבילות תוכנה אחרות. אסטרטגית gating מודגמת באיור 1.
- זהה את אוכלוסיית תאי קיימא באמצעות פרמטרים FSC-וSSC-.
- בתוך אוכלוסייה זו לא לכלול כפילויות ואגרגטים באמצעות FSC-וFSC-H (FSC-W יכול לשמש גם כאן).
- בתוך אוכלוסייה זו נקבעה עלילת נקודה באמצעות 7-AAD על ציר x וBrdU-APC על ציר y.
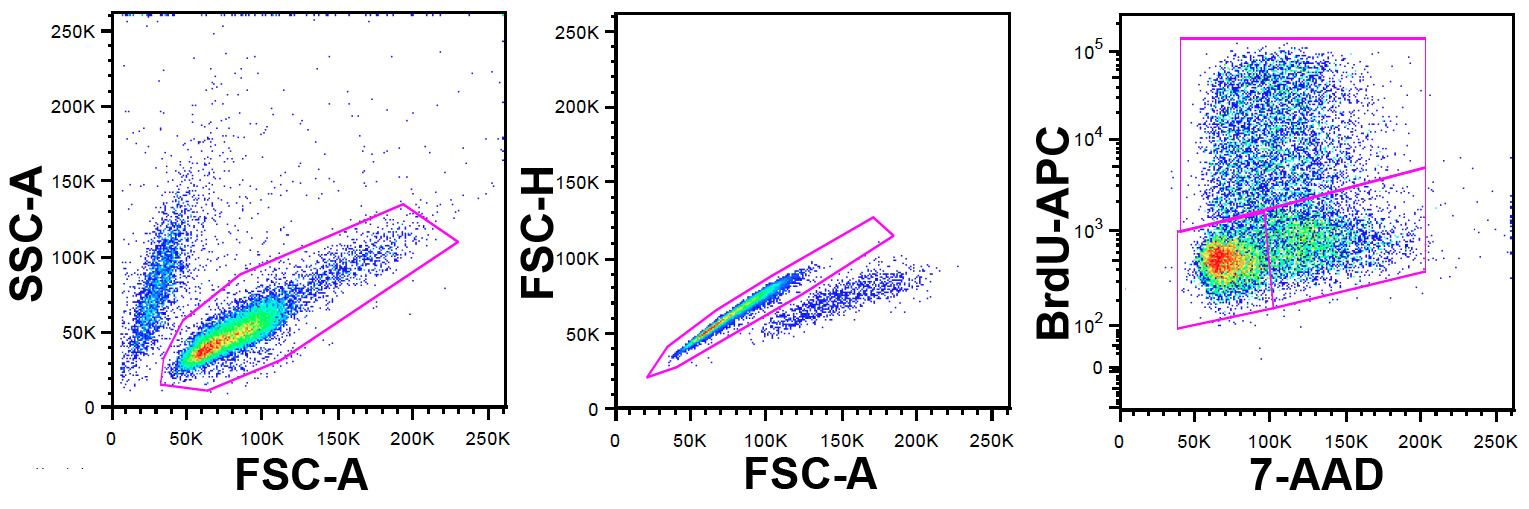
איור 1: gating אסטרטגיה שמאל הרשות הפלסטינית.Nel: תאי ungated מוצגים בFCS-מול SSC-עלילת נקודה. אוכלוסיית תאי קיימא מזוהה על ידי השער שמוצג. פנל מרכז: תאים מגודר מהלוח השמאלי מוצגים בFSC-מול עלילת נקודת FSC-H (FSC-W יכול לשמש במקום גובה). כפילויות ואגרגטים מזוהות, ולא נכללו בשער שמוצג. פנל ימני: תאים מגודר ממועד הרחקת כפיל בלוח המרכז מוצגים על 7-AAD לעומת APC-עלילת נקודה. נוגדן BrdU מסומן עם APC מאפשר זיהוי של תאים ששולבו במהלך BrdU תיוג הדופק. 7-AAD מספק מידע על תוכן DNA. השער העליון מגדיר תאים חיוביים לBrdU ולכן בשלב S בזמן דופק BrdU, השער השמאלי התחתון, התאים בG 0/1 והשער הימני התחתון אלה בG 2 / M. אנא לחץ כאן לצפייה גרסה גדולה יותר של דמות זו.
- תא מחזור nalysis
- פתח את הקובץ הראשון נתונים ושער על התאים בשער הדרת כפיל.
- לנתח אוכלוסייה זו להפצת מחזור התא (הממוקמת תחת פלטפורמות בתוכנה פלה-ג'ו) ולהשתמש במודל הדיקן-ג'ט-פוקס.
- השג את העמדות של G 0/1 וG 2 / M פסגות באמצעות ליצור שערים.
- שער בנושא תאים וחיוביים BrdU אוכלוסייה זו לאותו ניתוח מחזור התא.
- לספק המשרות לG 0/1 וG 2 / M פסגות על ידי יישום אותו השערים משערים ליצור וקביעת מגבלות (באמצעות השערים שנוצרו) לעמדות של G 0/1 וG 2 / M פסגות. זו באה לידי ביטוי בלוחות 2 הראשונים של איור 2.
הערה: גם תוכנות אחרות ניתן להשתמש כדי לנתח את הנתונים וההוראות היו להשתנות בהתאם.
840 / "width =" 700 52840fig2highres.jpg "/>
איור 2:. התקדמות פנל תא המחזור הראשון (כל התאים) הוא מגודר באוכלוסיית התא שהוגדרה על ידי שער הדרת כפיל. אוכלוסייה זו הוצגה בהיסטוגרמה עם 7-AAD על ציר ה- X. השיא של שיא G 0/1 מצויינים על ידי החץ מתחת לציר. בלוחות הבאים תאים חיוביים BrdU כבר מגודר בכפי שמוצגים באיור 1. הערך לתפקיד 0/1 G מתקבל כאשר gating של שער הדרת כפיל מוחל על התאים מגודרות החיוביים BrdU בתוך תוכנת מחזור תא FlowJo. כל פנל שלאחר מכן היה מגודר באוכלוסייה החיובית BrdU כפי שמוצג באיור 1 ואת עמדתו של שיא 0/1 G מבוסס על הערך שהושג בניתוח האוכלוסייה כולה, כפי שמוצג בשני הלוחות הראשונים. שימוש בחלק השלילי BrdU לזהות את המיקום של אוכלוסיית G 0/1 לתאים החיוביים BrdU באותו SAMPle שולט על כל הבדלים קלים בעוצמה של כתם DNA בין דגימות. המספר המוצג בכל פנל מייצג את הזמן מאז דופק BrdU הסתיים. שלבי מחזור התא המחושבים מוצגים בירוק מוצלת. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מתודולוגיה זו יכולה לשמש כדי להשיג מגוון רחב של מידע. כמה יישומים המפורטות כאן.
הערכה של משך מחזור התא
כדי לקבוע את הזמן דרוש לתאים למעבר דרך מחזור התא, תאים נקצרים בנקודות זמן שונות הבאות דופ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
היכולת לנתח את מחזור התא היא חשובה להבנת ביולוגיה של סרטן ואת מנגנון פעולה של שתי התרופות וגנים המשפיעים על שגשוג תאים וצמיחה. אמנם יש מספר רב של מבחני שדיווחים למדוד התפשטות תאים, רוב לספק מידה המציינת את מספר התאים בהווה בלבד. אלה כוללים מבחני המודדים תא מספר על ידי ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The work was funded by the Leukemia and Lymphoma Society of the USA (6105-08), a Cancer Council NSW grant (13-02), an NHMRC Senior Research Fellowship (LJB) (1042305) and project grant (1041614).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| APC BrdU Flow Kit | BD Biosciences | 552598 | Contains BrdU antibody, 7-AAD and BD Cytofix/Cytoperm Buffer (referred to as Fixation Buffer) |
| BD Cytoperm Permeabilization Buffer Plus | BD Biosciences | 561651 | Referred to as Permeabilization buffer |
| BD Perm/Wash Buffer | BD Biosciences | 554723 | Referred to as Wash buffer |
| DNase | Sigma | D-4513 | |
| BD Falcon 12 x 75 mm FACS tubes | BD Biosciences | 352008 | |
| BD Pharmingen Stain Buffer | BD Biosciences | 554656 | |
| BD LSR FORTESSA flow cytometer | BD Biosciences | FORTESSA | |
| Pipetman | Gilson | P2, P20, P100, P1000 | |
| RPMI 1,640 w/o L-Gln 500 ml | Lonza | 12-167F | |
| DPBS | Lonza | 17-512F | |
| Fetal Bovine Serum | FisherBiotec | FBS-7100113 | |
| L-Glutamine | Sigma | G7513-100ML | |
| 5-Bromo-2′-deoxyuridine | Sigma | B5002-1G | |
| Falcon TC 150 cm2 vented Flasks | BD Biosciences | 355001 | |
| Pipettes 25 ml | Greiner | 760180 | |
| Aersol Pipettes 200 µl | Interpath | 24700 | |
| Aersol Pipettes 1 ml | Interpath | 24800 | |
| Centrifuge | Spintron | GT-175R | |
| CO2 incubator | Binder | C 150 | |
| AF488 anti-Histone H3 Phospho (Ser10) Antibody | Cell Signalling | 9708S | |
| Phospho-Chk2 (Thr68) (C13C1) Rabbit mAb | Cell Signalling | 2197S | |
| Phospho-Chk1 (Ser345) (133D3) Rabbit mAb | Cell Signalling | 2348S | |
| NALM6 | DSMZ | ACC-128 |
References
- Banfalvi, G. Methods Mol Biol. Banfalvi, G. 761, Humana Press. New York, Dordrecht, Heidelberg, London. 1-23 (2011).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132, 487-498 (2008).
- Harper, J. W., Elledge, S. J. The DNA damage response: ten years after. Molecular Cell. 28, 739-745 (2007).
- Latt, S. A., George, Y. S., Gray, J. W. Flow cytometric analysis of bromodeoxyuridine-substituted cells stained with 33258 Hoechst. The Journal of Histochemistry and Cytochemistry. 25, 927-934 (1977).
- Gratzner, H. G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science. 218, 474-475 (1982).
- Carayon, P., Bord, A. Identification of DNA-replicating lymphocyte subsets using a new method to label the bromo-deoxyuridine incorporated into the DNA. Journal of Immunological Methods. 147, 225-230 (1992).
- Gonchoroff, N. J., et al. S-phase detection with an antibody to bromodeoxyuridine. Role of DNase pretreatment. Journal of Immunological Methods. 93, 97-101 (1986).
- Rabinovitch, P. S., Torres, R. M., Engel, D. Simultaneous cell cycle analysis and two-color surface immunofluorescence using 7-amino-actinomycin D and single laser excitation: applications to study of cell activation and the cell cycle of murine Ly-1 B cells. Journal of Immunology. 136, 2769-2775 (1986).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. 32, 4789-4797 (2013).
- Hendzel, M. J., et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma. 106, 348-360 (1997).
- Draetta, G., Beach, D. Activation of cdc2 protein kinase during mitosis in human cells: cell cycle-dependent phosphorylation and subunit rearrangement. Cell. 54, 17-26 (1988).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. , (2012).
- Knudsen, R. C., Ahmed, A. A., Sell, K. W. An in vitro microassay for lymphotoxin using microculture plates and the multiple automated sample harvester. Journal of Immunological Methods. 5, 55-63 (1974).
- Beck, H. P. Proliferation kinetics of perturbed cell populations determined by the bromodeoxyuridine-33258 technique: radiotoxic effects of incorporated [3H]thymidine. Cytometry. 2, 170-174 (1981).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Collins, J. M., Berry, D. E., Bagwell, C. B. Different rates of DNA synthesis during the S phase of log phase HeLa S3, WI-38, and 2RA cells. Journal of Biological Chemistry. 255, 3585-3590 (1980).
- Schwarting, R., Gerdes, J., Niehus, J., Jaeschke, L., Stein, H. Determination of the growth fraction in cell suspensions by flow cytometry using the monoclonal antibody Ki-67. Journal of Immunological Methods. 90, 65-70 (1986).
- Danova, M., et al. Cell cycle-related proteins: a flow cytofluorometric study in human tumors. Biology of the Cell. 64, 23-28 (1988).
- Juan, G., et al. Histone H3 phosphorylation and expression of cyclins A and B1 measured in individual cells during their progression through G2 and mitosis. Cytometry. 32, 71-77 (1998).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 761, 75-83 (2011).
- Kues, W. A., et al. Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors. Biology of Reproduction. 62, 412-419 (2000).
- Urbani, L., Sherwood, S. W., Schimke, R. T. Dissociation of nuclear and cytoplasmic cell cycle progression by drugs employed in cell synchronization. Experimental Cell Research. 219, 159-168 (1995).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved