Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Временная Отслеживание клеточного цикла прогрессии Использование проточной цитометрии без необходимости синхронизации
В этой статье
Резюме
Этот протокол описывает использование бромдезоксиуридин (BrdU) поглощения, чтобы разрешить временную отслеживание клеток, которые были в S фазе на определенный момент времени. Добавление красителей ДНК и маркировки антител способствует детальный анализ судьбы S фазовых клеток в более поздние времена.
Аннотация
This protocol describes a method to permit the tracking of cells through the cell cycle without requiring the cells to be synchronized. Achieving cell synchronization can be difficult for many cell systems. Standard practice is to block cell cycle progression at a specific stage and then release the accumulated cells producing a wave of cells progressing through the cycle in unison. However, some cell types find this block toxic resulting in abnormal cell cycling, or even mass death. Bromodeoxyuridine (BrdU) uptake can be used to track the cell cycle stage of individual cells. Cells incorporate this synthetic thymidine analog, while synthesizing new DNA during S phase. By providing BrdU for a brief period it is possible to mark a pool of cells that were in S phase while the BrdU was present. These cells can then be tracked through the remainder of the cell cycle and into the next round of replication, permitting the duration of the cell cycle phases to be determined without the need to induce a potentially toxic cell cycle block. It is also possible to determine and correlate the expression of both internal and external proteins during subsequent stages of the cell cycle. These can be used to further refine the assignment of cell cycle stage or assess effects on other cellular functions such as checkpoint activation or cell death.
Введение
Оценка возможностей клеточного цикла и изменений, которые происходят в клетках в течение клеточного цикла является фундаментальным для понимания многих аспектов биологии, в частности биологии рака. Многие агенты в развитии для лечения злокачественных опухолей оказывают глубокое воздействие на прогрессирование клеточного цикла или индуцируют гибель клеток с помощью клеточного цикла зависимых механизмов-. С целью изучения динамики клеточного цикла или клеток в определенной фазе клеточного цикла, обычно для синхронизации клеток. Однако методы синхронизации может иметь пагубные последствия для клеток изучаются, потенциально сомнительных полученные результаты. 1 Недавно использование флуоресцентно меченых белков, которые присутствуют только в конкретных фаз цикла клетки имеют разрешенное анализ клеточного цикла в одиночных камерах в течение долгого времени 2, однако эти клетки должны быть изучены необходимость быть генетически манипулировать, чтобы выразить эти меченных белков, ограничивает их использование в системах, где это может быть прочитанаIly достигнута.
Клеточный цикл состоит из двух активных фаз: синтез-(S) фазы, где ДНК репликации и митоза (М), где деление клеток имеет место. Эти фазы разделяют три фазы пробел, G 0, G 1 и G 2. G 0 или неподвижность, это фаза отдыха, где клетка оставил цикл, G 1, когда клетки увеличиваются в размере до репликации ДНК и G 2, где рост клеток продолжается между завершением репликации ДНК, но до деления клеток. Прогрессирование через клеточный цикл контролируется числом пропускных пунктов. G 1 пункт пропуска активируется, когда условия окружающей среды не поддерживают синтеза ДНК и предотвращает попадание в S фазе. Фаза контрольно-пропускной пункт или задержка внутри S могут быть вызваны повреждением ДНК, что может привести к тупик вилки репликации. Во G 2 верность реплицированного ДНК подтвердил, и если обнаруживается дефект, то G 2 контрольно-пропускной пункт активируется репарации ДНК позволяет до клеточного деления. Окончательный контрольной точки во время митоза, что гарантирует хроматиды были выровнены в митотической пластины так, что деление клеток можно успешно завершена. 3 Активация этих пропускных пунктах обычно используется для синхронизации клеточных популяций. Контрольные клеточного цикла могут быть активированы с помощью целого ряда факторов, но в биологии рака наиболее распространенным является обнаружение повреждения ДНК. Реакция повреждение ДНК инициируется PI3-киназы-подобных киназ атаксии телеангиэктазии и Rad3 связанной (ATR) и атаксия-телеангиэктазия мутантный (ATM), что активации эффекторных киназ вниз по течению Chk1 и Chk2, соответственно. 3 спектр событий активирует Chk1 в том числе в тупик вилки репликации, сшивки ДНК, и ультрафиолетовое излучение, а ущерб Chk2 в первую очередь активируется двунитевых разрывов.
Обычный метод для изучения влияния изменившихся условий на длине I клеточного циклас синхронизировать клетки в определенной фазе клеточного цикла. 1 Это может быть достигнуто с помощью нескольких способов. Клетки могут быть физически разделены в зависимости от размера, плотности, боковое рассеивание (зернистости), и маркеров экспрессии клеточной поверхности. С практической точки, клетки могут быть синхронизированы с помощью химических средств. Несколько агенты, такие как гидроксимочевина тимидина, и цитозинарабинозидом может быть использовано, чтобы ингибировать синтез ДНК в S фазе клеточного цикла, что приводит к накоплению клеток в S фазе, которые продолжают велосипеде после агенты не будут удалены. Клетки обрабатывали нокодазолом, что предотвращает образование митотического веретена, остановки с G 2 - или М-фазы содержанием ДНК. Ликвидация сыворотки из результатов культуральной среды в накоплении клеток в G 0 фазе. Повторное добавление питательных веществ в культуре сыворотки возобновит нормальную велосипеде клеток. Тем не менее, все эти методы синхронизации мешать нормальной езды на велосипеде и рост клеток и может Ресулт в значительной гибели клеток.
Синхронизация острого лимфобластного лейкоза клеток является особенно сложным, и эти клетки не поддаются генетической манипуляции. Описанный здесь метод позволяет оценить динамику клеточного цикла и исследование клеток в отдельных фаз клеточного цикла без традиционных синхронизации или генетической модификации. Этот метод также может быть полезен для других типов клеток, где генетическая модификация и традиционные процедуры синхронизации не легко достигается. Метод основан на давние использования бромдезоксиуридина (BrdU) регистрации, которая имеет очень небольшое влияние на краткосрочный рост и пролиферацию клеток. 4 Установленные протоколы BrdU воспользоваться включения BrdU во вновь синтезированной ДНК во время S фазы , Это постоянно отмечает клетки, побывав в S фазе во время экспозиции BrdU. Это население может быть идентифицирован в более поздние моменты времени путем окрашивания BrdU для incorporвания и тем самым выступать в качестве синхронизированной населения, которые могут применяться, и в течение долгого времени оценочной позволяет изучение эффектов препарата по транзиту клеточного цикла. BrdU нужно подвергаться до окрашивания антител, как правило, достигается следующее ДНКазы или кислотной обработки. 6,7 Использование проточной цитометрии для обнаружения BrdU включены позволяет включение дополнительных маркеров. Наиболее важным является использование красителей для измерения содержания ДНК, позволяя оценку фазы клеточного цикла распределения клеток, которые были в S фазе в начале исследования. 8 Кроме дополнительные поверхности или внутриклеточные антигены также могут быть изучены. 9 Они может относиться к событиям клеточного цикла, таких как Ki67 или, казалось бы, не связанных между собой функций клеток, таких как апоптоз маркеров, как расщепляется каспазы-3. Потенциальные применения ограничены фантазией исследователя.
Access restricted. Please log in or start a trial to view this content.
протокол
Протокол, описанный здесь, использует острый лимфобластный лейкоз линию клеток NALM6 но может быть применено к другим типам клеток.
1. Решения и реагенты
- Полный RPMI
- Добавить 56 мл фетальной телячьей сыворотки (FCS) и 5,5 мл 200 мМ L-глутамина в 500 мл бутылку среде RPMI-1640.
- BrdU со Решение
- Подготовьте 32,5 мМ BrdU (10 мг / мл) в Дульбекко забуференным фосфатом физиологическим раствором (DPBS).
- BrdU Полный RPMI
- Добавить 6,2 мкл исходного раствора BrdU в 10 мл полной среды RPMI.
- ДНКазы решение
- Подготовьте 1 мг / мл ДНКазы в DPBS.
- Окрашивание буфера
- Готовят 3% инактивированной нагреванием ФТС и 0,09% азида натрия в DPBS.
- Обратитесь к Список материалов для определения фиксации буфера, пермеабилизирующего буфера и промывочного буфера.
2. Клетки
НетTe: Клетки не культивировали в течение более 6 месяцев. Этот метод напрямую адаптируется к любой неадгезированных клеточной линии с корректировкой плотности клеток и питательных сред. Использование клеток, которые экспоненциально растет с начала эксперимента.
- Поддержание NALM6 клеток в Т-75 колбы с культурой в полном RPMI. Выполните все шаги в стерильных условиях, используя класс Кабинета II биобезопасности.
- Поддержание NALM6 клетки между 1-2 х 10 6 клеток на мл, разделив культуры трижды в неделю.
- Инкубировать при 37 ° С в 5% СО 2 в воздухе.
3. Импульсный маркировки клеток с BrdU
ВНИМАНИЕ: Обращайтесь BrdU с осторожностью, поскольку это потенциальная мутагенным и тератогенным.
- Центрифуга клетки при 150 мкг в течение 5 мин. Примечание: Передача клеток в свежую среду улучшает воспроизводимость результатов.
- Выполните подсчет клеток и ресуспендирования клеток в RPMI Полный на 2 х 10 6 СELLS / мл.
- Развести ячеек 1 в 2 с BrdU Полный RPMI получения конечной концентрации клеток 1 × 10 6 клеток / мл.
- Инкубируют при 37 ° С с 5% СО 2 в течение 45 мин, затем разбавленным ячеек 1 в 10 с полной среде RPMI. Центрифуга клетки при 150 мкг в течение 5 мин и осторожно выбросить всю супернатанта.
- Ресуспендируют клеток в небольшом объеме (~ 100 мкл) полного RPMI, выполнить подсчет клеток и корректировать до 1 × 10 6 клеток / мл.
- Пипетка 1 мл клеток в лунки 48-луночного планшета. Внесите 1 мл DPBS в любых незанятых скважин для получения более воспроизводимые результаты.
- Инкубировать при 37 ° С в 5% СО 2 в воздухе в течение желаемых временных точках, здесь 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 , 18, 19, 20, 21, 22, 23, и 24 ч. Примечание: Длина и время будет зависеть от того, опытно-конструкторских является измерение.
- Перенесите все клетки в FACS труб с использованием пипетки. Промыть последовательно а 1 мл VoluМЭС PBS до конечной общего объема 5 мл.
- Центрифуга при 150 х г в течение 5 мин и тщательно удалить все супернатанта. Клетки готовы к окрашиванию, выполните это (раздел 4) немедленно.
4. Сотовый Окрашивание
Примечание: Если поверхность окрашивание клеток требуется выполнить его до фиксации, гарантируя, что клетки выдерживали при 4 ° С на протяжении.
- Ресуспендируют клеток в 100 мкл окрашивающего буфера (для дополнительного окрашивания поверхности, добавить рекомендуемый объем антитела к поверхностным антигенам и инкубируют в течение 30 мин при 4 ° С).
- Добавить 1 мл окрашивающего буфера, центрифугируют в течение 5 мин при 150 х г и отбросить супернатант.
Примечание: специфическое антитело, концентрации, времени инкубации и т.д. будет варьироваться в зависимости от конкретных экспериментальных целей. - Фиксация и проницаемости
- Ресуспендируют клеток в 100 мкл буфера фиксации и инкубировать в течение 15 мин при комнатной температуре.
- Добавить 1 мл ое промывочный буфер, центрифуги в течение 5 мин при 150 мкг и отбросить супернатант.
- Ресуспендируют клеток в 100 мкл буфера пермеабилизации и инкубируют клетки в течение 10 мин на льду.
- Добавить 1 мл промывочного буфера, центрифуг в течение 5 мин при 150 мкг, и отбросить супернатант.
- Ресуспендируют клеток в 100 мкл буфера фиксации на пробирку и инкубируют в течение 5 мин при комнатной температуре.
- Добавить 1 мл промывочного буфера, центрифуг в течение 5 мин при 150 мкг, и отбросить супернатант.
Примечание: протокол может быть приостановлена здесь, если требуется. Фиксированные клетки стабильны в течение нескольких дней при температуре 4 ° С, если ресуспендировали в буфере для окрашивания. Снимите буфер окрашивания После центрифугирования прежде чем продолжить.
- ДНКазы лечение
- Ресуспендируют клеток в 100 мкл ДНКазы раствора (30 мкг ДНКазы / 10 6 клеток) и инкубируют клетки в течение 1 часа при 37 ° С.
- Добавить 1 мл промывочного буфера, центрифугируют при 150 х г в течение 5 мин и отбросить супернатант.
- Антитела Окрашивание
Примечание: Окрашивание для других, чем BrdU внутриклеточных маркеров могут быть выполнены одновременно с окрашиванием BrdU.- ВАЖНО: Подготовка компенсации управления, состоящие из неокрашенных клеток и клеток, меченных каждого отдельного флуорохромом. В идеале, использовать одни и те же антитела для управления компенсации, как те, которые используются в экспериментальных трубок. Однако, если это невозможно, заменяющие антитела к высоким уровнем экспрессии антигенов, конъюгированный с той же флуорохромом.
- Ресуспендируют клеток в 50 мкл промывочного буфера и добавить 1 мкл / 10 6 клеток BrdU антителами. Примечание: Непосредственно конъюгированные антитела к другим антигенам специфическими внутриклеточными также могут быть добавлены.
Примечание:. Антитела к гистона Н3 фосфорилированным по Ser10 может быть использовано для различения клеток в G2 и М, гистона H3 фосфорилируется по Ser10 при митозе 10 Антитела к cdc2 фосфорилируется на Tyr15 может быть использован для обнаружения клеток, которые HAVе стремится к митоза. 11 - Инкубируйте клетки в течение 20 мин при комнатной температуре.
- Добавить 1 мл промывочного буфера, центрифуг клетки при 150 мкг в течение 5 мин и отбросить супернатант.
- Пятно ДНК анализа клеточного цикла
- Ослабьте осадок и добавить 20 мкл раствора 7-АСР (0,25 мкг). Примечание: Очень важно, чтобы использовать постоянное количество 7-АСР / клетку.
- Ресуспендируют клеток в 1 мл окрашивающего буфера.
5. Сбор данных проточной цитометрии
Примечание: машина необходимую будет зависеть от количества и характера используемых флуорохромами.
- Собирают следующие параметры: ЛПС-А, SSC-ЛПС-Н (FSC-W может быть использован вместо FSC-H) и флуоресценции 7-АСР на линейной шкале. Соберите канал APC по логарифмической шкале. Соберите все дополнительные каналы, необходимые для оценки поверхностных или внутренних меток с использованием логарифмической шкалы.
- Выполните компенсации перекрытия сигналов в спектрах излучения наблюдалось между различными флуорохромами прежде чем анализировать образцы. Примечание: Большинство цитометров потока будет выполнять это автоматически.
- Собирают по меньшей мере 10000 события для каждого образца.
6. Анализ проточной цитометрии данных
Примечание: FlowJo был использован в данном исследовании для проточной цитометрии анализа данных, но другие программные пакеты также могут быть использованы. Стратегия стробирования показано на рисунке 1.
- Определить жизнеспособной популяции клеток с использованием параметров FSC-A и SSC-A.
- В этой популяции исключить дублеты и агрегаты с использованием FSC-A и FSC-H (FSC-W также может быть использован здесь).
- В этой популяции установить точка участок с использованием 7-AAD на оси х и BrdU-АПК по оси ординат.
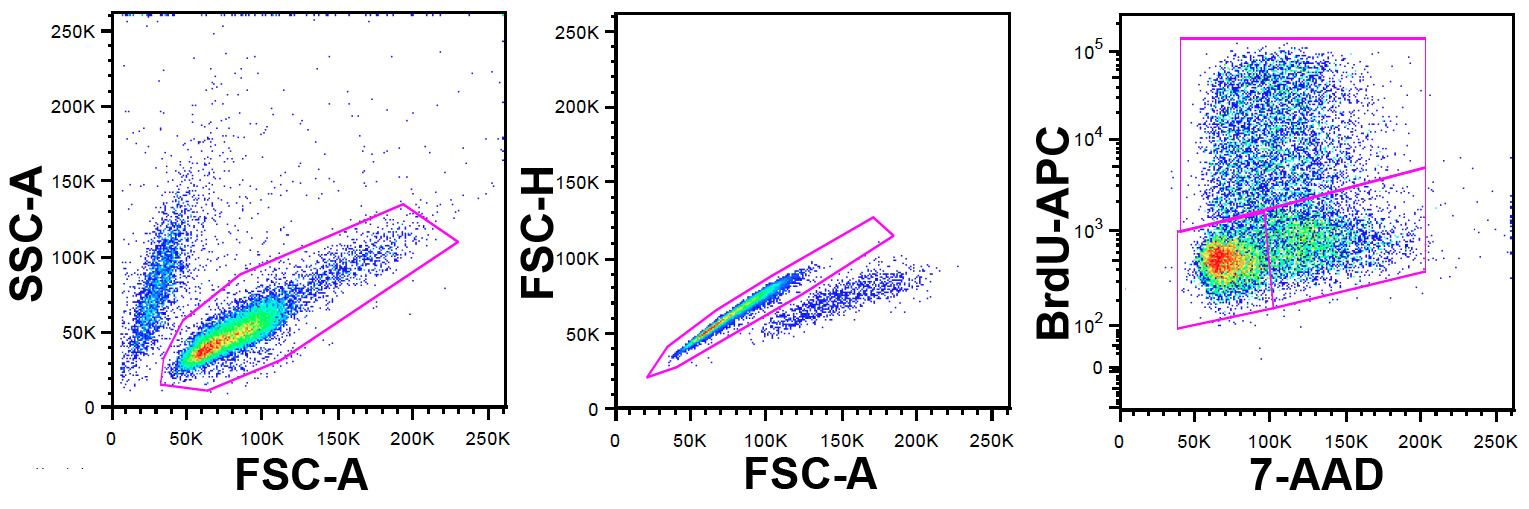
Рисунок 1: Память Стратегия слева годовых.нель: ungated клетки показано на FCS-A против SSC-точка участка. Жизнеспособным клеточной популяции идентифицируется ворот, показанного. Панель центр: клетки закрытых из левой панели показаны на FSC-A против FSC-Н точка участка (FSC-W может быть использован вместо высоты). Дублеты и агрегаты идентифицируются, и исключается ворот показано на рисунке. Правая панель: клетки закрытых от дублета даты исключения в центральной панели показаны на 7-AAD против APC-точка участка. BrdU антитело мечено APC позволяет идентифицировать клетки, которые включили BrdU в течение импульса маркировки. 7-AAD предоставляет информацию о содержании ДНК. Верхняя ворота определяет клетки положительные для BrdU и, следовательно, в S фазе в момент BrdU импульса, в нижнем левом ворот, клеток в G 0/1 и нижней правой ворот тех в G 2 / M. Пожалуйста, нажмите здесь, чтобы посмотреть крупная версия этой фигуры.
- Клеточного цикла нализ
- Откройте первый файл данных и ворота на клетки в дублет исключения ворот.
- Анализ этой группы населения для распределения клеточного цикла (находится под платформы в программном обеспечении FloJo) и использовать модель Дина-Джетт-Fox.
- Получите позиции G 0/1 и G 2 / M пики, использующие создать ворота.
- Ворота на BrdU положительных клеток и субъекта этого население же анализа клеточного цикла.
- Обеспечить позиции для G 0/1 и G 2 / M пики применяя те же самые ворота из ворот создания и настройки ограничений (с использованием созданных ворота) для позиций G 0/1 и G 2 / M пиков. Это показано в первые 2 панелей фиг.2.
Примечание: Другие программы также могут быть использованы для анализа данных, а также инструкции будет меняться соответственно.
840 / 52840fig2highres.jpg "ширина =" 700 "/>
Рисунок 2:. Клеточного цикла прогрессии первая панель (все ячейки) закрытого на клеточной популяции, определяемой дублет исключения ворот. Это население было отображается на гистограмме с 7-AAD на оси абсцисс. Пик G 0/1 пика обозначено стрелкой ниже оси. В последующие панелей BrdU положительных клеток были воротами на, как показано на рисунке 1. Значение для G 0/1 позиции, полученного при стробирования в дублет исключения ворот применяется к BrdU положительных клеток в закрытых программного обеспечения клеточного цикла FlowJo. Каждый последующий панель закрытого на положительной популяции BrdU, как показано на фиг.1 и положением пика G 0/1 на основе значения, полученного при анализе все население, как показано в первых двух панелей. Использование отрицательного фракции BrdU чтобы определить местоположение населения G 0/1 для BrdU-положительных клеток в той же SAMPле контролирует любые незначительные различия в интенсивности окраски ДНК между образцами. Показано на каждой панели число представляет собой время, так как импульс BrdU закончился. Фазы клеточного цикла расчетные приведены в затененной зелени. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Эта методика может быть использована для получения различной информации. Через несколько приложений изложены здесь.
Оценка длительности клеточного цикла
Чтобы определить время, необходимое для клеток транзит через клеточного цикла, клетки собирают в р...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Способность к анализу клеточного цикла имеет важное значение для понимания биологии рака и механизма действия обоих препаратов и генов, которые влияют на пролиферацию и рост клеток. В то время как есть множество анализов, которые, как сообщается измерения пролиферации клеток, большин?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
The work was funded by the Leukemia and Lymphoma Society of the USA (6105-08), a Cancer Council NSW grant (13-02), an NHMRC Senior Research Fellowship (LJB) (1042305) and project grant (1041614).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| APC BrdU Flow Kit | BD Biosciences | 552598 | Contains BrdU antibody, 7-AAD and BD Cytofix/Cytoperm Buffer (referred to as Fixation Buffer) |
| BD Cytoperm Permeabilization Buffer Plus | BD Biosciences | 561651 | Referred to as Permeabilization buffer |
| BD Perm/Wash Buffer | BD Biosciences | 554723 | Referred to as Wash buffer |
| DNase | Sigma | D-4513 | |
| BD Falcon 12 x 75 mm FACS tubes | BD Biosciences | 352008 | |
| BD Pharmingen Stain Buffer | BD Biosciences | 554656 | |
| BD LSR FORTESSA flow cytometer | BD Biosciences | FORTESSA | |
| Pipetman | Gilson | P2, P20, P100, P1000 | |
| RPMI 1,640 w/o L-Gln 500 ml | Lonza | 12-167F | |
| DPBS | Lonza | 17-512F | |
| Fetal Bovine Serum | FisherBiotec | FBS-7100113 | |
| L-Glutamine | Sigma | G7513-100ML | |
| 5-Bromo-2′-deoxyuridine | Sigma | B5002-1G | |
| Falcon TC 150 cm2 vented Flasks | BD Biosciences | 355001 | |
| Pipettes 25 ml | Greiner | 760180 | |
| Aersol Pipettes 200 µl | Interpath | 24700 | |
| Aersol Pipettes 1 ml | Interpath | 24800 | |
| Centrifuge | Spintron | GT-175R | |
| CO2 incubator | Binder | C 150 | |
| AF488 anti-Histone H3 Phospho (Ser10) Antibody | Cell Signalling | 9708S | |
| Phospho-Chk2 (Thr68) (C13C1) Rabbit mAb | Cell Signalling | 2197S | |
| Phospho-Chk1 (Ser345) (133D3) Rabbit mAb | Cell Signalling | 2348S | |
| NALM6 | DSMZ | ACC-128 |
Ссылки
- Banfalvi, G. Methods Mol Biol. Banfalvi, G. 761, Humana Press. New York, Dordrecht, Heidelberg, London. 1-23 (2011).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132, 487-498 (2008).
- Harper, J. W., Elledge, S. J. The DNA damage response: ten years after. Molecular Cell. 28, 739-745 (2007).
- Latt, S. A., George, Y. S., Gray, J. W. Flow cytometric analysis of bromodeoxyuridine-substituted cells stained with 33258 Hoechst. The Journal of Histochemistry and Cytochemistry. 25, 927-934 (1977).
- Gratzner, H. G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science. 218, 474-475 (1982).
- Carayon, P., Bord, A. Identification of DNA-replicating lymphocyte subsets using a new method to label the bromo-deoxyuridine incorporated into the DNA. Journal of Immunological Methods. 147, 225-230 (1992).
- Gonchoroff, N. J., et al. S-phase detection with an antibody to bromodeoxyuridine. Role of DNase pretreatment. Journal of Immunological Methods. 93, 97-101 (1986).
- Rabinovitch, P. S., Torres, R. M., Engel, D. Simultaneous cell cycle analysis and two-color surface immunofluorescence using 7-amino-actinomycin D and single laser excitation: applications to study of cell activation and the cell cycle of murine Ly-1 B cells. Journal of Immunology. 136, 2769-2775 (1986).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. 32, 4789-4797 (2013).
- Hendzel, M. J., et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma. 106, 348-360 (1997).
- Draetta, G., Beach, D. Activation of cdc2 protein kinase during mitosis in human cells: cell cycle-dependent phosphorylation and subunit rearrangement. Cell. 54, 17-26 (1988).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. , (2012).
- Knudsen, R. C., Ahmed, A. A., Sell, K. W. An in vitro microassay for lymphotoxin using microculture plates and the multiple automated sample harvester. Journal of Immunological Methods. 5, 55-63 (1974).
- Beck, H. P. Proliferation kinetics of perturbed cell populations determined by the bromodeoxyuridine-33258 technique: radiotoxic effects of incorporated [3H]thymidine. Cytometry. 2, 170-174 (1981).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Collins, J. M., Berry, D. E., Bagwell, C. B. Different rates of DNA synthesis during the S phase of log phase HeLa S3, WI-38, and 2RA cells. Journal of Biological Chemistry. 255, 3585-3590 (1980).
- Schwarting, R., Gerdes, J., Niehus, J., Jaeschke, L., Stein, H. Determination of the growth fraction in cell suspensions by flow cytometry using the monoclonal antibody Ki-67. Journal of Immunological Methods. 90, 65-70 (1986).
- Danova, M., et al. Cell cycle-related proteins: a flow cytofluorometric study in human tumors. Biology of the Cell. 64, 23-28 (1988).
- Juan, G., et al. Histone H3 phosphorylation and expression of cyclins A and B1 measured in individual cells during their progression through G2 and mitosis. Cytometry. 32, 71-77 (1998).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 761, 75-83 (2011).
- Kues, W. A., et al. Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors. Biology of Reproduction. 62, 412-419 (2000).
- Urbani, L., Sherwood, S. W., Schimke, R. T. Dissociation of nuclear and cytoplasmic cell cycle progression by drugs employed in cell synchronization. Experimental Cell Research. 219, 159-168 (1995).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены