このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
同期を必要とせずに、フローサイトメトリーを用いた細胞周期の進行の時間追跡
要約
このプロトコルは、特定の時点でS期にあった細胞の時間的な追跡を可能にするために、ブロモデオキシウリジン(BrdUの)取り込みの使用が記載されています。 DNA色素と抗体標識の添加は、後の時点でS期細胞の運命の詳細な分析を容易にします。
要約
This protocol describes a method to permit the tracking of cells through the cell cycle without requiring the cells to be synchronized. Achieving cell synchronization can be difficult for many cell systems. Standard practice is to block cell cycle progression at a specific stage and then release the accumulated cells producing a wave of cells progressing through the cycle in unison. However, some cell types find this block toxic resulting in abnormal cell cycling, or even mass death. Bromodeoxyuridine (BrdU) uptake can be used to track the cell cycle stage of individual cells. Cells incorporate this synthetic thymidine analog, while synthesizing new DNA during S phase. By providing BrdU for a brief period it is possible to mark a pool of cells that were in S phase while the BrdU was present. These cells can then be tracked through the remainder of the cell cycle and into the next round of replication, permitting the duration of the cell cycle phases to be determined without the need to induce a potentially toxic cell cycle block. It is also possible to determine and correlate the expression of both internal and external proteins during subsequent stages of the cell cycle. These can be used to further refine the assignment of cell cycle stage or assess effects on other cellular functions such as checkpoint activation or cell death.
概要
細胞周期の進行の間に細胞内で起こる細胞周期の機能と変更点の評価は、生物学の多くの側面、特に癌の生物学を理解するための基本です。悪性腫瘍の治療のために開発中の多くの薬剤は、細胞周期の進行に大きな影響を持っているか、細胞周期依存性の機構を介して、細胞死を誘導します。細胞周期の特定の期における細胞周期動態または細胞を研究するためには、細胞を同期させることが一般的です。しかし、同期化方法は、潜在的に得られた結果を混乱させる、研究された細胞に有害な影響を有し得る。1近年、細胞周期の特定の段階でのみ存在する蛍光タグ付きタンパク質の使用は、時間をかけて、単一細胞における細胞周期進行の分析を可能にしました2、ただし細胞は遺伝的にこれを読み取ることができるシステムへの使用を制限する、これらの標識タンパク質を発現するように操作する必要性を検討しますILY達成。
細胞周期は、2つのアクティブフェーズで構成されています細胞分裂が起こる合成DNAが複製される(S)相、有糸分裂(M)を。これらの相は3ギャップ相、G 0、G 1及びG 2で分離されています。 G 0または休止は、細胞は、細胞が前のDNA複製および細胞増殖は、DNA複製の完了との間が、細胞分裂の前に続けてG 2のサイズの増加ここで、G 1は 、周期を離れた休止期です。細胞周期の進行は、チェックポイントの数によって制御されます。環境条件がDNA合成の支援ではなく、S期への進入を防止するときG 1チェックポイントが活性化されます。イントラS期チェックポイントまたは遅延は、停止した複製フォークで生じ得るDNA損傷によって誘発することができます。 G 2の間、複製されたDNAの忠実性が確認され、損傷をG 2、検出された場合チェックポイントは、前の細胞分裂にDNA修復を可能にする活性化されます。有糸分裂の間の最終的なチェックポイントは、細胞分裂が正常に完了することができるように、染色分が正常に分裂プレートに整列されていることを保証します。これらのチェックポイントの3活性化は、一般的に細胞集団を同期するために使用されます。細胞周期チェックポイントは、多くの要因によって活性化することができるが、癌生物学において最も一般的には、DNA損傷の検出です。 DNA損傷応答はPI3キナーゼ様キナーゼ毛細血管拡張性運動失調およびRAD3関連(ATR)は、それぞれ、下流のエフェクターキナーゼのChk1およびChk2での活性化血管拡張性失調症変異した(ATM)によって開始される。3イベントの範囲は、ストールを含めたChk1を活性化させます複製フォーク、DNAの架橋、および紫外線損傷はChk2では、主に二本鎖切断によって活性化されます。
細胞周期iの長さに変更された条件の影響を研究するための通常の方法細胞周期の特定の段階において細胞を同期させるための1本は、いくつかの方法を介して達成することができます。細胞は、物理的サイズ、密度、側方散乱(粒度)、および細胞表面マーカーの発現に基づいて分離することができます。具体的には、細胞は、化学的手段によって同期させることができます。チミジン、ヒドロキシ尿素及びシトシンアラビノシドのようないくつかの薬剤は、薬剤が除去された後に循環を続けるS期における細胞の蓄積を生じ、細胞周期のS期におけるDNA合成を阻害するために使用することができます。またはM期のDNA含量-有糸分裂紡錘体、G 2と逮捕の形成を防止するノコダゾール、で処理した細胞。 G 0期の細胞の蓄積培地結果から血清の排除。培養血清中の栄養素の再添加は、細胞の正常な循環を再起動します。しかし、これらの同期方法の全ては、細胞の正常な循環と成長を妨害することが可能とresul有意な細胞死でT。
急性リンパ芽球性白血病細胞の同期は特に困難であり、これらの細胞は、遺伝子操作に適していません。ここで説明する方法は、細胞周期動態の評価と、従来の同期または遺伝子改変することなく、細胞周期の特定の段階にある細胞の研究を可能にします。この方法は、遺伝子改変し、従来の同期手順は容易に達成されていない他の細胞型のために有用であり得ます。この方法は、細胞の短期の成長および増殖にはほとんど影響を与えブロモデオキシウリジン(BrdUの)取り込み、長い確立使用に基づいている。4設立のBrdUプロトコルはS期の間に新たに合成されたDNAへのBrdUの取り込みを利用します。これは恒久的にBrdU露光中、S期にあったように、細胞をマークします。この集団は、BrdUのincorporために染色することにより、後の時点で識別することができエーション、それにより追跡し、細胞周期の通過に対する薬物効果の研究を可能にする時間をかけて評価することができる同期集団として機能します。 BrdUを通常DNアーゼまたは酸処理した後の達成、前抗体染色にさらされる必要がある。6,7取り込まれたBrdUは、追加のマーカーを含めることができ検出するために、フローサイトメトリーを使用しました。最も重要なのは、試験の開始時にS期にあった細胞の細胞周期分布の評価を可能にする、DNA含有量を測定するための色素の使用である。8さらに、追加の表面または細胞内抗原はまた、研究することができる。9、これらなどのKi67として、またはそのような切断されたカスパーゼ3のようなアポトーシスマーカーとしての一見無関係な細胞機能への細胞周期のイベントに関連してもよいです。潜在的な用途は、研究者の想像力によって制限されています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
ここで説明するプロトコルは、急性リンパ芽球性白血病細胞株NALM6を使用するが、他の細胞型に適用することができます。
1.ソリューションおよび試薬
- 完全RPMI
- 56ミリリットルのウシ胎児血清(FCS)およびRPMI-1640培地500mlボトルに5.5ミリリットルの200mMのL-グルタミンを追加します。
- BrdUの原液
- ダルベッコのリン酸緩衝生理食塩水(DPBS)で32.5 mMのBrdUを(10mg / ml)を準備します。
- BrdUを完全RPMI
- 完全RPMIの10mlまでのBrdUストック溶液6.2μlを添加します。
- DNase溶液
- 1mgのDNアーゼ/ DPBSでミリリットルを準備します。
- 染色緩衝液
- DPBSで3%の熱不活性化FCSおよび0.09%アジ化ナトリウムを準備します。
- 固定バッファ、透過処理用緩衝液および洗浄用緩衝液の定義については、物質一覧を参照してください。
2.細胞
いいえTE:細胞はより大きい6ヶ月間培養しませんでした。この方法は、細胞密度および培養培地の調整と非付着性細胞株に直接適用可能です。実験の開始時に指数関数的に増殖している細胞を使用してください。
- 完全RPMI中のT-75培養フラスコ中NALM6細胞を維持します。クラスII安全キャビネットを使用して、無菌条件下で、すべての手順を実行します。
- 週に3回文化を分割して、1ml当たり1〜2×10 6個の細胞間NALM6細胞を維持します。
- 大気中のCO 2、5%、37℃でインキュベートします。
BrdUで細胞の3パルス標識
注意:それは潜在的な変異原と催奇形物質であるように注意したBrdUを処理します。
- 5分間、150×gで遠心分離した細胞。注:新鮮な培地に細胞を転送すると、結果の再現性を向上させます。
- 2×10 6℃での完全RPMI中の細胞数および再懸濁細胞を行いますells / mlの。
- BrdUの完全RPMIに1×10 6細胞/ mlの最終細胞濃度を産生して細胞を2 1に希釈します。
- その後、完全RPMIで10のセル1を希釈し、45分間、5%CO 2で37℃でインキュベートします。遠心セル5分間150×gで、慎重に上清をすべて廃棄します。
- 完全RPMIの少量(〜100μL)中で再懸濁した細胞は、細胞計数を行い、1×10 6細胞/ mlに調整します。
- ピペット48ウェルプレートのウェルへの細胞の1ミリリットル。ピペットより再現性のある結果を得るために、未使用のウェルにDPBSの1ミリリットル。
- 所望ここ時点、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、空気中5%CO 2中で37℃でインキュベートします、18、19、20、21、22、23、及び24時間。注意:時間の長さは、実験計画を測定することを目的とするものに依存します。
- ピペットを用いてFACSチューブにすべてのセルを転送します。 1ミリリットルvoluとよく順次をすすぎます5ミリリットルの最終全容量のPBS MES。
- 5分間150×gで遠心分離し、慎重にすべての上清を除去します。細胞は、染色のための準備ができているすぐにこの(セクション4)を行います。
4.細胞染色
注:細胞表面染色が必要な場合は、細胞が全体に4℃に保たれることを確実に定着する前にそれを行います。
- 染色緩衝液100μl中に再懸濁細胞(任意の表面染色のためには、表面抗原と4℃で30分間インキュベートし、抗体の推奨量を追加します)。
- 、染色緩衝液1mlを加え150×gで5分間遠心分離し、上清を捨てます。
注記:特定の抗体濃度、インキュベーション時間等は、特定の実験の目的に応じて変化します。 - 固定および透過処理
- 固定緩衝液100μl中に細胞を再懸濁し、室温で15分間インキュベートします。
- 1ミリリットルOを追加F洗浄バッファー、150×gで5分間遠心分離し、上清を捨てます。
- 透過化緩衝液100μlで細胞を再懸濁し、氷上で10分間細胞をインキュベートします。
- 、洗浄緩衝液1mlを加え150×gで5分間遠心分離し、上清を捨てます。
- チューブあたり固定緩衝液100μl中に細胞を再懸濁し、室温で5分間インキュベートします。
- 、洗浄緩衝液1mlを加え150×gで5分間遠心分離し、上清を捨てます。
注:必要に応じてプロトコルは、ここで一時停止することができます。染色緩衝液中に再懸濁させた場合に固定された細胞は、4℃で数日間安定です。先に進む前に、遠心分離後染色バッファーを削除します。
- DNase処理
- DNase溶液100μl中に再懸濁細胞(30μgの6 DNアーゼ/ 10の細胞)および37℃で1時間、細胞を培養します。
- 、洗浄緩衝液1mlを加え5分間、150×gで遠心分離し、上清を捨てます。
- 抗体染色
注:BrdUの以外の細胞内マーカーについて染色BrdU染色と同時に行うことができます。- 重要:それぞれの単一の蛍光色素で標識された未染色の細胞と細胞からなる補償コントロールを準備します。理想的には、実験チューブに使用されるもののような補償のコントロールに同じ抗体を使用しています。これが不可能な場合には、高度に発現される抗原に対する代替抗体は、同一の蛍光色素にコンジュゲート。
- 洗浄緩衝液50μl中に細胞を再懸濁し、1μL/ BrdU抗体の10 6個の細胞を追加します。注:他の特定の細胞内抗原に直接結合した抗体を添加することもできます。
注:セリン10上でリン酸化ヒストンH3に対する抗体は、G2中の細胞を区別するために使用することができ、M、ヒストンH3のセリン10、有糸分裂の間にリン酸化されるTyr15がリン酸化CDC2に対する10抗体は、HAV細胞を検出するために使用することができます。E有糸分裂にコミット。11 - 室温で20分間細胞をインキュベートします。
- 、洗浄緩衝液1mlを加え5分間、150×gで遠心分離細胞と上清を捨てます。
- 細胞周期分析のための染色DNA
- ペレットを緩め、7-AAD溶液(0.25μgの)の20μlを添加します。注:これは、7-AAD /セルの一定量を使用することが重要です。
- 染色緩衝液1mlで細胞を再懸濁します。
フローサイトメトリーデータの5集
注:必要なマシンが使用する蛍光色素の数と性質に依存します。
- リニアスケールのFSC-A、SSC-A、FSC-H(FSC-Wの代わりにFSC-Hを用いることができる)と7-AAD蛍光:次のパラメータを収集します。対数スケール上のAPCチャネルを収集します。対数スケールを用いて表面や内部のラベルの評価のために必要な追加のチャネルを収集します。
- COMを行いますサンプルを分析する前に、異なる蛍光色素との間で観察された発光スペクトルの信号の重複pensation。注:ほとんどのフローサイトメーターは、これを自動的に実行します。
- 各サンプルの少なくとも10,000個のイベントを収集します。
フローサイトメトリーデータの分析6.
注:FlowJoソフトは、フローサイトメトリーデータ分析のために、本研究で使用したが、他のソフトウェアパッケージを使用することもできます。ゲーティング戦略は、図1に示されています。
- FSC-AおよびSSC-Aのパラメータを使用して、生細胞集団を特定します。
- この集団内ダブレットと(もここで用いることができるFSC-W)FSC-AおよびFSC-Hを用いて凝集体を除外します。
- この集団内でのy軸上のx軸とのBrdU-APCに7-AADを用いたドットプロットを設定します。
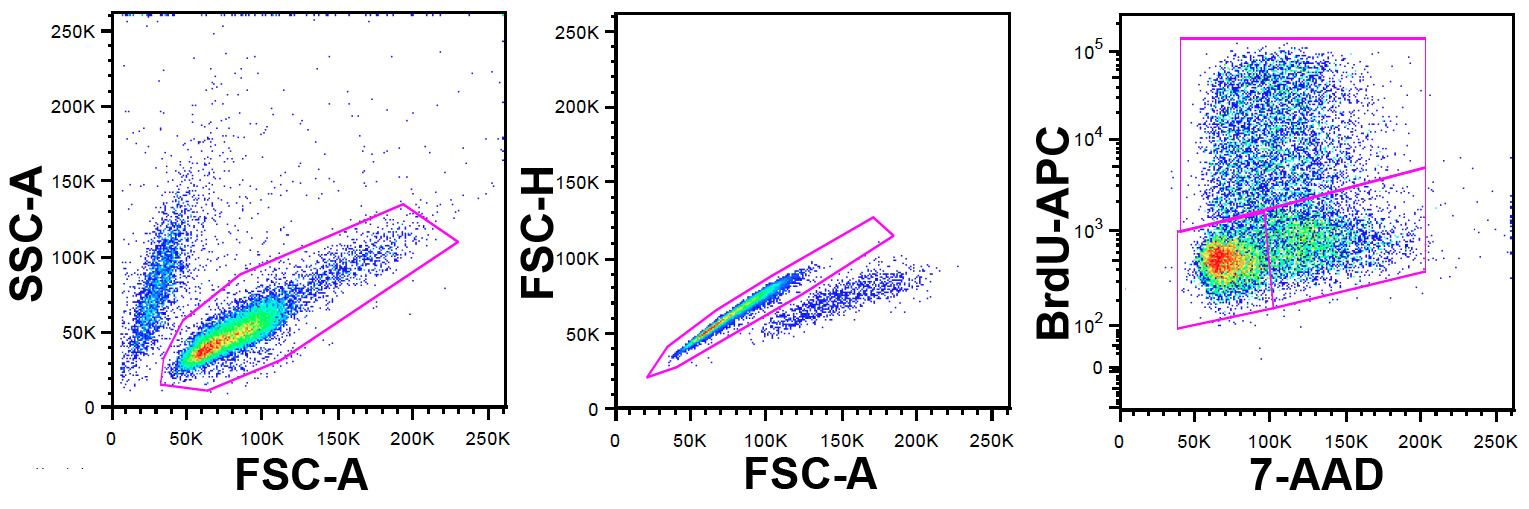
図1:ゲーティング戦略左PA。ネル:非ゲートの細胞は、SSCドットプロット対FCS-Aに示されています。生存可能な細胞集団を示したゲートによって識別されます。センターパネル:左パネルからゲート細胞は、FSC-Hドットプロット対FSC-A(FSC-Wの代わりに高さを使用することができます)に表示されます。ダブレットと凝集体が同定され、示されたゲートで除外されています。右パネル:中央のパネルで二重排除日からゲート細胞は、APC-ドットプロット対7-AADに表示されます。 BrdU抗体は、APCをパルス標識中のBrdUを取り込んだ細胞の同定を可能に標識されています。 7-AADは、DNA含有量についての情報を提供します。上部ゲートは、BrdUのための陽性細胞を定義するため、S期でのBrdUパルスの時に、左下のゲート、G 0/1のセルと右下のゲートGのもの2 / M。 表示するにはこちらをクリックしてくださいこの図の拡大版。
- 細胞周期A nalysis
- ダブレット排除ゲート内の細胞の最初のデータ·ファイルとゲートを開きます。
- (FloJoソフトウェアのプラットフォームの下に位置する)は、細胞周期分布のために、この集団を分析し、ディーン·ジェット·フォックスモデルを使用します。
- ゲートを作成し使用してG 0/1およびG 2 / Mピークの位置を取得します。
- BrdU陽性細胞と被写体上のゲートと同じ細胞周期分析にこの集団。
- 作成ゲートから同じゲートを適用し、G 0/1およびG 2 / Mピークの位置について(作成したゲートを使用)制約を設定することにより、G 0/1およびG 2 / Mピークの位置を提供します。これは、 図2の第2のパネルに示されています。
注:他のソフトウェアは、データを分析するために使用されてもよく、命令は、それに応じて変化するであろう。
840 / 52840fig2highres.jpg "幅=" 700 "/>
図2:細胞周期の進行最初のパネル(全細胞)を二重排除ゲートによって定義された細胞集団にゲートされます。この集団は、X軸上の7-AADとヒストグラムで表示しました。 G 0/1ピークのピークが軸の下の矢印で示されています。 図1に示すように、後続のパネルでのBrdU陽性細胞にゲートされている。得られたG 0/1位置の値を二重排除ゲートのゲートは、FlowJoソフト細胞周期ソフトウェア内のBrdU陽性のゲート細胞に適用した場合。 図1および第2のパネルに示すように、全体の人口を分析したときに得られる値に基づいて、G 0/1ピークの位置に示すように後続の各パネルには、BrdU陽性集団にゲートをしました。同じSAMPでのBrdU陽性細胞のためのG 0/1集団の位置を特定するためのBrdU陰性画分を使用しましたルは、サンプル間のDNA染色の強度のわずかな違いを制御します。各パネルに表示される数は、BrdUのパルスが終了してからの時間を表しています。計算された細胞周期相は日陰緑色で示されている。 この図の拡大版を表示するには、こちらをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
この方法は、情報の範囲を得るために使用することができます。いくつかのアプリケーションは、ここで概説されています。
細胞周期の継続時間の評価
細胞周期を介して通過する細胞のために必要な時間を決定するために、細胞を、BrdUのパルス後の種々の時点で採取します。評価の間隔は、分析される特定の細胞に適応させることができます。造血...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
細胞周期を分析する能力は、癌生物学および細胞増殖と成長に影響を与える両薬物および遺伝子の作用機序を理解するために重要です。報告によると、細胞増殖を測定するアッセイの多数がありますが、大半は単に本数細胞を示す尺度を提供します。これらは、直接可視化、カウント、代謝活性またはATP濃度によって細胞数を測定するアッセイが含まれます。これらの方法の多くの主な利点?...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors have nothing to disclose.
謝辞
The work was funded by the Leukemia and Lymphoma Society of the USA (6105-08), a Cancer Council NSW grant (13-02), an NHMRC Senior Research Fellowship (LJB) (1042305) and project grant (1041614).
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| APC BrdU Flow Kit | BD Biosciences | 552598 | Contains BrdU antibody, 7-AAD and BD Cytofix/Cytoperm Buffer (referred to as Fixation Buffer) |
| BD Cytoperm Permeabilization Buffer Plus | BD Biosciences | 561651 | Referred to as Permeabilization buffer |
| BD Perm/Wash Buffer | BD Biosciences | 554723 | Referred to as Wash buffer |
| DNase | Sigma | D-4513 | |
| BD Falcon 12 x 75 mm FACS tubes | BD Biosciences | 352008 | |
| BD Pharmingen Stain Buffer | BD Biosciences | 554656 | |
| BD LSR FORTESSA flow cytometer | BD Biosciences | FORTESSA | |
| Pipetman | Gilson | P2, P20, P100, P1000 | |
| RPMI 1,640 w/o L-Gln 500 ml | Lonza | 12-167F | |
| DPBS | Lonza | 17-512F | |
| Fetal Bovine Serum | FisherBiotec | FBS-7100113 | |
| L-Glutamine | Sigma | G7513-100ML | |
| 5-Bromo-2′-deoxyuridine | Sigma | B5002-1G | |
| Falcon TC 150 cm2 vented Flasks | BD Biosciences | 355001 | |
| Pipettes 25 ml | Greiner | 760180 | |
| Aersol Pipettes 200 µl | Interpath | 24700 | |
| Aersol Pipettes 1 ml | Interpath | 24800 | |
| Centrifuge | Spintron | GT-175R | |
| CO2 incubator | Binder | C 150 | |
| AF488 anti-Histone H3 Phospho (Ser10) Antibody | Cell Signalling | 9708S | |
| Phospho-Chk2 (Thr68) (C13C1) Rabbit mAb | Cell Signalling | 2197S | |
| Phospho-Chk1 (Ser345) (133D3) Rabbit mAb | Cell Signalling | 2348S | |
| NALM6 | DSMZ | ACC-128 |
参考文献
- Banfalvi, G. Methods Mol Biol. Banfalvi, G. 761, Humana Press. New York, Dordrecht, Heidelberg, London. 1-23 (2011).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132, 487-498 (2008).
- Harper, J. W., Elledge, S. J. The DNA damage response: ten years after. Molecular Cell. 28, 739-745 (2007).
- Latt, S. A., George, Y. S., Gray, J. W. Flow cytometric analysis of bromodeoxyuridine-substituted cells stained with 33258 Hoechst. The Journal of Histochemistry and Cytochemistry. 25, 927-934 (1977).
- Gratzner, H. G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science. 218, 474-475 (1982).
- Carayon, P., Bord, A. Identification of DNA-replicating lymphocyte subsets using a new method to label the bromo-deoxyuridine incorporated into the DNA. Journal of Immunological Methods. 147, 225-230 (1992).
- Gonchoroff, N. J., et al. S-phase detection with an antibody to bromodeoxyuridine. Role of DNase pretreatment. Journal of Immunological Methods. 93, 97-101 (1986).
- Rabinovitch, P. S., Torres, R. M., Engel, D. Simultaneous cell cycle analysis and two-color surface immunofluorescence using 7-amino-actinomycin D and single laser excitation: applications to study of cell activation and the cell cycle of murine Ly-1 B cells. Journal of Immunology. 136, 2769-2775 (1986).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. 32, 4789-4797 (2013).
- Hendzel, M. J., et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma. 106, 348-360 (1997).
- Draetta, G., Beach, D. Activation of cdc2 protein kinase during mitosis in human cells: cell cycle-dependent phosphorylation and subunit rearrangement. Cell. 54, 17-26 (1988).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. , (2012).
- Knudsen, R. C., Ahmed, A. A., Sell, K. W. An in vitro microassay for lymphotoxin using microculture plates and the multiple automated sample harvester. Journal of Immunological Methods. 5, 55-63 (1974).
- Beck, H. P. Proliferation kinetics of perturbed cell populations determined by the bromodeoxyuridine-33258 technique: radiotoxic effects of incorporated [3H]thymidine. Cytometry. 2, 170-174 (1981).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Collins, J. M., Berry, D. E., Bagwell, C. B. Different rates of DNA synthesis during the S phase of log phase HeLa S3, WI-38, and 2RA cells. Journal of Biological Chemistry. 255, 3585-3590 (1980).
- Schwarting, R., Gerdes, J., Niehus, J., Jaeschke, L., Stein, H. Determination of the growth fraction in cell suspensions by flow cytometry using the monoclonal antibody Ki-67. Journal of Immunological Methods. 90, 65-70 (1986).
- Danova, M., et al. Cell cycle-related proteins: a flow cytofluorometric study in human tumors. Biology of the Cell. 64, 23-28 (1988).
- Juan, G., et al. Histone H3 phosphorylation and expression of cyclins A and B1 measured in individual cells during their progression through G2 and mitosis. Cytometry. 32, 71-77 (1998).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 761, 75-83 (2011).
- Kues, W. A., et al. Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors. Biology of Reproduction. 62, 412-419 (2000).
- Urbani, L., Sherwood, S. W., Schimke, R. T. Dissociation of nuclear and cytoplasmic cell cycle progression by drugs employed in cell synchronization. Experimental Cell Research. 219, 159-168 (1995).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved