Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Senkronizasyon Need for olmadan Akım Sitometri Kullanımı Hücre Döngüsü ilerleme zamansal İzleme
Bu Makalede
Özet
Bu protokol, zaman içinde belirli bir noktada S fazında olan hücrelerin zamansal izleme izin vermek için bromodeoksiüridin (BrdU) alımından kullanımını tarif eder. DNA boyalar ve antikor etiketleme eklenmesi daha sonraki zamanlarda S fazı hücrelerinin kaderi detaylı analizini kolaylaştırır.
Özet
This protocol describes a method to permit the tracking of cells through the cell cycle without requiring the cells to be synchronized. Achieving cell synchronization can be difficult for many cell systems. Standard practice is to block cell cycle progression at a specific stage and then release the accumulated cells producing a wave of cells progressing through the cycle in unison. However, some cell types find this block toxic resulting in abnormal cell cycling, or even mass death. Bromodeoxyuridine (BrdU) uptake can be used to track the cell cycle stage of individual cells. Cells incorporate this synthetic thymidine analog, while synthesizing new DNA during S phase. By providing BrdU for a brief period it is possible to mark a pool of cells that were in S phase while the BrdU was present. These cells can then be tracked through the remainder of the cell cycle and into the next round of replication, permitting the duration of the cell cycle phases to be determined without the need to induce a potentially toxic cell cycle block. It is also possible to determine and correlate the expression of both internal and external proteins during subsequent stages of the cell cycle. These can be used to further refine the assignment of cell cycle stage or assess effects on other cellular functions such as checkpoint activation or cell death.
Giriş
hücre döngüsü ilerlemesi sırasında hücre döngüsü özellikleri ve hücrelerde meydana gelen değişikliklerin değerlendirilmesi biyolojisi, özellikle kanser biyolojisi birçok yönünü anlamak için esastır. Malignitelerin tedavisi için geliştirilmesinde bir çok madde, hücre döngüsü ilerlemesi üzerinde derin etkilere sahip ya da hücre devre bağımlı-mekanizmalar yoluyla hücre ölümüne neden olmaktadır. Hücre döngüsünün belirli fazında hücre döngüsü dinamikleri veya hücreleri incelemek için, bu hücrelerin senkronize olağandır. Ancak senkronizasyon yöntemleri potansiyel sonuçlar elde karıştırıcı, çalışılan hücreleri üzerinde zararlı etkileri olabilir. 1 zamanla tek hücrelerde hücre döngüsü ilerlemesinin son hücrelerin döngüsünün belirli aşamalarında sadece mevcut floresan isim levhası proteinlerin kullanılmasına izin var analizi 2, bununla birlikte, bu hücreler, genetik olarak okunabilir sistemlere kullanımlarını sınırlayan, bu etiketlenmiş proteinlerin sentezlenmesi için manipüle edilmesi ihtiyacı incelenecekily elde etti.
(S) faz DNA çoğaltılır ve mitoz (M) burada hücre bölünmesi gerçekleşir: hücre döngüsü, iki aktif aşamadan oluşmaktadır. Bu fazlar, üç boşluk fazlar, G 0, G1 ve G2 ile ayrılır. Hücreler boyutu önceden hücre büyümesi DNA replikasyonu tamamlanması arasındaki fakat hücre bölünmesi öncesinde devam DNA replikasyonu ve G 2 artırmak nerede G 0 ya da sessizlik, hücre döngüsünü terk etti bir dinlenme aşamasıdır, G 1'dir. hücre döngüsü yoluyla ilerleme kontrol noktaları bir dizi tarafından kontrol edilir. Çevre koşulları, DNA sentezinin destekleyici değildir ve S fazına girişi önler G 1 kapısı aktive edilir. içi S fazı kapısı veya gecikme durdu çoğaltma çatal yol açabilir DNA hasarı ile tetiklenebilir. Hasar G 2 sonra tespit edilirse G 2 Sırasında çoğaltılan DNA sadakat onaylanır ve Denetim noktası bölümü hücre DNA tamir önce izin aktive edilir. Mitoz sırasında son bir kontrol noktası o hücre bölünmesi başarıyla tamamlandı böylece kromatidler doğru mitotik plakada hizalanmış olduğunu garanti eder. Bu kontrol noktalarında 3 aktivasyonu yaygın hücre popülasyonlarının eşitlemek için kullanılır. Hücre döngüsü kontrol noktası, bir dizi faktöre göre ancak en yaygın DNA hasarının tespiti, Kanser biyolojisinde etkinleştirilebilir. DNA hasar cevabı (ATR) ile ilgili PI3-kinaz benzeri kinazlar ataksi telenjiektazi ve RAD3 tarafından başlatılan ve ataksi telenjiektazi (ATM) sırasıyla aşağı efektör kinazları CHK1 ve Chk2 aktive olduğu mutasyona uğramış. 3 olaylar bir dizi durdu dahil CHK1 aktive çoğaltma çatal, DNA çapraz bağlarının ve ultraviyole radyasyon hasarı Chk2 öncelikle çift iplikli kırılmalara tarafından aktive ediliyor.
hücre döngüsü i uzunluğuna değiştirilmiş koşullarının etkisini incelemek için her zamanki yöntemis hücre döngüsü belirli bir aşamasında hücreleri senkronize etmek. 1. Bu çeşitli yöntemler ile elde edilebilir. Hücreler fiziksel boyutu, yoğunluk, yan dağılım (parçalı) ve hücre yüzey ifadesi belirteçleri dayalı ayrıştırılır edilebilir. Daha pratik hücreleri kimyasal yollarla senkronize edilebilir. Örneğin timidin, hidroksiüre ve sitosin arabinosid gibi çeşitli ajanlar ajanlar çıkarıldıktan sonra bisiklet devam S fazında hücrelerin birikimiyle sonuçlanır hücre döngüsünün S fazında DNA sentezini inhibe etmek için de kullanılabilir. Veya M-fazı DNA içeriğinin - Hücreler G 2 mitotik iğ oluşumunu tutuklama önler nokodazolun ile işlemden geçirildi. G 0 aşamasında hücrelerin birikimi kültür ortamı sonuçlarından serum ortadan kaldırılması. kültür, serum içindeki besinlerin yeniden eklenmesi hücrelerinin normal bisiklet yeniden başlatır. Ancak, bu senkronizasyon yöntemlerinin tüm hücrelerin normal bisiklet ve büyüme ile müdahale ve resul edebilirsinizönemli bir hücre ölümü t.
Akut lenfoblastik lösemi hücrelerinin Senkronizasyon özellikle zor olduğu ve bu hücreler genetik manipülasyon için uygun değildir. Burada tarif edilen yöntem, hücre döngüsü dinamiklerinin değerlendirme ve geleneksel senkronizasyon veya genetik değişiklik yapılmadan hücre döngüsünün belirli aşamalarında hücreleri çalışmasına izin verir. Bu yöntem, aynı zamanda genetik modifikasyon ve geleneksel senkronizasyon işlemleri kolayca elde olmayan diğer hücre türleri için yararlı olabilir. yöntem hücrelerin kısa vadeli büyüme ve çoğalması üzerinde çok az etkiye sahiptir bromodeoksiüridin (BrdU) Kuruluş, uzun kurulan kullanımına dayanmaktadır. 4 Kuruldu BrdU protokolleri S fazında yeni sentezlenmiş DNA içine BrdU dahil yararlanmak . Bu kalıcı BrdU maruziyeti sırasında S fazında yapılmış olan olarak hücreleri işaretler. Bu popülasyon BrdU incorpor için boyama daha sonra zaman noktalarında tespit edilebilirtirme ve böylece takip ve hücre döngüsü transit uyuşturucu etkileri çalışma izin zamanla değerlendirilebilir senkronize nüfus olarak hareket ederler. BrdU genellikle DNase veya asit tedaviden sonra elde önce antikor boyama maruz kalması gerekir. 6,7 dahil BrdU ek markörler dahil sağlayan tespit etmek için akış sitometrisi kullanılarak. En önemli çalışma başlangıcında S fazında olan hücrelerin, hücre döngüsü faz dağılımının değerlendirilmesini sağlayan DNA içeriğini ölçmek için boyalar kullanılmasıdır. 8 Ayrıca ek yüzey ya da hücre içi antijenler de incelenebilir. 9 Bu Böyle Ki67 gibi hücre döngüsü olaylarla ilgili ya da bölünmüş kaspaz-3 gibi apoptoz belirteçlerinin olarak görünüşte ilgisiz hücre özellikleri olabilir. potansiyel uygulamalar araştırmacı hayal gücü ile sınırlıdır.
Access restricted. Please log in or start a trial to view this content.
Protokol
Burada açıklanan protokol, akut lenfoblastik lösemi hücre çizgisi NALM6 kullanır, ancak diğer hücre tiplerine uygulanabilir.
1. Çözümler ve Reaktifler
- Tam RPMI
- 56 ml cenin buzağı serumu (FCS) ve RPMI-1640 ortam içinde 500 ml'lik bir şişeye 5.5 mi, 200 mM L-glutamin ekleyin.
- BrdU Stok Çözümü
- Dulbecco Fosfat Tamponlu Salin (DPBS) içinde 32.5 mM BrdU (10 mg / ml) hazırlayın.
- BrdU tam RPMI
- Tam RPMI 10 ml BrdU stok çözeltisi 6.2 ul ekleyin.
- DNaz Çözümü
- 1 mg Dnaz / DPBS ml hazırlayın.
- Lekeleme tampon maddesi
- DPBS içinde% 3 ısı ile inaktive edilmiş FCS ve% 0.09 sodyum azit hazırlayın.
- Sabitleme Buffer, Permeabilization Tampon ve Yıkama Tamponu tanımları için malzemeler Listesine bakınız.
2. Hücreler
Hayırte: Hücreler 6 aydan fazla süre ile kültüre değildi. Bu yöntem, hücre yoğunluğu ve kültür ortamına ayarlamaları ile herhangi bir bitişik olmayan hücre hattına doğrudan uyarlanabilir. Deneyin başlangıcında katlanarak büyüyen hücreler kullanın.
- Tam RPMI içinde, T-75 kültür şişelerinde NALM6 hücreleri korumak. Bir Sınıf II Biyogüvenlik Kabini kullanarak steril şartlar altında tüm adımları uygulayın.
- Haftada üç kez kültürü bölerek ml başına 6 10 x 1-2 arasındaki hücreleri NALM6 hücreleri korumak.
- Havadaki CO2,% 5 37 ° C'de inkübe edilir.
BrdU Hücre 3. Darbe Etiketleme
DİKKAT: potansiyel bir mutajen ve teratojen olduğu gibi özenle BrdU kullanın.
- 5 dakika boyunca 150 x g'de santrifüje hücreleri. Not: Taze ortama aktarılması hücrelerin sonuçların tekrarlanabilirliği geliştirir.
- 2 x 10 6 c Komple RPMI bir hücre sayımı ve tekrar süspansiyon hücreleri gerçekleştirinarşın / ml olmuştur.
- BrdU tam RPMI 1 x 10 6 hücre / ml'lik bir nihai hücre konsantrasyonu üreten 2 hücreleri: 1 seyreltin.
- Daha sonra tam RPMI ile 10 hücreleri: 1 seyreltin, 45 dakika boyunca% 5 CO2 37 ° C'de inkübe edilir. Dikkatle 150 5 dakika boyunca xg ve Santrifüj hücreleri süpernatant tüm atın.
- Tam RPMI küçük bir hacme (~ 100 ul) içinde süspanse edin hücreleri, bir hücre sayımı yapar ve 1 x 10 6 hücre / ml olacak şekilde ayarlanır.
- Pipet 48 çukurlu bir levhanın çukurlarına içine hücre 1 mi. Herhangi bir işgal edilmemiş kuyulara DPBS pipetle 1 ml daha yeniden üretilebilir sonuçlar elde edilmiştir.
- 17 Burada arzu edilen zaman noktalarında, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 için hava içinde% 5 37 ° C'de CO2 inkübe , 18, 19, 20, 21, 22, 23 ve 24 saat. Not: süre deneysel tasarım ölçmeyi amaçlamaktadır ne bağlıdır.
- Bir pipet kullanarak FACS tüpler içine tüm hücreleri aktarın. 1 mi VOLU iyi bir sekans durulayın5 ml'lik bir nihai toplam hacim PBS mes.
- 5 dakika boyunca 150 xg'de Santrifüj ve dikkatli bir şekilde tüm süpernatant kaldırmak. Hücreler, boyama için hazır hemen bu (bölüm 4) gerçekleştirin.
4. Hücre Boyama
Not: hücre yüzeyi boyaması gerekli ise hücreler boyunca 4 ° C'de tutulmasını sağlamak, tespit öncesinde bunu gerçekleştirmek.
- Lekeleme tampon maddesi içinde 100 ul içinde süspanse hücreleri (isteğe bağlı yüzeyi boyama, antijenleri yüzey ve 4 ° C'de 30 dakika boyunca inkübasyona antikorun önerilen hacim kazandırmak).
- 150 x g'de 5 dakika boyunca boyama tamponu 1 ml santrifüj ekleyin ve süpernatant atılır.
Not: vs. özel antikor, konsantrasyon, kuluçkalama süresi spesifik deneysel hedeflerine bağlı olarak değişecektir. - Tespit ve Permeabilization
- Sabitleme tampon 100 ul hücre yeniden süspanse edin ve oda sıcaklığında 15 dakika inkübe edilir.
- 1 ml o eklemef yıkama tamponu, 150 x g'de 5 dakika boyunca santrifüj ve süpernatant atın.
- Permeabilizasyon tampon maddesi içinde 100 ul hücrelerin tekrar ve buz üzerinde 10 dakika boyunca hücreler inkübe edin.
- 150 x g'de 5 dakika boyunca yıkama tamponu 1 ml santrifüj ekleyin ve süpernatant atılır.
- Tüp başına sabitleme tampon 100 ul hücre yeniden süspanse edin ve oda sıcaklığında 5 dakika inkübe edilir.
- 150 x g'de 5 dakika boyunca yıkama tamponu 1 ml santrifüj ekleyin ve süpernatant atılır.
Not: Gerekirse protokol burada durdurulmuş olabilir. lekeleme tampon maddesi içinde yeniden süspansiyona alınmış, eğer sabit hücreler 4 ° C 'de pek çok gün boyunca stabildir. Devam etmeden önce santrifüj aşağıdaki boyama tamponu çıkarın.
- DNaz Tedavi
- DNaz çözeltisi 100 ul (30 DNase / 10 6 hücre ug) ve 37 ° C'de 1 saat boyunca hücrelerin inkübe yeniden süspanse hücreleri.
- 5 dakika boyunca 150 xg'de yıkama tamponu, santrifüj 1 ml ekleyin ve süpernatant atın.
- Antikor Boyama
Not: BrdU dışındaki hücre içi belirteçler için boyama BrdU boyama ile eş zamanlı olarak yapılabilir.- ÖNEMLİ: Her bir florokrom etiketli lekesiz hücreleri ve hücrelerin oluşturduğu tazminat kontrolleri hazırlayın. İdeal olarak, deney tüpleri kullanılanlar gibi dengeleme kontrol için aynı antikorları kullanır. Bu mümkün değilse Ancak, son derece ifade antijenlere karşı antikorlar yerine aynı florokromu konjuge.
- Yıkama tamponu, 50 ul hücrelerin yeniden süspanse edin ve 1 ul / BrdU antikoru 10 6 hücre ekleyin. Not: diğer spesifik hücre içi antijenlere karşı doğrudan konjüge edilmiş antikorlar da ilave edilebilir.
NOT:. Cdc2 için Ser10 üzerinde fosforile histon H3 antikorlar G2 ve M hücreleri arasında ayrım yapmak için kullanılabilir, histon H3 mitoz sırasında Ser10 üzerinde fosforlaştırılır 10 antikorlar, hav hücreleri tespit etmek için kullanılabilir Tyr15 ilgili fosforileE mitoz kararlıdır. 11 - Oda sıcaklığında 20 dakika boyunca inkübe hücreleri.
- 5 dakika boyunca 150 x g'de 1 yıkama tampon maddesinin ml'si santrifüj hücreleri ekleyin ve süpernatant atılır.
- Hücre Döngüsü Analizi için Leke DNA
- Pelet gevşetin ve 7-AAD çözeltisi (0.25 mcg) 20 ul ekleyin. Not: 7-AAD / hücre sabit bir miktarda kullanımı için çok önemlidir.
- Lekeleme tampon maddesi içinde 1 ml içinde tekrar süspansiyon hücreleri.
Sitometrisi Verilerin 5. Koleksiyonu
Not: Kullanılan fluorochromes sayısı ve niteliğine bağlı olacaktır gerekli makine.
- Aşağıdaki parametreler toplamak: FSC A, SSC-A, FSC lH doğrusal bir ölçek üzerinde ve 7-AAD floresan (FSC W yerine FSC H kullanılabilir). Bir günlük ölçeğinde APC kanalı toplayın. Bir günlük ölçeği kullanılarak yüzey veya iç etiket değerlendirilmesi için gerekli herhangi bir ek kanallar toplayın.
- Com gerçekleştirinörnekleri analiz etmeden önce farklı fluorochromes arasında gözlenen emisyon spektrumları sinyalleri örtüşen Telafisi. Not: Çoğu akış sitometrelerinde otomatik olarak gerçekleştirecektir.
- Her bir numune için en azından 10,000 olayları toplayın.
Sitometrisi Verilerin 6. Analizi
Not: Veri analizi, ancak diğer yazılım paketleri de kullanılabilir sitometri FlowJo akışı için bu çalışmada kullanılmıştır. Ayırıcı stratejisi, Şekil 1 'de gösterilmiştir.
- FSC-A ve SSC-A parametreleri kullanılarak canlı hücre popülasyonu tanımlayın.
- Bu nüfus içinde çiftleri ve (burada da kullanılabilir FSC-W) FSC-A ve FSC-H kullanılarak agrega dahil değildir.
- Bu nüfusun içinde y ekseni üzerinde x-ekseni ve BrdU-APC 7-AAD kullanarak nokta arsa ayarlayın.
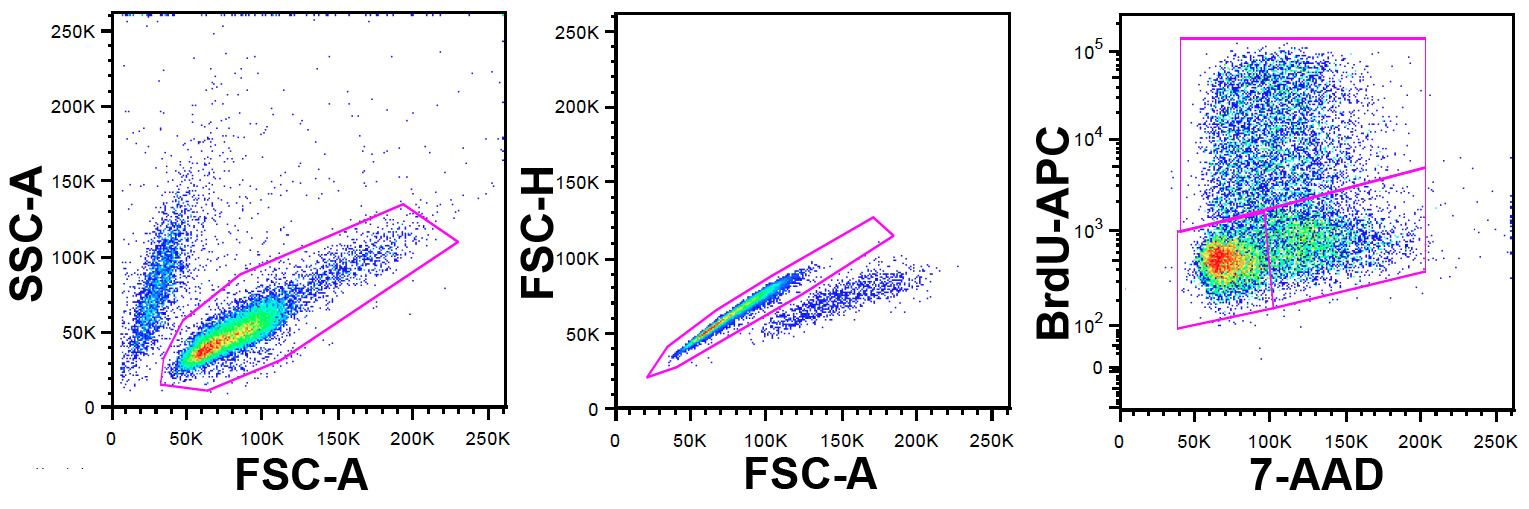
Şekil 1: Yolluk Strateji Sol pa.nel: ungated hücreler SSC-A nokta arsa vs FCS-A gösterilir. canlı hücre popülasyonu gösterilen kapısı ile tanımlanır. Merkez paneli: sol panelden Geçitli hücreler FSC-H nokta arsa (yerine yüksekliği kullanılabilir FSC-W) vs FSC-A gösterilir. Ikilileri ve agrega tespit ve gösterilen kapısı ile dışlanır. Sağ paneli: orta panelinde ikili dışlama tarihinden itibaren Geçitli hücreler APC-bir nokta arsa vs 7-AAD gösterilir. BrdU antikoru APC darbe etiketleme sırasında BrdU dahil hücrelerin tanımlanmasına imkân ile etiketlenir. 7-AAD DNA içeriği hakkında bilgi verir. Üst geçit BrdU darbe, sol alt kapısı, hücrelerde G 0/1 ve G olanlar sağ alt geçidin zamanında S fazında nedenle BrdU pozitif ve hücreleri tanımlar / M 2. Bir görmek için buraya tıklayınız Bu rakamın büyük bir sürümü.
- Hücre Döngüsü A nalysis
- Ikili dışlama kapısı hücreler üzerinde ilk veri dosyası ve kapıyı açın.
- (Flojo yazılımında platformlarda altında bulunur) hücre döngüsü dağıtımı için bu nüfusu analiz ve Dean-Jett-Fox modeli kullanın.
- G 0/1 ve G kapıları oluşturmak kullanarak 2 / M zirveleri konumlarını edinin.
- BrdU pozitif hücrelerin ve konuyla ilgili Kapısı aynı hücre döngüsü analizi bu nüfus.
- Oluşturmak kapıları aynı kapıları uygulanması ve G 0/1 ve G 2 / M zirveleri pozisyonları için (yaratılmış kapıları kullanarak) kısıtlamaları ayarlayarak G 0/1 ve G 2 / M zirveleri için pozisyonları sağlayın. Bu durum, Şekil 2'nin birinci 2 panel gösterilmiştir.
Not: Diğer yazılım aynı zamanda verileri analiz etmek için kullanılabilir ve talimatlar buna göre değişecektir.
840 / 52840fig2highres.jpg "width =" 700 "/>
Şekil 2:. Hücre Döngüsü İlerleme ilk panel (Tüm Hücreler) ikili dışlama kapısı tarafından tanımlanan hücre popülasyonu üzerinde işlenir. Bu popülasyon, X ekseni üzerindeki 7-AAD içeren bir histogramda gösterilen edildi. G 0/1 pikin tepe ekseninin altında bir okla gösterilir. Şekil 1 'de gösterildiği gibi daha sonra paneller BrdU pozitif hücreler kapılanmış edilmiştir. Çiftler dışlama kapısının yolluk elde edilen G 0/1 pozisyonda değeri FlowJo hücre döngüsü yazılım içinde BrdU pozitif kapılanmış hücrelerin uygulanır. Şekil 1, ilk iki panel de gösterildiği gibi, tüm nüfus analizinde elde edilen değere göre G 0/1 tepe pozisyonda gösterildiği gibi, her bir takip eden paneli BrdU pozitif popülasyonu üzerinde geçirilen edildi. Aynı samp BrdU pozitif hücrelerin G 0/1 nüfus yerini belirlemek için BrdU negatif kısmını kullanmale örnekler arasındaki DNA leke yoğunluğunda herhangi küçük farklılıklar için kontrol eder. Her panelde gösterilen numara BrdU darbe sona ermesinden bu yana zamanı temsil eder. Hesaplanan hücre döngüsü fazları gölgeli yeşil gösterilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu yöntem, bir dizi bilgi elde etmek için kullanılabilir. Birkaç uygulamalar burada özetlenmiştir.
Hücre döngüsü süresinin değerlendirilmesi
Hücre döngüsü yoluyla transit hücreleri için gerekli süreyi belirlemek için, hücreler BrdU darbe sonra çeşitli zaman noktalarında toplanır. değerlendirmeler arasındaki aralıklar analiz edilmekte olan özel hücrelere uyarlanabilir. Hematopoietik hücre hatları, standart kültür koşulları altı...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Hücre döngüsü analiz yeteneği kanseri biyoloji anlaşılması ve hücre çoğalmasını ve büyümesini etkileyen iki ilaç ve gen hareket mekanizması için çok önemlidir. Bildirildi hücre çoğalmasını ölçmek deneylerinde bir sayıda olsa da, çoğunluğu sadece Halen mevcut hücreleri gösteren bir ölçü sağlar. Bu doğrudan görselleştirme ve sayma, metabolik aktivite veya ATP konsantrasyonu ile hücre sayısını ölçmek deneyleri içermektedir. Bu yöntemlerin çoğu temel avantajı, koşullar ya ...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The work was funded by the Leukemia and Lymphoma Society of the USA (6105-08), a Cancer Council NSW grant (13-02), an NHMRC Senior Research Fellowship (LJB) (1042305) and project grant (1041614).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| APC BrdU Flow Kit | BD Biosciences | 552598 | Contains BrdU antibody, 7-AAD and BD Cytofix/Cytoperm Buffer (referred to as Fixation Buffer) |
| BD Cytoperm Permeabilization Buffer Plus | BD Biosciences | 561651 | Referred to as Permeabilization buffer |
| BD Perm/Wash Buffer | BD Biosciences | 554723 | Referred to as Wash buffer |
| DNase | Sigma | D-4513 | |
| BD Falcon 12 x 75 mm FACS tubes | BD Biosciences | 352008 | |
| BD Pharmingen Stain Buffer | BD Biosciences | 554656 | |
| BD LSR FORTESSA flow cytometer | BD Biosciences | FORTESSA | |
| Pipetman | Gilson | P2, P20, P100, P1000 | |
| RPMI 1,640 w/o L-Gln 500 ml | Lonza | 12-167F | |
| DPBS | Lonza | 17-512F | |
| Fetal Bovine Serum | FisherBiotec | FBS-7100113 | |
| L-Glutamine | Sigma | G7513-100ML | |
| 5-Bromo-2′-deoxyuridine | Sigma | B5002-1G | |
| Falcon TC 150 cm2 vented Flasks | BD Biosciences | 355001 | |
| Pipettes 25 ml | Greiner | 760180 | |
| Aersol Pipettes 200 µl | Interpath | 24700 | |
| Aersol Pipettes 1 ml | Interpath | 24800 | |
| Centrifuge | Spintron | GT-175R | |
| CO2 incubator | Binder | C 150 | |
| AF488 anti-Histone H3 Phospho (Ser10) Antibody | Cell Signalling | 9708S | |
| Phospho-Chk2 (Thr68) (C13C1) Rabbit mAb | Cell Signalling | 2197S | |
| Phospho-Chk1 (Ser345) (133D3) Rabbit mAb | Cell Signalling | 2348S | |
| NALM6 | DSMZ | ACC-128 |
Referanslar
- Banfalvi, G. Methods Mol Biol. Banfalvi, G. 761, Humana Press. New York, Dordrecht, Heidelberg, London. 1-23 (2011).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132, 487-498 (2008).
- Harper, J. W., Elledge, S. J. The DNA damage response: ten years after. Molecular Cell. 28, 739-745 (2007).
- Latt, S. A., George, Y. S., Gray, J. W. Flow cytometric analysis of bromodeoxyuridine-substituted cells stained with 33258 Hoechst. The Journal of Histochemistry and Cytochemistry. 25, 927-934 (1977).
- Gratzner, H. G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science. 218, 474-475 (1982).
- Carayon, P., Bord, A. Identification of DNA-replicating lymphocyte subsets using a new method to label the bromo-deoxyuridine incorporated into the DNA. Journal of Immunological Methods. 147, 225-230 (1992).
- Gonchoroff, N. J., et al. S-phase detection with an antibody to bromodeoxyuridine. Role of DNase pretreatment. Journal of Immunological Methods. 93, 97-101 (1986).
- Rabinovitch, P. S., Torres, R. M., Engel, D. Simultaneous cell cycle analysis and two-color surface immunofluorescence using 7-amino-actinomycin D and single laser excitation: applications to study of cell activation and the cell cycle of murine Ly-1 B cells. Journal of Immunology. 136, 2769-2775 (1986).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. 32, 4789-4797 (2013).
- Hendzel, M. J., et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma. 106, 348-360 (1997).
- Draetta, G., Beach, D. Activation of cdc2 protein kinase during mitosis in human cells: cell cycle-dependent phosphorylation and subunit rearrangement. Cell. 54, 17-26 (1988).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. , (2012).
- Knudsen, R. C., Ahmed, A. A., Sell, K. W. An in vitro microassay for lymphotoxin using microculture plates and the multiple automated sample harvester. Journal of Immunological Methods. 5, 55-63 (1974).
- Beck, H. P. Proliferation kinetics of perturbed cell populations determined by the bromodeoxyuridine-33258 technique: radiotoxic effects of incorporated [3H]thymidine. Cytometry. 2, 170-174 (1981).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Collins, J. M., Berry, D. E., Bagwell, C. B. Different rates of DNA synthesis during the S phase of log phase HeLa S3, WI-38, and 2RA cells. Journal of Biological Chemistry. 255, 3585-3590 (1980).
- Schwarting, R., Gerdes, J., Niehus, J., Jaeschke, L., Stein, H. Determination of the growth fraction in cell suspensions by flow cytometry using the monoclonal antibody Ki-67. Journal of Immunological Methods. 90, 65-70 (1986).
- Danova, M., et al. Cell cycle-related proteins: a flow cytofluorometric study in human tumors. Biology of the Cell. 64, 23-28 (1988).
- Juan, G., et al. Histone H3 phosphorylation and expression of cyclins A and B1 measured in individual cells during their progression through G2 and mitosis. Cytometry. 32, 71-77 (1998).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 761, 75-83 (2011).
- Kues, W. A., et al. Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors. Biology of Reproduction. 62, 412-419 (2000).
- Urbani, L., Sherwood, S. W., Schimke, R. T. Dissociation of nuclear and cytoplasmic cell cycle progression by drugs employed in cell synchronization. Experimental Cell Research. 219, 159-168 (1995).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır