A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור ואופטימיזציה של LTE, מערכת ביטוי חלבונים ללא תאים המופקת מלישמניה טרנטולאי לייצור חלבונים רקומביננטיים
In This Article
Summary
תמצית לישמניה תרגומית (LTE) היא מערכת ביטוי חלבונים אאוקריוטית נטולת תאים שמקורה בטפיל חד-תאי, Leishmania tarentolae. פרוטוקול ממוטב זה הופך את LTE לפשוט וחסכוני לייצור. הוא מתאים ליישומים שונים המתמקדים בביטוי רב-מקבילי ולימוד של חלבונים איקריוטים מורכבים והאינטראקציות ביניהם.
Abstract
פרוטוקול זה מתאר את הייצור והאופטימיזציה של מערכת ביטוי חלבון ללא תאים אאוקריוטית (CFPS) שמקורה בשוטונים חד-תאיים Leishmania tarentolae, המכונה תמצית תרגום לישמניה או LTE. למרות שאורגניזם זה התפתח במקור כטפיל של שממיות, ניתן לטפח אותו בקלות ובזול בצלוחיות או ביוריאקטורים. שלא כמו לישמניה מז'ור, היא אינה פתוגנית לבני אדם ואינה דורשת אמצעי מעבדה מיוחדים. יתרון נוסף של השימוש בלישמניה עבור CFPS הוא שהוספת אוליגונוקלאוטיד אנטיסנס יחיד ל-CFPS, המכוון לרצף מוביל שחבור שמור בקצה 5' של כל הרנ"א המקודד חלבון, יכולה לדכא ביטוי חלבונים אנדוגניים. אנו מספקים נהלים לשיבוש תאים ועיבוד ליזט, אשר פושטו ושופרו בהשוואה לגרסאות קודמות. הליכים אלה מתחילים בתרביות בקבוקים פשוטות. בנוסף, אנו מסבירים כיצד להציג מידע גנטי באמצעות וקטורים המכילים אתרי ייזום תרגום שאינם תלויים במינים (SITS) וכיצד לבצע אופטימיזציה פשוטה של אצווה ובקרת איכות כדי להבטיח איכות ביטוי חלבון עקבית.
Introduction
בשנות ה-60 של המאה ה-20, מערכות ביטוי חלבונים ללא תאים מילאו תפקיד מרכזי בחשיפת הקוד הגנטי1. עם זאת, מערכות ביטוי חלבונים נטולי תאים פרוקריוטים, המבוססות בעיקר על E. coli, שולטות כיום הן ביישומים מעבדתיים והן ביישומים מסחריים. בעוד שמערכות מבוססות E. coli מציעות יתרונות כגון עלות-תועלת, מדרגיות ותשואות ביטוי גבוהות, הן מתמודדות עם אתגרים בעת ייצור חלבונים רב-תחומיים בצורתם הפעילה ומקלות על הרכבת קומפלקסים חלבוניים 2,3. כיום, צורות נפוצות של סינתזת חלבונים ללא תאים אאוקריוטים (CFPS) כוללות תמצית נבט חיטה (WGE), ארנב רטיקולוציטים ליזט (RRL) וליזט תאי חרקים (ICL)4,5,6. עבודה זו מציגה מערכת חלופית ללא תאים אאוקריוטים שהיא גם פשוטה וגם ניתנת להרחבה, המבוססת על טפיל השוטון החד-תאי Leishmania tarentolae.
ניתן לגדל טרנטולאי לישמניה בקלות בצלוחיות באמצעות מדיה חסכונית, וניתן גם להגדיל אותו בביוריאקטורים כדי להשיג צפיפות תאים גבוהה יותר. ניתן לנטרל את נוכחותם של mRNA אנדוגניים בליזט התא, שאחרת היו יכולים להתחרות במסרים שהוכנסו, באמצעות אוליגונוקלאוטידים אנטיסנסיים המכוונים לרצף המוביל 7 של לישמניה mRNAשמור. שלא כמו קרוב משפחתו לישמניה מז'ור, הגורם למחלות אנושיות, L. tarentolae מדביק את השממית המורית (Tarentolae mauritanica), מה שהופך אותו מתאים לגידול בסביבות מעבדה PC2 ללא צורך באמצעי זהירות מיוחדים. הוא שימש בעבר כאורגניזם מהונדס עבור ביטוי חלבון in vivo8.
כדי להקל על הכנת תבניות במערכות נטולות תאים, תוכננו רצפים אוניברסליים המבוססים על מבני RNA פולימריים המשפרים את האתחול התרגומי9. רצפי תרגום בלתי תלויים במינים אלה (SITS) ישימים הן למערכות פרוקריוטיות והן למערכות נטולות תאים אאוקריוטים ומתאימים להחדרת מידע גנטי ל-LTE. בעוד פרוטוקול זה אינו מספק הסבר מפורט על בנייה וקטורית עבור ביטוי חלבון ללא תאי LTE, אופטימיזציה ובקרת איכות דורשים וקטורים מתאימים המכילים איחוי פלואורופור של החלבונים הרצויים בעלי עניין במורד הזרם של אתר SITS. לשם כך הופקדו וקטורי LTE מתאימים במאגר הגנים Addgene, כגון וקטור pCellFree_G03, המקודד היתוך eGFP N-terminal לחלבון הרצוי באמצעות אתרי שיבוט Gateway.
LTE הוכיח את ערכו במגוון רחב של יישומים הדורשים ביטוי חלבונים, כולל ניתוח של הרכבה עצמית של חלבונים10,16, ייצור חלבוני ממברנה אינטגרליים אנושיים17, מחקר על תרופות אנטי-ויראליותמועמדות 18, פיתוח אנזימים שימושיים ביוטכנולוגית19, אב טיפוס של ביו-חיישנים חלבוניים20,21, וחקר ביולוגים מתולעי קרס22. LTE סייע גם במיפוי רשתות אינטראקציה חלבון-חלבון בתחומי הווירולוגיה והמבנים התאיים21,32. LTE נבדק לביצועים דומים למערכות איקריוטיות אחרות נטולות תאים בביטוי חלבונים באורך מלא, חד-מפוזרים ולא מצטברים33, כל זאת תוך הצעת ייצור חסכוני ומדרגי יותר.
פרוטוקול זה מספק טכניקות לטיפוח ושיבוש האורגניזם המארח, הכנת ליזט והשלמת תמיסת הזנה (FS) לביטוי חלבון שעתוק / תרגום מצומד. בנוסף, הוא כולל פרוטוקול לאופטימיזציה של אצוות ייצור. בגרסה הראשונית של המערכת נטולת תאי הלישמניה נצפתה שונות בלתי רצויה בין אצווה לאצווה ברמות הביטוי, בשבר החלבונים באורך מלא ובנוכחות של אגרגטים חלבוניים, מה שהוביל לסילוק אצוות34. שיפורים מאוחרים יותר בפרוטוקול נעשו כדי לטפל בבעיה זו25. הפרוטוקול הנוכחי מתבסס על שיפורים אלה, ומאפשר אופטימיזציה של אצוות בודדות לביטוי וגודל שיא של חלבון. הוא משיג זאת על ידי שליטה הדוקה בעומס משבשי תאים (נמדד כצפיפות אופטית של 600 ננומטר; OD600nm) ונרמול תפוקת הליזט המתקבלת באמצעות ספיגה ב-280 ננומטר (Abs280nm). יתר על כן, הוא משלב שיטה לתוספת חלקית של הליזט עם rNTP ומגנזיום במהלך הייצור, עם אופטימיזציה לאחר מכן של רכיבי תמיסת הזנה אלה במהלך ביטויי הבדיקה. למרות אופטימיזציה זו מוצגת כאופציה בפרוטוקול, מומלץ מאוד על ידי המחברים.
Protocol
פרוטוקול זה כולל מתכוני מדיה מפורטים ושלבים הכוללים תרבית, צנטריפוגה, מדידת פלואורסצנטיות GFP באמצעות קורא לוחות רב-מצבים, מדידת תרבית OD600nm והערכת ליזט Abs280nm. הוא מכסה גם את ההתקנה וההדמיה של ג'ל חלבון SDS-PAGE. החומרים הדרושים או המוצעים עבור פרוטוקול זה מפורטים בגיליון האלקטרוני של חומרים. חשוב לציין כי משאבי מעבדה טיפוסיים כגון רכיבי מדיה, צנטריפוגות, צינורות, ספקטרופוטומטרים ומערכי אלקטרופורזה בג'ל עשויים לשמש לסירוגין, אלא אם כן צוין אחרת. איור 1 מספק סיכום של תהליך הייצור של LTE.
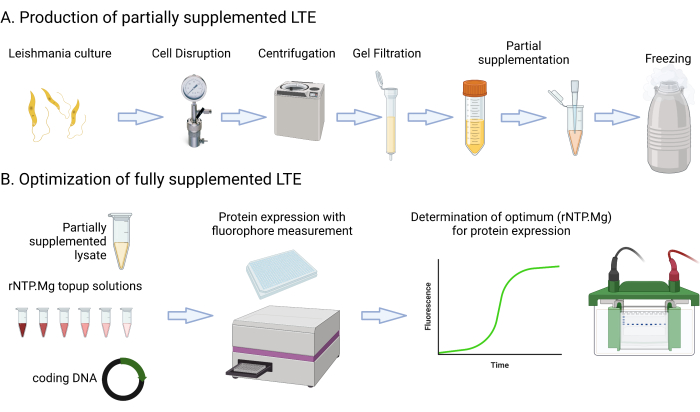
איור 1: סקירה כללית של פרוטוקול ייצור LTE. קריקטורה זו מספקת סיכום תמציתי של פרוטוקול הייצור LTE. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
1. צמיחה של תרבויות לישמניה טרנטולה
- הכינו לפחות 3 ליטר של מצע גדילה TBGG (בקטוטריפטון 12 גרם/ליטר, תמצית שמרים 24 גרם/ליטר, גליצרול 8 מ"ל/ליטר, גלוקוז 1 גרם/ליטר, KH2PO4 2.3 גרם/ליטר, K2HPO4 2.5 גרם/ליטר, ראו טבלת חומרים). יש לעקר את המדיה באמצעות מסנן 0.22 מיקרומטר תחת ואקום או התקנה דומה.
- אחסנו את המדיה בטמפרטורת החדר (RT), כאשר התוספות הסופיות (Hemin, אנטיביוטיקה) נוספו ממש לפני החיסון עם L. tarentolae. Hemin (0.25% v/v ב-50% triethanolamine) מתווסף ב-0.2% v/v, פניצילין (10,000 יחידות/מ"ל) בתוספת סטרפטומיצין (10,000 מיקרוגרם/מ"ל) מתערבבים ב-0.5% v/v.
הערה: נקודת המוצא של פרוטוקול זה היא תרבית מתוחזקת בגודל 2 x 10 מ"ל של בר מסוג L. tarentolae. תרביות תחזוקה גדלות ב 27 ° C בצלוחיות סטנדרטיות של 50 מ"ל תרבית רקמה עם רעידות נמוכות (75 סל"ד). תרביות כאלה של 10 מ"ל יכולות להישמר ללא הגבלת זמן עם ~ 1/20 דילולים סטריליים (TBGG + hemin, פניצילין, סטרפטומיצין) כל 2-3 ימים. מומלץ להשתמש בארון בטיחות ביולוגית סטנדרטי במעבדת PC2; עם זאת, זיהומים חיידקיים נוטים להימנע על ידי אנטיביוטיקה נוספת, בעוד זיהומים פטרייתיים הם בדרך כלל outgrown על ידי L. tarentolae. - במשך יומיים, הרחיבו את תרביות התחזוקה של L. tarentolae ל-200 מ"ל (יום 1) ולאחר מכן 2 ליטר (יום 2) באמצעות דילול 1:10 עם נפח הולך וגדל של TBGG + hemin/אנטיביוטיקה בכל יום. בצעו את שני הדילולים בצלוחיות זכוכית 5 ליטר מעוקרות אוטוקלאביות (ממולאות עד למקסימום של 1 ליטר). הדילול השני חייב להתבצע בשעות אחר הצהריים בין השעות 15:00-18:00, מתוך כוונה להתחיל בייצור ליזט למחרת בין השעות 8-11 בבוקר.
הערה: פרוטוקול זה משתמש בנפח ההתחלתי המינימלי לייצור LTE (2 x 1 L תרביות). ניתן גם להרחיב את התרבית עד 10 ליטר לייצור LTE על ידי שילוב שלב הרחבה נוסף (למשל, יום 1: 100 מ"ל; יום 2: 1 L; יום 3: 10 L). למרות שפרוטוקול זה משתמש בצלוחיות מבולבלות (ראו טבלת חומרים) כדי לגדל L. tarentolae, ניתן להשתמש בביוריאקטורים קונבנציונליים המיועדים לגידול חיידקים עם אימפלרים של ראשטון, בתנאי שקצב הערבוב נשמר מתחת ל-100 סל"ד. אוורור משופר ובקרת pH בביוריאקטורים בדרך כלל מרחיבים את הצמיחה בשלב היומן של תרביות L. tarentolae , ומאפשרים שימוש ב- OD600nm גבוה יותר של 10 בשלב 1.4. - הקלט את OD600nm של התרבית במשולש באמצעות דילול 1:10 ב- TBGG ישירות בקובט הספקטרופוטומטר. טווח התחלה מתאים להכנת ליזט הוא OD600nm = 4.0-8.0.
- ספק זמן דגירה נוסף אם OD600nm < 4.0. תרבית עם OD600nm > 8 היא שמישה ותגרום לנפח גדול יותר של ליזט ביטוי ללא תאים, אך באיכות נמוכה יותר עקב תחילת שלב הצמיחה המאוחר. הניחו צלוחיות תרבות על קרח, ממתינים לצעדים הבאים.
הערה: מדידה מדויקת של התרבית הסופית OD600nm היא קריטית, מכיוון שהיא משמשת לחישוב הנפח הסופי עבור תאים מרוכזים לפני הפרעה. חישוב זה מחליף שיטת שקילת גלולות שהייתה נהוגה בגרסאות קודמות של ייצור LTE לכיול ריכוז התאים לפני שיבוש34, על מנת לפשט את הפרוטוקול. הקפד לדלל ב- TBGG למדידת OD600nm , אחרת הלם אוסמוטי משנה את צורת התא וגורם לשגיאת מדידה. פיפטה מערבבת את הדילול ביחס של 1:10 למדידת OD600nm (ישירות בקובט) שניות לפני ביצוע הקריאה הספקטרופוטומטרית, כאשר תאי L. tarentolae מתיישבים במהירות עם מראה מעונן ייחודי. אם הנפח הסופי של תרבית הביטוי נחשב משוער, מומלץ גם לשקול צלוחיות בעת הקציר (עם צוואר בקבוק ריק מתאים) כדי לקבל נפח משוער טוב יותר (ב 1 גרם = 1 מ"ל). OD600nm המרבי האפשרי מגידול L. tarentolae בצלוחיות מבולבלות הוא 15-20, אם כי זה לא מתאים לייצור ליזט עקב הגעה לשלב נייח.
2. ריכוז תרבויות L. tarentolae
- יש לשטוף ולרכז את תאי הלישמניה כ-60 פעמים לפני השיבוש. חשב את נפח היעד עבור ריכוז התא בהתבסס על OD600nm = 300 עבור התרכיז הסופי. המשוואה היא V = נפח הקציר (mL) x (קציר OD600nm/300). לדוגמה, באמצעות תרבית 2 L עם קציר OD600 = 5, נפח היעד הוא 33 מ"ל.
הערה: ניתן לשנות את יעד OD600nm של 300; ייצור LTE קודם השתמש בערכים בטווח של 150-350. ריכוזים גבוהים יותר של תאים הנכנסים להפרעה נוטים להניב תגובות ביטוי סופיות ללא תאים עם תפוקת חלבון גבוהה יותר, אך עם נטייה מוגברת להצטברות חלבונים פגיעים. OD600nm = 300 מייצג יעד ברירת מחדל מתאים לייצור LTE. - מעבירים את התרביות שנקטפו לבקבוקי צנטריפוגות מתאימים ומסובבים אותם במהירות של 2500 x גרם למשך 10 דקות ב-4°C. מרוקנים בזהירות את הסופרנאטנט לתוך פסולת התרבות.
הערה: חשוב למזער את אובדן התאים לתוך supernatant שהושלכ, כפי שהוא משפיע על חישוב של עומס הפרעה. בפרוטוקולי ייצור LTE קודמים, הריכוז של תאי L. tarentolae לשיבוש כויל על ידי סיבוב תרכיז התא בצינור מיקרוצנטריפוגה בדיקה ומדידת משקל הכדורית לעומת המשקל הכולל34. פרוטוקול פשוט זה משתמש במקום זאת ביעד OD600nm תיאורטי עבור התרכיז, המבוסס על הקציר הנמדד OD600nm, ומניח אובדן תאים נמוך במהלך ריכוז התאים ושטיפתם. - שטפו את גלולת התא במאגר SEB (45 mM HEPES-KOH pH 7.6, 250 mM סוכרוז, 100 mM KOAc, 3 mM Mg(OAc)2, נשמר על קרח) שלוש פעמים, בכל פעם צנטריפוגה ב 2500 x גרם במשך 10 דקות ב 4 ° C. לשטיפה הראשונה, יש להשהות מחדש כל 1 ליטר של תרבית כדורית ב-100 מ"ל של חיץ SEB, ולאחר מכן לשלב אותם לצלוחית צנטריפוגה אחת. עבור הכביסה השנייה, גם להשתמש 100 מ"ל של SEB עבור כל 1 L של התרבות המקורית.
הערה: למתלה הכדורי הסופי, הוסף מאגר SEB ל-50% מנפח מתלי היעד הסופי (שלב 2.1). זה מאפשר למלא בזהירות את התרכיז המאגר עד לנפח היעד הסופי בדיוק בשלב 2.4. כל מתלה חייב להיות עדין ככל האפשר כדי למנוע ליזה מוקדמת של L. tarentolae, למשל, על ידי ערבול עדין של SEB הנוסף סביב הגלולה המפורקת או פיפטינג SEB מעל הגלולה הנצמדת לדופן צינור הצנטריפוגה. ייתכן שיהיה נוח יותר להעביר סופרנאטנטים לצינורות צנטריפוגות קטנים יותר בשלב הסופי. - יוצקים את התרכיז המרחף לתוך גליל נפחי מתאים מזכוכית שטופה, ולאחר מכן ממלאים את הנפח לנפח היעד (שלב 2.1) באמצעות SEB קר נוסף ומערבבים בעדינות.
3. ליזה של L . tarentolae להתרכז
- מעבירים את תרכיז התא למכשיר קוויטציה של חנקן (ראו טבלת חומרים) מקורר מראש ל-4°C, לוחצים אותו ל-70 בר חנקן ודגרים במשך 45 דקות על קרח.
הערה: בעוד שמשבשי קוויטציה של חנקן אינם פריטי מעבדה נפוצים, הם מומלצים לייצור LTE. שיטות חלופיות כגון הפשרה בהקפאה סלולרית ומשבשים מסוג עיתונות צרפתית נוסו; עם זאת, פעילות ביטוי החלבונים הייתה <50% בהשוואה לשימוש בשיטת קוויטציית החנקן. יש לנקות היטב את מכשיר קוויטציית החנקן לפני השימוש ובין הריצות, בדומה לכל כלי הדם הנמצאים בשימוש חוזר הבאים במגע עם התא ליזט משלב זה ואילך (כגון צלוחיות המקלט). משטר ניקוי מתאים כולל שטיפה עם חומרי ניקוי מעבדה ולאחר מכן שטיפה יסודית עם מים נטולי יונים. - פתח את פתח האוורור במכשיר קוויטציה של חנקן והוציא את הליזט שנוצר לתוך מיכל חזק מתאים, כגון בקבוק מקלט ואקום על קרח. הטה את בקבוק המקלט כדי להבטיח שכל הליזט שנוצר שוקע וניתן יהיה להכניס אותו לצינור צנטריפוגה טרי או לכלי דומה.
זהירות: משבשי חנקן מסתמכים על המעבר הפתאומי של תרכיז התא מ-70 בר חנקן ללחץ הסביבה, המושג באמצעות זרימה חזקה של נוזל תחילה ולאחר מכן חנקן דרך שסתום היציאה של המכשיר. אוורור חייב להיעשות עם ציוד מגן אישי מתאים (PPE) במכסה בטיחות כימי. קיים סיכון לשבור את ספינת היעד ולאבד את הליזט, ולכן אנו משתמשים במקלט ואקום קשיח במקום בבקבוק גנרי. אם שסתום היציאה של המכשיר הוא צינור, הימנע ממיקום הצינור ישירות בתוך המקלט כדי למנוע הצטברות לחץ מוגזם בנקודת האוורור.
4. צנטריפוגה של ליזט התא
- העבר את הליזט לצינורות צנטריפוגות מתאימים בדירוג כוח G וצנטריפוגה במהירות של 10,000 x גרם למשך 15 דקות ב- 4 ° C. מוציאים את הסופרנאטנט לצינורות צנטריפוגות טריים ודומים.
- צנטריפוגה את הליזט ב 30,000 x גרם במשך 15 דקות ב 4 ° C, ולאחר מכן להסיר את supernatant הסופי לצינור צנטריפוגה טרי או מיכל דומה מונח על קרח. הערך את הנפח הכולל.
5. סינון ג'ל של ליזט התא
הערה: סינון ג'ל משמש להסרת סוכרוז הכלול במאגר SEF. בעוד שסוכרוז מסייע בייצוב המנגנון התאי במהלך הפרעה לתאים, הוא מפחית את היבול אם הוא נשמר בתגובות ביטוי חלבונים.
- הגדר מספר מספיק של עמודות סינון ג'ל PD-10 המוזנות מכוח הכבידה (ראה טבלת חומרים) בתבנית ארון תקשורת המאפשרת להן לטפטף לתוך מגש איסוף או מיכל דומה מתחת, ומבטיחה שהן יכולות לסנן את כל נפח הליזט ב- 2.5 מ"ל לעמודה. אזנו מראש את העמודות על ידי העברת 10 מ"ל של 4 °C EB buffer (45 mM HEPES-KOH pH 7.6, 100 mM KOAc, 3 mM Mg(OAc)2) דרכם מראש.
הערה: כל השלבים מנקודה זו נהנים מביצוע בחדר קר בטמפרטורה של 4 מעלות צלזיוס. עם זאת, זה מתאים גם לשמור את כל lysates וריאגנטים על מגש קרח ספסל. יוצא דופן אחד הוא שלב סינון הג'ל, שבו המחברים מניחים מתלה של עמודים בתוך מקרר 4 מעלות צלזיוס תוך כדי חציצה. בגרסאות המקוריות של פרוטוקול זה, עמודות סינון ג'ל חדשות "נחסמו" על ידי אגירה ראשונית של הליזט והשלכת הפלט הראשון. למרות שזה לא נחשב הכרחי, עמודות חייב להיות שוטף עם מאגר EB ומאוחסן ב 4 ° C בין אצוות lysate. הפלט הראשון של ליזט עשוי להיות בעל פעילות ביטוי חלבון נמוכה יותר מאשר הפלט הבא עקב שימור רקע מסוים של רכיבי ליזט בעמודה החדשה. - הוסף 2.5 מ"ל של ליזט לכל עמודה והמתן עד שהיא תעבור לעמודה. הוסף 0.5 מ"ל נוספים של EB כדי ליישב את הליזט לתוך העמודה תוך השלכת הפולט.
- הצביעו על הליזט המסונן בג'ל על ידי הוספת 2.5 מ"ל נוספים של EB לכל עמודה, ואיסוף הפלט על ידי הנחת מגש טרי ונקי או כלי קיבול אחר מתחת לעמודים.
6. תוספת של תאים lysate
- השתמש בספקטרופוטומטר ננו-טיפות (ראה טבלת חומרים) כדי למדוד ABS280nm של ליזט מסונן בג'ל. אם הוא עולה על 60, דלל אותו כדי להגיע ל- Abs280nm = 60 באמצעות מאגר EB נוסף של 4 °C.
הערה: בעוד שבקרת צפיפות התא בכניסה להפרעה באמצעות OD600nm קובעת בקירוב את חוזק פלט הליזט, נרמול ABS280nm לאחר הפרעה ועיבוד ליזט משפר עוד יותר את עקביות האצווה של ביצועי הליזט. ניתן לכוונן את Lysate Abs280nm למעלה ולמטה, עם השלכות על תפוקת ביטוי חלבונים וצבירה (ראה פרק דיון). אם הליזט ללא תוספת מצביע על ABS280nm < 60, ייתכן שיהיה צורך לכלול יותר ביומסה לישמניה בשלב ההפרעה, כלומר, להגדיל את טעינת משבש התא ל- OD600nm > 300 בשלב 2.1. - הוסף תמיסת הזנה 5x (5x FS, טבלה 1) לליזט ביחס של 2:5 ומערבב היטב. הכניסו אותו למיכלים מתאימים (למשל, צינורות מיקרופוגה של 1.5 מ"ל), והקפיאו אותו בחנקן נוזלי. אם אתה מבצע את השלבים האופציונליים 7.1-7.3 עבור מיטוב ביטוי LTE להלן, השתמש ב- FS המופחת rNTP.Mg- 5x FS מטבלה 1 במקום ב- 5x FS המוגדר כברירת מחדל. כלול 5 x 100 μL aliquots להקפאה לשימוש בניסויי אופטימיזציה.
הערה: הקפאה עם ברירת המחדל של 5x FS ביחס של 2:5 יוצרת LTE משלים מוכן לביטוי, המשמש בביטוי 7 μL/10 μL (לכן, 5x FS הופך ל- 1x FS בתגובה הסופית). עם זאת, המחברים ממליצים לבצע את השלבים האופציונליים הנוספים שבהם כמות ברירת המחדל של rNTPs ומגנזיום מסופקת פי 0.6 ב-FS 5x. לאחר מכן מתבצע שלב מיטוב שבו מתווסף שילוב שווה משקל של השניים (המכונה rNTP.Mg) כדי לטעון את תגובות הבדיקה לערך ממוטב. 5x FS חלקי מכיל גם אוליגונוקלאוטיד המכבה ביטוי mRNA אנדוגני (ראה סעיף מבוא). רצף האוליגונוקלאוטיד הוא CAATAAAGTACAGAAACTGATACTTATATAGCGTT.
7. QC ואופטימיזציה של LTE מוסף סופי
הערה: הצעדים המינימליים הדרושים כדי לקבוע את התוספת המתאימה של rNTP.Mg ל-rNTP מופחת ולליזט בתוספת מגנזיום כוללים ביטוי eGFP או פלואורופור דומה (למשל, sfGFP) ללא שותף איחוי. ריכוזים הולכים וגדלים של rNTP.Mg מתווספים לתגובות כדי לקבוע את הנקודה שבה רמת הביטוי (הנמדדת כ-eGFP RFU באמצעות קורא לוחות רב-מצבים) ממוטבת. סיומות מוקדמות של eGFP, שאינן פלואורסצנטיות, מתגלות על ידי הפחתת eGFP RFU בריכוזי rNTP.Mg גבוהים מדי. עם זאת, תקלות במוצר קצר של LTE מתרחשות בתדירות גבוהה יותר בחלבונים מבוטא גדולים יותר (>50 kDa). לפיכך, ניתן לבצע אופטימיזציה זו באמצעות תבנית גדולה יותר מאשר eGFP, במיוחד אם אחת זמינה בווקטור ביטוי מתאים, המספק איחוי פלואורופור הרצוי להיות מיוצר על ידי LTE עבור יישום או מחקר מסוים (ראה סעיף תוצאות מייצגות).
- הפשירו אליציטוט של 100 μL וצרו שש תגובות ביטוי של 10 μL, שכל אחת מהן מורכבת מליזט בתוספת חלקית של 7 μL משלב 6.2, 1 μL של תמיסה מלמעלה לפי טבלה 2, ו-2 μL של מים אולטרה-טהורים המכילים תבנית בקרת DNA מספקת כדי להשיג ריכוז סופי של 50 ng/μL בתגובה.
- לדגור על התגובות במשך 2 שעות ב 25 ° C ולפקח על הגידול פלואורסצנטיות GFP באמצעות קורא לוחות multimode.
הערה: ערכי תצורה מתאימים עבור GFP הם עירור ב- 485 ננומטר (רוחב פס 5 ננומטר), פליטה ב- 516 ננומטר (רוחב פס 5 ננומטר), עם מרווח קריאה של דקה אחת למשך שעתיים. - דרג את ערכי הביטוי הסופיים כדי לקבוע את ריכוז rNTP.Mg המתאים ל- eGFP RFU הגבוה ביותר. אם נתונים קינטיים זמינים, עודף של rNTP.Mg יצויין גם על ידי עלייה דו-פאזית ב- eGFP RFU במהלך תקופת הביטוי של שעתיים (ראה סעיף תוצאות מייצגות).
- לאחר קביעת ריכוז rNTP.Mg המילוי הממוטב, הוסיפו אותו לכל ביטויי החלבון הנוספים באמצעות אצווה של LTE שהושלמה חלקית בשלבים הקודמים.
הערה: אם aliquoting בשלב 6.2 נעשה בזהירות עם נפחים קבועים, ניתן להוסיף את הטעינה בדיעבד לכל aliquot ללא הפשרה, למשל, עם aliquots מונח על קרח יבש. אליציטוטים אלה מקבלים כעת תוספת מלאה, מכיוון שתוספת rNTP.Mg הנכונה תערבב דרך כל אחד מהם כאשר הם מופשרים ומעורבבים לשימוש.
תוצאות
מטרת ביטוי חלבונים ללא תאים היא לייצר חלבונים באורך מלא בצורה מקופלת ופעילה המתאימה למגוון רחב של יישומים. LTE (תמצית Leishmania tarentolae ) הושוותה בעבר למערכות ביטוי פרוקריוטיות ואיקריוטיות אחרות ללא תאים, והדגימה יכולת גבוהה להימנע מחיתוך וצבירה כאשר הן פועלות בצורה אופטי...
Discussion
פרוטוקולים ליצירת LTE פורסמו בעשור האחרון7 ועברו עדכונים תקופתיים25,34. עם זאת, מצטרפים חדשים לטכניקה נתקלים לעתים קרובות בעקומת למידה תלולה, וכתוצאה מכך עיכובים בהשגת ביטוי חלבון באיכות גבוהה ותשואה גבוהה. אתגרים דומים דווחו ע?...
Disclosures
אין אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מבקשים להודות לחברי מעבדת אלכסנדרוב הרבים שתרמו לפיתוח מערכות LTE במהלך 10 השנים האחרונות, ובמיוחד לסרגיי מורייב שהיה חלוץ המערכת ופיתח את אתר הכניסה לריבוזום SITS. איור 1 נוצר על-ידי Biorender.com ושוכפל ברישיון.
Materials
| Name | Company | Catalog Number | Comments |
| PD-10 SuperDex 25 Columns | Cytiva | 17085101 | Gel filtration columns |
| Nitrogen Cavitation cell disrupter | Parr Industries | 4635 or 4639 | Cell Disrupter |
| Bovine derived Hemin | Sigma-Aldrich | H5533 | Culture additive |
| Penicillin/Streptomycin 10000U/ml | Thermo-Fisher | 15140122 | Antibiotic mix |
| Optiplate 384 | Perkin-Elmer | 6007290 | Multiwell plate for 10ul expressions |
| Oligonucleotide | IDT synthesis | Oligo with sequence CAATAAAGTACAGAAACTGATAC TTATATAGCGTT | |
| Creatine Phosphokinase | Sigma-Aldrich | 9001-15-4 | Enzyme |
| Tecan Spark | Tecan | or similar Multimode Platereader | |
| Chemidoc MP Imager | Biorad | or similar SDS-PAGE gel Imager | |
| 4-12% Bis-Tris Gels | Invitrogen | NW04125 | SDS-PAGE gels |
| Biophotometer | Eppendorf | or similar Cuvette Specrophotometer | |
| Nanodrop One | Thermofisher | Nanodrop spectrophotometer | |
| Avanti JXN-26 centrifuge | Beckman Coulter | or similar centrifuge, with rotors/tubes rated 10K and 50K g | |
| 5424R microcentrifuge | Eppendorf | or similar microcentrifuge, with 1.5ml microcentrifuge tubes | |
| Flask Incubator Inova S44i | Eppendorf | or similar flask incubator shaker suitable for 5L Flasks | |
| 5L glass culture flasks | Baffled glass flasks for culture growth | ||
| Bactotryptone | BD | 211705 | Growth medium |
| Yeast Extract | Merck | VM930053 | Growth medium |
| Glycerol | Any analytical grade | ||
| Glucose | Any analytical grade | ||
| KH2PO4 | Any analytical grade | ||
| K2HPO4 | Any analytical grade | ||
| UltraPure water | Invitrogen | 10977-015 | Or output from any MilliQ-type water dispenser |
References
- Nirenberg, M. W., Matthaei, J. H. The dependence of cell-free protein synthesis in E.coli upon naturally occurring or synthetic polyribonucleotides. Proc Natl Acad Sci USA. 47 (10), 1588-1602 (1961).
- Caschera, F., Noireaux, V. Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie. 99, 162-168 (2014).
- Kelwick, R., Webb, A. J., MacDonald, J. T., Freemont, P. S. Development of a Bacillus subtilis cell-free transcription-translation system for prototyping regulatory elements. Metab Eng. 38, 370-381 (2016).
- Ezure, T., et al. Cell-free protein synthesis system prepared from insect cells by freeze-thawing. Biotechnol Prog. 22 (6), 1570-1577 (2006).
- Harbers, M. Wheat germ systems for cell-free protein expression. FEBS Letters. 588 (17), 2762-2773 (2014).
- Kobs, G. Selecting the cell-free protein expression system that meets your experimental goals. Promega Corporation. 21, 6-9 (2008).
- Kovtun, O., et al. Leishmania cell-free protein expression system. Methods. 55 (1), 58-64 (2011).
- Basile, G., Peticca, M. Recombinant protein expression in Leishmania tarentolae. Mol Biotechnol. 43 (3), 273-278 (2009).
- Mureev, S., Kovtun, O., Nguyen, U. T., Alexandrov, K. Species-independent translational leaders facilitate cell-free expression. Nat Biotechnol. 27 (8), 747-752 (2009).
- Gambin, Y., et al. Single-molecule fluorescence reveals the oligomerization and folding steps driving the prion-like behavior of ASC. J Mol Biol. 430 (4), 491-508 (2018).
- Sierecki, E., et al. Rapid mapping of interactions between human SNX-BAR proteins measured in vitro by AlphaScreen and single-molecule spectroscopy. Mol Cell Proteomics. 13 (9), 2233-2245 (2014).
- Sierecki, E., et al. Nanomolar oligomerization and selective co-aggregation of alpha-synuclein pathogenic mutants revealed by single-molecule fluorescence. Sci Rep. 6, 37630 (2016).
- Leitao, A., Bhumkar, A., Hunter, D. J. B., Gambin, Y., Sierecki, E. Unveiling a selective mechanism for the inhibition of alpha-synuclein aggregation by beta-synuclein. Int J Mol Sci. 19 (2), 334 (2018).
- Gambin, Y., et al. Single-molecule analysis reveals self assembly and nanoscale segregation of two distinct cavin subcomplexes on caveolae. Elife. 3, e01434 (2013).
- Ve, T., et al. Structural basis of TIR-domain-assembly formation in MAL- and MyD88-dependent TLR4 signaling. Nat Struct Mol Biol. 24 (9), 743-751 (2017).
- Guo, Z., et al. Subunit organisation of in vitro reconstituted HOPS and CORVET multisubunit membrane tethering complexes. PLoS One. 8 (12), e81534 (2013).
- Ruehrer, S., Michel, H. Exploiting Leishmania tarentolae cell-free extracts for the synthesis of human solute carriers. Mol Membr Biol. 30 (4), 288-302 (2013).
- Varasteh Moradi, S., et al. Mapping Interactions among cell-free expressed Zika virus proteins. J Proteome Res. 19 (4), 1522-1532 (2020).
- Gagoski, D., et al. Cell-free pipeline for discovery of thermotolerant xylanases and endo-1,4-beta-glucanases. J Biotechnol. 259, 191-198 (2017).
- Ergun Ayva, C., et al. Exploring performance parameters of artificial allosteric protein switches. J Mol Biol. 434 (17), 167678 (2022).
- Lau, D., et al. Fluorescence biosensor for real-time interaction dynamics of host proteins with HIV-1 capsid tubes. ACS Appl Mater Interfaces. 11 (38), 34586-34594 (2019).
- Ryan, S. M., et al. Novel antiinflammatory biologics shaped by parasite-host coevolution. Proc Natl Acad Sci USA. 119 (36), e2202795119 (2022).
- McMahon, K. A., et al. Identification of intracellular cavin target proteins reveals cavin-PP1alpha interactions regulate apoptosis. Nat Commun. 10 (1), 3279 (2019).
- Sierecki, E., et al. A cell-free approach to accelerate the study of protein-protein interactions in vitro. Interface Focus. 3 (5), 20230018 (2013).
- Johnston, W. A., Moradi, S. V., Alexandrov, K. Adaption of the Leishmania cell-free expression system to high-throughput analysis of protein interactions. Methods Mol Biol. 2025, 403-421 (2019).
- Jung, W., et al. Cell-free formation and interactome analysis of caveolae. J Cell Biol. 217 (6), 2141-2165 (2018).
- Fontaine, F. R., et al. Functional domain analysis of SOX18 transcription factor using a single-chain variable fragment-based approach. MAbs. 10 (4), 596-606 (2018).
- Overman, J., et al. Pharmacological targeting of the transcription factor SOX18 delays breast cancer in mice. Elife. 6, e21221 (2017).
- Kubala, M. H., et al. Mammalian farnesyltransferase alpha subunit regulates vacuolar protein sorting-associated protein 4A (Vps4A)--dependent intracellular trafficking through recycling endosomes. Biochem Biophys Res Commun. 468 (4), 580-586 (2015).
- Han, S. P., et al. Cortactin scaffolds Arp2/3 and WAVE2 at the epithelial zonula adherens. J Biol Chem. 289 (11), 7764-7775 (2014).
- Das Gupta, K., et al. Class IIa histone deacetylases drive toll-like receptor-inducible glycolysis and macrophage inflammatory responses via pyruvate kinase M2. Cell Rep. 30 (8), 2712-2728.e8 (2020).
- Leitão, A. D. G., et al. Selectivity of protein interactions along the aggregation pathway of α-synuclein. BioRxiv. , (2021).
- Gagoski, D., et al. Performance benchmarking of four cell-free protein expression systems. Biotechnol Bioeng. 113 (2), 292-300 (2016).
- Johnston, W. A., Alexandrov, K. Production of eukaryotic cell-free lysate from Leishmania tarentolae. Methods Mol Biol. 1118, 1-15 (2014).
- Hunter, D. J. B., Bhumkar, A., Giles, N., Sierecki, E., Gambin, Y. Unexpected instabilities explain batch-to-batch variability in cell-free protein expression systems. Biotechnol Bioeng. 115 (8), 1904-1914 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved