Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Производство и оптимизация LTE, бесклеточной системы экспрессии белка, полученной из Leishmania tarentolae , для производства рекомбинантных белков
В этой статье
Резюме
Leishmania Translational Extract (LTE) представляет собой эукариотическую бесклеточную систему экспрессии белка, полученную из одноклеточного паразита Leishmania tarentolae. Этот оптимизированный протокол делает LTE простым и экономичным в производстве. Он подходит для различных приложений, ориентированных на многопараллельную экспрессию и изучение сложных эукариотических белков и их взаимодействий.
Аннотация
Этот протокол описывает производство и оптимизацию эукариотической системы экспрессии бесклеточных белков (CFPS), полученной из одноклеточного жгутиконосца Leishmania tarentolae, называемого трансляционным экстрактом Leishmania или LTE. Хотя этот организм изначально эволюционировал как паразит гекконов, его можно легко и недорого выращивать в колбах или биореакторах. В отличие от Leishmania major, она непатогенна для человека и не требует специальных лабораторных предосторожностей. Еще одним преимуществом использования Leishmania для CFPS является то, что добавление одного антисмыслового олигонуклеотида к CFPS, нацеленного на консервативную последовательность лидера сплайсинга на 5'-конце всех белок-кодирующих РНК, может подавлять экспрессию эндогенных белков. Мы предоставляем процедуры для разрушения клеток и обработки лизата, которые были упрощены и улучшены по сравнению с предыдущими версиями. Эти процедуры начинаются с простых колбовых культур. Кроме того, мы объясняем, как вводить генетическую информацию с помощью векторов, содержащих видонезависимые сайты инициации трансляции (SITS), и как выполнять прямую оптимизацию партии и контроль качества для обеспечения стабильного качества экспрессии белка.
Введение
В 1960-х годах внеклеточные системы экспрессии белков сыграли ключевую роль в раскрытии генетическогокода. Тем не менее, прокариотические системы экспрессии бесклеточных белков, в основном основанные на E. coli, в настоящее время доминируют как в лабораторных, так и в коммерческих приложениях. В то время как системы на основе E. coli обладают такими преимуществами, как экономическая эффективность, масштабируемость и высокая экспрессия, они сталкиваются с проблемами при производстве многодоменных белков в их активных формах и облегчении сборки белковыхкомплексов2,3. В настоящее время широко используемые формы синтеза эукариотического бесклеточного белка (CFPS) включают экстракт зародышей пшеницы (WGE), лизат ретикулоцитов кролика (RRL) и лизат клеток насекомых (ICL)4,5,6. В этой работе представлена альтернативная эукариотическая бесклеточная система, которая является одновременно простой и масштабируемой, основанной на одноклеточном жгутиковом паразите Leishmania tarentolae.
Leishmania tarentolae можно легко культивировать в колбах с использованием экономичных сред, а также масштабировать в биореакторах для достижения более высокой плотности клеток. Присутствие эндогенных мРНК в клеточном лизате, которые в противном случае могли бы конкурировать с введенными сообщениями, может быть нейтрализовано с помощью антисмысловых олигонуклеотидов, нацеленных на консервативную последовательность лидера сплайсинга мРНК Leishmania7. В отличие от своего близкого родственника Leishmania major, который вызывает заболевания человека, L. tarentolae инфицирует мавританского геккона (Tarentolae mauritanica), что делает его пригодным для выращивания в лабораторных условиях PC2 без необходимости специальных мер предосторожности. Ранее он использовался в качестве трансгенного организма для экспрессии белка in vivo8.
Для облегчения прайминга матриц в бесклеточных системах были разработаны универсальные последовательности на основе полимерных структур РНК, которые усиливают трансляционную инициацию9. Эти видонезависимые трансляционные последовательности (SITS) применимы как к прокариотическим, так и к эукариотическим бесклеточным системам и подходят для введения генетической информации в LTE. Хотя этот протокол не дает подробного объяснения построения векторов для экспрессии внеклеточного белка LTE, для оптимизации и контроля качества требуются подходящие векторы, содержащие флуорофорные слияния желаемых белков, представляющих интерес, ниже по течению от сайта SITS. С этой целью в репозиторий генов Addgene были депонированы соответствующие векторы LTE, такие как вектор pCellFree_G03, который кодирует N-концевое слияние eGFP с желаемым белком, представляющим интерес, с использованием сайтов клонирования Gateway.
LTE доказал свою ценность в широком спектре применений, требующих экспрессии белков, включая анализ самосборки белка10,16, производство интегральных мембранных белков человека17, исследования кандидатов в противовирусные препараты18, разработку биотехнологически полезных ферментов19, прототипирование белковых биосенсоров20,21 и изучение биологических препаратов из анкилостомозов22. LTE также сыграл важную роль в картировании сетей белок-белковых взаимодействий в области вирусологии и клеточных структур21,32. Было проведено исследование LTE, которое показало схожие с другими эукариотическими бесклеоточными системами экспрессии полноразмерных, монодисперсных и неагрегированных белков33, обеспечивая при этом более экономичное и масштабируемое производство.
Этот протокол предусматривает методы культивирования и разрушения организма хозяина, получения лизата и добавления питательного раствора (ФС) для сопряженной экспрессии транскрипционного/трансляционного белка. Кроме того, он включает в себя протокол оптимизации производственных партий. В первоначальном варианте бесклеточной системы Leishmania наблюдались нежелательные вариации от партии к партии в уровнях экспрессии, доле полноразмерных белков и наличии белковых агрегатов, что приводило к утилизации партий34. Для решения этой проблемы были внесены последующие усовершенствования протокола25. Текущий протокол основан на этих улучшениях, позволяя оптимизировать отдельные партии для максимальной экспрессии и размера белка. Это достигается за счет тщательного контроля нагрузки на разрушитель ячеек (измеряется как оптическая плотность на длине волны 600 нм; наружный диаметр600 нм) и нормализация результирующего выхода лизата с использованием абсорбции при длине волны 280 нм (Abs280 нм). Кроме того, он включает в себя метод частичного добавления в лизат rNTP и магния в процессе производства с последующей оптимизацией компонентов этого исходного раствора во время тестовых экспрессий. Хотя такая оптимизация представлена в протоколе как вариант, авторами она настоятельно рекомендуется.
протокол
Этот протокол включает в себя подробные рецепты сред и этапы, которые включают культивирование, центрифугирование, измерение флуоресценции GFP с помощью многорежимного планшетного ридера, измерение наружного диаметра культуры600 нм и оценку лизата Abs280 нм. Он также охватывает настройку и визуализацию белковых гелей SDS-PAGE. Материалы, необходимые или предлагаемые для этого протокола, перечислены в таблице «Материалы». Важно отметить, что типичные лабораторные ресурсы, такие как компоненты среды, центрифуги, пробирки, спектрофотометры и установки для гель-электрофореза, скорее всего, могут использоваться взаимозаменяемо, если не указано иное. На рисунке 1 представлена краткая информация о производственном процессе LTE.
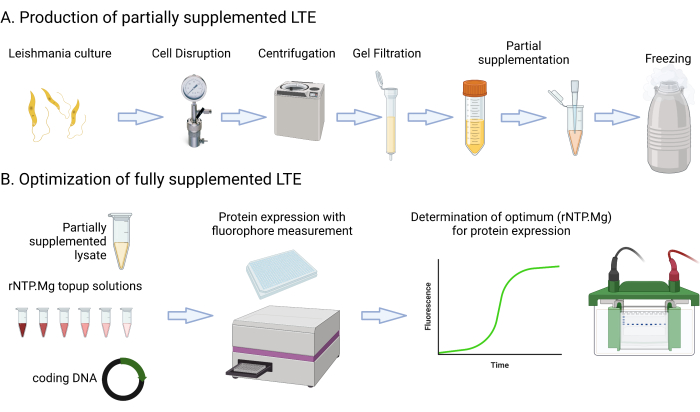
Рисунок 1: Обзор производственного протокола LTE. В этом мультфильме представлено краткое изложение протокола производства LTE. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
1. Рост культур Leishmania tarentolae
- Приготовьте не менее 3 л питательной среды TBGG (бактотриптон 12 г/л, экстракт дрожжей 24 г/л, глицерин 8 мл/л, глюкоза 1 г/л, KH2PO4 2,3 г/л, K2HPO4 2,5 г/л, см. Таблицу материалов). Стерилизуйте фильтр с помощью фильтра 0,22 мкм под вакуумом или аналогичной установкой.
- Храните среду при комнатной температуре (RT), с окончательными добавками (гемин, антибиотики), добавленными непосредственно перед посевом L. tarentolae. Гемин (0,25% v/v в 50% триэтаноламина) добавляется в дозе 0,2% v/v, пенициллин (10 000 ЕД/мл) плюс стрептомицин (10 000 мкг/мл) в смеси 0,5% v/v.
ПРИМЕЧАНИЕ: Отправной точкой этого протокола является поддерживаемая культура 2 x 10 мл дикого типа L. tarentolae. Поддерживающие культуры выращивают при температуре 27 °C в стандартных колбах для тканевых культур объемом 50 мл с низким встряхиванием (75 об/мин). Такие культуры в 10 мл можно поддерживать неограниченное время с разведениями ~1/20 в стерильных (TBGG + гемин, пенициллин, стрептомицин) каждые 2-3 дня. Рекомендуется использовать стандартный шкаф биобезопасности в лаборатории PC2; тем не менее, бактериальные загрязнения, как правило, предотвращаются добавлением антибиотиков, в то время как грибковые загрязнения обычно перерастают L. tarentolae. - В течение двух дней увеличьте поддерживающие культуры L. tarentolae до 200 мл (день 1), а затем до 2 л (день 2) с помощью разведений 1:10 с увеличением объема TBGG + гемин/антибиотики каждый день. Выполните оба разведения в стерилизованных автоклавом стеклянных колбах объемом 5 л (заполненных максимум до 1 л). Второе разведение должно произойти во второй половине дня между 3 и 6 часами вечера, с намерением начать производство лизата на следующий день между 8 и 11 часами утра.
ПРИМЕЧАНИЕ: В этом протоколе используется минимальный начальный объем для производства LTE (2 x 1 л культур). Также возможно расширение культуры до 10 л для производства LTE путем включения дополнительной ступени расширения (например, День 1: 100 мл; День 2: 1 л; День 3: 10 л). Хотя в этом протоколе для выращивания L. tarentolae используются колбы с перегородками (см. Таблицу материалов), опционально можно использовать обычные биореакторы, предназначенные для роста бактерий с крыльчатками Раштона, при условии, что скорость перемешивания поддерживается ниже 100 об/мин. Улучшенная аэрация и контроль pH в биореакторах, как правило, удлиняют логарифмический рост культур L. tarentolae, что позволяет использовать более высокий наружный диаметр урожая600 нм 10 на этапе 1.4. - Запишите наружный диаметр600 нм культуры в трех экземплярах путем разведения в соотношении 1:10 в TBGG непосредственно в кювете спектрофотометра. Подходящий стартовый диапазон для изготовления лизата – наружный диаметр600 нм = 4,0-8,0.
- Обеспечьте дополнительное время инкубации, если наружный диаметр600 нм < 4.0. Культура с наружным диаметром600 нм > 8 пригодна для использования и приведет к получению большего объема бесклеточного лизата экспрессии, но с более низким качеством из-за наступления фазы позднего логарифмического роста. Поместите колбы с культурой на лед, ожидая последующих действий.
ПРИМЕЧАНИЕ: Точное измерение конечного наружного диаметракультуры 600 нм имеет решающее значение, поскольку он используется для расчета конечного объема для концентрированных клеток до разрушения. Этот расчет заменяет метод взвешивания гранул, использовавшийся в более ранних версиях производства LTE для калибровки концентрации элементов до нарушения34, с целью упрощения протокола. Убедитесь, что для измерения наружного диаметра600 нм необходимо разбавить TBGG, так как в противном случае осмотический удар изменяет форму ячейки, вызывая погрешность измерения. Пипетка смешивает разведение 1:10 для измерения наружного диаметра600 нм (непосредственно в кювете) за несколько секунд до проведения спектрофотометрического считывания, поскольку клетки L. tarentolae быстро оседают с характерным мутным видом. Если конечный объем сцеживаемой культуры считается приблизительным, также рекомендуется взвешивание колб при сборе урожая (с подходящей пустой тарой из колбы) для получения лучшего расчетного объема (при 1 г = 1 мл). Максимально возможный наружный диаметр600 нм от роста L. tarentolae в перегородках составляет 15-20, хотя это нецелесообразно для производства лизата из-за достижения стационарной фазы.
2. Концентрация культур L. tarentolae
- Клетки Leishmania должны быть промыты и сконцентрированы примерно в 60 раз до разрушения. Рассчитайте целевой объем для концентрации клеток на основе наружного диаметра600 нм = 300 для конечного концентрата. Уравнение выглядит следующим образом: V = объем урожая (мл) x (наружный диаметрурожая 600 нм/300). Например, при использовании культуры объемом 2 л с урожаем OD600 = 5 целевой объем составляет 33 мл.
ПРИМЕЧАНИЕ: Цель наружного диаметра600 нм 300 может быть изменена; Предыдущее производство LTE использовало значения в диапазоне 150-350. Более высокие концентрации клеток, находящихся в процессе разрушения, будут иметь тенденцию приводить к конечным реакциям безклеточной экспрессии с более высоким выходом белка, но с повышенной тенденцией к агрегации уязвимых белков. Наружный диаметр600 нм = 300 представляет собой подходящую цель по умолчанию для производства LTE. - Переложите собранные культуры в подходящие центрифужные бутылки и вращайте их при температуре 2500 x g в течение 10 минут при 4 °C. Осторожно сцедите надосадочную жидкость в отходы культуры.
ПРИМЕЧАНИЕ: Важно свести к минимуму потери клеток в отброшенную надосадочную жидкость, так как это влияет на расчет нагрузки на разрушение. В предыдущих производственных протоколах LTE концентрация клеток L. tarentolae для разрушения калибровалась путем откручивания концентрата клеток в тестовой микроцентрифужной пробирке и измерения массы гранул по отношению к общей массе34. Этот упрощенный протокол вместо этого использует теоретический целевой внешний диаметр600 нм для концентрата, основанный на измеренном наружном диаметре600 нм, и предполагает низкую потерю клеток во время концентрации и промывки клеток. - Промойте клеточную гранулу в буфере SEB (45 мМ HEPES-KOH pH 7,6, 250 мМ сахароза, 100 мМ KOAc, 3 мМ Mg(OAc)2, выдерживая на льду) три раза, каждый раз центрифугируя при 2500 x g в течение 10 мин при 4 °C. Для первой промывки суспендируйте каждый 1 л гранулированной культуры в 100 мл буфера SEB, затем объедините их в одну колбу центрифуги. Для второй промывки также используйте 100 мл SEB на каждый 1 л исходной культуры.
ПРИМЕЧАНИЕ: Для окончательной ресуспензии гранул добавьте буфер SEB до 50% от конечного целевого объема ресуспензии (шаг 2.1). Это позволяет тщательно доливать объединенный концентрат точно до конечного целевого объема на шаге 2.4. Каждая ресуспензия должна быть как можно более щадящей, чтобы избежать преждевременного лизиса L. tarentolae, например, путем осторожного взматывания добавленного SEB вокруг сцеженной гранулы или пипетирования SEB поверх гранулы, прилипшей к стенке центрифужной трубки. Возможно, более удобным будет перенос надосадочной жидкости в центрифужные пробирки меньшего размера для заключительного этапа. - Перелейте ресуспендированный концентрат в подходящий мерометрический цилиндр из вымытого стекла, затем долейте объем до целевого объема (шаг 2.1) с помощью дополнительного холодного SEB и аккуратно перемешайте.
3. Лизис концентрата L. tarentolae
- Поместите концентрат клеток в устройство для кавитации азота (см. Таблицу материалов), предварительно охлажденное до 4 °C, нагнетайте его до 70 бар азота и инкубируйте в течение 45 минут на льду.
ПРИМЕЧАНИЕ: Несмотря на то, что нарушители кавитации азота не являются распространенными лабораторными изделиями, они рекомендуются для производства LTE. Были опробованы альтернативные методы, такие как клеточное замораживание-размораживание и разрушители типа френч-пресса; Однако активность экспрессии белка составила <50% по сравнению с использованием метода кавитации азотом. Устройство для кавитации азота должно быть тщательно очищено перед использованием и между прогонами, как и все повторно используемые сосуды, которые вступают в контакт с клеточным лизатом на этом этапе (например, колба-приемник). Подходящий режим чистки предполагает стирку лабораторными моющими средствами с последующим тщательным промыванием деионизированной водой. - Откройте вентиляционное отверстие на устройстве кавитации азота и выдавите полученный лизат в достаточно прочный контейнер, например, в колбу вакуумного ресивера на льду. Наклоните колбу-приемник, чтобы убедиться, что весь полученный лизат оседает и может быть передан пипеткой в свежую центрифужную пробирку или аналогичный сосуд.
ВНИМАНИЕ: Нарушители кавитации азота основаны на резком переходе концентрата элемента от 70 бар азота к давлению окружающей среды, достигаемом за счет сильного потока сначала жидкости, а затем азота через выпускной клапан устройства. Вентиляция должна осуществляться с помощью соответствующих средств индивидуальной защиты (СИЗ) в капюшоне химической безопасности. Существует риск поломки сосуда назначения и потери лизата, поэтому мы используем прочный вакуумный приемник вместо обычной колбы. Если выпускной клапан устройства представляет собой трубку, не размещайте трубку непосредственно внутри ресивера, чтобы предотвратить чрезмерное повышение давления в точке вентиляции.
4. Центрифугирование клеточного лизата
- Переведите лизат в подходящие центрифужные пробирки с номинальной силой перегрузки и центрифугу при давлении 10 000 x g в течение 15 минут при 4 °C. Удалите надосадочную жидкость в свежие, аналогичные центрифужные пробирки.
- Центрифугируйте лизат при 30 000 х г в течение 15 мин при 4 °С, а затем удалите окончательную надосадочную жидкость в свежую центрифужную пробирку или аналогичную емкость, помещенную на лед. Оцените общий объем.
5. Гелевая фильтрация клеточного лизата
ПРИМЕЧАНИЕ: Гель-фильтрация используется для удаления сахарозы, входящей в состав буфера SEB. В то время как сахароза помогает стабилизировать клеточный механизм во время клеточного разрушения, она снижает выход, если сохраняется в реакциях экспрессии белка.
- Установите достаточное количество колонок для фильтрации геля с гравитационной подачей PD-10 (см. Таблицу материалов) в формате штатива, который позволяет им капать в лоток для сбора или аналогичный контейнер внизу, гарантируя, что они могут фильтровать весь объем лизата со скоростью 2,5 мл на колонку. Предварительно уравновесьте колонки, предварительно пропустив через них 10 мл буфера EB с температурой 4 °C (45 мМ HEPES-KOH pH 7,6, 100 мМ KOAc, 3 мМ Mg(OAc)2).
ПРИМЕЧАНИЕ: Все шаги с этого момента лучше проводить в холодильной камере при температуре 4 °C. Тем не менее, он также подходит для хранения всех лизатов и реагентов на настольном лотке для льда. Одним из исключений является этап фильтрации гелем, на котором авторы помещают стеллаж с колоннами внутрь холодильника с температурой 4 °C во время повторной буферизации. В первоначальных версиях этого протокола новые колонки для фильтрации геля «блокировались» путем первоначальной буферизации лизата и отбрасывания первого выхода. Хотя это не считается необходимым, колонки должны быть промыты EB-буфером и храниться при температуре 4 °C между партиями лизата. Первый выходной лизат может иметь более низкую активность экспрессии белка, чем последующие выходы, из-за некоторого фонового удержания компонентов лизата на новой колонке. - Добавьте по 2,5 мл лизата в каждую колонку и подождите, пока он перейдет в колонку. Добавьте еще 0,5 мл EB, чтобы отсадить лизат в колонке, отбрасывая элюат.
- Разбавьте фильтрованный гелем лизат, добавив дополнительно 2,5 мл EB в каждую колонку, собирая выход, помещая под колонки свежий, чистый лоток или другую емкость.
6. Добавка клеточного лизата
- С помощью нанокапельного спектрофотометра (см. Таблицу материалов) измерьте Abs280 нм лизата, отфильтрованного гелем. Если он превышает 60, разбавьте его до Abs280 нм = 60 с помощью дополнительного буфера EB при температуре 4 °C.
ПРИМЕЧАНИЕ: В то время как контроль ввода плотности клеток в разрушение с помощью наружного диаметра600 нм приблизительно определяет выходную силу лизата, нормализация Absна длине волны 280 нм после разрушения и обработки лизата еще больше улучшает стабильность лизата в партии. Lysate Abs280 нм можно регулировать вверх и вниз, что приводит к выходу экспрессии белка и агрегации (см. раздел «Обсуждение»). Если недополненный лизат указывает на Abs280 нм < 60, возможно, потребуется включить больше биомассы Leishmania на этапе разрушения, т.е. увеличить нагрузку разрушителя клеток до наружного диаметра600 нм > 300 на этапе 2.1. - Добавьте 5x Питательный раствор (5x FS, Таблица 1) в лизат в соотношении 2:5 и тщательно перемешайте. Разложите его по подходящим емкостям (например, микропробиркам объемом 1,5 мл) и заморозьте в жидком азоте. Если вы следуете необязательным шагам 7.1-7.3 для оптимизации выражения LTE, приведенному ниже, используйте уменьшенную rNTP.Mg 5x FS из таблицы 1 вместо стандартной 5x FS. Включите 5 аликвот по 100 мкл для замораживания для использования в экспериментах по оптимизации.
ПРИМЕЧАНИЕ: Замораживание с использованием стандартного 5x FS в соотношении 2:5 создает готовый к экспрессии дополненный LTE, используемый при экспрессии 7 μL/10 μL (следовательно, 5x FS становится 1x FS в конечной реакции). Тем не менее, авторы рекомендуют следовать дальнейшим необязательным шагам, в которых в 5x FS предусмотрено 0,6-кратное стандартное количество rNTP и магния. За этим следует этап оптимизации, на котором добавляется эквимолярная смесь этих двух реакций (называемая rNTP.Mg) для доведения тестовых реакций до оптимизированного значения. Частичная 5x FS также содержит олигонуклеотид, который подавляет экспрессию эндогенной мРНК (см. раздел «Введение»). Последовательность олигонуклеотида — CAATAAAGTACAGAAACTGATTATATAGCGTT.
7. Контроль качества и оптимизация конечного дополненного LTE
ПРИМЕЧАНИЕ: Минимально необходимые шаги для определения подходящего «доливочного» добавления rNTP.Mg к восстановленному rNTP и лизату с добавлением магния включают экспрессию eGFP или аналогичного флуорофора (например, sfGFP) без партнера по синтезу. Увеличивающиеся концентрации rNTP.Mg добавляются в реакции, чтобы определить точку, в которой уровень экспрессии (измеряемый как eGFP RFU с помощью многорежимного считывателя) оптимизируется. Преждевременное прекращение eGFP, которое не является флуоресцентным, становится очевидным при снижении РКГ eGFP при слишком высоких концентрациях rNTP.Mg. Тем не менее, короткие продукты сбоев LTE чаще происходят в более крупных экспрессированных белках (>50 кДа). Следовательно, можно выполнить эту оптимизацию с использованием более крупного шаблона, чем eGFP, особенно если он доступен в подходящем векторе экспрессии, обеспечивающем слияние флуорофоров, которое желательно получить с помощью LTE для конкретного применения или исследования (см. раздел «Репрезентативные результаты»).
- Разморозьте 100 мкл аликвоты и запустите шесть реакций экспрессии по 10 мкл, каждая из которых состоит из 7 мкл частично дополненного лизата из стадии 6.2, 1 мкл раствора для долива в соответствии с таблицей 2 и 2 мкл сверхчистой воды, содержащей достаточное количество контрольного шаблона ДНК для достижения конечной концентрации 50 нг/мкл в реакции.
- Инкубируйте реакции в течение 2 ч при 25 °C и контролируйте увеличение флуоресценции GFP с помощью многорежимного считывателя планшетов.
ПРИМЕЧАНИЕ: Подходящими конфигурационными значениями для GFP являются возбуждение на длине волны 485 нм (полоса пропускания 5 нм), излучение на длине волны 516 нм (полоса пропускания 5 нм) с интервалом считывания 1 минута в течение 2 часов. - Ранжируйте итоговые значения выражения, чтобы определить концентрацию rNTP.Mg, соответствующую наивысшему РФС eGFP. Если кинетические данные доступны, превышение rNTP.Mg также будет свидетельствовать о двухфазном увеличении РФП eGFP в течение 2-часового периода экспрессии (см. раздел «Репрезентативные результаты»).
- После того, как будет определена оптимизированная концентрация rNTP.Mg долива, добавьте ее ко всем дальнейшим экспрессиям белка, используя партию LTE, которая была частично добавлена на предыдущих этапах.
ПРИМЕЧАНИЕ: Если аликвотирование на шаге 6.2 выполняется осторожно с фиксированными объемами, то доливка может быть ретроспективно добавлена к каждой аликвоте без размораживания, например, с помощью аликвот, помещенных на сухой лед. Теперь эти аликвоты полностью дополнены, так как правильная rNTP.Mg долива будет смешиваться через каждую из них, когда они будут разморожены и смешаны для использования.
Результаты
Целью экспрессии внеклеточных белков является получение полноразмерных белков в свернутой, активной форме, подходящей для широкого спектра применений. LTE (экстракт Leishmania tarentolae) ранее сравнивали с другими прокариотическими и эукариотическими системами бесклето...
Обсуждение
Протоколы создания LTE были опубликованы за последнее десятилетие7 и претерпели периодическиеобновления25,34. Тем не менее, новички в этом методе часто сталкиваются с крутой кривой обучения, что приводит к задержкам в достиже...
Раскрытие информации
Конкурирующие финансовые интересы отсутствуют.
Благодарности
Авторы выражают признательность многим сотрудникам лаборатории Александрова, которые внесли свой вклад в развитие систем LTE за последние 10 лет, в частности Сергею Мурееву, который стал пионером системы и разработал сайт входа рибосом SITS. Рисунок 1 создан компанией Biorender.com и воспроизведен по лицензии.
Материалы
| Name | Company | Catalog Number | Comments |
| PD-10 SuperDex 25 Columns | Cytiva | 17085101 | Gel filtration columns |
| Nitrogen Cavitation cell disrupter | Parr Industries | 4635 or 4639 | Cell Disrupter |
| Bovine derived Hemin | Sigma-Aldrich | H5533 | Culture additive |
| Penicillin/Streptomycin 10000U/ml | Thermo-Fisher | 15140122 | Antibiotic mix |
| Optiplate 384 | Perkin-Elmer | 6007290 | Multiwell plate for 10ul expressions |
| Oligonucleotide | IDT synthesis | Oligo with sequence CAATAAAGTACAGAAACTGATAC TTATATAGCGTT | |
| Creatine Phosphokinase | Sigma-Aldrich | 9001-15-4 | Enzyme |
| Tecan Spark | Tecan | or similar Multimode Platereader | |
| Chemidoc MP Imager | Biorad | or similar SDS-PAGE gel Imager | |
| 4-12% Bis-Tris Gels | Invitrogen | NW04125 | SDS-PAGE gels |
| Biophotometer | Eppendorf | or similar Cuvette Specrophotometer | |
| Nanodrop One | Thermofisher | Nanodrop spectrophotometer | |
| Avanti JXN-26 centrifuge | Beckman Coulter | or similar centrifuge, with rotors/tubes rated 10K and 50K g | |
| 5424R microcentrifuge | Eppendorf | or similar microcentrifuge, with 1.5ml microcentrifuge tubes | |
| Flask Incubator Inova S44i | Eppendorf | or similar flask incubator shaker suitable for 5L Flasks | |
| 5L glass culture flasks | Baffled glass flasks for culture growth | ||
| Bactotryptone | BD | 211705 | Growth medium |
| Yeast Extract | Merck | VM930053 | Growth medium |
| Glycerol | Any analytical grade | ||
| Glucose | Any analytical grade | ||
| KH2PO4 | Any analytical grade | ||
| K2HPO4 | Any analytical grade | ||
| UltraPure water | Invitrogen | 10977-015 | Or output from any MilliQ-type water dispenser |
Ссылки
- Nirenberg, M. W., Matthaei, J. H. The dependence of cell-free protein synthesis in E.coli upon naturally occurring or synthetic polyribonucleotides. Proc Natl Acad Sci USA. 47 (10), 1588-1602 (1961).
- Caschera, F., Noireaux, V. Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie. 99, 162-168 (2014).
- Kelwick, R., Webb, A. J., MacDonald, J. T., Freemont, P. S. Development of a Bacillus subtilis cell-free transcription-translation system for prototyping regulatory elements. Metab Eng. 38, 370-381 (2016).
- Ezure, T., et al. Cell-free protein synthesis system prepared from insect cells by freeze-thawing. Biotechnol Prog. 22 (6), 1570-1577 (2006).
- Harbers, M. Wheat germ systems for cell-free protein expression. FEBS Letters. 588 (17), 2762-2773 (2014).
- Kobs, G. Selecting the cell-free protein expression system that meets your experimental goals. Promega Corporation. 21, 6-9 (2008).
- Kovtun, O., et al. Leishmania cell-free protein expression system. Methods. 55 (1), 58-64 (2011).
- Basile, G., Peticca, M. Recombinant protein expression in Leishmania tarentolae. Mol Biotechnol. 43 (3), 273-278 (2009).
- Mureev, S., Kovtun, O., Nguyen, U. T., Alexandrov, K. Species-independent translational leaders facilitate cell-free expression. Nat Biotechnol. 27 (8), 747-752 (2009).
- Gambin, Y., et al. Single-molecule fluorescence reveals the oligomerization and folding steps driving the prion-like behavior of ASC. J Mol Biol. 430 (4), 491-508 (2018).
- Sierecki, E., et al. Rapid mapping of interactions between human SNX-BAR proteins measured in vitro by AlphaScreen and single-molecule spectroscopy. Mol Cell Proteomics. 13 (9), 2233-2245 (2014).
- Sierecki, E., et al. Nanomolar oligomerization and selective co-aggregation of alpha-synuclein pathogenic mutants revealed by single-molecule fluorescence. Sci Rep. 6, 37630 (2016).
- Leitao, A., Bhumkar, A., Hunter, D. J. B., Gambin, Y., Sierecki, E. Unveiling a selective mechanism for the inhibition of alpha-synuclein aggregation by beta-synuclein. Int J Mol Sci. 19 (2), 334 (2018).
- Gambin, Y., et al. Single-molecule analysis reveals self assembly and nanoscale segregation of two distinct cavin subcomplexes on caveolae. Elife. 3, e01434 (2013).
- Ve, T., et al. Structural basis of TIR-domain-assembly formation in MAL- and MyD88-dependent TLR4 signaling. Nat Struct Mol Biol. 24 (9), 743-751 (2017).
- Guo, Z., et al. Subunit organisation of in vitro reconstituted HOPS and CORVET multisubunit membrane tethering complexes. PLoS One. 8 (12), e81534 (2013).
- Ruehrer, S., Michel, H. Exploiting Leishmania tarentolae cell-free extracts for the synthesis of human solute carriers. Mol Membr Biol. 30 (4), 288-302 (2013).
- Varasteh Moradi, S., et al. Mapping Interactions among cell-free expressed Zika virus proteins. J Proteome Res. 19 (4), 1522-1532 (2020).
- Gagoski, D., et al. Cell-free pipeline for discovery of thermotolerant xylanases and endo-1,4-beta-glucanases. J Biotechnol. 259, 191-198 (2017).
- Ergun Ayva, C., et al. Exploring performance parameters of artificial allosteric protein switches. J Mol Biol. 434 (17), 167678 (2022).
- Lau, D., et al. Fluorescence biosensor for real-time interaction dynamics of host proteins with HIV-1 capsid tubes. ACS Appl Mater Interfaces. 11 (38), 34586-34594 (2019).
- Ryan, S. M., et al. Novel antiinflammatory biologics shaped by parasite-host coevolution. Proc Natl Acad Sci USA. 119 (36), e2202795119 (2022).
- McMahon, K. A., et al. Identification of intracellular cavin target proteins reveals cavin-PP1alpha interactions regulate apoptosis. Nat Commun. 10 (1), 3279 (2019).
- Sierecki, E., et al. A cell-free approach to accelerate the study of protein-protein interactions in vitro. Interface Focus. 3 (5), 20230018 (2013).
- Johnston, W. A., Moradi, S. V., Alexandrov, K. Adaption of the Leishmania cell-free expression system to high-throughput analysis of protein interactions. Methods Mol Biol. 2025, 403-421 (2019).
- Jung, W., et al. Cell-free formation and interactome analysis of caveolae. J Cell Biol. 217 (6), 2141-2165 (2018).
- Fontaine, F. R., et al. Functional domain analysis of SOX18 transcription factor using a single-chain variable fragment-based approach. MAbs. 10 (4), 596-606 (2018).
- Overman, J., et al. Pharmacological targeting of the transcription factor SOX18 delays breast cancer in mice. Elife. 6, e21221 (2017).
- Kubala, M. H., et al. Mammalian farnesyltransferase alpha subunit regulates vacuolar protein sorting-associated protein 4A (Vps4A)--dependent intracellular trafficking through recycling endosomes. Biochem Biophys Res Commun. 468 (4), 580-586 (2015).
- Han, S. P., et al. Cortactin scaffolds Arp2/3 and WAVE2 at the epithelial zonula adherens. J Biol Chem. 289 (11), 7764-7775 (2014).
- Das Gupta, K., et al. Class IIa histone deacetylases drive toll-like receptor-inducible glycolysis and macrophage inflammatory responses via pyruvate kinase M2. Cell Rep. 30 (8), 2712-2728.e8 (2020).
- Leitão, A. D. G., et al. Selectivity of protein interactions along the aggregation pathway of α-synuclein. BioRxiv. , (2021).
- Gagoski, D., et al. Performance benchmarking of four cell-free protein expression systems. Biotechnol Bioeng. 113 (2), 292-300 (2016).
- Johnston, W. A., Alexandrov, K. Production of eukaryotic cell-free lysate from Leishmania tarentolae. Methods Mol Biol. 1118, 1-15 (2014).
- Hunter, D. J. B., Bhumkar, A., Giles, N., Sierecki, E., Gambin, Y. Unexpected instabilities explain batch-to-batch variability in cell-free protein expression systems. Biotechnol Bioeng. 115 (8), 1904-1914 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены